V. Симбиотические связи бактерий с бобовыми. Симбиоз клубеньковых бактерий и бобовых растений
V. Симбиотические связи бактерий с бобовыми.
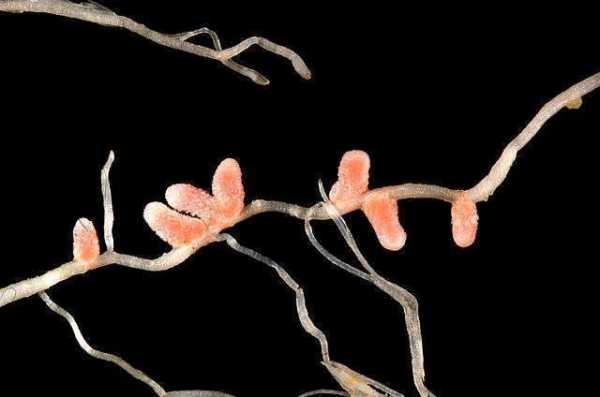
Симбиотические связи бактерий с бобовыми благодаря широкому использованию их в полевом растениеводстве, луговодстве и, частично, в лесоводстве, изучались весьма интенсивно. Установлено, что не все виды бобовых имеют на корнях клубеньки. При обобщении имеющихся данных, оказалось, что из 1285 изученных бобовых (в широком понимании этой группы) клубеньки отсутствовали у 166 (13,0%), в том числе у 77,4% изученных цезальпиновых, у 13% мимозовых и 7% - мотыльковых (Fabaceae) (E. Allen, O. Allen, 1961).
Отсутствие клубеньков на корнях не всегда означает неспособность данного вида бобовых к симбиозу с клубеньковыми бактериями, иногда это происходит из-за местных условий, неблагоприятных для образований клубеньков, или по тому, что в почве нет соответствующих рас клубеньковых бактерий. В то же время наличие клубеньков на корнях бобовых не всегда указывает на активную фиксацию азота клубеньковыми бактериями. Установлено, что многочисленные мелкие белые клубеньки на боковых корнях травянистых бобовых образованы малоэффективной расой клубеньковых бактерий, неспособной связывать атмосферный азот или фиксирующий его в незначительном количестве, в то время как крупные, окрашенные в розовый цвет клубеньки на стержневом корне обычно характеризуют энергично идущий процесс усвоения азота.
А процесс естественного отбора и сопряженной эволюции возникло много рас клубеньковых бактерий, способных выступать в эффективные симбиотические отношения с определенными видами бобовых. Значение отдельных рас клубеньковых бактерий давно было выяснено для возделываемых видов бобовых, и, в связи с необходимостью в ряде случаев вносить бактериальное удобрение (нитраты), содержащие соответствующие клубеньковые бактерии, они были разделены на ряд групп в соответствии с пригодностью для определенных видов бобовых. Принято выделять следующие расы клубеньковых бактерий по их способности к эффективному симбиозу со следующими определенными видами или группами видов бобовых:
горох, вика, кормовые бобы;
фасоль; 3) соя; 4) люпин, сераделла;
5) вигна, магу, арахис; 6) нуж; 7) клевер;
8) люцерна, донник, пажитник; 9) эспарцет;
10) лядвенец (Вознесенская, 1969).
На самом деле число рас клубеньковых бактерий значительно больше.
Выявлена специфичность рас клубеньковых бактерий в пределах уже установленных групп, в частности в "клеверной группе", например у клевера несходного, клубеньки возникают лишь при участии особой расы клубеньковых бактерий.
Эта специфичность проявляется также в значительных различиях фиксируемого ими азота в зависимости от вида клевера, с которым они связаны. В таблице 12 показано, что наиболее эффективные для клеверов лугового и ползучего расы клубеньковых бактерий для клевера подземного были наименее эффективными, и наоборот. Расы, обеспечивающие фиксацию очень значительных количеств азота при инокуляции ими клевера подземного, в симбиозе с клевером луговым и ползучим фиксировали незначительное количество азота. Все это обусловило выделение среди "клеверной группы" трех подгрупп: А - клевера ползучий, луговой, розовый, простертый, зямляничный; В - подземный, инкармантный, скученный, александрийский; С - несходный. Три подгруппы выделяют и среди "люцерновой группы".
Таблица 12.
Способность отдельных рас клубеньковых бактерий фиксировать атмосферный азот при симбиозе с различными видами клевера (содержание азота в мг на 8 растений; по White et al., 1953).
| Виды клевера | Расы бактерий | |||
| №1 | №16 | №8 | №13 | |
| Клевер луговой Клевер ползучий Клевер подземный | 51,4 59,6 7,9 | 34,3 46,5 7,2 | 2,8 10,5 138,5 | 1,9 7,0 153,5 |
Возможность фиксации атмосферного азота клубеньковыми бактериями и количество фиксированного азота определяются также средой - отсутствием условий, ограничивающих жизнедеятельность бактерий и бобовых растений (высокая кислотность, высокое содержание растворимого алюминия, плохая аэрация и др.), а также достаточной обеспеченностью фосфором, калием, кальцием, молибденом, серой, кобальтом, водой и др. Фиксация азота клубеньковыми бактериями снижается по мере увеличения содержания в почве растворимых форм азота, доступных для бобовых. Большое значение имеют условия освещения, поскольку клубеньковые бактерии получают от бобового углеводы, необходимые им как энергетический материал для фиксации азота, и потому зависят от фотосинтеза. При затенении резко снижается не только число клубеньков, но и их размеры, а также предельная глубина их образования.
Клубеньковые бактерии более экономно используют энергию, необходимую для фиксации азота, затрагивая 3-4 г углеводов на 1 г азота, в то время как свободноживущие азотфиксирующие бактерии затрачивают 50 - 100 и более граммов на фиксацию 1 г азота. Это связано с тем, что у свободноживущих азотфиксаторов фиксация азота происходит в процессе их роста, и потому большое количество энергии потребляется на этот рост. Кроме того, в целях создания благоприятных условий для активности нитрогеназы - фермента, участвующего в фиксации азота, для снижения парциального давления кислорода усиливается дыхание, что связано с затратой энергии. Эти расходы энергии отсутствуют у клубеньковых бактерий. Поскольку фиксация азота происходит в бактероидах, клетках, прекративших рост, а внутри клубеньков создаются благоприятные условия для активности нитрогеназы. В том числе сниженное содержание кислорода. Очень существенно то, что фиксируемый клубеньковыми бактериями азот на 90 - 95% передается бобовым растениям. Бобовые, получая связанный азот от клубеньковых бактерий, не зависят или мало зависят от обеспечения минеральным азотом почвы и потому могут успешно произрастать совместно с другими растениями на почвах, бедных доступными формами азота.
Количество азота, фиксируемого клубеньковыми бактериями бобовых, сильно варьирует от фитоценоза к фитоценозу, а в пределах конкретных фитоценозов может изменяться от года к году. Оно определяется участием бобовых в фитоценозах, условиями среды и эффективностью соответствующих рас бактерий. Для некоторых лугов в Новой Зеландии с травостоями, где преобладает клевер, отмечена фиксация азотом до 450 - 550 кг/га.
Фиксация азота в столь больших количествах возможна лишь в условиях исключительно благоприятного климата Новой Зеландии (равномерное распределение большого количества атмосферных осадков, отсутствие засух, благоприятные тепловые условия, возможность вегетации в течении всего года), когда растения в результате применения известкования и внесения удобрений произрастают в условиях благоприятных для них реакций почвы и обеспечены необходимыми зольными элементами. Однако, даже в Новой Зеландии среднее количество азота, фиксируемого клубеньковыми бактериями бобовых, входящих в состав луговых травостоев, составляло 185 кг/га (колебания достигали 85 - 340 кг/га от луга к лугу и в среднем от года к году 145 - 225 кг/га). В годы с более влажным и прохладным летом оно было выше, а в годы с сухим, более теплым летом - ниже. Данные о сходных количествах фиксируемого азота клубеньковыми бактериями бобовых получены для Ирландии (в среднем 160 кг/га) и Южной Англии (250 - 270 кг/га) и относятся к лугам, созданным путем посева трав. На природных лугах нашей страны, в травостоях которых бобовые принимают меньшее участие, количество азота, фиксируемого клубеньковыми бактериями, как правило, не более 30 - 50 кг/га. В посевах многолетних трав (бобовых или бобовых в смеси со злаками) количество фиксируемого азота обычно не превышает 200 кг/га.
Давно замечено, что бобовые благоприятно влияют на произрастающие совместно с ними злаки и другие растения, в том числе увеличивают содержание азота в их органах. На основе результатов вегетационных опытов Виртанен пришел к выводу, что такое воздействие связано с прижизненными выделениями из корней бобовых в почву значительных количеств азотсодержащих соединений. Проверка результатов опытов Виртанена, проведенная в СССР, Шотландии, США, Австралии, не подтвердила его выводов. Оказалось, что в условиях нормального фотосинтеза бобовые не выделяют в почву сколь-либо заметных количеств азотистых соединений. Лишь с ослаблением фотосинтеза (при сниженной интенсивности освещения), когда растения не располагают достаточным количеством углеводов и органических кислот для связывания всего фиксируемого клубеньковыми бактериями азота, часть его может выделяться в почву. Благоприятное влияние бобовых на другие растения можно объяснить поступлением в почву азота с их отмирающими органами, у древесных растений - в основном с опадом, у травянистых (в фитоценозах, используемых как сенокосы и пастбища) - преимущественно с отмирающими подземными органами. На пастбищах злаки получают азот бобовых из экскрементов скота, поедающих их. Так как бобовые, если фиксация азота клубеньковыми бактериями идет достаточно активно, не поглощают из почвы азот или поглощают его в незначительных количествах, на долю небобовых растений остается больше доступных форм азота, и потому они растут лучше с бобовыми, чем в их отсутствие. Совместное произрастание бобовых с небобовыми растениями оказывает благоприятное влияние на фиксацию азота клубеньковыми бактериями, так как в результате поглощения небобовыми азота из почвы содержание его доступных форм снижается до незначительных величин, что стимулирует фиксацию азота.
Биологическая фиксация азота.
Баланс доступного растениям азота на Земном шаре поддерживается за счет деятельности особой группы организмов - так называемых азотфиксаторов. В экономике природы процессам биологической фиксации азота принадлежит исключительная роль, которая по значению вполне равнозначна процессу фотосинтеза.
В группу азотфиксаторов входят свободно живущие организмы, а также организмы, способные существовать лишь в симбиозе с другими видами.
Первой в ряду свободно живущих азотфиксаторов открыта анаэробная спороносная бактерия Clostridium pasterianum. Это открытие принадлежит русскому ученому С. Н. Виноградскому (1893). Через 8 лет (1901) М. Бейеринком был открыт аэробный микроорганизм, названный азотбактером (Azotobacter).
Оба организма являются сапрофитами. Для восстановления молекулярного азота они используют энергию, получаемую ими при окислении глюкозы и других органических соединений (например, маннита). На каждый грамм сброженной глюкозы азотбактер накапливает около 15 мг связанного азота, тогда как Clostridium - не более 2 -3 мг.
Выделив азотбактер, Бейринк обратил внимание на большое сходство свойств этого микроорганизма со свойствами фотосинтезирующей бактерии Chromatium. В настоящее время установлено, что способность фиксировать азот широко распространена у различных видов бактерий. Эта функция свойственна, в частности, сульфатредуцирующим бактериям, развитие которых осуществляется в анаэробных условиях. Способностью ассимилировать молекулярный азот обладает также пурпурная бактерия Rhodospirillum rubrum (Чест и Камен).
К свободно живущим азотфиксаторам принадлежат также синезеленые водоросли (Nostoc, Phormidium). Осуществляемая ими ассимиляция молекулярного азота имеет в особенности большое значение для пресноводных бассейнов, для развития растений риса на заливаемых водой плантациях и т.п. Благодаря своей крайне четко выраженной автотрофности синезеленые водоросли способны заселять голые скалы; они развиваются на вулканической пыли, пензе и т.д.
Общий уровень азотфиксирующей активности свободно живущих организмов невысок. В зависимости от вида и условий существования они накапливают в год от 10 до 30 - 40 кг связанного азота на гектар.
Основную роль в пополнении убыли запасов связанного азота выполняют бактерии - симбиоты, в первую очередь Bacterium radicicola. В настоящее время известно, что кроме бобовых имеется еще около 100 видов других растений, на корнях которых развиваются специфические для каждого растения клубеньковые бактерии.
Химическая природа взаимодействия бобовых с клубеньковыми бактериями изучена неполно, в связи с чем ряд факторов в этой области не находит еще объяснения. Например, установлено, что клубеньковые бактерии способны восстанавливать молекулярный азот только при взаимодействии с корнями бобовых растений. Этой способности лишены бактерии, культивируемые в искусственных средах. Клубеньковые бактерии развивались на корнях бобовых растений и в том случае, если последние служили подвоем, а привоем - любое другое растение. В тех вариантах, где бобовые служили привоем, а подвоем - различные небобовые растения, бактерии не развивались.
Все это показывает, что тканям бобовых должны быть свойственны определенные особенности.
Представитель экспериментального направления в физиологии растений. Замечательный французский ученый Жан Батист Буссенго первый широко использовал в своих исследованиях по питанию метод выращивания растений в вегетационных сосудах. Точные эксперименты позволили Буссенго опровергнуть представления Либиха об азотном питании растений. Буссенго первый отметил специфические особенности бобовых растений как азотсобирателей, а вслед за тем Гельригель открыл, что эту роль бобовые выполняют в симбиозе с клубеньковыми бактериями. Большое значение имели исследования русского ботаника М. С. Воронина, который первый сформулировал представление о клубеньках как о болезненных образованиях, возникающих в результате заражения корней.
Симбиоз корней высших растений с грибами носят название микориз, симбиозы с бактериями - бактериориз. В зависимости от формы симбиотрофизма различают микоризы экто- и эндотрофные. Первые развиваются на поверхности корней, вторые проникают внутрь ткани. Классическим примером бактериотрофизма является взаимодействие бобовых растений с клубеньковыми бактериями.
Исследования микробиологов, проведенные в последние годы, значительно расширили представления о значении симбиотрофизма в процессах корневого питания растений.
Число микробных телец, приходящихся на 1 г почвы, исчисляется многими сотнями миллионов и даже миллиардами. Некоторое представление об этом дают цифры, заимствованные из работ Н. А. Красильникова:
| Число микроорганизмов в 1 г почвы | Вес микробных тел в пахотном слое, кг/га | |
| Бактерии Грибы Актиномицеты Водоросли | 1109 1105 1105 1103 | 600 60 8 160 |
Почвенные микроорганизмы сосредоточены в основном в зоне размещения корней.
Важное значение азотфиксирующих бактерий диктует необходимость обеспечения наиболее благоприятных условий для их развития и физиологической деятельности.
Один из путей решения этой важной практической задачи состоит в увеличекнии численности микробного населения почвы с помощью бактериальных удобрений.
Данное мероприятие в равной степени оправдывает себя в отношении как клубеньковых бактерий, так и свободно живущих азотфиксаторов.
Дело в том, что даже при длительной культуре бобовых растений, почвы, занятые ими содержат нередко недостаточное количество Bact. radicicola, в результате чего на корнях образуется мало клубеньков, либо они не образуются вовсе. В этих условиях бобовые не обогащают почву азотом, а аналогично другим растениям истощают имеющиеся в ней азотистые соединения.
Искусственное обогащение почвы клубеньковыми бактериями оказывает весьма благоприятное влияние на азотный баланс почвы и на развитие бобовых и других растений севооборота. Препарат клубеньковых бактерий, который называется нитрагином, вносят вместе с семенами бобовых при посеве. При приготовлении нитрагина следует учитывать специфичность клубеньковых бактерий.
studfiles.net
Симбиотические гены клубеньковых бактерий и влияние их горизонтального переноса на видовой состав микросимбионтов бобовых растений Текст научной статьи по специальности «Биология»
УДК 579.25 579.262
СИМБИОТИЧЕСКИЕ ГЕНЫ КЛУБЕНЬКОВЫХ БАКТЕРИИ И ВЛИЯНИЕ ИХ ГОРИЗОНТАЛЬНОГО ПЕРЕНОСА НА ВИДОВОЙ СОСТАВ МИКРОСИМБИОНТОВ БОБОВЫХ РАСТЕНИЙ
© Е. С. Иванова1, Ан. Х. Баймиев1, Р. И. Ибрагимов2*, Ал. Х. Баймиев1
1 Институт биохимии и генетики Уфимского научного центра РАН Россия, Республика Башкортостан, 450054 г. Уфа, пр. Октября, 71.
Тел.: +7 (347) 235 60 88.
E-mail: [email protected] 2Башкирский государственный университет Россия, Республика Башкортостан, 450074 г. Уфа, ул. Заки Валиди, 32.
Тел./факс: +7 (347) 229 96 71.
E-mail: [email protected]
Наличие у клубеньковых бактерий симбиотических генов определяет их возможность образовывать с бобовыми растениями азотфиксирующий симбиоз. В статье описана структурно-функциональная организация основных симбиотических генов и влияние их горизонтального переноса на видовое разнообразие микросимбионтов у бобовых растений.
Ключевые слова: ризобии, клубеньковые бактерии, бобовые растения, симбиоз, симбиотические гены, горизонтальный перенос генов.
Изучение взаимодействий между растениями и микроорганизмами - одно из увлекательных и бурно развивающихся направлений современной биологии. Эти взаимодействия играют исключительно важную роль в жизни растений, обеспечивая их минеральное питание, защиту от патогенов и вредителей, а также адаптацию к стрессам и регуляцию развития [1].
Исследование микробно-растительных взаимодействий восходит к трудам Антона де Барии, сформулировавшего в 1879 году концепцию симбиоза [1]. Согласно данной концепции, симбиоз - длительное сосуществование неродственных организмов, в ходе которого осуществляется широкий спектр взаимовыгодных (мутуалистических) и паразитарных (антагонистических) взаимодействий [2].
Обладая способностью полностью обеспечивать себя углеродом и энергией, получаемыми в процессе фотосинтеза, большинство растений испытывает недостаток во многих других элементах минерального питания, в первую очередь - в азоте и фосфоре [3]. Дело в том, что растения «купаются» в азоте, имеющимся в окружающей их среде: атмосфера состоит на 78% из азота, а органические вещества почвы (гумус, лигнин, хитин) содержат много связанного азота. Однако этот элемент недоступен для растений, так как у них нет ферментных систем для его фиксации, как и для деструкции почвенной органики. А недостаточная обеспеченность азотом - один из основных факторов, лимитирующих развитие растений [1]. Поэтому симбиозы с микроорганизмами, фиксирующими азот (ри-зобии, актиномицеты, цианобактерии, эндофитные и ризосферные бактерии) или оптимизирующими получение питательных веществ из почвы (микоризные грибы), характерны для подавляющего большинства растений [3].
Огромное практическое и экологическое значение представляет симбиоз бобовых растений с клубеньковыми бактериями (ризобиями), который
является одной из наиболее эффективных систем биологической фиксации атмосферного азота. В данном взаимодействии достигается сопряжение двух глобальных биохимических процессов - азот-фиксации и фотосинтеза, благодаря чему нормализуется азотно-углеродный баланс растительного организма. При симбиозе микробы экспортируют продукты азотфиксации в клетки хозяина, которые предоставляет партнерам весь комплекс элементов питания, в первую очередь соединения углерода [1]. Благодаря деятельности клубеньковых бактерий часть азотистых соединений из корней бобовых растений диффундирует в почву, обогащая ее азотом. Посев бобовых растений ведет к повышению почвенного плодородия. Гектар бобовых растений в симбиозе с бактериями может перевести в связанное состояние от 100 до 400 кг азота за год. Значение этого трудно переоценить, если учесть, что азотные удобрения наиболее дорогостоящи, а в почве соединения азота содержатся в небольших количествах.
Становление эффективного азотфиксирующе-го симбиоза между бобовыми растениями и ризо-биями требует наличия у микросимбионтов симбиотических генов (sym генов), включающих в себя ответственные за фиксацию азота nif гены, которые кодируют синтез и регуляцию фермента нитрогена-зы; nod гены, кодирующие синтез Nod-факторов, отвечающих за инициацию и специфичность образуемого симбиоза; а также fix-гены, которые также необходимы для азотфиксации, часто сцепленные с nif генами, но не гомологичные с ними.
Гены клубенькообразования (nod гены) кодируют синтез липо-хито-олигосахаридных Nod-факторов - сигналов, узнаваемых растениями и вызывающих развитие симбиотических тканей и субклеточных компартментов (инфекционные нити, симбиосомы), которые содержат бактериальные клетки [4-7]. Nod-факторы совместно с экзополисахаридами инициируют у бобового растения-
* автор, ответственный за переписку
хозяина многоступенчатый процесс формирования клубеньков.
Клубеньковые примордии, возникающие у бобовых под действием Коё-факторов, вырабатывают сигналы, поступающие в листья и приводящие к формированию авторегуляторного ответа. Он ограничивает число формируемых растением клубеньков, ограждая растение от перерасхода энергии и определяя формирование симбиоза только в условиях недостатка азота [2].
Некоторые гены (nodA, nodB, nodQ присутствуют у ризобий в одной копии, тогда как другие (nodM (gfmS)y nodP, nodQ, nodT) — в нескольких копиях. В ряде случае гены клубенькообразования формируют кластеры, состоящие из нескольких оперонов, многие из которых консервативны у разных ризобий [8].
Гены nif кодируют структуру белков нитроге-назы - фермента, восстанавливающего молекулярный азот до аммиака, ее кофакторов и транскрипционных регуляторов [9].
У всех известных азотфиксаторов нитрогеназа состоит из белков трех типов (а, р и у) и двух кофакторов: молибден-железосодержащего (МоБе-кофактора) и железосодержащего (Бе-кофактора). Эти компоненты организованны в две субъединицы: большую - динитрогеназу (а2, р2), в состав которой входит МоБе-кофактор, и малую - редук-тазу динитрогеназы (у2), содержащую Бе-кофактор. Восстановление молекул азота происходит при взаимодействии с динитрогеназой, которая получает необходимые для этого активированные электроны от редуктазы динитрогеназы [1].
У некоторых ризобий выявлены множественные копии гена пі/Н: К- еїіі имеет 3 идентичные копии, тогда как копии пі/Н1 и пі/Н2 у АіоткіїоЬіит caulтodans различаются по 6 нуклеотидам. Все эти копии кодируют функционально активные белки, участвующие в азотфиксации, а их высокое сходство или даже идентичность говорит о том, что мно-гокопийность гена пі/Н является результатом дупликаций, а не горизонтального переноса. Эта мно-го-копийность может играть роль в адаптации ри-зобий к фиксации азота в различных экологических условиях. Нельзя исключить и того, что некоторые из копий пі/Н могут выполнять редуктазные функции в биохимических процессах, не связанных с азотфиксацией [10].
У ризобий пі/ - гены разделены на несколько кластеров, что отражает сложную регуляцию симбиотической азотфиксации, осуществляемую не только внешними факторами, но и растением-хозяином. Большинство т/-генов организовано в опероны, состав которых варьирует у разных видов.
Процесс восстановления азота до аммиака требует затраты большого количества энергии. Это связано с чрезвычайной стабильностью тройной связи в молекуле азота - одной из самых прочных химических связей. Наиболее эффективными источниками энергии, способными обеспечить высо-
кую интенсивность биологической азотфиксации, являются окислительное фосфорилирование и фотосинтез. Эти процессы сопряжены с присутствием кислорода, который поглощается при дыхании или выделяется при фотолизе воды. Однако нитрогеназа очень чувствительна к кислороду: она необратимо инактивируется даже при небольших его концентрациях (около 100 нмоль/л) [1]. Поэтому в клубеньках присутствует особый железосодержащий белок - леггемоглобин, который аналогичен гемоглобину крови человека и животных по строению и функции. Леггемоглобин связывает кисло -род и, тем самым создает условия для работы нит-рогеназы [11].
fix гены ответственны за специфичную для симбиоза регуляцию ^-фиксации. Гены fixL, fixJ, fixK имеют гомологов у свободноживущих бактерий, однако эти гомологи не связаны с контролем азотфиксации. Гены, гомологичные fixLJ, кодируют двухкомпонентные регуляторные системы (FixL -мембранный белок, обладающий киназной и фос-фатазной активностями; FixJ - цитоплазматический фосфорилируемый регулятор транскрипции). Активация этой системы происходит лишь в макроаэ-рофильных условиях, поскольку FixL является гемм содержащим сенсором кислорода. Гомологи FixK - это транскрипционные регуляторы, относящиеся к семейству Crp - Fnr. У ризобий система регуляции азотфиксации помимо структурных генов нитрогеназы включает гены dctABD (кодируют транспорт в бактериоиды дикарбоновых кислот, являющихся основным источником энергии для азотфиксации), fixNOPQ fixGHIS (кодируют синтез бактериоидной цитохромоксидазы cbb3, обеспечивающей транспорт электронов в дыхательных цепях бактериоидов) и гены биосинтеза гема [12].
Геном ризобий обычно содержит кольцевую хромосому и один или несколько крупных плазмид размерами от 100 тпн до более 2Мпн. Sym гены локализованы либо в специфических симбиотических геномных компартментах в составе крупных плазмид, обозначаемых pSym (симбиотические плазмиды), либо в пределах хромосомных островков, также называемых островками симбиоза. У быстрорастущих клубеньковых бактерий рода Rhizobium и Ensifer (Sinorhizobium) Sym-гены находятся на pSym-плазмидах, тогда как у медленнорастущих бактерий родов Azorhizobium, Bradyrhizobium и Mesorhizobium эти гены расположены на хромосомах. За счет плаз-мидной локализации или же за счет ограничения симбиотического островка IS-подобными элементами, симбиотические гены клубеньковых бактерий часто бывают вовлечены в процессы горизонтального переноса генов (ГПГ) как между штаммами внутри одного вида, так и между штаммами разных видов, родов, семейств и и даже еще более высших таксонов. Данный процесс может привести к появлению штаммов клубеньковых бактерий, различающихся по азотфиксирующей эффективности и по хозяйской специфичности.
Интересно, что при переносе Sym генов между близкородственными штаммами специфичность к хозяину проявляется наиболее четко: реципиент может приобретать способность формировать полностью развитые, азотфиксирующие клубеньки с растениями - хозяевами донора. При этом исходная специфичность реципиента либо утрачивается, либо сохраняется. В то время как при переносе Sym генов между неродственными видами ризобий специфичность проявляется лишь частично (на уровне образования неактивных клубеньков, часто имеющих аномальную структуру) либо вовсе не проявляется. При этом исходная специфичность часто сохраняется [1].
Возможность ГПГ показана в работах многих авторов. Одним из первых в этом плане была работа Саливана с соавторами, в которой они показали, что в Новой Зеландии аборигенные штаммы Mezorhizobium loti, не способные нодулировать растения Lotus corniculatus L. после 7 лет выращивания данной культуры с исскуственной инокуляцией специфичным штаммом M.loti (ICMP 3153) также стали способны инокулировать данное растение. Было обнаружено, что все выделенное из клубеньков штаммы как аборигенные, так и штамм ICMP 3153 имеют идентичные симбиотические гены. На основании этого, авторы делают вывод, что аборигенные штаммы получили симбиотические гены посредством ГПГ от штамма ICMP 3153, что изменило их специфичность [13-17].
Сходный процесс образования новых симбионтов путем ГПГ выявлен при интродукции Biserrula pelecinus L. (Fabaceae) из Европы в Австралию, где в течение шести лет сформировалась местная популяция новых симбионтов, содержащих хромосомные маркеры авирулентных местных мезоризобий в сочетании с sym-генами («симбиотическими» островками) интродуцированного мезоризобиального штамма WSM 1271 [18]. При интродукции сои из США в Южную Америку (Парагвай), сопровождавшуюся внесением производственных штаммов Bradyrhizobium japonicum, происходил перенос их sym-генов в разнообразные местные ризобии, как быстро- так и медленнорастущие, с широким спектром хозяев, а также в агробактерии [19].
Исследования, проведенные в Китае на астрагале, показали, что способность формировать клубеньки в ответ на заражение большого спектра ри-зобий, относящихся к родам Rhizobium, Sinorhizobium, Mesorhizobium и Bradyrhizobium обеспечивается горизонтальным переносом симбиотических генов, благодаря чему появляются новые виды ризобий, которые адаптированы к различным условиям окружающей среды, а также способные заражать виды Астрагала [16].
При исследовании клубеньковых бактерий дикорастущих бобовых, произрастающих на территории Республики Башкортостан нами также были выявлены штаммы, которые, вероятно, также получили симбиотические гены за счет ГПГ. Так, например, у чины весенней Lathyrus vernus (L.) Bernh. в
клубеньках некоторых растений, произрастающих на кислых почвах, были обнаружены несвойственные для них клубеньковые бактерии Rhizobium tropici. Однако при анализе последовательностей симбиотических генов данных микроорганизмов было выявлено, что они имеют большую гомологию с аналогичными генами R. leguminosarum bv. viceae, обычных симбионтов данного вида растения, нежели R. tropici. Исходя из этого, был сделан вывод, что R. tropici приобрел способность вступать в симбиоз с чиной весенней за счет ГПГ симбиотических генов [20]. Подобное явление также было обнаружено и у некоторых симбионтов чины болотной Lathyrus palustris L. у которой в клубеньках были обнаружены Agrobacterium sp., содержащие симбиотические гены R. leguminosarum bv. viceae привнесенные в геном Agrobacterium sp. посредством ГПГ.
В этом плане интересны также клубеньковые бактерии рода Phyllobacterium. Данные микроорганизмы впервые были описаны Кнозелем как бактерии, образующие клубенек подобные структуры на листьях некоторых тропических растений [21]. В настоящее время данные бактерии обнаружены в клубеньках у многих бобовых, таких как Trifolium pratense, Argyrolobium uniflorum, Astragalus algerianus, Lathyrus numidicus, Oxytropis sp., Genista saharae и др. [22-25]. Нами Phyllobacterium были обнаружены в клубеньках эспарцета песчаного Onobrychis arenaria [26], караганы древовидной Caragana arborescens [27], чины Гмелина Lathyrus gmelinii [20], а также в клубеньках кустарниковых видов бобовых: ракитника русского Chamaecytisus ruthenicus, караганы кустарниковой Caragana frutex и дрока красильного Genista tinctoria. Но, тем не менее, симбиотические гены были обнаружены только у штаммов из клубеньков ракитника русского, по нуклеотидной последовательности сходные с аналогичными последовательностям Bradyrhizobium, и у штаммов из клубеньков чины Гмелина, содержащие симбиотические гены R. leguminosarum bv. viceae. У остальных штаммов обнаружить sym гены не удалось. Видимо данные клубеньковые бактерии способны вступать в симбиоз с различными видами бобовых растений в зависимости от того, какие симбиотические гены они содержат, а также, по мнению некоторых исследователей, попадать в клубеньки с другими ризобиями, и по сути представляют из себя оппортунистические микроорганизмы.
Несомненно, именно наличие sym генов делает свободноживущие сапрофитные почвенные микроорганизмы симбиотическими партнерами бобовых растений. В основном это а-протеобактерии, относящиеся к семейству Rhizobiaceae. В некоторых исключительных случаях симбиотические гены, попадая в клетки других бактерий, не родственных Rhizobiaceae также наделяют их способностью образовывать клубеньки у бобовых растений. Примерами данного явления могут послужить обнаруженные в клубеньках некоторых тропических ви-
дов бобовых представители ß-группы протеобакте-рий [28, 29]. Но такие случаи не многочисленны, и в большинстве своем симбиозы с подобными микроорганизмами малоэффективны. В основном такие бактерии служат в качестве «депо» для sim генов, которые когда то перейдут в более подходящие бактериальные клетки, придав тем самым им способность образовать эффективный азотфикси-рующий симбиоз. Таким образом за счет ГПГ происходит постоянное изменение разнообразия способных к симбиозу с бобовыми микроорганизмов, что является одним из механизмов приспособления, когда нет необходимости поддерживать симбиотические гены всем ризобиям, что энергетически очень выгодно, но оставаясь, тем не менее, потенциальными донорами данных генов и соответственно потенциальными микросимбионтами бобовых растений.
ЛИТЕРАТУРА
1. Тихонович И. А., Проворов Н. А. Симбиозы растений и микроорганизмов: молекулярная генетика агросистем будущего. СПб.: Изд-во С.-Петерб. ун-та. 2009. 210с.
2. Тихонович И. А., Проворов Н. А. Принципы селекции растений на взаимодействие с симбиотическими микроорганизмами // Вестник ВОГиС. 2005. Том 9. №3. С. 295-305.
3. Лутова Л. А., Проворов Н. А., Тиходеев О. Н.,Тихонович И. А., Ходжайова Л. Т., Шишкова С. О. Генетика развития растений. Под ред. С. Г. Инге-Вечтомова. СПб.: Наука. 2000. 539 с.
4. Овцына А. О., Тихонович И. А. Структура, функции и возможность практического применения сигнальных молекул, инициирующих развитие бобово-ризобиального симбиоза. // Экологич. Генетика. 2004. Т.2. №3. С. 14.
5. Brewin N.J. Plant cell wall remodeling in the Rhizobium-legume symbiosis. // Crit. Rev. Plant. Sci. 2004. V. 23. P. 1-24.
6. Hirsch A. M., LaRue T. A. Is the Legume Nodule a Modified Root or Stem or an Organ sui generis? // Crit. Rev. Plant Sci. 1997. V.16. P. 361-392.
7. Ovtsyna A. O., Staehelin C. Bacterial signals required for the Rhizobium-legume symbiosis // Recent Res. Develop. Microbiol. 2005. V.7. P. 631-648.
8. Жуков В. А., Штарк О. Ю., Борисов А. Ю., Тихонович И. А. Молекулярно-генетические механизмы контроля растением ранних стадий развития взаимовыгодных (мутуа-листических) симбиозов бобовых. // Генетика. 2009. Т.45. №11. С. 1449-1460.
9. Проворов Н. А., Воробьев Н. И. Роль горизонтального переноса генов в эволюции клубеньковых бактерий, направляемой растением-хозяином. // Успехи современной биологии. 2010. Т. 130. №4. С. 336-345.
10. Spaink H. P., Kondorosi A., Hooykaas P. J. J. The Rhizobiaceae. Kluwer Academic Publishers. Pordrecht. The Netherlands. 1998. 566 p.
11. Сидорова К. К., Шумный В. К., Власова Е. Ю., Гляненко М. Н., Мищенко Т. М., Майстренко Г. Г. Симбиогентика и селекция макросимбионта на повышение азотфиксации на примере гороха (Pisum Sativum L.) // Вестник ВОГиС. 2010. Т.14. №2. С. 357-374.
12. Проворов Н. А., Воробьев Н. И. Эволюционная генетика клубеньковых бактерий: молекулярные и популяционные аспекты. // Генетика. 2000. Т.36. №12. С. 1573-1587.
13. Andam C. P., Parker M. A. Novel Alphaproteobacterial Root Nodule Symbiont Associated with Lupinus texensi. // Appl Environ. Microbiol. 2007. V.73. №17. P. 5687-5691.
14. Andam C. P., Mondo S. J., Parker M. A. Monophyly of nodA and nifH genes across Texan and Costa Rican populations of Cupriavidus nodule symbionts. // Appl. Environ. Microbiol. 2007. V.73. №14. P. 4684-4690.
15. Barcellos F. G., Menna P., da Silva Batista J. S., Hungria M. Evidence of Horizontal Transfer of Symbiotic Genes from a Bradyrhizobium japonicum Inoculant Strain to Indigenous Diazotrophs Sinorhizobium (Ensifer) fredii and Bradyrhizobium elkanii in a Brazilian Savannah Soil. // Appl. Environ. Microbiol. 2007. V.73. №8. P. 2635-2643.
16. Zhao C. T., Wang E. T., Chen W. F., Chen W. X. Diverse genomic species and evidences of symbioticgene lateral transfer detectedamong the rhizobia associated with Astragalus species grown in the temperate regions of China // FEMS Microbial Lett. 2008. V.286. P. 263-273.
17. Sullivan J. T., Patrick H. N., Lowther W. L., Scott D. B., Ronson C. W. Nodulating strains of Rhizobium loti arise through chromosomal symbiotic gene transfer in the environment. // Proc Natl Acad Sci USA. 1995. V.92. P. 8985-8989.
18. Nandasena K. G., O’Hara G. W., Tiwari R. P., Howieson J. G. Rapid In Situ Evolution of Nodulating Strains for Biserrula pelecinus L.through Lateral Transfer of a Symbiosis Island from the Original Mesorhizobial Inoculant. // Appl Environ Microbiol. 2006. V.72. №11. P. 7365-7367.
19. Chen L. A., Figueredo A., Pedrosa F. O., Hungria M. Genetic characterization of soybean rhizobia in Paraguay. // Appl. Environ. Microbiol. 2000. V.66. P. 5099-5103.
20. Баймиев Ан. Х., Птицын К. Г., Мулдашев А. А., Баймиев Ал. Х. // Экол. генет. 2011. №2. С. 3-8.
21. Knosel D. H. Prüfung von bakterien auf Fähigkeit zur Stembildung. // Zentralbl Bakteriol Parasitenkd Infektionskr Hyg. 1962. V.116. P. 79-100 (in German).
22. Valverde A., Velazquez E., Fernandez-Santos F., Vizcaino N., Rivas R., Mateos P. F., Eustoquio Molina M., Igual J. M. and Willems A. Phyllobacterium trifolii sp. nov., nodulating Trifolium and Lupinus in Spanish soils. // Journal of Systematic and Evolutionary Microbiology. 2005. V.55. P. 1985-1989.
23. Mantelin S., Fischer-Le Saux M., Zakhia F., Bena G., Bonneau S., Jeder H., Philippe de Lajudie and Cleyet-Marel J. S. Emended description of the genus Phyllobacterium and description of four novel species associated with plant roots: Phyllobacterium bourgognense sp. nov., Phyllobacterium ifriqiyense sp. nov., Phyllobacterium leguminum sp. nov. and Phyllobacterium brassicacearum sp. nov. // Journal of Systematic and Evolutionary Microbiology. 2006. V.56. P. 827-839.
24. Kan F. L., Chen Z. Y., Wang E. T., Tian C. F., Sui X. H., Chen W. X. Characterization of symbiotic and endophytic bacteria isolated from root nodules of herbaceous legumes grown in Qinghai-Tibet plateau and in other zones of China. // Archives of Microbiology. 2007. V.188. P. 103-115
25. Mahdhi M., Nzoue A., Gueye F., Merabet C., P. de Lajudie and Mars M. Phenotypic and genotypic diversity of Genista saharae microsymbionts from the infra-arid region of Tunisia. // Letters in Applied Microbiology. 2007. V.45. P. 604-609
26. Баймиев Ал. Х., Баймиев Ан. Х., Губайдуллин И. И., и др. В клубеньках эспарцета песчаного обнаружены бактерии, близкие по гену 16S рРНК к Phyllobacterium trifolii // Генетика. 2007. Т. 43. №5. С. 716-719.
27. Баймиев Ан.Х., Птицын К.Г., Баймиев Ал.Х. Влияние интродукции караганы древовидной на состав ее клубеньковых бактерий // Микробиология. 2010. Т.79. №1. С.123-128.
28. Chen W. M., Moulin L., Bontemps C., Vandamme P., Bena G., Boivin-Masson C. Legume symbiotic nitrogen fixation by beta-proteobacteria is widespread in nature. // J. Bacteriol. 2003. V. 185 №24. P. 7266-7272.
29. Liu X. Y., Wu W., Wang E. T., Zhang B., Macdermott J., Chen W. X. Phylogenetic relationships and diversity of ß-rhizobia associated with Mimosa species grown in Sishuangbanna, China. // Int J Syst Evol Microbiol. 2011. V. 61. P. 334-342.
Поступила в редакцию 04.09.2011 г.
cyberleninka.ru
Факторы, определяющие симбиотические взаимоотношения клубеньковых бактерий с бобовыми растениями
Количество просмотров публикации Факторы, определяющие симбиотические взаимоотношения клубеньковых бактерий с бобовыми растениями - 234
Важно заметить, что для симбиоза, обеспечивающего хорошее развитие растений, необходим определенный комплекс условий среды. В случае если условия окружающей среды будут неблагоприятными, то, даже несмотря на высокую вирулентность, конкурентную способность и активность микросимбионта͵ эффективность симбиоза будет низкой.
Рис. 163. Начальный период формирования артроспор в бактероидах клевера. Увел. X 30 000.
Для развития клубеньков оптимальная влажность 60—70% от полной влагоемкости почвы. Минимальная влажность почвы, при которой еще возможно развитие клубеньковых бактерий в почве, приблизительно равна 16% от полной влагоемкости. При влажности ниже этого предела клубеньковые бактерии обычно уже не размножаются, но тем не менее они не погибают и могут долгое время сохраняться в неактивном состоянии. Недостаток влаги приводит и к отмиранию уже сформировавшихся клубеньков.
Нередко в районах с недостаточным увлажнением многие бобовые растения развиваются, не образуя клубеньков.
Поскольку размножение клубеньковых бактерий в отсутствие влаги не происходит, в случае засушливой весны инокулированные (искусственно зараженные) семена крайне важно вносить глубже в почву. К примеру, в Австралии семена с нанесенными на них клубеньковыми бактериями глубоко заделывают в почву. Интересно, что клубеньковые бактерии почв засушливого климата более стойко переносят засуху, чем бактерии почв влажного климата. В этом проявляется их экологическая приспособленность.
Избыточная влажность, как и ее недостаток, также неблагоприятна для симбиоза — из-за снижения степени аэрации в зоне корней ухудшается снабжение корневой системы растения кислородом. Недостаточная аэрация отрицательно влияет и на живущие в почве клубеньковые бактерии, которые, как известно, лучше размножаются при доступе кислорода. Тем не менее высокая аэрация в зоне корней приводит к тому, что кислород начинают связывать восстановители молекулярного азота͵ снижая степень азотфиксации клубеньков.
Важную роль во взаимоотношениях клубеньковых бактерий и бобовых растений играет температурный фактор. Размещено на реф.рфТемпературные характеристики разных видов бобовых растений различны. Также и разные штаммы клубеньковых бактерий имеют свои определенные температурные оптимумы развития и активной фиксации азота. Следует отметить, что оптимальные температуры развития бобовых растений, образования клубеньков и азотфиксации не совпадают. Так, в природных условиях образование клубеньков может наблюдаться при температурах несколько выше О °С, азот-фиксация при таких условиях практически не происходит. Возможно, лишь арктические симбиозирующие бобовые растения связывают азот при очень низких температурах. Обычно же данный процесс происходит лишь при 10 °С и выше. Максимальная азотфиксация ряда бобовых растений наблюдается при 20—25 °С. Температура выше 30 °С отрицательно влияет на процесс азотонакопления.
Экологическая адаптация к температурному фактору у клубеньковых бактерий значительно меньше, чем у многих типичных сапрофитных форм. По мнению Е.Н. Мишустина (1970), это объясняется тем, что естественной средой обитания клубеньковых бактерий являются ткани растений, где температурные условия регулируются растением-хозяином.
Большое влияние на жизнедеятельность клубеньковых бактерий и образование клубеньков оказывает реакция почвы. Для разных видов и даже штаммов клубеньковых бактерий значение рН среды обитания несколько различно. Так, к примеру, клубеньковые бактерии клевера более устойчивы к низким значениям р.Н, чем клубеньковые бактерии люцерны. Очевидно, здесь также сказывается адаптация мпкро-ерганизмов к среде обитания. Клевер растет на более кислых почвах, чем люцерна. Реакция почвы как экологический фактор оказывает влияние на активность и вирулентность клубеньковых бактерий. Наиболее активные штаммы, как правило, легче выделить из почв с нейтральными значениями рН. В кислых почвах чаще встречаются неактивные и слабовирулентные штаммы. Кислая среда (рН 4,0 — 4,5) оказывает непосредственное влияние и на растения, в частности нарушая синтетические процессы обмена веществ растений и нормальное развитие корневых волосков. В кислой среде у инокулированных растений резко сокращается срок функционирования бакте-роидной ткани, что ведет к снижению степени азотфиксации.
В кислых почвах, как отмечает А. В. Петербургский, в почвенный раствор переходят соли алюминия и марганца, неблагоприятно действующие на развитие корневой системы растений и процесс азотоусвоения, а также снижается содержание усвояемых форм фосфора, кальция, молибдена и углекислоты. Неблагоприятную реакцию почвы лучше всего устраняет известкование.
Размеры симбиотической азотфиксации определяются в значительной степени условиями питания растения-хозяина, а не клубеньковых бактерий. Клубеньковые бактерии как эндотрофные симбионты растений зависят в основном от растения при получении углеродсодер-жащих веществ и минеральных элементов питания.
Рис. 164. Бактероид со сформировавшейся артроспорой клубеньковой бактерии клевера. Увел. X 35 000.
Для клубеньковых бактерий ткань хозяина представляет такую питательную среду, которая может удовлетворить даже самый требовательный штамм вследствие содержания в ткани всех типов питательных веществ. Тем не менее после внедрения клубеньковых бактерий в ткань растения-хозяина их развитие определяется не только внутренними процессами, но и в значительной степени зависит от действия внешних факторов, оказывающих влияние на весь ход инфекционного процесса. Содержание или отсутствие того или иного питательного вещества в окружающей среде должна быть определяющим моментом для проявления симбиотической азотфиксации.
Степень обеспеченности бобовых растений доступными формами минеральных соединений азота определяет эффективность симбиоза. На основании многочисленных лабораторных и вегетационных опытов известно, что чем больше азотсодержащих соединений в окружающей среде, тем с большим трудом внедряются бактерии в корень.
Сельскохозяйственная практика требует однозначно решить задачу — целесообразнее удобрять бобовые культуры азотом или же правы те исследователи, которые утверждают, что минеральный азот подавляет симбиотическую азотфиксацию бобовых культур и в связи с этим экономически выгоднее такие растения азотом не удобрять. На кафедре агрономической и биологической химии Московской сельскохозяйственной академии им. К. А. Тимирязева были проведены опыты, результаты которых дали возможность получить картину поведения симбионтов в условиях вегетационных и полевых опытов при обеспеченности растений разными дозами азота в среде. Установлено, что повышение содержания растворимых азотсодержащих соединений в среде в полевых условиях при оптимальных условиях произрастания растений не препятствует их симбиозу с клубеньковыми бактериями. Снижение доли атмосферного азота͵ усваиваемого растениями при повышенной обеспеченности минеральным азотом, имеет только относительный характер. Размещено на реф.рфАбсолютное количество азота͵ усвоенного бактериями из атмосферы, практически не снижается, даже нередко увеличивается по сравнению с растениями, выращивающимися в присутствии клубеньковых бактерий, но без внесения в почву азота.
Рис. 165. Миграция артроспор в окружающую среду из клубеньков: 1 — клевера (увел. X 17 000), 2 — люцерны (увел. X 23 000).
Большое значение в активации усвоения азота бобовыми растениями имеет фосфорное питание. При низком содержании фосфора в среде проникновение бактерий в корень происходит, но клубеньки при этом не образуются. Бобовым растениям присущи некоторые особенности в обмене фосфорсодержащих соединений. Семена бобовых отличаются повышенным содержанием фосфора. Запасной фосфор при прорастании семян используется не так, как у других культур, — сравнительно равномерно для формирования всех органов, а в большей степени сосредоточиваясь в корнях. По этой причине в ранние сроки развития бобовые растения, в отличие от злаковых, в большей степени удовлетворяют свои потребности в фосфоре за счёт семядолей, а не запасов почвы. Чем крупнее семена, тем меньше бобовые растения зависят от фосфора почвы. При этом при симбиотическом способе существования потребность бобовых растений в фосфоре выше, чем при автотроф-ном. По этой причине при недостатке фосфора в среде у инокулированных растений ухудшается снабжение растений азотом.
Бобовые растения, как известно, выносят с урожаем значительно больше калия, чем другие сельскохозяйственные культуры. По этой причине калийные и особенно фосфорно-калийные удобрения существенно повышают продуктивность азотфиксации бобовыми растениями.
Рис. 166. Прекратившие функционировать интерцеллюлярная (1) и интрацеллюлярная (2) инфекционные нити в клубеньках клевера. Увел. X 10 000.
Положительное действие калия на образование клубеньков и интенсивность азотфиксации связано в значительной степени с физиологической ролью калия в углеводном обмене растения.
Кальций нужен не только для устранения излишней кислотности почвы. Он играет специфическую роль в развитии клубеньковых бактерий и обеспечении нормального симбиоза бактерий с растением-хозяином. Потребность клубеньковых бактерий в кальции частично должна быть компенсирована стронцием. Интересно, что клубеньковые бактерии тропических культур, растущих на кислых латеритных почвах, не нуждаются в кальции. В этом опять проявляется экологическая адаптация клубеньковых бактерий, поскольку тропические почвы содержат очень небольшие количества кальция.
Важно заметить, что для симбиотической азотфиксации необходимы также магний, сера и железо. При недостатке магния тормозится размножение клубеньковых бактерий, снижается их жизнедеятельность, подавляется симбиотическая азот-фиксация. Сера и железо оказывают также благоприятное влияние на образование клубеньков и процесс азотфиксации, в частности играя несомненную роль в синтезе леггемоглобина.
Из микроэлементов особо отметим роль молибдена и бора. При недостатке молибдена клубеньки плохо образуются, в них нарушается синтез свободных аминокислот и подавляется синтез леггемоглобина. Молибден вместе с другими элементами с переменной валентностью (Fe, Co, Си) служит посредником при переносе электронов в окислительно-восстановительных ферментных реакциях. При дефиците бора в клубеньках не формируются сосудистые пучки, и вследствие этого нарушается развитие бактероидной ткани.
На формирование клубеньков у бобовых растений большое влияние оказывает углеводный обмен растений, определяемый рядом факторов: фотосинтезом, наличием в среде углекислого газа, физиологическими особенностями растений. Улучшение углеводного питания благоприятно сказывается на инокуляционном процессе и азотонакоплении. С практической точки зрения большой интерес представляет использование соломы и соломистого свежего навоза для удобрения бобовых растений как источника углеводов. Но в первый год после внесения соломы в почву при ее разложении накапливаются токсические вещества. Следует отметить, что не все виды бобовых растений чувствительны к токсическим продуктам распада соломы; горох, к примеру, не реагирует на них.
Определенное значение в симбиозе клубеньковых бактерий и бобовых растений имеют биологические факторы.
Большое внимание уделяется влиянию ризо-сферной микрофлоры на клубеньковые бактерии, ĸᴏᴛᴏᴩᴏᴇ может иметь как стимуляционный, так и антагонистический характер исходя из состава микроорганизмов ризосферы.
Много работ посвящено изучению фагов клубеньковых бактерий. Большинство фагов способны лидировать различные виды бактерий, некоторые специализированы лишь в отношении отдельных видов или даже штаммов клубеньковых бактерий. Фаги могут препятствовать внедрению бактерий в корень, вызывать лизис клеток в ткани клубенька. Фаги наносят большой ущерб, лизируя препараты клубеньковых бактерий на заводах, вырабатывающих нитрагин.
Среди различных видов насекомых, наносящих вред клубеньковым бактериям, особенно выделяется полосатый клубеньковый долгоносик, личинки которого разрушают клубеньки на корнях многих видов бобовых растений (главным образом однолетних). Широко распространен и щетинистый клубеньковый долгоносик.
Ранней весной самки клубеньковых долгоносиков откладывают от 10 до 100 яиц. Через 10—15 дней из яиц развиваются небольшие (до 5,5 мм), червеобразные, согнутые, белые, со светло-бурой головкой личинки, питающиеся преимущественно клубеньками и корневыми волосками. Только что вылупившиеся личинки проникают в клубенек и питаются его содержимым. Более взрослые личинки разрушают клубеньки снаружи. Одна личинка за 30—40 дней уничтожает 2—6 клубеньков. Особенно большой вред они наносят в сухую и жаркую погоду, когда развитие растений замедляется.
Клубеньки люцерны и некоторых других видов бобовых растений повреждает также большой люцерновый долгоносик.
Самки жука откладывают до 400 яиц, из которых развиваются безногие, дугообразные, желтовато-белые, с бурой головкой, покрытые бурыми щетинками личинки. Их длина 10— 14 мм. Цикл развития большого люцернового долгоносика протекает в течение двух лет.
Наличие нематод в корневой зоне различных видов бобовых растений отмечают многие исследователи. В прикорневой зоне гороха, к примеру, обнаружено 47 видов нематод, среди них 25 паразитических.
На корнях молодых растений фасоли, люпина, клевера может паразитировать широко распространенная ростковая нематода. Самки этого вида, питающиеся корнями растений, откладывают яйца в ткани растения. Весь жизненный цикл развивающейся из яиц нематоды протекает обычно внутри тканей.
В степных районах на корнях люцерны, клевера и сои обнаружена степная нематода. Самки перед откладкой яиц проникают в корень, куда откладывают от 12 до 20 яиц. В корнях личинки проходят три личиночные стадии развития, нарушая функции корня и клубеньков.
referatwork.ru
Инициация заражения бобовых клубеньковыми бактериями » Привет Студент!
Развитие симбиотических ассоциаций между бобовыми растениями и клубеньковыми бактериями представляет огромный интерес для агрономии. Эти симбиозы обеспечивают большую часть биологически связанного азота, доступного сельскохозяйственным культурам.
Клубеньковые бактерии — довольно обычные грам-отрицательные микроорганизмы, объединенные в одно семейство с известными фитопатогенными бактериями Agrobacterium. Хотя клубеньковые бактерии рассматриваются в этой статье исключительно с точки зрения их роли в симбиотических взаимоотношениях с растениями, необходимо всегда помнить, что они очень хорошо приспособлены к длительному выживанию в почве даже в отсутствие специфических растений-хозяев. Точно так же и хозяева этих бактерий — бобовые растения, например соя и клевер, могут хорошо расти без своих симбионтов. Таким образом, симбиоз бобовых растений и клубеньковых бактерий — это скорее факультативная, а не облигатная ассоциация. Она обычно выгодна для обоих организмов, но не обязательна для их развития. Каждый партнер этой ассоциации может вести свою собственную жизнь и хорошо для этого приспособлен. Следовательно, можно ожидать, что в процессе инфекции и установления симбиоза развитие клубеньковых бактерий должно быстро изменяться, т. е. происходит адаптация, позволяющая им перейти из комплексной среды обитания в почве в динамическую среду на поверхности корня, а затем в совсем особую среду внутри клеток хозяина. Растение-хозяин должно также быстро реагировать на присутствие симбиотических бактерий на поверхности его корней, причем ответные реакции хозяина должны заметно отличаться от их реакций на другие почвенные микроорганизмы. В растении-хозяине должны произойти значительные внутренние изменения, в результате которых оно сможет принять своего бактериального партнера и переключиться с потребления связанного азота из экзогенных источников на усвоение симбиотически образованного Nh4. Совершенно очевидно, что процесс инфекции и развития симбиотических отношений состоит из целой серии мутуалистических адаптаций. Во многих отношениях этот процесс напоминает инфицирование восприимчивого хозяина патогенным организмом, и в то же время они совершенно различны.
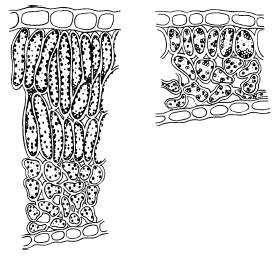
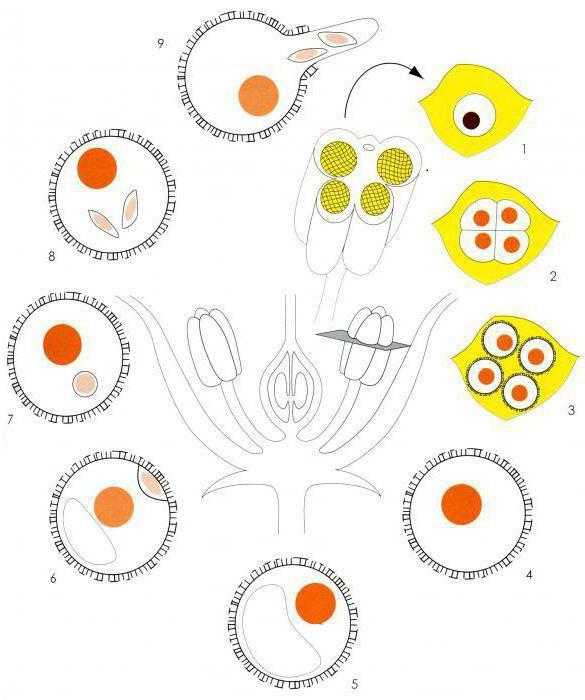
Инфицирование сои Rhizobium japonicum, очевидно, начинается с реакции бактерии на появление сигнальных и питательных веществ, выделяемых корнями хозяина. Клетки Rhizobium очень быстро прикрепля-ются к поверхности корня, и их можно обнаружить уже спустя несколько секунд или минут после инокуляции корней. Прикрепление бактерий чаще всего полярное. Следующий этап, наблюдаемый в инфекционном процессе, — скручивание корневых волосков. Скручивание и деформация последних специфически индуцируются клубеньковыми бактериями. Скручивание начинается спустя несколько часов после инокуляции и становится заметным примерно через 12 ч . Клубеньковые бактерии проникают в скрученные корневые волоски у точки наибольшего изгибания и внедряются в них в виде трубчатой структуры, называемой инфекционной нитью. Эти нити переносят клетки ризо-бий, обычно в виде одной цепочки, к основанию корневого волоска (к базальной клетке). Кончик растущей инфекционной нити, по-видимому, движется по пути ядра клетки хозяина. До того момента как инфекционная нить выйдет из базальной клетки волоска, в близлежащих кортикальных клетках происходит стимуляция деления и заполнения цитоплазмой. Инфекционные нити проникают через клеточную стенку, расположенную между клеткой корневого волоска и прилегающими к ней кортикальными клетками, и разветвляются, захватывая многие непрерывно делящиеся кортикальные клетки. Затем происходит высвобождение клеток клубеньковых бактерий из кончиков инфекционных нитей в цитоплазму клеток хозяина. Сразу же после высвобождения бактерии инкапсулируются цитоплазматическими мембранами клеток хозяина и, таким образом, никогда не вступают в прямой контакт с цитоплазмой хозяина. Клетки клубеньковых бактерий и расте-ния-хозяина пролиферируют, формируя структуры, называемые клубеньками, которые состоят из примерно равных в весовом соотношении масс бактерий и тканей растения. Хозяин обеспечивает ризобии продуктами фотосинтеза, а бактерии осуществляют превращение атмосферного N2 в Nh4, снабжая растения доступным азотом.
Это удивительный процесс, замечательный по специфике, механизмам действия, развитию и регуляторной утонченности. Наблюдение за ним и изучение его доставляет истинное наслаждение.
Мы начали систематическое и многоплановое изучение инфицирования con Rhizobium japonicum. Моими коллегами в этой работе были физиологи Арвинд Бхаг-ват, Маргарет Пирс и Т. В. Бхуванесвари, цитологи Джиллиан Терджен, Марк Пенс и Гарри Калверт, биохимик Эндрю Морт и специалисты по мутагенезу Ян Ло и Поко Ямамото. Исследования клубеньковых бактерий были начаты с изучения механизмов распознавания и специфичности по отношению к хозяевам. По крайней мере, для большинства бобовых растений, обитающих в зоне умеренного климата, существует четко выраженная специфичность к ризобиям. Например, Rhizobium meli-loti формирует клубеньки только с люцерной и не инфицирует клевер или другие виды бобовых. Штаммы R. japonicum образуют клубеньки лишь с соей, но не с люцерной, клевером и т. д.
Молекулярные основы специфичности хозяев и клубеньковых бактерий
Специфичность хозяина и механизмы распознавания в течение многих лет представляют обширную область исследований для фитопатологов, включая и тех специалистов, которые изучают симбиозы Rhizobium. В 1975 г. Альбершейм и Андерсон-Праути выдвинули теоретическое предположение о том, что в реакции распознавания в системах растение — патоген участвуют связывающие углеводы белки (т. е. лектины) хозяина, реагирующие с углеводами на поверхности клеточных стенок микроорганизмов. Почти одновременно Болул и Шмидт привели экспериментальное доказательство тесной корреляции между возможностью различных клубеньковых бактерий инфицировать сою и их способностью связывать меченый лектин в семенах этого растения. Мы проверили с максимальной тщательностью опыты Болула и Шмидта и подтвердили корреляцию между образованием клубеньков и связыванием лектина ризобиями. Однако в научной литературе отмечены некоторые отклонения от указанной закономерности:
— Бретауэр и Пэкстон, Чен и Филлипс, Ло и Стрийдом привели данные, свидетельствующие об отсутствии корреляции между связыванием лекти-нов и образованием клубеньков у сои;
— некоторые штаммы R. japonicum очень активно образовывали клубеньки, но не связывали лектин сои;
— у ряда штаммов ризобий в культуре лишь небольшое число клеток (1—5%) связывало лектин сои.
На основании наблюдений мы установили одну важную закономерность, а именно способность клеток Rhi-zobium japonicum связывать лектин сои резко меняется с возрастом культуры. Это открытие позволяет предположить, что появление или исчезновение соединений, служащих рецепторами лектина, на поверхности клеток Rhizobium каким-то образом регулируется. Изучив возможность синтеза рецептора лектина в зависимости от веществ, присутствующих в корнях хозяина, мы установили, что все испытанные штаммы R. japonicum связывают лектин сои при выращивании в присутствии корней хозяина, тогда как на лабораторных средах многие из штаммов не имели клеток, способных связывать лектин. Влияние корней на образование рецепторов лектина позволяет объяснить противоречивость в результатах опытов с теми штаммами бактерий, которые образовывали клубеньки, но не связывали лектин, а также понять отсутствие корреляции между этими процессами в опытах других исследователей. Однако нам до сих пор неизвестно, какое из веществ в корнях растения-хозяина ответственно за изменения в синтезе рецептора.
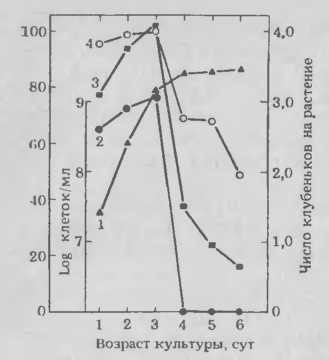
Рис.1. Влияние возраста культуры Rhizobium japo nicum штамм 110 ARS на число клеток, способных связывать лектин сои, и на образование клубеньков на первичных корнях выше отметки исходного положения кончика корня (см. текст) в момент инокуляции:
1 — число клеток/мл; 2 — процент клеток, связывающих лек-тин; 3 — число клубеньков выше отметки в пересчете на растение; 4 — процент растений, имеющих клубеньки выше отметки.
Целесообразно также отметить, что Даззо и Хаббелл установили аналогичную четкую корреляцию между связыванием лектина и образованием клубеньков в симбиотической ассоциации клевер/Rhizobium trifolii.
Стабильность корреляций со связыванием лектина в системе соя/R, japonicum позволяет рассмотреть еще два вопроса:
— можно ли утверждать, что подходящий лектин, находящийся на поверхности корней сои в нужное время и нужном месте, действительно играет роль в реакции узнавания?
—какова природа рецептора лектина сои на поверхности клеток Rhizobium japonicum?
Определенного ответа на первый вопрос в настоящее время пока нет. Лучшим доказательством в его пользу могут быть данные Стейси и др., которые показали, что меченые антитела, специфичные для лектина семян сои, связывались корнями сои в противоположность меченым антителам неспецифической сыворотки. Низкая плотность связывания меченых антител может объяснить причину трудного обнаружения лектина в корнях другими, более прямыми биохимическими методами.
Более полные и точные данные получены по второму вопросу. В соответствии с убедительными цитологическими и биохимическими экспериментами лектин сои связывается материалом капсулы, окружающей клетки Rhizobium japonicum. Меченный ферритином лектин сои связывается капсулярным материалом бактерий, но не внешней мембраной клеток. Эта связь биохимически специфична, что показано методом ингибирования гаптенами сахара, и свободна от влияния артефактов, возникающих при фиксации, как было установлено с помощью криоскалывания.
Мы выделили капсулярный материал у двух различных штаммов R. japonicum и установили, что он состоит из полисахарида, структура которого представлена на рисунке 2. Возможно, что наиболее важной особенностью капсулярного полисахарида (КПС) является наличие боковой галактознльной цепи в каждой повторяющейся единице полимера. Связывание лектина сои поверхностью бактериальной клетки особенно сильно ингибируется при добавлении галактозы или N-ацетнлгалактозамина, показывая, что галактозоподобные структуры составляют важную часть материала, специфически связывающего лектин. Галакто-зильные остатки КПС иногда содержат метильную группу в позиции 4. По данным Хаммарстрема и др., лектин сон не присоединяется к 4-О-метилгалак-тозе. Поэтому особый интерес представляло открытие изменения состава сахаров, входящих в КПС, с возрастом культур бактерий. В старых культурах галакто-зильные остатки в КПС чаще были 4-О-метилированы.
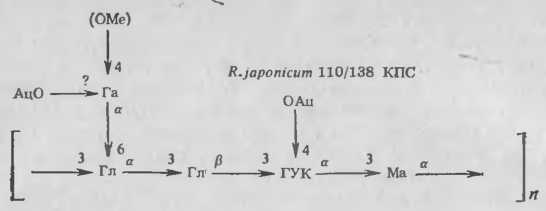
Рис. 2. Структура повторяющейся пентасахаридной единицы, образующей капсулярный полисахарид/экзополисахарид (КПС/ЭПС) в штаммах 110/138 R. japonicum:
Гл — глюкоза; Ма — манноза; ГУК — галактуроновая кислота; Га — галактоза; Ац — ацетат; Me — метнл.
Превращение неметилированной галактозы в метилированную происходит особенно быстро в период, когда бактериальные культуры переходят от экспоненциальной к стационарной фазе роста. В это же время происходит внезапное уменьшение числа инкапсулированных клеток и бактерий, способных связывать лек-тин сон. Изменения в составе КПС и в инкапсуляции объясняют внезапную потерю этими штаммами способности связывать лектин. Как будет показано дальше, при достижении стационарной фазы роста эти штаммы также внезапно теряют инфекционную способность. Пока не установлено, существуют ли какие-либо причинные взаимосвязи между изменениями химического состава КПС, связыванием лектина и инфекционностью Rhizo-bium.
Необходимо учитывать, что штаммы R. japonicum синтезируют как капсулярный полисахарид (КПС), присоединяющийся к хозяину, так и экзополисахарид (ЭПС), не соединяющийся с хозяином. По данным Дад-мена, некоторые штаммы R. japonicum образуют ЭПС, структура которого представлена на рисунке 3. Этот ЭПС, выделенный из культуральных фильтратов, достоверно не содержит галактозоподобных остатков, способных связывать лектин сои. Если последний выступает в роли ви-доспецифичного детерминанта в реакциях распознавания для всех бактерий, образующих клубеньки на сое, следовательно, эти штаммы R. japonicum должны, в свою очередь, также образовывать, по крайней мере в малых количествах, какой-то КПС или ЭПС с сайтом связывания лектина по типу галактозы. По некоторым предварительным данным, два штамма клубеньковых бактерий, которые образуют ЭПС рамнозного типа, способны также синтезировать небольшие количества галактозосодержащих КПС/ЭПС (Морт, неопубл. данные).
Способность клеток R. japonicum связывать лектнн сон строго зависит от наличия капсулярного материала на бактериях. Однако образование клубеньков от этого не зависит. Мутанты R. japonicum, не формировавшие заметных капсул в любой фазе роста как на лабораторных питательных средах, так и при культивировании с корнями хозяина, тем не менее довольно легко образовывали клубеньки на корнях сон. Важным детерминантом способности к образованию клубеньков является возможность синтезировать адекватные количества галактозосодержащего полисахарида. Между количеством образуемого ЭПС, синтезированного различными мутантами ризобий, и их относительной способностью формировать клубеньки существует линейная связь. С появлением некоторого количества галактозосодержащего полисахарида перестает иметь значение, связан ли он с клетками бактерий или находится в свободном состоянии.
Рис. 3. Структура повторяющегося мономера в тетрасахариде, входящем в состав ЭПС штамма 61А76 Rhizobium japonicum; обозначения те же, что и на рисунке 2 (Rha — рафиноза).
1. Взаимосвязь между синтезом ЭПС и формированием клубеньков на корнях сои различными мутантами Rhizobium japonicum, не дающими нормальные капсулы

Можно считать слишком упрощенной идею о том, что лектпны хозяина и полисахариды поверхности клеток Rhizobium — это единственные детерминанты специфичности и распознавания при взаимодействии симбионтов. Если Даззо и Стейси с соавт. считают, что лектнны хозяина ответственны за специфичное прикрепление гомологичных клубеньковых бактерий к поверхности хозяина, то другие исследователи особо выделяют индукцию специфических ответных реакций хозяина с помощью образования связей типа лек-тин — полисахариды. И все же, по-видимому, более вероятно, что эти реакции взаимодействия представляют собой лишь часть сложной последовательности взаимообменов между обоими симбионтами по принципу сигнал— ответ. Согласно этой точке зрения, каждый этап в такой последовательной цепи по-своему определяет общую биологическую специфичность симбиоза. Ни один из этапов процесса распознавания нельзя исключать только потому, что он не является первым или наиболее селективным, и в то же время нельзя считать, что первый или наиболее селективный этап будет полностью определять специфичность симбиотических отношений.
Ранние процессы при инфекциях, вызываемых RHIZOBIUM
Об инициации или раннем развитии инфекций, вызываемых клубеньковыми бактериями у их симбионтов, известно удивительно мало, хотя некоторые последние работы дают по этим вопросам ценную информацию. Как показано ранее, первое внешнее проявление инфекционного процесса — это прикрепление бактерий к поверхности корней хозяина. Клетки Rhizobium, как правило, прикрепляются полярно. По мнению Даз-зо, такое прикрепление определяется лектином хозяина и специфично для системы клевер/R, trifolii. Стейси с соавт. привели аналогичные данные в отношении R. japonicum на корнях сои. Однако мы установили, что и R. trifolii, и R. japonicum могут прикрепляться полярно к корням сои, причем при вполне сравнимых количестве и плотности (Терджен и Бауэр, не-опубл. данные). Характер прикрепления обоих видов практически не различался в условиях наших экспериментов. Независимо от того, является присоединение специфическим или неспецифическим, а иногда промежуточным, приходится признавать, что пока ничего не известно ни о клеточных и молекулярных компонентах, обусловливающих прикрепление, ни о механизмах действия этих компонентов.
Второе проявление инфекционного процесса — индукция скручивания корневых волосков. Функция этого явления заключается, по-видимому, в защемлении клеток Rhizobium в пространстве между двумя поверхностями клеточных стенок изогнутого корневого волоска. До сих пор никому не удалось определить вещества, индуцирующие скручивание или ветвление корневых волосков, не изучены и механизмы, с помощью которых происходит скручивание.
Третье проявление инфекционного процесса — формирование инфекционной нити. Недавние исследования Каллахэма дали очень важную информацию об этом процессе. Он предложил три возможных модели проникания Rhizobium в клетку хозяина:
— локальная инвагинация клеточной стенки корневого волоска;
— локальное разрушение клеточной стенки волоска с помощью индуцированных ферментов самого хозяина и синтез инфекционной нити;
— локальное разрушение клеточной стенки корневого волоска ферментами Rhizobium и синтез инфекционной нити.
Результаты исследований Каллахэма убедительно показали, что процесс инфицирования клевера бактерией R. trifolii включает локальное разрушение клеточных стенок корневых волосков вблизи от захваченных бактерий, связанное с локальным отложением нового слоя неидентифицированного материала, из которого формируется инфекционная нить. Это отложение очень напоминает образование футляра (чехла) вокруг инфицирующих гиф патогенных грибов. Цитологические исследования Каллахэма позволили исключить гипотезу об инвагинации клеточной стенки корневого волоска, однако не дали решения вопроса о том, чьими ферментами вызывается локальное разрушение клеточных стенок — ферментами хозяина или бактерии? Некоторые сообщения поддерживают оба возможных варианта, но не дают определенного ответа.
Множество вопросов, касающихся дальнейших этапов инфекционного процесса, также до сих пор не решено. Например, как может инфекционная нить проникать в клетку хозяина против ее тургорного давления? Почему (и как) кончик растущей инфекционной нити следует за движением ядра в клетке корневого волоска? Как инфекционная нить проникает в соседние кортикальные клетки? Каким образом стимулируется деление кортикальных клеток при развитии инфекционного процесса, вызываемого прониканием нити? Как могут клубеньковые бактерии избегать нормальных защитных реакций растений-хозяев или подавлять их?
К сожалению, серьезные методологические сложности мешают детальному изучению более ранних этапов инфекционного процесса. Сложности возникают из-за того, что в процессе инокуляции обычно участвует около 100 тыс. клеток бактерий и около 10 тыс. корневых волосков, однако инфекционный процесс инициируется не более чем в 100 случаях и лишь около 10 случаев инфекции завершается формированием клубеньков. Поэтому трудно рассмотреть механизмы или неиз-вестные этапы инфекционного процесса в 10 успешных или в целом в 100 случаях инфицирования корневых волосков на фоне 10 тыс. или даже большего количества неудачных или невосприимчивых взаимодействий хозяина и Rhizobium.
Рис. 4. Диаграмма, показывающая фазы инфекционного процесса, вызываемого клубеньковыми бактериями. Клубеньковые бактерии, заключенные в пространство между двумя поверхностями изогнутого корневого волоска, разрушают клеточную стенку хозяина (а), вызывают синтез нового слоя материала со стороны цитоплазмы клеточной стенки хозяина (б) и проникают через частичио разрушенную клеточную стенку корневого волоска в инфекциониую нить, сформировавшуюся из вновь отложившегося слоя (в).
Локализация инфицируемых клеток на корнях растения-хозяина
Для облегчения методики изучения биохимических механизмов процессов распознавания и инфицирования мы недавно решили определить, какие клетки корня хозяина восприимчивы к инфекции. Проростки растений выращивали в пластиковых пакетах, что позволяло вести визуальное наблюдение за развивающимися корнями. Положение кончиков корней (КК) и зоны образования корневых волосков отмечали на пластике в момент внесения инокулюма. Спустя неделю после инокуляции определяли положение каждого клубенька с учетом сделанных отметок. Если учесть перемещение эпидермальных клеток во время роста корня, можно вычислить положение и фазу развития тех клеток корня, которые были восприимчивы к инфицированию в момент инокуляции клубеньковыми бактериями. Графики (рис. 5. 5) четко показывают, что клубеньки наиболее часто образовывались на тех участках корней, которые находились непосредственно под зоной корневых волосков и над зоной быстрого растяжения. Относительно мало клубеньков формировалось в зоне развивающихся волосков корня, а на участках корней, в момент инокуляции покрытых зрелыми волосками, их вообще не было. Таким образом, способность к формированию клубеньков ограничена определенными фазами развития корней и кратковременностью существования клеток-мишеней, восприимчивых к бактериям. Эксперименты с более поздней инокуляцией сон показали, что весь участок корня выше кончика заметно теряет восприимчивость через 4—6 ч. У других видов бобовых способность к образованию клубеньков также кратковременна и ограничена определенными фазами развития.
Эти данные представляют несомненный теоретический и практический интерес. Например, капельки ино-кулирующей суспензии объемом в нанолитр, содержащие лишь несколько клеток клубеньковых бактерий, можно наносить непосредственно на участок наибольшей восприимчивости корня, и развитие Rhizobium произойдет именно в точке инокуляции. Этот метод позволил нам использовать электронный микроскоп для изучения самых ранних процессов, которые происходят еще до образования инфекционной нити, скручивания корневых волосков или каких-либо иных показателей начала инфекции, заметных в световом микроскопе. Проведение таких исследований возможно только при достаточной уверенности в том, что корневые волоски, взятые для приготовления ультратонких срезов, пригодны для этой цели и будут инфицированы клубеньковыми бактериями.
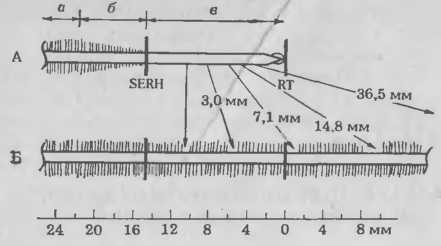
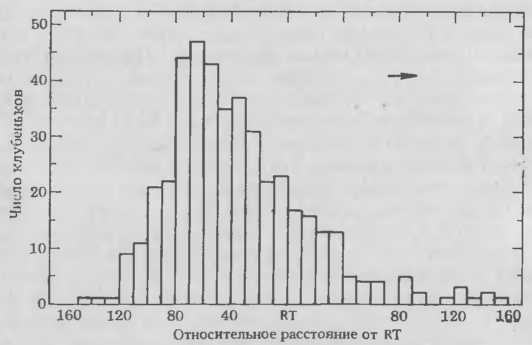
Рис. 5. Частота образования клубеньков в различных зонах корней сои, инокулированных штаммом 110 R. japonicum. Растения выращивали в пластиковых пакетах, на поверхности которых были сделаны отметки, показывающие положение коичика корня (RT) и место наименьшего развития корневых волосков (SERH). Корни приблизительно 120 растений исследовали через неделю после инокуляции, определяя относительное (%) расстояние от каждого клубенька, образовавшегося на первичном корне, до RT. Для более легкого определения относительного положения неинфицированных клеток кория во время инокуляции рассчитано перемещение эпидермальных клеток относительно RT.
Вещества, влияющие на интенсивность начальных процессов инфекции
Не менее интересный аспект исследований темпов развития восприимчивости бобовых растений к клубеньковым бактериям состоит в том, что в настоящее время появилась возможность изучать факторы, влияющие на скорость инициации успешного инфицирования. Число клубеньков, развивающихся над кончиком корня (RT) выше сделанной на пластике отметки, служит прекрасным количественным параметром развития инфекции. Например, Бхагват (личное сообщение) недавно обнаружил, что образование клубеньков некоторыми ризобиями на корнях коровьего гороха происходит непосредственно под меткой, если бактерии культивировали на среде вместе с корнями хозяина перед инокуляцией. Эти результаты позволяют предположить, что Rhizobium могут адаптироваться или отвечать каким-то образом на вещества, выделяемые из корня хозяина, прежде чем они приобретут способность к инфицированию.
У сои можно наблюдать обратное явление. Образование клубеньков на корнях сои выше отметки RT мало зависит от предварительного культивирования R. japonicum в корневых экссудатах хозяина. Однако образование клубеньков с максимальной частотой происходит ниже зоны развития корневых волосков, хотя даже цитологические исследования показали, что инфекция, приводящая к образованию клубеньков, происходит через короткие, только начинающие развиваться корневые волоски. Различия между локализацией ожидаемой и действительной зоны максимального образования клубеньков привели нас к заключению о наличии определенного лаг-периода между временем первого взаимодействия клеток корней с бактериями и временем начала успешного инфекционного процесса в них. Очевидно, этот лаг-период можно сократить, предварительно обработав корни клеточным полисахаридом клубеньковых бактерий. N-ацетилгалактоза, возможный полисахаридный гаптен лектина сон, также эффективен в этом отношении. Такие эксперименты трудны для точного воспроизведения, но нам удалось найти способы, позволяющие контролировать большую часть меняющихся показателей.
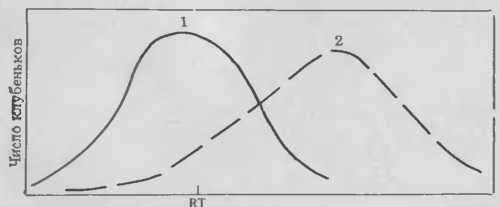
Относительное расстояние между клубеньками и меткой у кончика корня (RT)
Рис.6. Влияние экссудатов коровьего гороха на развитие клубеньковых бактерий:
1 бактерии на экссудатах корней; 2 — бактерии на синтетической питательной среде.
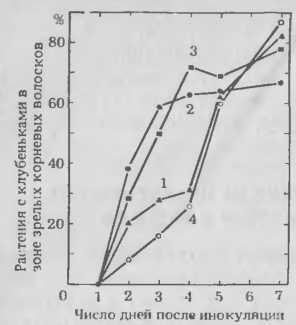
Рис. 7. Влияние бесклеточ-ного фильтрата Rhizobium tri-folii на образование клубеньков в зоне зрелых корневых волосков у клевера. Корни клевера предварительно обработали 100 мкл воды (4) или культурального фильтрата в течение 6, 14 и 24 ч (на графике — 1, 2, 3 соответственно) до внесения инокулюма. Число клубеньков. образовавшихся в зоне корней со зрелыми корневыми волосками в момент инокуляции, определяли ежедневно в течение недели.
Аналогичное явление отмечено и в корнях клевера. Если культуру R. trifolii отмыть, ресуспендировать в дистиллированной воде в течение часа и затем отфильтровать, то свободный от клеток фильтрат заметно сокращает время, необходимое для образования клубеньков в зоне зрелых корневых волосков, при обработке корней этим фильтратом перед инокуляцией. Интересно отметить, что такая же обработка корней клевера не отражалась заметно на времени образования клубеньков в зоне без корневых волосков.
Фильтрат действует на образование клубеньков только в зоне зрелых корневых волосков, очевидно, влияя на второй тип инфекции, характерный для клевера, но не отмеченный у сои, коровьего гороха или люцерны.
Активные соединения, присутствующие в фильтратах суспензий R. trifolii или в корневых экссудатах коровьего гороха, до сих пор не идентифицированы. Тем не менее обнаружение их действия подтверждает точку зрения на то, что взаимное распознавание клубеньковых бактерий и их хозяев представляет комплекс реакций, происходящих между симбионтами по типу сигнал — ответ.
Инфекционная способность клеток RHIZOBIUM
К инфицированию ризобиями восприимчивы только определенные клетки корней бобовых, причем восприимчивость зависит от времени и фазы развития растения. Что же можно сказать о клубеньковых бактериях? Зависит ли инфекционная способность Rhizobium от времени, фазы развития или среды? Влияние корневых экссудатов коровьего гороха на формирование клубеньков ризобиями позволяет предположить, что, по крайней мере, некоторые виды бактерий должны подвергаться определенным изменениям, прежде чем они будут способны вызвать инфекцию. Конечно, даже в одной культуре клетки Rhizobium могут отличаться друг от друга множеством признаков. Например, они могут иметь разные способность к инкапсуляции, подвижность, фазы клеточных циклов, число полярных телец. Возможно, что инфекционная способность зависит от одного или нескольких подобных специфических признаков. Из вышеприведенных данных следует, что в отличие от синтеза ЭПС инкапсуляция сама по себе, видимо, не связана с инфекционной способностью. По данным недавних исследований, инфекционная способность клубеньковых бактерий не зависит от их подвижности.
Работы, проведенные в нашей лаборатории, позволили установить, что инфекционность R. japonicum в значительной мере зависит от возраста культуры. Культуры штаммов 110 и 138 R. japonicum, достигнув фазы стационарного роста, быстро теряли способность вызывать образование клубеньков выше отметки RT. Очевидно, в этой фазе бактерии в меньшей мере готовы или способны вызвать инфекционный процесс во время инокуляции, чем клетки в экспоненциальной фазе. Основа этого изменения к концу экспоненциальной фазы не известна. Изучение влияния дозы инокулюма на процесс образования клубеньков показало, что культуры штамма 110 R. japonicum, находящиеся в ранней или поздней фазе стационарного роста, могут индуцировать образование клубеньков так же быстро и интенсивно, как и культуры в фазе экспоненциального роста, однако для инокуляции растений необходимо большее количество инокулюма старых культур.
Следовательно, различия в инфекционной способности между культурами бактерий в экспоненциальной или стационарной фазе роста являются скорее количественными, чем качественными. Находящиеся в стационарной фазе роста культуры, по-видимому, содержат в пропорциональном отношении меньшее число клеток, способных быстро вызывать инфекцию.
Заслуживает внимания еще один аспект образования симбиотических ассоциаций. Графики частот образования клубеньков показывают ослабление интенсивности этого процесса в нижних участках корней, которые в момент инокуляцин были на 5— 10 ч моложе, чем участки с максимальной активностью образования клубеньков. Очевидно, растения сои обладают быстродействующим регуляторным механизмом, служащим для предупреждения развития излишнего числа клубеньков на корнях. Второе возможное объяснение состоит в том, что убывание числа клубеньков в нижних участках корней может быть связано с уменьшением числа бактерий, приходящихся на долю этих частей. Однако, если эти же корни повторно инокулировали спустя 10—12 ч после первого нанесения бактерий, никаких изменений в образовании клубеньков не происходило, т. е. необходимости в повышении численности бактерий не было. В то же время если первичный инокулюм был нанесен только на верхнюю часть корня без корневых волосков и на зону молодых, развивающихся волосков, где удлинение корня полностью или большей частью завершено, то вторичная инокуляция вызывала формирование новых клубеньков. Этот эксперимент показывает, что быстродействующий регуляторный механизм в растении сон включает в себя некоторые типы взаимодействий между Rhizobium и теми клетками хозяина, которые локализованы в зоне быстрого удлинения корня вблизи от его кончика.
Наличие быстродействующего регуляторного механизма в растениях сои и, возможно, коровьего гороха и люцерны создает дополнительный уровень сложности и организации в динамическом влиянии фаз развития и окружающей среды на раннее развитие и успех инфекций клубеньковыми бактериями.
Используемая литература: Инфекционные болезни растений: физиологические и биохимические основы/Пер. с англ. Л. Л. Великанова, Л. М. Левкиной, В. П. Прохорова, И. И. Сидоровой; Под ред. и с предисл. Ю. Т. Дьякова. — М.: ВО Агропромиздат, 1985. — 367 с.
Скачать реферат: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ
Пароль на архив: privetstudent.com
privetstudent.com
Факторы, определяющие симбиотические взаимоотношения клубеньковых бактерий с бобовыми растениями
Количество просмотров публикации Факторы, определяющие симбиотические взаимоотношения клубеньковых бактерий с бобовыми растениями - 228
Важно заметить, что для симбиоза, обеспечивающего хорошее развитие растений, необходим определенный комплекс условий среды. В случае если условия окружающей среды будут неблагоприятными, то, даже несмотря на высокую вирулентность, конкурентную способность и активность микросимбионта͵ эффективность симбиоза будет низкой.
Рис. 163. Начальный период формирования артроспор в бактероидах клевера. Увел. X 30 000.
Для развития клубеньков оптимальная влажность 60—70% от полной влагоемкости почвы. Минимальная влажность почвы, при которой еще возможно развитие клубеньковых бактерий в почве, приблизительно равна 16% от полной влагоемкости. При влажности ниже этого предела клубеньковые бактерии обычно уже не размножаются, но тем не менее они не погибают и могут долгое время сохраняться в неактивном состоянии. Недостаток влаги приводит и к отмиранию уже сформировавшихся клубеньков.
Нередко в районах с недостаточным увлажнением многие бобовые растения развиваются, не образуя клубеньков.
Поскольку размножение клубеньковых бактерий в отсутствие влаги не происходит, в случае засушливой весны инокулированные (искусственно зараженные) семена крайне важно вносить глубже в почву. К примеру, в Австралии семена с нанесенными на них клубеньковыми бактериями глубоко заделывают в почву. Интересно, что клубеньковые бактерии почв засушливого климата более стойко переносят засуху, чем бактерии почв влажного климата. В этом проявляется их экологическая приспособленность.
Избыточная влажность, как и ее недостаток, также неблагоприятна для симбиоза — из-за снижения степени аэрации в зоне корней ухудшается снабжение корневой системы растения кислородом. Недостаточная аэрация отрицательно влияет и на живущие в почве клубеньковые бактерии, которые, как известно, лучше размножаются при доступе кислорода. Тем не менее высокая аэрация в зоне корней приводит к тому, что кислород начинают связывать восстановители молекулярного азота͵ снижая степень азотфиксации клубеньков.
Важную роль во взаимоотношениях клубеньковых бактерий и бобовых растений играет температурный фактор. Размещено на реф.рфТемпературные характеристики разных видов бобовых растений различны. Также и разные штаммы клубеньковых бактерий имеют свои определенные температурные оптимумы развития и активной фиксации азота. Следует отметить, что оптимальные температуры развития бобовых растений, образования клубеньков и азотфиксации не совпадают. Так, в природных условиях образование клубеньков может наблюдаться при температурах несколько выше О °С, азот-фиксация при таких условиях практически не происходит. Возможно, лишь арктические симбиозирующие бобовые растения связывают азот при очень низких температурах. Обычно же данный процесс происходит лишь при 10 °С и выше. Максимальная азотфиксация ряда бобовых растений наблюдается при 20—25 °С. Температура выше 30 °С отрицательно влияет на процесс азотонакопления.
Экологическая адаптация к температурному фактору у клубеньковых бактерий значительно меньше, чем у многих типичных сапрофитных форм. По мнению Е.Н. Мишустина (1970), это объясняется тем, что естественной средой обитания клубеньковых бактерий являются ткани растений, где температурные условия регулируются растением-хозяином.
Большое влияние на жизнедеятельность клубеньковых бактерий и образование клубеньков оказывает реакция почвы. Для разных видов и даже штаммов клубеньковых бактерий значение рН среды обитания несколько различно. Так, к примеру, клубеньковые бактерии клевера более устойчивы к низким значениям р.Н, чем клубеньковые бактерии люцерны. Очевидно, здесь также сказывается адаптация мпкро-ерганизмов к среде обитания. Клевер растет на более кислых почвах, чем люцерна. Реакция почвы как экологический фактор оказывает влияние на активность и вирулентность клубеньковых бактерий. Наиболее активные штаммы, как правило, легче выделить из почв с нейтральными значениями рН. В кислых почвах чаще встречаются неактивные и слабовирулентные штаммы. Кислая среда (рН 4,0 — 4,5) оказывает непосредственное влияние и на растения, в частности нарушая синтетические процессы обмена веществ растений и нормальное развитие корневых волосков. В кислой среде у инокулированных растений резко сокращается срок функционирования бакте-роидной ткани, что ведет к снижению степени азотфиксации.
В кислых почвах, как отмечает А. В. Петербургский, в почвенный раствор переходят соли алюминия и марганца, неблагоприятно действующие на развитие корневой системы растений и процесс азотоусвоения, а также снижается содержание усвояемых форм фосфора, кальция, молибдена и углекислоты. Неблагоприятную реакцию почвы лучше всего устраняет известкование.
Размеры симбиотической азотфиксации определяются в значительной степени условиями питания растения-хозяина, а не клубеньковых бактерий. Клубеньковые бактерии как эндотрофные симбионты растений зависят в основном от растения при получении углеродсодер-жащих веществ и минеральных элементов питания.
Рис. 164. Бактероид со сформировавшейся артроспорой клубеньковой бактерии клевера. Увел. X 35 000.
Для клубеньковых бактерий ткань хозяина представляет такую питательную среду, которая может удовлетворить даже самый требовательный штамм вследствие содержания в ткани всех типов питательных веществ. Тем не менее после внедрения клубеньковых бактерий в ткань растения-хозяина их развитие определяется не только внутренними процессами, но и в значительной степени зависит от действия внешних факторов, оказывающих влияние на весь ход инфекционного процесса. Содержание или отсутствие того или иного питательного вещества в окружающей среде должна быть определяющим моментом для проявления симбиотической азотфиксации.
Степень обеспеченности бобовых растений доступными формами минеральных соединений азота определяет эффективность симбиоза. На основании многочисленных лабораторных и вегетационных опытов известно, что чем больше азотсодержащих соединений в окружающей среде, тем с большим трудом внедряются бактерии в корень.
Сельскохозяйственная практика требует однозначно решить задачу — целесообразнее удобрять бобовые культуры азотом или же правы те исследователи, которые утверждают, что минеральный азот подавляет симбиотическую азотфиксацию бобовых культур и в связи с этим экономически выгоднее такие растения азотом не удобрять. На кафедре агрономической и биологической химии Московской сельскохозяйственной академии им. К. А. Тимирязева были проведены опыты, результаты которых дали возможность получить картину поведения симбионтов в условиях вегетационных и полевых опытов при обеспеченности растений разными дозами азота в среде. Установлено, что повышение содержания растворимых азотсодержащих соединений в среде в полевых условиях при оптимальных условиях произрастания растений не препятствует их симбиозу с клубеньковыми бактериями. Снижение доли атмосферного азота͵ усваиваемого растениями при повышенной обеспеченности минеральным азотом, имеет только относительный характер. Размещено на реф.рфАбсолютное количество азота͵ усвоенного бактериями из атмосферы, практически не снижается, даже нередко увеличивается по сравнению с растениями, выращивающимися в присутствии клубеньковых бактерий, но без внесения в почву азота.
Рис. 165. Миграция артроспор в окружающую среду из клубеньков: 1 — клевера (увел. X 17 000), 2 — люцерны (увел. X 23 000).
Большое значение в активации усвоения азота бобовыми растениями имеет фосфорное питание. При низком содержании фосфора в среде проникновение бактерий в корень происходит, но клубеньки при этом не образуются. Бобовым растениям присущи некоторые особенности в обмене фосфорсодержащих соединений. Семена бобовых отличаются повышенным содержанием фосфора. Запасной фосфор при прорастании семян используется не так, как у других культур, — сравнительно равномерно для формирования всех органов, а в большей степени сосредоточиваясь в корнях. По этой причине в ранние сроки развития бобовые растения, в отличие от злаковых, в большей степени удовлетворяют свои потребности в фосфоре за счёт семядолей, а не запасов почвы. Чем крупнее семена, тем меньше бобовые растения зависят от фосфора почвы. При этом при симбиотическом способе существования потребность бобовых растений в фосфоре выше, чем при автотроф-ном. По этой причине при недостатке фосфора в среде у инокулированных растений ухудшается снабжение растений азотом.
Бобовые растения, как известно, выносят с урожаем значительно больше калия, чем другие сельскохозяйственные культуры. По этой причине калийные и особенно фосфорно-калийные удобрения существенно повышают продуктивность азотфиксации бобовыми растениями.
Рис. 166. Прекратившие функционировать интерцеллюлярная (1) и интрацеллюлярная (2) инфекционные нити в клубеньках клевера. Увел. X 10 000.
Положительное действие калия на образование клубеньков и интенсивность азотфиксации связано в значительной степени с физиологической ролью калия в углеводном обмене растения.
Кальций нужен не только для устранения излишней кислотности почвы. Он играет специфическую роль в развитии клубеньковых бактерий и обеспечении нормального симбиоза бактерий с растением-хозяином. Потребность клубеньковых бактерий в кальции частично должна быть компенсирована стронцием. Интересно, что клубеньковые бактерии тропических культур, растущих на кислых латеритных почвах, не нуждаются в кальции. В этом опять проявляется экологическая адаптация клубеньковых бактерий, поскольку тропические почвы содержат очень небольшие количества кальция.
Важно заметить, что для симбиотической азотфиксации необходимы также магний, сера и железо. При недостатке магния тормозится размножение клубеньковых бактерий, снижается их жизнедеятельность, подавляется симбиотическая азот-фиксация. Сера и железо оказывают также благоприятное влияние на образование клубеньков и процесс азотфиксации, в частности играя несомненную роль в синтезе леггемоглобина.
Из микроэлементов особо отметим роль молибдена и бора. При недостатке молибдена клубеньки плохо образуются, в них нарушается синтез свободных аминокислот и подавляется синтез леггемоглобина. Молибден вместе с другими элементами с переменной валентностью (Fe, Co, Си) служит посредником при переносе электронов в окислительно-восстановительных ферментных реакциях. При дефиците бора в клубеньках не формируются сосудистые пучки, и вследствие этого нарушается развитие бактероидной ткани.
На формирование клубеньков у бобовых растений большое влияние оказывает углеводный обмен растений, определяемый рядом факторов: фотосинтезом, наличием в среде углекислого газа, физиологическими особенностями растений. Улучшение углеводного питания благоприятно сказывается на инокуляционном процессе и азотонакоплении. С практической точки зрения большой интерес представляет использование соломы и соломистого свежего навоза для удобрения бобовых растений как источника углеводов. Но в первый год после внесения соломы в почву при ее разложении накапливаются токсические вещества. Следует отметить, что не все виды бобовых растений чувствительны к токсическим продуктам распада соломы; горох, к примеру, не реагирует на них.
Определенное значение в симбиозе клубеньковых бактерий и бобовых растений имеют биологические факторы.
Большое внимание уделяется влиянию ризо-сферной микрофлоры на клубеньковые бактерии, ĸᴏᴛᴏᴩᴏᴇ может иметь как стимуляционный, так и антагонистический характер исходя из состава микроорганизмов ризосферы.
Много работ посвящено изучению фагов клубеньковых бактерий. Большинство фагов способны лидировать различные виды бактерий, некоторые специализированы лишь в отношении отдельных видов или даже штаммов клубеньковых бактерий. Фаги могут препятствовать внедрению бактерий в корень, вызывать лизис клеток в ткани клубенька. Фаги наносят большой ущерб, лизируя препараты клубеньковых бактерий на заводах, вырабатывающих нитрагин.
Среди различных видов насекомых, наносящих вред клубеньковым бактериям, особенно выделяется полосатый клубеньковый долгоносик, личинки которого разрушают клубеньки на корнях многих видов бобовых растений (главным образом однолетних). Широко распространен и щетинистый клубеньковый долгоносик.
Ранней весной самки клубеньковых долгоносиков откладывают от 10 до 100 яиц. Через 10—15 дней из яиц развиваются небольшие (до 5,5 мм), червеобразные, согнутые, белые, со светло-бурой головкой личинки, питающиеся преимущественно клубеньками и корневыми волосками. Только что вылупившиеся личинки проникают в клубенек и питаются его содержимым. Более взрослые личинки разрушают клубеньки снаружи. Одна личинка за 30—40 дней уничтожает 2—6 клубеньков. Особенно большой вред они наносят в сухую и жаркую погоду, когда развитие растений замедляется.
Клубеньки люцерны и некоторых других видов бобовых растений повреждает также большой люцерновый долгоносик.
Самки жука откладывают до 400 яиц, из которых развиваются безногие, дугообразные, желтовато-белые, с бурой головкой, покрытые бурыми щетинками личинки. Их длина 10— 14 мм. Цикл развития большого люцернового долгоносика протекает в течение двух лет.
Наличие нематод в корневой зоне различных видов бобовых растений отмечают многие исследователи. В прикорневой зоне гороха, к примеру, обнаружено 47 видов нематод, среди них 25 паразитических.
На корнях молодых растений фасоли, люпина, клевера может паразитировать широко распространенная ростковая нематода. Самки этого вида, питающиеся корнями растений, откладывают яйца в ткани растения. Весь жизненный цикл развивающейся из яиц нематоды протекает обычно внутри тканей.
В степных районах на корнях люцерны, клевера и сои обнаружена степная нематода. Самки перед откладкой яиц проникают в корень, куда откладывают от 12 до 20 яиц. В корнях личинки проходят три личиночные стадии развития, нарушая функции корня и клубеньков.
referatwork.ru