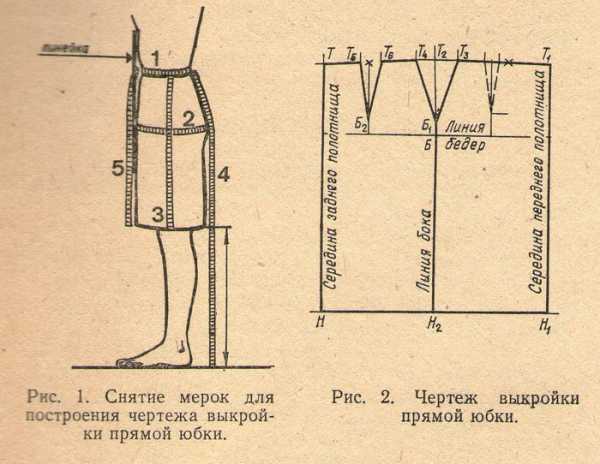
Open Library - открытая библиотека учебной информации. Основные компоненты питательной среды для культуры тканей растений
Биология для студентов - 10. Питательные среди, требования, классификация
Культуру тканей растений в настоящее время выращивают главным образом двумя способами:
- поверхностным — на агаризованных питательных средах или различных гелеобразующих подложках,
- в жидкой питательной среде.
В жидкой питательной среде каллус легко распадается на отдельные агрегаты клеток и дает начало суспензионной культуре. Известны два способа культивирования тканей в жидкой питательной среде:
- накопительное,
- непрерывное.
Важный фактор создания эффективной биотехнологической системы — подбор питательной среды, обеспечивающей потребности культуры ткани продуцента в химических компонентах, необходимых для оптимального биосинтеза целевого продукта. Обязательными компонентами питательных сред служат:
- смеси минеральных солей (макро- и микроэлементов),
- фитогормоны, выступающие как факторы регуляции процессов клеточного деления и дифференциации,
- источник углерода вводится в состав среды в виде сахарозы.
Получение автотрофных культур тканей — пока задача будущего. При приготовлении питательных сред в качестве подложки используют агар-агар, образующий с водой гель. В последнее время в качестве подложки для культуры тканей растений испытывают и другие гелеобраующие вещества:
- силикагели,
- биогели,
- полиакриламидные гели,
- пенополиуретан и др.
В питательные среды для культуры тканей и клеток растений входят:
- минеральные соли (макро- и микроэлементы),
- источник углеродного питания (сахароза, глюкоза и др.),
- витамины,
- регуляторы роста (ауксины, цитокинины, гиббереллины, обычно в концентрации 10~6~10~5М),
- агар-агар (0,6-1,0 %).
Иногда включают комплексные органические добавки:
- эндосперм кокосового ореха (7-20 %) или злаков (10-15 %),
- березовый или томатный сок (5-20 %),
- экстракты из органов вегетирующих растений (0,1—1 %),
- солодовый экстракт (5-10 %),
- дрожжевой экстракт (0,1-0,2 %),
- гидролизат казеина (0,02-0,1 %),
- смесь аминокислот и др.
Начиная работать с новым объектом, исследователи модифицируют состав стандартных сред, особенно набор и концентрацию органических компонентов. В настоящее время наибольшее распространение получили следующие питательные среды.
- Среда Мурасиге и Скуга (МС) - наиболее универсальная, пригодна для растительных клеток многих видов, дает хорошие результаты при каллусообразовании у большинства растений, хорошо поддерживает неорганизованный каллусный рост и вызывает индукцию морфогенеза у двудольных.
- Среда Шенка и Хильдсбрандта используется для получения каллусной ткани из мезокотилей табака, сои, красных бобов, кукурузы и других культур.
- Среда Гамборга и Эвелега (В5) используется при культивировании клеток и тканей бобовых растений.
- Среда Уайта применяется для укоренения побегов и нормального роста стеблевой части после регенерации.
- Среда Нича - китайская среда N6 - используется для индукции андрогенеза в культуре пыльников и для индукции морфогенеза у злаков.
- Среда Као и Михайлюка применяется для культивирования единичных протопластов и клеток.
Питательная среда должна обязательно содержать регуляторы роста (ауксин и цитокинин). Без регуляторов роста каллус обычно не образуется (это происходит лишь в некоторых случаях, когда экспланты обогащены собственными фитогормонами). Иногда для образования каллусной ткани и ее роста достаточно одного ауксина, как, например, при использовании эксплантов, содержащих наряду с паренхимными клетками проводящие и камбиальные ткани. Вероятно, проводящие пучки являются источником ауксинов и цитокининов для окружающих паренхимных клеток. Часто для успешного культивирования следует применять более низкие концентрации регуляторов роста, чем при получении каллуса. Иногда через несколько субкультивирований у каллусных тканей может исчезать потребность в цитокининах, так как у них увеличивается способность к синтезу собственных цитокининов.
В качестве регуляторов роста при культивировании применяют следующие:
- ауксины — ИУК, 2,4-Д, индолилмасляную кислоту (ИМК), анафтилуксусную кислоту (ПУК) и др.;
- цитокинины - кинетин, 6-бензиламинопурин (6-БАП), зеатин, тидиазурон; гиббереллины — ГК3; АБК; брассинолид; этилен.
Иногда в питательную среду добавляют активированный уголь, поливи- нилиирролидон (5-10 г/л), различные антиоксиданты: аскорбиновую кислоту (1 мг/л), восстановленный глутатион (4 -5 мг/л), дитиотрейтол (1-3 мг/л), ди- этилдитиокарбамат (2-5 мг/л).
vseobiology.ru
Глава 10. Биопрепараты растительного происхождения : Farmf
Глава 10. Биопрепараты растительного происхождения
10.1. Культура изолированных клеток, тканей и органов растений10.2. Особенности культивирования изолированных клеток и тканей растений10.3. Методы культивирования изолированных клеток и тканей10.4. Культура растительных клеток как источник лекарственных веществ
10.1. Культура изолированных клеток, тканей и органов растений
Культура клеток, тканей и органов растений представляет собой части растений, наращиваемые в асептических условиях на искусственных питательных средах, и включает:— каллусные культуры на гелеобразной (твердой) питательной среде,— суспензионные культуры клеток в жидкой питательной среде,— культуру протопластов, изолированные органы растений.
Первые попытки культивировать изолированные клетки и ткани растений были предприняты в конце XIX в. известными немецкими учеными Т. Габерландтом, Ж. Фёхтингом и С. Рехингером. Они пытались выращивать in vitro небольшие кусочки тканей растений, помещая их на влажную поверхность фильтра в растворе сахарозы. По аналогии с культурами животного происхождения, где использовались питательные среды природного происхождения (плазма крови, зародышевая жидкость), физиологи растений пытались выращивать клеточную массу, используя соки и экстракты растений. Первые опыты оказались не совсем удачными, поскольку транспорт и превращение питательных веществ у целого растения и изолированных растительных клеток существенно отличается. Лишь к началу 20-х гг. прошлого века ученые отказались от использования природных сред неопределенного состава в пользу синтетических сбалансированных сред. Основой послужили среды, используемые для выращивания целых растений.
Описанный период может считаться лишь предысторией метода культуры тканей и клеток растений. Настоящее развитие этого метода началось с работ Филиппа Уайта в США и Роже Готре во Франции. В результате их исследований в 30-х гг. XX столетия было установлено, что изолированные органы, ткани и клетки растений могут расти в культуре in vitro неограниченно долго при пассировании (пересадках) их на свежую питательную среду при определенных условиях. Многие ткани, введенные ими в культуру, существуют в пассированной культуре в настоящее время.
Культура клеток и тканей лекарственных растений — сравнительно молодая отрасль науки. Впервые культуру тканей лекарственного растений, а именно барвинка розового, получил Уайт в 1945 г. В 1947 г. в лаборатории Готре была получена культура ткани белены червой и доказана ее способность вырабатывать соответствующие алкалоиды. В кронце 50-х гг. XX в. был разработан метод массового выращивания клеток и тканей глубинным способом в жидких питательных средах.
В СССР первые лаборатории по исследованию культур изолированных тканей и клеток лекарственных растений были открыты на базе Института физиологии растений АН СССР под руководством член- корр. АН СССР Р.Г. Бутенко, в Ленинградском химико-фармацевтическом институте, во Всесоюзном институте лекарственных растений и в Томском медицинском институте (ТМИ). В ТМИ лаборатория была организована при кафедре фармакогнозии и ботаники под руководством профессора Д.Н. Березнеговской.
С культурами изолированных тканей и клеток работают по разным направлениям почти во всех странах Европы, в том числе и.в России, а также Северной и Южной Америке, Азии, особенно в Китае, Индии, Японии.
10.2. Особенности культивирования изолированных клеток и тканей растений
Изолированные ткани и клетки растений могут успешно расти только при отсутствии конкуренции с микроорганизмами. Все работы по культивированию растительных объектов необходимо производить в асептических условиях. Если в состав питательной среды входят термолабильные вещества, их фильтруют через мембранные стерилизующие фильтры и добавляют в простерилизованную среду, охлажденную до 30-40 °С.
Изолированные фрагменты растения (экспланты), помещаемые на питательную среду, легко поражаются микроорганизмами, поэтому их также необходимо стерилизовать. Предварительно часть растения, из которой будет извлечен эксплайт, промывают несколько раз водой очищенной. Затем растительный материал стерилизуют в растворах дезинфицирующих веществ, несколько раз промывают водой и стерильным скальпелем удаляют наружные поврежденные слои клеток. Небольшие кусочки эксплантанта помещают на поверхность питательной среда с гелеобразующим компонентом. Клетки, изолированных растительных тканей могут делится и давать начало длительно растущей недифференцированной массе, называемой каллусом.
В настоящее время изолированные клетки и ткани культивируют на многокомпонентных питательных средах, которые отличаются по своему составу в зависимости от вида культуры. В состав всех питательных сред обяхательно входят необходимые растению макроэлементы. Лучшей формой азотного питания являются нитраты (калия или аммония), в некоторых случаях дополнительно используются аминокислоты. Кроме азотистых соединений необходимы фосфор, сера, кальций, сульфаты. Отсутствие в питательной среде микроэлементов уже в первом пассаже (пересадке) может уменьшить интенсивность роста тканей на 30-40%, а при последующих — гибель тканей. В зависимости от вида изолированной культуры могут в небольших количествах использоваться: железо, бор, цинк, марганец, медь, алюминий, никель, йод и др.
Для успешного роста культур необходимы также источники углерода, поскольку даже зеленеющие, выращиваемые на свету ткани неаутоттрофны. Лучшим источником углеводного питания, является сахароза, используемая обычно в концентрации 2-5%. Реже используется глюкоза или другие сахара.
Большинство тканей, культивируемых in vitro, способны к синтезу всех нужных для их жизнедеятельности витаминов, если все питательные элементы присутствуют в средах. Однако большинство культур синтезируют витамины в субминимальных количествах, поэтому дополнительное внесение витаминов в среду также способствует росту клеток, особенно это относится к витаминам группы В. Чаще используют витамины В1, В2, B3, а также кальция пантотенат, биотин, кислоты: аскорбиновую, никотиновую, фолиевую.
Обязательными компонентами питательных сред должны быть фитогормоны. К ним относятся ауксины, регулирующие рост и дифференцировку клеток и цитокинины, индуцирующие клеточное деление. Природный ауксин в растении представлен в основном в виде β-индолил-3-уксусной кислоты (ИУК). Для практических целей чаще применяют не ИУК, а синтетические ауксины (α-нафтил-1-уксусная кислота (НУК), 2,4-дихлорфеноксиуксусная кислота (2,4-Д), фенилуксуснаяя кислота (ФУК), фенилмасляная кислота (ФМК) и др.) В отличие от природных ауксинов эти соединения не разрушаются ИУК-оксидазой в клетках растений.
В качестве источников цитокининов в средах используют кинетин, зеатин, 6-бензиламинопурин и др. Действие цитокининов проявляется прежде всего в ускорении клеточных делений, что опосредуется усилением синтеза ДНК, РНК, белков, а также в дифференцировке клеток. В состав некоторых сред входит ЭДТА (этилендиаминтетрауксусная кислота) или ее натриевая соль, которые улучшают усвоение клетками железа.
На рост и развитие растительных тканей и клеток in vitro большое влияние оказывают физические факторы: свет, температура, аэрация, влажность воздуха. Большинство изолированных культур выращиваются в темноте. При необходимости они могут расти и на свету, образовывая хлорофилл, но при этом проявляют низкую способность к фотосинтезу. В некоторых случаях свет может использоваться как фактор, обеспечивающий морфогенез или активизирующий процесс синтеза биологически активных веществ. Для освещения чаще используют люминесцентные лампы с интенсивностью светового потока 1000-1500 люкс. Оптимальная температура для успешного роста большинства культур составляет 25-27 °С, для индукции их морфогенеза требуются более низкие температуры (18-25 °С). Влажность в помещении, где растут культуры, должна составлять 60-70%. Интенсивная аэрация требуется при культивировании клеток в больших объемах с использованием жидких питательных сред. Аэрацию биомассы клеток осуществляют барботированием стерильным воздухом. При выращивании клеток в малых объемах (колбах) аэрация достигается постоянным перемешиванием суспензий клеток с помощью качалок различной конструкции.
10.3. Методы культивирования изолированных клеток и тканей
Твердофазный способ культивирования. Каллусные культуры
При этом способе культивирования используются так называемые твердые питательные среды, содержащие гелеобразующий компонент, чаще всего агар-агар как наиболее близкий по природе субстрат растительного происхождения. Такая среда имеет вид плотного геля, и каллусные клетки находятся на ее поверхности.
Для получения каллусных культур небольшие фрагменты тканей разных органов высших растений помещают на поверхность питательной среды (пробирки, колбы). Через 4-6 недель культивирования экспланта образуется первичный каллус (масса недифференцированных клеток), который необходимо разделить и перенести на свежую питательную среду. Каллусная ткань, выросшая на твердой питательной среде, имеет рыхлую аморфную структуру в виде массы тонкостенных клеток белого или желтоватого цвета. Качественный химический состав каллусной ткани обычно незначительно отличается от соответствующего интактного растения.
Твердофазный способ культивирования чаще используется в лабораторных условиях для первичного получения , изолированных растительных культур, предварительной оценки культур в качестве возможных продуцентов БАВ, а также для выращивания посевного материала. За 4-6 недель среда истощается, что определяет необходимость производить пересев. В противном случае ткани могут погибнуть.
Высшие растения состоят из множества дифференцированных клеток с различными функциями: клетки зеленой ткани листа создают органические вещества в результате фотосинтеза, клетки корня поглощают из почвы минеральные вещества и подают их в другие части растения и т.д. Но все дифференцированные клетки образовались от одной оплодотворенной яйцеклетки материнского растения — зиготы. Эта клетка содержит в себе всю генетическую основу целого растения. Из нее образуются специализированные ткани, различные по химизму происходящих в них процессов, форме и структуре. Клетка (зигота) является родоначальником целого растения, она тотипотентна, т.е. многофункциональна. Кроме зиготы тотипотентность в природных условиях могут проявлять и специализированные клетки. Пример тому — вегетативное размножение черенками, от листа и др. Тотипотентность реализуется также при травмах растений. На раневой поверхности в результате неорганизованной пролиферации клеток происходит образование нароста — каллуса, способствующего заживлению ран (от лат. callus — мозоль, толстая кожа).
При образовании каллуса в культуре in vitro происходит неорганизованный рост клеток и их дедифференциация, т.е. потеря первоначальных функций, свойственных ткани или органу, из которых был получен каллус. Клетки как бы обезличиваются, их функции практически одинаковы и существуют за счет питательной среды. Однако при изменении условий культивирования можно вызвать вторичную дифференциацию и получить целое растение. По сравнению с клетками животных и человека растительные клетки обладают большим преимуществом. Они способны в определенных условиях и на соответствующих питательных средах регенерировать целое растение. Решающую роль во вторичном образовании органов (корней и почек) из изолированных клеток и тканей играет соотношение фитогормонов (ауксинов и цитокининов) и их концентрация в питательной среде.
Как бы долго ни выращивались клетки в изолированной культуре, они твердо «помнят» свое происхождение: клетки моркови образуют зародыш целого растения моркови, клетки катарантуса розового — также соответствующее растение и т,д. Культивируемые ветки высших растений — это уникальная клеточная популяция, в которой каждая клетка представляет собой отдельный организм, способный к автономному развитию. При регулярном пассировании способность клеток к делению и росту может поддерживаться очень долго. Есть ткани, которые поддерживаются в культуре in vitro по 60-70 лет.
Глубинное суспензионное культивирование
Для посева в жидкую питательную среду необходимо получить посевной материал в виде суспензии клеток. Поэтому первичная калеточная ткань, которая используется в качестве посевного материала, должна быть более рыхлой и легко фрагментироваться на отдельные клетки. Для отделения крупных агрегатов клеточную массу перед пересевом фильтруют через нейлоновые или металлические сита. При пересевах на 100 мл среды используют 2-3 г свежей каллусной ткани.
В лабораторных условиях для культивирования тканей в жидких питательных средах обычно используют колбы емкостью 100-500 мл с небольшим объемом питательной среды. Сосуды с суспензией клеток помещают на качалки с частотой вращения 100-120 об/мин. В таких условиях обеспечивается аэрация тканей и нарастающая масса клеточных агрегатов распадается на отдельные фрагменты.
Необходимо отметить, что растительные клетки растут и размножаются значительно медленнее, чем клетки животных или микроорганизмов, время их удвоения составляет 1-3 суток. Поэтому при суспензионном культивировании стационарная фаза роста клеток, при которой культура достигает максимума сухой биомассы, наблюдается обычно через 2-3 недели. Истощение питательной среды и накопление продуктов жизнедеятельности клеток определяют необходимость обновления культуральной среды или пересева культуры на свежую питательную среду.
В промышленных условиях используется метод непрерывного культивирования к ферментерах (биореакторах) различной конструкции, имеющих конструктивные особенности, которые учитывают специфику растительных клеток. Метод основан на поддержании баланса между разбавлением среды и удалением части суспензии.
Если в культуральную систему периодически добавлять свежую среду, то деление клеток может поддерживаться неограниченно долго. Это послужило основой для создания систем, позволяющих осуществлять непрерывное культивирование.
Культуральные системы, функционирующие непрерывно, разделяют на полупроточные и проточные. При полупроточном режиме выращивания через определенные интервалы времени производится отбор части суспензий и разбавление оставшейся части суспензии свежей средой. Культивирование в ферментерах такого типа может продолжаться несколько месяцев.
Проточный режим культивирования позволяет осуществлять непрерывное снабжение культуральной системы свежей питательной средой и одновременным удалением равного объема клеточной суспензии. В таком режиме автоматизированные ферментеры могут функционировать в течение нескольких лет.
Глубинное культивирование в ферментерах имеет ряд преимуществ по срвнению с твердофазным статическим способом:— автоматически поддерживаются все необходимые параметры: температура, pH среды, степень аэрации, скорость работы мешалки и пр.;— постоянный, контроль содержания в культуральной среде основных элементов питания;— культуральная система периодически пополняется свежей питательной средой,— постоянно осуществляется микробиологический контроль с целью предотвращения инфицирования и гибели культур;— контроль активности роста и деления клеток;— контроль образования БАВ.
Необходимо отметить, что для получения БАВ может использоваться не только биомасса клеток, но и культуральная среда. В некоторых случаях получаются штаммы и клеточные линии, почти полностью выделяющие БАВ в культуральную среду, что значительно облегчает процесс их выделения из такого специфического вида сырья.
Культура протопластов
Протопласт — это клетка, лишенная оболочки. Такая «голая» клетка потенциально способна восстанавливать новую оболочку, делиться, образовывать клеточные агрегаты, из которых можно получить клеточную культуру с новыми свойствами, а затем новое растение — регенерант. Отсутствие клеточной стенки облегчает проведение различных генетических манипуляций, связанных с реконструированием генома, а также дает возможность получать популяции гибридных клеток в результате слияния протопластов.
Существует два способа разрушения клеточной оболочки — механический и ферментативный. Последний менее травматичен для клеток и чаще используется. Для получения протопластов растительный материал (например, суспензия клеток мезофилла листа или суспензия культуры изолированных клеток) обрабатывается препаратами пектиназ и целлюлаз или более сложными смесями ферментов. Для получения суспензии клеток целого растения предпочтительнее использовать листья стерильных растений, культивируемых in vitro, поскольку при получении «голых» протопластов также необходимо соблюдать стерильность.
После разрушения клеточных стенок суспензию протопластов очищают от остатков клеток и тканей фильтрованием, смесь ферментов удаляют центрифугированием с последующим промыванием в культуральной среде. После очистки протопласты ресуспендируют в питательной (культуральной) среде. Изолированные протопласты широко используются в качестве модельных систем в физиологических, цитологических, фитопатологических и других экспериментах, а также генно-инженерных манипуляциях.
В настоящее время разработаны способы получения новых гибридов в результате слияния изолированных протопластов различных растений. Поскольку поверхности протопластов имеют отрицательный заряд, то для их соединения необходимо его нейтрализовать. Для индукции слияния протопласты обрабатывают полиэтиленгликолем. Частота слияния протопластов может быть увеличена добавлением декстрана, поливинола или под влиянием электрического поля. После слияния происходит регенерация кяеточной стенки, она образуется менее чем за сутки, после чего клетки начинают делиться. При слиянии протопластов разных родительских растений образуются новые клетки, из которых через культуру каллуса можно регенерировать новое растение с заданными свойствами.
В результате слияния протопластов возникают два вша новых клеток:— гомокарионы (гомокариоциды), состоящие из клеток одного родителя;— гетерокарионы (гетерокариоциды), состоящие из клеток обоих родителей.
Больший представляют гетерокарйоны, которые после слияния отбирают микроскопически. Для отбора исходные протопласты окрашивают флуоресцентными красителями различных цветов. Если происходит слияние протопластов мезофилла листа (зеленые) и культуры изолированных клеток (бесцветные), то получаются гетерокарионы, состоящие из бесхлорофилльных и хлорофиллосодержащих зон, что позволяет вести отбор без предварительного окрашивания.
В результате объединения растительных геномов (ядер и цитоплазмы) формируются новые комбинации генов, которые практически невозможно получить обычными методами селекции. Метод позволяет скрещивать представителей разных видов и родов растений и широко используется при выведении новых сортов пищевых, декоративных, технических, а также лекарственных растений.
Слиянием протопластов получен гибрид томата и картофеля — «томофель», гибриды некоторых лекарственных растений: дурмана индийского и белладонны, скополии гималайской и белладонны, гибрид двух видов дурмана, содержащий на 25% больше тропановых алкалоидов, чем родительское растение.
Микроклональное размножение (культура органов растений)
Культуры клеток и тканей для массового размножения растений и оздоровления посадочного материала, в том числе лекарственных растений, нашли широкое применение в растениеводстве. Этот метод, названный микроклональным размножением, позволяет от одной меристемы получить (регенерировать) достаточно большое количество Новых растений, в том числе и в культуре in vitro.
Обязательным условием для микроклонального размножения является идентичность полученного растительного материала исходному материнскому растению. Для обеспечения максимальной генетической стабильности клонируемого материала в качестве исходного экспланта используют молодые слабодифференцированные ткани, в частности кончики молодых стеблей и корней, пазушные почки, зародыши, части молодых проростков и другие меристематические ткани. Культуры клеток, полученные из меристематических тканей, дают возможность получить безвирусные клоны. Распределение вирусов в различных частях растения неравномерное, а меристема, как правило, их лишена. Восстановление целого растения с помощью изолированных культур может происходить разными путями.
Прямая регенерация — это получение растений «в пробирке» непосредственно из верхушечных побегов, пазушных почек и т.д.
Косвенная регенерация — получение целых растений из меристематических тканей, но с промежуточной стадией каллуса. В обоих случаях дифференциация и органогенез управляется фитогормонами. Выросшее в пробирке переносится в грунт.
Следует подчеркнуть, что такой своеобразный способ вегетативного размножения основан на свойстве тотипотентности растительных ниток, это по сути — клонирование растений. В отличие от клонирования животных, которое очень активно обсуждается лишь последнее десятилетие, метод микроклонального размножения, растений используется уже более 40 лет. Впервые этот метод успешно применил французский исследователь Ж. Морель в 1960 г. для размножения орхидеи. Из одного безвирусного экспланта ему удалось в течение года получить около 4 млн. новых растений, свободных от вирусной инфекции. Метод клонального микроразмножения может использоваться для создания элитного и суперэлитного посадочного материала.
Основное преимущество метода микроклонального размножения, по сравнению с другими классическими методами — это значительно более высокий коэффициент размножения. Если обычным способом (черенками, луковицами, корневищами и т.д.) от одного растения можно получить от 2-3 до 100 растений в год, то методом микроклонального размножения их число можно увеличить от нескольких тысяч до миллиона.
К настоящему времени показана возможность клонировать «в пробирке» около тысячи видов растений, более чем у ста видов этот метод имеет коммерческое значение. Среди них — декоративные, плодово-ягодные, овощные, древесные, а также некоторые лекарственные растения.
Метод культуры тканей и клеток успешно используется для выведения новых сортов, в том числе и высокопродуктивных лекарственных растнеий. Для создания нового сорта классическим способом в грунте требовалось 10-30 лет. Благодаря методу культуры тканей этот период можно сократить до нескольких месяцев, поскольку сезонность значения не имеет.
10.4. Культура растительных клеток как источник лекарственных веществ
Природные запасы лекарственных растений уменьшаются, а синтез БАВ либо не осуществлен, либо нерентабелен. Поэтому технология получения биомассы на основе культуры клеток приобретает большое значение для производства лекарственных средств.
Преимущества использования клеточных культур заключаются в следующем:— решается проблема дефицита исходного сырья, особенно ценных исчезающих видов, не поддающихся плантационному культивированию;— возможно получение фитомассы, полностью свободной от гербицидов, пестицидов, тяжелых металлов и др.;— имеется возможность получения новых веществ, не синтезируемых соответствующим целевым растением;— возможно управление биосинтезом целевых продуктов за счет условий культивирования, состава питательной среды и другими способами;— имеется возможность индустриализации и удешевления производства некоторых БАВ, синтез которых пока не разработан или очень дорог.
Вместе с тем, развитие производства БАВ из изолированных клеточных культур в промышленных масштабах сдерживается рядом причин. Некоторые культуры изолированных клеток и тканей либо не синтезируют БАВ, характерные для соответствующего целого растения, либо вырабатывают их значительно меньше. В сравнении с микроорганизмами растительные клетки растут значительно медленнее, время их удвоения в среднем в 20 раз больше, чем клеток микроорганизмов. Вследствие длительности производства высок риск инфекций и гибели культур. Кроме того, большие объемы суспензионных культур растительных клеток состоят как из единичных клеток, так и агрегатов различного размера, которые не идентичны, что усложняет процесс производства БАВ. Вторичные метаболиты многих растительных культур не выделяются в питательную среду, что создает трудности их экстрагирования. Из-за больших размеров растительные клетки очень чувствительны к перемешиванию и снабжению кислородом. Себестоимость производства лекарственных средств на основе культуры изолированных растительных клеток достаточно высока. Промышленный выпуск такой продукции рентабелен лишь для особо ценных БАВ, стоимость которых на мировом рынке очень высока, сырье мало доступно, синтез пока не осуществлен и продуктивность культур достаточно высока.
В настоящее время получено более 30 видов различных изолированных клеточных культур лекарственных растений, продуцирующих БАВ на уровне соответствующего интактного растения, либо в большем количестве.
Первый отечественный биопродукт из культуры изолированных клеток — настойка «Биоженьшень» — разработан в лаборатории культуры тканей Института физиологии растений РАН, под руководством Р.Г. Бутенко. Препарат получен на основе высокопродуктивного клеточного штамма культуры клеток женьшеня и используется для изготовления лосьонов, кремов, а также тонизирующих напитков. Комплекс гинзенозидов (сапонинов женьшеня), выделяемый из культуры тканей, предлагается в качестве противоэпилептического средства.
Культивируемые in vitro клетки раувольфии змеиной являются перспективным источником гипотензивных и противоаритмических индольных алкалоидов. Методами клеточной селекции с использованием химических мутагенов и оптимизации условий выращивания получен высокопродуктивный штамм, накапливающий противоаритмический алкалоид аймалин, содержание которого составляет около 50% от суммы алкалоидов, синтезируемых культурой.
Получены изолированные клеточные культуры из различных видов барбариса, а также василисника малого. Суспензионная клеточная культура василисника малого продуцирует берберин — растительный антибиотик и противоопухолевое средство, при этом более 80% синтезируемых тканями алкалоидов секретируются в культуральную жидкость. В Японии налажено биотехнологическое производство противоопухолевого алкалоида берберина из культуры клеток коптиса японского, а также производство нафтохинонового пигмента шиконина — природного антибиотика широкого спектра действия из культуры клеток воробейника. На основе шиконина российские ученые разработали мазь «Эритромин», которая обладает антимикробной активностью в отношении антибиотико-резистентных микроорганизмов, многих патогенных бактерий, а также грибов.
Перспектива использования культуры тканей тиса обыкновенного связана с возможностью получения таксола — вещества, обладающего противоопухолевой активностью. Для лечения одного больного в течение года требуется 120-130 г сухой коры нативного растения, сырьевые запасы которого истощаются. Национальный институт рака США выделил около 1 млн. долларов для разработки экономически целесообразного способа получения таксола из культуры клеток.
Активно продолжаются работы с культурой клеток барвинка розового, продуцирующего противораковые алкалоиды. Стоимость субстанции винкристина на мировом рынке достигает 30 тыс. долларов за 1 кг, винбластина — около 20 тыс. за кг.
В Германии разработали способ получения кислоты розмариновой из культуры клеток каллуса. Кислота розмариновая — вещество, обладающее противоопухолевой активностью, и природный антибиотик широкого спектра действия. Из культуры клеток табака получен убихинон 10. На основе убихинона получают препарат для лечения инсультов и купирования спаечных процессов.
farmf.ru
Общая характеристика питательных сред
Биология Общая характеристика питательных сред
просмотров - 259
Питание культивируемых клеток.
Лекция 3
Цель:изучить особенности питания растительных клеток, раскрыть факторы культивирования, обратить внимание на значение компонентов питательной среды, их концентрация, соотношение, рассмотреть влияние фитогормонов на образование каллуса.
План лекции:
1. Выбор питательной среды. Оптимизация состава среды.
2. Химические факторы культивирования. Основные компоненты питательной среды.
1 Культура клеток требует стерильности самих культивируемых эксплантов, питательных сред, посуды, инструментов и лабораторию помещения. Лучше всего работу по выделению тканей из растений и их высадку на питательную среду проводить в ламинарном боксе. Из простерилизованных различными способами и тщательно промытых в стерильной дистиллированной воде объектов изолируют нужные ткани и помещают их на предварительно проавтоклавированную питательную среду (твердую агаризованную или жидкую).Возможно культивирование любых тканей и органов растений. Успех в культивировании клеток, тканей и органов прежде всего определяется составом питательной среды. Культура клеток каждого вида растений и даже разных органов и тканей одного и того же вида требует питательной среды определенного состава. Более
того, для инициации каллуса, поддержания его роста͵ для индукции органоге-
неза нужно в каждом из этих случаев изменять состав среды. Почти любой исследователь пытается разработать оптимальную среду для своего объекта͵ в связи с этим количество рецептов питательных сред с каждым годом все возрастает.
Выбор питательной среды определяется видом растения, ĸᴏᴛᴏᴩᴏᴇ вводится в культуру, а также задачами эксперимента. В случае если в литературе не имеется крайне важной информации, работу начинают с применения таких широко используемых сред, как среда Мурасиге-Скуга, Шенка-Хильдебрандта͵ Гамборга Эвелага (В5), Блейдза, Уайта͵ Нича и Нич, Лисмайера-Скуга, а затем подбирают концентрации регуляторов роста и органических добавок. Перечисленные среды оказались эффективными для культивирования in vitro различных видов как однодольных, так и двудольных растений.
Сегодня некоторые фирмы выпускают готовые среды МС, Уайта͵ Хеллера в виде сухих порошков, содержащих все необходимые компоненты – за исключением регуляторов роста͵ сахарозы, агара. При этом их применение ограниченно для исследования, в которых крайне важно варьирование компонентов среды. Обычно, начиная работать с новым объектом, авторы модифицируют состав стандартных сред, особенно часто изменяя концентрацию и набор органических компонентов. Оптимизацию состава среды по многим компонентам целесообразно проводить с применением метода математического планирования эксперимента. Основным преимуществом метода математического планирования по сравнению с классическими методами исследований является возможность одновременного изучения большого числа факторов, действующих в системе. Это позволяет наряду с количественным учетом влияния каждого отдельного фактора установить наличие в системе межфакторных взаимодействий и оценить эффекты последних. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, метод математического планирования дает ответ не только на вопрос о том, какие компоненты питательной среды оказывают положительное влияние, но и показывает оптимальные соотношения этих компонентов.
2 Изолированные клетки и ткани культивируют на многокомпонентных питательных средах. Οʜᴎ могут существенно различаться по своему составу, однако, в состав всех сред обязательно входят необходимые растениям макро- и микроэлементы, углеводы, витамины, регуляторы роста͵ аминокислоты. Клетки в культуре нуждаются в углеводах, потому что в этих условиях они питаются гетеротрофно. Источник углерода вводится в состав среды в виде сахарозы или глюкозы, обычно в концентрации 20-40 г/л (2-3 %). Другие углеводы хотя и используются для некоторых видов растений в культуре, в целом являются менее пригодными. В качестве источников углерода были также испытаны некоторые органические кислоты и спирты, которые однако уступали углеводам. Углеводы необходимы в качестве питательного компонента͵ так как большинство каллусных тканей лишено хлорофилла и не способны к автотрофному питанию. По этой причине их выращивают в условиях рассеянного освещения или в темноте.
Основой всех питательных сред для выращивания изолированных тканей растений является смесь минеральных солей, представленных как макро- так и микроэлементами. Азот входит в среды в виде нитратной или аммонийной соли, фосфор – в виде фосфата͵ сера – в виде сульфата͵ железо вводится в виде неорганических солей и солей органических кислот и в форме хелата. Последний обеспечивает доступность железа при рН до 8,0 в течение всего периода роста культуры. В отсутствие хелатирующего агента недостаток железа может возникнуть очень быстро. Все среды содержат также ионы Ca2+, K+, Mg2+. Почти все среды содержат ряд микроэлементов: B, Mn, I, Cu, Zn, Mo, Co.
В состав некоторых сред входит ЭДТА (этилендиаминтетрауксусная кис-лота) или ее натриевая соль, которые улучшают доступность железа для клеток.
В состав большинства сред входят витамины. Особенно важны витамины группы В: тиамин (В1), рибовлафин (В2), пиридоксин (В6). Многие культуры нуждаются также в никотиновой, фолиевой, пантотеновой кислотах, мезоинозите. Хотя большинство тканей в культуре способно к биосинтезу витаминов, но этого количества оказывается недостаточно для выполнения метаболических функций. По этой причине дополнительное внесение витаминов в питательную среду стимулирует рост тканей. Необходимым компонентом любой питательной среды являются фитогормоны – соединения, которые принимают участие в регуляции физиологических процессов у растений. Для роста и дифференциации растительных клеток необходимы ауксины и цитокинины. Ауксины – гормоны растений, производные индола. Образуются в апикальных меристемах и стимулируют клеточное растяжение.
Цитокинины – гормоны растений, производные 6-аминопурина. Индуцируют в присутствии ауксина деление клеток и дифференцировку каллуса. Следовательно, ауксины вызывают дифференцировку клеток экспланта͵ и цитокинины индуцируют клеточные деления. Только культура тканей опухолей и культура «привыкших» тканей способны расти на средах без регуляторов роста. В качестве ауксинов для получения каллуса и его поддержания используются: b-индолилуксусная кислота (ИУК), a-нафтилуксусная кислота (НУК), 2,4 –дихлорфеноксиуксусная кислота (2,4-Д). Природный ауксин ИУК легко окисляется в клетках, в связи с этим ее вводят в среду в больших количествах и, кроме того, редко добавляют в среду в качестве единственного ауксина для того, чтобы вызвать образование каллуса, обычно используют более высокие концентрации ауксинов, чем для его последующего роста. Наиболее выраженный эффект ауксина проявляется в стимуляции роста. Ауксин играет важную роль в процессах регенерации при размножении каллусных клеток; в процессе образования придаточных и боковых корней, луковиц, при заложении вегетативных почек. Для практических целей в сельском хозяйстве часто применяют не ИУК, а синтетические ауксины, так как они в растениях не разрушаются ИУК-окси-дазой. Молекулы синтетических ауксинов имеют разную структуру, они содержат ароматическое или гетероциклическое кольцо, боковая часть которого представлена остатком алифатической кислоты. Это –индолил-3-масля-ная кислота (ИМК), a-нафтил-1-уксусная кислота (НУК), 2,4 –дихлорфеноксиуксусная кислота (2,4 -Д), фенилуксусная кислота (ФУК), фенилмасляная (ФМК).
2,4-Д применяют для индукции каллуса у злаков, бобовых, томатов, для роста суспензионных культур, в сочетании с другими фитогормонами для формирования у протопластов клеточной стенки.
ИУК, ИМК, НУК, ФУК И ФМК применяют в качестве индукторов образования корней, а в сочетании с цитокининами эти фитогормоны бывают использованы для развития проростков при культивировании изолированных зародышей.
ИУК необходима для индуцирования каллусогенеза.
В качестве источников цитокининов в искусственных питательных средах используют кинетин (6-фурфуриламинопурин), 6-бензиламинопурин, зеатин, которые представляют собой N-замещенные производные аденина.
Действие цитокининов проявляется прежде всего в ускорении клеточных делений, что опосредуется усилением синтеза ДНК и РНК и белков. Благодаря этому замедляется старение клеток и повышается их устойчивость к неблагоприятным условиям среды.
Кинетин (6-фурфуриламинопурин) вводится в среду как обязательный компонент для индукции деления клеток. Некоторые другие адениновые производные бывают более активны, к примеру природный цитокинин – зеатин. При этом это очень дорогой и дефицитный фитогормон, к тому же он термолабилен, в связи с этим его нельзя автоклавировать. Другой цитокинин - ϶ᴛᴏ широко применяемый 6-бензиламинопурин (БАП), который активнее кинетина на много порядков.
Гиббереллины оказывают множественные действия: стимулируют рост в фазе растяжения и деления клеток (к примеру, камбия), вызывают рост плодов. Важное свойство гиббереллинов – вызвать вытягивание стебля у розеточных растений или у растений с укороченным стеблем, ᴛ.ᴇ. устранять физиологическую и генетическую карликовость.
Для практических целей наиболее часто используют гибберелловую кислоту, которая производится в промышленности. Обработка гибберелловой кислотой семян и клубней приводит к снятию у них покоя и стимулирует быстрое прорастание. Для образования первичного каллуса и реже с целью поддержания его роста в питательную среду вносят комплексные органические добавки. Это бывают различные экстракты (солодовый экстракт, дрожжевой экстракт, картофельный, вытяжки из разных органов растений, из опухолевых тканей), соки (березовый, томатный, апельсиновый), незрелые эндоспермы кокосового ореха, кукурузы, других злаков, гидролизат казеина, смесь аминокислот. Небольшим стимулирующим действием обладают незрелые эндоспермы ряда растений, особенно кокосового ореха, так называемое кокосовое молоко. Это связано с особой ролью эндосперма, который служит питательным субстратом и источником гормонов для развивающего зародыша. При этом в последнее время
таких добавок стараются избегать в связи с трудностями воспроизведения результатов и наличия в них неизвестных факторов роста.
Важное значение для нормального роста и развития растений in vitro как на агаризованных, так и в жидких средах имеет ее рН. В нативных (врожденных, естественных) условиях растительная клетка функционирует в узких границах концентрации водородных ионов. От величины рН зависит структура и активность макромолекул, прежде всего белков-ферментов в самой ткани. Вместе с тем, рН влияет на устойчивость и усвояемость компонентов питательной среды, в первую очередь регуляторов роста и витаминов. При низких рН не желатинизируется агар, в связи с этим рН питательных растворов обязательно доводится до требуемого уровня путем добавления щелочей и кислот.
Оптимальный рост культуры клеток растений обычно происходит на среде с начальными значениями рН от 5 до 6. Среды, содержащие такие неопределенные органические компоненты, как гидролизат казеина и дрожжевой экстракт, обычно хорошо забуферены, в связи с этим рН среды в процессе роста культуры меняется слабо. В средах без этих веществ сдвиги рН в ходе культивирования бывают весьма значительными. Особенно важно учитывать это обстоятельство для суспензионной культуры клеток.
В качестве гелеобразующего вещества для приготовления твердых питательных сред используется агар-агар. Агар – полисахарид, содержащий целый ряд примесей, в связи с этим его промывают проточной водой в течение 4-6 часов. Содержание агара в питательных средах колеблется в зависимости от требований культивируемой ткани. Первые успешные результаты по культивированию тканей растений были получены именно на агаризованных средах в 30-х годах нашего века Р. Готре во Франции и Ф.Уайтом в США.
Каллусные ткани можно выращивать сколько угодно долго, если пересаживать их через каждые 3-4 недели на свежую питательную среду. Именно в такой длительной пересадочной культуре выращиваются клетки и каллусные ткани. И сейчас в некоторых лабораториях мира сохраняются штаммы клеток, полученные в 1938 году из корнеплода моркови Р.Готре.
В таблице 1 приведены составы различных сред. Эти среды оказались эффективными для культивирования in vitro различных видов как однодольных, так и двудольных растений. Сложные добавки (к примеру, кокосовое молоко) и регуляторы роста͵ используемые с этими средами, не приведены в таблице.
Сегодня некоторые фирмы выпускают готовые питательные среды Мурасиге-Скуга, Уайта͵ Хеллера в виде сухих порошков, содержащих все необходимые компоненты – за исключением регуляторов роста͵ сахарозы и агара. При этом их применение ограничено для исследований, в которых крайне важно варьирование компонентов среды. Обычно, начиная работать с новым объектом, авторы модифицируют состав стандартных сред, особенно часто изменяя концентрацию и набор органических компонентов.
Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, питательные среды для культивирования клеток имеют сложный состав: макро- и микроэлементы, углеводы, витамины, аминокислоты, фитогормоны. При соблюдении условий стерильности успех в культивировании клеток определяется прежде всего составом питательной среды. Изменяя состав питательной среды, можно индуцировать морфогенез и вырастить растение-регенерант. Внешними факторами, влияющими на культивирование клеток, являются температура, свет, осмотическое давление, аэрация.
oplib.ru
Питательные среды для культивирования клеток и тканей.
В отличие от культивирования одноклеточных микроорганизмов, культивирование клеток и тканей требует для своего нормального протекания значительно более сложные по составу питательные среды. Общее число компонентов может варьироваться от нескольких десятков, до нескольких сотен. Помимо углеводов (глюкоза, сахароза) в их число входят различные соли (источники азота, фосфора, микроэлементов), различные аминокислоты, витамины, антибиотики (для поддержания стерильности). В средах для культивирования клеток растений обязательно присутствие различных фитогормонов и факторов роста. Среды для культивирования клеток животных и человека требуют добавки эмбриональной сыворотки, получаемой от эмбрионов или новорожденных телят. Из сыворотки выделено более 30 компонентов (факторов) в основном белковой природы, необходимых для поддержания нормального клеточного роста, и в частности прикрепления клеток к поверхности, однако вопрос о количестве и природе этих факторов до настоящего времени окончательно не решен.
Варьируя в ростовой и продукционной стадиях (трофофазе и идиофазе) состав питательной среды, в частности соотношение легкоусваиваемых (глюкоза) и трудноусваиваемых углеводов (сахароза), добавляя на определенных этапах культивирования различные вещества (индукторы, стрессовые факторы), можно существенно повысить выход целевых продуктов-метаболитов или вызвать синтез веществ, образование которых в нормальных условиях не происходит. Так для многих культур растительных клеток было показано, что увеличение в продукционной стадии концентрации основного питательного компонента – сахарозы в несколько раз вызывает значительное увеличение выхода целевого вторичного метаболита, т.е. сахароза выступает в роли индуктора. Положительное влияние на выход вторичных метаболитов оказывает и изменение соотношения количеств источников азота и фосфора (солей) и других микроэлементов в ростовых и продукционных питательных средах.

Асептика
Культуры животных и растительных клеток предъявляют очень высокие требования к стерильности питательных сред и наличию в них различных токсичных веществ.
“Дикие” микроорганизмы, которые могут попасть в такую “богатую”питательную среду очень быстро вытеснят растительные или животные клетки, кроме того, токсины, которые они выделяют, могут ингибировать рост клеток или вызывать гибель культуры. Поэтому при всех манипуляциях с клетками и тканями при культивировании in vitro соблюдают определенные правила асептики в ламинар - боксе или в асептических комнатах. В первом случае асептика достигается подачей профильтрованного стерильного воздуха, направленного из ламинкар-бокса наружу, на работающего. Асептические комнаты стерилизуют с помощью ультрафиолетовых ламп, а работают в таких помещениях в стерильной одежде. Рабочую поверхность столов в асептических комнатах и инструменты перед работой дополнительно стерилизуют спиртом.
Чистую посуду, предварительно завернутую в бумагу или в фольгу, инструменты, бумагу, вату стерилизуют сухим жаром в сушильном шкафу при температуре 160°С в течение 1,5 - 2 ч. Питательные среды стерилизуют в автоклаве при температуре 120 °С и повышенном давлении в течение 15 - 20 мин. Если в состав питательных сред входят вещества, разрушающиеся при автоклавировании, их следует стерилизовать путем фильтрации через бактериальный фильтр. Затем стерильные профильтрованные компоненты добавляют в проавтоклавированную среду, охлажденную до температуры 40 "С.
Клетки в культуре требуют отсутствия в ростовой среде любых токсических веществ. Вода, используемая для приготовления относительно небольших объемов питательных сред, должна быть вначале деионизирована, а затем перегнана в стеклянной посуде. Хранить такую воду следует в стеклянной или пластиковой посуде. В связи с потребностью для культивирования клеток больших количеств воды высокой степени чистоты разработаны высокоэффективные технологические процессы получения очищенной воды методами обессоливания, такими, как ультрафильтрация, ионный обмен, обратный осмос, электролиз. Для культур клеток используется высокоочищенная вода, обычно получаемая комбинацией нескольких методов, например, электродиализа и ионного обмена, ионирования и дистилляции. Большое распространение получили мембранные методы очистки воды, которые отличаются высокой эффективностью и экономичностью. Так компактные уста-новки Ulttipoie, (США) обеспечивают полную очистку воды и постоянный контроль за ее качеством.
Антибиотики вводятся в состав питательных сред для подавления бактериальной инфекции. Однако, использование антибиотиков при культивировании клеток целесообразно только в случае кратковременных культур, а постоянное пассирование (пересев) клеточных линий должно проводиться в отсутствие антибиотиков, чтобы не способствовать отбору устойчивых к антибиотикам штаммов бактерий.
Растительные ткани сами по себе могут служить серьезным источником заражения, так как на их поверхности всегда находится эпифитная микрофлора. Поэтому необходима поверхностная стерилизация, которую проводят следующим образом. Предварительно часть растения, из которой будет извлечен эксплант (образец ткани для культивирования), промывают водой с мылом и споласкивают чистой водой. Затем растительный материал стерилизуют в растворах дезинфицирующих веществ. После выдерживания эксплантов в дезинфицирующем растворе их несколько раз промывают в дистиллированной воде и скальпелем удаляют наружный слой клеток на срезах эксплантов, так как он может быть поврежден при стерилизации.
Микроорганизмы могут находиться и внутри растительной ткани. Наиболее часто внутреннее инфицирование встречается у тропических и субтропических растений. Поэтому кроме поверхностной стерилизации иногда приходится применять антибиотики, которые и убивают микробную флору внутри ткани. Следует, однако, заметить, что подобная обработка не всегда приводит к стерилизации внутренних тканей, так как трудно выбрать направленно действующий антибиотик.
Похожие статьи:
poznayka.org
История изучения культуры клеток и тканей
Клеточная инженерия — одно из наиболее важных направлений в биотехнологии. Она основана на использовании принципиально нового объекта — изолированной культуры клеток или тканей эукариотических организмов, а также на тотипотентности — уникальном свойстве растительных клеток воспроизводить целый организм. Применение этого объекта раскрыло большие возможности в решении глобальных теоретических и практических задач. В области фундаментальных наук стало осуществимым исследование таких сложных проблем, как взаимодействие клеток в тканях, клеточная дифференцировка, морфогенез, реализация тотипотентности клеток, механизмы появления раковых клеток и др. При решении практических задач основное внимание уделяется вопросам селекции, получения значительных количеств биологически ценных метаболитов растительного происхождения, в частности более дешевых лекарств, а также выращивания оздоровленных безвирусных растений, их клонального размножения.
Бурное развитие клеточной инженерии приходится на 50-е годы прошлого века, хотя первые попытки выращивания изолированных кусочков ткани были сделаны гораздо раньше. В конце XIX — начале XX в. немецкие ученые X. Фехтинг (1892), С. Рехингер (1893), Дж. Хаберландт (1902) сделали первую неудачную попытку стимуляции роста растительных тканей и органов, помещенных на фильтровальную бумагу, пропитанную сахарозой. Несмотря на отсутствие положительного результата, их работы представляют большой интерес. В них были высказаны идеи, которые намного опередили развитие науки того времени и которые нашли свое подтверждение несколько десятилетий спустя. Так, Фехтинг предположил, что полярность присуща не только организму или органу растения, но и самой клетке. Рехингер определил минимальный размер сегмента, образующего каллус. Согласно его исследованиям, в кусочках ткани тоньше 1,5 — 2,0 мм клетки не делились. Хаберландт впервые четко сформулировал идеи о возможности культивирования in vitro изолированных клеток растений и о тотипотентности клеток, т. е. способности каждой растительной клетки давать начало целому организму.
Первые успехи были получены в 1922 г. американским ученым В. Роббинсом и немецким ученым В. Котте. Независимо друг от друга они показали возможность выращивания меристем кончиков корней томатов и кукурузы на синтетической питательной среде. Считается, что их работы легли в основу метода культуры изолированных корней растения.
Настоящее развитие метода культуры тканей и клеток высших растений началось в 1932 г. с работ французского ученого Р. Готре и американского исследователя Ф. Уайта. Они показали, что при периодической пересадке на свежую питательную среду кончики корней могут расти неограниченно долго. Кроме того, ими были разработаны методы культивирования новых объектов: тканей древесных растений камбиального происхождения, каллусных тканей запасающей паренхимы (Р. Готре), а также тканей растительных опухолей (Ф. Уайт). С этого момента начинаются массовые исследования по разработке новых питательных сред, включающих даже такие неконтролируемые компоненты, как березовый сок или эндосперм кокоса, и по введению в культуру новых объектов. К 1959 г. насчитывалось уже 142 вида высших растений, выращиваемых в стерильной культуре.
В 1955 г. после открытия Ф. Скугом и С. Миллером нового класса фитогормонов — цитокининов — оказалось, что при совместном их действии с другим классом фитогормонов — ауксинами — появилась возможность стимулировать деление клеток, поддерживать рост каллусной ткани, индуцировать морфогенез в контролируемых условиях.
В 1959 г. был предложен метод выращивания больших масс клеточных суспензий. Важным событием стала разработка Е. Коккингом (Ноттингемский университет, Великобритания) в 1960 г. метода получения изолированных протопластов. Это послужило толчком к получению соматических гибридов, введению в протопласты вирусных РНК, клеточных органелл, клеток прокариот. В это же время Дж. Морелом и Р. Г. Бутенко был предложен метод клонального микроразмножения, который сразу же нашел широкое практическое применение. Весьма важным достижением в развитии технологий культивирования изолированных тканей и клеток стало культивирование одиночной клетки с помощью ткани-«няньки». Этот метод был разработан в России в 1969 г. в Институте физиологии растений им. К. А. Тимирязева РАН под руководством Р. Г. Бутенко. В последние десятилетия продолжается быстрый прогресс технологий клеточной инженерии, позволяющих значительно облегчить селекционную работу. Большие успехи достигнуты в развитии методов получения трансгенных растений, технологий использования изолированных тканей и клеток травянистых растений, начато культивирование тканей древесных растений.
Методы и условия культивирования изолированных тканей и клеток организмов
Выращивание изолированных клеток и тканей на искусственных питательных средах в стерильных условиях (in vitro) получило название метода культуры изолированных тканей.
В связи с тем, что в жизни человека наибольшее значение имеют семенные растения, методы и условия для их культивирования разработаны лучше, чем для голосеменных растений или водорослей, выращивание которых в стерильных условиях вызывает определенные затруднения. Однако, независимо от принадлежности растений к той или иной таксономической группе, существуют общие требования к выращиванию объектов в культуре in vitro.
Асептика. Прежде всего, культивирование фрагментов ткани или органа растения — эксплантов, а тем более отдельных клеток требует соблюдения полной асептики. Микроорганизмы, которые могут попасть в питательную среду, выделяют токсины, ингибирующие рост клеток и приводящие культуру к гибели, поэтому при всех манипуляциях с клетками и тканями при культивировании in vitro соблюдают определенные правила асептики.
Питательные среды. Изолированные клетки и ткани культивируют на многокомпонентных питательных средах. Они могут существенно различаться по своему составу, однако, в состав всех сред обязательно входят необходимые растениям макро- и микроэлементы, углеводы, витамины, фитогормоны и их синтетические аналоги. Углеводы (обычно это сахароза или глюкоза) входят в состав любой питательной смеси в концентрации 2—3%. Они необходимы в качестве питательного компонента, так как большинство каллусных тканей лишено хлорофилла и не способно к автотрофному питанию. Поэтому их выращивают в условиях рассеянного освещения или в темноте. Обязательными компонентами питательных сред должны быть ауксины, вызывающие дедифференцировку клеток экспланта, и цитокинины, индуцирующие клеточные деления. При изменении соотношения между этими фитогормонами или при добавлении других фитогормонов могут быть вызваны разные типы морфогенеза.
Физические факторы. На рост и развитие растительных тканей in vitro большое влияние оказывают физические факторы — свет, температура, аэрация, влажность. Большинство каллусных тканей могут расти в условиях слабого освещения или в темноте, так как они не способны фотосинтезировать. Вместе с тем свет может выступать как фактор, обеспечивающий морфогенез и активирующий процессы вторичного синтеза. Для большинства каллусных культур оптимальна температура 26 °С. Для выращивания суспензионных культур большое значение имеет аэрация. Особенно важно снабжение воздухом культивируемых клеток в больших объемах ферментеров. Оптимальная влажность в помещении, где растут культуры, должна составлять 60—70%. Таким образом, культивирование клеток и тканей зависит от многих факторов внешней среды, и действие их не всегда хорошо известно. Поэтому при введении в культуру нового вида растений необходимо прежде всего тщательно изучить влияние физических факторов на рост и физиологические характеристики этой культуры.
Дифференцировка каллусных тканей
Одна из наиболее интересных, но сложных проблем в биологии — развитие многоклеточных организмов. Изучение данного вопроса возможно несколькими путями. Так, большое распространение получило моделирование процессов онтогенеза на более простых системах. При этом используют изолированные ткани, клетки, протопласты, культивируемые в стерильных условиях. Преимущество этого процесса состоит в том, что нет необходимости постоянно учитывать результаты взаимодействия органов в целостной системе растительного организма. Кроме того, экспериментатор сам имеет возможность выбирать, изменять и повторять условия опыта в соответствии с поставленной задачей. После завершения дедифференцировки дальнейшее развитие каллусной клетки может идти в нескольких направлениях. Во-первых, это вторичная дифференцировка разной степени сложности. Во-вторых, в клетке может сформироваться состояние стойкой дедифференцировки («привыкание»), а следовательно, способность расти на безгормональной среде. В-третьих, каллусная клетка проходит свой цикл развития, завершающийся ее старением и отмиранием. В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток. Вторичная дифференцировка каллусной клетки может завершиться образованием в каллусной ткани отдельных дифференцированных клеток. Они имеют определенное строение и выполняют специфические функции.
Примером служит образование эпибластов — клеток, в которых запасаются вторичные метаболиты. Это наиболее простой тип дифференцировки каллусной клетки. Более сложная гистологическая дифференцировка завершается образованием в каллусе различных тканей: млечников, волокон, трихом, элементов ксилемы (трахеи и трахеиды) и флоэмы (ситовидные трубки и клетки-спутницы). К самым сложным видам вторичной дифференцировки относятся органогенез — образование органов и соматический эмбриогенез — образование из соматических клеток эмбриоидов, биполярных зародышеподобных структур. Все эти типы дифференцировки возможны только благодаря тотипотентности: любая растительная клетка содержит полный набор генов, характерный для того организма, из которого она была выделена. Потенциальные возможности всех клеток этого растения одинаковы; каждая из них в определенных условиях может дать начало целому организму. Однако выяснено, что реально детерминируется только одна из 400—1000 клеток, что, вероятно, связано с физиологическим состоянием клетки, с ее компетентностью. Так, у эксплантов стеблевого происхождения компетентны к действию экзогенных фитогормонов и, следовательно, способны к морфогенезу только клетки эпидермальных и субэпидермальных тканей. Однако компетентность клеток может приобретаться ими в процессе культивирования каллусной ткани, в условиях, индуцирующих морфогенез. Время, в течение которого в каллусных клетках возникает это свойство, изменяется в широких пределах. Кроме того, существенную роль в дифференциации играют генотип растения-донора, условия и физические факторы культивирования.
Все каллусные клетки, готовые к вторичной дифференцировке, т. е. детерминированные, характеризуются общими чертами. Эти клетки — «клетки-инициали» — образуют утолщенную клеточную стенку, обособляясь от остальных каллусных клеток. Для них характерно более крупное ядро, большее количество запасных веществ, меньшие размеры вакуолей. В «клетках-инициалях» начинается синтез определенных белков, интенсифицируется пентозофосфатный путь расщепления гексоз. Очень важно, что между этими клетками, формирующими меристематические очаги, восстанавливаются плазмодесмы, которые практически отсутствуют в массе каллусных клеток.
Интересное предположение было высказано Л. Саксом и С. Той-воненом (1963). Оно сводится к тому, что существует минимальная масса каллусных клеток, которая определяет способность уже детерминированных клеток к дальнейшему морфогенезу. Это подтвердилось другими учеными в опытах с культурой семядолей ели и было показано, что развитие соматических зародышей детерминируется в клеточных комплексах из 5 — 10 клеток.
biofile.ru
| АрхеологияАрхитектураАстрономияАудитБиологияБотаникаБухгалтерский учётВойное делоГенетикаГеографияГеологияДизайнИскусствоИсторияКиноКулинарияКультураЛитератураМатематикаМедицинаМеталлургияМифологияМузыкаПсихологияРелигияСпортСтроительствоТехникаТранспортТуризмУсадьбаФизикаФотографияХимияЭкологияЭлектричествоЭлектроникаЭнергетика | Основным типом культивируемой растительной клетки является каллусная. Значительно реже культивируют клетки опухолей растений различного происхождения. Культуры опухолевых клеток независимо от способа культивирования на уровне морфологии мало отличаются от культур каллусных клеток. Значительным физиологическим отличием между ними является гормононезависимость опухолевых клеток, позволяющая им делиться и расти на питательных средах без добавок фитогормонов или их аналогов. Однако опухолевые клетки лишены способности давать начало нормально организованным структурам. В некоторых случаях они способны образовывать тератомы (уродливые органоподобные структуры), нормальное развитие которых не происходит. Каллусные клетки в пересадочной культуре могут спонтанно приобрести гормононезависимость. Природа такой независимости к ауксину и цитокинину, чаще всего применяемым при выращивании клеточных культур растений, может быть генетической (результат мутации) или эпигенетической (результат экспрессии генов, определяющих гормононезависимость клетки). При генетической гормононезависимости каллусные клетки ведут себя как опухолевые, при эпигенетической они теряют признак в ряду превращений клетка-растение-клетка. Каллусная клетка, в результате деления которой возникает каллусная ткань или каллус, представляет один из типов клеточной дифференцировки, присущей высшему растению. Для растения каллус является тканью, возникающей при исключительных обстоятельствах (обычно при травмах) и функционирующей непродолжительное время. Эта ткань защищает травмированное место, накапливает питательные вещества для анатомической регенерации или генерации утраченного органа. Для получения культивируемых каллусных клеток in vitro фрагменты тканей разных органов высших растений (экспланты) помещают на искусственную питательную среду в пробирки, колбы, чашки Петри. Процесс получения первичного каллуса и поддержание пересадочной культуры требует строго стерильных условий. Для этого с помощью стерильных растворов, содержащих хлор или ртуть (гипохлориты, сулема, диацид), к которым для лучшего смачивания добавлены детергенты, стерилизуют экспланты, тщательно отмывая их затем от используемого раствора стерильной водой. Питательные среды, растворы, инструменты, материалы, необходимые для работы, стерилизуют в автоклавах или сухожаровых шкафах. Все манипуляции с культурами проводят в микробиологических боксах, облучаемых перед работой ультрафиолетом, или ламинар-боксах, где стерильность достигается постоянной подачей стерильного воздуха в рабочий объем. Особенности дедифференцировки клеток экспланта и каллусогенеза зависят от эпигенетических характеристик составляющих его тканей. Клетки специализированных тканей, эксплантированных на питательную среду, содержащую минеральные соли, источники углерода, витамины и гормоноподобные вещества, должны дедифференцироваться, т.е. потерять структуры, характерные для их специфической функции в растении, и вернуться к состоянию делящейся клетки. Часто эксплант, используемый для получения каллуса, является фрагментом органа и включает ткани, клетки которых различно дифференцированы. Различное тканевое происхождение первичных каллусных клеток является одной из причин гетерогенности культуры каллусной ткани, так как некоторые функциональные особенности исходных дифференцированных клеток передаются в ряду клеточных поколений как стойкие модификации или эпигенетически наследуемые признаки. В клетках экспланта, состоящего из неделящихся специализированных клеток, в самом начале культивирования могут наблюдаться изменения в метаболизме, вызываемые и травматическими синтезами, и дедифференцировкой, и подготовкой к процессу деления. Для разделения этих процессов можно применять прединкубацию эксплантов на среде без гормонов в течение нескольких суток (3-6). Это позволяет исключить не только изменения, связанные с травмой, но и возможное неконтролируемое влияние эндогенных гормонов эксплантата на изучаемые процессы. В готовящейся к делению клетке стимулируется синтез всех типов РНК, исчезают тканеспецифические белки-антигены и появляются белки, специфичные для делящихся клеток и каллусной ткани. Это свидетельствует об изменении активности генов и белкового аппарата клеток при дедифференцировке. Образование каллуса не во всех случаях связано с травматическим воздействием. Каллус может возникнуть в результате пролиферации внутренних тканей эксплантата без связи с поверхностью среза. Растущий каллус разрывает слои ткани и развивается на поверхности. Образование каллуса при эксплантировании фрагмента ткани в условиях in vitro свойственно двудольным и однодольным покрытосеменным и голосеменным растениям, папоротникам, мхам, печеночникам. Первичный каллус, возникший на эксплантах через 4-6 недель (в зависимости от скорости роста клеток), переносится на свежую питательную среду (субкультивируется). Размер транспланта (переносимого кусочка) при культивировании на агаризованной питательной среде обычно составляет от 60 до 100 мг массы ткани на 30-40 мл питательной среды. Таким образом, техника культивирования тканей растений позволяет получить длительную пересадочную каллусную культуру из любых живых тканевых клеток интактного растения. Клетки различно дифференцированные (в том числе и меристематические) переходят in vitro к сложному процессу дедифференциации, теряют присущую им структурную организацию и специфические функции и индуцируются к делению, образуя первичный каллус. В процессе субкультивирования формируется штамм, характеризующийся индивидуальными генетическими и физиологическими особенностями. При культивировании растительных клеток и при выращивании культуры тканей применяются среды Мурасиге-Скуга, Нагата-Такебе, Хеллера, Нича-Нича, Кнудсона и другие в различных модификациях. Основными компонентами питательных сред для культуры клеток и тканей растений являются минеральные соли (макро- и микроэлементы), источник углеродного питания (обычно сахароза или глюкоза), витамины, регуляторы роста. Иногда в состав питательных сред включают комплексные органические добавки (гидролизат казеина или смесь аминокислот, дрожжевой экстракт, экстракты из разных органов растения).
|
studopedya.ru