Геном растений и современные методы его идентификации. Геном растения
Геном растений и современные методы его идентификации
Транскрипт


1 Геном растений и современные методы его идентификации Николай Фризен Ботанический Сад Университета Оснабрюк, Германия
2 ДНК - Дезоксирибонуклеиновая кислота ДНК макромолекула обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Способность ДНК денатурировать, ренатурировать, а также самоудваиваться, является основой практически для всех методов в молекулярной биологии
3 Геном растений Геном растений включает в себя все типы ДНК присутствующие в организме (клетке) растений ГЕНОМ РАСТЕНИЙ - Ядро - Хлоропласты - Митохондрии Хлоропласты Митохондрии Ядро
4 ГЕНОМ РАСТЕНИЙ Ядро самая крупная часть растительного генома кодирует большинство белков содержит большое количество повторной ДНК (=> Большоe различие в количестве ДНК между видами) показывает рекомбинацию и расшепление признаков по Менделю
5 Хромосома Молекула ДНК намотана на определенных отрезках дважды вокруг комплекса гистона, состоящего из 8 молекул (гистона h2) для крепления - Нуклеосомы Каждая молекула ДНК образует 1 хроматиду. Две хроматиды соединеные между собой образуют хромосому. Хромосо мы (др.-греч. χρῶμα цвет и σῶμα тело) нуклеопротеидные структуры в ядре эукариотической клетки, в которых сосредоточена бо льшая часть наследственной информации и которые предназначены для её хранения, реализации и передачи. Хромосомы чётко различимы в световом микроскопе только в период митотического или мейотического деления клетки. (Википедия)

6 Основу хромосомы составляет линейная макромолекула ДНК значительной длины. Перед митозом хромосомная ДНК спирализуется в 10 5 раз по сравнению с линейной длиной.
7 Величина ядерного генома у различных живых организмах Покрытосеменные Голосеменные Млекопитающиеся Рептилии Птицы Рыбы Членистоногие Кольчатые черви Нематоды Мягкотелые Иглокожие Кищечнополостные Одноклеточные Водоросли Грибы Грам+ Бактерии Грам- Бактерии Микоплазма
8 Величина ядерного генома у растений Arabidopsis thaliana 2n= million base pairs Allium cepa 2n= million base pairs Количество генов у Арабидопсиса и у Лука практически одинаковое. Различие в количестве повторной,некодирующей ДНК (микросателиты, ретротранспозоны и т. д.)
9 ГЕНОМ РАСТЕНИЙ Хлоропласты упрощенный геном цианобактерий кольцевая от 130 до 160 кб стабильная структура эволюционирует очень медленно наследуется только по материнской линии, рекомбинации очень редки Хлоропласты


10 ГЕНОМ РАСТЕНИЙ Митохондрии упрощенный геном бактерий кольцевая от 200 до 2000 кб частые рекомбинации структура нестабильная наследуется по материнской линии Гены эволюционируют очень медленно
11 Выделение ДНК из растений Экстракция чистой недеградированной ДНК из растительных объектов остается определяющим первым этапом в любой сфере использования молекулярно-генетических подходов для изучения растительных организмов. Особенности выделения ДНК из растений! При экстракции ДНК из растительных объектов необходимо не только деактивировать клеточные ферменты, но и «удалить» запасные вещества, например, полисахариды и вторичные метаболиты, такие как алкалоиды, фенольные соединения, терпены, которые не просто мешают изолированию ДНК, но и отрицательно влияют на ее качество.
12 Процедура выделения ДНК включает обязательные процедуры: - разрушение клеток; - удаление мембранных липидов; - удаление вторичных метаболитов и запасных веществ; - удаление белков; - удаление РНК; - осаждение ДНК.
13 Фенол-Хлороформная экстрация ДНК Метод Фенол-Хлороформная экстрация ДНК была опубликована в 1968 году (Kirby & Cook, Biochem. J. 104,254). Образец подвергаeтся лизису с SDS и после лизиса смешивается с фенолом-хлороформом, образуя при этом двухфазную смесь. ДНК осаждают из верхней фазы и осажденную ДНК растворяют водой. ДНК получается хорошего качества и ее довольно много НО! Процедура довольно длинная и используемые химикаты опасны для здоровья!
14 Выделение ДНК с использованием СТАБ (бромистого цетилтриметиламмония - cetyltrimethylammonium bromide) Методика с использованием СТАВ впервые разработанная Мюррэем и Томпсоном в 1980 г. (Murray and Thompson, 1980). Этот метод хорошо подходит для выделения и очистки ДНК из растений Лизис или растворение ДНК происходит с помощью буфера экстракции, который содержит EDTA, Tris/HCl и СТАВ. Очистку ДНК уже можно проводить только с хлороформом, без фенола.
15 Выделение ДНК на основе силиконовых мембран Колонка с силиконовой мембраной ДНК адсорбируют на кремнеземе в присутствии хаотропныхсолевых растворов с высокой ионной силой. Хаотропные соли денатурирует биомолекулы, нарушая оболочка гидратации вокруг них. Это позволяет положительно заряженным ионам соли образовывать мост между отрицательно заряженным диоксидом кремния и отрицательно заряженнщй ДНК. ДНК промывают раствором этанола с высоким содержанием соли и потом растворяют водяным раствором с низким содержанием соли. Процедура выделение ДНК на основе силиконовых мембран очень проста и не требует опасных химикатов!
16 Разработано огромное количество протоколов для выделения ДНК. Комерческими компаниями предлагаются множество КИТов для выделения ДНК из растений, основанных на силиконовых мембранах, стоимость выделения одной пробы которыми колеблется от 1 до 6 Евро DNeasy Plant Mini Kit Qiagen innuprep Plant DNA Kit AnalytikJena sbeadex plant kit NucleoSpin Plant II Процедура выделения ДНК в КИТах не меняется, но меняются химические вешества, используемые для связывания ДНК на силиконовой мембране
17 Набор для выделения ДНК из засушенных растений и семян DiamondDNA Genomic DNA Extraction Kit for Dry Plants & Seeds ABT Llc. Russia, Barnaul, Nikitina Str. 111
18 Из каких частей (органов) растений лучше всего выделять ДНК? Лучше всего выделять ДНК из молодых органов растений (молодые листья, соцветия и т.д.). В них меньше всего запасных веществ и вторичных метаболитов. Но к сожалению это не всегда доступно! Чаще всего для таксономических работ мы имеем дело со специально собранными образцами или с гербарным материалом. Кроме того растения сильно различаются по компонентному составу вторичных метаболитов. Поэтому для каждой группы растений иногда приходиться модифицировать протоколы выделения ДНК (например: суккулунтные растения; хвойные). Сбор материала в поле и т.д.: Найлучший результат при сборе материала получают при высушивании проб в силикагеле. При работе с Гербарным материалом особо важное значение имеет, как был высушен гербарий. Чем естественей цвет растения в гербарии, тем больше вероятность в получении рабочей, мало деградированной ДНК. Ваучер! В таксономических исследованиях к любым публикуемым последовательностям ДНК неоходимо указание на Гербарный образец с которого выделена ДНК (vouchered specimen).
19 Выделив ДНК, как получить информацию записанную эволюцией в ДНК?
20 Маркерные системы ДНК (Молекулярные маркеры) Молекулярные маркеры представляют собой генетические маркеры, позволяющие анализировать организм на уровне ДНК. К ним применимы термины классической генетики, такие как локус, аллель, доминантный и кодоминантный тип наследования. Аллели маркерных локусов представляют собой различные формы (нуклеотидные последовательности, отличающиеся по длине и/или по нуклеотидным заменам) одного и того же маркера, расположенные в одинаковых участках (локусах) гомологичных хромосом. Если метод анализа маркера позволяет выявлять оба аллеля, говорят о кодоминантном типе наследования данного маркера, если выявляется только один аллель о доминантном наследовании ДНК маркеры условно можно разделить на три группы: маркеры, основанные на блот-гибридизации, маркеры, основанные на ПЦР и маркеры, основанные на ДНК-чипах. В последующих лекциях мы расмотрим подробнее маркеры, основанный на ПЦР.
21 PCR - polimerase chain reaction Полимеразная цепная реакция - ПЦР ПЦР очень мощный метод размножения фрагментов ДНК вне организмов (in vitro). С момента его открытия в 1985 году, этот метод используется сейчас практически во всех молекулярнoбиологических лабораториях. В 1985, технология полимерной цепной реакции (PCR) была введена Миллисом (Mullis) c сотрудниками. Через 8 лет после этого за изобретение метода ПЦР Кэри Муллис получил Нобелевскую премию. Baby Blue Thermocycler, В 1980 году Каледин с сотрудниками впервые выделили и описали свойства днк-полимеразы из термофильной бактерии Thermus aquaticus.
22 Полимера зная цепна я реа кция (ПЦР) экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (Википедия). Метод основан на многократном избирательном копировании определённого участка нуклеиновой кислоты ДНК при помощи ферментов в искусственных условиях (in vitro). С помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований. С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать тысяч пар нуклеотидов.
23 Компоненты ПЦР ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. Термостабильная ДНК-полимераза фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwoполимераза) и другие. Дезоксирибонуклеозидтрифосфаты (datp, dgtp, dctp, dttp). Буферный раствор, обеспечивающий необходимые условия реакции рн, ионную силу раствора. Содержит соли, бычий сывороточный альбумин. Ионы Mg 2+, необходимые для работы полимеразы.

24 Праймеры Это короткие синтетические олигонуклеотиды длиной оснований. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка. После гибридизации матрицы с праймером (отжиг), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы. Важнейшая характеристика праймеров температура плавления Полимеразная цепная реакция - ПЦР Денатурация 95 C Отжиг C Элонгация 72 C
25
26 Учебный Фильм
27 Разновидности ПЦР Вложенная ПЦР (Nested PCR) применяется для уменьшения числа побочных продуктов реакции. Используют две пары праймеров и проводят две последовательные реакции. Вторая пара праймеров амплифицирует участок ДНК внутри продукта первой реакции. Инвертированная ПЦР (Inverse PCR ) используется в том случае, если известен лишь небольшой участок внутри нужной последовательности. Этот метод особенно полезен, когда нужно определить соседние последовательности после вставки ДНК в геном. ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR) используется для амплификации, выделения или идентификации известной последовательности из библиотеки РНК. Перед обычной ПЦР проводят на матрице мрнк синтез одноцепочечной молекулы ДНК с помощью ревертазы и получают одноцепочечную кднк, которая используется в качестве матрицы для ПЦР. Этим методом часто определяют, где и когда экспрессируются данные гены. Количественная ПЦР (Quantitative PCR, Q-PCR) или ПЦР в реальном времени используется для непосредственного наблюдения за измерением количества конкретного ПЦР продукта в каждом цикле реакции. ПЦР со случайной амплификацией полиморфной ДНК используется тогда, когда нужно различить близкие по генетической последовательности организмы. В этом случае используются более короткие праймеры с одинаковой последовательностью. ПЦР длинных фрагментов (Long-range PCR) модификация ПЦР для амплификации протяженных участков ДНК (10 тысяч и более оснований). Используют смесь двух полимераз, одна из которых Taq-полимераза, а вторая ДНК полимераза с 3'-5' экзонуклеазной активностью, обычно это Pfu полимераза. И много других вариантов...
28 Гель Электрофорез Электрофорез ДНК это аналитический метод, применяемый для разделения фрагментов ДНК по размеру Силы электрического поля, прикладываемого к образцам, заставляют фрагменты ДНК мигрировать через гель. Сахарофосфатный остов молекул ДНК заряжен отрицательно и поэтому цепи ДНК двигаются от катода, заряженного отрицательно, к положительному аноду. Более длинные молекулы мигрируют медленнее, так как задерживаются в геле, более короткие молекулы двигаются быстрее. Электрофорез проводится в камере, заполненной буферным раствором. Чаще всего используются буферы, содержащие ЭДТА, трис и борную кислоту: TAE и TBE. Буфер необходим для повышения ионной силы раствора, в котором будет происходить разделение молекул ДНК под действием приложенного электрического поля. После разделения фрагменты ДНК разной длины визуализируют при помощи флюоресцентных красителей, специфично взаимодействующих с ДНК, например, агарозные гели обычно красят бромистым этидием, который интеркалирует между азотистыми основаниями дуплекса и флюоресцирует в УФ-лучах. Определение размеров производят путем сравнения коммерчески доступных фрагментов ДНК (DNA ladder, «линейка»), содержащий линейные фрагменты ДНК известной длины.
29 Гель Электрофорез Для электрофоретического анализа ДНК обычно используют агарозные (для относительно длинных молекул ДНК) и полиакриламидные (для высокого разрешения коротких молекул ДНК, например, в случае секвенирования) гели.
30 Приборы для документирования гелей
31 ДНК маркеры основанные на ПЦР, также условно делятся на две группы: - Методы фрагментного анализа ДНК. - Анализ последовательностей амплифицированных фрагментов ДНК (секвенирование).
32 Методы Области применения маркерных систем /молекулярных методов/ на различных таксономических уровнях Организм Популяция Подвид Вид Секция Род Семейство Порядок Класс Spacer/Introns Gene cpdna DNA-Сиквенс RFLP ISSR / RAPD / SCoT/ AFLP Микросателиты SCAR SNP
33
docplayer.ru
Эволюция сокращает геном растений | Взгляд за Грань

Геном Arabidopsis thaliana почти в два раза меньше, чем у её ближайшего родственника, Arabidopsis lyrata. Но при этом потери пошли A. thaliana только на пользу: из её генома исчезли последовательности транспозонов, провоцирующие опасные мутации.
Каков размер генома у растений? — Трудный вопрос. Наиболее крупный геном у вороньего глаза: он в тысячу раз превосходит самый короткий, коим обладают хищные растения из рода Genlisea. А в какую сторону эволюция подталкивает растения — к увеличению или уменьшению запасов ДНК? Те же вороний глаз и хищные генлисеи — слишком разные виды, чтобы можно было оценить направление эволюции. Для этого нужны более или менее родственные виды.Исследователи из Института биологии развития имени Макса Планка (Германия) предприняли сравнительный анализ геномов резуховидки лиролистной и резуховидки Таля (согласитесь, по-русски это звучит куда хуже, чем Arabidopsis). Оба вида, представляющие знаменитейший и популярнейший среди биологов род Arabidopsis, произошли от одного предка, и их эволюционные пути разошлись не так уж давно — всего 10 млн лет назад.
Геном резуховидки Таля секвенирован уже много раз, его длина составляет 125 млн «букв» (то есть пар нуклеотидов), которые складываются в 27 025 генов, расположенных на пяти хромосомах. Геном резуховидки лиролистной — почти вдвое больше: 207 млн «букв». А вот выигрыш по генам не столь велик: 32 670 генов на восьми хромосомах. ДНК р. лиролистной оказалась больше за счёт незначащих зон, которые не кодируют белки и не имеют регуляторных функций.
Учёные решили проверить, что именно есть у одного растения и чего нет у второго. Выяснилось, что геном р. Таля стал таким за счёт потерь сотен и тысяч пар оснований в областях транспозонов и между ними. Транспозоны, или мобильные элементы, обладают свойством самопроизвольно «прыгать» из одного участка генома в другой, и такие прыжки часто приводят к негативным эффектам: транспозон может встроиться в ген и полностью нарушить его функцию.
По словам исследователей, р. лиролистная недалеко ушла от своего предка, имея восемь хромосом и много «мусора» в геноме. Напротив, A. thaliana избавила себя от многих неприятностей, отбросив в ходе эволюции не вызывающие доверяя участки собственного генома.
Статья с анализом геномов двух растений опубликована в журнале Nature Genetics.
www
vzglyadzagran.ru
Расшифрован геном растения — живого ископаемого
Группа китайских ученых расшифровала геном гинкго – растения, строение которого не менялось 200 миллионов лет. Эта работа поможет выяснить, как эволюционировал геном современных голосеменных растений, таких как ель, сосна или кипарис.
Гинкго билоба — древнее растение, обладающее набором интересных особенностей. У гинкго большой геном, размер которого составляет 10,6 миллиарда пар нуклеотидных оснований, содержащий 41 840 генов. Таким образом, геном гинкго почти в четыре раза длиннее, чем геном человека, состоящий из 3,1 миллиарда пар нуклеотидных оснований.
Кроме того, гинкго отличается высокой устойчивостью к патогенным грибкам, бактериальным инфекциям, паразитам и неблагоприятным факторам среды. При этом гинкго — двудомное растение, у которого есть как мужские, так и женские цветы. Это делает его идеальной моделью для биологических исследований.
Ученые расшифровали геном гинкго и сравнили его с пятью уже расшифрованными геномами современных голосеменных растений. Выяснилось, что 76% генома гинкго состоит из повторов ретротранспозонов (LTR-RTs) — генетических элементов, которые при помощи РНК могут самостоятельно встраиваться в геном и увеличивать его длину.
Ученым удалось доказать, что устойчивость гинкго к вредителям и условиям среды связана с большим количеством ретротранспозонных повторов в геноме, а также выяснить, что накопление ретротранспозонов началось между 16 и 24 миллионами лет назад.
Исследование генома гинкго поможет прояснить родословную современных голосеменных растений и понять, как гинкго борется с вредителями — насекомыми, бактериями и грибами. В будущем это поможет защитить от паразитов современные ели и сосны.
Исследование опубликовано в журнале GigaScience.
О том, как работа иммунной системы растений зависит от времени суток, читайте в материале «Чердака».
chrdk.ru
Геном хищного растения опроверг теорию о необходимости мусорной ДНК
Гены составляют всего 2% человеческого генома. Оставшиеся 98% приходятся на так называемую «некодирующую» ДНК и последовательности, функции которых пока не установлены. Некодирующая ДНК — это ДНК, которая не кодирует белки. Она состоит из подвижных элементов — «прыгающих» генов — которые способны копировать сами себя на других участках генома.
Уже много лет учёные пытаются понять, зачем человеку так много нефункционального генетического материала.


Авторы исследования, опубликованного в журнале Nature, пришли к необычному выводу: большая часть некодирующей ДНК, крайне распространённой среди живых существ, вовсе не нужна сложным организмам.
Для того чтобы сделать такое открытие, биологи расшифровали геном пузырчатки (Utricularia gibba) − хищного растения, произрастающего преимущественно в водоёмах и использующего ловчие пузырьки для охоты. Из всех многоклеточных растений у этого самый скудный геном, который когда-либо был расшифрован. Исследователи утверждают, что он состоит на 97% из генов (напомним: участков ДНК, кодирующих белки) и небольших участков, контролирующих их работу.
Учёные полагают, что пузырчатка на протяжении многих лет своей эволюции удаляла из своего генома «мусорную» ДНК. Так можно объяснить отличие генома пузырчатки от других организмов, богатых нефункциональным материалом — кукурузы, табака и даже человека.
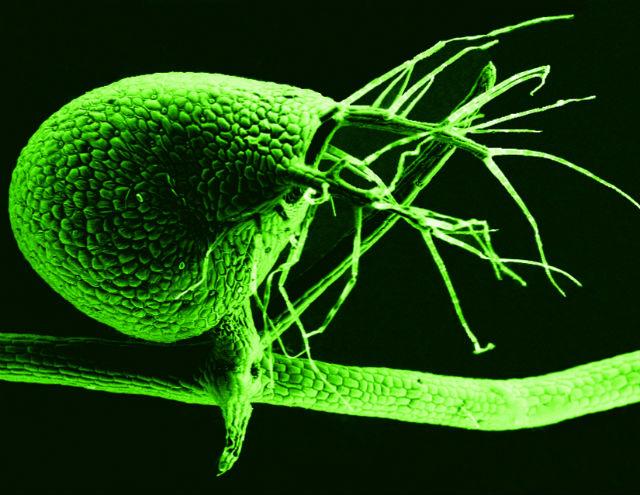

Над секвенированием и анализом генома пузырчатки работала международная команда исследователей из мексиканской национальной Лаборатории исследования генома и биологического разнообразия (LaNGeBio) и университета Баффало (Buffalo University) во главе с Луисом Эррера-Эстреллой (Luis Herrera-Estrella) и Виктором Альбертом (Victor Albert). В команду также входили биологи из США, Мексики, Китая, Сингапура, Испании и Германии.
«То, что геном пузырчатки содержит всего 3% «мусорной» ДНК, — это большое открытие. Каким-то образом это растение удалило большую часть того материала, из которого состоит геном почти всех многоклеточных организмов. Выходит, можно быть полноценным растением, состоящим из множества клеток, тканей и цветов, и при этом не иметь в своём геноме ничего лишнего. Мусор вовсе не нужен для жизни», — рассказывает Альберт.
Согласно «Энциклопедии элементов ДНК» (ENCODE), крупнейшему международному проекту по изучению генома, 80% некодирующей ДНК играют важную роль в некоторых биохимических функциях. «Мусор» используется в производстве РНК, которая необходима генам в процессе кодирования белков.
Однако Эррера-Эстрелла и Альберт придерживаются другого мнения. Они считают, что организм не может загромождать себя таким количеством генетического мусора ради сомнительных преимуществ. По мнению исследователей, некоторые организмы от природы склонны к удалению лишней генетической информации, а некоторые — наоборот, к приумножению и копированию участков ДНК. И только дарвиновский естественный отбор покажет, какой метод более жизнеспособен.
Примечательно, что геном пузырчатки всё же имеет повторения, однако он далеко не так велик, как геном её дальнего родственника — томата. Для сравнения, геном хищного растения состоит из 80 миллионов пар оснований и 28 500 генов, тогда как геном томата состоит из 780 миллионов пар, а винограда — из 490 миллионов.
В процессе эволюции геном пузырчатки дублировался, по крайней мере, три раза (тогда отпрыск получал две полноценных копии генома). «Такая богатая история дупликаций генома в сочетании с таким маленьким размером генома объясняется только тем, что растение действительно множество раз вычищало ненужную генетическую информацию, но каждый раз оставляло набор функциональных генов», — объясняет Эррера-Эстрелла в пресс-релизе университета Баффало.
Ссылка на источник
Похожие записи:
alev.biz
Гены хлоропластов: многочисленные геномы растений
Если пластиды были приобретены в результате симбиоза, то растения генетически и метаболически более сложны, чем представляли себе многие физиологи. Если гетеротрофные эукариоты тригеномны благодаря своим митохондриям, ундулиподиям и нуклеоцитоплазме, то растения уже квадригеномны благодаря дополнительной органелле-своим фотосинтезирующим пластидам.
Работы, в которых несколько геномов растения и их продукты гомогенизируют, а затем их функции реконструируют, исходя из отдельных химических реакций, неизбежно должны приводить к путаным и противоречивым результатам. Разве биохимик может ожидать успеха в изучении брожения при производстве вина, если он просто закладывает «фермент», который состоит из нескольких организмов, различающихся по возрасту, физиологическому состоянию, степени взаимозависимости и многим другим переменным? Нужно рассортировать вторичные метаболиты растений (флавоноиды, алкалоиды, ацетогенины и лигнаны) в соответствии с тем, кодируются ли они только одним из геномов, двумя, тремя или всеми четырьмя. Аналогичный анализ белков пластидной мембраны указывает на то, что многие из них, вероятно, находятся под прямым или косвенным генетическим контролем пластид. А поскольку со степенью текучести мембран связана морозоустойчивость и холодочувствительность сельскохозяйственных растений, ясно, что различение уровней интеграции партнеров в этих древних множественных симбиозах представляет не только академический интерес.
Почти все важные работы по передаче, сегрегации и рекомбинации генов хлоропластов были проведены на гаплоидном зеленом протисте Chlamydomonas. Недавно появился критический обзор впечатляющих достижений в этой области более чем за 20 лет. Геном хлоропласта у хламидомонады содержит достаточное количество уникальных последовательностей ДНК, чтобы кодировать, возможно, несколько сотен белков. Для сравнения отметим, что у большинства митохондриальных ДНК кодирующая способность примерно в 10 раз меньше. Однако интерпретацию данных генетического изучения хлоропластов сильно затрудняет то, что у всех известных организмов, обладающих хлоропластами, имеются также митохондрии (эволюционное объяснение этого факта будет дано в конце раздела). Не только у хламидомонады, но и у любого растения или водоросли неядерные генетические эффекты могут быть обусловлены одними хлоропластами, одними митохондриями, взаимодействием между этими органеллами или между ними и ядром; возможно даже участие иных симбионтов или вирусов. Однако с помощью остроумных методов было показано, что некоторые генные продукты, находящиеся в митохондриях растущих клеток, кодирует ДНК хлоропластов и что для образования пластидных рибосом у хламидомонады нужны продукты как ядерных, так и пластидных генов.
Клеточная эволюция идет в направлении большей взаимозависимости; в особенности органеллы становятся зависимыми от продуктов ядерных геномов. По меньшей мере несколько белков совместно кодируются пластидными и ядерными генами. Например, важный белок рибулозобисфосфат-карбоксилаза (РБК), ответственный за первый шаг на пути фиксации атмосферной СО2, продукт двух геномов, ядерного и пластидного. У хламидомонады и у пшеницы ген, кодирующий большую субъединицу этого фермента, находится в хлоропласте, а малую субъединицу в ядре. РБК служит примером интеграции партнеров на уровне генного продукта. Этот чрезвычайно важный белок, который очень мало изменился в. процессе эволюции, обещает стать отличным средством для построения схем филогении фотосинтезирующих организмов. Из хламидомонады можно выделить кодирующий РБК ген; путем инкубации с надлежащими ферментами и малыми молекулами его можно клонировать in vitro в присутствии радиоактивного фосфата и получить достаточное количество меченой ДНК для того, чтобы испытать ее в реакциях гибридизации с ДНК других организмов. Это позволяет оценить степень гомологичности нуклеотидных последовательностей в генах РБК многих фотосинтезирующих организмов. Стэн Джелвин, аспирант Океанографического института Скриппса, написал нам (личное сообщение, 16 мая 1977 г.):
«Как я Вам объяснил, я выделил информационную РНК и клонировал ген, кодирующий большую субъединицу рибулозобисфосфат-карбоксилазы из Chlamydomonas reinhardi. Я смог получить, введя в качестве метки 32PO4, мРНК очень высокой удельной активности (1-2∙106 имп/мин на 1 мкг РНК), чтобы использовать ее как гибридизационный зонд. В прошлый уикэнд я поставил предварительные опыты, результаты которых оказались чрезвычайно интересными. Как Вы знаете, большая субъединица РБК чрезвычайно консервативна; у всех изученных организмов от фотосинтезирующих бактерий до высших растений она имеет один и тот же (приблизительно) аминокислотный состав и дает перекрестные иммунологические реакции. Я представил себе, что если это так, то моя мРНК для большой субъединицы из С. reinhardi должна была бы перекрестно гибридизоваться с ДНК из других фотосинтезирующих организмов. Я гибридизовал свою мРНК с ДНК, выделенной из Rhodopseudomonas spheroides [фотосинтезирующая несерная пурпурная бактерия], и с ДНК хлоропластов салата, шпината, цикория, мангольда, С. reinhardi и моего клонированного гена. Во всех случаях гибридизация произошла, тогда как с ДНК из молок сельди и в контроле она была ничтожной. Весьма предварительные кривые плавления указывают на то, что исследованная мРНК С. reinhardi с большей специфичностью гибридизуется с ДНК высших растений, чем с бактериальной ДНК. Разумеется, это лишь самые предварительные результаты, но их следовало бы обнародовать после более тщательных и полных опытов. Эти результаты волнуют (по крайней мере меня) потому, что мы имеем теперь реальную молекулярную отмычку к белку, который важен как в сельскохозяйственном, так и в эволюционном отношении.
После того как я прослушал Ваш семинар и прочел Вашу книгу, я подумал, что детальное изучение молекулярной эволюции этого гена может быть полезно для Вашей работы. Конечно, нас интересует эволюционная дивергенция этого гена не только в сопоставлении с С. reinhardi, но и во всех других парных комбинациях фотосинтезирующих организмов, особенно между сине-зелеными и зелеными водорослями. Для этого нужно было бы выделить соответствующий ген из нескольких организмов (и, вероятно, клонировать его, чтобы получить достаточный материал для анализа). Тот факт, что мРНК для большой субчастицы РБК С. reinhardi перекрестно гибридизируется с гомологичным геном других организмов, означает, что она может послужить средством для обнаружения искомого гена с целью его изоляции».
Тот факт, что не найдено водорослей или растений с пластидами, но без митохондрий, вероятно, обусловлен той последовательностью, в которой эти органеллы были приобретены. Для фагоцитоза, который важен не только для питания, но и для захвата протопластид, нужны гибкие стероидные мембраны. У организмов, лишенных митохондрий, таких мембран, по-видимому, не было, поскольку фагоцитоз не обнаружен ни у каких прокариот, даже у тех бактерий, окисляющих метан, которые способны синтезировать стероиды. Значит, протопластиды были захвачены теми способными к фагоцитозу организмами, которые имели митохондрии и синтезировали стероиды. Если бы водоросли произошли прямо от цианобактерий, то среди ныне живущих организмов нашлись бы эукариотические формы, имеющие пластиды, но лишенные митохондрий.
Источник: Л. Маргелис. Роль симбиоза в эволюции клетки. Пер. В.Б. Касинова, Е.В. Кунина. Под ред. Б.М. Медникова. Издательство «Мир». Москва. 1963
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Генетика иммунитета растений
Иммунитет растений к инфекционным болезням является наследственным признаком и контролируется генетически.
При этом устойчивость или восприимчивость представляет собой результат взаимодействия двух геномов — растения и паразита, а это объясняет существование многообразия как генов устойчивости растений к одному и тому же виду паразита, так и физиологических рас паразита, способных преодолевать действие этих генов. Такое многообразие является результатом сопряженной параллельной эволюции паразита и хозяина. Наибольшее разнообразие генов устойчивости обнаруживают растения из местностей, являющихся одновременно и родиной паразита. Например, устойчивые к фитофторе виды картофеля наиболее богато представлены в мексиканском центре, являющемся одновременно и родиной паразита, но не в чилийском, куда фитофтора была завезена лишь впоследствии.
Устойчивость растений может быть обусловлена как одной, так и несколькими парами генов. В частности, у картофеля установлено наличие девяти генов устойчивости к фитофторе, обозначаемых буквой R (R1, R2… и т. д.). У разных видов пшениц обнаружено около 20 генов устойчивости к стеблевой ржавчине, которые также пронумерованы (Sr1, Sr2… и т. д.). Гены устойчивости к стеблевой ржавчине овса обозначены буквами А, В, D, Е, F…
Параллельные исследования в области генетики устойчивости растении и вирулентности патогенов показали, что гены устойчивости растений и вирулентности паразитов комплементарны. Сорта, не имеющие генов устойчивости, поражаются всеми расами паразита; на сортах, содержащих один ген устойчивости, могут развиваться паразиты, имеющие минимум один ген вирулентности; для сортов с двумя генами устойчивости вирулентная раса должна обладать не менее чем двумя генами вирулентности и т. д. Например, раса 0 Ph. infestans не способна поражать ни один сорт картофеля, имеющий ген R, раса 1 может подавлять устойчивость, сообщаемую геном R1 расы 1, 2, 3, 4 могут преодолевать устойчивость, сообщаемую каждым в отдельности или комбинацией генов R1, R2, R3 и R4. Эти положения были сформулированы американским генетиком Г. Г. Флором в его теории «ген на ген» и в настоящее время нашли подтверждение для ряда пар: растение-хозяин — паразит.
Гены, контролирующие устойчивость, делят на олигогены, т. е. гены, проявляющие сильное фенотипическое действие, и полигены, т. е. гены, оказывающие слабое фенотипическое действие. Некоторые авторы употребляют для обозначения этих групп генов еще термины «главные» гены (major genes) и «малые» гены (minor genes).
Различают моногенную и полигенную устойчивость растений. Монотонная устойчивость, называемая еще вертикальной, означает устойчивость к одним расам патогена и поражаемость другими. Она контролируется главными генами, или олигогенами. Эта устойчивость обусловливает, в частности, реакцию «сверхчувствительности». Другой, хорошо изученный тип устойчивости — полигенный, или горизонтальная, или полевая устойчивость — контролируется полимерными генами. Она определяет ту или иную степень устойчивости и замедляет развитие болезни после ее начала. Кроме того, снижая степень заражения растения, горизонтальная (половая) устойчивость может уменьшить количество заразного (инфекционного) начала, зимующего в больных частях растения, и тем самым задержать начало массового развития болезни в следующем году.
Этот тип устойчивости сильно зависит от внешних условий, определяющих развитие патогена и фенотип растения-хозяина. Среди них большую роль играет рельеф участка выращивания растения, состав почвы, виды и количество удобрений, густота и сроки посадки растений, температура и т. д.
Полигенная устойчивость гораздо менее специфична, чем моногенная, и не преодолевается расами паразита. Для многих растений такая устойчивость сохраняется долгое время.
С сожалением приходится отметить, что изучение биохимической стороны генетики иммунитета растений находится в настоящее время на самом начальном этапе. Имеющиеся по этому вопросу данные относятся лишь к случаям олигогенной устойчивости, контролируемой небольшим числом генов. Что касается полигенной устойчивости, то для ее изучения на физиолого-биохимическом уровне пока еще нет достаточно апробированных методических подходов.
Большое значение для изучения генетического контроля процессов, а также синтеза метаболитов, участвующих в реакциях устойчивости, имеет генетическая подготовка материала, т. е. создание аналогов одного сорта растений, различающихся лишь по генам устойчивости. В частности, такие изогенные линии растений получены для пшеницы, льна, кукурузы. На их примере показано, что моногенная устойчивость определяется физиологической реакцией клеток на установление взаимодействия патогена и растения, а не структурными или морфологическими особенностями растения. На основании некоторых имеющихся экспериментальных данных предложена гипотеза для объяснения механизма несовместимости реакций паразита и хозяина, основанная на теории французских генетиков Жакоба и Моно. Согласно этой гипотезе, ген устойчивости растения является регуляторным геном и контролирует синтез в цитоплазме репрессора (вероятно, белковой природы), который, соединяясь с геном-оператором, ингибирует образование защитных веществ. Этот репрессор при внедрении несовместимого патогена (растение устойчиво) способен соединяться с метаболитами патогена, играющими роль эффектора, в результате чего снимается репрессия с гена-оператора, что способствует образованию защитных веществ. Вирулентность паразитов, т. е. их способность преодолевать защитные реакции растения, можно объяснить адаптацией паразита к токсическим продуктам защитных реакций, образованием токсинов, позволяющих подавить защитные реакции, а также неспособностью образовывать эффектор, связывающий репрессор растения.
В настоящее время начато генетическое изучение форм окислительных ферментов, участвующих в реакциях иммунитета, исследуются температурочувствительные гены устойчивости. Однако эти исследования пока все еще немногочисленны.
Из изложенного следует, что изучение генетических основ иммунитета растений должно привлечь более широкое внимание исследователей, что позволит им принять действенное участие в разработке биологически обоснованной селекции растений на устойчивость к болезням.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Расшифрован геном растения — живого ископаемого
Автор: chrdk.ru
24 ноября 2016, 11:40
Группа китайских ученых расшифровала геном гинкго – растения, строение которого не менялось 200 миллионов лет. Эта работа поможет выяснить, как эволюционировал геном современных голосеменных растений, таких как ель, сосна или кипарис. Исследование опубликовано в журнале GigaScience.
Гинкго билоба — древнее растение, обладающее набором интересных особенностей. У гинкго большой геном, размер которого составляет 10,6 миллиарда пар нуклеотидных оснований, содержащий 41 840 генов. Таким образом, геном гинкго почти в четыре раза длиннее, чем геном человека, состоящий из 3,1 миллиарда пар нуклеотидных оснований.
Кроме того, гинкго отличается высокой устойчивостью к патогенным грибкам, бактериальным инфекциям, паразитам и неблагоприятным факторам среды. При этом гинкго — двудомное растение, у которого есть как мужские, так и женские цветы. Это делает его идеальной моделью для биологических исследований.
Ученые расшифровали геном гинкго и сравнили его с пятью уже расшифрованными геномами современных голосеменных растений. Выяснилось, что 76% генома гинкго состоит из повторов ретротранспозонов (LTR-RTs) — генетических элементов, которые при помощи РНК могут самостоятельно встраиваться в геном и увеличивать его длину.
Ученым удалось доказать, что устойчивость гинкго к вредителям и условиям среды связана с большим количеством ретротранспозонных повторов в геноме, а также выяснить, что накопление ретротранспозонов началось между 16 и 24 миллионами лет назад.
Исследование генома гинкго поможет прояснить родословную современных голосеменных растений и понять, как гинкго борется с вредителями — насекомыми, бактериями и грибами. В будущем это поможет защитить от паразитов современные ели и сосны.
Источник: chrdk.ru
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
naukatehnika.com











