Проект – исследование на тему: «Изучение свойств растительных пигментов». Таблица пигменты растений
Состав и свойства растительных пигментов
Натуральные Пищевые красители
Для окрашивания продуктов питания применяют соки и экстракты из культурных и дикорастущих плодов и ягод — таких,, как черника, ежевика, клюква, рябина, калина, черемуха, вишня, барбарис, виноград, черная смородина и т. п. Ягоды и соки из них сами по себе питательны и служат ценными вкусовыми и ароматическими компонентами ряда пищевых продуктов: кондитерских и ликеро-наливочных изделий, напитков и т. п. Эти изделия, кроме того, нуждаются также в дополнительном подкрашивании. Но пригодны соки - красители далеко не во всех случаях, так как концентрация красящих веществ в них относительно невелика.
Сырьем для изготовления натуральных красителей растительного происхождения кроме ягод являются также цветы и листья растений, плоды, корнеплоды и т. п. Наряду с культурными и дикорастущими растениями важным источником натуральных пищевых красителей могут быть отходы переработки растительного сырья на консервных и винодельческих заводах. Применение этих отходов (выжимок ягод и т. п.) в производстве некоторых пищевых продуктов наряду с ликвидацией дефицита в красителях способствует повышению уровня «рентабельности использования растительного сырья.
В винодельческой и плодоовощекоисервной отрас-. лях пищевой промышленности ежегодно образуется значительное количество растительных отходов, которые могут служить ценным сырьем для получения натуральных красителей. Так, в плодоовощной промышленности сырье используется только на 70—90% (24].
Содержание красящих веществ в растительном сырье относительно невелико, а количество других присутствующих химических соединений может превышать его в несколько раз. Это сахаристые, пектиновые, белковые вещества, органические кислоты, минеральные соли и т. п. Сами по себе эти вещества также полезны. Однако наличие их в сырье влияет на содержание красящих веществ в конечном продукте; по мере необходимости указанные химические элементы могут быть удалены в ходе технологического процесса приготовления красителя.
Следует учитывать и то, что в некоторых видах красильных растений могут присутствовать нежелательные примеси, такие, как алкалоиды, сильнодействующие физиологически активные гликозиды. Освобождение от них в достаточной степени не всегда возможно, а следовательно, нет полной гарантии в безопасности применения в пищевых целях полученного из таких растений красителя. Поэтому из множества растений, являющихся источниками красок различного назначения, лишь ограниченное количество их видов пригодно для получения натуральных пищевых красителей.
В связи с этим важнейшей задачей исследователей в этой области является выбор наиболее перспективного растительного сырья и оптимальных способов изготовления из него пищевых красителей.
Красящие вещества растительного происхождения разнообразны по химическому составу и структуре. Наиболее широко распространены красящие вещества, относящиеся по химической природе к флавоиоидным и каротиноидным соединениям, которые являются основой красных, оранжевых и желтых красителей.
Пигменты, содержащиеся в растительном сырье, в зависимости от их растворимости в воде могут быть разделены на две группы: растворимые в воде, находящиеся в соке растений (лепестках цветков, ягодах, Фруктах и т. п.), и нерастворимые в воде — хлорофилл, каротин, присутствующие в хлоропластах клеток листьев зеленых растений, фруктах, овощах и т. п.
Цвет растворимых в воде растительных пигментов 0.Уловлен в основном антоцианами.
Антоцианы — красящие вещества растений — от - к фенольным соединениям. Одной из харак - рных особенностей растительной клетки является
Образование фенольных соединений. Это вещества, содержащие в своей молекуле ароматическое (бензольное) кольцо, которое несет одну, две или более гид - роксильных группы [39]. Важнейшая функция фенольных соединений в растительных тканях — их участие в окислительно-восстановительных процессах.
Известное в природе огромное разнообразие фенольных соединений можно разделить па трн основные группы в соответствии с их Углеродным скелетом : С6 — Ср, CG — Сз - и С6 — С3 — Сq-соединение.
К группе С6—Сі-соединений относятся оксибензой - ные кислоты: п—оксибеизойная, протокатеховая, ванилиновая, галловая и сиреневая. Они широко распространены в растениях. Присутствуют оксибензойные кислоты в растениях обычно в связанной форме и высвобождаются при гидролизе. Галловая кислота обнаружена в растениях как в свободном - виде, так и в виде димераметадигалловой кислоты. Депсиды (соединения со сложноэфирной связью, образуемой за счег феноль - ной гидроксильной группы одной молекулы фенолкар - боновой кислоты и карбоксильной группы другой) галловой кислоты представляют собой исходные продукты для образования гидролизуемых дубильных веществ.
Из Сб — Сі-соединений широко используется в пищевой промышленности, особенно в кондитерской отрасли, ванилин (альдегид ванилиновой кислоты), обладающий характерным приятным запахом. В виде глюкозида он содержится в плодах ванили.
Группа Се—Сз-соединений включает подгруппы ок - снкоричных кислот и кумаринов. Оксикорнчные кислоты— я-оксикоричная (я-кумаровая), кофейная, феруловая и синаповая — присутствуют в растениях как в свободном, так и в связанном виде.
В растениях часто встречаются сложные эфиры ок - сикоричных кислот (хинной и шикимовой), на-прнмер хлорогеновая (кофеил-3-хинная) кислота. Она широко распространена в растениях. Особенно большое количество хлорогеновой кислоты обнаруживается в прорастающих семенах подсолнечника и необжаренных зернах кофе. Определена она в какао-бобах, где также присутствует и неохлорогеновая (кофеил-5-хинная) кислота.
• Кумарин — бесцветное кристаллическое вещество с приятным запахом, напоминающим запах сена. Чистый кумарин и цветы донника, в которых он содержится в основном в виде гликозидов, используются как ароматизаторы, чаще в парфюмерной промышленности.
Группа Сб — С3 — Сб-соединений особенно разнообразна. Фенольные соединения, относящиеся к этой группе, называются также флавоноидами. В молекуле фла - воноида содержится два бензольных ядра и одно гетероциклическое, содержащее кислород (называемое пирановым). Флавоноиды — производные флавана — в зависимости от степени окисленности (или восстанов - ленности) гетероциклического фрагмента могут быть разбиты на шесть основных подгрупп: катехины, лей - коантоцианы, флаваноны, антоцианы, флавоны и фла - вонолы [28, 32, 39]. Отдельные группы флавоноидов отличаются друг от друга по 'степени окисленности трех - углеродного фрагмента. Химическим путем (окислением или восстановлением) возможно осуществить переход от одной группы флавоноидов к другой. Большое разнообразие природных флавоноидов обусловлено как их строением, наличием асимметрических атомов углерода, так и способностью большинства из них образовывать гликозиды с моно-, ди - и даже трасахаридами. Отдельные группы флавоноидов значительно отличаются друг от друга по свойствам и биологической активности-
| ОН
R = H иди ОН |
| ОН
|
«Катехины — наиболее восстановленная группа фла - воноидных соединений.-Их строение может быть изображено так
'Сатин ОН
^Лаг°Даря наличию в молекуле двух асимметричес - х атомов углерода катехины встречаются в четырех
|
(-) - Эпикатехин |
Несколько реже встречаются в растениях (—)-эпи - галлокатехин и (+ )-галлокатехин (R = OH; R' = H). Характерной особенностью катехинов является образование зфиров с галловой кислотой (R'-галлоил): катехин - галлатов и галлокатехингаллатов.
Катехины представляют собой бесцветные кристаллические вещества, легко окисляющиеся и склонные к полимеризации. Они широко распространены в растениях, содержатся во многих съедобных плодах и ягодах (яблоки, груши, вишня, айва, персики, абрикосы, ежевика, земляника, брусника, смородина, рябина, виноград, малина и др.). Особенно богаты катехинами молодые побеги чайного растения, используемые для изготовления чая, а также нестандартное чайное сырье, из которого готовят натуральные чайные красители. В чайных побегах обнаружены в основном (—)-эпикатехин, (±)-катехин, (—)-эпигаллокатехин, (±)-галлока - техин, (—)-эпикатехингаллат, (—)-эпигаллокатехин-
Галлат, (—)-галлокатехингаллат и кверцетин {16, 18, 25, 28].
Окислительные превращения катехинов играют
Важную роль в производстве ряда пищевых продуктов:
Вина, чая, какао, шоколада и шоколадных изделий
| Ющие формулы: эпикатехин, имеющие следу- |
И т. п. [27, 76]. Обусловлено это тем, что продукты окис - 12
Ления катехинов обладают характерным приятным слабовяжущим вкусом и определенной окраской. В какао - бобах обнаружены наряду с антоциановымн пигментами, иеохлорогеновой кислотой и лейкоцианидинами (—)-эпикатехин и ( + )-катехин [76, 93, 94].
В разных органах виноградной лозы содержатся (+) - катехин, ( + )-катехин, (±)-галлокатехин, (—)-гал - локатехин, ( + )-эпикатехингаллат. В семенах винограда наряду с указанными веществами были идентифицированы еще (±)-эпикатехингаллат и (—)-эпикатехин [70]. Количество катехинов в семенах и гребнях больше, чем в мякоти и кожице ягод винограда.
В винах найдены (±) катехин, (—)-эпикатехин, (—)-эпикатехингаллат [21, 27, 48].
Многие флавоноидные соединения обладают Р-ви - таминной активностью. Они укрепляют кровеносные капилляры, увеличивают их упругость и нормализуют проницаемость. Исследованиями А. Л. Курсанова и М. И. Запрометова показано, что это свойство присуще и катехинам, которые обладают наиболее высоким Р-вн - таминным действием по сравнению с другими флавоно - идными соединениями [28, 40].
Катехины наряду с лейкоантоцианамп являются родоначальниками конденсированных дубильных веществ.
> Лейкоантоцианы — неустойчивые соединения, лишь в единичных случаях были выделены в кристаллическом виде. При обработке разбавленными минеральными кислотами переходят в окрашенные антоцианидины. Впервые лейкоантоцианы изучал в 1914 г. создатель хроматографического метода М. С. Цвет, который установил их широкое распространение в растениях. Наиболее часто в растениях обнаруживается лейкоциани - Дин:
|
|
Плодах различных видов цитрусовых, и имеют следующее строение:
Д'
|
|
НО
|
|
| R,= R,' = Н - пеларгоиидин, (<=ОН; R'=H-циашдин, R = R'=ОН - вепыришдин, R = Rr = OC \\3-ма/іь5иіїин |
Он о
= ОН R,'= Н —нарингенин, ^~0\\—эрипдиктол. R=OCh4; \(=ОН-геслеритин
Содержатся они обычно в тканях растений в виде 7-моно - и ди-гликозидов следующих трех агликоиов: иарингенина (TR'= ОН; R' = Н), эриодиктиола (R = = R' = ОН) и гесиеретина (R = ОСН3; R' = ОН). Например, в кожуре грейпфрута присутствует 7-рамноглю - хозид иарингенина — нарингин, а в кожуре апельсина и мандарина — 7/-рамноглюкозид гесперетина — геспери - дин. Нарингин имеет горький вкус, гесперидин — нет. Вкус горечи зависит от строения сахарного остатка [391 Антоциаиы — красящие вещества цветочных лепестков различных растений, всевозможных плодов и ягод. Они окрашивают растительные ткани, плоды, ягоды, листья, лепестки цветов в самые разнообразные цвета я оттенки — от розового, красного, синего до черно-фи - юлетового. Строение антоцианов установлено в 1913— 1916 гг. немецким химиком Р. Вилыитеттером. Все они содержат в гетероциклическом кольце четырехвалентный кислород (оксоний) и поэтому легко образуют соли, например, хлориды. Строение некоторых из антоцианов следующее:
В тканях растений (в вакуолях клеток) ангоцианы содержатся, как правило, в виде гликозидов.
Агликоны антоцианов называют антоцианидинами. В растениях из антоцианидинов наиболее широко распространен цианидин. Например, красящее вещество василька цианин представляет собой 3,5-диглюкозид цианидина. В состав красящих веществ плодов вишни, сливы, земляники, винограда, брусники и других ягод входят гликозиды цианидина. В одном и том же растении очень часто встречается целая серия антоцианов, построенных на основе одного или нескольких антоцианидинов. Так, в цветах и клубнях картофеля обнаружено до 10 антоцианов [39].
Антоциановая пигментация растительных клеток зависит от многих факторов. Важнейшими из них являются следующие три: комплексообразование с ионами металлов (соли калия обусловливают пурпурную окраску, соли кальция и магния — синюю), строение антоци - аниднна (метилирование придает окраске красные тона) н адсорбция на полисахаридах. На интенсивность п разнообразие окраски большое влияние оказывают содержание кислот и величина рН. Одни и те же анто - цианы в кислой среде дают красную окраску, при под - щелачивании — голубую, а в сильнощелочной среде — зеленоватую.
Наиболее часто в природе антоциановые пигменты окрашивают цветы, плоды и особенно ягоды в красные цвета разных оттенков и интенсивности. Это и послужило основным поводом для разработки способов получения натуральных красных пищевых красителей из растительного сырья (104].
|
ОН О |
| R = R—Н — апигенин, R = ОН; R' = Н-лютео/шн, Ъ=\(=ОС\\г-трицин |
• Флавоны — вещества, имеющие желтую окраску. В растениях обычно встречаются в виде гликозидов. Имеют следующее строение:
Эти агликоны наиболее распространены в растительном мире. Так, в петрушке, цветах хризантемы, в плодах кислого апельсина (Citrus aurantium) обнаружен апигенин, в пшенице и рисе — трицин.
Флавонолы — наиболее широко распространенные в растениях желтые красящие вещества. Образуют множество разнообразных глнкозидов, чаще всего являющихся производными агликонов: кемпферола (R = — R' = Н), кверцетина ("R = ОН; R' = Н) и мирицети - на (TR'=R'=OH)- Строение флавонолов следующее:
|
ОН О R — Н —кемпферол, Ц= ОН; R'=Н—кдериетан, R = R = ОН — мирииетин |
Из листьев чая выделен 3-глюкозид кемпферола ас - трагалин и 3-рамнозид кверцетина кверцитрин. Последний содержится в ягодах винограда - 3-рамноглюкозид кверцетина рутин встречается в растениях очень часто (28, 39].
Основу красящих веществ большинства натуральных красных красителей, как уже отмечалось, составляют антоцианы, широко распространенные в растительном мире. Пигменты красного цвета содержатся в разнообразных частях многих растений: в лепестках цветов, ягодах, корнеплодах и т. п. Сырьем для получения натуральных красных пищевых красителей в большинстве случаев служат ягоды культивируемых и дикорастущих растений, лепестки цветков отдельных видов растений, некоторые корнеплоды. Из ягод непосредственно перерабатываются на краситель в основном несъедобные в сыром виде и не используемые в производств"5 соков, вина и других продуктов питания. В этих случаях для приготовления красителя используют сок ягод. Например, натуральные красные красители получают кз сока ягод бузины, вороники и т. п.
В большинстве случаев красные красители получают из выжимок соответствующих ягод, остающихся при переработке их на соки или вино на консервных и винодельческих заводах. Так получают красители из выжимок темных сортов винограда, черноплодной рябины, черной смородины, черники и т. п.
Натуральный красный пищевой краситель получают также из сока столовой свеклы, красный цвет которой обусловлен наличием в ней азотсодержащих пигментов пирроловой природы — бетацианов. Из лепестков цветов получают натуральные красные красители, основу которых также составляют антоциановые пигменты. Они обладают индикаторными свойствами.
Характер и интенсивность окраски антоциановьгх пигментов изменяется в зависимости от реакций среды. В кислых растворах антоцианьг образуют истинные соли, в которых носителем красной окраски является катион флавилия. При уменьшении концентрации водородных ионов снижается и интенсивность окраски, которая при рН>8 переходит в фиолетовую, и при дальнейшем подщелачивании до рН 11 раствор окрашивается в синий цвет. Эти изменения цвета раствора обусловлены происходящими в молекуле антоцианов структурными изменениями под влиянием реакции среды.. Возникновение фиолетовой окраски по мере смещения рН среды в щелочную сторону связано с образованием основания красящего пигмента. Поэтому активная кислотность— величина рН натуральных красных пищевых красителей должна быть не более 3,5. Для получения интенсивных красных тонов окрашиваемые анто - циановьгми красителями пищевые изделия должны иметь кислую реакцию или в процессе окрашивания их следует подкислять.
^Способы пол
msd.com.ua
ИСПОЛЬЗОВАНИЕ РАСТИТЕЛЬНЫХ ПИГМЕНТОВ И ПИЩЕВЫХ КРАСИТЕЛЕЙ В ЖИЗНИ ЧЕЛОВЕКА
Транскрипт
1 ИСПОЛЬЗОВАНИЕ РАСТИТЕЛЬНЫХ ПИГМЕНТОВ И ПИЩЕВЫХ КРАСИТЕЛЕЙ В ЖИЗНИ ЧЕЛОВЕКА Л. Г. Колосова, учитель биологии и химии МБОУ СОШ 13, г. Йошкар-Ола Одним из направлений деятельности кружка «Юный эколог» и экологического клуба «Венерин башмачок» являются исследовательские работы и экологические проекты. На занятиях учащиеся сначала получают теоретические знания по программе «Проектная деятельность учащихся». I этап знакомство с основными направлениями исследований по экологии в тесной связи с химией, биологией, биохимией. II этап выполнение учащимися минипроектов с отработкой таких разделов: цель, задачи, актуальность и практическая значимость, новизна работы, гипотеза, обзор литературы; методика и методы исследования; результаты работы и их обсуждение; выводы; заключение; приложение. III этап составление проекта на основе конкретного проведенного исследования, включая обзор литературы. Интеграция экологии с химией хорошо прослеживается в работе Ольги Белоножкиной о растительных пигментах. Цель: показать области применения пигментов человеком. Задачи: 1. Экспериментально доказать чем обусловлен белый цвет лепестков цветков. 2. Получить краситель из луковой шелухи с последующим окрашиванием пряжи. 3. Изготовить самодельную индикаторную бумагу из вытяжки листьев краснокочанной капусты. 4. Показать использование пищевых красителей в жевательных резинках и их воздействие на организм человека. Практическая значимость: 1. Возможность получения натуральных красителей из растительного материалов. 2. Возможность определения ph растворов различных бытовых веществ и кислотности почвы самодельной индикаторной бумагой из вытяжки растений. 1. Изучение растительных пигментов. 2. Растительные пигменты это органические вещества. 3. Классификация растительных пигментов. 1. Бетулин белый красящий пигмент. 2. Антоцианы розовые, сиреневые, синие, фиолетовые пигменты. 3. Флавоны и флавонолы жёлтые пигменты. 4. Каротиноиды желтые, оранжевые, краснокоричневые цвета. 5. Меланины черно-коричневые пигменты. 6. Хлорофилл самый главный пигмент растений. 4. Функции пигментов в жизни растений. 5. Использование красителей в составе пищевых добавок. Отличительные свойства некоторых природных и синтетических красителей указаны в таблице 1. Название красителя Отличительное свойство Таблица 1 1. Рибофлавин (Е101) Водорастворимый витамин желтого цвета. Содержится в молочных и мясных продуктах, овощах, курином желтке, пивных дрожжах. Синтезируется микроорганизмами и растениями. Животные и человек должны получать рибофлавин с пищей. Недостаток рибофлавина приводит к поражениям кожи, нарушению зрения, хроническим гастритам и коликам 2. Кармин (Е120) Красный краситель, добываемый из тел бескрылых тел самок насекомых кошенили. Используется для окраски гистологических препаратов, как пищевой (ликероводочные, кондитерские, молочные продукты) и парфюмерный краситель 3. В-каротин (Е160а) Природный пигмент желтого или оранжевого цвета. Синтезируется некоторыми организмами и всеми растениями, в клетках которых участвует в фотосинтезе и процессах, связанных с поглощением света. Обусловливает окраску плодов, осенней листвы, колоний ряда микробов. В организме животных и человека из каротинов, поступающих с пищей, образуется витамин А ХИМИЯ. ВСЁ ДЛЯ УЧИТЕЛЯ! 23
2 АААААААААААААААА Название красителя Отличительное свойство 4. Антоцианы (Е163) Красящие вещества (пигменты) растений красного, синего и фиолетового цвета, растворенные в клеточном соке. Наряду с другими пигментами определяют окраску плодов, цветков, листьев 5. Индигокармин (Е132) Синие кристаллы, плохо растворимы в воде. Получают нагреванием индиго с концентрированной серной кислотой. Используют в кондитерских изделиях, кремах для тортов, напитках 6. Хлорофилл (Е140) Зеленый пигмент растений, содержащий в хлоропластах. По химическому строению сложное циклическое соединение порфирин, в состав молекулы которого входит атом Mg. В процессе фотосинтеза поглощает световую энергию и превращает ее в энергию химических связей органических соединений. Применяют для окраски масел, жиров, йогуртов, мороженого 7. Диоксид титана () Бесцветные кристаллы, химически очень стоек. Применяют в качестве отбеливающего вещества при производстве жевательной резинки, в качестве наполнителя при производстве сухих напитков некоторых видов. Пигмент, наполнитель в производстве лакокрасочных материалов, пластмасс, бумаги Среди пищевых красителей, как природного, так и синтетического происхождения, встречаются опасные для здоровья красители. Сведения о них приведены в таблице 2. Название пищевых красителей Знак воздействия Результат воздействия на организм Таблица 2 Е102 тартразин О Опасный. Вызывает приступы астмы. Запрещен в ряде стран Е103 алканин З Запрещенный, рост злокачественных опухолей Е104 желтый хинолиновый П Подозрительный, вызывает дерматит. Запрещен в ряде стран Е110 желтый «солнечный закат» О Опасный. Может вызывать аллергические реакции, тошноту. Запрещен в ряде стран Е120 кошениль кармины О Опасный. Здравоохранительные организации советуют избегать его Е121 цитрусовый красный З Запрещен в России! Рост злокачественных опухолей Е122 азорубин П Подозрительный, запрещен в ряде стран. Канцероген Е123 амарант ОО, З Очень опасный, запрещенный в России и ряде стран! Вызывает пороки развития у плода, злокачественные опухоли Е124 кошенилевый красный О Опасный. Запрещен в ряде стран. Канцероген. Провоцирует приступы астмы Е125 понсо пунцовый З Запрещенный. Считается канцерогеном. Рост злокачественной опухоли! Е127 эритрозин О Опасный. Запрещен в ряде стран. Может вызывать гиперактивность щитовидной железы Е129 красный очаровательный О Опасный. Канцероген. Запрещен в ряде стран Е131 синий патентованный Р Ракообразующий. Запрещенный. Канцероген Е142 зеленый Р Ракообразующий. Запрещен в ряде стран. Канцероген Е151 черный блестящий ВК Вреден для кожи. Запрещен в ряде стран. Канцероген Е-153 уголь растительный Р Ракообразующий. Запрещен в США. Канцероген Е154 коричневый РК, РД Кишечные расстройства, повышает артериальное давление. Канцероген Е155 коричневый НТ О Опасный. Запрещен в ряде стран. Канцероген Е160 ликопин ВК Вреден для кожи 24 ХИМИЯ. ВСЁ ДЛЯ УЧИТЕЛЯ!
3 Название пищевых красителей Знак воздействия Результат воздействия на организм Е141 медные комплексы хлорофиллов П Подозрительный Е152 уголь З Запрещенный диоксид титана П Подозрительный Е173 алюминий П Подозрительный Е180 рубиновый литол ВК О Опасный Серые кардиналы: Е103, Е105, Е121, Е123, Е125, Е126, Е130, Е131, Е142, Е153 красители. Содержатся в сладкой газированной воде, леденцах, цветном мороженом. Опасность: образование злокачественных опухолей. Е173 красители. Содержатся в леденцах, цветном мороженом. Опасность: заболевания печени и почек. 6. Красители в жевательных резинках. 7. Влияние жевательной резинки на организм человека. III. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Материалами исследования являлись растительные материалы: лепестки белого цветка фиалки, листья краснокочанной капусты, луковая шелуха. Методика получения растительных красителей и самодельной индикаторной бумаги взята из журнала «Биология» ( 6 за 2010 год). IV. РЕЗУЛЬТАТЫ РАБОТЫ И ИХ ОБСУЖДЕНИЕ Чтобы выявить, чем обусловлен белый цвет лепестков цветов (на примере белой хризантемы), были проведены следующие опыты: Удалили воздух из межклетников. Это можно сделать несколькими способами. 1-й способ. Погрузили лепестки в воду. Через час, когда вода через устьица проникнет в межклетники, лепестки станут бесцветным. 2-й способ. Лепестки помещали в шприц (без иглы) и заполняли водой. Установив шприц наконечником вверх, задвигали поршень, чтобы вытеснить воздух. После этого закрывали пальцем отверстие наконечника и отводили поршень вниз. В результате создавшегося разрежения из лепестков в воду начали выделяться пузырьки воздуха. Через 1 2 мин воздух из межклетников вышел. Вновь вдвигали поршень в шприц вода поступала в межклетники, и лепесток становился прозрачным. Вывод: белый цвет лепестков цветов обусловлен развитой системой межклетников в сочетании с клетками, лишенными пигментов. Белый цвет им придает воздух. 1. Натуральные красители из растительного сырья Яркие краски растительного мира радуют наш глаз и доставляют эстетическое наслаждение. Но люди находят растительным краскам и утилитарное применение. Индиго, хна, басма, ализари (ализарин, мареновый корень) названия этих натуральных красителей известны всем. Да и другие краски издревле получали из растительного сырья. В средней полосе России, например, для окрашивания волокон и тканей в желтый цвет использовали цмин песчаный, череду трехраздельную, пупавку красильную, василек луговой, ястребинку зонтичную. В зеленые, коричневые, болотные тона окрашивает шерсть экстракт из наземной части зверобоя продырявленного; в желтые, зеленые, коричневые вытяжка из корней укропа огородного; желтый краситель получают из молодых листьев березы. 2. Получение красителя из луковой шелухи Экстракт шелухи лука широко применяется для окрашивания пищевых продуктов и тканей в желто-коричневый цвет. Для работы понадобится сульфат железа(ii). 1) 100 г луковой шелухи залили на 30 мин 1 л теплой воды, добавили 1 чайную ложку питьевой соды и прокипятили 1,5 ч на слабом огне, слегка помешивая. а) Ингредиенты. б) Первоначальный экстракт. ХИМИЯ. ВСЁ ДЛЯ УЧИТЕЛЯ! 25
4 АААААААААААААААА 2) Экстракт слили, а шелуху лука еще раз залили небольшим количеством воды и кипятили в течение часа. Снова слили экстракт, смешали с полученной ранее порцией; готовый экстракт отстаивался. 3) Смешанный экстракт. Для получения стойкого окрашивания нужно использовать протравитель (1 г сульфата железа на 2 л воды). Окраску можно провести несколькими способами, но остановимся на одном с предварительным протравливанием. Окрашиваемый материал прокипятили мин в растворе протравителя, затем переложили в холодный раствор красителя и прокипятили мин. 4) Первоначальная пряжа. 5) Раствор протравителя с пряжей. 6) Холодный раствор красителя с пряжей. 7) Полученный материал. При кипячении в экстракте из луковой шелухи материал постепенно окрасится в темнокоричневый цвет. Другие варианты окрашивания с помощью растительных материалов приведены в таблице 3. Источник красителя Молодые листья березы Хвоя ели Опавшие листья липы Протравитель Дихромат калия Медный купорос (сульфат меди(ii)) Медный купорос Таблица 3 Цвет окрашенного материала Оливковожелтый Зеленый Желтый 3) Использование растительных пигментов в медицине 4) Меланиновые пигменты сильные антиоксиданты 5) Хна как бактерицидное средство 6) Растительные биофлавоноиды биологически активные вещества 7) Использование растительных пигментов в кулинарии 8) Изготовление самодельной индикаторной бумаги На основе растительных пигментов можно изготовить индикаторную бумагу. Для этого взяли г листьев краснокочанной капусты и измельчили в ступке с небольшим количеством промытого песка и 5 мл воды. Отфильтровали. 1) Листья краснокочанной капусты. 2) Измельчили в ступке. 3) Отфильтровали. Фильтрат разделили на две части. Из одной части фильтрата приготовили индикаторную бумагу для определения ph растворов в кислой среде. В полученный фильтрат опустили полоски (5 6) из белой фильтровальной бумаги. Пропитанные этой вытяжкой полоски просушили. После высыхания индикаторная бумага приобрела синий цвет. 4) Пропитанные полоски (ph в кислой среде). По шкале можно точно определить ph раствора в кислой среде. Для приготовления индикатора на щелочь в вытяжку добавили 1 2 капли уксуса до появления окраски. Пропитываем 5 6 полосок фильтровальной бумаги. Получилась красная индикаторная бумага для определения ph растворов в щелочной среде. 5) Пропитанные полоски (ph в щелочной среде). Вывод: индикаторные свойства красителя из краснокочанной капусты сходны с лакмусом: область перехода окраски лежит в интервале ph Для более точного определения ph раствора нужно составить цветную шкалу изменений окраски этого индикатора. Полученную индикаторную бумагу можно использовать для определения ph различных веществ и кислотности почвы (табл. 4). Таблица 4 Вещество Цвет индикатора ph среды Чистящий порошок Светло-синий 8 «Тайд» Чистящее средство Не изменился 7 «Lock» Мыло «Детское» Светло-синий 8 9 Мыло «Dove» Не изменился 7 Парацетамол Красный 4,5 9) Определение наличия красителей в жевательных резинках Для определения наличия красителей в жевательных резинках были изучены обертки от семи видов жевательных резинок разных производителей (табл. 5). 26 ХИМИЯ. ВСЁ ДЛЯ УЧИТЕЛЯ!
5 Название кондитерских изделий Индекс Значение индекса 1. Orbit, жевательная резинка без сахара с ароматом мяты. Беларусь, Минск 2. Eclipse, ледяная мята с антибактериальными свойствами. Санкт-Петербург Е102 Е133 Краситель: диоксид титана Краситель: диоксид титана. Краситель: синий блестящий Таблица 5 3. Center Fruit. Россия, Тульская область Е110 Краситель: оранжево-желтый 4. Fruit Boll. Тульская область Е102 Е110 Е122 Е124 Е133 Е Life is Life. Санкт-Петербург Е102 Е132 Краситель: оранжево-желтый Краситель: азорубин. Краситель: пунцовый. Краситель: синий блестящий. Краситель: зеленый. Краситель: диоксид титана Краситель: индиготин 6. Stimorol. Минск, Беларусь Краситель: диоксид титана 7. Orbit мятный. Санкт-Петербург Краситель: диоксид титана Из таблицы следует, что наибольшее число красителей содержит жевательная резинка Fruit Boll (производитель Тульская область): Е102, Е110, Е122, Е133, Е142,. При постоянном употреблении она может вызвать необратимые изменения в организме человека (приступы астмы, аллергические реакции, рак), дерматит. Наименьшее число красителей содержат жевательные резинки: Stimorol, мятный мороз (производитель: Минск, Беларусь). Orbit, жевательная резинка без сахара с ароматом мяты (производитель: Минск). диоксид титана необходим для придания резиновой массе снежно-белого цвета. V. ВЫВОДЫ ПО РАБОТЕ В ходе проведенной работы можно сделать следующие выводы: 1. Экспериментально доказано, что белый цвет лепестков хризантемы обусловлен развитой системой межклетников. 2. Экспериментально доказаны области применения растительных пигментов. а) Был получен краситель из луковой шелухи с последовательным окрашиванием пряжи; в качестве протравителя для усиления окрашивания использовали сульфат железа(ii). б) Из вытяжки листьев краснокочанной капусты была изготовлена самодельная индикаторная бумага на кислоту и щелочь. Впоследствии она использовалась для определения ph среды растворенных бытовых веществ. 3. Была изучена информация на оберточных жевательных резинках на наличие в них пищевых красителей. Литература 1. Артамонов В. И. Занимательная физиология растений. М.: Агропромиздат, Бердоносов С. С., Бердоносов П. С. Справочник по общей химии. М.: АСТ: Астрель, Головко Т. К. Дыхание растений (физиологические аспекты). СПб.: Наука, Детская энциклопедия. М.: Академия педагогических наук РСФСР, Заленский О. В. Эколого-физиологические аспекты изучения фотосинтеза // Тимирязевские чтения. Л.: Наука, Вып с. 6. Лебедева Т. С., Сытник К. М. Пигменты растительного мира. К.: Наукова думка, Ольгин О. Опыты без взрыва. М.: Химия, Петрухина А. Из чего мы состоим? Из того, что мы едим // Наука и жизнь С Пчелов А. М. Природа и ее жизнь. Л.: Жизнь, Эткинс П. Молекулы. М.: Мир, ХИМИЯ. ВСЁ ДЛЯ УЧИТЕЛЯ! 27
docplayer.ru
Пигменты зеленого листа, их строения и химические свойства.
Количество просмотров публикации Пигменты зеленого листа, их строения и химические свойства. - 1189
Растительные пигменты - ϶ᴛᴏ крупные органические молекулы, поглощающие свет определенной длины волны. Важнейшую роль в процессе фотосинтеза играют зеленые пигменты — хлорофиллы. Французские ученые П.Ж. Пелетье и Ж. Кавенту (1818) выделили из листьев зеленое вещество и назвали его хлорофиллом (от греч. ʼʼхлоросʼʼ — зеленый и ʼʼфиллонʼʼ — лист). Сегодня известно около десяти хлорофиллов. Οʜᴎ отличаются по химическому строению, окраске, распространению среди живых организмов. У всех высших растений содержатся хлорофиллы а и b. Хлорофилл с обнаружен в диатомовых водорослях, хлорофилл d — в красных водорослях. Вместе с тем, известны четыре бактериохлорофилла (a, b, c и d), содержащиеся в клетках фотосинтезирующих бактерий. В клетках зеленых бактерий имеются бактериохлорофиллы с и d, в клетках пурпурных бактерий — бактериохлорофиллы а и b. Основными пигментами, без которых фотосинтез не идет, являются хлорофилл а для зеленых растений и бактериохлорофиллы для бактерий. Впервые точное представление о пигментах зеленого листа высших растений было получено благодаря работам крупнейшего русского ботаника М.С. Цвета (1872—1919). Он разработал новый хроматографический метод разделения веществ и выделил пигменты листа в чистом виде. Хроматографический метод разделения веществ основан на их различной способности к адсорбции. Метод данный получил широкое применение. М.С. Цвет пропускал вытяжку из листа через стеклянную трубку, заполненную порошком — мелом или сахарозой (хроматографическую колонку). Отдельные компоненты смеси пигментов различались по степени адсорбируемости и передвигались с разной скоростью, благодаря чему они концентрировались в разных зонах колонки. Разделяя колонку на отдельные части (зоны) и используя соответствующую систему растворителей, можно было выделить каждый пигмент. Оказалось, что листья высших растений содержат хлорофилл а и хлорофилл b, а также каротиноиды (каротин, ксантофилл и др.). Хлорофиллы, так же как и каротиноиды, нерастворимы в воде, но хорошо растворимы в органических растворителях. Хлорофиллы а и b различаются по цвету: хлорофилл а имеет сине-зеленый оттенок, а хлорофилл b — желто-зеленый. Содержание хлорофилла а в листе примерно в три раза больше по сравнению с хлорофиллом b.
По химическому строению хлорофиллы — сложные эфиры дикарбоновой органической кислоты — хлорофиллина и двух остатков спиртов — фитола и метилового. Эмпирическая формула — C55H7205N4Mg. Хлорофиллин представляет собой азотсодержащее металлорганическое соединение, относящееся к магнийпорфиринам.
В хлорофилле водород карбоксильных групп замещен остатками двух спирит — метилового СН3ОН и фитола С20Н39ОН, в связи с этим хлорофилл является сложным эфиром. На рисунке дана структурная формула хлорофилла а. Хлорофилл b отличается тем, что содержит на два атома водорода меньше и на один атом кислорода больше (вместо группы СН3 группа СНО). В связи с этим молекулярная масса хлорофилла а — 893 и хлорофилла b — 907. В 1960 ᴦ. Г.Б. Вудворд осуществил полный синтез хлорофилла. В центре молекулы хлорофилла расположен атом магния, который соединен четырьмя атомами азота пиррольных группировок. В пиррольных группировках хлорофилла имеется система чередующихся двойных и простых связей. Это N есть хромофорная группа хлорофилла, предопределяющая поглощение определённых лучей солнечного спектра и его окраску. Диаметр порфиринового ядра составляет 10 нм, а длина фитольного остатка — 2 нм. Расстояние между атомами азота пиррольных группировок в ядре хлорофилл составляет 0,25 нм. Интересно, что диаметр атома магния равен 0,24 нм. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, магний почти полностью заполняет пространство между атомами азота пиррольных группировок. Это придает ядру молекулы хлорофилла дополнительную прочность.
Еще К.А. Тимирязев обратил внимание на близость химического строения двух важнейших пигментов: зеленого — хлорофилла листьев и красного — гемина крови. Действительно, в случае если хлорофилл относится к магнийпорфиринам, то гемин — к железопорфиринам. Сходство это не случайно и служит еще одним доказательством единства всего органического мира. Одной из специфических черт строения хлорофилла является наличие в его молекуле помимо четырех гетероциклов другой циклической группировки из пяти углеродных атомов — циклопентанона. В циклопентановом кольце содержится кетогруппа, обладающая большой реакционной способностью. Есть данные, что в результате процесса энолизации по месту этой кетогруппы к молекуле хлорофилла присоединяется вода. Молекула хлорофилла полярна, ее порфириновое ядро обладает гидрофильными свойствами, а фитольный конец — гидрофобными. Это свойство молекулы хлорофилла обусловливает определенное расположение ее в мембранах хлоропластов. Порфириновая часть молекулы связана с белком, а фитольная цепь in пружена в липидный слой.
Извлеченный из листа хлорофилл легко реагирует как с кислотами, так и со щелочами. При взаимодействии со щелочью происходит омыление хлорофилла, благодаря чему образуются два спирта и щелочная соль кислоты хлорофиллина. В интактном живом листе от хлорофилла может отщепляться фитол под воздействием фермента хлорофиллазы. При взаимодействии со слабой кислотой извлеченный хлорофилл теряет зеленый цвет, образуется соединение феофитин, у которого атом магния в центре молекулы замещен на два атома водорода. Хлорофилл в живой интактной клетке обладает способностью к обратимому фотоокислению и фотовосстановлению. Способность к окислительно-восстановительным реакциям связана с наличием в молекуле хлорофилла сопряженных двойных связей с подвижными л-электронами и атомов азота с неподеленными электронами. Азот пиррольных ядер может окисляться (отдавать электрон) или восстанавливаться (присоединять электрон).
Исследования показали, что свойства хлорофилла, находящегося в листе и извлеченного из листа͵ различны, так как в листе он находится в комплексном соединении с белком. Это доказывается следующими данными:
1. Спектр поглощения хлорофилла, находящегося в листе, иной по сравнению с извлеченным хлорофиллом.
2. Хлорофилл невозможно извлечь абсолютным спиртом из сухих листьев. Экстракция протекает успешно, только если листья увлажнить или к спирту добавить воды, которая разрушает связь между хлорофиллом и белком.
3. Выделенный из листа хлорофилл легко подвергается разрушению под влиянием самых разнообразных воздействий (повышенная кислотность, кислород и даже свет).
Между тем в листе хлорофилл достаточно устойчив ко всем перечисленным факторам. Следует отметить, что хотя крупный русский ученый В. Н. Любименко и предлагал данный комплекс назвать хлороглобином, по аналогии с гемоглобином, связь между хлорофиллом и белком иного характера, чем между гемином и белком. Для гемоглобина характерно постоянное соотношение — на 1 молекулу белка приходится 4 молекулы гемина. Между тем соотношение между хлорофиллом и белком различно и претерпевает изменения исходя из типа растений, фазы их развития, условий среды (от 3 до 10 молекул хлорофилла на 1 молекулу белка). Связь между молекулами белка и хлорофиллом осуществляется путем нестойких комплексов, образующихся при взаимодействии кислотных групп белковых молекул и азота пиррольных колец. Чем выше содержание дикарбоновых аминокислот в белке, тем лучше идет их комплексирование с хлорофиллом (Т.Н. Годнев). Белки, связанные с хлорофиллом, характеризуются низкой изоэлектрической точкой (3,7—4,9). Молекулярная масса этих белков порядка 68 кДа. Вместе с тем хлорофилл может взаимодействовать и с липидами мембран. Важным свойством молекул хлорофилла является их способность к взаимодействию друг с другом. Переход из мономерной в агрегированную форму возник в результате взаимодействия двух и более молекул при их близком расположении друг к другу. В процессе образования хлорофилла его состояние в живой клетке закономерно меняется. При этом и происходит его агрегация (АА. Красновский). Сегодня показано, что хлорофилл в мембранах пластид находится в виде пигментлипопротеидных комплексов с различной степенью агрегации.
referatwork.ru
Проект – исследование на тему: «Изучение свойств растительных пигментов».
Муниципальное бюджетное образовательное учреждение
«Буранная СОШ»
Изучение свойств растительных пигментов
Работу выполнила ученица 8 класса
Вдовкина Дарья
Руководитель
учитель экологии и биологии
Вдовкина Ольга Владимировна
Буранное
2014 г.
Содержание
Введение.
Основная часть:
Что такое «пигмент»? Какие бывают пигменты?
Практическая часть работы.
Какие пигменты составляют окраску листа?
При каком освещении желтеют листья?
Необходимость кислорода для разрушения хлорофилла.
Влияние на хлорофилл химических веществ.
Воздействие на пигмент хлорофилл высокой температуры.
Выводы.
Список литературы и Интернет-ресурсов.
Приложения.
Введение
Природа обладает удивительным многоцветием. Мы не устаем восхищаться красотой окружающего растительного мира. Весной мы с надеждой смотрим на нежно-зеленые молодые листочки деревьев, а желто-оранжевая цветовая гамма осеннего леса навевает грусть и печаль по ушедшему лету. Кто не восхищался красками цветущего луга, лесной опушки, осенней листвы, даров сада и огорода? Я думаю, что каждый ребенок, как только он начинает изучать окружающий мир, задает себе вопросы: «Почему листья зеленые? Почему они осенью желтеют или краснеют? Почему лепестки ромашки белые, а розы - красные? Почему окружающие растения окрашены именно так, а не иначе, как возникает такое богатство цветов и оттенков? Что для природы значат эти цвета?» Меня заинтересовали эти вопросы, надеюсь, что моя работа поможет на них ответить.
Цель моей работы – выяснить, от чего зависит цвет растения.
Задачи, которые я перед собой поставила:
Изучить литературу с целью выяснить, какие вещества придают органам растения различную окраску.
Провести несколько практических опытов с целью выявления особенностей этих веществ.
Что такое «пигмент»? Какие бывают пигменты?
Изучив специальную литературу, я выяснила, что окраску различным органам растений придают особые вещества – пигменты. Это органические соединения, присутствующие в клетках и тканях растений и окрашивающие их. Многие из них важны для фотосинтеза. Расположены пигменты в пластидах клетки – хлоропластах и хромопластах, некоторые находятся в клеточном соке растений.
Существует несколько основных групп растительных пигментов:
Самыми распространенным растительным пигментом является хлорофилл. Это одно из самых важных на Земле красящих веществ. Название хлорофилла идет от греческих слов «хлорос» - зеленый и «филлон» - лист. Хлорофилловые пластиды зеленые. Зеленый цвет – цвет жизни. Зеленые «фабрики» вокруг нас поддерживают жизнь. Хлорофилл обладает жизненно важной функций: перехват солнечных лучей и преобразование полученной энергии в питательные вещества — простые сахара, которые получаются из воды и углекислого газа. Эти сахара являются основой питания растений — источниками углеводов, необходимых для роста и развития. Во время процесса производства питательных веществ хлорофилл разрушается, так как непрерывно используется. Несмотря на это, в течение сезона роста, растения снова и снова восстанавливают запасы хлорофилла. Большой запас хлорофилла позволяет листьям оставаться зелёными. Возрастные изменения хлоропластов сопровождаются изменением окраски – от салатно-зеленого, разной интенсивности зеленого, до желто-зеленого. Когда он в большом количестве содержится в клетках, что происходит во время периода роста, зелёный цвет хлорофилла преобладает, затмевая цвета любых других пигментов, которые могут содержаться в листе. Поэтому листья летом имеют характерный зелёный цвет.
Флавоны и флавонолы – одни из самых распространенных растительных пигментов. Нет растения, где бы они ни были обнаружены. Долгое время считалось, что эти пигменты характерны только для растительного царства, однако в 90-х годах прошлого века некоторые флавоны были обнаружены и в грибах. На латинском языке «flavus» означает «желтый». В природе флавоны и флавонолы являются основными пигментами, обеспечивающими желтую цветовую гамму плодов и цветов. Много этих красителей и в других органах растений, хотя там желтая окраска маскируется другими пигментами. Разнообразие оттенков желтого цвета достигается как изменением концентрации флавонов и флавонолов, так и присутствием в соке растений солей кальция и магния, увеличивающих интенсивность окраски.
Близки к флавонам по строению другие красители желтого цвета – халконы и ауроны. Встречаются они значительно реже. Среди известных нам растений эти пигменты можно обнаружить в листьях и цветах кислицы, кореопсиса и львиного зева. Как и некоторые люди, эти красители совершенно не переносят курильщиков и краснеют, если их окуривать сигаретным дымом. Отдельного упоминания заслуживают халконы еще и потому, что во многих случаях именно из них в процессе биосинтеза в растениях образуются флавоны, флавонолы и ауроны. Подражая природе, химики применяют халконы для получения разнообразных растительных и искусственных пигментов в лабораторных условиях.
Еще одна группа пигментов, родственная флавонам и флавонолам, носит название антоцианов. Антоцианы, которые ответственны за красные цвета в листьях, не присутствуют в листьях до тех пор, пока в листьях не начнёт снижаться уровень хлорофиллов. Раньше предполагали, что антоцианы просто результат разрушения зелёного хлорофилла, но эта теория уже не считается общепризнанной. Антоциановые пигменты, вызывающие розовую, красную и пурпурную осеннюю окраску листьев, связаны с веществом - углевод (или сахара, крахмала). Так накопление углеводов способствует образованию клеточного сока с пигментами антацина. Антоцианы растворимы в воде и обычно встречаются в клеточном соке.
Каротиноиды – пигменты, которые имеют преимущественно жёлтый или оранжевый цвет. Они всегда присутствуют в листьях, но перекрываются зелёным цветом хлорофилла. Название пигментам этого типа дал ученый М. С. Цвет. В честь одного из пигментов, содержащегося в оранжевых корнях моркови, он назвал весь этот класс красителей каротиноидами («carotte» – морковь). Каротиноиды придают желтый цвет цветам и листьям растений. Желтая, оранжевая и красная окраска кукурузы, тыквы, кабачков и перезрелых огурцов, баклажанов, паслена, помидора, дыни, а также многих цитрусовых обусловлена присутствием в них разнообразных каротиноидных пигментов. Рекордсменом по числу каротиноидных пигментов является стручковый красный перец.
Какие пигменты составляют окраску листа?
Первый опыт проведем с целью выяснить, какие пигменты обеспечивают листьям растения зеленую окраску. Оборудование, необходимое для проведения опыта: свежие листья комнатных растений, 95% -ый этиловый спирт, бензин, ступка фарфоровая, пробирка, воронка, ножницы, фильтровальная бумага.
Ход опыта. Прежде всего, получим вытяжку пигментов. Лучше, если вытяжка будет концентрированной, темно-зеленой. Можно использовать листья любых травянистых растений, а лучше всего теневыносливых комнатных растений - они мяче, легче растираются, содержат больше хлорофилла. К измельченным листьям добавим 5-10 мл этилового спирта, на кончике ножа мел для нейтрализации кислот клеточного сока и разотрем их в фарфоровой ступке до однородной зеленой массы. Подольем еще этилового спирта и осторожно продолжаем растирание, пока спирт не окрасится в интенсивный зеленый цвет. Полученную спиртовую вытяжку отфильтруем в чистую сухую пробирку или колбу.Убедимся в том, что спиртовая вытяжка пигментов помимо зеленых содержит еще и желтые пигменты. Для этого на фильтровальную бумагу нанесем стеклянной палочкой каплю спиртовой вытяжки пигментов листа. Через 3-5 мин на бумаге образуются цветные концентрические круги: в центре зеленый (хлорофилл), снаружи - желтый (каротиноиды) (Приложение 1).
Вывод. Разделение пигментов обусловлено их различной адсорбцией (поглощением в поверхностном слое) на фильтровальной бумаге и неодинаковой растворимостью в растворителе, в данном случае - этиловом спирте. Каротиноиды хуже, по сравнению с хлорофиллом, адсорбируются на бумаге, больше растворимы в спирте, поэтому передвигаются по фильтровальной бумаге дольше хлорофилла.Таким образом, в создании цвета листа участвуют две группы пигментов - зеленые и желтые. Содержание хлорофилла в сформировавшихся листьях примерно в 3 раза выше, чем каротиноидов, поэтому желтый цвет каротиноидов маскируется зеленым цветом хлорофилла. Количественное соотношение хлорофилла и каротиноидов не постоянно, оно зависит от возраста листа, физиологического состояния растения. Если содержание хлорофилла уменьшается, листья приобретают желто-зеленый или желтый цвет.
При каком освещении желтеют листья?
Различные факторы внешней среды (освещенность растений, температура воздуха, водоснабжение) оказывают влияние на окраску листьев. Например, в зависимости от погодных условий цвет листьев клена меняется от желтого до пурпурно-красного.
Цель этого опыта – установить устойчивость хлорофилла в листьях растений без освещения.
Оборудование: для опыта нужны листья любого растения, которые уже закончили рост, но еще не имеют внешних признаков старения, стакан, черный лист бумаги.
Ход опыта. Половину листовой пластинки закрываем с двух сторон черной бумагой. Лист помещаем в стакан с водой и ставим в хорошо освещенное место. Спустя 4-5 дней снимем бумагу, сравним цвет половинок листа. Хорошо заметны различия в окраске: освещенная часть зеленая, а затемненная - желтая.
Вывод: Результаты опыта свидетельствуют, что снижение интенсивности и продолжительности освещения листьев ускоряет распад молекул хлорофилла в хлоропластах. Мы сравнили устойчивость хлорофилла в листьях бадана и традесканции. Самый неустойчивый пигмент в листьях традесканции, он разрушается за 20 дней, а самый устойчивый у фикуса, разрушается через 40 - 50 дней. (Приложение 1)
Необходимость кислорода для разрушения хлорофилла.
Для разрушения хлорофилла необходимо еще одно условие – кислород. Проводимый опыт ставит своей целью доказать, что без кислорода хлорофилл не разрушается или разрушается медленнее.
Оборудование: стакан c водой, лист плотной бумаги, зеленые листья растения.
Ход опыта: Стареющий, но еще сохранивший зеленый цвет лист любого светолюбивого растения опустим в стакан с водой так, чтобы только половина листа его находилась под водой. Для этого закрепим лист в прорези укрывающей стакан плотной бумаги. Стакан поставим в темное место.
Вывод: Через 3 - 5 дней станут заметны различия в окраске листа: находившаяся в воде часть сохранит зеленый цвет, другая - пожелтеет. Уменьшение скорости распада хлорофилла в той части листа, которая находилась в воде, свидетельствует, что в разрушении хлорофилла важную роль играет процесс дыхания. Содержание кислорода в воде намного ниже, чем в воздухе. (Приложение 2)
Влияние на хлорофилл химических веществ.
Как органическое вещество, пигмент хлорофилл должен разрушаться от воздействия различных химических веществ. Цель этого опыта – проверить, как воздействует на хлорофилл соляная кислота.
Оборудование: Для опыта нужны "чернила" - 10%-ая соляная кислота, листья растений, палочка.
Ход опыта: Заостренный конец палочки смочим в соляной кислоте и нанесем на лист рисунок (в нашем случае это смайлик и звездочка). На зеленом фоне листа бегонии постепенно появляется рисунок звездочки бурого цвета. На листе монстеры был нарисован смайлик, но картинка не появилась, бурое пятно было маленьким, размером с копеечную монету. Значит, скорость изменения цвета в месте нанесения кислоты зависит от плотности покровов листа. Появление бурой окраски обусловлено проникновением кислоты внутрь клеток и образованием в них особого вещества - феофитина.
Вывод: Хлорофилл разрушается при воздействии на него соляной кислоты, а значит, и других кислот. Следовательно, газообразные выделения промышленных предприятий, которые часто содержат в себе химические вещества (например, сернистый ангидрит), которые, проникая через устьица в листья, растворяются в цитоплазме клеток и образуют кислоту. Накопление ее в больших количествах в цитоплазме вызывает разнообразные нарушения обмена веществ в клетках, в том числе и разрушение хлорофилла. Внешне такие повреждения могут выражаться в появлении на листьях бурых пятен. (Приложение 3)
Воздействие на пигмент хлорофилл высокой температуры.
Образование феофитина в листьях многих растений может происходить также и при нагревании листа выше 70 - 80 С. Цель данного опыта – показать, что разрушение хлорофилла и образование феофитина в листьях растений возможно и при воздействии на клетки листьев высокой температуры.
Оборудование: Для опыта нужны зеленые листья различных растений, спиртовка, стеклянная палочка.
Ход опыта: Прикоснемся к листу концом сильно нагретой стеклянной палочки или проколем его раскаленной препаровальной иглой. Во всех случаях возникают своеобразные изменения окраски листа: зеленые круги с неровными бурыми кольцами.
Вывод: Появление бурых колец обусловлено поступлением кислот клеточного сока из вакуолей в цитоплазму, а затем в хлоропласты. Под действием температуры раскаленной стеклянной палочки происходит разрушение молекул хлорофилла, образование феофитина и появление бурого окрашивания. Поскольку химический состав листьев различных растений имеет свои особенности, можно получить различные картины колец отмирания. Желтые, коричневые пятна отмирания появляются на листьях и в природных условиях под влиянием сильного перегрева, засухи. (Приложение 5)
Выводы.
Исследовав вопрос о растительных пигментах, я узнала, что пигменты играют очень значительную роль в природе и имеют огромное значение для жизни на Земле. Многие природные пигменты принимают участие в важных метаболических или физиологических процессах. Особенно детально изучено значение хлорофилла и других пигментов в фотосинтезе. Во многих случаях, однако, единственной известной функцией пигмента является то, что он придает окраску организму или той его части, которая содержит данный пигмент. В растительном царстве ярко окрашенные цветки и плоды, контрастно выделяющиеся на общем фоне зеленой окраски листвы, привлекают внимание насекомых и других животных. Благодаря этому растения извлекают для себя пользу при опылении и распространении семян. По итогам работы были установлены следующие выводы:
В создании цвета листа участвуют различные группы пигментов.
Снижение интенсивности и продолжительности освещения листьев ускоряет распад молекул хлорофилла в хлоропластах.
Уменьшение скорости распада хлорофилла в той части листа, которая находилась в воде, свидетельствует, что в разрушении хлорофилла важную роль играет процесс дыхания.
Хлорофилл разрушается при воздействии на него кислоты
Под действием температуры происходит разрушение молекул хлорофилла и появление бурого окрашивания.
Список литературы и Интернет-ресурсов.
Энциклопедия для детей. Биология; "Аванта +", М., 1993.
Биология. Первое сентября. № 44, 45, 46, 1999.
http://ru.wikipedia.org – Википедия.
http://lib.e-science.ru – Портал Естественных наук.
Приложения.
Приложение 1. Какие пигменты составляют окраску листа?




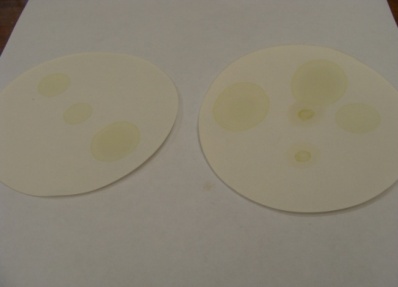
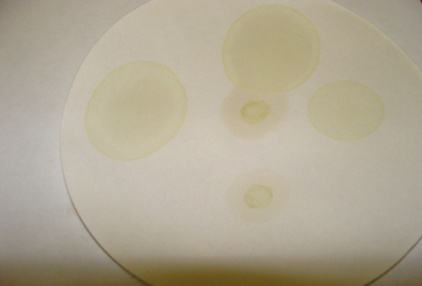
Приложение 2. При каком освещении желтеют листья?


Приложение 3. Необходимость кислорода для разрушения хлорофилла.



Приложение 4. Письмо на зеленом листе.






Приложение 5. Образование колец отмирания на листьях.



infourok.ru
Пигменты хлоропластов
Фотосинтез связан с избирательным поглощением пигментами света в видимой части солнечного спектра. Фотосинтетические питменты составляют 10-15 % сухой массы хлоропластов. Они характеризуются большим разнообразием и по химической природе делятся на две группы - хлорофиллы и каротиноиды.
Хлорофиллы
Состав и структура. В настоящее время известно несколько различньк форм хлорофилла, которые обозначают латинскими буквами. хлоропласты высших растений содержат хлорофилл а и хлорофилл b. Они были идентифицированы русским ученым М. С. Цветом (1906) с помощью разработанного им метода хроматографии. Структурная формула хлорофилла, предложенная Г. Фишером (1939), получила окончательное подтверждение в 1960 г. в результате двух независимо проведенных работ в США и ФРГ по искусственному синтезу хлорофилла а.
Хлорофилл - сложный эфир дикарбоновой кислоты хлорофиллина. у которой одна карбоксильная группа этерифицирована спиртом фитолом, а вторая - спиртом метанолом.
Каратиноиды
Световая фаза фотосинтеза
Сущность световой фазы фотосинтеза состоит в поглощении лучистой энергии и ее трансформации в ассимиляционную силу (АТФ и НАДФН), необходимую для восстановления углерода в темповых реакциях. Сложность процессов преобразования световой энергии в химическую требует их строгой мембранной организации. Световая фаза фотосинтеза происходит в гранах хлоропласта.
В состав фотохимически активных мембран хлоропластов входят 5 согласованно функционирующих многокомпонентных белковых комплексов:
светособирающий комплекс (ССК),
ФС 1,
ФС 2,
цитохромный комплекс (цитохромы b6 и f), участвующий в транспорте электронов, и
АТФ-азный комплекс, обеспечивающий синтез АТФ.
Организация и функционирование пигментных систем
Пигменты хлоропластов объединены в функциональные комплексы - пигментные системы, в которых реакционный центр (РЦ) хлорофилл а, осуществляющий фотосенсибилизацию, связан процессами переноса энергии с антенной, состоящей из светособирающих пигментов.
Современная схема фотосинтеза высших растений включает 2 фотохимические реакции, осуществляемые с участием 2 различных ФС. Предположение об их существовании было высказано Р. Эмерсоном в 1957 г. на основании обнаруженного им эффекта усиления действия длинноволнового (ДВ) красного света (700 нм) совместным освещением более коротковолновыми лучами (650 нм).
Впоследствии с помощью обработки ультразвуком и поверхностно-активными веществами и использования дифференциального центрифугирования в градиенте плотности сахарозы удалось получить легкие фрагменты хлоропластов, обогащенные фракцией ФС1, и более тяжелые фрагменты, содержащие фракцию ФС2.
Установлено, что ФС II поглощает более коротковолновые лучи по сравнению с ФС 1. Фотосинтез идет эффективно только при их совместном функционировании, что объясняет эффект усиления Эмерсона.
ФС I: в качестве РЦ выступает димер хлорофилла а с максимумом поглощения света 700 нм (P700), роль антенного компонента играют также хлорофиллы а675-695. Первичным акцептором электронов в этой системе является мономерная форма хлорофилла а695, вторичными акцепторами - железосерные белки (-FeS).
Комплекс ФС 1 под действием света восстанавливает железосодержащий белок - ферредоксин (Фд) и окисляет медьсодержащий белок- пластоцианин (Пц).
ФC II: включает РЦ, содержащий хлорофилл а (P680) и антенные пигменты - хлорофиллы a670-683. Первичным акцептором электронов является феофитин (фф), передающий электроны на пластохинон. В состав ФС II входит также белковый комплекс S-системы, окисляющий воду, и переносчик электронов Z. Этот комплекс функционирует с участием Mn, Cl и Mg.
ФС II восстанавливает пластохинон (PQ) и окисляет воду с выделением О2 и протонов.
Связующим звеном между ФС II и ФС 1 служат фонд пластохинонов, белковый цитохромный комплекс (b6, f) и пластоцианин.
На один РЦ приходится примерно 300 молекул пигментов, которые входят в состав антенных или светособирающих комплексов (ССК). Светособирающий белковый комплекс ламелл связан с ФСII и содержит хлорофиллы а, b и каротиноиды. В каждом ССК содержится от 120 до 240 молекул хлорофилла. Антенные комплексы входят в состав ФС1 и ФСII (фокусирующие антенные компоненты ФС).
Антенный белковый комплекс ФС 1 содержит 110 молекул хлорофиллов а680-695 на один P700, из них 60 молекул - компоненты антенного комплекса, который можно рассматривать как ССК ФС1. Антенный комплекс ФС1 также содержит -каротин.
Антенный белковый комплекс ФС II содержит 40 молекул хлорофиллов а670-683 на один P680 и -каротин.
Хромопротеины антенных комплексов не обладают фотохимической активностью. Их роль состоит в поглощении и передаче энергии квантов на небольшое количество молекул РЦ P700 и P680, каждая из которых связана с цепью транспорта электронов и осуществляет фотохимическую реакцию. Организация электронно-транспортных цепей (ЭТЦ) при всех молекулах хлорофилла нерациональна, так как даже на прямом солнечном свету на молекулу пигмента кванты света попадают не чаще одного раза за 0,1 с.
Передача энергии в светособирающих комплексах и ФС происходит путем индуктивного резонанса. Условиями для резонансного переноса энергии служат сближенное расположение и перекрытие частот осциллирующих электронных систем у двух взаимодействующих молекул. Причем миграция энергии осуществляется от коротковолновых пигментов к более длинноволновым. Квант света мигрирует в ФС, пока не попадет в стоковую молекулу (ловушку) - пигмент реакционного центра, который является самым длинноволновым и поэтому неспособным возбуждать соседние молекулы. Энергия возбужденного пигмента РЦ расходуется на фотохимическую работу. Квант света обычно передается на стоковую молекулу через несколько сотен передач, каждая передача осуществляется за 10-12 с, 100 передач-соответственно за 10-10 с. Экспериментально установлено, что 90 % энергии возбуждения хлорофилла а может быть передано на P700 менее чем за 10-9 с.
studfiles.net

















