Строение дерева. От клеток до корней. Срез органа растения
Строение дерева. От клеток до корней
 Строение растений мы изучали еще в школе. В этой статьей мы решили напомнить, что из себя представляет дерево, и рассказать о каждой из его частей: клетках и тканях, древесине и коре, ветвях и ветках, листьях и корнях.
Строение растений мы изучали еще в школе. В этой статьей мы решили напомнить, что из себя представляет дерево, и рассказать о каждой из его частей: клетках и тканях, древесине и коре, ветвях и ветках, листьях и корнях.
Материал был взят из первого русскоязычного издания справочника Европейского специалиста по уходу за деревьями (European Tree Worker), который пригодится как владельцам питомников и садовых участков, так и сертифицированным специалистам.
Анатомия дерева
Деревья – это древесные растения большого размера. Они обладают уникальными свойствами, позволяющими им являться доминирующим видом царства растений во многих странах мира. В основе ухода за деревьями (древоводства) лежит глубокое понимание процессов роста и развития деревьев. Только с учетом данного принципа можно профессионально осуществлять уход за деревьями.
-
Клетки и ткани
Для всех живых организмов характерна общая организационная структура, состоящая из клеток, тканей и органов. Клетки – это основные «строительные блоки» данной структуры. У растений новые клетки образуются путем деления существующих. Этот процесс проходит в специальных образовательных тканях – меристемах.

Клетки:1 — Молодая клетка с плазмой и ядром 2 — Рост клетки 3 — Зрелая клетка с большой вакуолью
После деления клетки проходят этап дифференцировки, во время которого изменяется их структура и они приобретают способность к различным специфическим функциями. Клетки с аналогичной структурой и функциями объединяются в ткани.
Затем из тканей формируются органы, которых у растений шесть: листья, стволы, корни, почки, цветы и плоды. И, наконец, органы образуют полностью функциональные организмы – деревья.
Существует два основных типа меристематической ткани:
- первичная меристема, из которой образуются клетки, отвечающие за рост побегов и корней в длину;
- вторичная меристема, из которой образуются клетки, отвечающие за прирост в диаметре.

Поперечное сечение ствола дерева: 1 — Сердцевина 2 — Ядро 3 — Сердцевинный луч 4 — Заболонь 5 — Камбий 6 — Флоэма 7 — Феллоген 8 — Кора
У деревьев есть две вторичные меристемы: камбий и феллоген.
- Камбий выполняет крайне важную роль: в процессе деления в нем образуются новые клетки, формирующие систему сосудов дерева. Из него генерируются два вида ткани: ксилема во внутренней части и флоэма снаружи.
- Феллоген – это камбий, из которого образуется кора. Ксилема – это часть древесины, состоящая из отмерших и живых клеток. К мертвым клеткам относятся трахеи и трахеиды у хвойных пород и сосуды у лиственных деревьев. Ксилема выполняет три функции: служит механической опорой дерева; обеспечивает передвижение воды и минеральных веществ; обеспечивает хранение питательных веществ.
Когда дерево срубают и рассматривают в поперечном сечении, в ксилеме видны годичные кольца. В зонах умеренного климата данные кольца соответствуют годовому образованию ксилемы в камбии. Они имеют форму круга, так как относительный размер и плотность сосудистой ткани изменяются в течение вегетационного периода. По мере приближения к концу вегетационного периода клетки становятся меньше в диаметре.
Таким образом, благодаря резкой разнице между клетками, образованными в начале сезона (ранняя древесина), и клеткам, сформированными позднее (поздняя древесина), индивидуальный годовой прирост становится различимым.
 Сердцевинный луч в древесине
Сердцевинный луч в древесине  1. Кольцесосудистая древесина2. Рассеяннососудистая древесина
1. Кольцесосудистая древесина2. Рассеяннососудистая древесина В отношении древесины хвойные и лиственные породы значительно отличаются друг от друга. Кроме того, среди лиственных деревьев выделяются кольцесосудистые (например, Дуб (Quercus), Ясень (Fraxinus)) и рассеяннососудистые виды (например, Липа (Tilia), Бук (Fagus)).
В центре ствола формируется ядровая древесина. Она окружена живой заболонью. Не все проводящие элементы ксилемы служат для передвижения воды. За это отвечает только живая и активная ткань заболони, тогда как другая часть ксилемы, расположенная ближе к центру, является нефункциональной. Такие мертвые клетки образуют ядро – непроводящую ткань, цвет которой темнее, чем у заболони.
Флоэма отвечает за перемещение сахара от листьев к другим частям растения. Кроме флоэмы и ксилемы, сосудистая система дерева включает в себя лучевые клетки. Лучи расходятся в радиальном направлении от центра поперечного сечения через флоэму и ксилему и служат для транспортировки сахаров и их компонентов вдоль ствола. Они помогают ограничивать распространение гнили по древесной ткани и хранить запасы питательных веществ в виде крахмала.

Поперечный разрез ствола
Внешняя часть ветвей и ствола деревьев называется корой. Это защитная ткань, поддерживающая температуру внутренней части ствола, предохраняющая растения от повреждений и уменьшающая потерю воды. Кора состоит из нефункциональной флоэмы, пробковой ткани и мертвых клеток. Для минимизации потери воды ее клетки пропитаны воском и маслами.
Газообмен между живыми тканями дерева и атмосферой происходит с помощью чечевичек, маленьких пор в коре.
 Это интересно
Это интересноКора различных деревьев имеет разное строение и свойства. Например, кора бука очень гладкая с небольшим количеством пробковой ткани, а кора дуба, наоборот, образует толстые слои феллемы.
| Смотрите также:
|
Ветки – это небольшие ветви, которые служат опорой для листьев, цветов и плодов. Ветви поддерживают ветки, а ствол поддерживает всю крону. Ветви и ветки развиваются из двух типов почек:
- терминальных или верхушечных почек на конце побега;
- боковых или пазушных почек, которые образуются вдоль ветки.
Верхушечная почка является наиболее сильной на ветви или ветке и располагается на конце побега. Она контролирует развитие вторичных почек с помощью гормонов. Обычно вторичные почки не развиваются и остаются в спящем состоянии. Как правило, верхушечная почка является наиболее активной на каждой ветви или ветке и контролирует развитие пазушных почек на том же побеге, которые часто бывают спящими: их рост сдерживается апикальным доминированием терминальной почки.

Формирование ветвей
Побеги с доминирующей верхушечной почкой бывают моноподиальными или симподиальными.
Побеги без апикального доминирования являются ложнодихотомическими.

Гибель верхушечной почки в результате случайного повреждения или обрезки может привести к активизации спящих почек рядом со срезом и, как следствие, к развитию нового побега.
Некоторые побеги развивают придаточные почки, которые формируются вдоль стволов и корней. Они возникают, как правило, в ответ на потерю обычных почек в результате действия регуляторов роста.

Ежегодный прирост: 1 — 1 год; 2 — 2 года; 3 — 3 года
Листья и почки образуются из немного утолщенной части ветки, которая называется узел. Междоузлие – это зона между узлами. На ветке видны листовые рубцы и рубцы верхушечной почки. Они помогают измерять ежегодное удлинение ветки и общий прирост. По своей структуре и функции каждая ветвь дерева сопоставима со всей кроной. Но в то же время ветви – это не просто отростки ствола.
Наоборот, ветви характеризуются уникальной формой присоединения к нему, которая имеет крайне важное значение для практической деятельности в сфере ухода за деревьями, например, для обрезки.
Ветви прочно крепятся к древесине и коре, расположенной под ветвями, но над ними крепление более хрупкое. Годовой прирост слоев ткани в зоне соединения ветви и ствола хорошо заметен и формируется большую часть времени. Плечо или выпуклость вокруг основания ветви называется воротником. В точке разветвления ткани ветви и ствола расширяются на встречу друг другу. В результате, кора приподнимается, образовывая гребень ветви. Если кора в районе разветвления окружена древесиной, она называется включенной корой. Это еще больше ослабляет развилку ствола, поскольку нормальное присоединение ветви к стволу не формируется.
Смотрите также:  Рис.1 Правильная обрезка В этой статье мы поговорим об особенностях обрезки у основания ветви и обрезки, параллельной стволу. Вы узнаете, почему в наше время специалисты отдают предпочтение именно первому способу обрезки деревьев. |
Листья отвечают за производство питательных веществ для дерева. Они содержат хлоропласт, наполненный зеленым пигментом – хлорофиллом, с помощью которого происходит фотосинтез. Еще одна функция листьев – транспирация, представляющая собой выведение воды через листву посредством испарения.

Строение листа: 1 — Устьице 2 — Кутикула 3 — Эпидермис 4 — Клетки палисадной паренхимы5 — Клетки губчатой паренхимы
Площадь листьев достаточно большая, что позволяет им поглощать солнечный свет и углекислый газ, необходимые для фотосинтеза.
Внешняя поверхность листа покрыта воскообразным слоем, который называется кутикула. Она служит для минимизации дессикации (высушивания) листа.
Испарение воды и газообмен контролируют устьица – маленькие отверстия на поверхности листа.
Лист обладает развитой системой проводящих тканей, включающей в себя вены, или капиллярные каналы. Вены состоят из тканей как флоэмы, так и ксилемы, и отвечают за транспортировку воды и жизненно необходимых веществ, а также за перенос питательных веществ, которые вырабатываются в клетках листьев, к остальным органам дерева.
 Это интересно
Это интересноДеревья, сбрасывающие листву каждый год, называются лиственными, а те, которые сохраняют ее в течение более чем одного года, называются хвойными или вечнозелеными. Осыпание листьев обусловлено клеточными изменениями и регуляторами роста, формирующими точку отделения органа у основания черешка, или ножки листа.
Точка отделения листьев выполняет две функции:
- обеспечивает осыпание листвы осенью;
- предотвращает высыхание, распространение болезней и повреждение части растения, от которой отрывается лист.
Осенью изменение цвета листвы листопадных деревьев связано с разложением хлорофилла, позволяющим проявиться другим пигментам, содержащимся в листьях. Сокращение продолжительности светового дня в сочетании с холодными ночами приводит к усиленному накоплению сахаров и замедляет выработку хлорофилла. Этот процесс и позволяет другим пигментам, в том числе антоцианинам (красный и пурпурный) и каротиноидам (желтый, оранжевый и красный), проявиться.
Корни деревьев выполняют четыре основные функции:
- фиксация дерева;
- аккумуляция энергии и питательных веществ;
- поглощение веществ;
- транспортировка веществ.

Окончание корня:1. Одревесневший корень2. Корневой волосок3. Корневой кончик4. Корневой чехлик
Всасывающие корни представляют собой небольшие, волокнистые участки ткани, растущей на окончаниях основных одревесневших корней. У них есть эпидермальные клетки, модифицированные в корневые волоски, которые помогают поглощать воду и минеральные вещества. Корневые волоски живут совсем не долго (3–4 недели весной) и значительно активизируют способность к поглощению веществ с наступлением вегетационного периода весной.
Что касается корневых кончиков, они содержат меристему, где клетки делятся и растут в длину.
Корни растут там, где они могут найти воздух и кислород. Большая часть всасывающих корней находится на расстоянии 30 см от поверхности почвы. Также рядом с поверхностью располагаются горизонтальные боковые корни.
Якорные корни растут вертикально по направлению вниз от боковых корней, обеспечивая надежную фиксацию дерева и увеличивая глубину освоения почвы корневой системой.

Корневая система:1 — Стержневая корневая система 2 — Мочковатая корневая система 3 — Поверхностная корневая система
Корни многих растений находятся в симбиозе с некоторыми грибами. Результат таких взаимоотношений называется микориза (грибокорень). Симбиоз двух организмов (дерева и грибов в нашем случае) основывается на взаимной пользе: грибы получают питательные вещества из корней и, в свою очередь, помогают корням всасывать воду и жизненно необходимые элементы.
Смотрите также:  Грибы внутри тканей корня Сожительство микоризы и растения, как правило, бывает чрезвычайно взаимовыгодно, что обусловлено объединением имеющихся у них различных способностей. |
_____________________________________________________________________
Появление первого русскоязычного издания справочника Европейского специалиста по уходу за деревьями (European Tree Worker) в России стало возможным благодаря сотрудничеству НПСА «ЗДОРОВЫЙ ЛЕС» (Россия) с ведущим немецким учебным заведением в области подготовки специалистов по уходу за деревьями – Нюрнбергской школы ухода за деревьями (Германия).
givoyles.ru
4.7 Изготовление срезов растений и подготовка предметных и покровных стёкол
Анатомические исследования подразумевают, прежде всего, подготовку объектов изучения таким образом, чтобы его можно рассматривать в микроскоп. Наиболее широко распространенным типом микроскопа, особенно на уровне студенческих исследований, является световой, а значит, объект должен пропустить через себя пучок света.
Из растительных объектов готовят тонкие срезы, толщиной 8 - 25 мкм. Изначально готовили срезы опасной бритвой от руки. Объект зажимают между кусочками сердцевины бузины (сейчас используют пенопласт, сердцевину топинамбура). Это очень трудоемкий способ, требующий отработанных навыков. Безусловно, таким способом, работая безопасной бритвой, нельзя подготовить массовый материал, серийные срезы, срезы значительной площади.
Совершенно изменилась технология работы с изобретением микротома. Эволюция этого аппарата прошла очень быстро по пути совершенствования. Наиболее трудной задачей является механизм закрепления объекта, из которого необходимо изготовить срезы. Если древесина как твердый материал может быть укреплена зажимами, то мелкие объекты (семена), мягкие (лист, кора) не могут быть закреплены таким образом. Есть методы специальной обработки материала (заливка в целлоидин, парафин), но они трудоемки и требуют значительного времени. Чтобы выполнить ВКР с использованием этих методов, надо работать с материалом не менее 3-х лет. Огромным прогрессом стало изобретение замораживающих столиков. Объект к ним прикрепляется с использованием низких температур.
Эти столики могут работать с использованием углекислоты, что более приемлемо для мягких животных тканей, особенно в медицине. В ботанике наиболее удобным являются столики, работающие по типу «холодильника». Постоянный ток проходит через термопару, тепло удаляется проточной водой.
Из зафиксированного материала готовят микрообъекты в виде кубиков или призм. Площадь поперечного среза зависит от характера материала. Если он однородный, то может быть больше, а если его структура гетерогенна (на границе коры и древесины), то не более 0,5 × 0,5 см; для продольных срезов (радиальный, тангентальный) один из размеров (по направлению оси органа) желательно делать длиннее (до 0,7 - 0,8 см). Приготовленный таким образом материал выдерживают в воде не менее 0,5 часа (лучше дольше), меняя через 10 - 15 минут воду. Таким образом, спирт удаляют из объекта и он хорошо примораживается. Древесину перед изготовлением микрообразцов следует варить в смеси воды и глицерина (1:1) в огнеупорной колбе на электрической плитке в течение 5 - 6 часов. Вода испаряется и ее следует периодически доливать, но ни в коем случае не в кипящую массу, а только после некоторого охлаждения с соблюдением осторожности. В противном случае происходит выброс горячей массы, который может привести к повреждению лица и рук. После такой подготовки древесина становится очень эластичной, и длина поперечного среза может достигать 2 см.
Подготовленные микрообъекты ориентируют на замораживающем столике соответствующим образом, включают вначале воду и спустя 3 - 4 минуты выпрямитель переменного тока в постоянный и наносят на объект по каплям пипеткой воду до тех пор, пока весь объект не будет покрыт небольшим куполом льда. Со стороны, противоположной движению ножа, намораживается большая площадь льда, т.к. надо обеспечить упор давлению ножа.
При резке растительных объектов необходимо помнить, что в любом органе присутствуют как мягкие не одревесневшие ткани, так и механические, сильно лигнифицированные. Поэтому очень важно «найти» правильный угол наклона ножа, угол между лезвием ножа и направлением его движения.
Толщину среза или устанавливают фиксированную, в этом случае доведение ножа назад до упора обеспечивает поднятие столика на толщину среза, или устанавливают вручную, поднимая после каждого среза замораживающий столик.
Разнообразие растений обуславливает и разнообразие подходов в процессе резки. Очень хорошо режутся лимонник, липа, бузина, очень трудно объекты с твердой древесиной, поэтому каждый новый объект требует некоторого испытания разных приёмов.
Одним плавным, без рывков, движением ножа на себя производят срез, кисточку (желательно беличью) каждый раз смачивают в воде, движением по ножу на себя снимают срез и помещают его в бюксу с водой (ни в коем случае не спиртом, т.к. кисточка, смоченная спиртом, будет переносить его на объект, и приведет к разрушению блока).
Изготовление срезов на микротоме позволяет получить их значительное количество, а значит, позволяет вести отбор для изготовления препаратов. Необходимо готовить срезы разной толщины. Сделать очень тонкий срез, пригодный для фотографирования, но большой площади, невозможно. Срезы большой площади дают возможность судить о соотношении тканей, их топографии.
Если полученные срезы сразу не будут использованы для изготовления препаратов, то в воду следует добавить спирт, и препараты можно сделать на второй день.
Из полученных срезов готовят временные и постоянные препараты, но этому предшествует подготовка предметных и покровных стекол. Основные требования к ним: стекла должны быть обезжирены, что достигается тщательной промывкой. Стекла моют в горячей воде с мылом, протирая с обеих сторон щеточкой. Затем помещают в емкости с наструганным мылом и кипятят в течение часа, осторожно переворачивая их. Не рекомендуется использование специальных порошков, т.к. они оставляют на поверхности налет.
После кипячения стекла тщательно промывают в холодной воде под краном и погружают в насыщенный водный раствор двухромовокислого калия с крепкой серной кислотой в пропорции 3:1 или 4:1 (хромпик). В этой смеси стекла хранят не менее суток, используя по мере необходимости. Перед изготовлением препаратов стекла хорошо промывают от хромпика.
Можно промытые в мыльной воде стекла поместить на несколько часов в 10-15% раствор калийной щелочи, затем промыть водой и перенести в слабый 1-5% раствор соляной кислоты и через 1-2 минуты снова промыть водой.
Предметные стекла, на которые помещают препараты, должны быть хорошо обезжирены и промыты. На правильно подготовленных стёклах нанесенные капли воды хорошо растекаются. Если же на стекле остались следы жира, то вода собирается каплями, не растекаясь. На такие стекла срезы накладывать не следует, так как они не закрепляются на нем.
4.7.1 Изготовление временных препаратов
Для первоначального знакомства с полученными срезами, а иногда и для наблюдения, готовить постоянные препараты нецелесообразно. В этом случае ограничиваются временными препаратами, которые хранят непродолжительное время. Средой, в которую помещают срез, является вода, если материал свежий, т.е. живой. Если материал зафиксирован, то для этой цели используют глицерин (чистый или разбавленный водой) или другие просветляющие жидкости.
Срезы помещают в чистый или слегка разбавленный глицерин, в котором они могут находиться до нескольких месяцев. Для более длительного хранения покровное стекло обводят жидким парафином или канадским бальзамом, чем достигается прикрепление покровного стекла к предметному.
4.7.2 Окраска срезов и приготовление постоянных препаратов
Если срезов несколько, то их окрашивают на предметом стекле. Но при изготовлении срезов на микротоме их готовят несколько десятков, что делает возможным выбор, тогда срезы окрашивают в небольших бюксах. В этом случае срезы помешивают очень осторожно кисточкой, чтобы предотвратить слипание и обеспечить равномерное окрашивание.
Для окрашивания срезов из вегетативных органов растений используют чаще всего сафранин и водный или нильский синий. Вообще, красителей много, их применение обусловлено характером и природой объекта.
Итак, в бюксы, где в воде находятся срезы, добавляют сафранин. В сафранине срезы следует выдерживать не менее 30 минут. Затем, осторожно сливая и добавляя воду, промывают срезы для удаления сафранина. На приготовленное предметное стекло наносят пипеткой несколько капель воды и препаровальными иглами или кисточкой извлекают из стаканчиков (лучше их перелить в чашку Петри) окрашенные сафранином срезы и кладут на предметное стекло. Срезы подбирают по величине, как по всей площади объекта, так и более мелкие кусочки, которые, как правило, тоньше. На срезах большей площади устанавливают расположение и соотношение тканей, а тонкие срезы более пригодны для микрофотографирования.
Заранее готовят полоски фильтровальной бумаги по площади в 2 раза превышающие ширину предметного стекла и чуть больше по длине. Берут несколько полосок и, постепенно прижимая их к стеклу по направлению к себе, убирают воду, при этом после полного контакта со стеклом пальцами с нажимом разглаживают бумагу, это обеспечивает хорошее отхождение срезов от фильтровальной бумаги. Подняв бумагу, отбрасывают 2-3 слоя, впитавшие воду, и сразу на срезы пипеткой наносят водный или нильский синий, выдерживают в нем 1-2 минуты (поперечные срезы выдерживают дольше, чем продольные) и таким же приемом фильтровальной бумагой удаляют синюю краску. Далее на срезы поочередно наносят 50%, 75% и 96% спирт, выдерживая в каждом, несколько минут и убирая фильтровальной бумагой. Такое же обезвоживание производят несколько раз, пока не будет заметна резкая разница в окраске разных тканей. Этот прием называют дифференцировкой окраски.
Сафранин окрашивает одревесневшие элементы, а нильский синий нелигнифицированные, тонкостенные. Последним наносят 100% спирт, но если для обезвоживания используют 5-20% карбол-ксилол (смесь фенола с ксилолом), а это чаще всего, то его наносят после 96% спирта, минуя промывку в абсолютном спирте. Эта смесь обладает прекрасным просветляющим и обезвоживающим свойствами, продолжительность выдержки в ней зависит от интенсивности окраски. Убрав бумагой карбол-ксилол, срезы заливают ксилолом. В течение всей дифференцировки (проводки) после каждого погружения осторожно препаровальной иглой корректируют положение срезов на предметном стекле, чтобы они оказались в средней части. Не следует допускать подсыхания срезов, т.к. они свертываются в трубочку.
Трудно рекомендовать время выдержки срезов в каждом из реактивов, т.к. это зависит от толщины среза, характера объекта. Если в процессе дифференцировки срезы плохо обезвожены, они помутнеют при погружении их в ксилол. На прокрашенные и обезвоженные срезы наносят канадский бальзам и закрывают покровным стеклом, опуская его под некоторым углом к предметному стеклу, что способствует удалению воздуха. Количество наносимого бальзама устанавливают в процессе работы, и оно зависит от толщины среза, величины покровного стекла. Важно, чтобы все срезы были закрыты, покровное стекло полностью прилегало к предметному, и бальзам не вытекал в избытке.
После подсыхания в течение нескольких дней препарат маркируют или карандашом по стеклу, или наклеивают этикетку (при изготовлении учебных препаратов фабричным способом). Нельзя препараты держать на сильно освещенных местах, так как они выцветают.
Многие растения (лимонник, липа, пихта, актинидия и др.) содержат многочисленные слизевые идиобласты. Слизь затрудняет работу, т.к. срезы прилипают к фильтровальной бумаге и снять их без повреждения не удается. Избавиться от них можно кипячением в воде, но при этом мягкие ткани коры могут мацерироваться. Лучше заспиртованный материал (срезы) выдержать в 10%-ом водном растворе уксусно-кислого свинца, т.к. слизи теряют способность к набуханию.
4.7.3 Изготовление постоянных препаратов в глицерин-желатине
Этот способ изготовления постоянных препаратов используют в том случае, если хотят оставить неокрашенные препараты (эпидерма листа, мезофилл и т.д.). Окрашенные срезы в глицерин-желатине раскрашиваются. Это быстрый способ изготовления препаратов, причем некоторые структуры на них выявляются резче, чем неокрашенные.
Для приготовления глицерин-желатина берут 1 г желатина, 6 мл дистиллированной воды и 7 мл чистого глицерина. На 100 частей этой смеси добавляют 1 г карболовой кислоты (фенол). Сначала смачивают желатин в указанном количестве воды и оставляют набухать 2 часа, затем приливают глицерин и карболовую кислоту. Смесь при помешивании нагревают, пока желатин не растворится до равномерной консистенции. Затем сразу фильтруют через стеклянную вату с помощью воронки с двойными стенками, наполненной горячей водой. Можно пользоваться обычной воронкой, которую необходимо подогревать кругом, не давая ей остыть.
Для получения совершенно прозрачного желатина в теплый раствор глицерин-желатина рекомендуется добавить яичный белок, и нагреть до кипения, размешивая стеклянной палочкой. При этом белок свертывается, адсорбирует все примеси, обуславливающие муть. Глицерин-желатин нагретым надо профильтровать, но после этого мешать смесь ни в коем случае нельзя, т.к. образовавшиеся пузырьки воздуха будут попадать на препараты, а в отличие от канадского бальзама, из которого пузырьки воздуха очень хорошо исчезают, из глицерин-желатина они практически не удаляются. Хранить глицерин-желатин надо в колбе с широким дном, закрывая ее корковой пробкой, в которую через отверстие вставляют стеклянную палочку.
В комнатных условиях глицерин-желатин застывает, поэтому перед работой и в процессе изготовления препаратов его подогревают на водяной бане.
Объекты из мягких тканей в глицерин-желатине сжимаются, поэтому перед нанесением среза на предметное стекло, его сначала помещают в раствор глицерина с водой (1:9). Вода постепенно испаряется, и когда густота глицерина станет достаточной, срез помещают в глицерин-желатин под покровное стекло.
Срезы древесины такой процедуре не подвергают, а прямо из воды помещают под стекло. Избыток глицерина удаляют фильтровальной бумагой. Перед изготовлением предметное стекло слегка нагревают над спиртовкой, кладут срез, помещают на него несколько капель глицерин-желатина и накрывают покровным стеклом, опуская его постепенно на одно ребро наклонно. Тогда покровное стекло, опускаясь, вытесняет воздух. После опускания стекла его не прижимают и не надавливают (в отличие от помещения в канадский бальзам), не сдвигают. Для хранения препарата покровное стекло заключают в рамочку из канадского бальзама, расплавленного воска или парафина, перед этим удаляя выступивший из-под стекла глицерин-желатин.
4.7.4 Анализ препаратов
После изготовления препаратов, особенно при использовании канадского бальзама, им необходимо «подсохнуть». Ксилол, в котором растворяют канадский бальзам, испаряется, и покровное стекло прочно прикрепляется к предметному. Теперь необходимо произвести анализ объектов. Его характер зависит от целей исследования.
Если производится описание структуры нового объекта, о котором данных в литературе нет, то дают подробную его характеристику. Исследуя несколько срезов (они могут быть под одним стеклом), устанавливают общую картину структуры. Определяют гистологический состав объекта, топографию (расположение) тканей на разных срезах, их параметры, соотношение, наличие идиобластов и др.
Затем производят подробное описание, отмечая как общие, так и характерные особенности. Ткани описывают не в произвольном порядке, а в порядке их расположения в органе (в стебле – от центра к периферии, или наоборот; в листе от верхней стороны к нижней, или наоборот). Описание сопровождают количественными характеристиками, производя замеры винтовым окуляр-микрометром, а если его нет, то мерной линейкой, вставляемой в окуляр. Предварительно определяют цену деления на всех увеличениях.
При описании тканей отмечают:
studfiles.net
Тканевая диагностика растений
Тканевая диагностика растений

Тканевая диагностика включает в себя ряд методов для определения неорганических форм соединений элементов в отобранных пробах, причем для анализа используют срезы стеблей, черешков, жилок листьев, выжатый сок из них или вытяжки из навесок этих частей, а также других органов растений.
Разработаны экспресс методы анализа срезов и сока растений, позволяющие быстро получить оценку обеспеченности растений элементами питания. Каждый исследователь, который занимался разработками экспресс методов, предлагал также портативный прибор для анализа непосредственно в поле только что взятых проб растений.
При определении неорганических форм соединений в тканях растений нужно учитывать, что в них происходят быстрые ферментативные превращения веществ, особенно при увядании. Поэтому для проб, отобранных в поле для тканевой диагностики, обязательно должна быть холодильная сумка, и анализы следует выполнять незамедлительно.
ЭКСПРЕСС-АНАЛИЗЫ СРЕЗОВ И СОКА РАСТЕНИЙ
Г. С. Давтян в черешках листьев хлопчатника проводил определение нитратов по реакции с дифениламином (0,5%-ный раствор в 80—85%-ной h3SO4). По его методу в ячейку палетки вливают 0,15 мл дифениламина. Концом срезанной ветви или черешка листа хлопчатника в течение 20 c помешивают каплю дифениламина в палетке. Затем черешок листа удаляют. Синюю окраску, дифениламина нитратами из черешка (ветви) сравнивают с пятибалльной шкалой.
Американский ученый А. Ульрих предложил анализировать содержание нитратов в растениях по реакции с дифениламином непосредственно в поле. Для этого бритвой делают насечку на стебле или главной жилке листа. На образовавшийся срез наносят каплю дифениламина. Интенсивность синей окраски среза оценивают в баллах. Несколькими проходами по полю, выполняя такие анализы растений, выявляют уровень их обеспеченности азотом и, следовательно, уровень плодородия почвы.
Определение нитратов, ортофосфатов и калия в растениях, по В. В. Церлинг, проводят на поперечных срезах различных органов растений: стеблей, листьев, их черешков и пластинок, почек, бутонов, цветков и их частей, корней, корнеплодов, клубней, клубеньков бобовых и др. Для получения срезов определенной толщины можно пользоваться ручным микротомом, который состоит из цилиндрической ручки — держателя для зажима части растения и вращающегося кольца на верхнем конце этого держателя. Движением бритвы по этому кольцу делают срез, поворотом кольца по метке на держателе регулируют толщину среза.
При определении нитратов срезы кладут на стеклянную пластинку, фосфора и калия — на кусочки (около 2 см2) плотной фильтровальной бумаги («белая лента»), положенные на стекло.
Чтобы выяснить характер распределения питательных веществ по органам растения, срезы (поперечные и продольные) делают с разных частей: от кончика корня до верхушечной почки, цветка и семени.
Если требуется определить нуждаемость растения в подкормке, можно ограничиться анализом лишь той его части, где искомое вещество локализуется в наибольших количествах: корни, стебли, черешки и главные жилки листьев нижних ярусов. Если в этой части определяемое вещество отсутствует или находится в весьма малом количестве, то делают заключение о необходимости внесения дефицитного элемента.
При оценке результатов анализа важно иметь в виду, что с возрастом растений количество минеральных форм питательных веществ в них уменьшается (особенно нитратов). Например, малое количество нитратов в начале вегетации указывает на недостаток азотного питания, тогда как в фазе цветения такое содержание их считается нормальным.
Прибор В. В. Церлинга содержит все необходимые реактивы и материалы для определения нитратов, ортофосфатов и калия.
Нитраты. На свежий срез, положенный на стекло, наносят одну каплю 1%-ного сернокислого раствора (в h3SO4 плотностью 1,84) дифениламина. Для ускорения реакции срез раздавливают стеклянным пестиком, взятым из прибора. Полученную окраску оценивают в баллах.
| Бал | Окраска среза | Нуждаемость растений в азотных удобрениях |
| 0 | Нет синей окраски | Очень сильная |
| 1 | Бледно-голубая, быстро исчезает | Сильная |
| 2 | Голубая окраска проводящих сосудов, быстро исчезает | Нуждается |
| 3 | Срез и сок голубой окраски, исчезает через 2-3 мин | Средняя |
| 4 | Срез и сок синее, окраска сохраняется несколько минут | Слабая |
| 5 | Срез и сок окрашены в интенсивно-синий цвет, окраска сохраняется некоторое время | Не нуждаются |
| 6 | Срез и сок темно-синие, окраска устойчивая | Избыток нитратов |
В связи с необходимостью уточнения доз азотной подкормки под зерновые культуры для получения высококачественного зерна стали широко применять дифениламиновую реакцию на нитраты в срезах стеблей пшеницы на основе прибора ОП-2 (Церлинг). Для этой цели ЦИНАО упростил шкалу до трех баллов: 1 — без окраски или бледно-голубая окраска сока (сильный недостаток азота), 2 — интенсивно-синяя окраска (слабая нуждаемость), 3-темно-синяя окраска сока (питание азотом достаточное). Определения проводят по среднему баллу из 20 параллельных анализов. Для каждого результата даны дозы азотного удобрения: при 1 бал – 60 кг/га, при 2 баллах —30 кг и при 3 — подкормка не нужна.

Ортофосфаты. Содержание их в растении определяют анализом сока из поперечного среза стебля, черешка или главной жилки нижнего листа. На кусочки (2 см2) фильтровальной бумаги, разложенные на стеклянной пластинке, помещают срезы растений. Их раздавливают пестиком из прибора. На каплю сока и отодвинутый срез наносят по каплям реактивы: молибденовокислый аммоний, бензидин и уксуснокислый натрий.
Более четкая реакция получается при нанесении последующего реактива после высыхания капли предыдущего. Это достигается, когда единовременно анализируют 50 срезов и более. Результаты анализов оценивают в баллах.
| Бал | Окраска на фильтровальной бумаге | Нуждаемость растений в фосфорных удобрениях |
| 0 | Нет синей окраски | Очень сильная |
| 1 | Бледно-серо-голубая | Сильная |
| 2 | Серо-голубая | Нуждаются |
| 3 | Светло-синяя | Средняя |
| 4 | Синяя | Не нуждаются или слабо нуждаются |
| 5 | Темно-синяя | Не нуждаются |
Для ускорения анализа можно заранее пропитать фильтровальную бумагу раствором молибденовокислого аммония: высушить, нарезать кусочками по 2 см2 и хранить в закрытой коробке (на свету может посинеть).
Калий. Для определения свободного калия, неадсорбированного на органеллах клетки, кладут поперечный срез части растения на кусочек фильтровальной бумаги. Срез раздавливают пестиком из прибора в сторону от пятна капли сока. Наносят на пятно сока и срез по одной капле: сначала раствор дипикриламината магния, затем соляной кислоты HCl. Дипикриламинат калия красно-оранжевого цвета, нерастворим в НСl, тогда как дипикриламинат магния разлагается под действием кислоты, выделяя избыток дипикриламината магния желтого цвета. Интенсивность красного цвета дипикриламината калия сравнивают со шкалой, прилагаемой к прибору, и оценивают в баллах.
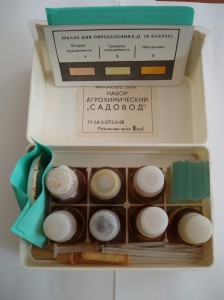
| Бал | Окраска на фильтровальной бумаге | Нуждаемость растений в калийных удобрениях |
| 0 | Лимонно-желтая | Очень сильная |
| 1 | Соломенно-желтая | Сильная |
| 2 | Желто-оранжевая | Нуждается |
| 3 | Оранжевая | Средняя |
| 4 | Красно-оранжевая | Слабая |
| 5 | Красно-суриковая | Не нуждаются |
К. П. Магницкий в выжатом щипцами соке из черешков листьев или стеблей растений предложил определять нитраты, фосфаты, калий, магний и хлор на основе колориметрических реакций с балльной оценкой результатов. Он же разработал технику количественного анализа содержания тех же соединений в 2%-ной уксуснокислой вытяжке из свежих или (фиксированных) сухих растений на основе колориметрических реакций.
АНАЛИЗ ПАСОКИ РАСТЕНИЙ ПО Д. А. САБИНИНУ
Метод, разработанный Д. А. Сабининым и его сотрудниками, применяют для определения снабжения растений питательными веществами. Он может служить также для оценки развития и функциональной активности корневых систем. Использование метода вполне возможно как в вегетационном опыте, так и в полевых условиях.
Пасока — это сок, выделяющийся из стеблей и стволов растений при срезании. Технически метод прост и в то же время достаточно точен, так как основан на результатах анализа пасоки («плача растений») как естественного и неизменного продукта жизнедеятельности растений и их корневых систем.
Все растения – травянистые, кустарниковые и древесные и большей или меньшей степени выделяют пасоку при срезании стебля, ствола, ветви. При этом количество ее неодинаково. Оно зависит от возраста растения, степени развития корневых систем и в очень значительной мере от времени суток, а также от условий произрастании. Например, злаковые растения образуют максимальное количество пасоки в начале кущении. В более поздние фазы развития в связи с падением влажности почвы при одновременном усилении транспирации подача пасоки корневыми системами замедляется, становится неравномерной. В условиях орошаемого земледелия этот недостаток можно легко устранить.
При работе с растениями в условиях вегетационного опыта для сохранения влажности можно применять стеклянные колпаки или сосуды. Если сбор пасоки проводят с 1—2 растений, а в вегетационном сосуде их 8—10, необходимо срезать все. В противном случае может произойти остановка «плача» или засасывание уже выделенной пасоки под влиянием несрезанных растений, продолжающих транспирировать.
Техника сбора пасоки заключается в следующем. Стебель растения срезают на некоторой высоте от поверхности почвы (1,5—2 см) и на оставшийся конец стебля немедленно натягивают и закрепляют ниткой тонкостенную чистую резиновую трубку. Последняя должна плотно прилегать к стеблю, чтобы не было протекания пасоки. В свободный конец резиновой трубки вставляют подходящего диаметра стеклянную трубку, нижний конец которой немного оттянут для облегчения соединения. Стеклянную трубку сверху затыкают пробкой с тонким отверстием для выхода воздуха. Нужно отметить продолжительность выделения пасоки (от времени надевания до времени снятия трубки), которая обычно составляет 24 ч. При сборе по возможности максимально сливают пасоку пипеткой в сухие, чистые, предварительно взвешенные стаканчики с номерами. Количество пасоки определяют взвешиванием.
Для установления динамики выделения пасоки или для большей точности учета можно рекомендовать в качестве приемника узкую пробирку с делениями по 0,1 мл, соединенную через стеклянный сифон с резиновой трубкой и оставшимся после среза концом стебля.
Собранную пасоку до анализа хранят в холодильнике с добавлением 2— 3 капель толуола в качестве антисептика. Последний желательно вводить в пробирку при сборе пасоки.
В основу рассматриваемого метода положена концепция Д. А. Сабинина о существовании определенного равновесия между содержанием минеральных соединений в пасоке и в наружной среде, окружающей корни.
При анализе пасоки вычисляют произведение процента диагностируемого вещества на массу всей собранной пасоки за определенное время. Для этого, требуется точный учет в единицу времени количества собранной пасоки по массе или по объему, как указано выше. Произведение концентрации определяемого соединения на количество собранной пасоки дает именно ту величину, которая может характеризовать интенсивность снабжения растений питательными веществами.
В пасоке анализируют как минеральные соединения элементов питания, так и общее их содержание после кислотного озоления. В первую очередь определяют азот, фосфор, калий и кальций.
Преимущество этого метода по сравнению с другими заключается в том, что анализируется не смесь различных продуктов жизнедеятельности, как в вытяжке или в выжатом соке растения, а определенная органическая часть растений — сок питательных веществ, который корневая система подает в надземные органы.
АНАЛИЗ ВЫТЯЖЕК ИЗ РАСТЕНИЙ ПО К. Л. МАГНИЦКОМУ
В качестве экстрагентов для получения вытяжек из растений используют дистиллированную воду, 2%-ную уксусную кислоту, раствор Моргана и даже раствор первого реактива для определения элемента (например, раствор молибденовокислого аммония при определении фосфатов). Сравнение первых трех экстрагентов, проведенное нами, показало преимущество 2%-ной уксусной кислоты перед другими реактивами.
Определение проводят в 2%-ной уксуснокислой вытяжке или в ацетатно-буферном растворе Моргана. Пробу листьев разрезают ножом на мелкие кусочки и из нее берут навеску в измельчитель тканей, куда добавляют экстрагирующий раствор в отношении 1:20 и активированный уголь для осветления вытяжки. При сухом материале это отношение равно 1:100.
В отдельных порциях вытяжки определяют нитратный азот, фосфор в фосфатах, сульфатную серу, хлор, магний, кальций, калий и натрий. Калий, натрий и хлор переходят в вытяжку полностью, а кальций и магний частично.
Фильтрат до анализа сохраняют в холодильнике или с добавлением хлороформа. Для ускорения анализа рекомендуется иметь по четыре пробирочных штатива с 50 гнездами, набор автоматических пипеток и заранее подготовленные реактивы.
Для использования результатов анализа в оценке минерального питания нужно знать нормальное (оптимальное) содержание элементов в листьях или критические их уровни. Для некоторых культур критические уровни не установлены, но известен состав листьев высокопродуктивных растений и голодающих растений.
Методами тканевой диагностики можно не только уточнить потребность растений в подкормке, но и решить вопросы плодородия почв, например, о доступности почвенных элементов для определенной культуры, выявить значение свойств почвы (засоление, кислотность, гранулометрический состав, степень увлажнения), приемов агротехники, условий погоды в поглощении корнями питательных веществ почвы и удобрений.
Тканевая диагностика позволяет также понять многие физиологические процессы: поглощение и передвижение элементов по органам и тканям растений, обменные процессы, связь минерального питания с другими функциями растительного организма, прежде всего с фотосинтезом и дыханием.
Источник: Диагностика питания сельскохозяйственных культур:Справочник. Церлинг В.В. М.: Агропромиздат, 1990. — 235 с.
Инфоиндустрия
infoindustria.com.ua

 Именно она защищает деревья от воздействия окружающей среды. Что представляет собой перидерма? Как формируется? Как выполняет свои защитные функции? Чем отличается перидерма разных пород?
Именно она защищает деревья от воздействия окружающей среды. Что представляет собой перидерма? Как формируется? Как выполняет свои защитные функции? Чем отличается перидерма разных пород?








