V Международный конкурс научно-исследовательских и творческих работ учащихся Старт в науке. Определение тяжелых металлов в растениях методика
1.4. Методы определения тяжелых металлов
На сегодняшний день существуют две группы основных аналитических методов, определяющие наличие тяжелых металлов в почве:
1. Электрохимические
Электрохимические методы классифицируют по природе аналитического сигнала. Так, в ходе анализа можно измерять потенциал одного из электродов (потенциометрия), сопротивление ячейки или электропроводность раствора (кондуктометрия). Во многих случаях на электроды накладывают внешнее напряжение, после чего измеряют силу тока, проходящего через раствор (вольтамперометрические методы, в частности полярография). При этом на поверхности электродов протекают окислительно-восстановительные реакции, то есть идет электролиз раствора. Если провести электролиз до конца и измерить количество электричества, пошедшего на окисление (или на восстановление) определяемого вещества, можно рассчитать массу этого вещества. Такой метод называют кулонометрией. Иногда содержание определяемого вещества рассчитывают по привесу электрода, т. е. по массе выделившегося на нем продукта электролиза (электрогравиметрия). [3]
Электрохимические методы довольно селективны (кроме кондуктометрии), поэтому с их помощью количественно определяют одни элементы в присутствии других, раздельно определяют разные формы одного элемента, делят сложные смеси и идентифицируют их компоненты, а также концентрируют некоторые микропримеси. Электрохимические методы широко применяют для контроля состава природных и сточных вод, почв и пищевых продуктов, технологических растворов и биологических жидкостей. Соответствующие методики не требуют сложного оборудования, в них не используются высокие температуры и давления. Разные электрохимические методы различаются по чувствительности, точности, экспрессности и другим показателям, а потому хорошо дополняют друг друга [5].
Рассмотрим методы электрохимической группы:
вольтамперометрии:
Вольтамперометрическими называют методы анализа, основанные на регистрации и изучении зависимости тока, протекающего через электролитическую ячейку, от внешнего наложенного напряжения. Графическое изображение этой зависимости называют вольтамперограммой. Анализ вольтамперограммы даёт информацию о качественном и количественном составах анализируемого вещества.
Для регистрации вольтамперограмм нужна электролитическая ячейка, состоящая из индикаторного электрода и электрода сравнения. Электродом сравнения обычно служит насыщенный каломельный электрод или слой ртути на дне электролизёра. В качестве индикаторного используют ртутный капающий электрод, микродисковые платиновый или графитовый электроды.
В зависимости от типа индикаторного электрода вольтамперометрические методы принято делить на полярографию и собственно вольтамперометрию. Если в качестве индикаторного электрода используют ртутный капающий электрод, то полученные зависимости силы тока от напряжения называют полярограммами и соответственно метод анализа – полярографией. Метод был создан выдающимся чешским электрохимиком лауреатом Нобелевской премии Яр. Гейровским (1922). При работе с любым другим индикаторным электродом, в том числе и со стационарным ртутным, дело имеют с вольтамперометрией.
потенциометрии:
Потенциометрический анализ – это измерение показателей тех веществ, которые находятся в ионном состоянии. Иными словами, под объектами исследования выступают растворы, практически всегда водные, хотя анализ твердых веществ также осуществляется в случае, если есть наличие растворимых элементов. Для того чтобы исследовать некоторые частицы, может потребоваться электрод с чувствительной мембраной определенной формы, что поможет произвести анализ вязких веществ или гелей [3].
Потенциометрический анализ проводиться несколькими вариантами. Первый – это прямая потенциометрия. Чаще всего такой метод проводят для измерения уровня pH и зависит он от самого типа измерительного электрода. Этот метод самый простой. Второй метод – это потенциометрическое титрование, который осуществляется во множестве вариантов. Его суть состоит в том, что для вычисления показателей осуществляют ряд химических реакций под контролем ионоселективного электрода. Этот метод отличается от предыдущего большими трудозатратами, но и более точным результатом. И третий метод – метод добавок – родственный вышеописанному. Его проводят во множестве вариантов, которые и позволяют сделать анализ малых концентраций [4].
кулонометрии:
Кулонометрия - электрохимический метод анализа, основанный на измерении количества электричества, необходимого для электрохимического превращения определяемого вещества. В кулонометрии различают два вида анализа:
прямую кулонометрию;
кулонометрическое титрование.
кондуктометрии:
Кондуктометрические методы анализа основаны на измерении электропроводности исследуемых растворов. Существует несколько методов кондуктометрического анализа:
· прямая кондуктометрия – метод , позволяющий непосредственно определять концентрацию электролита путем измерения электропроводности раствора с известным качественным составом;
· кондуктометрическое титрование– метод анализа, основанный на определении содержания вещества по излому кривойтитрования. Кривую строят по измерениям удельной электропроводности анализируемого раствора, меняющейся в результате химических реакций в процессе титрования;
· хронокондуктометрическое титрование – основано на определении содержания вещества по затраченному натитрование времени, автоматически фиксируемого на диаграммной лентерегистратора кривой титрования.
Таким образом, можно найти и вычислить содержание тяжёлых металлов с низким пределом обнаружения в почвенном образце.
2.Экстракционно-фотометрические методы
Эти методы применяют в аналитической химии очень даже широко, причем определение анализируемого компонента в экстракте может производиться как фотометрическим, так и другим методом: полярографическим, спектральным.
Вместе с тем существуют некоторые группы экстракционных методов, в которых фотометрическое окончание является наиболее эффективным, обеспечивая необходимую быстроту и точность определения. Эти методы называются экстракционно-фотометрическими. Весьма распространенной является методика, по которой определенный микроэлемент переводят в растворимое в воде окрашенное соединение, экстрагируют его и экстракт фотомоделируют. Такая методика позволяет устранить мешающее влияние посторонних компонентов и увеличивает чувствительность определения, так как при экстракции происходит концентрирование микропримесей. Например, определение примесей железа в солях кобальта или никеля проводят экстракцией его тиоцаинатных комплексов амиловым спиртом [3].
Спектрофотометрия
Спектрофотометрический метод анализа основан на спектрально-избирательном поглощении монохроматического потока световой энергии при прохождении его через исследуемый раствор. Метод позволяет определять концентрации отдельных компонентов смесей окрашенных веществ, имеющих максимум поглощения при различных длинах волн, он более чувствителен и точен, чем фотоэлектроколориметрический метод. Известно, что фотоколориметрический метод анализа применим только для анализа окрашенных растворов, бесцветные растворы в видимой области спектра обладают незначительным коэффициентом поглощения. Однако многие бесцветные и слабо окрашенные соединения (особенно органические) обладают характерными полосами поглощения в ультрафиолетовой и инфракрасной областях спектра, что используют для их количественного определения. Спектрофотометрический метод анализа применим для измерения светопоглощения в различных областях видимого спектра, в ультрафиолетовой и инфракрасной областях спектра, что значительно расширяет аналитические возможности метода.
Спектрофотометрический метод в ультрафиолетовой области спектра позволяет индивидуально определять двух- и трехкомпонентные смеси веществ. Количественное определение компонентов смеси основано на том, что оптическая плотность любой смеси равна сумме оптических плотностей отдельных компонентов.
Атомно – абсорционной спектроскопии
Метод атомно-абсорбционной спектроскопии в настоящее время является самым удобным для определения содержания металлов в объектах окружающей среды, пищевых продуктах, почвах, различных сплавах. Также метод используется в геологии для анализа состава горных пород, металлургии для определения состава сталей.
Метод атомно-абсорбционной спектроскопии рекомендуется большей частью государственных стандартов для определения подвижного цинка в почве, природных и водах, а также во множестве цветных сплавов [5].
Метод основан на поглощении электромагнитного излучения свободными атомами в стационарном (невозбужденном) состоянии. При длине волны, соответствующей переходу атома из основного в возбужденное электронное состояние, заселенность основного уровня уменьшается. Аналитический сигнал зависит от числа невозбужденных частиц в анализируемом образце (т.е. от концентрации определяемого элемента), следовательно, измеряя количество поглощенного электромагнитного излучения можно определить концентрацию определяемого элемента в исходном образце [4].
Метод основан на поглощении ультрафиолетового или видимого излучения атомами газов. Чтобы провести пробу в газообразное атомное состояние, ее впрыскивают в пламя. В качестве источника излучения применяют лампу с полым катодом из определяемого металла. Интервал длин волн спектральной линии, испускаемой источником света, и линии поглощения того же самого элемента в пламени очень узок, поэтому мешающее поглощение других элементов практически не сказывается на результатах анализа. Метод атомно-абсорбционного спектрального анализа отличается высокой абсолютной и относительной чувствительностью. Метод позволяет с большой точностью определять в растворах около восьмидесяти элементов в малых концентрациях, поэтому он широко применяется в биологии, медицине (для анализа органических жидкостей), в геологии, почвоведении (для определения микроэлементов в почвах) и других областях науки, а также в металлургии для исследований и контроля технологических процессов.
Через слой атомных паров пробы, получаемых с помощью атомизатора пропускают излучение в диапазоне 190-850 нм. В результате поглощения квантов света атомы переходят в возбужденные энергетические состояния. Этим переходам в атомных спектрах соответствуют т. наз. резонансные линии, характерные для данного элемента. Согласно закону Бугера-Ламберта-Бера, мерой концентрации элемента служит оптическая плотность A = lg(I0/I), где I0 и I-интенсивности излучения от источника соответственно до и после прохождения через поглощающий слой.
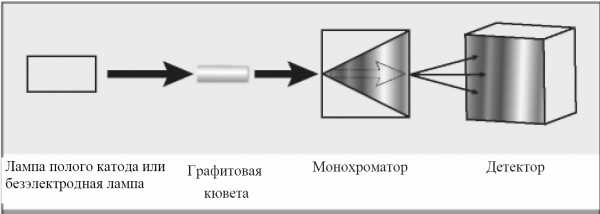
Рисунок 1.1. Принципиальная схема атомно-абсорбционного спектрометра: 1-лампа полого катода или безэлектродная лампа; 2-графитовая кювета; 3-монохроматор; 4-детектор
По точности и чувствительности этот метод превосходит многие другие; поэтому его применяют при аттестации эталонных сплавов и геологических пород (путем перевода в раствор).
Существенным отличием атомной абсорбции от пламенно-эмиссионной спектрометрии является то, что в последнем методе измеряется излучение, испускаемое атомами в возбужденном состоянии в пламени, а атомная абсорбция основана на измерении излучения, поглощенного нейтральными, невозбужденными атомами, находящимися в пламени, которых в пламени во много раз больше, чем возбужденных. Этим объясняется высокая чувствительность метода при определении элементов, имеющих высокую энергию возбуждения, т. е. трудно возбуждающихся [4].
Источником света в ААС служит лампа с полым катодом, испускающая свет, имеющий очень узкий интервал длин волн, порядка 0, 001нм. Линия поглощения определяемого элемента несколько шире испускаемой полосы, что позволяет измерять линию поглощения в ее максимуме. Прибор содержит необходимый набор ламп, каждая лампа предназначается для определения только одного какого-либо элемента.
«Кюветой» в ААС служит само пламя. Поскольку в ААС соблюдается закон Бэра, чувствительность метода зависит от длины поглощающего слоя пламени, которая должна быть постоянной и достаточно большой.
Применяют пламя, для получения которого в качестве горючего используют ацетилен, пропан или водород, а в качестве окислителя - воздух, кислород или оксид азота (1). Выбранная газовая смесь определяет температуру пламени. Воздушно-ацетиленовое пламя и воздушно-пропановое имеют низкую температуру (2200-2400 °С). Такое пламя используют для определения элементов, соединения которых легко разлагаются при этих температурах. Воздушно-пропановое пламя используют тогда, когда имеются затруднения в получении ацетилена; такая замена осложняет работу, поскольку в техническом пропане имеются примеси, загрязняющие пламя. При определении элементов, образующих труднодиссоциирующие соединения используют высокотемпературное пламя (3000-3200 ОС, создаваемое смесью оксид азота (1) - ацетилен. Такое пламя необходимо при определении алюминия, бериллия, кремния, ванадия и молибдена. Для определения мышьяка и селена, превращенных в их гидриды, требуется восстановительное пламя, образующееся сжиганием водорода в аргоно-воздушной смеси. Ртуть определяют (беспламенным методом» , поскольку она может существовать в парообразном состоянии и при комнатной температуре.
Сравнительная оценка возможностей и характеристик различных оптических методов не может носить абсолютного характера в связи с большим разнообразием и спецификой задач анализа. Различными могут быть требования к концентрационному диапазону, точности и нижним границам количественных определений. В зависимости от массы анализируемой пробы существенно различны требования к характеристике пределов обнаружения, достигаемых применяемым методом анализа. Так, располагая большой массой пробы, можно решить задачу определения микропримесей с помощью методов анализа, характеризуемых низкими относительными пределами обнаружения. Если же в распоряжении аналитика имеется лишь малая масса пробы, метод анализа должен характеризоваться низкими абсолютными пределами обнаружения интересующих элементов-примесей. Не последнюю роль в оценке недостатков и достоинств различных методов играет экономичность этих методов: стоимость аппаратуры, расход энергии, трудовые затраты, продолжительность анализа [5].
Атомно-эмиссионный спектральный анализ - практически самый распространенный экспрессный высокочувствительный метод идентификации и количественного определения малых содержаний элементов. Важным достоинством метода по сравнению с другими оптическими спектральными, а также многими химическими и физико-химическими методами анализа является возможность одновременного количественного определения большого числа элементов в широком интервале концентраций с приемлемой точностью при использовании малой массы пробы [4].
Достоинствами метода атомно-флуоресцентного анализа являются сравнительно низкий уровень фона, высокая селективность измерений, малые спектральные помехи, что позволяет детектировать слабые аналитические сигналы и соответственно очень малые абсолютные количества элементов. К недостаткам метода атомно-абсорбционной и в определенной мере атомно-флуоресцентной спектрометрии следует отнести затруднительность одновременного определения нескольких элементов [3].
С точки зрения возможности определения ультрамалых абсолютных содержаний элементов-примесей (#10-11-10-12 г) из оптических атомно-спектральных методов заслуживают особого внимания новые атомно-флуоресцентные и атомно-ионизационные методы с возбуждением и ионизацией атомов с помощью перестраиваемых лазеров на красителях, а также некоторые современные варианты оптических атомно-эмиссионного и атомно-абсорбционного методов анализа. В последнее время широкое распространение получил атомно-эмиссионный анализ с возбуждением спектров в высокостабильной индуктивно-связанной плазме (ИСП-АЭС). Современные анализаторы на основе этого метода обычно включают полихроматор с решеткой и приемники с зарядовой связью. Такая оптическая схема позволяет одновременно регистрировать все спектральные линии в ультрафиолетовом и видимом диапазонах. Программное обеспечение современных ИСП-АЭС-анализаторов способно автоматически рассчитывать концентрацию определяемых элементов по интенсивности их спектральных линий с коррекцией фона и возможных спектральных наложений. Соответственно такие анализаторы отличаются высокой точностью и продуктивностью [4].
Основными особенностями МГА-915-М является: универсальность и селективность. Анализатор МГА-915М, благодаря своей высокой селективности, позволяет определять содержание широкого круга элементов в пробах самого разного состава – без или с минимальной пробоподготовкой. ААС с ЭТА и зеемановским корректором неселективного поглощения во всем мире признан в качестве референтного метода при определении малых содержаний элементах в пробах сложного состава [5].
Пределы обнаружения элементов на уровне лучших атомно-абсорбционных спектрометров, предлагаемых на рынке аналитического оборудования.
Автоматизация измерений. МГА-915М является полным автоматом с автоматической сменой источников излучения и установкой соответствующих резонансных линий, присутствует турель на 6 ламп (компьютерная перестройка с одного элемента на другой без необходимости ручной юстировки). Для ввода проб в МГА-915М используется автосемплер с 55 ячейками для проб. Полученные данные могут непрерывно передаваться в АСУ для управления технологическим процессом. Анализ воздуха - с электростатическим осаждением аэрозолей воздуха непосредственно в графитовом атомизаторе. Анализ низких содержаний гидридообразующих элементов (в частности Se, As, и др.) и ртути в природных водах с помощью ртутно-гидридной приставки. Возможно проведение прямого анализа питьевых, сточных и морских вод и биожидкостей (без предварительной пробоподготовки). Прибор имеет автономную систему охлаждения. Спектрометр «МГА-915М» может применяться в экологии, геологоразведке, контроле технологических процессов, производственной санитарии, научных исследованиях [5].
Экологический контроль:
измерение содержания различных элементов в воде, почве, донных отложениях, атмосферном воздухе, а также тканях растительного и животного происхождения.
Технологический контроль:
экспресс-анализ и непрерывный контроль состава веществ в технологических процессах;
входной контроль, контроль готовой продукции.
Медицина:
анализ тканей и жидкостей биологического происхождения (кровь, моча, волосы и т.д.)
Криминалистика:
Ветеринарные лаборатории:
Контролирующие и сертифицирующие лаборатории:
анализ пищевых продуктов и кормов, анализ сточных, природных, питьевых вод и воздуха.
Контроль качества вин и крепких напитков:
содержание широкого круга элементов в ликероводочной продукции;
определение подлинности напитков.
Спектрометр измеряет концентрацию элементов, аналитические линии которых лежат в рабочей области спектра спектрометра, методом атомно-абсорбционного (АА) анализа с электротермической атомизацией. Управление процессом измерения и обработка полученной информации производится с помощью компьютера с установленным программным обеспечением. Дозирование жидкой пробы в печи атомизатора может проводиться либо ручным микродозатором объемом 5...50 мкл, либо с помощью автодозатора (автосемплера).
Рисунок 1.2. Атомно-абсорбционный спектрометр «МГА-915М»
«МГА-915» предназначен для измерения содержания элементов (Ag, Al, As, Au, Ba, Be, Bi, Cd, Co, Cr, Cu, Fe, Hg, Mn, Mo, Ni, Pb, Pd, Pt, Rh, Ru, Se, Sn, Sb, Sr, Ti, V, Zn и др.) в широком круге объектов: различных типах вод (питьевые, природные, сточные, морские), атмосферном воздухе, почвах, донных отложениях и осадках сточных вод, пищевых продуктах и сырье (в том числе в напитках), биологических тканях и жидкостях (кровь, моча), продуктах нефтехимического производства, а также металлах и сплавах и иных объектах.
studfiles.net
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ НЕКОТОРЫХ ТЯЖЕЛЫХ МЕТАЛЛОВ В РАСТЕНИЯХ ЦЕНТРАЛЬНО-ЧЕРНОЗЕМНОГО ГОСУДАРСТВЕННОГО БИОСФЕРНОГО ЗАПОВЕДНИКА ИМ. В.В. АЛЕХИНА КАК ЭТАП ЭКОЛОГИЧЕСКОГО МОНИТОРИНГА ЕГО СОСТОЯНИЯ
Автор:
Анна Пученкова (Курск, Россия)
Проблема загрязнения окружающей среды тяжелыми металлами остается актуальной в связи с расширением их потребления и ростом числа источников поступления [2, с.7]. Тяжелые металлы остаются ведущей группой загрязняющих веществ, которые представляют научный и практический интерес для оценки экологического состояния загрязненных территорий. Возросшее число автотранспорта и работа промышленных предприятий связана с выбросом в атмосферу токсичных веществ, в том числе и тяжелых металлов (ТМ). Загрязнение окружающей среды тяжелыми металлами оказывает значительное отрицательное влияние на химический состав почв, пищевые свойства растительности. Попадая в почву тяжелые металлы, вступают во все основные циклы миграции, происходящие в биосфере [2]. Важность понимания проблемы загрязнения почв тяжелыми металлами определяется также тем, что почвы являются природным накопителем тяжелых металлов в окружающей среде и основным источником загрязнения сопредельных сред, включая растения[1].
Центрально-Черноземный государственный биосферный заповедник им. В. В. Алехина широко известен как единственный сохранившийся кусочек ландшафта лесостепи. Заповедник находится в юго-западной части Среднерусской возвышенности, в пределах средней полосы лесостепной зоны, и состоит из пяти разобщенных и разных по величине участков — Стрелецкого, Казацкого, Баркаловки, Букреевых Барм и Ямского общей площадью 4847 га. Заповедник находится в зоне умеренного увлажнения и умеренно холодного климата. Рельеф заповедника типично эрозионный. Все его участки сильно изрезаны и дренируются глубокими балками с многочисленными разветвлениями.
Основное богатство заповедника — луговые целинные степи, представляющие коренной зональный тип травянистой растительности, — занимают половину его площади. Многие растения: бобовые — горошек тонколистный, вязель пестрый или злаки — костер безостый, пырей средний, вейник наземный образуют пятна или куртины [3].
Мониторинг состояния природных объектов является актуальным для биосферных заповедников, поэтому определение содержания тяжелых металлов в растениях за 30 летний цикл является важным и подлежит изучению.
Исследуемые образцы отбирали в сухую погоду, в утренние часы, после высыхания росы. На выбранном для отбора проб участке выделили 8-10 учетных площадок площадью 1 м2 , располагая их по диагонали участка. Точечные пробы количеством не менее десяти отбирали с каждой учетной площадки вручную. Полученную зеленую массу расстилали на полиэтиленовую пленку и тщательно перемешивали, получая объединенную пробу. Исследуемую пробу, выделенную методом квартования из объединенной пробы, помещали во взвешенную тару.
Высушенную пробу оставляли на лабораторном столе на 24 ч для доведения ее до воздушно-сухого состояния. Воздушно-сухую пробу использовали в дальнейшем для озоления. Озоление проводили следующим способом: пробу без уплотнения укладывали в фарфоровый тигель, чтобы в ее нижние слои поступал воздух. Тигель с пробой взвешивали на весах высокого класса точности, помещали в холодную печь для обугливания пробы и повышали температуру до 200 °С — 250 °С (что сопровождается появлением дыма).
После прекращения выделения дыма температуру печи доводили до 500 °С и прокаливали в течение 3 — 5 ч. Золу смачивали дистиллированной водой, приливали по каплям концентрированную перекись водорода, затем раствор азотной кислоты (1:1). Высушивали золу на электроплитке. Далее тигель снова помещали в печь и прокаливали при температуре 500°С до достижения постоянной массы тигля с золой.
Охлажденную и доведенную до постоянной массы золу смачивали несколькими каплями дистиллированной воды и добавляли раствор соляной кислоты (1:1). Затем тигель ставили на электрическую плитку и упаривали содержимое до влажных солей, не допуская разбрызгивания и прокаливания осадка. После этого в пробу вносили раствор азотной кислоты (1:1), накрывали тигель часовым стеклом и снова нагревали на электроплитке до кипения, не допуская разбрызгивания осадка.
После охлаждения тигля проводили отделение раствора золы фильтрованием от нерастворенного осадка.
Определение тяжелых металлов выполняли инверсионно – вольтамперометрическим методом. Концентрацию металлов определяли методом добавок стандартных растворов, приготовленных из ГСО. Результаты исследования отображены в таблицах №1 и №2.
Во всех исследуемых образцах растений были обнаружены тяжелые металлы. Наиболее часто в образцах отобранных в 1986 г., встречается свинец, его содержание колеблется в пределах 1,116 – 12,494 мг/кг. В настоящие время активным накопителем свинца является таволга шестилепестная и адонис, его содержание 7,012 и 7,063 мг/кг соответственно, что в 7 раз превышает концентрацию в других исследуемых образцах, причем в адонисе не было обнаружено других тяжелых металлов, это может говорить об избирательности данного растения в накоплении определенного элемента. Цинк, кадмий и медь были также обнаружены в изучаемых образцах. Лучше всего аккумулирует цинк и медь горошек тонколистный при этом их содержание в образцах, отобранных в 2011 г, превышает аналогичные значения в образцах отобранных 1986г.
Литература:
1. Клинская Е.О. содержание свинца, цинка, никеля и кадмия в почвах города Биробиджана и оценка их влияния на здоровье населения // Известия Самарского научного центра Российской академии наук, т. 12, №1(4), 2010. – С 1027 – 1031.
2. Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам / / Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Институт биологии КарНЦ РАН. Петрозаводск: Карельский научный центр РАН, 2007. - 172 с.
3.http://www.zapoved.net/index.php/News/Регионы/Центральный округ/Курская область/Курский район/Центрально-Черноземный заповедник.
oldconf.neasmo.org.ua
Изучение поглощения тяжелых металлов в органах растений гистохимическим методом
Изучение поглощения тяжелых металлов в органах растений гистохимическим методом
Долинина К.Д. 11Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школа № 16» Копейского городского округа
Худякова Л.П. 11Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школа № 16» Копейского городского округа
Текст работы размещён без изображений и формул.Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Введение
Среди многочисленных веществ, загрязняющих биосферу, тяжелые металлы считаются самыми опасными. Они поступают в почву, водоемы и атмосферу как в результате естественных процессов (выветривание горных пород, вулканическая деятельность), так и в результате хозяйственной деятельности человека. Загрязнение почвы солями тяжелых металлов влияет на рост и развитие сельскохозяйственных культур, на здоровье человека, использующего эти культуры.
Объектом нашего исследования стали семена и проростки белой горчицы, предметом исследования – особенности накопления и распределения ионов тяжелых металлов в органах растения.
Цель нашего исследования: определение локализации ионов тяжелых металлов в различных частях растений.
Гипотеза исследования: тяжелые металлы неравномерно распределяются в вегетативных органах растений, наибольшее их содержание должно быть в листе.
Для достижения цели были поставлены следующие задачи:
1) изучить литературу по теме исследования
2) рассмотреть влияние солей меди, свинца, цинка на растения
3) исследовать особенности накопления, распределения ионов тяжелых металлов в различных частях растения
4) научиться применять гистохимический метод при проведении лабораторного исследования.
В своей работе мы использовали следующие методы: анализ литературы, наблюдение, эксперимент.
Глава 1. Гистохимический метод определения тяжелых металлов
Тяжелые металлы
Тяжелые металлы – группа металлов, имеющих молярную массу более 40-50 г/моль и плотность более 5г/см3. В малых количествах тяжелые металлы являются необходимой частью живых организмов. В научной литературе их называют микроэлементами. Они по-разному влияют на биохимические процессы. Но накопление тяжелых металлов может привести к сильному изменению состояния любого организма. Например, к снижению скорости роста, увяданию надземной части растения, повреждению его корневой системы или к изменению водного баланса. У животных возникают заболевания различных систем органов: дыхательной, пищеварительной, эндокринной и нервной систем.
К тяжелым металлам относятся, например, медь, свинец, цинк [3,4].
Медь Cu необходима растениям для образования хлорофилла, активно участвует в процессах фотосинтеза, дыхания, фиксации азота, входит в состав пластоцианина, участвующего в фотосинтезе, и некоторых других медьсодержащих белков и окислительных ферментов. Она повышает засухо-, морозо- и жароустойчивость растений. Токсическое действие меди в повышенных концентрациях проявляется в снижении накопления фитомассы, уменьшении содержания хлорофилла. Высокие концентрации этого металла приводят к развитию металлотоксикозов (хлорозы, некрозы, ингибирование роста корней и побегов), вплоть до полной гибели растений.
Цинк Zn также влияет на процесс фотосинтеза, углеводный обмен, синтез белка, на образование витаминов группы В. Под влиянием цинка в растениях увеличивается образование гормона роста-ауксина, повышается засухо-, морозо- и жароустойчивость растений.
Токсичное действие свинца (Pb) на растения связано, главным образом, с нарушением фотосинтеза, а также роста растений. В основном он накапливается в корнях растений. Однако следует отметить, что фитотоксичность этого металла менее выражена по сравнению с многими другими тяжелыми металлами. Это объясняется тем, что в почве катионы металла быстро связываются с образованием малорастворимых соединений. Вследствие этого свинец становится малоподвижным и утрачивает свою доступность для растений.
Гистохимический метод
В основе гистохимического метода лежит соединение принципов и методов химического анализа с принципами и методами морфологического изучения клеток и тканей, используемыми в цитологии и гистологии. Благодаря этому обеспечиваются существенные преимущества в изучении организации растительных и животных тканей, т.к. выявленное химическое вещество можно связать с определенной тканевой или клеточной структурой, т.е. установить его локализацию [2]. Гистохимический метод находит широкое применение в гистологии, цитологии, эмбриологии, патологической анатомии, экспериментальной и клинической морфологии. С помощью разнообразных методов современной гистохимии можно судить об особенностях функционирования различных тканевых и клеточных структур, определять характер и темп обменных процессов в клетках и тканях, обнаруживать ранние проявления заболеваний.
Непременным условием проведения гистохимического метода исследования является сохранение структуры тканей и клеток в состоянии, близком тому, какое имеется в живом организме. Это достигается получением срезов свежезамороженных тканей с помощью ножа глубокого охлаждения и криостата, а также использованием лиофильной сушки.
Этот метод можно использовать для биотестирования почвы, в которой выращиваются растения, для экологического мониторинга загрязненной территории.
Гистохимический метод можно использовать для определения локализации тяжелых металлов в органах растений [1]. Для визуализации распределения и ориентировочной концентрации тяжелых металлов можно использовать металлохромные индикаторы (металлоиндикаторы). Это вещества, образующие окрашенные внутрикомплексные соединения при определенных значениях рН. Интенсивность окраски этих соединений пропорциональна количеству комплексообразователя. К таким индикаторам относится дитизон (рис.1). Это качественный реактив на ионы меди (II), свинца, цинка [6]. С этими металлами дитизон образует соли, имеющие разный оттенок красно-коричневого цвета.
Рис.1. Дитизон
Горчица белая
Горчица белая Sinápis álba – однолетнее растение, относится к семейству Капустоцветных [5].
Царство: Растения
Отдел: Цветковые
Класс: Двудольные
Порядок: Капустоцветные
Семейство: Капустные
Род: Горчица
Вид: Горчица белая
Горчица используется в качестве кормовой культуры или как сидерат. Хорошо восстанавливает бедные почвы — быстро производит органическое вещество, которое заделывается в почву (через 30-50 дней от посева) и обогащает её азотом и фосфором; поглощает труднорастворимые минералы и переводит их в легкодоступные формы; отличный разрыхлитель для тяжелых почв, улучшает структуру почвы; подавляет рост сорняков до посева основной культуры или после уборки урожая; выделяемые горчицей вещества препятствуют росту плесени и бактерий, поэтому посадка горчицы после томатов, картофеля и др. овощей, значительно снижает в почве количество патогенов фитофторы, парши, гнилостных микроорганизмов; позволяет сократить севооборот и вернуть основную культуру на прежнее место раньше требуемых сроков на год или два; на почвах, где выращивается белая горчица, резко снижается количество проволочника и слизней; при поздней посадке нескошенная горчица остается в качестве мульчи, выполняет функцию снегозадержания; посеянная весной белая горчица во время цветения является хорошим медоносом.
Выводы по главе 1
Нами была проанализирована литература по теме исследования, установлена сущность гистохимического метода анализа, влияние ионов тяжелых металлов на растения.
Глава 2. Опыты с растворами солей тяжелых металлов
Для проращивания семян белой горчицы использовали чашки Петри, на дно которых ровным слоем насыпали одинаковый объем прокаленного песка. В каждую чашку сажали по 50 семян. Однократно поливали растворами солей хлорида меди (II), ацетата свинца, сульфата цинка разной концентрации. Растворы разной концентрации готовили методом разведения наиболее концентрированного раствора. В литературе мы нашли, что предельно допустимая концентрация ионов меди (II) – 500 мг/л, ионов свинца – 50 мг/л, ионов цинка – 1000 мг/л.
Использовали следующие растворы (таблица 1).
Таблица 1
Концентрации ионов металлов
|
Номер чашки Петри |
Cu2+, мг/л |
Pb2+, мг/л |
Zn2+, мг/л |
|
1 |
500 |
50 |
1000 |
|
2 |
50 |
5 |
100 |
|
3 |
5 |
0,5 |
10 |
|
4 |
0,5 |
0,05 |
1 |
После закладки семян в песок их однократно поливали раствором соли тяжелого металла, в остальное время по мере подсыхания увлажняли дистиллированной водой. В контрольном варианте использовали дистиллированную воду.
Проращивание семян проводили в течение 14 дней при постоянной температуре в темноте. На свету происходит накапливание хлорофилла в зеленых частях растения, что мешает определению локализации солей тяжелых металлов.
На протяжении всего эксперимента вели дневник наблюдений (приложение 1).
На следующем этапе работы готовили срезы тканей, окрашивали их раствором дитизона с последующей фиксацией в виде временных микропрепаратов.
Раствор дитизона готовили следующим образом: навеску дитизона массой 3 г (1-2 кристаллика) растворили в смеси из 6 мл ацетона и 2 мл дистиллированной воды. Готовили его непосредственно перед началом работы, так как он долго не хранится.
На срез капали 1-2 капли реактива. Ждали 3-5 минут. После этого с помощью цифрового микроскопа Digital Blue QX5 определяли локализацию и интенсивность окраски. Отмечали её по следующей шкале:
0 - отсутствие окрашивание,
1 – очень слабое окрашивание,
2 – слабое окрашивание,
3 – окрашивание средней интенсивности,
4 – окрашивание высокой интенсивности,
5 – окрашивание очень высокой интенсивности.
Результаты представлены в таблицах 2 - 4.
Таблица 2
Локализация солей меди (II)
|
СuCl2(0,5 мг/л) |
||
|
Часть растения |
Степень окрашивания |
Оценка |
|
Зона всасывания |
Высокой интенсивности |
4 |
|
Зона роста |
Средней интенсивности |
3 |
|
Нижняя часть стебля |
Высокой интенсивности |
4 |
|
Средняя часть стебля |
Средней интенсивности |
3 |
|
Верхняя часть стебля |
Очень высокой интенсивности |
5 |
|
Лист |
Очень высокой интенсивности |
5 |
Таблица 3
Локализация солей свинца
|
Pb(Ch4COO)2 (0,05 мг/л) |
||
|
Часть растения |
Степень окрашивания |
Оценка |
|
Зона всасывания |
Слабое |
2 |
|
Зона роста |
Очень высокой интенсивности |
5 |
|
Зона деления |
Высокой интенсивности |
4 |
|
Нижняя часть стебля |
Средней интенсивности |
3 |
|
Средняя часть стебля |
Высокой интенсивности |
4 |
|
Верхняя часть стебля |
Очень высокой интенсивности |
5 |
|
Лист |
Очень высокой интенсивности |
5 |
Таблица 4
Локализация ионов цинка
|
ZnSO4(1,0 мг/л) |
||
|
Часть растения |
Степень окрашивания |
Оценка |
|
Зона роста |
Очень слабое |
1 |
|
Придаточный корень |
Слабое |
2 |
|
Зона всасывания |
Очень слабое |
1 |
|
Нижняя часть стебля |
Отсутствует |
0 |
|
Средняя часть стебля |
Отсутствует |
0 |
|
Верхняя часть стебля |
Отсутствует |
0 |
|
Лист |
Очень высокой интенсивности |
5 |
Выводы по главе 2
Проведя исследование, мы пришли к следующим результатам:
среди представленных металлов наиболее токсичными по отношению к горчице являются ионы меди;
ионы цинка накапливаются в основном в корне и листе;
ионы свинца и меди накапливаются во всех вегетативных органах, но больше в стебле и листе;
максимальным угнетающим действием обладают ионы меди, минимальным – цинка;
контрольный образец, поливаемый дистиллированной водой, отличается активным ростом, размером листа, хорошо сформировавшейся корневой системой;
концентрация раствора соли тяжелого металла влияет на начало и скорость прорастания семян;
соли свинца и цинка в больших концентрациях оказывают благотворное влияние на прорастание семян, но замедляют их развитие.
Эксперименты, проведенные нами, доказали верность выдвинутой гипотезы о том, что тяжелые металлы неравномерно распределяются в вегетативных органах растений, наибольшее их содержание обнаружено в листе.
Заключение
В работе рассмотрена возможность определения локализации тяжелых металлов в растении горчица белая с помощью гистохимического метода. Результаты показывают, что этот метод можно использовать даже в условиях школьной лаборатории. Гистохимический метод относится к полуколичественным методам анализа. Поэтому его можно использовать для оценки состояния окружающей среды, биотестирования почвы, в которой накапливаются ионы тяжелых металлов.
Список литературы
1.Ольшанская, Л.Н. Гистохимические исследования локализации тяжелых металлов в тканях высших растений в процессе фитоэкстракции [Текст] / Л.Н.Ольшанская // Известия высших учебных заведений, сер. «Химия и химическая технология». – 2016.
Пичугин, Н.Г. Лабораторный комплекс для учебной практической и проектной деятельности по биологии и экологии [Текст] / Н.Г.Пичугин // Биология в школе.-2017.-№ 3.
Титов, А.Ф. Тяжелые металлы и растения [Текст] /А.Ф. Титов. – Петрозаводск, 2014.
Шапошникова, И.А. Металлы в живых организмах.10-11 классы. [Текст]/И.А.Шапошникова. – М.: Издательство БИНОМ, 2013.- 408 с.
Горчица белая [Электронный ресурс] /URL: http://iplants.ru
Дитизон [Электронный ресурс] /URL: http://dic.academic.ru
Приложение 1
Дневник наблюдений
|
СuCl2 |
Кол-во проросших семян |
||||
|
Дата |
№1 |
№2 |
№3 |
№4 |
№5 |
|
15.01 |
0 |
0 |
0 |
7 |
11 |
|
16.01 |
0 |
0 |
0 |
18 |
19 |
|
18.01 |
0 |
0 |
0 |
18 |
38 |
|
20.01 |
0 |
0 |
0 |
18 |
40 |
|
23.01 |
0 |
0 |
3 |
30 |
40 |
|
25.01 |
0 |
0 |
3 |
31 |
47 |
|
27.01 |
2 |
0 |
8 |
38 |
47 |
|
Pb(Ch4COO)2 |
Количество проросших семян |
||||
|
Дата |
№1 |
№2 |
№3 |
№4 |
№5 |
|
18.01 |
10 |
7 |
7 |
12 |
10 |
|
20.01 |
29 |
30 |
24 |
38 |
31 |
|
23.01 |
36 |
30 |
37 |
43 |
36 |
|
25.01 |
40 |
42 |
45 |
49 |
38 |
|
27.01 |
40 |
43 |
46 |
49 |
47 |
|
ZnSO4 |
Количество проросших семян |
|||
|
Дата |
№1 |
№2 |
№3 |
№4 |
|
30.01 |
15 |
5 |
1 |
16 |
|
01.02 |
28 |
37 |
17 |
25 |
|
03.02 |
43 |
41 |
28 |
36 |
|
06.02 |
43 |
34 |
39 |
40 |
|
08.02 |
46 |
46 |
47 |
42 |
|
10.02 |
46 |
47 |
48 |
46 |
Приложение 2
Накопление ионов свинца, 0,05мг/л
контрольный образец зона роста корня
(дистиллированная вода)
стебель лист
цифровой микроскоп DigitalBlueQX5, увеличение 60х
Просмотров работы: 200
school-science.ru
Определение металлов в почве
Откуда появляются тяжелые металлы в почве?
Главные источники тяжелых металлов — отходы промышленных предприятий, различные типы электростанций, заводы из добывающей и перерабатывающей отрасли, а также выхлопы автомобильной и некоторой иной техники. Чаще всего тяжелые металлы попадают в окружающую среду в виде аэрозолей или таких химических соединений как сульфаты, сульфиды, карбонаты, оксиды и др.
Какие из тяжелых металлов чаще всего загрязняют почву? Наиболее распространенным металлами из группы тяжелых в промышленных отходах являются ртуть, свинец и кадмий. Также нередко встречается среди вредных выбросов мышьяк, цинк, железо, медь и марганец.
Тяжелые металлы могут попадать в окружающую среду в нерастворимых и растворимых формах.
Пути засорения почвы тяжелыми металлами
Первый способ загрязнения тяжелыми металлами почвы — попадание в воду и дальнейшее распространение этой воды в грунте.

Другой вариант — попадание тяжелых металлов в атмосферу и выпадение в осадок посредством сухого осаждения или мокрого осаждения.

Взаимодействие почвы с тяжелыми металлами
Почва является адсорбентом различных типов химических элементов, в том числе и тяжелых металлов. На протяжении длительного периода они находятся в грунте, проходя постепенную дезактивацию. Для некоторых тяжелых металлов эти сроки могут составлять несколько сотен или даже тысяч лет.
Ионы тяжелых и других металлов могут вступать в реакцию с компонентами почвы, утилизируясь путем выщелачивания, с помощью эрозии, дефляции и благодаря растениям.
Какие существуют методы определения тяжелых металлов в почве?
Прежде всего, надо понимать, что состав почвы неоднородный, поэтому даже на одном и том же земельном участке почвенные показатели могут сильно различаться в различных его частях. Поэтому нужно брать несколько проб и либо исследовать каждую в отдельности, либо смешивать их в единую массу и брать образец для исследования оттуда.
Количество методов определения металлов в почве достаточно велико, например некоторые из них:
- метод определения подвижных форм.
- метод определения обменных форм.
- метод выявления растворимых в кислотах (техногенных) форм.
- метод валового содержания.
С помощью данных методик производится процесс вытяжки металлов из почвы. Впоследствии нужно определить процент содержания тех или иных металлов в самой вытяжке, для чего применяются три основных технологии:
1) Атомно-абсорбционная спектрометрия.
2) Масс-спектрометрия с индуктивно-связанной плазмой.
3) Электрохимические методы.
Прибор для соответствующей технологии выбирается в зависимости от того, какой элемент исследуется и какая его концентрация предполагается в почвенной вытяжке.
Спектрометрические методы исследования тяжелых металлов в почве
1) Атомно-абсорбционная спектрометрия.
Проба грунта растворяется в специальном растворителе, после чего реагент связывается с определенным металлом, выпадает в осадок, высушивается и прокаливается, чтобы вес стал постоянным. Затем производится взвешивание с использованием аналитических весов.
К недостаткам этого метода относится значительное количество времени, требуемое на анализ, и высокий уровень квалификации исследователя.
2) Атомно-абсорбционная спектрометрия с плазменной атомизацией.
Это более распространенный метод, позволяющий определить сразу несколько различных металлов за один прием. Также отличается точностью. Суть метода заключается в следующем: пробу нужно перевести в газообразное атомное состояние, затем анализируется степень поглощения атомами газов излучения — ультрафиолетового или видимого.
Электрохимические методы исследования тяжелых металлов в почве
Подготовительный этап заключается в растворении образца почвы в водном растворе. В дальнейшем применяются такие технологии определения в нем тяжелых металлов:
- потенциометрия.
- вольтамперометрия.
- кондуктометрия.
- кулонометрия.
ecology-of.ru
3.5 Определение накопления тяжёлых металлов в тканях растений. Загрязнение тяжёлыми металлами придорожной травянистой растительности Павловского района
Похожие главы из других работ:
Загрязнение тяжёлыми металлами придорожной травянистой растительности Павловского района
1.1 Характеристика тяжёлых металлов
Тяжёлые металлы - группа химических элементов со свойствами металлов (в том числе и полуметаллы) и значительным атомным весом либо плотностью. Термин «тяжёлые металлы» чаще всего рассматривается не с химической...
Загрязнение тяжёлыми металлами придорожной травянистой растительности Павловского района
1.2 Влияние тяжёлых металлов на растения и почву
Начало технической революции в середине 20 века, и в связи с этим внедрение различных технологий в разные отрасли производства...
Изучение влияния антропогенной нагрузки на травянистую растительность Лабинского района
4.5 Определение содержания тяжёлых металлов в тканях органов Polygonum aviculare
Растительный материал собирался в августе 2013 года во второй половине дня в сухую погоду, температура воздуха не превышала 26 ° С...
Исследование аварийной экотоксикологической ситуации и меры по ее устранению (хром)
Определение тяжелых металлов в почвах сельскохозяйственных угодий, продукции растениеводства и кормах
Работы по определению содержания тяжелых металлов в почвах, продукции растениеводства и кормах проводятся проектно-изыскательскими станциями химизации сельского хозяйства и их филиалами по программам...
Источники наличия тяжелых металлов в природных водах
Глава 1. Свойства тяжелых металлов и их роль в экологии
Тяжёлые металлы - это элементы периодической системы химических элементов Д.И. Менделеева, с относительной молекулярной массой больше 40...
Источники наличия тяжелых металлов в природных водах
1.1 Физические и химические свойства тяжелых металлов
Химические и физические свойства меди. Медь - химический элемент I группы периодической системы Менделеева; атомный номер - 29, атомная масса - 63,546. Температура плавления ? 1083 градусов C, температура кипения - 2595 градусов C, плотность - 8,98 г/см3...
Источники наличия тяжелых металлов в природных водах
1.2 Нормирование содержания тяжелых металлов в воде (ПДК)
Предельно допустимая концентрация (ПДК) - утверждённый в законодательном порядке санитарно-гигиенический норматив. Под ПДК понимается такая концентрация химических элементов и их соединений в окружающей среде...
Источники наличия тяжелых металлов в природных водах
1.3 Источники попадания тяжелых металлов в природные воды
Тяжелые металлы - свинец, кадмий и ртуть - относятся к микрозагрязнителям и представляют собой особую проблему, так как они играют особую роль в отношении здоровья людей и окружающей среды из-за их персистентности...
Источники наличия тяжелых металлов в природных водах
Глава 2. Методы очистки природных вод от тяжелых металлов
Существуют механические, химические, физико-химические и биологические методы очистки природных вод...
Моделирование процессов в природно-техногенных комплексах
1.2 Модель передвижения тяжёлых металлов
При повышении содержания тяжёлых металлов в почве и природных водах выше предельно допустимых возникает угроза загрязнения природной среды, приводящая к токсичным условиям для биоты. В группу тяжёлых металлов включают: Pb, Zn, Cd, Hg, Mo, Mn, Ni, Sn, Tu, Co, Cn...
Почвы как ионообменные сорбенты, особенности сорбции ионов свинца дерново-подзолистой супесчаной почвы
6 Пути поступления тяжелых металлов в почву
В последние десятилетия человек стал причиной быстрой деградации почв, хотя потери почв имели место на протяжении всей человеческой истории. Во всех странах мира сейчас распахивают около 1,5 млрд. га земель...
Почвы как ионообменные сорбенты, особенности сорбции ионов свинца дерново-подзолистой супесчаной почвы
7 Сорбция тяжелых металлов почвами
В то же время количественные закономерности адсорбции и ионного обмена могут быть описаны сходными по форме уравнениями. Для описания изотерм адсорбции ТМ пользуются уравнением Фрейндлиха или уравнением Ленгмюра...
Содержание токсичных веществ и элементов в речной рыбе Приамурья
1.1 Биогеохимические свойства тяжелых металлов
Формы нахождения тяжелых металлов в окружающей среде: · В атмосферном воздухе тяжелые металлы присутствуют в форме органических и неорганических соединений в виде пыли и аэрозолей, а также в газообразной элементной форме (ртуть)...
Содержание токсичных веществ и элементов в речной рыбе Приамурья
2.4 Методика определения содержания тяжелых металлов в рыбе
В санитарно-гигиенической лаборатории Россанэпиднадзора используется способ минерализации проб пищевых продуктов и продовольственного сырья с использованием аналитических автоклавов для последующего определения содержания токсичных...
Экологическая оценка водоемов при помощи ряски малой
1. Изучение влияния солей тяжелых металлов на ряску малую.
...
eco.bobrodobro.ru