Вильдфлуш И.Р. и др. Определение тяжелых металлов в почве и растениях - файл n1.doc. Определение содержания тяжелых металлов в растениях
Накопление тяжелых металлов в растениях в зависимости от уровня загрязнения почв
В статье рассматриваются проблемы загрязнения окружающей среды от деятельности металлургической промышленности. Приведены основные загрязняющие вещества металлургического производства. Даны содержания тяжелых металлов в почве и растениях.
In the article it is considered a problem of environmental pollutioncaused by mining industry. The main polluters of thi mining and metallurgical complex are given by stages of regeneration cycle. Recommendations on refining the ecologicalcondition
Одним из основных принципов концепции устойчивого развития является: право на развитие должно быть реализовано таким образом, чтобы удовлетворять потребности в развитии сохранении окружающей среды нынешнего и будущих поколений. Так как особенность многих видов природных ресурсов проявляется в том, что их использование ограничено во времени. Уровень их потребления сегодня должен жестко предопределять возможность удовлетворения потребности в них в будущем. Именно с этой проблемой природопользования связан вопрос рационального использования природных ресурсов, так как предприятия перерабатывающей промышленности в основной своей части являются эколого-опасными. Поэтому решение данных проблем предопределяет необходимость поиска оптимального, рационального обеспечения текущих и будущих потребностей и выработки обоснованной политики недропользования и охраны окружающей среды [1]. В настоящее время воздействие человека на окружающую среду по своим масштабам превосходит способности природы к самовосстанавлению. Опасны мигрирующие отходы не полностью протекающих технологических процессов: газовые выбросы, сточные воды промышленных предприятий, содержащие токсичные соединения и попадающие в почву и водоемы [2].
Наиболее крупные загрязнители окружающей среды в Южно-Казахстанской области сосредоточены в городе Шымкент. Среди них АО ПК «Южполиметалл» расположен в территории города и оказывает существенное влияние на загрязнение окружающей среды, а неблагоприятная экологическая обстановка в районе свинцового производства складывалась годами. АО ПК “Южполиметалл” оказывает существенное влияние на накопление тяжелых металлов в почве и растениях.
Мы изучили закономерности распространения и аккумуляции тяжелых металлов растениями в зависимости от содержания их в почве и определили содержание тяжелых металлов в почве и растениях распространенных участках территории города
Для исследования использованы были следующие методы: атомно-адсорбционным метод определения содержания тяжелых металлов в почве и растениях (свинец, кадмйя, цинк и медь).
Для оценки пространственного распределения тяжелых металлов в г.Шымкент были выбраны 4 пункта исследования.
Пункт № 1 расположен в 200 м от АО ПК “Южполиметалл”. Пункт № 2 расположен на расстоянии 3 км от свинцового производства, в центре города. Пункт № 3 расположен на расстоянии 5 км в северо-восточном направлении города. Пункт № 4 — контрольный пункт, расположенный в 80 км от города. Из выше перечисленных пунктов отбирались пробы почвы и растения, как подорожник ланцетолистный (Plantago lanceolata), мятлик луговой (Paa protensis) и ячмень заячий (Hordeum leporinum), клен ясенелистный (acer negundo), тополь черный (Populus nigra), карагач (Ulmus pumila), ива Вавилонская (Salix babilonica), акация белая (Robinia pseudoacacia)
Данные о содержании тяжелых металлов в почве представлен в рисунке 1.
Как видно из таблицы, содержание свинца в почве показало, что максимальная концентрация данного элемента характерна для района металлургического производства. Содержание свинца в пункте № 1 составило 946,11 ± 5,04 мг/кг, что превышает ПДК в 27 раз, а контрольный показатель в 45 раз. Это объясняется тем, что 30–35 % промышленных выбросов оседают на территории производства. Высокотоксичный свинец является основным выбросом свинцового производства, так как происходит накопление его в почве. В других пунктах исследования по мере удаления от свинцового производства наблюдается снижение содержания свинца в почве.
Содержание цинка в почве составляет в пункте № 1 171,30±4,64 мг/кг, то-есть по сравнению с контрольным пунктом в 14 раз превышает контрольный показатель, а ПДК в 2 раза. Высокое содержание цинка так-же отмечаны в пункте № 2, оно составляет 20,65±2,14 мг/кг, что превышает контрольный показатель в 10 раз, но не превышает ПДК. В других пунктах содержание цинка не превышает показатель контрольного пункта. Наиболее высокие содержания меди и кадмия так-же были установлены в производственном пункте. Во всех других пунктах содержание меди не превышает ПДК, но по сравнению с контрольным пунктом превышает контрольный показатель. Содержание кадмия во всех пунктах превышает ПДК.
Высокие содержания выше указанных тяжелых металлов установлены в районе АО ПК “Южполиметалл” (пункт № 1). В других пунктах по мере удаления от производства содержание тяжелых металлов в почве снижается.
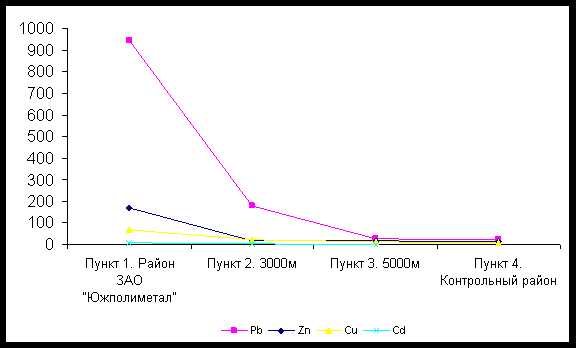
Рис. 1. Содержание тяжелых металлов в почве (мг/кг)
Почва является важнейшим объектом окружающей среды. В отличие от других объектов окружающей среды (воздух, вода), где протекают процессы самоочищения, почва обладает этим свойствам в незначительной мере. Более того для некоторых веществ, в частности для тяжелых металлов почва является едким акцептором.
Тяжелые металлы прочно сорбируются и взаимодейтвуют с почвенным гумусом, образуя труднорастворимые соединения. Таким образом идет их накопление в почве. Наряду с этим в почве под воздействием различных факторов происходит постоянная миграция поподающих в нее веществ и перенос их на большие расстояния [3].Тяжелые металлы попадающие в почву с выбросами предприятий, прочно связываются уже в верхнем слое. Максимальное содержание металлов в почвах наблюдается на расстояниях 1–3 км от источников загрязнения [4].
Данные о содержании тяжелых металлов в растениях представлены на рисунке 2,3.
Как видно из рисунка, акация белая, тополь черный и мятлик луговой аккумулирует свинец в высокой степени. Его содержание в пункте № 1 составило в акаций белой 292,9 мг/кг, что превышает ПДК 58 раз, а контрольный показатель в 15 раз. Содерание свинца в тополе 91,42 мг/кг (18 ПДК), контрольный показатель превышает в 5 раз, в мятлике луговой — 67,14 мг/кг, что превышает контрольный показатель в 27 раза, а ПДК — в 13 раз. Содержание свинца в ячмене тоже высокое, оно составило 42,14±2,32 мг/кг, что превышает контрольный показатель в 21 раз, а ПДК — в 8 раз. У подорожника ланцетолистного содержание свинца составляет 31,07±2,65 мг/кг, что превышает контрольный показатель в 15 раз, а ПДК — в 6 раз. Анализ результатов определения содержания цинка в изучаемых видов растениий также показал различную аккумулятивную способность.
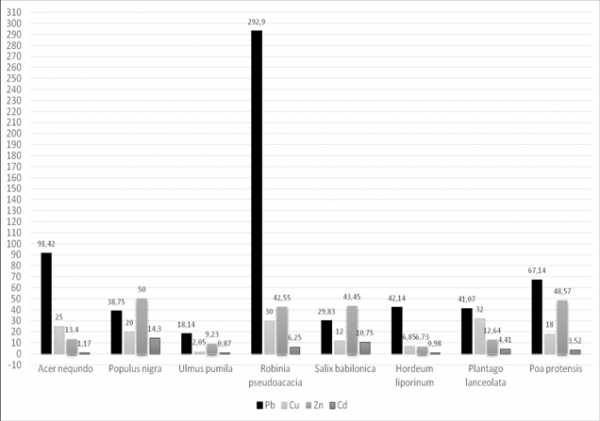
Рис. 2. Содержание тяжелых металлов в растениях (Пункт № 1- район ЗАО «Южполиметалл»), (мг/кг)
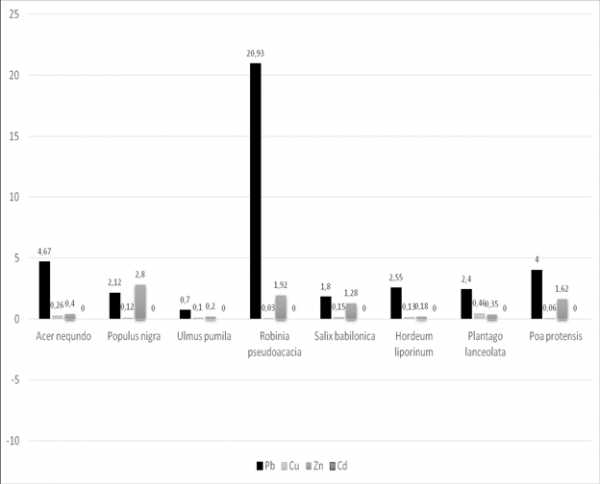
Рис. 3 Содержание тяжелых металлов (Пункт № 4 — контрольный пункт), (мг/кг) ПДК: Свинец–5мг/кг; цинк–30мг/кг; кадмий–0,3мг/кг.
Максимальное содержание цинка в растениях так-же было отмечано в пункте № 1, у мятлика лугового оно составляет 48,57±3,46 мг/кг, что превышает ПДК 1,6 раза, а контрольный показатель в 12 раз. У подорожника ланцетолистного и ячменя заячего содержание цинка не превышает ПДК, но намного выше по сравнению с контрольным пунктом. Содержание кадмия во всех растениях значительно выше ПДК.
Результаты проведенных исследований показали, что с увеличением поступления в почву тяжелых металлов, соответственно повышается уровень поглощения тяжелых металлов растениями.Таким образом, результаты исследований свидетельствуют о загрязнении почв и растений тяжелыми металлами металлургического производства.
Литература:
1. Окружающая среда и устойчивое развитие в Казахстане. Обзор ПРООН. Алматы, 2004г. 210 с.
2. Гринь А. В., Ли С. К. Поступление тяжелых металлов в растения в зависимости от их содержания по миграции // Тезисы докладов II — Всемирного совещания по миграции загрязненных веществ в почвах и определенных сферах. Ленинград, 1980г. — С. 46–48.
3. Микшевич Н. В., Ковальчук Л. А. Тяжелые металлы в системе “почва — растения — животные” в зоне действия медеплавильного предприятия // Материалы 2 — Всесоюзной Международной Конференции по ТМ в окружающей среде и охраны природы. 1988г. — С. 127–129.
4. Садовников Л. К. Влияние промышленных предприятий на окружающую среду// Тезисы доклодов. Мониторинг содержания ТМ в почвах естественных и техногенных ландшафтов. г. Пущино, 1984г. –С.163
moluch.ru
Содержание тяжелых металлов в растениях
Кобальт
В биосфере кобальт преимущественно рассеивается, однако на участках, где есть растения — концентраторы кобальта, образуются кобальтовые месторождения. В верхней части земной коры наблюдается резкая дифференциация кобальта — в глинах и сланцах в среднем содержится 2·10-3% кобальта, в песчаниках 3·10-5, в известняках 1·10-5. Наиболее бедны кобальтом песчаные почвы лесных районов. В поверхностных водах его мало, в Мировом океане его лишь 5·10-8%. Будучи слабым водным мигрантом, он легко переходит в осадки, адсорбируясь гидроокисями марганца, глинами и другими высокодисперсными минералами.
Содержание кобальта в почвах определяет количество этого элемента в составе растений данной местности, а от этого зависит поступление кобальта в организм травоядных животных.
Постоянно присутствуя в тканях растений, кобальт участвует в обменных процессах. В животном организме его содержание зависит от его уровня в кормовых растениях и почвах. Концентрация кобальта в растениях пастбищ и лугов в среднем составляет 2,2·10-5—4,5·10-5% на сухое вещество. Способность к накоплению этого элемента у бобовых выше, чем у злаковых и овощных растений. В связи с высокой способностью к концентрации кобальта морские водоросли по его содержанию мало отличаются от наземных растений, хотя в морской воде его значительно меньше, чем в почвах. Кобальт участвует в ферментных системах клубеньковых бактерий, осуществляющих фиксацию атмосферного азота; стимулирует рост, развитие и продуктивность бобовых и растений ряда других семейств. В микродозах кобальт является необходимым элементом для нормальной жизнедеятельности многих растений и животных. Вместе с тем повышенные концентрации соединений кобальта являются токсичными.
Кобальт применяют в сельском хозяйстве как микроудобрения – удобрения, содержащие микроэлементы (В, Cu, Mn, Zn, Со и др.), т. е. вещества, потребляемые растениями в небольших количествах.
Известкование почв снижает усвояемость растениями кобальта. Так же влияет избыток марганца и железа в почвах; наоборот, фосфор усиливает поступление кобальта в растения.
Применение кобальтовых солей (сернокислого кобальта) в качестве удобрений, как оказалось, способствует ускорению созревания ячменя, повышает урожай семян красного клевера, увеличивает содержание жира в семенах льна. Под влиянием кобальта повышается урожайность сахарной свеклы.
Внесение 300 г сернокислого кобальта на 1 га значительно повышает урожай винограда: вес ягод увеличивается на 35%, сахаристость — на 14%, кислотность снижается на 10%.
М. Я. Школьник предлагает вносить кобальт в качестве удобрений в следующих дозах: внесение в почву перед посевом — 2—6 кг на 1 га; внесение в междурядье в виде подкормки — 0,5 кг на 1 га; внекорневое питание— 0,1-процентный раствор; намачивание семян — 0,1-процентный раствор. При внесении кобальтовых удобрений с самолета применяется измельченный сернокислый кобальт в дозе 1,415 кг на 1 га.
Помимо чистых химических соединений кобальта, в качестве удобрений могут быть также использованы продукты переработки шлаков никелевого производства и колчеданных огарков.
Молибден
Среднее содержание молибдена в почвах составляет 0,0003%, в изверженных породах — 0,000154%, в осадочных породах —0,00024%. Больше всего молибдена находится в болотистых почвах и в почвах тундр. Богатство почв органическими веществами обусловливает низкий окислительный потенциал среды.
Наиболее растворимы в воде и доступны для растений соединения Мо6 в нейтральной и слабощелочной среде. На кислых почвах молибден мало доступен растениям, поэтому в таких условиях сказывается положительно внесение молибденовых удобрений. Влияние молибдена зависит от многих факторов: на кислых почвах эффект молибдена зависит от содержания подвижного алюминия (чем больше алюминия, тем выше эффект молибдена). Между молибденом и марганцем наблюдается обратная зависимость—избыток марганца вызывает недостаток молибдена, и, наоборот, присутствие молибдена улучшает состояние растений (льна), болеющих на кислых почвах от избытка марганца. Антагонистическая зависимость наблюдается также между молибденом и медью (молибден вытесняет медь).
Молибден особенно важен для бобовых растений; он концентрируется в клубеньках бобовых, способствует их образованию и росту и стимулирует фиксацию клубеньковыми бактериями атмосферного азота. Входя в состав фермента нитраторедуктазы (являющейся по своему строению молибдофлавопротеином), молибден восстанавливает нитраты у высших и низших растений и стимулирует синтез белка в них. Поэтому в условиях недостатка молибдена в растениях накапливаются нитраты, одновременно уменьшаются азотистая растворимая фракция и уровень азотистой белковой фракции. Молибден и марганец, по-видимому, катализируют отдельные реакции, каждая из которых влияет на концентрацию аминокислот — промежуточных продуктов белкового обмена. Молибден активирует реакцию, ведущую от нитратов к образованию аминокислот, тогда как марганец, по-видимому, активирует дальнейшие фазы превращения аминокислот в белки.
Молибден оказывает положительное влияние не только на бобовые растения, но и на цветную капусту, томаты, сахарную свеклу, лен и др. Растениями-индикаторами недостатка молибдена могут быть томаты, кочанная капуста, шпинат, салат, лимоны.
Молибден необходим не только для процесса синтеза белков в растениях, но и для синтеза витамина С и каротина, синтеза и передвижения углеводов, использования фосфора.
Болезни молибденовой недостаточности:
- болезнь нитевидности цветной капусты. Выражается в уменьшении листовой пластинки. Поражает растения на кислых почвах: известкование может предотвратить появление болезни. Описана преимущественно в Австралии и Новой Зеландии.
- желтая пятнистость цитрусовых. Выражается в появлении желтых пятен на листьях, быстро опадающих. При этом значительно уменьшается количество плодов. Заболевание наблюдается во Флориде (США).
Применяются различные способы внесения молибдена в качестве удобрения. Так, урожай и сахаристость сахарной свеклы увеличиваются при
внесении в почву путем подкормки в междурядья на 0,5 кг с 1 га, при непосредственном внесении в почву — на 2,8 кг с 1 га. То же было установлено названным автором при изучении действия молибдена (молибденовокислого аммония) на урожай семян красного клевера. На неизвесткованной почве эффект молибдена значительно более выражен.
Ввиду высокой стоимости молибденовых солей рекомендуют применение предпосевной обработки семян — 0,8 г/л. При этом методе потребность в молибденовых солях уменьшается в сотни раз. Для внекорневого питания потребность в молибдате аммония составляет 600 л 0,03—0,05-процентного раствора на 1 га.
Никель
Содержание никеля в почвах составляет 0,004%, в природных поверхностных водах — 0,000 000 34%. В растениях в среднем содержится 0,00005% на живой вес (в зависимости от вида растения, местности, почвы, климата и др.). Растения в районе никелевых месторождений могут накоплять в себе значительные количества никеля. При этом наблюдаются явления эндемического заболевания растений, например уродливые формы астр, что может быть биологическим и видовым индикатором в поисках никелевых месторождений. Морфологически измененные анемоны в обогащенных никелем биогеохимических провинциях концентрируют никель в 30-кратном размере; повышенное содержание никеля в почвенных растворах и в почвах Южного Урала, обогащенных никелем в 50-кратном размере, является причиной появления уродливых форм у сон-травы (семейство лютиковых) и грудницы (семейство сложноцветных).
Критические значения концентрации никеля в питательном растворе—1,5 мг/кг и в сухой массе ячменя, выращенного на такой среде — 26 мг/кг. Токсический уровень этого элемента в листьях растений начинается с превышения 1,0 мг/кг сухой массы.
При усвоении никеля растениями происходит взаимодействие с содержащимися в почве железом, кобальтом, хромом, магнием, медью, цинком, марганцем; при этом ионы марганца и магния не ингибируют, а ионы кобальта, меди, железа и цинка — ингибируют абсорбцию никеля на 25—42%. Существуют указания на то, что растения, произрастающие на серпентиновых почвах, не проявляют признаков токсического повреждающего воздействия никеля, в случаях, если соотношение медь: никель равно или более 1, или соотношение железо: никель равно или более 5. Среди растений существует различие в чувствительности по отношению к воздействию никеля. Токсические уровни никеля в листве растений (млн -1 сухой массы): рис 20—25, ячмень 26, виды твердой древесины 100—150, цитрусовые 55—140, сорняки 154. Типичные симптомы повреждающего токсического действия никеля: хлороз, появление желтого окрашивания с последующим некрозом, остановка роста корней и появления молодых побегов или ростков, деформация частей растения, необычная пятнистость, в некоторых случаях — гибель всего растения.
Марганец
Марганец находится в почвах в среднем в количестве 0,085%. Однако в отдельных случаях при высоком общем содержании марганца в почвах количество усвояемых его форм, переходящих в солянокислую или солевую форму, может быть явно недостаточно. В среднем растворимая часть Мn в почве составляет 1 —10% от общего его содержания.
Кислая реакция почвы (при рН ниже 6,0) благоприятствует усвоению растениями Мn2+ ; слабощелочная реакция (рН выше 7,5) стимулирует образование гидрата Мn(ОН)2, трудно усваиваемого растениями.
Подвижность марганца в пахотном слое также определяется буферностью почв по отношению к кислотам, что зависит от суммы обменных оснований (преимущественно Са и Mg) в них. При высокой буферности почв подвижность Мn2+ уменьшается. При низкой буферной емкости почв подвижность марганца выше. Марганец мобилизует фосфорную кислоту почвы. Целый ряд почвенных микроорганизмов, участвующих в усвоении растениями атмосферного азота, усиливают свою активность под влиянием марганца.
Среднее содержание марганца в растениях равно 0,001 %. Марганец служит катализатором процессов дыхания растений, принимает участие в процессе фотосинтеза. Исходя из высокого окислительно-восстановительного потенциала марганца можно думать, что марганец играет такую же роль для растительных клеток, как железо — для животных.
Марганец входит в состав либо является активатором ряда ферментативных систем; регулирует отношение Fe2+↔Fe3+, тем самым влияя на окислительно-восстановительные процессы, совершающиеся с помощью железа.
Марганец усиливает гидролитические процессы, в результате чего нарастает количество аминокислот, способствует продвижению ассимилятов, образующихся в процессе фотосинтеза от листьев к корням и другим органам. По данным П. А. Власюка, марганец при нитратном питании растений ведет себя как восстановитель, тогда как при аммиачном — как окислитель. Благодаря этому с помощью марганца можно воздействовать на процессы сахарообразования и синтеза белков.
Благотворное влияние марганца на рост и развитие растений очевидно; так, И. В. Мичурин подметил, что у гибридных сеянцев миндаля под влиянием марганца срок первого плодоношения ускоряется на 6 лет. Этот факт явился первым описанным в литературе случаем замечательного ускорения роста и созревания растений под влиянием микроэлементов.
При недостатке марганца в почвах (низком содержании либо неблагоприятных условиях для усвоения его растениями) возникают заболевания растений, характеризующиеся в общем появлением на листьях растений хлоротичных пятен, которые в дальнейшем переходят в очаги некроза (отмирания). Обычно при этом заболевании происходит задержка роста растений и их гибель. У различных видов растений заболевание марганцевой недостаточностью имеет свои специфические проявления и получило соответственные названия.
- cерая пятнистость злаков наблюдается у овса, ячменя, пшеницы, ржи, кукурузы. Характеризуется появлением на листьях узкой поперечной линии увядания. Листья загибаются по линии увядания и свешиваются вниз. У кукурузы на листьях появляются отдельные хлоротичные пятна, в дальнейшем отмирающие, что ведет к образованию отверстий на листьях. Болезнь распространена обычно на щелочных почвах при высоким содержании гумуса.
- болезнь сахарного тростника – на молодых листьях появляются длинные беловатые полосы хлоротичных участков, в дальнейшем краснеющие; на этих местах наступает разрыв листьев. Содержание марганца в листьях резко падает; наблюдаются лишь следы (вместо 0,003% в норме). Заболевание растений развивается на щелочных и нейтральных почвах. Внесение в почву серы, суперфосфатов (веществ, подкисляющих почву и повышающих содержание доступного марганца) излечивает или предупреждает названное заболевание.
- пятнистая желтуха сахарной свеклы, а также кормовой, столовой свеклы и шпината. В пространствах между жилками листьев появляются желтые хлоротичные участки; края листьев заворачиваются кверху. Содержание марганца в тканях больных растений резко уменьшается: в здоровом листе сахарной свеклы обычно 181 мг марганца на 1 кг сухого вещества, а в больном — лишь 13 мг на 1 кг.
- болотная пятнистость семян гороха. Поражаются как листья (легкий хлороз), так и, главным
образом, семена гороха. На семенах появляются коричневые или черные пятна; на внутренней поверхности семядолей образуются полости. Рядом с больными могут находиться и здоровые семена.
- болезни плодовых растений проявляются в хлорозе листьев (у главной жилки), преимущественно старых (недостаточность железа проявляется главным образом на молодых листьях). Отмирают ветви, светлеют плоды. Сильнее всего поражается груша; вишня и яблоня — меньше.
- пятнистость листьев тунга. Заболевание встречается преимущественно в США. При низком содержании обменного марганца в почвах, на листьях между жилками появляются хлоротичные участки, разрастающиеся в пятна.
Встречается также серая пятнистость клубники и другие заболевания.
Явление недостаточности марганца у растений в виде приведенных выше специфических заболеваний наблюдается при значительном дефиците марганца в почвах, однако и при относительном недостатке подвижного марганца могут наблюдаться «стертые» формы недостаточности, проявляющиеся в задержке роста, уменьшении урожайности и т. п.
Обогащение растений марганцем ведет к улучшению роста, плодоношения деревьев и урожайности многих культур, что нашло практическое использование. В качестве удобрений применяют отходы марганцеворудной промышленности, отходы производства серной кислоты и др.
Марганцевые отходы имеют преимущество перед чистыми марганцевыми солями: они используются растениями постепенно и действуют более эффективно. Доза удобрений зависит от источника получения отходов и от вида растений.
Внесение марганцевых отходов в почву в качестве удобрений положительно сказывается на урожайности сахарной свеклы, озимой пшеницы, кукурузы, картофеля, овощных культур и других культур, уменьшает полегаемость растений. Помимо обычного внесения марганцевых удобрений в почву, применяют и другие методы использования марганца, при которых исключаются неблагоприятные условия усвояемости марганца из почв.
Избыток марганца, так же как и его недостаток, неблагоприятно сказывается на растениях.
Л. П. Виноградов отмстил значительные морфологические изменения у растений, произрастающих на богатых марганцем почвах (например в Чиатури).
По данным Л. Я. Леванидова, существуют растения, способные в значительной степени накапливать марганец; такие растения называют манганофилами. Способность концентрировать марганец не обязательно свойственна всем видам данного рода и не связана с систематическим положением растения. Концентраторами марганца являются лютик золотистый, полынь лекарственная, некоторые папоротники, сосна, береза, пасленовые.
Растения-манганофилы активно извлекают марганец из почв. Если растения-манганофилы произрастают на почвах с малым содержанием легко усвояемого марганца, то они особенно страдают от его недостатка. Так, на черноземе, бедном доступным марганцем, могут произрастать только такие растения-манганофилы, как береза, мобилизующая марганец своими кислыми корневыми выделениями.
Медь
Общее содержание меди в почвах составляет около 0,002%, причем на долю растворимой части приходится около 1% этого количества.
В почвах встречаются несколько форм меди, в различной степени усваиваемой растениями:
а) водоорастворимая медь,
б) обменная медь, поглощенная органическими и минеральными коллоидами,
в) труднорастворимые медные соли,
г) медьсодержащие минералы,
д) комплексные металлоорганические соединения меди.
Подвижность меди и поступление ее в растения уменьшаются при известковании почв, связывании меди в виде органических соединений и закреплении почвенным гумусом. Часть меди почв прочно связана с почвенными перегнойными кислотами — гуминовой, креновой, апокреновой; в этой форме она становится неподвижной и неусвояемой для растений.
Медь образует также комплексные соединения с рядом органических кислот — щавелевой, лимонной, малеиновой, янтарной. Важную роль в фиксации меди играют микроорганизмы почвы.
Количество воднорастворимой доступной меди определяет в основном условия жизни растений в данной местности. Растения богатых медью почв обогащаются названным элементом, причем некоторые виды приобретают устойчивость даже к очень высоким концентрациям этого металла.
Медь необходима для жизнедеятельности растительных организмов. Почти вся медь листьев сосредоточена в хлоропластах и тесно связана с процессами фотосинтеза; она участвует в синтезе таких сложных органических соединений, как антоциан, железопорфирины и хлорофилл; медь стабилизирует хлорофилл, предохраняет его от разрушения.
Медь входит в качестве структурного компонента в состав соединения с белком (медьпротеида, содержащего 0,3% меди), образуя окислительный фермент полифенолоксидазу. Этот фермент впервые был обнаружен в клубнях картофеля, шампиньонах, а в дальнейшем в составе большинства распространенных растений.
Хотя этот фермент может окислять лишь определенные фенольные соединения, однако присутствие в растительных тканях наряду с оксидазой пирокатехина или ортохинона позволяет полифенолоксидазе участвовать в окислении большого количества органических соединений.
Медь способствует синтезу в растениях железосодержащих ферментов, в частности пероксидазы.
Установлено положительное влияние меди на синтез белков в растениях и благодаря этому — на водоудерживающую способность растительных тканей. Напротив, при недостатке меди гидрофильность коллоидов тканей уменьшается.
Очевидно, вследствие этого медь в виде удобрений имеет значение для придания растениям засухо- и морозоустойчивости, а также, возможно, устойчивости к бактерийным заболеваниям.
Болезни недостаточности меди у растений:
- экзантема, или суховершинность плодовых деревьев. Поражает цитрусовые, а также яблони, груши, сливы и маслины. У цитрусовых листья достигают больших размеров, молодые побеги изгибаются, на них развиваются вздутия, затем трещины. Пораженные побеги теряют листья и высыхают. Крона деревьев приобретает кустовидную форму. Плоды мелкие с бурыми пятнами и бородавками. Листья имеют сначала ярко-зеленый цвет, а в дальнейшем появляется пятнистость и хлороз.
У яблонь заболевание проявляется в отмирании верхушек побегов — наступает увядание и свертывание листьев. Края листьев становятся как бы обожженными. У персиков наступает гибель побегов, ухудшается цветение и завязывание плодов; на листьях появляются крупные хлоротичные пятна.
- «болезнь обработки» травянистых растений проявляется в подсыхании кончиков листьев, задержке в формировании репродуктивных органов, пустозернистости колоса. При этом заболевании растения кустятся и, не переходя к стеблеванию, погибают.
Поражаются «болезнью обработки» главным образом овес, ячмень, пшеница, свекла, бобовые, лук; меньше— рожь, гречиха, клевер. «Болезнь обработки» встречается преимущественно на болотистых почвах и торфяниках; это заболевание называется также «болезнью освоения», так как она поражает овес, ячмень, яровую и озимую пшеницы и другие злаки, а также лен, коноплю, махорку и другие культуры на мелиорированных почвах.
На некоторых торфяных почвах злаки в фазе молочной спелости полегают, образуя колена. В тканях выпуклой части колена окислительные процессы (активность пероксидазы, полифенолоксидазы, цитохромоксидазы) протекают на более высоком уровне и в них содержится в 3 раза больше меди, чем в противоположно расположенных тканях.
«Болезнь обработки» не возникает, если в почву вносят сернокислую медь в количестве 25 кг на 1 га, что ведет к нарастанию содержания меди в растениях (пшенице, ржи, овсе и других злаках).
Применение медных удобрений не только сказывается на повышении урожайности, но и на качестве сельскохозяйственных продуктов. Так, количество белка в зерне нарастает, сахаристость сахарной свеклы увеличивается, так же как процент выхода каучука у кок-сагыза, содержание витамина С и каротина в плодах и овощах, улучшаются технологические качества волокна конопли. Под влиянием медных удобрений повышается устойчивость озимой пшеницы к полеганию.
Цинк
Среднее содержание цинка в почвах составляет 0,005%; из этого количества на долю растворимого цинка приходится не более 1 %.
Солончаковые и солонцеватые почвы содержат больше всего подвижного цинка (0,0087—0,014%), что связано с высокой дисперсностью солонцеватых почв и наличием в них соединений цинка типа цинкатов натрия и калия. Промежуточное положение по количеству подвижных форм цинка занимают черноземы и серые лесные почвы; меньше всего таких форм в подзолистых почвах (0,00185—0,00241%). На кислых почвах цинк более подвижен и выносится из почв в больших количествах; поэтому на кислых почвах чаще наступает дефицит цинка, на щелочных почвах цинк наименее подвижен.
В среднем в растениях обнаруживается 0,0003% цинка. В зависимости от вида, местности произрастания, климата и т. п. содержание цинка в растениях весьма варьирует.
Цинк является компонентом ряда ферментных систем. Он необходим для образования дыхательных ферментов—цитохромов А и Б, цитохромоксидазы (активность которой резко падает при недостаточности цинка), входит в состав ферментов алкогольдегидразы и глицилглициндипептидазы. Цинк связан с превращением содержащих сульфгидрильную группу соединений, функция которых состоит в регулировании уровня окислительно-восстановительного потенциала в клетках. При недостатке цинка в вакуолях клеток накопляются полифенолы, фитостерин, лецитин как продукты неполного окисления углеводов и белков; в листьях обнаруживается больше редуцирующих сахаров и фосфора и меньше сахарозы и крахмала. При отсутствии цинка нарушается процесс фосфорилирования глюкозы. Недостаток цинка ведет к значительному уменьшению в растениях ростового гормона — ауксина.
Цинк является составным компонентом фермента карбоангидразы. Входя в состав карбоангидразы, цинк влияет на важнейшую фотохимическую реакцию «темновой» утилизации углекислого газа растениями и на процесс выделения СО2, т. е. на процесс дыхания растений. Растения, развивающиеся в условиях недостаточности цинка, бедны хлорофиллом; напротив, листья, богатые хлорофиллом, содержат максимальные количества цинка. В зеленых листьях цинк, возможно, связан с порфиринами.
Под влиянием цинка происходит увеличение содержания витамина С, каротина, углеводов и белков в ряде видов растений, цинк усиливает рост корневой системы и
положительно сказывается на морозоустойчивости, а также жаро-, засухо- и солеустойчивости растений. Соединения цинка имеют большое значение для процессов плодоношения.
Горох, сорго и бобы в водных культурах не дают семян при концентрации цинка в среде 0,005 мг на 1 л и ниже. С повышением концентрации цинка в питательной смеси соответственно число семян увеличивается.
В местностях вблизи цинковых залежей произрастает так называемая галмейская флора — растения, обогащенные цинком.
Болезни недостаточности цинка распространены преимущественно среди плодовых деревьев; могут заболевать также хвойные растения и кукуруза. Главнейшие из этих болезней недостаточности следующие:
- мелколистность, или розеточная болезнь, листопадных деревьев. Поражает яблони, груши, сливу, персики, абрикос, миндаль, виноград, вишню. На заболевшем растении весной образуются укороченные побеги с розеткой мелких скрученных листьев. На листве —явления хлороза. Плоды мелкие и деформированные, часто вообще не появляются. Через 1—2 года побеги отмирают.
Заболевание излечивается непосредственно введением в стволы больных деревьев сернокислого цинка в кристаллическом виде, внесением в почву соединений пинка, опрыскиванием растений раствором цинковых солги.
При обильном развитии микроорганизмов па некоторых почвах они могут в значительной мере поглощать цинк и создавать условия цинкового голодания для высших растений. Стерилизация почв, убивая микробы и, возможно, разрушая соединения, в виде которых цинк оказывается в связанном состоянии, ставят высшие растения в условия более полной обеспеченности цинком.
- пятнистость листьев цитрусовых, «крапчатость». Между жилками листьев появляются желтые участки, поэтому листья приобретают пятнистый вид. Зеленая окраска сохраняется лишь у основания листьев, остальная часть становится белой. Листья и корневая система перестают расти, и растения погибают.
- бронзовость листьев тунговых. Листья приобретают бронзовую окраску, отдельные участки отмирают. Появляющиеся взамен погибающих новые листья деформированы. Больные деревья мало устойчивы против морозов.
- розеточная болезнь сосны. Хвоя на концах побегов приобретает бронзовую окраску.
- побеление верхушки кукурузы. Между жилками листа появляются светло-желтые полосы, развиваются некротические пятна и отверстия. Новонарастающие листья имеют бледно-желтый цвет.
Цинковые удобрения с успехом используются для повышения урожайности ряда культур: сахарной свеклы, озимой пшеницы, овса, льна, клевера, подсолнечника, кукурузы, хлопчатника, цитрусовых, других плодовых, древесных и декоративных растений.
Некоторые растения особенно отзывчивы на цинковые удобрения. При использовании минеральных удобрений, содержащих 20 кг сернокислого цинка на 1 га, наблюдается больший урожай зерна кукурузы, чем от применения любой удобрительной смеси без цинка. При этом кукуруза, больная «побелением верхушки», полностью выздоравливает — исчезает хлороз, появляются нормальные зеленые листья.
biofile.ru
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА - Вильдфлуш И.Р. и др. Определение тяжелых металлов в почве и растениях
Вильдфлуш И.Р. и др. Определение тяжелых металлов в почве и растенияхДоступные файлы (1):n1.doc
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВАИ ПРОДОВОЛЬСТВИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
_______________________ГЛАВНОЕ УПРАВЛЕНИЕ ОБРАЗОВАНИЯ, НАУКИ И КАДРОВ
_______________________УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«БЕЛОРУССКАЯ ГОСУДАРСТВЕННАЯ
СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ»
Кафедра агрохимииОПРЕДЕЛЕНИЕ ТЯЖЕЛЫХ
МЕТАЛЛОВ В ПОЧВЕ
И РАСТЕНИЯХМетодические указания
к лабораторно-практическим занятиям
для студентов агроэкологического факультета специальностей
1–74 02 05 – «Агрохимия и почвоведение», 1–33 01 06 01 – «Экология со специализацией сельскохозяйственная радиоэкология»
Горки 2009
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
И ПРОДОВОЛЬСТВИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
_______________________ГЛАВНОЕ УПРАВЛЕНИЕ ОБРАЗОВАНИЯ, НАУКИ И КАДРОВ
_______________________УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«БЕЛОРУССКАЯ ГОСУДАРСТВЕННАЯ
СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ»
Кафедра агрохимии
ОПРЕДЕЛЕНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ
В ПОЧВЕ И РАСТЕНИЯХМетодические указания
к лабораторно-практическим занятиям
для студентов агроэкологического факультета специальностей
1–74 02 05 – «Агрохимия и почвоведение», 1–33 01 06 01 – «Экология со специализацией сельскохозяйственная радиоэкология»
Горки 2009Рекомендовано методической комиссией агроэкологического факультета УО «БГСХА»
29 июня2009гСоставители: И. Р. ВИЛЬДФЛУШ, т. ф. пЕРСИКОВА, С. П. Кукреш, П. М. РЯБЦЕВ, С. Ф. кукреш-Ходянкова, С. Ф. ШЕКУНОВА. УДК 631.816:631.171 (072)
Определение тяжелых металлов в почве и растениях:
Методические указания / УО «Белорусская государственная сельскохозяйственная академия»; Сост. И. Р. Вильдфлуш, Т.Ф. Персикова, С. П. Кукреш, П. М. Рябцев, С. Ф. Кукреш-Ходянкова, С. Ф. Шекунова./ – Горки, 2009. – 16 с.
Приведены методики определения содержания тяжелых металлов в почве и растениях в условиях учебных лабораторий для студентов агроэкологического факультета специальностей «Агрохимия и почвоведение» и «Экология со специализацией сельскохозяйственная радиоэкология». Даны градации дерново-подзолистых почв по валовому содержанию тяжелых металлов и подвижных форм кадмия и свинца. Таблиц 7. Библиогр. 6. Рецензент: зав. кафедрой химии УО «БГСХА»,
канд.с.-х. наук, доцент. И. В. КОВАЛЕВА.
Коллектив составителей, 2009
Учреждение образования
"Белорусская государственная
сельскохозяйственная академия", 2009
1. ВВЕДЕНИЕ
Для получения сельскохозяйственной продукции, соответствующей токсиколого-гигиеническому качеству, необходим жесткий контроль за содержанием тяжелых металлов в почве и растениях. К тяжелым относятся металлы с атомной массой более 40. Из большого разнообразия тяжелых металлов наибольшую опасность представляют кадмий (Cd), свинец (Рb), цинк (Zn), медь (Сu), что связано с их высокой токсичностью. Одним из источников поступления тяжелых металлов в почву являются удобрения [3], поэтому при разработке системы удобрения для культуры необходимо учитывать экологическую безопасность.
БелНИИПА разработана ориентировочная градация дерново-подзолистых почв по содержанию валовых и подвижных форм тяжелых металлов в почвах республики (приложение 1,2). Так, подвижные формы Cd и РЬ (в 1 М. НСI) являются избыточными если их содержание в почве превышает 0,2–0,4 (Cd) и 10,0–25,0 (РЬ) мг/кг почвы (в зависимости от гранулометрического состава почв).
При загрязнении почв Cd, Рb и Zn кормовые травы (сено) накапливают их более интенсивно по сравнению с зерном колосовых, гречихи, бобовых культур. При этом важное значение имеют свойства самих элементов. Миграционная способность металлов в системе почва – растения измеряется в ряду Cd > Zn > Сu > Рb > Cr [1].
Атомно-абсорбционная спектроскопия является одним из наиболее высокопроизводительных методов определения ряда химических элементов, в том числе и тяжелых металлов. В основе этого метода лежит явление селективного поглощения световой энергии свободными атомами определяемого элемента. Для перевода элемента в атомарное состояние используют пламя, распыляя в него анализируемый раствор. Анализ испытуемых растворов выполняют, сравнивая их поглощение с поглощением растворов с известной концентрацией определяемых элементов. Такие растворы готовят, используя тот же растворитель, который применялся при получении анализируемых растворов.
Нами представлены методики определения подвижных форм тяжелых металлов в почве и растениях согласно следующим ГОСТам: Си – ГОСТ 26931–86, Рb – ГОСТ 26932–86, Cd – ГОСТ 26933–86, Zn – ГОСТ 26934–86 [5].2. ОПРЕДЕЛЕНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ В РАСТЕНИЯХАтомно-абсорбционное определение тяжелых металлов в растительных пробах осуществляется на спектрофотометре в растворе азотной кислоты после минерализации растительных проб методом сухого озоления. Для атомизации элементов используют воздушно-ацетиленовое пламя. Используемые аналитические линии для цинка 213,8 нм, меди – 324,7 нм, свинца – 283,3 нм, кадмия – 228,8 нм.
Подготовка к анализу. 1. Приготовление раствора азотной кислоты (1:1). Концентрированную азотную кислоту (уд. вес 1,42) влить в дистиллированную воду в соотношении 1:1.
2. Приготовление основных, рабочих и растворов сравнения цинка, меди, свинца и кадмия описано далее на с. 6–9.
3. Подготовка растительного материала. Объединенные пробы сена, силоса, сенажа, соломы или зеленых кормов измельчают на отрезки длиной 1–3 см. Корнеплоды измельчают на ломтики толщиной до 0,8 см. Из объединенной пробы методом квартования выделяют среднюю пробу, масса которой после высушивания должна быть не менее 100 г. Высушивание проб ведут в сушильном шкафу при температуре 65°С до воздушно-сухого состояния. Воздушно-сухую пробу измельчают на мельнице и просеивают через сито с диаметром 2 мм. Остаток на сите после просеивания измельчают ножницами или в ступке и добавляют к просеянной части. Средние пробы комбикормов, зерна, жмыхов, гранул травяной муки размалывают без предварительного подсушивания и просеивают через сито. Пробы хранят в стеклянной банке с притертой пробкой.
4. Минерализация растительных проб. Проводят сухое озоление в прокаленных до достижения постоянной массы тиглях (тигли прокаливают при температуре 525°). В тигель берут навеску массой 10 г, без уплотнения укладывают материал не больше половины тигля. Взвешивают и помещают в холодную печь, затем повышают постепенно температуру до 200–250°С (до появления дыма). После прекращения выделения дыма температуру повышают до 525°С и прокаливают в течение 3 часов. На полное озоление указывает цвет золы – белый, кремовый, розовый и отсутствие обугленных частиц. При наличии частичек угля золу после охлаждения смачивают дистиллированной водой или 3%-ным раствором перекиси водорода, или разбавленной азотной кислотой (1:1). Перемешивают стеклянной палочкой, воду выпаривают на плитке или в сушильном шкафу, и тигель снова прокаливают еще час. По окончании озоления тигель взвешивают, предварительно охладив в эксикаторе. Взвешивание проводят несколько раз, достигая постоянства массы, (разность массы между двумя взвешиваниями составляет не более 0,001 г). Достижение постоянства массы проводят дополнительным прокаливанием в течение 30 мин.
5. Кислотная экстракция тяжелых металлов из золы. Золу смачивают несколькими каплями бидистиллированной воды и приливают из бюретки по 10–15 см3 азотной кислоты, разбавленной 1:1. Накрывают тигель часовым стеклом и нагревают на электроплитке до кипения или выдерживают в кипящей водяной бане в течение 30 мин. Затем фильтруют в мерную колбу вместимостью 50 см3 через фильтр с белой полосой, который предварительно промывают разбавленной азотной кислотой. Тигель и фильтр несколько раз споласкивают горячей бидистиллированной водой, доводя объем раствора до метки. Содержимое колбы перемешивают и оставляют для отстаивания до следующего дня. После отстаивания раствор используют для анализа. Одновременно проводят контрольный опыт, включая все стадии, кроме взятия пробы.
6. Определение тяжелых металлов в растворах золы на атомно-абсорбционном спектрофотометре проводят согласно инструкции к прибору.
7. Расчет содержания тяжелых металлов в исследуемой пробе растений ведут по формуле
,
где X – массовая концентрация металла в пробе, мг/кг;
А1 – концентрация металла в растворе золы (определена по градуировочному графику), мкг/см3;
А0 – концентрация металла в холостой пробе (по градуировочному графику), мкг/см3;
У – объем исследуемого раствора золы, см3;
m –масса воздушно-сухой пробы растений, г;
К – коэффициент, учитывающий уменьшение массы навески растительной пробы.
Результаты вычисляются до второго десятичного знака.
Приготовление растворов сравнения для проведения настройки атомно-абсорбционного спектрофотометра и построение градуировочного графика при определении цинка, меди, кадмия и свинца проводится следующим образом.
1. Приготовление основного раствора цинка с массовой концентрацией цинка 1000 мг/дм3 (1 мг/см3). На аналитических весах взвешивают 1,00 г металлического цинка, помещают навеску в мерную колбу вместимостью 1000 ом3, растворяют ее в 20 см3 50%-ной азотной кислоты* и доводят до метки азотной кислотой концентрации 1 моль/дм3. Раствор хранят год в закрытой стеклянной бутыли. На основании основного раствора цинка готовят рабочие растворы.
2. Приготовление рабочего раствора цинка с массовой концентрацией 100 мг/дм3 (100 мкг/см3). В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 основного раствора цинка, добавляют цилиндром вместимостью 5 см3 0,5 см3 50%-ной азотной кислоты и доводят раствор до метки бидистиллированной водой. Используют в день приготовления.
____________
* Приготовление раствора осуществляют добавлением 350 см3 концентрированной азотной кислоты плотностью 1,42 к бидистиллированной воде. Раствор готовят в конической колбе из термостойкого стекла вместимостью 1000см3, воды берут 500 см3.
3. Приготовление растворов сравнения цинка. В табл. 1 указаны объемы рабочего раствора цинка, которые приливают в мерные колбы вместимостью 100 см3. Затем в каждую колбу добавляют по 0,5 см3 50%–ной азотной кислоты и доводят до метки бидистиллированной водой. Используют в день приготовления.
Градуировочный график строят в день анализа в координатах. По оси абсцисс откладывают массовую концентрацию элемента в растворах сравнения, а по оси ординат – соответствующие им показания оптической плотности.Таблица 1. Объем рабочего раствора цинка и концентрация раствора сравнения
| Объем рабочего раствора цинка (100 мг/дм3), см3 | 0,2 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 15,0 |
| Концентрация раствора сравнения цинка, мг/дм3 | 0,2 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 15,0 |
1. Приготовление основного стандартного раствора меди с концентрацией меди 1000 мг/дм3. На аналитических весах взвешивают 3,929 г сернокислой меди, помещают в мерную колбу вместимостью 1000 см3 и растворяют в бидистиллированной воде, содержащей 1 см3 концентрированной серной кислоты, затем доводят объем раствора до 1 дм3. Хранят один год и используют для приготовления рабочих растворов.
2. Приготовление рабочего раствора меди с массой концентрацией 100 мг/дм3 (100 мкг/см3). В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 основного раствора меди, добавляют цилиндром вместимостью 5 см3 0,5 см3 50%-ной азотной кислоты и раствор доводят бидистиллированной водой до метки. Используют в день приготовления.
3. Приготовление растворов сравнения меди. В табл. 2 приводятся объемы рабочего раствора меди, из которых готовят растворы сравнения меди. В мерные колбы вместимостью 100 см3 приливают объемы рабочих растворов меди, указанных в таблице, затем в каждую колбу добавляют по 0,5 см3 50%-ной азотной кислоты и доводят до метки бидистиллированной водой. Используют в день приготовления для построения градуировочного графика.Таблица 2. Объем рабочего раствора меди и концентрация растворов сравнения
| Объем рабочего раствора меди (100 мг/дм3), см3 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 15,0 |
| Концентрация раствора сравнения меди, мг/дм3 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 15,0 |
1. Приготовление основного раствора с массовой концентрацией кадмия 1000 мг/дм3. На аналитических весах берут навеску 1,142г окиси кадмия (CdO) и помещают ее в мерную колбу вместимостью 1000 см3. Цилиндром вместимостью 50 см3 приливают 20 см3 50%-ной азотной кислоты и растворяют в ней навеску, доводят объем раствора до метки 1 М HNO3. Хранят в закрытой стеклянной посуде 1 год.
2. Приготовление рабочего раствора кадмия (I) с концентрацией 100 мг/дм3 (100 мкг/см3). В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 основного раствора кадмия, добавляют цилиндром местимостью 5 см3 50%-ной азотной кислоты и доводят объем до 100 см3 бидистиллированной водой. Используют в день приготовления.
3. Приготовление рабочего раствора кадмия (II) с массовой концентрацией 10 мг/дм3 (10 мкг/см3). В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 рабочего раствора кадмия (I). Цилиндром вместимостью 5 см3 добавляют 0,5 см3 50%-ной азотной кислоты и доводят объем раствора до 100 см3 бидистиллированной водой. Используют в день приготовления.
4. Приготовление растворов сравнения кадмия. Готовят добавлением к указанному в табл. 3 количеству рабочего раствора (II) по 0,5 см3 50%-ной азотной кислоты и доводят объемы растворов до 1000 см3 бидистиллированной водой. Используют в день приготовления для построения градуировочного графика.Таблица 3. Объем рабочего раствора кадмия и концентрация растворов
сравнения
| Объем рабочего раствора (II) кадмия (10 мг/дм3), см3 | 0,2 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 15,0 | 20,0 |
| Концентрация раствора сравнения кадмия, мг/дм3 | 0,02 | 0,05 | 0,1 | 0,2 | 0,5 | 1,0 | 1,5 | 2,0 |
1. Приготовление основного раствора свинца с массовой концентрацией свинца 1000 мг/дм3. На аналитических весах берут навеску 1000 г металлического свинца, помещают в мерную колбу вместимостью 1000 см3, добавляют 50 см3азотной кислоты с концентрацией HNO3 1 моль/дм3 и растворяют в ней навеску. Хранят в закрытой посуде 1 год.
2. Приготовление рабочего раствора свинца с массовой концентрацией свинца 100 мкг/см3 (100 мг/дм3). В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 основного раствора свинца, добавляют цилиндром вместимостью 5 см3 0,5 см3 50%-ной азотной кислоты и доводят до метки бидистиллированной водой. Используют в день приготовления.
3. Приготовление растворов сравнения свинца. Растворы сравнения готовят добавлением к указанным в табл. 4 количествам рабочего раствора свинца по 0,5 см3 50%-ной азотной кислоты и доводят объем растворов до 100 см3 бидистиллированной водой. Используют в день приготовления для построения градуировочного графика.Таблица 4. Объем рабочего раствора свинца и концентрация растворов сравнения
| Объем рабочего раствора свинца (100 мг/дм3), см3 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 20,0 |
| Концентрация раствора сравнения свинца, мг/дм3 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 20,0 |
3. ОПРЕДЕЛЕНИЕ ПОДВИЖНЫХ ФОРМ ТЯЖЕЛЫХ
МЕТАЛЛОВ В ПОЧВЕПодвижные формы кислоторастворимых металлов (медь, цинк, никель, кобальт, кадмий, свинец) определяют в вытяжках 1 М HNO3 или 1 М НСI. Из сильно загрязненных почв 1 М HNO3 извлекает 90–95% тяжелых металлов от их валового содержания. Отношение почвы к раствору для минеральных почв 1:10, для торфяных – 1:20. Пробу почвы массой 5 г (для торфяных почв 2,5 г) помещают в коническую колбу вместимостью 200 – 300 мл и добавляют 50 мл 1 М НМО3 (для извлечения свинца можно использовать 1 М НС1). Суспензию взбалтывают на ротаторе в течение часа или настаивают в течение суток после трехминутного встряхивания. Колбу закрывают пробкой (если резиновая, то нужна полиэтиленовая прокладка). Вытяжку фильтруют через сухой складчатый фильтр с белой лентой, предварительно промытый 1 M HNO3. В фильтрате определяют тяжелые металлы на атомно–абсорбционном спектрофотометре в пламени ацетилен – воздух. В табл. 5 приводятся аналитические линии, чувствительность и оптическая область концентраций атомно-абсорбционного определения элемента.Таблица 5. Условия атомно-абсорбционного определения элементов
| Элемент | Линия аналитическая, нм | Газовая смесь | Чувствительность определения, мкг/см3 | Оптимальная область массовых концентраций, мкг/см3 |
| Медь | 324,7 | Ацетилен- | 0,05 | 2 – 5 |
| Цинк | 213,8 | воздух | 0,01 | 0,4 – 1,5 |
| Свинец | 217,0 | –»– | 0,1 | 5 – 20 |
| Кадмий | 228,8 | – »– | 0,01 | 0,1 – 5,0 |
Содержание металлов в исследуемых пробах почв рассчитывается по формуле:
где X – массовая доля определяемого металла в воздушно-сухой пробе почвы, мг/кг;
a1 – концентрация металла в исследуемой вытяжке, найденная по градуировочному графику, мг/кг;
а0 – концентрация металла в контрольной пробе, найденная по градуировочному графику, мг/кг;
У – объем исследуемого раствора, см3;
m – масса воздушно-сухой пробы, г.
Подготовка к выполнению анализа. 1. Приготовление раствора соляной кислоты концентрации 1 моль/дм3: 82,0 см3 соляной кислоты плотностью 1,19 г/см3 приливают в бидистиллированную воду и доводят объем до 1000 см3.
2. Приготовление раствора азотной кислоты концентрации 1 моль/дм3: 62 см3 азотной кислоты плотностью 1,42 г/см3приливают в бидистиллированную воду. Бидистиллированной воды берут 938 см3. Раствор готовят в конической колбе, осторожно помешивая, затем охлаждают до комнатной температуры. Хранят раствор 1 год.
Приготовление растворов сравнения для проведения настройки прибора и построения градуировочного графика при определении меди и цинка описано в разделе «Определение тяжелых металлов в растениях».
3. Приготовление основного раствора кадмия с концентрацией 1000 мг/дм3. Навеску окиси кадмия (CdO) 1,142 г помещают в мерную колбу вместимостью 1000 см3. Цилиндром вместимостью 50 см3 приливают 20 см3 50%-ной азотной кислоты (в конической колбе вместимостью 1000 см3 цилиндром отбирают 500 см3 бидистиллированной воды, затем этим же цилиндром отбирают 350 см3 концентрированной азотной кислоты плотностью 1,42 и приливают ее, осторожно перемешивая, к воде; затем раствор охлаждается) и растворяют в ней навеску окиси кадмия. Затем доводят объем раствора до метки 1 M HNO3. Хранят раствор в закрытой полиэтиленовой (стеклянной) бутыли 1 год.
4. Приготовление рабочего раствора кадмия с концентрацией 100 мг/дм3. В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 основного раствора кадмия, добавляют цилиндром вместимостью 5 см3 0,5 см3 50%-ной азотной кислоты и доводят объем до 100 см3 бидистиллированной водой. Готовят в день проведения анализа.
- Приготовление рабочего раствора кадмия с концентрацией 10 мг/дм3. В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 рабочего раствора кадмия. Цилиндром вместимостью 5 см3 добавляют 0,5 см3 50%-ной азотной кислоты и доводят объем раствора до 100 см3 бидистиллированной водой. Раствор готовят в день проведения анализа.
- Приготовление растворов сравнения кадмия. Растворы сравнения готовят добавлением к указанным в табл. 6 количествам рабочего раствора кадмия по 0,5 см3 50%-ной азотной кислоты и доводят объемы растворов до 1000 см3 бидистиллированной водой. Готовят в день анализа.
Таблица 6. Объем рабочего раствора кадмия и концентрация раствора
сравнения
| Характеристика раствора | Объемы рабочего раствора кадмия (10 мг/дм3),см3 | |||||||
| Рабочий раствор кадмия, см3 | 0,2 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 15,0 | 20,0 |
| Концентрация растворов сравнения кадмия, мг/дм3 | 0,02 | 0,05 | 0,1 | 0,2 | 0,5 | 1,0 | 1,5 | 2,0 |
- Приготовление основного раствора свинца с массовой концентрацией 1000 мг/дм3. Навеску металлического свинца 1,0 г помещают в мерную колбу вместимостью 1000 см3, прибавляют к навеске 50 см3 азотной кислоты с концентрацией HNO3 = 1 моль/дм3 и растворяют в ней навеску. Хранят в стеклянной (полиэтиленовой) посуде год.
- Приготовление рабочего раствора свинца с концентрацией 100 мг/дм3. В мерную колбу вместимостью 100 см3 пипеткой отбирают 10 см3 основного раствора свинца, добавляют цилиндром 0,5 см3 50%-ной азотной кислоты и доводят до метки бидистиллированной водой. Готовят в день анализа.
- Приготовление растворов сравнения свинца. Растворы сравнения свинца готовят добавлением к указанным в табл.7 количествам рабочего раствора свинца по 0,5 см3 50%-ной азотной кислоты и доводят объем растворов до 100 см3 бидистиллированной водой. Готовят в день анализа.
Таблица 7. Объем рабочего раствора свинца и концентрация раствора сравнения
| Характеристика раствора | Объемы рабочего раствора свинца (100 мг/дм3), см3 | |||||
| Рабочий раствор свинца, см3 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 20,0 |
| Концентрация раствора сравнения свинца, мг/дм3 | 0,5 | 1,0 | 2,0 | 5,0 | 10,0 | 20,0 |
СПИСОК ЛИТЕРАТУРЫ1. Лапа В. В. Справочник агрохимика/В. В. Лапа [и др.] //Под ред. В. В. Лапа. – Минск: Институт почвоведения и агрохимии, 2007. – 389 с.
2. Экологические проблемы применения удобрений (по материалам зарубежных стран). Аналитическая записка. Мн., 1993.–16 с.
3. Персикова Т. Ф. Тяжелые металлы и окружающая среда: Лекция для студентов с.-х. вузов/ Т. Ф. Персикова [и др.] – Горки: БГСХА. 1995. – 43 с.
4. Инструктивное письмо. «О выполнении работ по определению загрязнения почв» № 02-10/51-2333 от 10.12.1990 г. М.: Госкомприрода СССР. – 11 с.
5. Отчет по научно-исследовательской работе за 1994 г. по хоздоговорной теме № 31 «Разработка и внедрение наиболее экспрессных методик анализа объектов окружающей среды и продукции сельскохозяйственного производства на содержание тяжелых металлов». Горки: БГСХА. –1994.
6. Методические указания по определению тяжелых металлов в почвах сельхозугодий и продукции растениеводства. М.: ЦИНАО, 1989. – 62 с.
7. Лапа В. В. Агрохимические регламенты для повышения плодородия почв и эффективного использования удобрений: Учебное пособие/ В. В. Лапа [и др.]. – Горки: БГСХА, 2002. – 48 с.СОДЕРЖАНИЕ
| 1. Введение | 3 |
| 2. Определение тяжелых металлов в растениях | 3 |
| 3. Определение подвижных форм тяжелых металлов в почве | 8 |
| Приложение | 11 |
| Список литературы | 19 |
Градация дерново-подзолистых почв по содержанию тяжелых металлов, мг/кг
| Группы по содержанию тяжелых металлов | Содержание, мг/кг почвы | ||
| Песчаные | Супесчаные | Суглинистые | |
| Валовое содержание | |||
| Cd | |||
| Фоновое | 0,07 и менее | 0,09 и менее | 0,12 и менее |
| Повышенное | 0,08 – 0,20 | 0,10 – 0,30 | 0,13 – 0,40 |
| Высокое | 0,21 – 0,30 | 0,31 – 0,40 | 0,41 – 0,60 |
| Очень высокое (ОДК) | более 0,30 | более 0,40 | более 0,60 |
| Pb | |||
| Фоновое | 7,0 и менее | 10,0 и менее | 15,0 и менее |
| Повышенное | 7,1 – 15,0 | 10,1 – 25,0 | 15,1 – 30,0 |
| Высокое | 15,1 – 25,0 | 25,1 – 35,0 | 30,1 – 60,0 |
| Очень высокое (ОДК) | более 25,0 | более 35,0 | более 60,0 |
| Cr | |||
| Фоновое | 18,0 и менее | 25,0 и менее | 50,0 и менее |
| Повышенное | 18,1 – 50,0 | 25,1 – 75,0 | 50,1 – 125,0 |
| Высокое | 50,1 – 80,0 | 75,1 – 150,0 | 125,1 – 200,0 |
| Очень высокое (ОДК) | более 80,0 | более 150,0 | более 200,0 |
| Подвижные формы (экстрагент 1 М НСI) | |||
| Cd | |||
| Фоновое | 0,02 и менее | 0,03 и менее | 0,04 и менее |
| Повышенное | 0,03 – 0,09 | 0,05 – 0,15 | 0,05 – 0,25 |
| Высокое | 0,10 – 0,20 | 0,16 – 0,30 | 0,25 – 0,40 |
| Очень высокое (ОДК) | более 0,20 | более 0,30 | более 0,40 |
| Pb | |||
| Фоновое | 2,0 и менее | 3,0 и менее | 5,0 и менее |
| Повышенное | 2,1 – 5,0 | 3,1 – 10,0 | 5,1 – 15,0 |
| Высокое | 5,1 – 10,0 | 10,1 – 15,0 | 15,0 – 25,0 |
| Очень высокое (ОДК) | более 10,0 | более 15,0 | более 25,0 |
Предельно допустимые уровни (ПДУ) цинка и меди
в дерново-подзолистых почвах, мг/кг почвы
| Группировка почв по содержанию тяжелых металлов | Глинистые и суглинистые | Супесчаные | Песчаные |
| Валовое содержание | |||
| Цинк | |||
| ПДУ рН>5,5 | 80,0 | 60,0 | 50,0 |
| рН | 60,0 | 50,0 | 40,0 |
| Медь | |||
| ПДУ рН>5,5 | 100,0 | 70,0 | 60,0 |
| рН | 80,0 | 60,0 | 50,0 |
| Подвижные формы (экстрагент 1 М НСI) | |||
| Цинк | |||
| ПДУ рН>5,5 | 18,0 | 16,0 | 14,0 |
| рН | 15,0 | 14,0 | 12,0 |
| Медь | |||
| ПДУ рН>5,5 | 15,0 | 12,0 | 10,0 |
| рН | 12,0 | 10,0 | 8,0 |
Приложение в
perviydoc.ru
Свойства и регламентирование тяжелых металлов в растениях
Из большинства веществ, поступающих в окружающую среду из антропогенных источников, особое место занимают тяжелые металлы. Проблема тяжелых металлов в современных условиях производства глобальная, т.к. они являются генетическими ядами, аккумулируются в организме с отдаленным эффектом действия, проявляющимся в наследственных заболеваниях, умственных расстройствах, а также вызывая сердечно-сосудистые расстройства, тяжелые формы аллергии, канцерогенный и эмбриотропный эффект у организма, поэтому необходимы соответствующие меры по предотвращению загрязнения окружающей среды. Все тяжелые металлы обладают высокой токсичностью, миграционной способностью, а также канцерогенными и мутагенными свойствами.
Поведение этих токсикантов в различных природных средах обусловлено специфичностью их основных биогеохимических свойств: комплексообразующей способностью, подвижностью, биохимической активностью, минеральной и органической формами распространения, склонностью к гидролизу, растворимостью, эффективностью накопления.
Большинство тяжелых металлов относятся к группе микроэлементов. В действии каждого микроэлемента на живые организмы много общего: они входят в состав ряда белковых комплексов (ферментов) или активизируют их деятельность, они необходимы организмам в очень небольших количествах – тысячных или десятитысячных долях процента. Повышение их концентрации выше определенного уровня приводит к угнетению роста и развития и в данном случае, когда они находятся в окружающей среде в концентрациях, опасных для живого их называют тяжелыми металлами.
В процессе эволюции растения, животные и человек приспособились к природному (фоновому) содержанию тяжелых металлов. Однако интенсивное развитие промышленности, транспорта и использование различных химических средств привело к накоплению тяжелых металлов на значительных территориях, что отрицательно влияет на почву, растения и другие живые организмы, а следовательно, фоновый уровень тяжелых металлов в биосфере постоянно растет.
Таблица 8
Свойства и регламентирование меди, хрома и кадмия
| Тяжелый металл | Значение ТМ для растений и человека | Токсикология тяжелого металла | ПДК | |||
| В почве мг/кг | В питьевой воде мг/л |
Для рыбохоз водое мов мг/л |
В продукции мг/кг | |||
| Cu | Способствует синтезу гемоглобина крови, ускоряет формирование эритроцитов, восстановление костной ткани, усиливает действие инсулина, препятствует распаду гликогена в печени, способствует синтезу витаминов В1, С, Р, РР и Е. | Избыток Cu2+ связывает гидросульфидные группы ферментов и действует на организм угнетающе. Симптомы избытка меди проявляются в виде хлороза, образования окрашенных в коричневый цвет боковых корней., снижается интенсивность дыхания, образования хлорофилла и активность некоторых ферментов. Соединения меди вызывают резкое раздражение слизистых оболочек верхних дыхательных путей и ЖКТ. При систематическом действии солей меди на организм человека отмечается поражение зубов и слизистой оболочки рта, язвенная болезнь желудка, конъюктива глаз приобретает зеленовато-желтый цвет, на деснах появляется темно-красная полоса. | 3,0 | 10 | 0,001 |
Рыбопродукция 10 Мясопродукты 5 Молочные продукты 0,5 Хлебопродукты 5 Овощи 10 Фрукты 10 Соки, напитки 5 |
| Сr | Биогенный элемент снижение содержания хрома ведет к уменьшению его содержания в крови, замедление роста, повышение холестерина в крови, затруднение дыхания | Наибольшей токсичностью обладают соединения хрома (VI): туман хромовой кислоты служит причиной плеврита; при хронических отравлениях отмечается сухой кашель, поражения печени (до цирроза). |
Cr(III) 100 Cr (VI) 0,05 |
- | 0,001 |
Рыбопродукция 0,3 Мясопродукты 0,2 Молочные продукты 0,1 Хлебопродукты 0,2 Овощи 0,2 Фрукты 0,1 Соки, напитки 0,1 |
| Cd | Снижает способность организма противостоять болезням, обладает мутагенным и концерогенным действием, может вызвать кумулятивный эффект. | Поражение нервной системы, печени и почек, органов дыхания, ЖКТ, нарушение фосфорно-калийного и белкового обмена, разрушение костей. Механизм токсического действия заключается в угнетении активности ферментных систем в результате связывания с сульфгидрильными, аминными и карбоксильными группами белков. | 5,0 | 0,01 | 0,005 |
Рыбопродукция 0,1 Мясопродукты 0,05 Молочные продукты 0,01 Хлебопродукты 0,02 Овощи 0,03 Фрукты 0,03 Соки, напитки 0,02 |
При загрязнении почв и растительности тяжелыми металлами, в качестве путей оптимизации обстановки, используют традиционные и специальные приемы:
1) Методы по ограничению поступления тяжелых металлов в почву. При планировании применения удобрений, мелиорантов, пестицидов, осадков сточных вод необходимо учитывать содержание в них тяжелых металлов, буферную емкость используемых почв. Ограничение доз, обусловленное экологическими требованиями, является необходимым условием экологизации земледелия.
2) Удаление тяжелых металлов за пределы корнеобитаемого слоя достигается следующими приемами:
- удалением загрязненного слоя почвы,
- засыпкой загрязненного слоя чистой землей,
- выращиванием культур, поглощающих ТМ и удалением с поля их растительной массы,
- промывкой почв водой и водорастворимыми (чаще органическими) соединениями, образующими с тяжелыми металлами водорастворимые комплексные соединения, в качестве органических лигандов используют продукты из отходов с/х производства,
- промывкой почв раствором для выщелачивания ТМ из верхних горизонтов на глубину 70-100 см и затем осаждения их на этой глубине, в виде трудно растворимых осадков (за счет последующей промывки почв реагентами, содержащими анионы, образующие с тяжелыми металлами осадки).
3) Разработка мероприятий по ограничению поступления ТМ в растения. Поступление тяжелых металлов в растения может быть уменьшено за счет изменения питательного режима, при создании конкуренции за поступление в корни токсикантов и катионов удобрений, при осаждении тяжелых металлов в корне в виде труднорастворимых осадков.
4) Связывание ТМ в почве в малодиссоциируемые соединения. Уменьшение поступления тяжелых металлов в растения может быть достигнуто их осаждением в почве в виде осадков карбонатов, фосфатов, сульфидов, гидроокисей; с образованием малодиссоциирующих комплексных соединений с большой молекулярной массой. Наилучшим способом, обеспечивающим существенное снижение содержания тяжелых металлов в растениях, является совместное внесение навоза и извести. Наиболее эффективными мероприятиями, приводящими к снижению подвижности свинца в почвах, является глинование (внесение цеолита) и совместное внесение извести и органических удобрений. Применение полного комплекса химических мелиорантов (органических и минеральных удобрений, извести и трепла) на 10-20% снижало в почве содержание поливалентных металлов.
5) Адаптивно-ландшафтные системы земледелия, как фактор оптимизации экологической обстановки при загрязнении почв ТМ.
Различные виды и сорта культур накапливают в растительной продукции неодинаковое количество ТМ. Это обусловлено селективностью к ним корневых систем отдельных растений и особенностью их процессов метаболизма. ТМ в большей степени накапливаются в корнях, меньше в вегетативной массе и генеративных органах. При этом отдельные группы культур селективно накапливают и определенные токсиканты. Подбор культур для выращивания на почвах определенной степени и характера загрязнения является наиболее простым, дешевым и достаточно эффективным способом оптимизации обстановки.
Распределение металлов в органах растений носит отчетливо выраженный акропетальный характер и увеличивается в ряду.
biofile.ru