19.4. ЭКСПРЕССИЯ И НАСЛЕДОВАНИЕ ЧУЖЕРОДНЫХ ГЕНОВ, ВВЕДЕННЫХ В РАСТЕНИЯ В СОСТАВЕ Т-ДНК. Наследование чужеродных генов у трансгенных растений
Диссертация на тему «Изучение экспрессии гетерологичных и собственных генов у трансгенных растений :На примере Nicotiana tabacum L.» автореферат по специальности ВАК 03.00.15 - Генетика
1. Дейнеко Е.В., Загорская А.А., Новоселя Т.В., Филипенко Е.А., Шумный В.К. Нестабильность экспрессии чужеродных генов у трансгенных растений табака // Физиология растений. 2000. Т. 47, № 3. С. 446-452.
2. Дейнеко Е.В., Загорская А.А., Филипенко M.JI., Кочетов А.В., Шумный В.К. Изменение уровня экспрессии и наследование маркерного гена nptll в потомстве трансгенных растений табака Nicotiana tabacum L. // Докл. АН. 1995. Т. 344, № 3. С. 407-411.
3. Дейнеко Е.В., Загорская А.А., Филипенко Е.А., Филипенко M.JI., Комарова Н.И., Кочетов А.В., Шумный В.К. Нестабильность экспрессии гена nptll у трансгенных растений табака (Nicotiana tabacum L.) при инбридинге // Генетика. 1998. Т. 34, № 9. С. 1212-1219.
4. Дейнеко Е.В., Новоселя Т.В., Загорская А.А., Филипенко Е.А., Шумный В.К. Стабильность экспрессии и наследование гена nptll в популяции трансгенных растений табака // Докл. АН. 1999. Т. 369, № 3. С.420-423.
5. Дрейпер Дж., Скотт Р., Армитидж Ф., Дъюри Г., Джекоб JI., Уолден Р., Ку-мар А., Джефферсон Р., Хемил Дж. Генная инженерия растений: лабораторное руководство. М.: Мир, 1991. 408 с.
6. Ли А., Тинланд Б. Интеграция Т-ДНК в геном растений: прототип и реальность // Физиология растений. 2000. Т. 47, № 3. С. 354-359.
7. Лутова Л.А., Павлова З.Б., Иванова М.М. Агробактериальная трансформация как способ изменения гормонального метаболизма у высших растений // Генетика. 1998. Т. 34, № 2. С. 165-182.
8. Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. М.: Мир, 1994. 477 с.
9. Новоселя Т.В., Дейнеко Е.В. Моделирование нестабильности экспрессии ирг//-гена у трансгенных растений табака // Физиология растений. 2002. Т. 49, N3. С. 437-443.
10. Новоселя Т.В., Дейнеко Е.В., Шумный В.К. Стабильность экспрессии гена nptll у трансгенных растений табака (Nicotiana tabacum L.) с множественными инсерциями Т-ДНК // Генетика. 2000. Т. 36, № 3. С. 427-430.
11. Паушева З.П. Практикум по цитологии растений. М.: Колос, 1980. 304 с.
12. Сидорчук Ю.В., Загорская А.А., Дейнеко Е.В., Шамина Н.В., Шумный В.К. Т-ДНК индуцированные аномалии цветков и мужская стерильность у трансгенных растений табака: морфометрический и цитологический анализ // Цитология и генетика. 2000. Т. 34, № 6. С. 3-8.
13. Томило в А. А., Томилова Н.Б., Огаркова О. А., Тарасов В. А. Инсерционный мутагенез Arabidopsis thaliana: увеличение эффективности трансформации прорастающих семян в результате предобработки их ультразвуком // Генетика. 1999. Т. 35, № 9. С. 1214-1222.
14. Чумаков М.И. Механизм агробактериальной трансформации растений. Саратов: Слово, 2001. С. 17-61; 118-150.
15. Шамина Н.В., Дорогова Н.В., Сидорчук Ю.В., Загорская А.А., Дейнеко Е.В., Шумный В.К. Нарушения мужского мейоза в трансгенной линии res9\ табака // Цитология. 2000. Т. 42, № 12. С. 1173-1178.
16. Aeschenbacher R.A., Hauser М.-Т., Feldmann К.А., Benfey P.N. The SABRE gene is required for normal cell expansion in Arabidopsis // Genes and Devel. 1995. V. 9. P. 330-340.
17. Al-Kaff N.S., Covey S.N., Kreike M.M., Page A.M., Pinder R., Dale P.J. Transcriptional and posttranscriptional plant gene silencing in response to a pathogen // Sciene. 1998. V. 279. P. 2113-2115.
18. Ambros P.F., Matzke A.J.M., Matzke M.A. Localization of Agrobacterium rhfcogenes T-DNA in plant chromosomes by in situ hybridization // EMBO J. 1986. V. 5. P. 2073-2077.
19. Amedeo P., Habu Y., Asfar K., Scheid O.M., Paszkowski I. Disruption of the plant gene MOM releases transcriptional silencing of methylated genes // Nature. 2000. V. 405. P. 203-206.
20. Andre D., Colau D., Schell J., van Montagu M., Hernalsteens J.P. Gene tagging in plants by T-DNA insertion mutagen that creates APh4'II-plant gene fusions // Mol. Gen. Genet. 1986. V. 204. P. 512-518.
21. Assaad F.F., Tucker K.L., Singer E.R. Epigenetic repeat-induced silencing (RIGS) in Arabidopsis II Plant Mol. Biol. 1993. V. 22. P. 1067-1085.
22. Azpiroz-Leehan R., Feldmann K.A. T-DNA insertion mutagenesis in Arabidopsis: going back and forth// Trends Genet. 1997. V. 13. P. 152-156.
23. Bachem C.W.B., Speckmann G.J., Vanderlinde P.C.G. Antisense expression of polyphenol oxidase genes inhibits enzymatic browning in potato tubers // Biotechnology. 1994. V. 12. P. 1101-1105.
24. Baram G.L., Grachev M.A., Komarova N.I. Microcolumn liquid chromatography with multi-wave-length photometric detection // J. Chromatogr. 1983. V. 264. P. 69-90.
25. Beaujean A., Sangwan R.S., Hodges M., Sangwan-Norreel B.S. Effect of ploidy and homozygosity on transgene expression in primary tobacco transformants and their androgenetic progenies // Mol. Gen. Genet. 1998. V. 260, N4. P. 362-371.
26. Bennetzen J.L. The contribution of retroelements to plant genome organization, function and evolution // Trends Microbiol. 1996. V. 4. P. 347-353.
27. Bollmann J., Carpenter R., Coen E.S. Related articles, allelic interactions at the nivea locus of Antirrhinum II Plant Cell. 1991. V. 3(12). P. 1327-1336.
28. Brandle J.E., McHugh S.G., James L., Labbe H., Miki B.I. Instability of transgene expression in field grown tobacco earring the csrl-1 gene for sunfonylurea herbicide resistance // Bio/Technology. 1995. V. 13. P. 994-998.
29. Brink R.A. A genetic change associated with the R locus in maize which is directed and potentially reversible // Genetics. 1956. V. 41. P. 872-889.
30. Brink R.A. Basis of a genetic change wich invariably occurs in certain maize heterozygotes // Science. 1958. V. 127. P. 1182-1183.
31. Brink R.A. Paramutation // Annu. Rev. Genet. 1973. V. 7. P. 129-152.
32. Brink R.A., Styles E.D., Axtell J.D. Paramutation: directed genetic change // Science. 1968. V. 159. P. 161-170.
33. Budar F., Thia-Toong, Montagu van M. Agrobacterium-mediated gene transfer results mainly in transgenic plants transmitting T-DNA as a single Mendelian factor//Genetics. 1986. V. 114. P. 303-313.
34. Camirand A., Brisson N. The complete nucleotide sequence of the Tstl retro-transposon of potato // Nucleic Acids Res. 1990. V. 18. P. 4929.
35. Castle L.A., Errampalli D., Atherton T.L., Franzmann L.H., Yoon E.S., Meinke D.W. Genetic and molecular characterization of embryonic mutants identified following seed transformation in Arabidopsis II Mol. Gen. Genet. 1993. V. 241. P. 504-514.
36. Castle L.A., Meinke D.W. A FUSCA gene of Arabidopsis encodes a novel protein essensial for plant development // The Plant Cell. 1994. V. 6. P. 25-41.
37. Cherdshewasart W., Ghart-Chhetri G.B., Saul M.W. et al. Expression instability and genetic disorders in transgenic Nicotiana plumbaginifolia L. plants // Transgenic Res. 1993. V. 2. P. 307-320.
38. Chiang H.H., Hwang I., Goodman H.M. Isolation of the Arabidopsis GA4 locus // The Plant Cell. 1995. V. 7(2). P. 195-201.
39. Christou P., Swain W.F., Yang N.S., McCabe D.E. Inheritance and expression of foreign genes in transgenic soybean plants // Proc. Natl Acad. Sci. USA. 1989. V. 86. P. 7500-7504.
40. Chyi Y.-S., Jorgensen R.A., Goldstein D., Tanksley S.D., Loaiza-Figuegoa F. Locations and stability of Agrobacterium-mediated T-DNA insertions in the Lycopersicon genome // Mol. Gen. Genet. 1986. V. 204. P. 64-69.
41. Cluster P.D., O'Dell M., Metzlaff M., Flavell R.B. Details of T-DNA structural organization a transgenic petunia population exhibiting co-suppression // Plant Mol. Biol. 1996. V. 32. P. 1197-1203.
42. Conceizro A.S., Van Vliet A., Krebbers E. Unexpectedly higher expression levels of a chimeric 2S albumin seed protein transgene from a tandem array construct//Plant Mol. Biol. 1994. V.26,N3.P. 1001-1005.
43. Dalmay T„ Hamilton A., Rudd S., Angell S., Baulcombe D.C. An RNA-dependent RNA polymerase gene in Arabidopsis is required for posttranscrip-tional gene silencing mediated by a transgene but not by a virus // Cell. 2000. V. 101, N5. P. 543-553.
44. Daniell H., Streatfield S., Wycoff K. Medical molecular farming: production of antibodies, biopharmaceuticals and edible vaccines in plants // Trends in Plant Science. 2001. V. 6. P. 219-226.
45. De Blok M., Botterman J., Vandewiele M. Engineering herbicide resistance in plants by expression of a detoxifying enzyme // EMBO J. 1987. V. 6. P. 2513-2518.
46. De Borne F., Vincentz M., Chupeau Y., Vaucheret H. Co-supression of nitrate reductase host genes and transgenes in transgenic tobacco plants // Mol. Gen. Genet. 1994. V. 243. P. 613-621.
47. De Buck S., De Wilde C., Montagu van M., Depicker A. T-DNA vector backbone sequences are frequently integrated into the genome of transgenic plants obtained by Agrobacterium-mediated transformation // Mol. Breed. 2000. V. 6. P. 459-468.
48. De la Riva G., Gonzalez-Cabrera J., Vazquez-Padron R., Ayra-Pardo C. Agrobacterium tumefaciens: a natural tool for plant transformation // Electronic J. of Biotechnol. 1998. V. 1,N3.
49. Deblaere R., Reynaerts A., Hofte H. et al. Vectors for cloning in plant cells // Methods Enzymol. 1987. V. 153. P. 277-291.
50. Dehio Ch., Schell J. Stable expression of a single-copy rolA gene in transgenic Arabidopsis thaliana plants allow an exhaustive mutagenic analysis of the transgene-associated phenotype // Mol. Gen. Genet. 1993. V. 241. P. 359-366.
51. Depicker A., Montagu M. Post-transcriptional gene silencing in plants // Curr. Opinion in Cell Biol. 1997. N 9. P. 373-382.
52. Deroles S.C., Gardner R.C. Analysis of the T-DNA structure in a large number of transgenic petunias generated by Agrobacterium-mediated transformation // Plant Mol. Biol. 1988. V. 11. P. 365-377.
53. Dilkes B.P., Feldmann K.A. Cloning genes from T-DNA tagged mutants // Methods Mol. Biol. 1998. V. 82. P. 339-351.
54. Dooner H.K., Belachew A. Chromosome breakage by pairs of closely linked transposable elements of the Ac-Ds family in maize // Genetics. 1991. V. 129(3). P. 855-862.
55. Dorer D.R., Henikoff S. Transgene repeat arrays interact with distant heterochro-matin and cause silencing in cis and trans II Genetics. 1997. V. 147. P. 1181-1190.
56. Dubreucq B., Grappin Ph., Caboche M. A new method for identification and isolation of genes essential for Arabidopsis thaliana seed germination // Mol. Gen. Genet. 1996. V. 252. P. 42-50.
57. Eichholtz D.A., Rogers S.G., Horsch R.B. Expression of mouse dihydrofolate reductase gene confers methotrexate resistance in transgenic Petunia plants // Somatic Cell. Mol. Genet. 1987. V. 13. P. 67-77.
58. Ellis J., Shirsat A.H., Hepher A., Garwood J. et al. Tissue specific expression of a pea legumin gene in seeds of Nicotiana plumbaginifolia II Plant Mol. Biol. 1988. V. 10. P. 203-214.
59. Elmayan T., Balzergue S., Beon F., Bourdon V., Daubremet J., Guenet Y., Mour-rain P., Palauqui J.C., Vernhettes S., Vialle T., Wostrikoff K., Vauche-ret H. Arabidopsis mutants impaired in cosuppression // Plant Cell. 1998. V. 10(10). P. 1747-1758.
60. Elomaa P., Holton T. Modification of flower colour using genetic engineering // Bio-technol. Genet. Eng. Rev. 1994. V. 12. P. 63-88.
61. English J.J., Mueller E., Baulcombe D.C. Supression of virus accumulation in transgenic plants exhibiting silencing of nuclear genes // Plant Cell. 1996. V. 8. P. 179-188.
62. Errampali D., Patton D., Castle L., Mickelson K., Hansen K., Schnall J., Feldmann BC., Meinke D. Embryogenic lethals and T-DNA insertional mutagenesis in Arabidopsis II Plant Cell. 1991. V. 3. P. 149-157.
63. Fagard M., Vaucheret H. Systemic silencing signals I I Plant Mol. Biol. 2000. V. 43, N2/3. P. 285-293.
64. Feldmann K.A. T-DNA insertion mutagenesis in Arabidopsis: mutation spectrum I I Plant J. 1991. V. 1. P. 71-82.
65. Feldmann K.A., Marks M.D., Christiansos M.L., Quatrano R.S. A dwarf mutant of Arabidopsis generated by T-DNA insertion mutagenesis // Science. 1989. V. 243. P. 1351-1354.
66. Feldmann K.A. Seed transformation in Arabidopsis thaliana II Gene Transfer to Plants. Berlin: Springer Lab. Manual. 1995. P. 11-18.
67. Feldmann K.A., Marks M.D. Agrobacterium-mediated transformation of germinating seeds of Arabidopsis thaliana: a non-tissue culture approach // Mol. Gen. Genet. 1987. V. 208. P. 1-9.
68. Finnegan J., McElroy D. Transgene inactivation: plants fight back! // Bio/Technology. 1994. V. 12. P. 883-887.
69. Flavell R.B. Inactivation of gene expression in plants as a consequence of specific sequence duplication // Proc. Natl Acad. Sci. USA. 1994. V. 91. P. 3490-3496.
70. Flavell R.B., O'Dell M., Metzlaff M., Bonhomme S., Cluster P.D. Developmental regulation of co-supression in petunia hybrida // Gene silencing in higher plants and related phenomens in others eukaryotes / Ed. P. Meyer. Springer, 1998.
71. Frank A., Guilley H., Jonard G. Nucleotide sequence of cauliflower mosaic virus DNA // Cell. 1980. V. 21. P. 285-294.
72. Franzmann L.H., Yoon E.S., Meinke D.W. Saturating the genetic map of Arabidopsis thaliana with embryonic mutations // Plant J. 1995. V. 10. P. 459-467.
73. Freitas F.A., Yunes J.A., Silva M.J., Arruda P., Leite A. Structural characterization and promoter activity analysis of the gamma-kafirin gene from sorghum // Mol. Gen. Genet. 1994. V. 245, N2. P. 177-186.
74. Fu X., Due L.T., Fontana S. et al. Linear transgene constructs lacking vector backbone sequences generate low-copy-number transgenic plants with simple integration patterns // Transgenic Res. 2000. V. 9. P. 11-19.
75. Furner J.J., Sheikh M.A., Collett C.E. Gene silencing and homology-dependent gene silencing in Arabidopsis: genetic modifiers and DNA methylation // Genetics. 1998. V. 149. P. 651-662.
76. Gendloff E.H., Bowen B., Buchhoilz W.G. Quantitation of chloramphenico; acetyl transferase in transgenic tobacco plants by ELISA and correlation with gene copy number// Plant Mol. Biol. 1990. V. 14. P. 575-583.
77. Gheysen G., Montagu van M., Zambryski P. Integration of Agrobacterium tume-faciens transfer DNA (T-DNA) involves rearrangements of target plant DNA sequences // Proc. Natl Acad. Sci. USA. 1987. V. 84. P. 6169-6173.
78. Gheysen G., Villarroel R., van Montagu M. Illegimate recombination in plants: model for T-DNA integration // Genes Dev. 1991. V. 5. P. 287-297.
79. Giddings G., Allison G., Brooks D., Carte A. Transgenic plants as factors for bio-pharmaceuticals // Nature Biotechnol. 2000. V. 18. P. 1151-1155.
80. Glover J., Blomer K.C., Farrell L.B. et al. Searching for tagged male-sterile mutants of Arabidopsis II Plant Mol. Biol. Reporter. 1996. V. 14, N 4. P. 330-342.
81. Graaff van der E., Make der D.-R., Hooykaas P.J.J. Deviating T-DNA transfer from Agrobacterium tumefaciens to plants // Plant Mol. Biol. 1996. V. 36. P. 677-681.
82. Grevelding C., Suter-Crazzolara C., Menges von A., Kemper E., Maesterson R., Schell J., Reiss B. Characterization of a new allele of pale cress and its role in greening in Arabidopsis thaliana II Mol. Gen. Genet. 1996. V. 251, N 5. P. 532-541.
83. Gritz L., Davies J. Plasmid-encoded hygromicin B resistance: the sequence of hy-gromicin B phosphotransferase gene and its expression in Esherichia coli and Saccharomyces cerevisiae II Gene. 1983. V. 25. P. 179-188.
84. Hain R., Stabel P., Chernilofsky A.P., Steibniss H.H., Herrera-Estrella L., Schell J. Uptake, integration, expression and genetic transmission of a selectable chimeric gene by plant protoplasts // Mol. Gen. Genet. 1985. V. 199. P. 161-168.
85. Hamilton A.J., Baulcombe D.C. A species of small antisense RNA in posttrans-criptional gene silencing in plants // Science. 1999. V. 286, N 5441. P. 950-952.
86. Haseloff J., Siemering K.R., Prasher D.C., Hodge S. Removal of cryptic intron and subcellular localisation of green fluorescent protein are required to mark transgenic Arabidopsis plants brightly // Proc. Natl Acad. Sci. USA. 1997. V. 94. P. 2122-2127.
87. Heberle-Bors E., Charvat B., Thompson D., Scherthaner J.P., Barta A., Matzke A.J.M., Matzke A.M. Genetic analysis of T-DNA insertion into tobacco genome // Plant Cell Rep. 1988. V. 7. P. 571-574.
88. Herman L., Jacobs A., Montagu van M., Depicker A. Plant chromosome/marker gene fusion assay for study of normal and truncated T-DNA integration events // Mol. Gen. Genet. 1990. V. 224. P. 248-256.
89. Hobbs S.L.A., Jackson J.A., Baliski D.S., DeLong M.O., Mahon J. Genotype- and promoter-induced variability in transient beta-glucuronidase expression in pea protoplasts // Plants Cell Reports. 1990. V. 9. P. 17-20.
90. Hobbs S.L.A., Warkauntin T.D., DeLong C.M.O. Transgene copy number can be positevly or negativly associated with transgene expression // Plant Mol. Biol. 1993. V. 21. P. 17-26.
91. Hoeven van der C., Dietz A., Landsmann J. Variability of organ-specific gene expression in transgenic tobacco plants // Transgenic Res. 1994. V. 3. P. 159-165.
92. Holton T.A., Tanaka Y. Blue roses a pigment of our imagination? // Trends Bio-technol. 1994. V. 12. P. 40-42.
93. Hirochika H., Okamoto H., Kakutani T. Silencing of retrotransposons in Arabi-dopsis and reactivation by the ddml mutation // Plant Cell. 2000. V. 12. P. 357-368.
94. Horsch R.B., Fraley R.T., Rogers S.G., Sanders P.R., Hoffmann L.A.N. Inheritance of functional foreign genes in plants // Science. 1984. V. 223, N 4635. P. 496-499.
95. Jeddeloh J.A., Bender J., Richards E. The DNA methylation locus DDM1 is required for maintenance of gene silencing in Arabidopsis // Genes and Development. 1998. V. 12. P. 1714-1725.
96. Jeddeloh J.A., Stokes T.L., Richards E.J. Maintenance of genomic methylation requires a SWI2/SNF2-like protein // Nat Genet. 1999. V. 22. P. 94-97.
97. Jefferson R.A., Kavanagh C., Bevan M.W. GUS fusions: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants // EMBO J. 1987. V. 6. P. 3901-3907.
98. Jofuku K.D., den Boer B.G.V., Montagu van M., Okamuro J.K. Control of Arabidopsis flower and seed development by the homeotic gene APETALA2 // Plant Cell. 1994. V. 6. P. 1211-1225.
99. Jones A.L., Thomas C.L., Manle A.J. De novo methylation and co-suppression induced by a cytoplasmically replicating plant RNA virus // EMBO J. 1999. V. 17,N21. P. 6385-6393.
100. Jones J.D.G., Gilbert D.E., Grady K.L., Jorgensen R.A. T-DNA structure and gene expression in petunia plants transformed by Agrobacterium tumefaciens C58 derivatives // Mol. Gen. Genet. 1987. V. 207. P. 478-485.
101. Jorgensen R.A. Cosupression, flower color patterns and metastable gene expression states // Science. 1995. V. 268. P. 686-691.
102. Karlin S., Mrazek J. Compositional differences within and between eukaryotic genomes // PNAS. 1997. V. 94. P. 10227-10232.
103. Khan M.R.I., Ceriotti A., Tabe I. Accumulation of a sulphur-rich seed albumin from sunflower in the leaves of transgenic subterranean clover (Trifolium sub-terraneum L.) // Transgenic Res. 1996. V. 5. P. 179-185.
104. Kilby N.J., Leyser H.M.O., Furner I.J. Promoter methilation and progressive transgene inactivation in Arabidopsis II Plant Mol. Biol. 1992. V. 20. P. 103-112.
105. Klucher K.M., Chow H., Reiser L., Fisher R.L. The AINTEGUMENTA gene of Arabidopsis required for ovule and female gametophyte development is related to the floral homeotic gene APETALA2 II The Plant Cell. 1996. V. 8. P. 137-153.
106. Komari T. Genetic characterization of a double-flowered tobacco plants obtained in a transformation experiment // Theor. Appl. Genet. 1990. V. 80. P. 167-171.
107. Koncz C., Martini N., Mayerhofer R. High frequency T-DNA-mediated gene tagging in plants // Proc. Natl Acad. Sci. USA. 1989. V. 86. P. 8467-8471.
108. Koncz C., Mayerhofer R., Koncz-Kalman Z. et al. Isolation of a gene encoding a novel chloroplast protein by T-DNA tagging in Arabidopsis thaliana II EMBO J. 1990. V. 9, N 5. P. 1337-1346.
109. Koncz C., Nemeth K., Redei G., Schell J. Homology recognition during T-DNA integration into the plant genome // Homologous Recombination and Gene Silencing in Plants / Ed. J. Paszkowski. Kluver Academic Publishers. Netherlands, 1994. P. 167-189.
110. Koncz C., Schell J. The promoter of Tl-DNA gene 5 controls the tissue-specific expression of chimaeric genes carried by a novel type of Agrobacterium binary vector // Mol. Gen. Genet. 1986. V. 204. P. 383-396.
111. Kononov M.E., Bassuner B., Gelvin S.B. Integration of T-DNA binary vector 'backbone' sequences into the tobacco genome: evidence for multiple complex pattern of integration // Plant J. 1997. V. 11, N 5. P. 945-957.
112. Koornneef M. The complex syndrome of ttg mutants // Arab. Jnf. Serv. 1981. V. 18. P. 45-51.
113. Koornneef M. Arabidopsis genetics // Arabidopsis / Eds. E. Meyerowitz, C. Somerville. Cold Spring Harb, NY: Cold Spring Harbor Laboratory Press. 1994.
114. Koornneef M., Veen van der J.N. Induction and analysis of gibberellin sensitive mutants in Arabidopsis thaliana (L.) Heynh. // Theor. Appl. Genet. 1980. V. 58. P. 257-263.
115. Korpowski H., Yusibov V. The green revolution: plants as heterologous expression vectors // Vaccine. 2001. V. 19. P. 2735-2741.
116. R., Martin-Hernandez A.M., Peart J.R., Malcuit I., Baulcombe D.C. Virus-induced gene silencing in plants // Methods. 2003. V. 30, N 4. P. 296-303.
117. Ma C., Mitra A. Intrinsic direct repeats generate consistent post-transcriptional gene silencing in tobacco // Plant J. 2002. V. 31. P. 37-49.
118. Mannerlof M., Terming P. Variability of gene expression in transgenic tobacco // Euphytica. 1997. V. 98. P. 133-139.
119. Marathe R., Anandalakshmi R., Smith T.H., Pruss G.J., Vance V.B. RNA viruses as inducers, suppressors and targets of post-transcriptional gene silencing // Plant Mol. Biol. 2000. V. 43, N 2/3. P. 295-306.
120. Mariani C., Beuckeleer M., Truetuer J. Induction of male sterility in plants by a chimaeric ribonuclease gene //Nature. 1990. V. 347. P. 737-741.
121. Marton L., Hrouda M., Pecsvaradi A., Czako M. T-DNA-insert-independent mutations induced in transformed plant cells during Agrobacterium co-cultivation // Transgenic Res. 1994. V. 3. P. 317-325.
122. Matzke M.A., Jorgensen R.A. From plants to mammals // Science. 1996. V. 271, N 5254. P. 1347-1348.
123. Matzke M.A., Matzke A.J.M. How and why do plants inactivate homologous (Trans) genes // Plant Physiol. 1995. V. 107, N 3. P. 679-685.
124. Matzke M.A., Matzke A.J.M. Epigenetic silencing of plant transgenes as a consequence of diverse cellular defence responses // Cel. and Mol. Life Sci. 1998. V. 54. P. 94-103.
125. Matzke M.A., Mette M.F., Matzke A.J.M. Transgene silencing by the host genome gefense: implications for the evolution of epigenetic control mechanisms in plants and vertebrates // Plant Mol. Biol. 2000. V. 43. P. 401-415.
126. Matzke M.A., Neuhuber F., Matzke A.J.M. A variety of epistatic interactions can occur between partially homologous transgene loci brought together by sexual crossing // Mol. Gen. Genet. 1993. V. 236. P. 379-386.
127. Matzke A., Neuhubar F., Park Y.D. et al. Homology-dependent gene silencing in transgenic plants: epistatic silencing loci contain multiple copies of methylated transgenes // Mol. Gen. Genet. 1994. V. 244. P. 219-229.
128. Matzke M.A., Priming M., Tronovsky J., Matzke A.J.M. Reversible methylation and inactivation of marker genes in sequentially transformed tobacco plants // EMBO J. 1989. V. 8. P. 643-649.
129. Matzke A.J., Stoger E.M., Schernthaner J.P., Matzke M.A. Deletion analysis of a zein gene promoter in transgenic tobacco plants // Plant Mol. Biol. 1990. V. 14, N3. P. 323-332.
130. Mayerhofer R., Koncz-Kalman Z., Nawrath C., Bakkeren G., Crameri A., Angelis K., Rebei G.P., Schell J., Hohn B., Koncz C. T-DNA integration: a mode of illegitimate recombination in plants // EMBO J. 1991. V. 10. P. 697-704.
131. McClintock B. The supressor-mutation system of control of gene action in maize /carnegie // Inst. Wash.Yrbk., 1958. V. 57. P. 415^52.
132. McNevin J.P., Woodward W., Hannoufa A., Feldmann K.A., Lemieux B. Isolation and characterization of eceriferum (cer) mutants induced by T-DNA insertions in Arabidopsis thalianall Genome. 1993. V. 36. P. 610-618.
133. Meinke D.W. Embrio-lethal mutants of A. thaliana: analysis of mutants with a wide range of lethal phases // TAG. 1985. V. 69. P. 543-552.
134. Meinke D.W., Franzmann L.H., Nickle T.C., Yeung E.C. Leafy cotyledone mutants of Arabidopsis 11 Plant Cell. 1994. V. 6. P. 1049-1064.
135. Meinke D.W., Sussex I.M. Embrio-lethal mutants of Arabidopsis thaliana: a model sistem for genetic analysis of plant embryo development // Dev. Biol. 1979. V. 72. P. 50.
136. Mette M.F., Aufsatz W., Winden J., Matzke M.A., Matzke A.J.M. Silencing and promoter methylation triggered by double-satranded RNA // EMBO J. 2000. V. 19. P. 5194-5201.
137. Meyer P., Heidmann I. Epigenetic variants of a transgenic petunia line show hy-permetilation in transgene DNA: an indication for specific recognition of foregn DNA in transgenic plants // Mol. Gen. Genet. 1994. V. 243. P. 390-399.
138. Meyer P., Heidmann I., Niedenhof I. Differences in DNA-methylation are associated with a paramutation phenomenon in transgenic petunia // The Plant J. 1993. V. 4. P. 86-100.
139. Mikula G. Heritable changes in R-locus expression in maize in response to environment// Genetics. 1967. V. 56. P. 733-742.
140. Miranda A., Janssen G., Hodges L., Peralta E.G., Ream \V. Agrobacterium tume-faciens transfers extremely long T-DNAs by a unidirectional mechanism // J. Bacteriol. 1992. V. 174, N 7. P. 2288-2297.
141. Modrusan Z., Roiser L., Feldmann K.A., Fisher R., Haughn G.W. Homeotic transformation of ovules into carpel-like struktures in Arabidopsis II The Plant Cell. 1994. V. 6. P. 333-349.
142. Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plant. 1962. V. 15. P. 473-497.
143. Nacry P., Camilleri C., Courtial B., Caboche M., Bouchez D. Major chromosomal rearrangement induced by T-DNA transformation in Arabidopsis II Genetics. 1998. V. 149. P. 641-650.
144. Napoli C., Lemieux C., Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-supression of homologous genes in trans // Plant Cell. 1990. V. 2. P. 279-289.
145. Narayan R.K.J. Discontinuous DNA variation in the evolution of plant species // J. Genet. 1985. V. 64. P. 101-109.
146. Narayan R.K.J. Nuclear DNA changes, genome differentiation and evolution in Nicotiana (Solanaceae) II Plant Syst. Evol. 1987. V. 157. P. 161-180.
147. Negruk V., Eisner G., Lemieux B. Addition-deletion mutations in transgenic Arabi-dopsis thaliana generated by the seed co-cultivation method // Genome. 1996. V. 39. P. 1117-1122.
148. Neuhuber F., Park Y.-D., Matzke A.J.M., Matzke M.A. Susceptibility of transgene loci to homology-dependent gene silencing // Mol. Gen. Genet. 1994. V. 244. P. 230-241.
149. Niebel A., Heungens K., Barthels N., Inze D., Montagu van M., Gheysen G. Characterization of a pathogen-induced potato catalase and its systemic expression upon nematode and bacterial infection // Mol. Plant Microbe Interact. 1995. V. 8(3). P. 371-378.
150. Ohba T., Yoshioka Y., Machida C. DNA rearragement associated with the integration of T-DNA in tobacco: an example for multiple duplications of DNA around the integration taget // Plant J. 1995. V. 7. P. 157-164.
151. Ohshima S., Murata M., Sanamoto W., Ogura Y., Motoyoshi F. Cloning and molecular analysis of Arabidopsis gene Terminal Flower 1 // Mol. Gen. Genet. 1997. V. 254. P. 186-194.
152. Oppenheimer D.G., Herman P.L., Sivakumaran S., Esch J., Marks M.D. A myb gene required for leaf trichome differentiation in Arabidopsis is expressed in stipules // Cell. 1991. V. 67. P. 483-493.
153. Palauqui J-Ch., Vaucheret H. Field trial analysis of nitrate reductase co-supression: a comparative study of 38 combinations of transgene loci // Plant Mol. Biol. 1995. V. 29. P. 149-159.
154. Park Y., Cheong H. Expression and production of recombinant human inter-leukin-2 in potato plants // Protein Expr. Purif. 2002. V. 25. P. 160-165.
155. Park S., Yong Hwi Yoon, Byung Chul Kim et al. Pollen of male-sterile mutant A. thaliana isolated from a T-DNA insertion pool is not effectivly released from the anther locule // Plant Cell Physiol. 1996a. V. 37, N 5. P. 580-585.
156. Papp I., Iglesias V.A., Moscone E.A., Michalowski S., Spiker S., Park Y.D., Matzke M.A., Matzke A.J. Structural instability of a transgene locus in tobacco is associated with aneuploidy // Plant J. 1996. V. 10, N 3. P. 469-478.
157. Patterson G.I., Chandler V.L. Paramutation in maize and related allelic interactions // Curr. Top. Microbiol. Immunol. 1995. V. 197. P. 121-141.
158. Peach C., Velten J. Transgen expression variability (position effects) of CAT and GUS reporter genes driven by linked divergent T-DNA promoters // Plant Mol. Biol. 1991. V. 17. P. 49-60.
159. Pennarubia L., Kim R., Giovannoni J. Production of the sweet protein monellin in transgenic plants // Biothechnology. 1992. V. 10. P. 561-563.
160. Petrhans A., Schlupmann H., Basse C., Paszkowski J. Intrachromosomal recombination in plants // EMBO J. 1990. V. 9, N 11. P. 3437-3445.
161. Porsch P., Jahnke A., During K. A plant transformation vector with a minimal T-DNA II. Irregular integration patterns of the T-DNA in the plant genome // Plant Mol. Biol. 1998. V. 37. P. 581-585.
162. Potrykus I., Paszkowski J., Saul M., Petruska J., Shillito R. Molecular and general genetics of hybrid foreign gene introduced into tobacco by direct gene transfer// Mol. Gen. Genet. 1985. V. 199. P. 169-177.
163. Prols F., Meyer P. The methylation patterns of chromosomal integration regions influence gene activity of transferred DNA in Petunia hybrida II Plant J. 1992. V. 2. P. 465-475.
164. Ramanathan V., Veluthambi K. Transfer of non-T-DNA portions of the Agrobac-terinm tumefaciens Ti plasmid pTiA6 from the left terminus of TL-DNA // Plant Mol. Biol. 1995. V. 28. P. 1149-1154.
165. Ratcliff F., Harrison B.D., Baulcombe D.C. A similarity between viral defense and gene silencing in plants // Sciene. 1997. V. 276. P. 1558-1560.
166. Reiss B., Sprengel R., Will H., Schaller H. A new sensitive method for qualitative and quantitative assay of neomycinphosphotransferase in crude cell eztracts // Gene. 1984. V. 30. P. 211-218.
167. Renckens S., De Greve H., Montagu van M., Hernalateens J-P. Petunia plants escape from negative selection against a transgene by silencing the foreign DNA via methylation // Mol. Gen. Genet. 1992. V. 233. P. 53-64.
168. Rerie W.G., Feldmann K.A., Marks M.D. The Glabra2 gene encodes a ho-meodomain protein required for normal trihome development in Arabidopsis thaliana II Genes and Devel. 1994. V. 8. P. 1388-1399.
169. Rhounim L., Rossignol J.-L., Faugeron G. Epimutation of repeated genes in Ascobolus immerses // EMBO J. 1992. V. 11, N 12. P. 4451-4457.
170. Robinson-Beers K., Pruitt R.E., Gasser C.S. Ovule development in wild-type Arabidopsis and two female-sterile mutants // Plant Cell. 1992. V. 4. P. 1237-1249.
171. Arabidopsis thaliana II Mol. Gen. Genet. 1991. V. 228. P. 104-112. Scheid O.M., Probst A.V., Afsar K., Paszkowski J. Two regulatory levels of transcriptional gene silencing in Arabidopsis II PNAS. 2002. V. 99. P.13659-13662.
172. Speulman E., Metz P.L.J., Gert van A., Hekkert B.L., Stiekema W.J., Pereira A. A two component enhancer inhibitor transposon mutagenesis system for functional analysis of the Arabidopsis genome // Plant Cell. 1999. V. 11. P. 1853-1866.
173. Spielman A., Simpson R.B. T-DNA structure in transgenic tobacco plants with multiple independent integration sites // Mol. Gen. Genet. 1986. V. 205. P. 34—41.
174. Stalberg K., Ellerstrom M., Josefsson L., Rask L. Deletion analysis of a 2S seed storage protein promoter of Brassica napus in transgenic tobacco // Plant Mol. Biol. 1993. V. 23. P. 671-683.
175. Stiff C., Killan A., Zhou H., Kudrna D., Kleinhofs A. Stable transformation of barley callus using biolistic particle bombardment and the phosphinothricin acetyltransferase (bar) gene // Plant Cell, Tissue and Organ Culture. 1995. V. 40. P. 243-248.
176. Stretfield S., Howard J. Plant-based vaccines // Int. J. Parasitol. 2003. V. 33. P. 479-493.
177. Stretfield S., Jika J., Hood E., Turner D., Bailey M., Mayor J., Woodard S., Beifuss K., Horn M., Delaney D., Tizard J., Howard J. Plant-based vaccine: unique advantages // Vaccine. 2000. V. 19. P. 2742-2748.
178. Svitashev S.K., Somers D.A. Characterization of transgene loci in plants using FISH: a picture is worth a thousand words // Tissue and Organ Culture. 2002. V. 69. P. 205-214.
179. Tacket C.O., Mason H. A review of oral vaccination with transgenic vegetables // Microbes and Infection. 1999. V. 1. P. 777-783.
180. Takahashi Yo., Kuroda H., Tanaka T., Mashida Ya., Takebe I., Nagata T. Isolation of an auxin-regulated gene cDNA expressed during the transition from Go to S phase in tobacco mesophyll protoplasts // Proc. Natl Acad. Sci. USA. 1989. V. 86. P. 9279-9283.
181. Takano M., Egawa H., Ikeda J-E., Wakasa K. The structure of integration sites in transgenic rice // Plant J. 1997. V. 11. P. 381-361.
182. Talon M., Koornneef M., Zeevaart J.A. Endogenous gibberellins in Arabidopsis thaliana and possible steps bloked in the biosynthetic pathways of the semidwarf ga4 and ga5 mutants // Proc. Natl Acad. Sci. USA. 1990. V. 87. P. 7983-7987.
183. Tinland B. The integration of T-DNA into plant genomes // Trends in Plant Science. 1996. V. 1, N 6. P. 178-183.
184. Tinland B., Hohn B., Puchta H. Agrobacterium tumefaciens transfers single-stranded transferred DNA (T-DNA) into the plant cells nucleus // Proc. Natl Acad. Sci. USA. 1994. V. 91. P. 8000-8004.
185. Tinland B., Schoumacher F., Gloeckler V., Bravo-Angel A.M., Hohn B. The Agrobacterium tumefaciens virulence D2 protein is responsible for precise integration of T-DNA into the plant genome // EMBO J. 1995. V. 14. P. 3585-3595.
186. Todd J.J., Vodkin L.O. Duplications that suppress and deletions that restore expression from a chalcone synthase multigene family // Plant Cell. 1996. V. 8, N 4. P. 687-699.
187. Topfer R., Martini N., Schell J. Modification of plant lipid synthesis // Science. 1995. V. 268. P. 681-686.
188. Ulian E.C., Magill J.M., Smith R.H. Expression and inheritance pattern of two foreign genes in petunia//Theor. Appl. Genet. 1994. V. 88. P. 433^440.
189. Vaucheret H. Identification of a general silencer for 19S and 35S promoters in a transgenic tobacco plant: 90 bp of homology in the promoter sequence are sufficient for trans-inactivation // C. R. Acad. Sci. Paris. 1993. V. 316. P.1471-1483.
190. Vaucheret H. Promoter-dependent trans-inactivation in transgenic tobacco plants: kinetic aspects of gene silencing and gene reactivation // C.R. Acad. Sci. Paris, 1994. V. 316. P. 310-323.
191. Vaucheret H., Fagard M. Transcriptional gene silencing in plants: targets, inducers and regulators // Trends Genet. 2001. V. 17, N 1. P. 29-35.
192. Vionnet O., Baulcombe D.C. Systemic signalling in gene silencing // Nature. 1997. N389. P. 553.
193. Vongs A., Kakutani T., Martienssen R.A., Richards E J. Arabidopsis thaliana DNA methylation mutants // Science. 1993. V. 260(5116). P. 1926-1928.
194. Wallroth M., Gerats A.G.M., Rogers S.G., Fraley R.T., Horsh R.B. Chromosomal location of foreign genes in Petunia hybrida // Mol. Gen. Genet. 1986. V. 202. P. 6-15.
195. Walter Ch., Broer I., Hillemann D., Puhler A. High frequency, heat treatment-induced inactivation of the phosphinothricin resistance gene in transgenic single cell suspension cultures of Medicago sativa // Mol. Gen. Genet. 1992. V. 235. P. 189-196.
196. Wang M.-B., Waterhouse P.M. High-efficiency of a P-glucuronidase gene in rice is correlated with repetitive transgene structure but is independent of DNA methylation // Plant Mol. Biol. 2000. V. 43. P. 67-82.
197. Waterhouse P.M., Helliwell C.A. Exploring plant genomes by RNA-induced gene silencing // Nat. Rev. Genet. 2003. V. 4, N 1. P. 29-38.
198. Wenck A., Czako M., Kanevski I., Marton L. Frequent collinear long transfer of DNA inclusive of the whole binary vector during Agrobacterium-mediated transformation // Plant Mol. Biol. 1997. V. 34. P. 913-922.
199. Winkler R.G., Feldmann K.A. PCR-based identification of T-DNA insertion mutants //Methods Mol. Biol. 1998. V. 82. P. 129-136.
200. Wolters A.-M.A., Trindade L.M., Jacobsen E., Visser R.G.F. Fluorescence in situ hybridization on extended DNA fibres as a tool to analyse complex T-DNA loci in potato // Plant J. 1998. V. 13. P. 837-847.
201. Yanofsky M.F., Hong Ma, Bowman J.L., Drews G.N., Feldmann K.A., Meyerowitz E.M. The protein encoded by the Arabidopsis homeotic gene agamous resembles transcription factors //Nature. 1990. V. 346. P. 35-39.
202. Yin Z., Wang G.-L. Evidence of multiple complex patterns of T-DNA integration into the rice genome // Theor. Appl. Genet. 2000. V. 100. P. 461-470.
203. Zambryski P. Chronicles from the Agrobacterium-plant cell DNA transfer story // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1992. V. 43. P. 465-490.
204. Zambryski P., Tempe J., Schell J. Transfer and function of T-DNA genes from Agrobacterium Ti and Ri plasmids in plants // Cell. 1989. V. 56. P. 193-201.
205. Zhao Y., Leisy D J., Okita T.W. Tissue-specific expression and temporal regulation of the rice glutelin Gt3 gene are conferred by at least two spatially separated cis-regulatory elements // Plant Mol. Biol. 1994. V. 25. P. 429-436.
206. Zrenner R., Salanoubat M., Willmitzer L., Sonnewald U. Evidence of the crutial role of sucrose synthase for sink strenght using transgenic potato plants {Solanum tuberosum L.) // Plant J. 1995. V. 7. P. 97-107.
www.dissercat.com
Экспрессия чужеродных генов в растения
Эксперименты по экспрессии чужеродных генов в растениях [c.382]К преимуществам векторных систем на основе вирусов можно отнести следующие малый размер генома, что дает возможность легко манипулировать вирусной ДНК высокая копийность вирусной ДНК в клетках зараженных растений (до 50 ООО на клетку) наличие сильных промоторов, которые могут обеспечить эффективную экспрессию чужеродных генов. [c.57]
При экспрессии чужеродных генов в геноме растений возникает ряд проблем. [c.63]
Определение содержания или активности продуктов, кодируемых перенесенным геном, представляет собой наиболее прямой способ изучения экспрессии чужеродных генов в трансформированных тканях растений. Многие промоторы и предполагаемые регуляторные последовательности изучали путем со- [c.308]Продукция рекомбинантных белков в растениях имеет ряд потенциальных преимуществ перед другими системами экспрессии чужеродных генов. Растительные системы более дешевы по сравнению с культивированием в биореакторах (ферментерах). Все, что требуется для нормальной жизнедеятельности растений, — это минеральные соединения, содержащиеся в почве, вода, энергия солнечного света и углекислый газ. [c.468]
После того как методика трансформации растений была полностью отработана, исследователи стали пытаться вводить различные растительные и бактериальные гены в клетки самых разных растений. Трансформированные растения проверяли на способность к синтезу чужеродного белка, проводили физиологические исследования, чтобы определить, как присутствие этого белка сказывается на всем растении. Во многих ранних экспериментах использовали промоторы, контролирующие конститутивную экспрессию в ряде растительных клеток. Не так давно были выделены и охарактеризованы растительные промоторы, контролирующие экспрессию чужеродных белков в специфических клетках на определенных стадиях роста и развития растения. Например, вместо сильного конститутивного 358-промотора вируса мозаики цветной капусты, функционирующего во всех растительных тканях в течение всей жизни растения, ис- [c.382]
Вводя в геном растений чужеродные гены и обеспечивая их экспрессию, можно относительно быстро создавать новые сорта растений. Уже получены трансгенные растения, устойчивые к неблагоприятным условиям окружающей среды, к насекомым-вредителям, вирусам, гербицидам, окислительному и солевому стрессам. Выведены культуры с необычной окраской цветков, растения, имеющие более высокую пищевую ценность, растения с измененным вкусом плодов и т. д. Некоторые растения удалось модифицировать так, что они стали своеобразными фабриками по крупномасштабному синтезу ценных белков, например антител. Многочисленные трансгенные растения с измененными свойствами и повышенной пищевой ценностью прошли успешную проверку в лабораторных, а некоторые из них — в полевых условиях. К настоящему времени на рынок поступило лишь небольшое число генетически модифицированных растений, однако можно с уверенностью сказать, что в будущем они займут на нем достойное место. [c.413]
ЭКСПРЕССИЯ (ФУНКЦИОНИРОВАНИЕ) ЧУЖЕРОДНЫХ ГЕНОВ В ГЕНОМЕ РАСТЕНИЙ [c.63]
Процессе развития или при изменении условий окружающей среды. Более того, в трансгенных растениях отпадает необходимость в разграничении экспрессии чужеродного и хозяйского генов. [c.310]
ЭКСПРЕССИЯ И НАСЛЕДОВАНИЕ ЧУЖЕРОДНЫХ ГЕНОВ, ВВЕДЕННЫХ В РАСТЕНИЯ В СОСТАВЕ Т-ДНК [c.466]
Высокий уровень экспрессии встроенного гена, быстрая аккумуляция значительных количеств чужеродного белка и вследствие этого простота его очистки делают вирусы растений привлекательными векторами для переноса генов. Вирусы растений имеют более широкий круг хозяев, чем агробактерии, что позволяет экспрессировать ген в разных видах растений с помощью одной и той же векторной конструкции. Кроме того, если антиген многократно экспонирован на поверхности вирусных частиц, его иммуногенность с)Ш] ественно повышается. В качестве носителей для антигенных пептидов используют белки оболочки вирусов табачной мозаики, мозаики коровьего гороха, мозаики вигны китайской, мозаики люцерны и некоторых других вирусов. [c.475]
Как видим, векторная система вирусов растений имеет определенные преимущества перед трансгенными растениями. Однако при создании вирусов, экспонирующих на поверхности своих частиц чужеродные пептиды, существует ограничение на размер такого пептида. Максимальный размер встройки, при котором процесс сборки вирусных частиц еще не нарушается, для вируса табачной мозаики составляет 25 АК, а для вируса мозаики люцерны — 37 АК. Кроме того, вирусная система не обеспечивает наследования растениями экзогенной РНК продукция вируса и экспрессия встроенного целевого гена возможна только в инфицированных растениях в ограниченный промежуток времени. Главным недостатком вирусной системы экспрессии в растениях является опасность распространения этих вирусов в окружающей среде насекомыми, механическими (контактными) и другими способами. Поэтому требуются жесткие меры контроля за инфицированными растениями. [c.479]
Введение гена и его экспрессия в геноме растения-реципиента. Проблема переноса чужеродных генов в геном растений существенно облегчается в связи с обнаружением Т1-плазмид почвенных агробактерий AgroЪa terium Ште/ааепз, позволяющих вводить чужеродные гены в геном двудольных и некоторых однодольных растений. В последнее время довольно широко, особенно для трансформации клеток однодольных растений, используется метод биобаллистической трансформации. Важно обеспечить экспрессию чужеродного гена в геноме растения-реципиента и стабильное наследование признака в поколениях. Экспрессия введенного гена зависит от ряда причин, в том числе от места интеграции гена в геном растения, последующего метилирования промоторной области и введенного гена и т.п. [c.50]
В заключение следует отметить, что хотя векторы на основе вирусов редко применяются для трансформации растений, вирусные промоторы, и прежде всего промотор 35S-PHK aMV, широко используется для экспрессии чужеродных генов в других векторных системах. Промотор 35S-PHK вируса мозаики цветной капусты является сильным промотором, кроме того, он активен не только в клетках крестоцветных, но и в клетках других семейств, не проявляет тканеспецифичности и экспрессируется во всех клетках трансформированного растения. [c.57]
Для выявления экспрессии чужеродных генов на ранних стадиях получения трансгенных растений используют маркеры экспрессии —репортерные гены. Продукты генов-репортеров обычно легко детектируются с помощью простых методов. Наиболее широко используемый ре-портерный ген GUS кодирует фермент -глюкуронидазу и при добавлении субстрата расщепляет его с получением соединения,окрашенного в 64 [c.64]
В трансформированных таким способом клетках, идентифицируемых по экспрессии маркерного гена, введенная ДНК зачастую экспрессируется лишь кратковременно. Пока чужеродная ДНК не встроится в геном растения, она с большой вероятностью утрачивается при делении трансформированных клеток. [c.381]
Вначале чужеродные гены вводили в ДНК хлоропластов в составе плазмидного вектора, несущего неселективную чужеродную ДНК и селективный маркер, например ген устойчивости к антибиотику, фланкированные специфическими последовательностями хлоропластной ДНК (рис. 17.7). Такая стратегия была весьма эффективной, однако нередко селективный маркер мешал экспрессии фланкирующих хлоропластных генов. Чтобы решить эту проблему, разработали стратегию, в которой селективный маркер и чужеродный ген не были физически связаны друг с другом. Для этого растения табака трансформировали смесью одинаковых количеств двух разных плазмид одна содержала селективный маркер (ген устойчивости к спектиномицину), фланкированный ДНК из одного участка хлоропластной ДНК, а вторая — чужеродный ген (ген устойчивости к канамицину), фланкированный последовательностями из другого участка [c.385]
Для обеспечения экспрессии чужеродньгх генов, введенных в растительные клетки, использовали растительные промоторы. Различные промоторы, функционирующие только в определенньгх растительных тканях или на определенной стадии развития растения, идентифицировали по экспрессии репортерного гена без промотора после его интеграции в хромосомную ДНК растения. Были разработаны методы встраивания чужеродных генов непосредственно в хлоропластную или митохондриальную ДНК так, чтобы кодируемый белок синтезировался прямо в этих органеллах. И наконец, для того чтобы успокоить общественность, были разработаны методы удаления маркерных генов из трансгенных растений. [c.387]
Трансгенные растения, трансформированные сильно измененным геном протоксина, синтезировали в 100 раз больще токсина, чем растения, трансформированные геном дикого типа, при этом наблюдалась прямая корреляция с увеличением инсектицидной активности. Полученные данные позволяют надеяться, что аналогичным образом удастся повысить уровень экспрессии в растениях множества других чужеродных генов. [c.392]
В некоторых случаях для тестирования последовательностей чужеродного гена в трансформированной ткани можно использовать метод дот-блоттинг-гибридизации ДНК. Изучение организации чужеродной ДНК, встроенной в геном растения, лучше всего начинать с блоттинг-гибридизации по Саузерну (гл.5 и разд. 6.2). Данный метод позволяет определить копийность встроенных последовательностей ДНК, выяснить, расположены ли эти многочисленные вставки тандемно либо рассеяны по геному, а также оценить стабильность этой ДНК в поколении Fl трансформированных растений. Весьма важно получить как можно больше данных о строении и расположении перенесенных генов в геноме трансформированного растения, поскольку от этого в значительной степени может зависеть их экспрессия и наследуемость. Для подробного анализа организации чужеродной и окружающей ее ДНК требуются такие методы выде- [c.236]
Таким образом, трансгенная система хлоропластов позволяет достичь высокой дозы чужеродного гена, что при правильно сконструированном трансгене обеспечивает очень эффективную продукцию целевого белка. Более того, способность пластид осуществлять экспрессию оперонов позволяет создавать искусственные опероны (см. рис. 19.15) и в перспективе — вводить новые метаболические пути в растения, улучшая их потребительские свойства. Важной особенностью пластид является то, что они передаются по материнской линии и обычно не содержатся в пыльце. Поэтому транспластомные растения по сравнению с обычными трансгенными растениями более безопасны для окружающей среды, так как в них предотвращается неконтролируемое распространение трансгена в другие растения. Поскольку интеграция [c.483]
Для идентификации трансформированных клеток необходимо уметь обнаруживать чужеродную ДНК, интегрировавшую в геномную ДНК растения. Более того, при исследовании сигналов регуляции транскрипции и их функций в специфических растительных тканях (листьях, корнях или цветках) зачастую важно уметь количественно оценивать уровень экспрессии гена, кодирующего легко идентифицируемый продукт. Все это требует применения репортерных генов, которые позволяют либо проводить отбор трансформированных клеток, либо оценивать активность кодируемого ими фермента. Было протестировано несколько разных генов, которые можно использовать как доминантные селективные маркеры, и генов, чей белковый продукт можно обнаружить с помощью специфических методов (табл. 17.4). Поскольку многие из ренортерных генов имеют бактериальное происхождение, они были снабжены регуляторными последовательностями, обеспечивающими их экспрессию в растительных клетках. Проводя отбор по доминантному маркеру, можно получить культуру, содержащую только трансформированные клетки. Так, в присутствии канамицина выживают только клетки растений, синтезирующих активную неомицинфосфо-трансферазу. [c.381]
Конъюгативный перенос бактериальных генов в клетки животных. Перенос генов во время конъюгации бактериальных клеток, когда мужские и женские клетки вступают в контакт друг с другом через объединяющий их цитоплазматический мостик, является широко распространенным и хорошо изученным генетическим явлением [224, 225]. Недавно была продемонстрирована возможность конъюгативного переноса ДНК из бактериальных клеток в культивируемые клетки животных [226]. В этой серии экспериментов В.Л. Ватерсу удалось показать, что гены устойчивости к антибиотикам, находящиеся в составе конъюгатив-ной плазмиды Е. соН, переносятся с низкой частотой в клетки яичников китайских хомячков СНО К1 из бактериальных клеток, давая возможность клеткам-реципиентам выживать на селективной среде в присутствии соответствующих антибиотиков. При этом не происходило поглощения бактериальных клеток клетками животных посредством эндоцитоза, и перенос имел место в присутствии ДНКазы в питательной среде, что исключало непосредственный захват ДНК клетками из культуральной жидкости. Чужеродная ДНК реплицировалась в клетках животных, а экспрессия генов генетических маркеров происходила лишь в том случае, если гены находились под контролем эукариотических промоторов. Хотя конъюгативный перенос генов бактерий в клетки дрожжей, а также растений (Ti-плазмиды) известен давно, обсуждаемая работа впервые продемонстрировала возможность непосредственного обмена генами между бактериями и клетками высших животных. В том случае, если данный процесс удастся оптимизировать, у генной инженерии появится дополнительная возможность введения очень больших молекул ДНК в клетки животных, в том числе и в целях генотерапии. [c.154]
chem21.info
Трансгенные растения и животные как биореакторы
Задачей селекционеров во все времена было получение хозяйственно ценных растений, животных, микроорганизмов. Основными методами традиционной селекции являются отбор, гибридизация, мутагенез, полиплоидия с целью получения нужного признака, который кодируется новым геном или новым комплексом генов.Существенное продвижение в понимании того, как функционируют гены, расшифровка геномов и развитие методологии генной инженерии позволили перейти от длительных и трудоемких методов традиционной селекции к прямому генетическому конструированию нужных признаков у конкретного организма. При создании трансгенного организма новый генный комплекс конструируется в пробирке и напрямую вводится в организм, фактически таким методом получения нового признака ученые просто ускоряют эволюцию.
Новые методы селекции - это сочетание молекулярных и традиционных методов. Необходимо отметить, что старые методы также остаются широко востребованными при создании новых организмов. Выяснилось, что трансформированные с идентичной конструкцией ДНК трансгенные клоны, полученные параллельно в одном и том же опыте, значительно различаются по уровню экспрессии введенного гена, поскольку работает эффект положения и копийности гена.
И необходимо проводить дальнейший отбор с анализом наследования полученного признака, используя традиционные методы селекции. Генно-инженерные манипуляции с геномом, сформировавшимся в процессе длительной эволюции, могут нарушать, в какой-то степени, сбалансированные генные комплексы и, соответственно, жизнеспособность полученных трансгенных организмов.
Например, встраивание селективного гена, нужного только для отбора трансгенных растений, может нарушить первичную структуру какого-либо хозяйского гена и тем самым вызвать его инактивацию. Это событие, по-видимому, не так редко, особенно с учетом того, что трансгены чаще встраиваются в транскрибируемые области хроматина (эухроматин). В последующих поколениях такой инактивированный ген может перейти в гомозиготное состояние, выражаясь в непредусмотренной и обычно нежелательной фенотипической мутации.
Появляется необходимость дальнейшего скрещивания и отбора для удаления нежелательных побочных мутаций у трансгенов. Иногда имеется необходимость удаления маркерных генов вообще, так что для получения новых организмов применяется сочетание старых и новых методов селекции.
В настоящее время практическая генно-инженерная биотехнология развивается по двум основным направлениям.
Первое направление, получившее не очень удачное название «молекулярное разведение (или селекция)» (molecular breeding), специализируется на решении новыми методами традиционных селекционно-генетических проблем повышения продуктивности хозяйственно ценных организмов и их защиты от различных биотических и абиотических стрессовых факторов. Второе направление, названное «молекулярным производством»» (molecular farming), специализируется на получении и использовании трансгенных организмов в качестве биореакторов, продуцирующих ценные для промышленности и медицины органические соединения.
Конструирование трансгенных растений
Возможность получения трансгенных растений основана на тотипотентности их некоторых клеток, т.е. способности в определенных условиях под действием фитогормонов дифференцироваться с образованием полноценного растения. Таким образом, из сконструированных генно-инженерными методами отдельных клеток можно получить фертильные растения, все клетки которых несут чужеродный генный комплекс (трансгенные растения).Если такое растение цветет и дает жизнеспособные семена, то желаемый признак передается последующим поколениям. Кроме того, многие растения легко размножаются вегетативно. Существующими приемами микроклонального размножения in vitro из микроскопических кусочков ткани (эксплантов) можно быстро получить за короткий промежуток времени генетически однородный посадочный материал с высоким коэффициентом размножения, что важно для последующего применения трансгенного организма.
Для создания трансгенного растения необходимо трансформировать культивируемые клетки, их протопласты или клетки в составе органов, отделить от нетрансформированных клеток и получить из отдельных клеток целые трансгенные растения (рис. 2.12). К настоящему времени для трансформации растений разработано несколько эффективных систем переноса рекомбинантной ДНК в клетки и экспрессирующих векторов, которые работают в ряде растительных клеток. Векторы на основе Ti-плазмид.
Рис. 2.12. Схема получения трансгенного растения трансформацией эксплантов (кусочки органа растения, например фрагменты тканей семядоли) Бактерии рода Agrobacterium иногда называют природными генными инженерами за их способность переносить свою плазмидную ДНК в клетки зараженных растений, интегрировать ее в геном организма-хозяина и вызывать стабильную трансформацию этих клеток введенными генами. Все они приводят к образованию у двудольных растений корончатых галлов - трансформация индуцирует образование опухолей, похожих на раковые. Инфекционным агентом является так называемая Ti-плазмида (tumor-inducing plasmid) в 200-250 тнп (рис. 2.13), которая содержит все гены, необходимые для инфекционного процесса.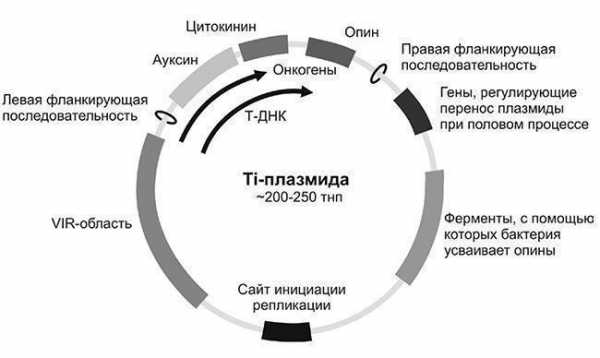 Рис. 2.13. Схема Ti-плазмиды. Указаны основные гены и их группы. Сайт инициации репликации (ori) обеспечивает удвоение плазмиды при делении клетки Agrobacterium. Колечками обозначены левая и правая фланкирующие
последовательности Т-ДНК После присоединения Agrobacterium, несущей Ti-плазмиду, к растительной клетке, часть плазмиды, индуцирующей развитие опухоли (Т-ДНК (transferred DNA), 12-24 тнп в зависимости от штамма), транспортируется в клетку, по-видимому, с помощью механизма, аналогичного конъюгации. При этом Т-ДНК транспортируется в одноцепочечной форме, и именно в такой форме она встраивается в хромосомную ДНК растения. С переносимой Т-ДНК остаются связанными два кодируемых Ti-плазмидой белка, способствующие ее вырезанию, и третий белок покрывает оболочкой переносимую одноцепочечную ДНК, предохраняя от деградации.
Рис. 2.13. Схема Ti-плазмиды. Указаны основные гены и их группы. Сайт инициации репликации (ori) обеспечивает удвоение плазмиды при делении клетки Agrobacterium. Колечками обозначены левая и правая фланкирующие
последовательности Т-ДНК После присоединения Agrobacterium, несущей Ti-плазмиду, к растительной клетке, часть плазмиды, индуцирующей развитие опухоли (Т-ДНК (transferred DNA), 12-24 тнп в зависимости от штамма), транспортируется в клетку, по-видимому, с помощью механизма, аналогичного конъюгации. При этом Т-ДНК транспортируется в одноцепочечной форме, и именно в такой форме она встраивается в хромосомную ДНК растения. С переносимой Т-ДНК остаются связанными два кодируемых Ti-плазмидой белка, способствующие ее вырезанию, и третий белок покрывает оболочкой переносимую одноцепочечную ДНК, предохраняя от деградации. Все белки содержат сигнал ядерной локализации (NLS), который обеспечивает перенос Т-комплекса из цитоплазмы в ядро растительной клетки. Введенные гены Agrobacterium активируются в растении, программируя разрастание ткани (формируется галл), которая начинает синтезировать и секретировать опины. Опины - продукты конденсации амино- и кетокислот или аминокислот и сахаров Agrobacterium -используют как источник углерода и азота, причем другие исследованные почвенные микроорганизмы не способны использовать данные соединения. Таким образом, Agrobacterium генетически трансформирует растительные клетки в «биологические фабрики» по производству для себя «продуктов питания».
Введение генов непосредственно с помощью Ti-плазмид не используется, поскольку приводит к образованию опухолевых клеток, из которых невозможно получить целое растение. Для этих целей применяют небольшие векторные молекулы на основе Ti-плазмид с удаленными онкогенами из переносимой Т-области, которая ограничена 24-нуклеотидными повторами.
Вместо онкогенов встраивают последовательности клонируемой чужеродной ДНК и селективный маркер. Наличие сайта инициации репликации E. coli в составе Ti-вектора позволяет проводить в кишечной палочке все стадии сборки генетической конструкции. В качестве селективного маркера используют гены устойчивости к антибиотикам или гербицидам, которые дают возможность отбирать трансформированные клетки растений. После введения целевой ДНК рекомбинантным Ti-вектором трансформируют клетки агробактерий, несущих модифицированную Ti-плазмиду-помощницу с удаленной Т-областью, но содержащую все необходимое для переноса в растительные клетки T-ДНК части с рекомбинантной плазмиды. Такие вектора получили название бинарных, поскольку только вместе с плазмидой-помощницей они составляют пару из двух элементов для полноценного функционирования системы переноса генов в растительную клетку с помощью агробактерий.
Генетически модифицированные растения получают простой инкубацией любых частей растения с суспензией рекомбинантных агробактерий. Во всех случаях достигается высокоэффективный перенос рекомбинантной ДНК в геном трансформируемых клеток. Интеграция рекомбинантной ДНК происходит случайным образом с небольшим предпочтением участков активно транскрибируемых генов (эухроматин).
Для внедрения больших фрагментов ДНК в клетки растений путем введения фланкирующих Т-область последовательностей из Ti-плазмиды в состав векторов для клонирования больших фрагментов ДНК получены соответствующие космидные векторы, а также векторы на основе искусственных бактериальных хромосом (ВАС), получившие название TAC (transformation-competent bacterial artificial chromosomes). ТАС-векторы могут быть реплицированы как в клетках Е. coli, так и агробактерий, что позволяет с помощью рекомбинантных агробактерий вводить в клетки растений фрагменты ДНК длиной более 150 тнп.
Другие векторы для конструирования трансгенных растений c прямым введением чужеродных генов в виде очищенной ДНК в растительные клетки также разработаны, поскольку эффективные системы переноса генов в растительный геном с помощью агробактерий работают не для всех видов растений. Эти векторы в основном предназначены для сборки эффективной экспрессионной генной конструкции в E. coli с последующим введением в растительную в клетку очищенной ДНК. Наиболее известные способы доставки рекомбинантной ДНК в растительные клетки приведены в табл. 2.1.
Таблица 2.1.Методы введения рекомбинантной ДНК в растительные клетки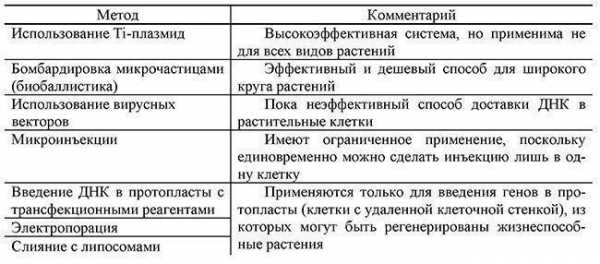 Растительные векторы отличаются главным образом различными сигнальными и регуляторными последовательностями, которые обеспечивают эффективную транскрипцию генов в растительных тканях, и различными селективными маркерами. Наиболее важными из регуляторных последовательностей являются проксимальный участок промотора, связывающий РНК-полимеразу; участок, кодирующий 5'-конец мРНК, необходимый для связывания с рибосомой и инициации трансляции, и эукариотический сигнал полиаденилирования на З'-конце мРНК.
Растительные векторы отличаются главным образом различными сигнальными и регуляторными последовательностями, которые обеспечивают эффективную транскрипцию генов в растительных тканях, и различными селективными маркерами. Наиболее важными из регуляторных последовательностей являются проксимальный участок промотора, связывающий РНК-полимеразу; участок, кодирующий 5'-конец мРНК, необходимый для связывания с рибосомой и инициации трансляции, и эукариотический сигнал полиаденилирования на З'-конце мРНК. Среди эукариотических организмов эти конститутивные сигнальные элементы оказались, к счастью, высококонсервативными и достаточно универсальными, так что растительные клетки в основном правильно экспрессируют чужеродные гены не только растений других видов, но и млекопитающих, дрожжей и других эукариот.
Но для обеспечения достаточного уровня работы чужеродного гена необходимы сильные регуляторные и сигнальные элементы экспрессии, в которых ключевыми являются промоторы, хорошо работающие именно в клетке-мишени. Как и в других системах, для конструирования растительных векторов популярны элементы экспрессионной системы вирусов.
В настоящее время одним из наиболее широко используемых промоторов для двудольных является сильный конститутивный 35S-промотор, выделенный из вируса мозаики цветной капусты (ВМЦК, CaMV) из группы каулимовирусов. Также для двудольных широко используется nos-промотор гена нопалин-синтазы агробактерий, хотя он намного слабее 35S; для однодольных - промоторы гена алкогольдегидрогеназы кукурузы (Adh) и гена актина 1 риса (Act).
Во многих векторах для трансформации растений как селективный, так и целевой гены находятся под контролем все того же классического 35Б-промотора. Наличие рядом двух копий 35S-промотора может отрицательно сказываться на уровне экспрессии, поскольку множественные копии этого вирусного промотора в геноме могут быть одной из причин «замолкания» трансгена (явление сайлесинга (gene silencing) в ряду поколений). В этой связи в настоящее время ведется как поиск новых, более эффективных промоторов, так и создание их химерных форм.
Особенно нужны эффективные тканеспецифичные и индуцибельные промоторы для тканеспецифичной и/или индуцированной экспрессии трансгена. Экспрессия под сильными конститутивными промоторами, с одной стороны, приводит к большому количеству целевого белка, с другой - к синтезу этого белка во всех тканях растения, что может отрицательно сказаться на жизнеспособности и стабильности трансгенного растения и часто нежелательно для исследователей.
Векторы для трансформации хлоропластов высших растений (транспластомные векторы) относятся к интегративным векторам. Хлоропласты содержат полноценную генетическую систему, сходную с прокариотическими, т.е. все компоненты, необходимые для экспрессии генетической информации, включая белоксинтезирующий аппарат. Геном хлоропластов (пластом) размером 130-160 тнп заключает в себе более 100 различных генов. Векторы для трансформации хлоропластов предназначены для интеграции чужеродной ДНК в пластом с помощью гомологичной рекомбинации.
Представляют собой кольцевые молекулы ДНК, содержащие кроме обычного векторного набора два участка длиной по 1 -2 тнп, гомологичные последовательностям ДНК хлоропластов, в которую и происходит встраивание. Экспрессионная кассета между этими гомологичными последовательностями состоит из 5'-некодирующей области с промотором, регулирующим транскрипцию (иногда включает последовательность лидерного пептида перед множественным клонирующим сайтом для целевой ДНК) и 3'-некодирующей регулятор-ной области с терминатором транскрипции, стабилизирующей структуру мРНК, что является одним из условий достижения высокого уровня экспрессии трансгена в хлоропластах.
Для получения эффективной транскрипции клонированного гена часто используют сильный Prrn-промотор оперона рибосомальных рРНК (rrn). В зависимости от размера хлопластной ДНК растения данная векторная система позволяет вводить в геном хлоропластов фрагменты ДНК длиной до 50 тнп, содержащие до 20-30 генов. В геноме хлоропластов описано, по крайней мере, около 20 сайтов, по которым удалось получить продуктивную интеграцию вектора.
Получение транспластомных растений, содержащих генетически измененные хлоропласты, является одним из перспективных направлений, поскольку хлоропласты не переносятся с пыльцой, а значит, устраняется опасность распространения трансгенов с пыльцой среди перекрестно опыляемых растений близких видов. Кроме того, сама пыльца трансгенных растений менее токсична для насекомых, которые не являются мишенью ее токсического воздействия у растений, синтезирующих инсектициды.
Для генома хлоропластов характерен высокий уровень полиплоидии -10-100 копий на хлоропласт. Учитывая большое число самих хлоропластов на клетку, каждая отдельная клетка с трансформированными хлоропластами содержит тысячи копий трансгена, что позволяет получать очень высокий уровень экспрессии соответствующих рекомбинантных белков (до 25 % от суммарного растворимого клеточного белка).
Транзиентная «временная» экспрессия в растениях - это еще один путь для синтеза чужеродных целевых белков. Преимущество транзиентной экспрессии заключается в том, что этот метод не приводит к возникновению трансгенного растения с его экологическими и другими ограничения для ГМО. Чаще всего для этого используются векторы на основе различных фитовирусов, например, вируса табачной мозаики (ВТМ), вируса мозаики коровьего гороха (ВМКГ).
Заражение растительных тканей производят рекомбинантными вирусами, несущими в своем составе гены целевых белков. Скорость мультипликации вирусной РНК в растениях чрезвычайно высока, за счет чего достигается высокая копийность транскриптов чужеродных генов в цитоплазме зараженных клеток. Поэтому продуктивность вирусной системы экспрессии в среднем на 2 порядка выше по сравнению со стабильной трансформацией растений. Иногда такую технологию применяют для масштабного коммерческого производства.
Для транзиентной продукции в растениях также используют векторы Ti-системы. При инфицировании целого растения или его части (листья) рекомбинантной Agrobacterium, содержащей целевой ген в составе бинарного вектора, уровень продукции чужеродного белка может достигать 10-30 % от общего растворимого белка растения в короткое время (5-10 дней). Такой способ также используется, когда требуется проверить сконструированную экспрессионную кассету перед получением стабильных трансформантов или разово наработать небольшое количество (порядка миллиграмма) рекомбинантного белка, например, для оценки его качества или доклинических испытаний.
Н.А. Воинов, Т.Г. Волова
medbe.ru
Трансгенные растения, используемые в сельском хозяйстве
Количество просмотров публикации Трансгенные растения, используемые в сельском хозяйстве - 99
Наследование трансгенов у трансгенных растений
В терминах классической генетики проявление перенесенного гена у трансгенных растений соответствует доминантной мутации при полном доминировании, а его наследование в ряду поколений подчиняется классическим законам Менделя. Придерживаясь общепринятых обозначений, генотип трансгенного растения с одной вставке Т-ДНК на геном должна быть записан как +/-, где ʼʼ+ʼʼ обозначает наличие вставки чужеродного гена и ʼʼ-ʼʼ — ее отсутствие в соответствующем локусе гомологичной пары хромосом. Соответственно, при встраивании маркерного гена nptII в составе одной Т-ДНК вставки на ядерный геном генотип исходного трансформанта можно записать как npt+/npt-. При самоопылении такого трансформанта перенесенный ген nptII будет комбинировать в составе гамет и среди потомков будут выявляться три генотипических класса в соотношении: 1npt+/npt+: 2npt+/npt-: 1 npt-/npt-.
Антибиотик канамицин в растительной клетке нарушает процесс фотосинтеза и вызывает гибель растений. Перенос бактериального гена, кодирующего неомицинфосфотрансферазу II, обеспечивает устойчивость трансформантов к этому антибиотику, благодаря его инактивации. Проведение теста на устойчивость трансгенных растений к канамицину позволяет отобрать трансгенные растения из множества регенерантов. В случае если в геном растения встроилась одна копия переносимого гена, то в потомстве соотношение трансгенных и нетрансгенных растений будет 3:1, в случае если две копии – 15:1. При этом следует учитывать, что в результате перестроек растительной ДНК, часть введенных генов может потеряться или модифицироваться.
Перенесенные в геном трансгенного растения гены проявляют разный уровень экспрессии, зависящий от числа вставок, интегрированных в одно место генома, от места встраивания трансгена и окружающих его собственных генов растения. Трансгены, организованные в виде кластеров нескольких тесно сцепленных Т-ДНК фрагментов, не только проявляют низкий уровень экспрессии, но и снижают уровень экспрессии других гомологичных генов при взаимодействии в геноме гибридного растения.
При создании трансгенных растений в коммерческих целях проблема вариабельности по экспрессии перенесенных генов преодолевается получением большого числа независимых трансформантов. Полученные растения оцениваются индивидуально и отбираются генотипы с высокой (требуемой) экспрессией перенесенных генов.
За последние годы кроме маркерных генов изолированы, клонированы и перенесены в геномы растений чужеродные гены, определяющие устойчивость к гербицидам, насекомым-вредителям, вирусам, а также гены, ответственные за синтез запасных белков. Большинство чужеродных генов в клетках растения экспрессируется нормально, стабильно наследуется и не влияет негативно на фенотип растения-хозяина и его потомства.
Первые трансгенные продукты появились в продаже в США в 1994 ᴦ., после прохождения всех необходимых тестов на токсичность, аллергенность, мутагенность и
т.д. Это были томаты Flavr Savr с замедленным созреванием, созданные фирмой ʼʼCalgenʼʼ, а также гербицидустойчивая соя компании ʼʼMonsantoʼʼ. Уже через 2 года биотехнологические фирмы поставили на рынок целый ряд генетически измененных растений: томатов, кукурузы, картофеля, табака, сои, рапса, кабачков, редиса,
хлопчатника. Наиболее остро стоит вопрос о получении растений, устойчивых к вредителям сельского хозяйства. Традиционно для этого используют ген bt, продуктом которого является бактериальный токсин Bacillus thuringiensis. Эта тюрингская бактерия продуцирует крупный белок (протоксин), контролируемый геном bt, который,
попадая в кишечник личинок насекомых, разрушается под действием ферментов, а его фрагмент (эндотоксин) приводит к их гибели. Сегодня уже синтезирован искусственный ген bt, конструкция с которым более эффективна, а сами трансгенные растения обладают широким спектром устойчивости к насекомым. Трансгенные
растения картофеля, хлопка, кукурузы с геном bt уже производятся фирмами ʼʼMonsantoʼʼ, ʼʼCiba Seedsʼʼ и продаются на рынках мира, хотя дискуссии о безопасности их использовании еще не закончены.
Получение гербицидустойчивых культурных растений позволяет удешевить их производство. По новой технологии обработку полей неселективными гербицидами можно проводить весь сезон, что улучшает результаты их применения. Но это направление генной инженерии таит ряд экологических опасностей: накопление гербицидов (или продуктов их детоксикации) в сельскохозяйственных продуктах; возможность переноса генов устойчивости к гербицидам из культивируемых растений в сорняки.
Трансгенные растения как биофабрики для производства белков медицинского назначения.
Получение рекомбинантных белков для терапевтических целей — одно из наиболее приоритетных направлений современной биотехнологии. Традиционно для этих целей используются системы экспрессии рекомбинантных белков в E.coli, дрожжах и клетках млекопитающих. Успехи в области генетической инженерии и расшифровка последовательностей растительных геномов открыли новые возможности в использовании растений для получения рекомбинантных белков терапевтического назначения.
Растения для производства рекомбинантных белков для фармакологии имеют ряд преимуществ: экономичность, возможность широкомасштабного производства при сохранении умеренной стоимости продукта͵ способность синтезировать многие сложные белки человека и животных в правильно-свернутой и модифициро-ванной форме, отсутствие проблем, связанных с безопасностью заражения вирусами животных. В ряде случаев нет крайне важно сти в очистке продуцируемого рекомбинантного полипептида, т.к. белки, накапливаемые в традиционно используемых в питании растений (морковь, салат, капуста и др.), могут вводиться в организм теплокровных и человека перорально в составе растительных тканей. Так как слизистая оболочка желудочно-кишечного тракта функционирует как часть иммунной системы организма, а функцию защитной капсулы, ограждающей белок от разрушительного действия желудочных ферментов, может выполнять клеточная стенка трансгенных растений, то такие растения бывают использованы в качестве так называемых ʼʼсъедобныхʼʼ вакцин. Растительные клетки так же можно использовать для доставки терапевтических белков, оказывающих прямое регуляторное воздействие на клетки иммунной системы желудочно-кишечного тракта.
referatwork.ru
особенности наследования чужеродных генов у трансгенных животных - Блоги
особенности наследования чужеродных генов у трансгенных животных`Фенотипический эффект экспрессии рекомбинантных генов в… * Особенности трансгенеза сельскохозяйственной птицы. 1.3.1.… И если влияние чужеродных генов на организм трансгенных животных достаточно полно изучено на… Изучить наследование трансгенов в ряде поколений свиней, … особенности межгенерационной передачи бычьей сателлитной… * Так, при наследовании чужеродной сателлитной. ДНК от дедушки… лагается негативное влияние Sat на экспрессию данных генов. К л ю ч е в ы е с л о в а:… вий интеграции являются трансгенные животные. За поr следние годы … Изучение экспрессии гетерологичных и собственных генов у… * Наследование гена nptll у трансгенных растений линий Т0и То-6.… из разных гетерологических систем: вирусов, бактерий, насекомых, животных и человека.… чужеродных генов в геноме трансгенных растений // Особенности … Реферат Биология Причуды генетики * Наследование при моногибридном скрещивании и закон расщепления, 8… Важная особенность эукариотических генов – их прерывистость.… В результате возникла возможность получения трансгенных животных,… Во- первых, возникли широкие возможности для изучения работы чужеродного гена в … Биотех.: Создание разных видов трансгенных животных * 6 фев 2013… Рост животного является сложным процессом, который зависит от… по получению трансгенных животных с чужеродными генами, которые… Эндогенные вирусные белки, в особенности их мутационные формы, … Генетическая инженерия — Щелкунов С.Н. — Учебно-справочное… * 21 окт 2010… Особенности строения и экспрессии генов грамположительных… Биотехнологическое применение трансгенных животных… Экспрессия и наследование чужеродных генов, введенных в растения в составе Т-ДНКСальникова Н.А. Введение в биотехнологию * Каковы методы выявления интеграции чужеродного гена в молекулу ДНК? Особенности его наследования у трансгенных животных. 10.лечение генами — фантастика или реальность? — фаворова о.о. * Животные, несущие чужеродный ген, получили название трансгенных.… Используют ретровирусные (их особенности будут пояснены позже) и ...28 выпуск новостей генетики * У животных чужеродные гены переносят в яйцеклетки, зиготы… сотни трансгенных растений, имеющих несвойственные им особенности за счет … Генетическая инженерия * В новое издание введены главы, посвященные трансгенным животным и… Векторы, обеспечивающие экспрессию чужеродных генов в клетках Е. coli 2.2 .10.… Особенности строения и экспрессии генов грамположительных бактерий… Экспрессия и наследование чужеродных генов, введенных в растения в … Психогенетика. Тема 8. Методы, использующие молекулярно… * Длительное время понятие «геном» определяли как совокупность генов в гаплоидном… особенности наследования генов, относящихся к одной хромосоме.… Генетические карты животных и растений, для которых возможны… внедрения в геном чужеродного гена (трансгенные мыши) и выключения … Биология → Генетическая инженерия — Щелкунов С.Н. — Биология… * 27 янв 2013… Векторы, обеспечивающие экспрессию чужеродных генов в клетках Е. coli… Особенности строения и экспрессии генов грамположительных бактерий… Биотехнологическое применение трансгенных животных… Экспрессия и наследование чужеродных генов, введенных в растения в … Дейнеко Елена Викторовна * Особенности организации Т-ДНК-встройки у трансгенных растений табака … экспрессии и наследование чужеродных генов у трансгенных растений… при пероральной доставке рекомбинантных белков в организм животныхЭтические проблемы современных генетических технологий… * 1 авг 2010… В ходе научных разработок и применения генных технологий… технологий; проблемы трансгенных растений и животных.… т.е. предотвратить наследование генетических особенностей… Достаточно хорошо отработаны методы переноса чужеродных генов для домашних животных.Генная инженерия * Изолирование генов растений и особенности их транскрипции.… Наследование чужеродных генов у трансгенных растений.… генофонда диких растений, животных и микроорганизмов при выращивании ГМ- растений.Скачать * Получение и изучение трансгенных перепелов с геном гормона… Получение трансгенных перепелов, экспрессия и наследование гена… свои особенности во взаимодействии ядерного и митохондриального геномов… на практике является использование трансгенных животных в качестве «фаб — рик» по … Генетика — Энциклопедия — Фонд знаний «Ломоносов» * 11 фев 2011… Доказал, что наследственные факторы ( гены), объединяясь в зиготе,… и в дигибридном скрещивании — независимое наследование и… Генная инженерия, трансгенные растения и животные, стволовые… ДНК in vitro, введения чужеродных клонированных генов в клетки и их экспрессия.Генетика и биометри * Наследование признаков при взаимодействии неаллельных генов: комплементарное, эпистатическое,… Особенности эритроцитарных антигенов животных и методы их определения.… Принципиальная схема введения чужеродного гена в организм животных.… Получение трансгенных животных. 15.Геном рекомбинантные — Справочник химика 21 * В последнем случае геном рекомбинантного ретровирусного вектора… со встроенными чужеродными генами часто называют гибридными (шти… были протестированы на наследование близлежащих перенесенных маркеров.… Благодаря переносу генов у трансгенных животных возникают новые … Генетическая инженерия — Википедия * Примерами применения генной инженерии являются получение новых… Жители Кении наблюдают, как растёт новый трансгенный сорт кукурузы,… очень важные для жизнедеятельности животных и человека, ряд ферментов , пептидные… Учёные исследовали особенности внедрения чужеродной ДНК и ...
aeterna.qip.ru
19.4. ЭКСПРЕССИЯ И НАСЛЕДОВАНИЕ ЧУЖЕРОДНЫХ ГЕНОВ, ВВЕДЕННЫХ В РАСТЕНИЯ В СОСТАВЕ Т-ДНК : Генетическая инженерия : Юридическая библиотека
В экспериментах по экспрессии трансгенов в растениях первоначально использовали хорошо охарактеризованные конститутивные промоторы ДНК-содержащего вируса мозаики цветной капусты, обеспечивающие транскрипцию молекул 35S и 19S РНК, или промоторы опиновых синтетаз. С развитием исследований стали использовать также регулируемые ткане- специфичные промоторы, например, клубне- специфичный промотор гена пататина картофеля или промотор гена ES, индуцируемый при созревании плодов томатов.
Агробактериальная трансформация растений приводит к интеграции Т-ДНК или гибри
дов на ее основе в различные участки разных хромосом. Каждое трансгенное растение индивидуально по месту встройки и числу встроенных копий Т-ДНК. Некоторые особи могут содержать единичную встройку гибридной Т-ДНК, в то время как другие — низкокопийные тандемные повторы Т-ДНК. Уровень экспрессии трансгена может значительно варьировать у разных трансгенных растений, полученных в одном эксперименте, при этом он часто не коррелирует с копийностью, а зависит от положения трансгена в растительном геноме (близость или удаленность от сильных промоторов, усилителей или глушителей транскрипции и т. п.).
При изучении трансгенных растений обнаружили эффект сайленсинга (от англ. silencing — замолкание) трансгена в последующих поколениях, т. е. у ряда индивидуальных трансгенных растений может происходить снижение уровня или полное прекращение синтеза целевого белка, кодируемого встроенным трансгеном. Механизмы замолкания гена могут быть разными. Например, встройка двойной копии трансгена в ориентации «голова к голове» (инвертированный повтор) приведет к нестабильности конструкции и вьпцеплению трансгена. Это рекомбинационный сайленсинг. Метилирование промотора трансгена, обусловленное встройкой Т-ДНК в активно метилируемые районы генома растения, приведет к транскрипционному сайленсингу. Специфичное расщеп
ление мРНК, в которое вовлекаются низкомолекулярные двухцепочечные молекулы РНК, вызывает посттранскрипционный сайлесинг трансгена. Такой механизм наиболее часто встречается у трансгенных растений, полученных прямым переносом ДНК, так как в этом случае интегрируется большое число трансгенов и образуются множественные повторы.
Учитывая возможность замолкания трансгена, в каждом эксперименте необходимо получать как можно больше трансгенных растений и тестировать уровень экспрессии встроенного гена. При этом по сравнению с исходными трансформантами (поколение ТО) более надежные результаты будут получены при анализе растений следующих поколений (Т1 или Т2), выросших на селективной среде из семян.
bookzie.com











