Исследовательская работа "Природные индикаторы". Природные индикаторы из растений
III Международный конкурс научно-исследовательских и творческих работ учащихся Старт в науке
ПОЛУЧЕНИЕ ПРИРОДНЫХ ИНДИКАТОРОВ ИЗ РАСТИТЕЛЬНЫХ ОБЪЕКТОВ ДЛЯ ОПРЕДЕЛЕНИЯ РЕАКЦИИ СРЕДЫ ПРИ ИСПОЛЬЗОВАНИИ ПРЕПАРАТОВ БЫТОВОЙ ХИМИИ
Филиппова Любовь Сергеевна 11МБОУ СШ №16 г. Павлово
Краснова Наталья Юрьевна 11МБОУ СШ №16 г. Павлово
Текст работы размещён без изображений и формул.Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Введение
Впервые с химическими веществами я познакомилась в 8 классе, когда начала изучать курс химии.
Меня поразило многообразие веществ в современном мире. Я задалась во- просом, как же можно ориентироваться в этом огромном и сложном мире веществ? Как можно различать вещества, ведь некоторые из них визуально идентичны? На уроках химии я поняла, как важно в современном мире овладеть экологической и химической грамотностью.
Наведение чистоты в современном доме невозможно без использования различных средств бытовой химии. Например, мытьё посуды мы не представляем себе без использовании синтетических моющих средств. Но многие из нас не догадываются, что буквально все широко разрекламированные «волшебные» чистящие средства имеют те или иные химические соединения, использование которых сопряжено с определённым риском для нашего здоровья. Производители утверждают, что средства для мытья посуды имеют нейтральную среду и тем самым не оказывают отрицательного влияния на кожу рук. А так ли это на самом деле? В своей работе я хотела бы представить результаты своих исследований по изучению кислотности среды моющих средств для посуды. Поэтому выбранная мной тема актуальна и имеет практическую значимость, так как она позволит развеять миф о том, что не все средства для мытья посуды хороши.
Гипотезаисследования:Не все средства для мытья посуды безвредны для кожи рук.
Целью моей исследовательской работы является: получение природных индикаторов из растительных объектов для определения реакции среды препаратов бытовой химии. Для достижения поставленной цели мне предстоит решить ряд задач.
Задачи:
-
Изучить и проанализировать литературу и другие источники информации по теме «Индикаторы».
-
Провести эксперимент по выделению природных индикаторов из различных видов растений и изучить их свойства.
-
Определить кислотность среды препаратов бытовой химии.
-
Проанализировать и обработать результаты эксперимента.
-
Сделать выводы по проделанной работе.
-
Оформить и представить результаты исследования.
Объектом данного исследованияявляются –природное растительное сырье: корнеплоды свеклы, листья краснокочанной капусты, моющие средства, а предметом изучения: цвет отваров растительного сырья в растворах с различной средой, а также среда моющих средств.
Для выполнения своей работы я применяла методытеоретического и экспериментального исследования.
Методология моегоисследования– описание изменения цвета отваров растительного сырья в испытуемых моющих средствах.
Практическаязначимостьработы:полученные результаты дают возможность в домашних условиях приготовить доступные индикаторы и с их использованием определить среду растворов моющих средств.
Глава I. Индикаторы
-
-
. Этимологияслова«индикатор»
-
Нетрудно представить себе, что мы живём в мире индикаторов. Именно индикаторы помогают нам ориентироваться в современном мире, защищают нас, подсказывают нам. Не верите – судите сами.
ИНДИКАТОР- (от позднелатинского indicator - указатель), прибор (уст- ройство), отображающий ход какого-либо процесса, полученные результа- ты, состояние объекта наблюдения и тому подобную информацию в про- стой и доступной человеку форме. Примеры индикатора: сигнальная лампа, звонок, стрелочный или цифровой прибор, табло, сигнальная лампочка на панели телевизора или магнитофона, светофор. Все эти индикаторы указы- вают нам на что – либо: уровень громкости на световом табло магнитофо- на, безопасность движения на перекрёстке, подключение к электросети хо- лодильника и т.д. Наша жизнь без индикаторов будет сильно затруднена. А представить себе, например, кабину современного пилота без электрон- ных индикаторов, которые дают информацию о взаимодействии всех сложных механизмов авиалайнера, просто невозможно.
Вот как трактуют определение понятия «индикатор» различные словари:
СловарьиностранныхсловподредакциейИ.В.Лехинадаёт сле- дующее определение понятию «индикатор»:
1. Всякий прибор, служащий для какого-либо измерения напряжения аппарата для записи колебаний давления в цилиндрах поршневых машин, во время их работы вычерчивающий индикаторную диаграмму.
2. Вещество (реактив), указывающее конец химической реакции изменением цвета или образованием осадка.
В соответствии с ТолковымсловарёмрусскогоязыкаподредакциейС.И.Ожегова,Н.Ю.Шведовой
индикатор–
-
Прибор, (устройство, элемент), отражающий какой-нибудь процесс, состояние наблюдаемого объекта. Визуальный индикатор. Акустический индикатор.
-
Вещество, являющееся химическим реактивом.
В соответствии со словарёмхимическихтерминов–
Индикаторы- вещества, меняющие цвет в зависимости от кислотности среды.
-
-
. Индикаторы в химии
-
Индикаторы (от латинского indicator – указатель) – это сложные органические вещества, которые меняют цвет в зависимости от того, попали они в кислую, щелочную или нейтральную среду. Когда среда кислая, у раствора кислый вкус, и в нем избыток катионов водорода, когда щелочная – в растворе избыток гидроксид-анионов. Если в растворе катионов водорода и гидроксид-анионов поровну, то среда считается нейтральной. Больше всего распространены индикаторы: лакмус, фенолфталеин и метиловый оранжевый (метилоранж).
-
-
. История открытия индикаторов
-
Природные пигменты-красители человеку были известны давно, еще в Древнем Риме и Древнем Египте. Красители находили широкое применение при окраске тканей. Для нас же особый интерес представляют природные индикаторы, красители-пигменты, которые изменяют окраску в зависимости от среды раствора: кислой, щелочной, нейтральной.
История открытия вещества, о котором пойдёт речь, началась в XVII веке в лаборатории известного английского физика и химика Роберта Бойля (1627-1692). В лаборатории, как обычно, кипела напряжённая работа: горели свечи, в ретортах нагревались разнообразные вещества. В кабинет к Бойлю вошел садовник и поставил в углу корзину с великолепными тёмно-фиолетовыми фиалками. В это время Бойль собирался проводить опыт по получению серной кислоты. Восхищённый красотой и ароматом фиалок, учёный, захватив с собой букетик, направился в лабораторию. Его лаборант Уильям сообщил Бойлю, что вчера доставили две бутылки соляной кислоты из Амстердама. Бойлю захотелось взглянуть на эту кислоту, и, чтобы помочь Уильяму налить кислоту, он положил фиалки на стол. Затем он взял со стола букетик и отправился в кабинет. Здесь Бойль заметил, что фиалки слегка дымятся от попавших на них брызг кислоты. Чтобы промыть цветы, Бойль опустил их в стакан с водой. Через некоторое время он бросил взгляд на стакан с фиалками, и случилось чудо: тёмно-фиолетовые фиалки стали красными. Естественно, Бойль, как истинный учёный, не мог пройти мимо такого случая и начал исследования. Он обнаружил, что и другие кислоты окрашивают лепестки фиалок в красный цвет. Учёный подумал, что если приготовить из лепестков настой и добавить немного к исследуемому раствору, то можно будет узнать, кислый он или нет. Бойль начал готовить растворы из целебных трав, древесной коры, корней растений. Однако самым интересным оказался фиолетовый настой, полученный из лакмусового лишайника.
|
Лакмусовый лишайник Roccella fuciformis(Ангола, Мадагаскар) |
Лакмусовый лишайник Parmelia sulcatf (Англия) |
Кислоты изменили его цвет на красный, а щёлочи – на синий. Бойль распорядился пропитать этим настоем бумагу и затем высушить её. Так была создана первая лакмусовая бумажка, которая теперь имеется в любой химической лаборатории. Клочок такой бумажки, погружённый в испытуемый раствор, изменяет цвет и показывает, кислый это раствор или щелочной. Таким образом, было открыто одно из первых веществ, которые Бойль уже тогда назвал индикаторами. Индикаторы помогли Р. Бойлю открыть новую кислоту. Сжигая фосфор и растворяя образовавшийся белый продукт в воде, он получил неизвестную химикам кислоту. По исходному веществу он назвал ее фосфорной.
4Р +5О2 = Р2О5
Р2О5 + 3Н2О = 2Н3РО4
В 1640 г. ботаники описали гелиотроп – душистое растение с темно-лиловыми цветками, из которого было выделено красящее вещество.
Этот краситель наряду с соком фиалок стали широко применять химики в качестве индикатора. Вот что писал Р.Бойль о гелиотропе – растении с душистыми темно-лиловыми цветами: «Плоды этого растения дают сок, который при нанесении на бумагу или материю имеют сначала свежий ярко-зеленый цвет, но неожиданно изменяет его на пурпурный. Если материал замочить в воде и отжать, вода окрашивается в винный цвет, такие виды красителя (их обычно называют «турнесоль») есть у аптекарей, в бакалейных лавках и в других местах, которые служат для окраски желе, или иных веществ, кто как хочет».
Фенолфталеин – кислотно-основный индикатор.
Фенолфталеин – бесцветное кристаллическое органическое вещество сложного строения. Фенолфталеин плохо растворим в воде и хорошо в этиловом спирте. Он может служить кислотно-основным индикатором: его раствор, бесцветный в нейтральной и кислотной среде, в щелочной среде становится малиновым. Фенолфталеин – это не только индикатор, но и лекарственное средство (сильное слабительное – пурген) и поэтому продаётся в аптеке. Синтез фенолфталеина впервые осуществил в 1871 году немецкий химик Адольф фон Байер, будущий лауреат Нобелевской премии.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины XIX века. С некоторыми из них можно познакомиться в школьной химической лаборатории. Индикатор- метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной – оранжевый, а в щелочной – жёлтый.
В зависимости от кислотности среды изменяет свою окраску и краситель бриллиантовый зелёный (его спиртовой раствор используется как дезинфицирующее средство – «зелёнка»). Для того чтобы проверить это, надо приготовить разбавленный раствор бриллиантового зелёного: налить в пробирку несколько миллилитров воды и добавить в неё одну-две капли аптечного препарата. Раствор приобретает красивый зелёно-голубой цвет. В сильнокислой среде его окраска сменится жёлтой, а в сильнощелочной раствор обесцветится.
Многие красители, которыми красят материю, бумагу тоже являются индикаторами. Этим и объясняется появление на одежде и обложках тетрадей цветных пятен при попадании капель кислоты.
Если нет настоящих химических индикаторов, то для определения среды растворов можно успешно применять самодельные индикаторы из природного сырья. Природные индикаторы содержат окрашенные вещества, способные менять свой цвет в ответ на то или иное воздействие. И, попадая в кислую или щелочную среду, они наглядным образом сигнализируют об этом.
Глава II. Экспериментальная часть
Одним из важнейших этапов моего исследования является выбор сырья для приготовления индикаторов, с помощью которых я исследовала моющие средства.
Для получения природных индикаторов были использованы растительные объекты, выращенные моей семьей на даче:
- корнеплоды свеклы,
- листья краснокочанной капусты.
-
-
Приготовление природных индикаторов и изучение их свойств
-
Из растений были приготовлены отвары. Для этого было взято по 50 граммов мелко измельчённого растительного сырья, смешанного с небольшим количеством воды. Смесь нагревали на водяной бане в течение 10-20 минут до появления интенсивной окраски. Полученный отвар остужали, фильтровали, и в таком виде он был готов к дальнейшим исследованиям.
Фото 1. Природные индикаторы (отвар листьев краснокочанной капусты и корнеплодов свёклы)
Полученные фильтраты применяли для определения реакции среды в кислотных, нейтральных и щелочных растворах.
Окраска растительных индикаторов в различных средах
|
Сырье для приготовления индикаторов |
Естественный цвет индикатора (нейтральная среда) |
Цвет раствора |
|
|
в кислой среде |
в щелочной среде |
||
|
Листья краснокочанной капусты |
Фиолетовый |
Красный |
Тёмно-зелёный |
|
Корнеплоды свёклы |
Красный |
Бордовый |
Жёлто-чёрный |
Фото 2.
Цвет отвара краснокочанной капусты в кислой, нейтральной, щелочной среде.
Фото 3.
Цвет отвара корнеплодов свёклы в кислой, нейтральной, щелочной среде.
-
-
Определение реакции среды моющих средств
-
2.2.1. Определение реакции среды моющих средств отваром
из листьев краснокочанной капусты
С использованием в качестве природного индикатора полученного отвара краснокочанной капусты была определена реакция среды семи моющих средств.
|
Моющее средство |
Окраска индикатора |
Среда раствора |
|
«Frosh» |
Красный |
Кислотная |
|
«Миф» |
Фиолетовый |
Нейтральная |
|
«Fairy» |
Красноватый оттенок |
Кислотная |
|
«Биолан» |
Тёмно-зелёная |
Щелочная |
|
«AOS» |
Зелёный |
Щелочная |
|
«Каждый день» |
Фиолетовый |
Нейтральная |
|
«Econta» |
Зелёный |
Щелочная |
Фото 4.
Цвет индикатора отвара краснокочанной капусты в моющих средствах.
2.2.2. Определение реакции среды моющих средств отваром
из корнеплодов свёклы
С использованием в качестве природного индикатора полученного из корнеплодов свёклы была определена реакция среды семи моющих средств.
|
Моющее средство |
Окраска индикатора |
Среда раствора |
|
«Frosh» |
Тёмно-красный |
Кислотная |
|
«Миф» |
Красный |
Нейтральная |
|
«Fairy» |
Бардовый |
Кислотная |
|
«Биолан» |
Жёлто-чёрный |
Щелочная |
|
«AOS» |
Жёлто-чёрный |
Щелочная |
|
«Каждый день» |
Красный |
Нейтральная |
|
«Econta» |
Жёлтый |
Щелочная |
Фото 5.
Цвет индикатора отвара корнеплодов свёклы в моющих средствах.
Глава III. Заключение
В ходе проведенной работы, я провела эксперимент по выделению природных индикаторов из различных видов растений и изучила их свойства, определила кислотность среды препаратов бытовой химии.
Работа была очень увлекательной и интересной. Я узнала много нового об индикаторах и моющих средствах. Оказывается, использовать растительное сырье для получения индикаторов кислотности люди научились с древних времен. Самый известный индикатор – лакмус – изначально изготавливался из лишайников определенного вида. Английский ученый Р. Бойль в середине 17 века описывал в своих трудах приготовление индикатора из сока фиалок.
В химической лаборатории часто возникает необходимость узнать кислотность среды. Для этого используются синтетические индикаторы, с некоторыми из которых я познакомилась на уроках химии. Но с кислотными и щелочными растворами мы встречаемся не только в химии, но и в повседневной жизни. И тут может пригодиться умение готовить индикатор из растений самостоятельно. Результаты моей работы подтвердили гипотезу, что не все средства для мытья посуды безвредны для кожи рук. Полученной информацией я поделилась с одноклассниками, учителями и со своими близкими людьми для того, чтобы они правильно выбирали моющие средства.
Выводы
-
Проведённое исследование позволило сделать вывод о реакции среды растворов моющих средств: «Frosh», «Fairy» имеют кислотную среду; средство «Каждый день», «Миф» имеют нейтральную среду; «Биолан», «AOS», «Econta» имеют щелочную среду.
-
Поверхностный слой кожи – эпидермис - покрыт микроскопически тонким слоем - кислотной мантией, следовательно, нормальная кожа имеет кислотную среду. Если среда раствора моющего средства щелочная, то данное средство будет разъедать поверхностный слой эпидермиса кожи рук.
-
Моющие средства: «Frosh», «Fairy» не вредны для кожи рук; моющие средства «Каждый день», «Миф» имеют нейтральную среду раствора, поэтому их тоже можно считать безопасными для рук, а вот «Биолан», «AOS», «Econta» – вредны, и при работе с ними желательно использовать перчатки.
Используемая литература
1. Аликберова Л.Ю. Занимательная химия/ Л. Ю. Аликберова.- М.: Астрель, 2000.
2. Горбенко Н.В. Методические рекомендации к учебному пособию С.Б. Шустова, Л.В. Шустовой, Н.В. Горбенко «Химические аспекты экологии» для учащихся старших классов общеобразовательных организаций. Курс по выбору/ Н.В. Горбенко. – М.: ООО «Русское слово – учебник», 2015
3. Лехин И.В. Словарь иностранных слов/ И.В. Лехин.- М., 1986; 19-е изд.
4. Ожегов С.И., Шведова Н.Ю. Толковый словарь русского языка/ С.И. Ожегов Н.Ю. Шведова.- М.6 Азбуковник,1997.
5. Перельман В.И. Краткий справочник химика / Сост. В. И. Перельман. – М.: Госхимиздат, 1963.
6.http://www.hintfox.com/article/prigotovlenie-indikatorov-iz-prirodnih-materialov.html
7. https://botan.cc/prepod/himiya/oqm8euso.html
8. http://dic.academic.ru/dic.nsf/enc_chemistry/1737/ИНДИКАТОРЫ
Просмотров работы: 601
school-science.ru
Проектная работа "Растительные индикаторы"
Введение
Лимонная кислота, уксус, нашатырный спирт, известь, аскорбиновая кислота, щавелевая кислота – вещества, часто встречающиеся в быту. Среди кислот и щелочей много опасных, агрессивных веществ, способных вызвать тяжелые химические ожоги. Многие растворы кислот и щелочей бесцветны, не имеют запаха, но их нельзя пробовать на вкус. Для того, различить кислоты и основания используют индикаторы.
Индикаторы – это органические и неорганические вещества, изменяющие свою окраску в зависимости от реакции среды. Название «индикаторы» происходит от латинского слова indicator, что означает «указатель».
Поставленные вопросы: какие растения могут использоваться в качестве индикаторов? Можно ли приготовить растворы растительных индикаторов самостоятельно? Пригодны ли самодельные индикаторы для использования при проведении экспериментов?
Актуальность: использование кислотно-основных индикаторов из плодов растений.
Цель работы: получение растительных индикаторов из природного сырья, изучение изменения цвета пигментов растений в различных средах
Задачи:
- изучить литературные источники по теме;
- рассмотреть классификацию индикаторов;
- изготовить растворы индикаторов из природного сырья;
- провести исследование по определению среды растворов Объект исследования: вытяжки из частей растения, обладающие свойствами индикаторов.
плоды растений, обладающие свойствами кислотно-основных индикаторов.
Гипотеза: пигменты, содержащиеся в плодах растений обладают свойствами индикаторов, растворы растительных индикаторов можно приготовить самостоятельно и применять в быту и школьной лаборатории.
Методы и приемы работы: · ознакомиться с методикой проведения опытов; · приготовить растворы индикаторов из природного сырья; · изучить изменения окраски природных индикаторов в зависимости от среды; · соблюдать правила техники безопасности во время химического эксперимента.
Предмет исследования: растворы растительных индикаторов.
Историческая справка
История индикаторов начинается в XVII веке. Еще в 1640 году ботаники описали гелиотроп – душистое растение с темно-лиловыми цветками, из которого было выделено красящее вещество. Этот краситель, наряду с соком фиалок, стал широко применяться химиками в качестве индикатора. Об этом можно прочитать в трудах знаменитого физика и химика XVII века Роберта Бойля.
В 1663 году был открыт лакмус – водный настой лишайника, растущего на скалах Шотландии. Роберт Бойль приготовил водный настой лакмусового лишайника для своих опытов. Склянка, в которой он хранил настой, понадобилась для соляной кислоты. Вылив настой, Бойль наполнил склянку кислотой и с удивлением обнаружил, что кислота покраснела. Заинтересовавшись этим, Бойль на пробу добавил несколько капель настоя лакмуса к водному раствору гидроксида натрия и обнаружил, что в щелочной среде лакмус синеет. Так был открыт первый индикатор для обнаружения кислот и оснований, названный по имени лишайника лакмусом.
Вначале с помощью лакмуса исследовали минеральные воды, а примерно с 1670 года его начали использовать в химических опытах. «Как только вношу незначительно малое количество кислоты, – писал в 1694 французский химик Пьер Поме о „турнесоле", – он становится красным, поэтому если кто хочет узнать, содержится ли в чем-нибудь кислота, его можно использовать». В 1704 немецкий ученый М.Валентин назвал эту краску лакмусом; это слово и осталось во всех европейских языках, кроме французского; по-французски лакмус – tournesol, что дословно означает «поворачивающийся за солнцем». Так же французы называют и подсолнечник; кстати, «гелиотроп» означает то же самое, только по-гречески.
Фенолфталеин, который применяется в виде спиртового раствора, приобретает в щелочной среде малиновый цвет, а в нейтральной и кислой он бесцветен.
Синтез фенолфталеина впервые осуществил в 1871 году немецкий химик Адольф фон Байер, будущий лауреат Нобелевской премии.
Что касается индикатора метилового оранжевого, он действительно оранжевый в нейтральной среде. В кислотах его окраска становится розово-малиновой, а в щелочах – желтой. В настоящее время химики часто пользуются индикаторной бумагой, пропитанной смесью разных индикаторов – универсальным индикатором.
Классификация индикаторов
Одни из самых распространенных – кислотно-основные индикаторы, изменяющие цвет в зависимости от кислотности раствора. Происходит это потому, что в кислой и щелочной среде молекулы индикаторов имеют разное строение. Примером может служить общеизвестный индикатор фенолфталеин. В кислой среде это соединение находится в виде недиссоциированных молекул и раствор бесцветен, а в щелочной среде – в виде ионов и раствор имеет малиновый цвет.
Помимо кислотно-основных применяют и другие типы индикаторов.
Окислительно-восстановительные индикаторы изменяют свой цвет в зависимости от того, что присутствует в растворе окислитель или восстановитель. Такими индикаторами служат вещества, которые сами подвергаются окислению или восстановлению, при чем окисленная и восстановленная формы имеют разные окраски. Например, окисленная форма дифениламина имеет фиолетовую окраску, а восстановленная – бесцветная.
Широкое распространение получили комплексонометрические индикаторы – вещества, образующие с ионами металлов окрашенные комплексные соединения.
Некоторые вещества, адсорбируются на поверхности осадка, изменяя его окраску; такие индикаторы называются адсорбционными.
При определении среды мутных или окрашенных растворов, в которых практически невозможно заметить изменение окраски обычных кислотно-основных индикаторов, используют флуоресцентные индикаторы. Они светятся (флуоресцируют) разным цветом в зависимости от рН раствора. При этом важно, что свечение индикатора не зависит от прозрачности и собственной окраски раствора.
При отсутствии фабричных химических индикаторов для определения среды растворов можно успешно применять самодельные индикаторы из природного сырья.
Растительные индикаторы
Растительные индикаторы содержат окрашенные вещества, способные менять свой цвет в ответ на то или иное воздействие.
Называются эти окрашенные вещества пигментами.
Их окраска определяется избирательным поглощением света в видимой части солнечного спектра. Меланин - пигмент, встречающийся кожуре красных сортов винограда, лепестках некоторых цветков.
Структура молекул меланина жидкокристаллическая. Пигмент является сильным антиоксидантом. Фитохром - голубой растительный пигмент белкового строения, контролирует процессы цветения и прорастания семян. У одних растений ускоряя цветение, у других - задерживая. Фитохром играет роль "биологических часов" растения, механизм действия пока не изучен. Известно, что строение пигмента меняется в зависимости от светлого и тёмного времени суток, сигнализируя об этом растению. Phyton - от греческого растение, сhrom - цвет, краска. Это вещество регулирует синтез белковых молекул (ДНК, РНК), образование хлорофилла, каратиноидов, антоцианов, органических фосфатов, витаминов. Фитохром связан с клеточными мембранами и встречается практически во всех органах растения. Антоцианы - придают растениям окраску в диапазоне от розовой, красной, сиреневой, до синей и тёмно-фиолетовой. Антоцианы образуются в процессах гидролиза крахмала и по своему происхождению являются безазотистыми соединениями, близким к глюкозидам - соединениям сахара с неуглеводной частью. Усиленное образование антоцианов в клетках растения происходит при снижениях температур окружающей среды, при остановках синтеза хлорофилла, при интенсивном освещении УФ-лучами, при недостатке фосфора, необходимого для ввязывания гидролизованных крахмалом сахаров. При этом окраска листьев растений изменяется от зелёных до красных и синих цветов. Антоцианы хорошо растворимы в воде и присутствуют в соке вакуолей. Диапазон цветов изменяется благодаря наличию в растении всего трёх моделей антоцианов, различных между собой числом гидроксильных групп. Вариации в пропорциях этих пигментов в растениях дают разную окраску лепестков. В зависимости от кислотности (рН) среды сока вакуолей, антоциан придаёт ту или иную окраску. В кислой среде он обычно имеет красные тона, например, у герани, гортензии, фиалок. В щелочной среде эти растения приобретают сине-голубые тона. Если же к синему или фиолетовому раствору антоциана прибавить кислоту, раствор снова станет розовым. Опытным путём это легко проверить на растениях, подбирая в качестве подкормок те или иные микроэлементы, изменяющие кислотность жидкости вакуолей. Если к нейтральному раствору антоциана добавить очень слабый щелочной раствор - получается голубое окрашивание, при более концентрированном растворе щелочи окрашивание перейдёт в жёлто-зелёное. Красная окраска - у маков, роз, герани, синяя - у васильков, голубая - у колокольчиков обусловлена наличием пигмента антоциана. Плоды винограда, слив, терна, краснокочанной капусты, свеклы окрашены антоцианом. Считается, что антоциан защищает растения от низких температур, от вредного воздействия солнечного цвета на цитоплазму. Антохлор - пигмент жёлтого цвета. Встречается в клетках кожицы лепестков первоцвета (баранчики, примула), льнянки, жёлтого мака, георгины, в плодах лимонов и других растениях. Антофеин - редко встречающийся пигмент тёмного цвета. Вызывает окраску пятен на крыльях венчика у русских бобов (Faba vulgaris). Каротиноиды - содержатся в растениях, устойчивых к пониженным температурам. Когда хлорофилл исчерпывается в холодное время года, листья приобретают заметную жёлтую или оранжевую окраску за счёт пролонгированного действия пигмента каротиноида. Каротиноиды защищают растения от пагубного действия солнечного света, принимая УФ-излучения солнца на себя, трансформируя в энергию и передавая её хлорофиллу. С помощью такой передачи хлорофилл регулирует процессы фотосинтеза. В доказательство того, что каротиноиды присутствуют в листьях постоянно наравне с хлорофиллом, послужит следующий эксперимент: к спиртовой вытяжке хлорофилла прилить бензина 1:1, взболтать смесь и дать отстояться, смесь расслоится. Нижний слой из спирта имеет жёлтую окраску и содержит жёлтый пигмент ксантофилл. Верхний бензиновый слой зелёного цвета и содержит хлорофилл и каротин. Оранжево-красный цвет растениям даёт пигмент каротин, жёлтую - ксантофилл. Эти пигменты имеют белково-липоидную основу. Эти пигменты обнаружены в плодах помидоров, апельсинов, мандаринов, в корне моркови. Основная роль этих пигментов- придать растениям яркую привлекательную окраску, привлекая птиц и животных для разнесения семян. Цветы с оранжево-жёлтой окраской - лютик, настурция.
Практическая часть
Методика изготовления индикаторов из природного сырья
Для приготовления растительных индикаторов берут по 50 г сырья, измельчают, перетирают в ступке, добавив 50 мл воды, 20 мл этилового спирта. Полученные вытяжки фильтруют.
С целью предохранения от порчи, в полученный фильтрат добавляют этиловый спирт в соотношении 2:0,5.
Получив таким образом растворы индикаторов, мы проверили, как будет изменяться цвет растворов в разных средах.
Брали пипеткой по несколько капель самодельного индикатора и добавляли их поочередно в воду (нейтральная среда), кислый (р-р HCl) или щёлочной (р-р NaOH) растворы. Результаты всех этих опытов заносили в таблицу.
Таблица 1. Изменение окраски природных индикаторов в различных средах.
Названиеиндикаторов
Среда
Кислая ( р-р НCl )
Щёлочная (р-р NaOH)
Нейтральная (h3O)
Капуста красная
Малиновый
Жёлтый
Бледно-розовый
Базилик
Бледно-коричневый
Бледно-коричневый
Бледно-коричневый
Малина
Бледно-красный
Зелёный
Бледно-розовый
Красная смородина
Бледно-розовый
Зелёный
Бледно-розовый
Клубника
Бледно-оранжевый
Бледно-коричневый
Бледно-оранжевый
Брусника
Красный
Зелёный
Красный
Облепиха
Бесцветный
Жёлтый
Светло-жёлтый
Свекла
Бледно-красный
Жёлтый
Красный
Морковь
Бледно-оранжевый
Оранжевый
Бесцветный
В результате эксперимента мы убедились, что не все индикаторы, из приготовленных нами , можно использовать как индикаторы. Например, морковный сок и вытяжку из ягод облепихи нежелательно использовать как индикатор, потому что его изменения незначительны. В то же время яки из ягод малины, брусики, краснокочанной капусты вещества проявляют ярко выраженные индикаторные свойства.
Приготовление индикаторных бумажек.
С помощью фильтровальной бумаги и вытяжек из растительных индикаторов мы приготовили индикаторные бумажки. Способ приготовления очень простой: на фильтровальную бумагу с помощью пипетки наносят раствор из вытяжки растительного индикатора, высушивают и повторяют процедуру ещё раз.
Изменение цвета пропитанных индикаторных бумажек в различных средах соответствует изменению цвета вытяжки аналогичного растительного индикатора.
Выводы:
Проведя исследовательскую работу, мы пришли к следующим выводам:
- пигменты растений могут использоваться в качестве индикаторов
-многие природные растения обладают свойствами кислотно-основных индикаторов, способных изменять свою окраску в зависимости от среды, в которую они попадают; - для изготовления растворов растительных индикаторов можно использовать следующее природное сырье: ягоды малины, клубники, брусники, краснокочанную капусту, свеклу
-растворы растительных индикаторов можно использовать в качестве кислотно-основных индикаторов для определения среды растворов
- эти индикаторы обладают достаточно высокой чувствительностью, особенно ярко окрашенные соки черной смородины, клюквы, калины, черники и свеклы. Свойства этих индикаторов сравнимы со свойствами универсальной индикаторной бумаги.
-Интенсивность окраски индикаторов зависит от концентрации исследуемых растворов, что позволяет приблизительно оценить агрессивность среды. Легкость приготовления и безопасность делают подобные индикаторы легкодоступными, а значит хорошими помощниками в работе с кислотами и основаниями
- ягоды растений имеют кислую среду, поэтому не изменяется цвет раствора в кислой среде, окраска остается красным. В щелочной среде растворы приобретают от желтого до зеленого цвета.
СПИСОК ЛИТЕРАТУРЫ
Аликберова Л.Ю. Занимательная химия. – М.: АСТ-ПРЕСС, 2002.
Аликберова Л.Ю. Занимательная химия. Книга для учащихся, учителей и родителей. – М.: АСТ-ПРЕСС, 1999.
Семенов П.П. «Индикаторы из местного растительного материала», «Химия в школе», 1984, №1, стр.73
Степин С.С., Аликберова Л.Ю. Занимательные задания и эффектные опыты по химии, М. «Дрофа», 2002 г
Оганесян Э.Т. Руководство по химии для поступающих в вузы. – М.: Высшая школа, 1998.
Энциклопедический словарь юного химика. – М.: Педагогика, 1982.
Интернет-ресурсы.
П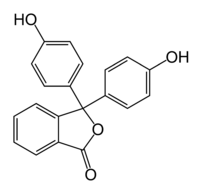 риложение 1
риложение 1
Структурная формула фенолфталеина
Приложение 2
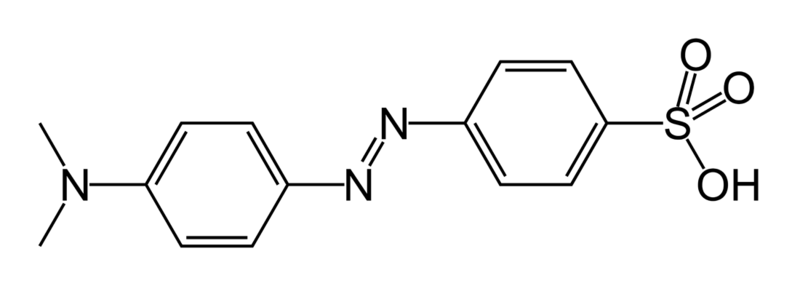
Структурная формула метилоранжа
infourok.ru
Исследовательская работа "Природные индикаторы" - химия, прочее
МБОУ «Малодербетовская СОШ № 2»
Природные индикаторы
( исследовательская работа)
Выполнила ученица 8 класса
Лисицкая Ольга Юрьевна
2014 год
Содержание.
1.Введение стр. 5 - 4
2.Основная часть стр. 5 – 14
2.1.Теоретическая часть стр. 5 – 10
2.2. исследовательская часть стр.10 - 14
3.Заключение стр. 15
4. Литература стр.16
Введение.
Природа – удивительное творение Вселенной. Мир природы красив, таинственен и сложен. Этот мир богат разнообразием фауны и флоры. Данная работа посвящена уникальным свойствам растений, которые не перестают удивлять человечество . Мы углубимся в их внутренний мир, установим их связь с такими науками как химия, биология и даже медицина.
Итак, давайте начнем с самого простого.
Царство растений удивляет нас своим многообразием цветовых оттенков. Цветовая палитра настолько разнообразна, что невозможно сказать, сколько цветов и их оттенков существует в мире растений. Таким образом, возникает вопрос – от чего зависит окраска тех или иных растений? Какова структура растений? Что они содержат в себе? И каковы их свойства? Чем дальше мы погружаемся в мир растений, тем мы задаемся все больше и больше другими вопросами. Оказывается, цвет растений определяется химическим составом клеточного содержимого каждого растения. А точнее, всему виной являются так называемые биофлавониды. Это химические природные соединения, придающие определенный цветовой оттенок и свойства любому растению. Поэтому биофлавонидов существует множество. К ним относятся антоцианы, ксантофиллы, каротиноиды, катехины, флавонолы, флавононы и другие.
Польза многих растений несомненна . Издревна люди применяли растения в качестве лекарственных средств. Поэтому недаром возникла народная медицина, основанная на уникальных и лекарственных свойствах растений.
Почему нами выбрана данная тема.
- Во-первых, нам интересны свойства растительных объектов.
- Во-вторых, какова их роль в такой науке как химия?
- Чем определяются их индикаторные свойства?
- И, в-третьих, как можно использовать их свойства в медицинских целях.
Поэтому нами будут рассмотрены такие флавониды, как антоцианы. Так как они являются идеальными кандидатами для нашего исследования. По литературным данным антоцианы содержатся в таких природных объектах как анютины глазки, малина, клубника, земляника, вишня, слива, краснокочанная капуста, черный виноград, свекла, черноплодная рябина, смородина, голубика, клюква и многие другие.
Актуальность темы заключается в том, что на сегодня все больше и больше интересуют свойства растительных объектов для применения и использования их в разных областях науки, таких как химия, биология и медицина.
Цель работы : с помощью исследования доказать наличие природных индикаторов – пигментов -антоцианов в растительных объектах и изучить их свойства. Задачи исследования:
1) Исследовать природные объекты на наличие индикаторов – антоцианов;
2) Доказать индикаторные свойства растительных пигментов – антоцианов;
3) Выявить значение и биохимическую роль природных объектов, содержащих антоцианы.
Объекты исследования: ягоды клубники, плоды боярышника, вишни, шиповника, черемухи, корнеплоды столовой свеклы, цветы медуницы. Методы исследования: эксперимент.
2. Основная часть.
2.1. Теоретическая часть
2.1.1.Химические индикаторы .История образования индикаторов
Индикаторы (от лат. Indicator –указатель) – вещества, позволяющие следить за составом среды или за протеканием химической реакции.На сегодняшний день в химии известно большое количество различных индикаторов как химических, так и природных.
К химическим индикаторам относятся такие как, кислотно-основные, универсальные, окислительно-восстановительные, адсорбционные, флуоресцентные, комплексонометрические и другие.
Также индикаторы можно найти среди природных объектов. Пигменты многих растений способны менять цвет в зависимости от кислотности клеточного сока. Следствие, пигменты являются индикаторами, которые можно применить для исследования кислотности других растворов. Общее название таких растительных пигментов флавониды. В эту группу входят так называемые антоцианы, которые обладают хорошими индикаторными свойствами.
Самый известно используемый в химии растительный кислотно-основной индикатор – лакмус. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолетовой краски-заменителя дорогостоящего пурпура. Готовили лакмус из специальных видов лишайников. Измельченные лишайники увлажняли, а затем добавляли в эту смесь золу и соду. Приготовленную смесь помещали в деревянные бочки, добавляли мочу и выдерживали длительное время. Постепенно раствор приобретал темно-синий цвет. Его упаривали и в таком виде применяли для окрашивания тканей.
Позже лакмус был открыт в 1663 году. Он представлял собой водный раствор лишайника, растущего на скалах в Шотландии.
Известен и следующий исторический факт :
«В лаборатории известного английского ученого физика и химика Роберта Бойля , как обычно, кипела напряженная работа: горели свечи, в ретортах нагревались разнообразные вещества. В кабинет к Бойлю вошел садовник и поставил в углу корзину с темно- фиолетовыми фиалками. В это время Бойль собирался проводить опыт по получению серной кислоты. Восхищенный красотой и ароматом фиалок ученый, захватив с собой букетик, направился в лабораторию. Лаборант сообщил Бойлю, что вчера доставили две бутылки соляной кислоты из Амстердама. Бойлю захотелось взглянуть на эту кислоту и , чтобы помочь лаборанту налить кислоту, он положил фиалки на стол. Затем, прежде чем отправиться в кабинет , он взял свой букетик и заметил , что фиалки слегка дымились от попавших на них брызг кислоты. Чтобы промыть цветы , он опустил их в стакан с водой. Через некоторое время он бросил взгляд на стакан с фиалками , и случилось чудо: темно- фиолетовые фиалки стали красными. Естественно, ученый начал исследования . Он обнаружил , что и другие кислоты окрашивают лепестки фиалок в красный цвет. Он подумал, что если приготовить из лепестков настой и добавить его к исследуемому раствору, то можно будет узнать, кислый он или нет. Бойль начал готовить настои из других растений : целебных трав, древесной коры, корней растений и др.Однако самым интересным оказался фиолетовый настой, полученный из лакмусового лишайника. Кислоты изменяли его цвет на красный , а щелочи на синий.
Бойль распорядился пропитать этим настоем бумагу и затем высушить ее. Так была создана первая лакмусовая бумага, которая имеется в любой химической лаборатории. Таким образом было открыто одно из первых веществ, которое Бойль уже тогда назвал « индикатором.»
Роберт Бойль приготовил водный раствор лакмусового лишайника для своих опытов. Склянка, в которой он хранил настой, понадобилась для соляной кислоты. Вылив настой, Бойль наполнил склянку кислотой и с удивлением обнаружил, что кислота покраснела. Заинтересовавшись этим явлением, Бойль на пробу добавил несколько капель к водному раствору гидроксида натрия и обнаружил, что в щелочной среде лакмус синеет. Так был открыт первый индикатор для обнаружения кислот и щелочей, названный по имени лишайника лакмусом. С тех пор этот индикатор является одним из незаменимых индикаторов в различных исследованиях в области химии.»
Кислотно-основные индикаторы.
Чаще всего в лабораториях используют кислотно-основные индикаторы. К ним относятся фенолфталеин, лакмус, метиловый оранжевый, бромтимоловый синий и другие.
Кислотно-основные индикаторы – это органические соединения, способные изменять цвет в растворе при изменении кислотности. Они изменяют цвет в достаточно узких границах рН. Таких индикаторов известно множество, и каждый из них имеет свою область применения.
Такие индикаторы являются одними из самых устойчивых и востребованных в лабораториях химии.
2.1.2. Природные индикаторы. Характеристика и классификация.
С древности люди уделяли большое внимание наблюдениям за природой. И в наше время учение многих стран все больше и больше стали обращаться к природным индикаторам.
Пигменты многих растений способны изменять цвет в зависимости от кислотности клеточного сока. Поэтому растительные пигменты являются индикаторами, которые можно применять для исследования кислотности других растворов. Общее название природных пигментов флавониды. В эту группу входят каротиноиды, ксантофиллы, антоцианы, соответственно определяющие желтую, оранжевую, красную, синюю, фиолетовую окраску растений.
Антоцианы – это природные пигменты из группы флавонидов.
Известно большое количество объектов, богатыми антоцианами. Это малина, клубника, земляника, вишня, слива, краснокочанная капуста, черный виноград, свекла, черника, голубика, клюква и многие другие.
Антоцианы придают фиолетовый, синий, коричневый, красный или оранжевый цвета плодам. Такое многообразие объясняется тем, что цвет изменяется в зависимости от баланса кислот и щелочей.
Строение антоцианов установлено в 1913 году немецким биохимиком Р.Вильштеттером. Первый химический синтез осуществлен в 1928 году английским химиком Р.Робинсоном. Разнообразие окраски объясняется не только особенностями их строения, но и образованием комплексов с ионными К (пурпурная соль), Мg и Са (синяя соль), а также адсорбцией на
полисахаридах. Образованию антоцианов благоприятствуют низкая температура, интенсивное освещение.
Антоцианы обладают хорошими индикаторными свойствами: в нейтральной среде приобретают пурпурную окраску, в кислой среде – красный цвет, в щелочной среде – зелено-желтый цвет.
Антоцианы очень часто определяют цвет лепестков, плодов и осенних листьев. Они обычно придают фиолетовую, синюю, коричневую, красную окраску. Эта окраска часто зависит от рН клеточного содержимого, и потому может меняться при созревании плодов, отцветании цветков в процессах, сопровождающихся закислением клеточного сока.
Растения с повышенной концентрацией антоцианов популярны в ландшафтном дизайне. Многие считают, что цвет осенних листьев (включая красный цвет) просто результат разрушения хлорофилла, который маскировал уже имевшиеся желтые, оранжевые и красные пигменты (каротиноид, ксантофилл и антоциан, соответственно). И если для каротиноидов и ксантофиллов это действительно так, то антоцианы не присутствуют в листьях до тех пор, пока в листьях не начнет снижаться уровень хлорофиллов. Именно тогда растения начинают синтезировать антоцианы. К сожалению, почти у всех природных индикаторов есть серьезный недостаток: их отвары довольно быстро портятся – скисают или плесневеют. Другой недостаток – слишком широкий интервал изменения цвета. При этом трудно или невозможно отличить, например, нейтральную среду от слабокислой или слабощелочную от сильнощелочной.
Какова биохимическая роль индикаторов ?
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких сред, следить за изменением их состава или за протеканием химической реакции.
Как уже было сказано, общее название всех природных пигментов, природных индикаторов – флавониды.
Флавониды - гетероциклические соединения. В зависимости от структуры и степени окисления делятся на антоцианы, катехины, флавонолы, флавононы, каротиноиды, ксантофиллы и т. д. Находятся в растениях в свободном состоянии и в виде гликозидов (исключение - катехины).
Антоцианы – это биофлавониды, придающие плодам фиолетовую, синюю, коричневую, красную окраску.
Поступая в организм человека с фруктами и овощами, антоцианы проявляют действие, схожее с витамином Р, они поддерживают нормальное состояние кровяного давления и сосудов, предупреждая внутренние кровоизлияния. Антоцианы требуются клеткам головного мозга, улучшают память.
Антоцианы – мощные антиоксиданты, которые сильнее в 50 раз витамина С. Многие исследования подтвердили пользу антоцианов для зрения. Наибольшая концентрация антоцианов содержится в чернике. Поэтому препараты, содержащие чернику, наиболее востребованы в медицине.
Так как антоцианы обладают хорошими индикаторными свойствами, то их можно применять как индикаторы для идентификации кислотной, щелочной или нейтральной среды, как в химии, так и в быту.
2.2. Исследовательская часть.
2.2.1. Введение.
В качестве природных индикаторов были отобраны ягоды клубники, плоды черемухи, черной смородины, вишни , шиповника, красно-кочанной капусты, черники и столовой свеклы . Это те природные объекты, которые содержат наибольшую концентрацию антоцианов. Поэтому мы поставили перед собой
цель исследования : с помощью исследования доказать наличие природных индикаторов – антоцианов в растительных объектах и изучить их свойства.
Для достижения цели работы были поставлены следующие задачи:
1) исследовать природные объекты на наличие индикаторов – антоцианов;
2) доказать индикаторные свойства растительных пигментов – антоцианов;
3) выявить значение и биохимическую роль природных объектов, содержащих антоцианы.
2.2.2 Методика исследования.
Зная о способности антоцианов изменять свою окраску в различных средах,
можно доказать их присутствие или опровергнуть. Для этого необходимо исследуемый материал порезать или потереть, затем прокипятить, так как это приводит к разрушению мембран клеток, и антоцианы свободно выходят из клеток , окрашивая воду. Растворы наливают в прозрачную посуду и добавляют в одну порцию аммиак или раствор соды , а в другую наливают уксус. Если окраска изменится под их воздействием, значит продукты содержат антоцианы и они особенно полезны.
Добиться извлечения антоцианов из клеток растения можно и механическим способом: растереть материал в ступке с песком, добавить около 10 мл воды и отфильтровать.
2.2.3 Результаты исследований.
| Исследуемый материал | Естественный цвет раствора | Изменение цвета от кислоты | Изменение цвета от щелочи |
| Плоды черемухи | Красно- фиолетовый | красный | зеленый |
| Корнеплоды свеклы | красный | Ярко красный | желтый |
| Плоды вишни | Темно-красный | красный | желтый |
| Черная смородина | бордовый | красный | Синевато-изеленый |
| шиповник | Светло-красный | красный | Светло-коричневый |
| Красно-кочанная капуста | фиолетовый | красный | Темно-зеленый |
| Лук фиолетовый | Светло- лиловый | розовый | Светло-зеленый |
| Ягоды клубники | розовый | красный | желтый |
Обычный чай можно использовать в домашних условиях как индикатор. Вы замечали, что чай с лимоном гораздо светлее, чем без лимона. В кислой среде он обесцвечивается, а в щелочной становится более темным.

 чай нейтральная среда чай в кислой и щелочной среде
чай нейтральная среда чай в кислой и щелочной среде
Учащиеся 8 класса , проводя исследование по первоцветам, обнаружили интересную особенность медуницы. Ее стебли развились еще под снегом, и когда обнажилась почва, у медуницы появляются уже окрашенные бутоны.
Бутоны розовые и в ярко- розовый цвет окрашены и распустившиеся цветки. Но проходит несколько дней , и окраска цветка изменяется: он становится пурпурным, а потом фиолетовым, затем синеет, а позже иногда голубеет и даже белеет. Соцветие медуницы – разноцветный букетик .

Самые верхние, только что распустившиеся цветки – розовые, пониже – фиолетовые и синие.
Почему изменяется окраска цветка?
Это зависит от присутствия в лепестках цветка особого красящего вещества- антоциана. Это вещество изменяет свой цвет: розовеет от кислоты и синеет от щелочи. С возрастом цветка состав клеточного сока в лепестках медуницы изменяется: кислый вначале сок затем становится щелочным. Изменяется и окраска антоциана: он синеет. Проверим эти явления с помощью опытов.
Провели следующие опыты с цветами медуницы:
1.Опустили розовый цветок медуницы в воду и капнули туда нашатырного спирта или раствора соды -цветок синеет. Почему ? (Потому что среда раствора стала щелочной.)
2.Взяли синий цветок , положили в другой стакан с водой и капнули туда уксусной эссенции - синий цветок порозовеет. Причина?
(среда стала кислой.)
2.2. 4 . Выводы исследования.
По результатам нашего исследования были доказаны индикаторные свойства исследуемых объектов . Причем ,здесь наблюдается следующая закономерность – все данные природные объекты в кислотной среде преимущественно окрашиваются в красный цвет, а в щелочной среде – в зелено-желтый. И это доказывает, что они действительно содержат антоцианы. Данное исследование нам показало, что в природе существуют такие растительные объекты, которые меняют свою окраску в зависимости от кислотности среды. Поэтому мы можем назвать их природными индикаторами.
3.Заключение.
В результате этой исследовательской работы нами доказано, что среди природных объектов существует большое количество природных индикаторов, которые можно использовать и применять как в быту, так и в химии для других разных исследований.
А также антоцианы часто применяются в медицине благодаря
их уникальным свойствам. Антоцианы имеют огромное биохимическое значение. Антоцианы являются мощными антиоксидантами, нейтрализующими свободные радикалы, которые в свою очередь губительно действуют на наш организм. Таким образом, антоцианы являются гарантами долгой и здоровой жизни клеток, а значит, продлевают и нашу жизнь. Многие исследования подтвердили пользу антоцианов для зрения. Также они помогают снизить уровень сахара крови. Особенно это касается тех людей, которые больны сахарным диабетом. Чтобы получить всю эту пользу, ученые советуют съедать в день всего полстакана черники – свежей или замороженной. Поэтому препараты, содержащие чернику, наиболее востребованы в медицине.
4. Литература.
1. Ветчинский К.М. Растительный индикатор.М.: Просвещение, 2002. – 256с.
2. Вронский В.А. Растительный индикатор. - СПб.: Паритет, 2002. – 253с.
3. Галин Г.А. Растения помогают геологам. – М.: Наука, 1989. - 99с.
4. Зацер Л.М. К вопросу об использовании растений-индикаторов в химии. – М.: Наука, 2000. – 253с.
5. Леенсон И.А. Занимательная химия: 8-11 классы. - М.: Просвещение, 2001. – 102с.
6. Соколов В.А. Природные красители.М.: Просвещения, 1997.
7. Журнал « Химия в школе» №2, №8 – 2002 год.
kopilkaurokov.ru
Химический калейдоскоп: Растительные индикаторы
Самодельные рН - индикаторы из экстрактов растений.
Индикаторы – это органические и неорганические вещества, изменяющие свою окраску в зависимости от реакции среды. Название «индикаторы» происходит от латинского слова indicator, что означает «указатель».
Действие природных индикаторов основано на способности антоцианинов, представляющих смесь гликозидов, содержащихся в цветках и плодах растений, образовывать в разных средах равновесные структуры разной окраски.
Технология изготовления самодельных индикаторов в виде шариков: 1. 100 г листьев краснокочанной капусты (или другого растительного сырья) выдержать
 10 минут в 400 мл кипящей воды. 2. Отвар остудить и профильтровать через бумажный фильтр.
10 минут в 400 мл кипящей воды. 2. Отвар остудить и профильтровать через бумажный фильтр.3. 30 мл полученного экстракта смешать с 20 мл 2 %-ного водного раствора альгината натрия (препарат, который используется в качестве стабилизатора и эмульгатора в пищевой, косметической и фармацевтической промышленности).
4. В чистый стакан поместить 100 мл 1 %-ного водного раствора хлорида кальция при непрерывном перемешивании добавлять из пипетки по каплям приготовленный раствор экстракта с альгинатом натрия. Попав в раствор CaCl2, капли сразу вёртываются в шарики.
 5. Шарики следует собрать и промыть несколько раз водой в мелком стальном ситечке.
5. Шарики следует собрать и промыть несколько раз водой в мелком стальном ситечке.6. За день до демонстрации рекомендуется выдержать шарики в растворе CaCl2 в холодильнике при температуре около 40 С.
Характеристика растительных индикаторов
Растение (часть его) | Цвет индикатора в кислой среде | Цвет индикатора в нейтральной среде | Цвет индикатора в щелочной среде | Количество повторов до разрушения шарика |
Тёмная фасоль | Красный | Фиолетовый | Жёлто-зелёный | 4-5 |
Кожица винограда | Розовый | Сиреневый | Жёлто-зелёный | 5-8 |
Краснокочанная капуста | Красный | Голубой | Жёлто-рыжий | 5-8 |
Ягоды восковицы | Розовый | Ярко-розовый | Оранжевый | 3-4 |
Кожица японского баклажана | Розово-красный | Красно-фиолетовый | Жёлтый | 4-5 |
Цветки азалии | Пурпурно-красный | Розовый | Жёлтый | 4-5 |
Цветки дуба | Розовый | Ярко-оранжевый | Оранжевый | 3 |
Цветки астрагала | Розовый | Тёмно-пурпурный | Жёлтый | 3 |
 |
| Восковица |
 |
| Японский баклажан |
 |
| Азалия |
 |
| Цветки дуба |
Процесс можно продолжать, пока не разрушаться шарики.
 |
| Астрагал |
Растительные индикаторы
Гимназия №14. Россихина Л.А.
 г. Улан-Удэ, респ. Бурятия.
г. Улан-Удэ, респ. Бурятия. Цель работы: исследование изменения пигментов растений в различных средах. Объект исследования: природные растения, обладающие свойствами индикаторов.
 Для определения рН раствора использовали рН метрРезультаты работы:
Для определения рН раствора использовали рН метрРезультаты работы:-многие природные растения обладают свойствами кислотно-основных индикаторов, способных изменять свою окраску в зависимости от среды, в которую они попадают;
 -опытным путем определены растения, обладающие свойствами кислотно-основных индикаторов: растворы растительных индикаторов из ягод малины, черной смородины, клубники, черноплодной рябины, черники, клюквы, коры крушины, лепестков мальвы, краснокочанной капусты; свеклы.
-опытным путем определены растения, обладающие свойствами кислотно-основных индикаторов: растворы растительных индикаторов из ягод малины, черной смородины, клубники, черноплодной рябины, черники, клюквы, коры крушины, лепестков мальвы, краснокочанной капусты; свеклы. Особенно ярко окрашенные соки черной смородины, клюквы, калины, черники и свеклы.
wwwalex137.blogspot.com
«Природные индикаторы» - PDF
Тема проекта: Природные индикаторы
 Тема проекта: Природные индикаторы Автор(ы):Подоляну Д., Полевикова А., Поляков Г., Попова Е., Попова С., Посконин А., Посконин С., Постников И., Максимова С., Малахов В. Школа: ГАОУ ВО МГПУ Полигон-ПРО
Тема проекта: Природные индикаторы Автор(ы):Подоляну Д., Полевикова А., Поляков Г., Попова Е., Попова С., Посконин А., Посконин С., Постников И., Максимова С., Малахов В. Школа: ГАОУ ВО МГПУ Полигон-ПРО
ПЛАН УРОКА. Цели обучения. Цели урока
 ПЛАН УРОКА Предмет Учитель Школа, класс Тема урока Химия Козловская Э.Р. г. Шымкент, НИШ ФМН, 7 класс Индикаторы Цели обучения Цели урока Языковые цели Первоначальные знания 7.3.4.4 уметь различать химические
ПЛАН УРОКА Предмет Учитель Школа, класс Тема урока Химия Козловская Э.Р. г. Шымкент, НИШ ФМН, 7 класс Индикаторы Цели обучения Цели урока Языковые цели Первоначальные знания 7.3.4.4 уметь различать химические
ВВЕДЕНИЕ ОСНОВНОЕ СОДЕРЖАНИЕ
 УДК 54 ИЗУЧЕНИЕ КИСЛОТОСТИ ПРОДУКТОВ ПИТАНИЯ С ПОМОЩЬЮ ПРИРОД- НЫХ ИНДИКАТОРОВ Тюрина Д. А. Научный руководитель учитель естественных дисциплин I категории Сорокина А. В. Емельяновская Средняя Общеобразовательная
УДК 54 ИЗУЧЕНИЕ КИСЛОТОСТИ ПРОДУКТОВ ПИТАНИЯ С ПОМОЩЬЮ ПРИРОД- НЫХ ИНДИКАТОРОВ Тюрина Д. А. Научный руководитель учитель естественных дисциплин I категории Сорокина А. В. Емельяновская Средняя Общеобразовательная
Альтернативные индикаторы МКОУ СОШ 4
 Альтернативные индикаторы Автор исследования: Толоконин Павел, учащийся 9 класса МКОУ СОШ 4, Руководитель Живан Ю.Н., учитель химии МКОУ СОШ 4 Московская область г. Солнечногорск 2012 1 Содержание Введение...3
Альтернативные индикаторы Автор исследования: Толоконин Павел, учащийся 9 класса МКОУ СОШ 4, Руководитель Живан Ю.Н., учитель химии МКОУ СОШ 4 Московская область г. Солнечногорск 2012 1 Содержание Введение...3
Лабораторные опыты 1 3 Дата г.
 РАСТВОРЫ Лабораторные опыты 1 3 1. ОПРЕДЕЛЕНИЕ ИОНОВ ГИДРОГЕНА И ГИДРОКСИД-ИОНОВ В РАСТВОРАХ. 2. УСТАНОВЛЕНИЕ ПРИБЛИЗИТЕЛЬНОГО ЗНАЧЕНИЯ ph ВОДЫ, ЩЕЛОЧ- НЫХ И КИСЛОТНЫХ РАСТВОРОВ (НАТРИЙ ГИДРОКСИДА, ХЛОРИД-
РАСТВОРЫ Лабораторные опыты 1 3 1. ОПРЕДЕЛЕНИЕ ИОНОВ ГИДРОГЕНА И ГИДРОКСИД-ИОНОВ В РАСТВОРАХ. 2. УСТАНОВЛЕНИЕ ПРИБЛИЗИТЕЛЬНОГО ЗНАЧЕНИЯ ph ВОДЫ, ЩЕЛОЧ- НЫХ И КИСЛОТНЫХ РАСТВОРОВ (НАТРИЙ ГИДРОКСИДА, ХЛОРИД-
ДОМАШНЯЯ ХИМИЧЕСКАЯ ЛАБОРАТОРИЯ
 ДОМАШНЯЯ ХИМИЧЕСКАЯ ЛАБОРАТОРИЯ Карманова И.И., учитель химии МОУ «СОШ 50» г. Саратова Пояснительная записка. Данный курс разработан для учащихся 9-х классов и предусматривает проведение некоторых химических
ДОМАШНЯЯ ХИМИЧЕСКАЯ ЛАБОРАТОРИЯ Карманова И.И., учитель химии МОУ «СОШ 50» г. Саратова Пояснительная записка. Данный курс разработан для учащихся 9-х классов и предусматривает проведение некоторых химических
Натуральные красители для пасхальных яиц
 ОГБОУ «ЦЕНТР образования для детей с особыми образовательными потребностями г.смоленска» Натуральные красители для пасхальных яиц работу выполнила: Садчикова Ю.Д. руководитель: Гвоздовская Н.П. 2017г Скоро
ОГБОУ «ЦЕНТР образования для детей с особыми образовательными потребностями г.смоленска» Натуральные красители для пасхальных яиц работу выполнила: Садчикова Ю.Д. руководитель: Гвоздовская Н.П. 2017г Скоро
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ Испытания на чистоту и ОФС.1.2.2.2.0011.15 допустимые пределы примесей. Взамен ГФ XII, ч. 1, Железо ОФС 42-0058-07 Испытания
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ Испытания на чистоту и ОФС.1.2.2.2.0011.15 допустимые пределы примесей. Взамен ГФ XII, ч. 1, Железо ОФС 42-0058-07 Испытания
Пояснительная записка
 1 Пояснительная записка Данный курс рассчитан на 36 часов, рекомендован для учащихся 7 классов. Он ориентирован на расширение знаний учащихся, на развитие любознательности, интеллектуальной деятельности
1 Пояснительная записка Данный курс рассчитан на 36 часов, рекомендован для учащихся 7 классов. Он ориентирован на расширение знаний учащихся, на развитие любознательности, интеллектуальной деятельности
Кружок по химии «Исследователи».
 Кружок по химии «Исследователи». ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Школа призвана воспитывать деловых людей, способных к восприятию новых идей, принятию нестандартных решений, умеющих работать в коллективе. Решение
Кружок по химии «Исследователи». ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Школа призвана воспитывать деловых людей, способных к восприятию новых идей, принятию нестандартных решений, умеющих работать в коллективе. Решение
8 класс Лабораторная работа 1:
 8 класс Лабораторная работа 1: Определение рн в воде реки или пруда Краткая теория Гидросфера водная оболочка Земли, совокупность ее океанов, морей, рек, озер, болот, водохранилищ, подземных вод, включая
8 класс Лабораторная работа 1: Определение рн в воде реки или пруда Краткая теория Гидросфера водная оболочка Земли, совокупность ее океанов, морей, рек, озер, болот, водохранилищ, подземных вод, включая
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОРОДА МОСКВЫ
 ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОРОДА МОСКВЫ Государственное бюджетное образовательное учреждение высшего профессионального образования РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ имени
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОРОДА МОСКВЫ Государственное бюджетное образовательное учреждение высшего профессионального образования РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ имени
протолитических реакций
 Кислотно-основное основное титрование (КОТ) - титриметрический метод анализа, основанный на использовании протолитических реакций HCl + NaOH NaCl + H O 2 H O + + OH - 2 H O 3 2 Na 2 CO 3 + HCl NaHCO 3
Кислотно-основное основное титрование (КОТ) - титриметрический метод анализа, основанный на использовании протолитических реакций HCl + NaOH NaCl + H O 2 H O + + OH - 2 H O 3 2 Na 2 CO 3 + HCl NaHCO 3
NaOH Na + + HSO 4. (1 ступень) HSO 4 H + + SO 4
 ЗАНЯТИЕ 5 ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ. ГИДРОЛИЗ СОЛЕЙ ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Электролиты вещества, проводящие электрический ток. Процесс распада вещества на ионы под действием растворителя называется электролитической
ЗАНЯТИЕ 5 ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ. ГИДРОЛИЗ СОЛЕЙ ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Электролиты вещества, проводящие электрический ток. Процесс распада вещества на ионы под действием растворителя называется электролитической
ТЕМА УРОКА: ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ.
 8 класс ТЕМА УРОКА: ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ. Цели урока: формировать знания учащихся о химические свойства кислот: действие на различные индикаторы, условия и особенности взаимодействия с металлами;
8 класс ТЕМА УРОКА: ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ. Цели урока: формировать знания учащихся о химические свойства кислот: действие на различные индикаторы, условия и особенности взаимодействия с металлами;
 КРИВАЯ ТИТРОВАНИЯ - график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции, от степени протекания процесса титрования (например, от количества
КРИВАЯ ТИТРОВАНИЯ - график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции, от степени протекания процесса титрования (например, от количества
Пояснительная записка
 Пояснительная записка Рабочая программа проектной деятельности «Занимательная химия» для 8 класса составлена в соответствии с положениями Федерального государственного образовательного стандарта основного
Пояснительная записка Рабочая программа проектной деятельности «Занимательная химия» для 8 класса составлена в соответствии с положениями Федерального государственного образовательного стандарта основного
ХИМИЯ В ТАБЛИЦАХ И СХЕМАХ
 Е.В. Савинкина Г.П. Логинова ХИМИЯ В ТАБЛИЦАХ И СХЕМАХ Справочное пособие 8 9 классы Издательство АСТ Москва УДК 373:54 ББК 24я721 С13 С13 Савинкина, Елена Владимировна. Химия в таблицах и схемах : справочное
Е.В. Савинкина Г.П. Логинова ХИМИЯ В ТАБЛИЦАХ И СХЕМАХ Справочное пособие 8 9 классы Издательство АСТ Москва УДК 373:54 ББК 24я721 С13 С13 Савинкина, Елена Владимировна. Химия в таблицах и схемах : справочное
«Биологическое значение буферных систем»
 Федеральное государственное бюджетное образовательное учреждение высшего образования ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ ИМЕНИ ИМПЕРАТОРА ПЕТРА I Кафедра химии Реферативный доклад по неорганической
Федеральное государственное бюджетное образовательное учреждение высшего образования ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ ИМЕНИ ИМПЕРАТОРА ПЕТРА I Кафедра химии Реферативный доклад по неорганической
 Цели урока Задачи урока для учителя Задачи урока для учащихся Ожидаемые результаты План конспект урока «Кислоты: химические свойства, классификация». Создание условий для проявления познавательной активности
Цели урока Задачи урока для учителя Задачи урока для учащихся Ожидаемые результаты План конспект урока «Кислоты: химические свойства, классификация». Создание условий для проявления познавательной активности
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ Общие реакции на подлинность ОФС.1.2.2.0001.15 Взамен ст. ГФ XI, вып.1 Алюминий. Около 15 мг лекарственного средства растворяют
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ Общие реакции на подлинность ОФС.1.2.2.0001.15 Взамен ст. ГФ XI, вып.1 Алюминий. Около 15 мг лекарственного средства растворяют
Тема: «АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ ДИБЕНЗОДИАЗЕПИНА, 1,5-БЕНЗОТИАЗЕПИНА, ИМИНОСТИЛЬБЕНА, 10,11-ДИГИДРОДИБЕНЗОЦИКЛОГЕПТАНА»
 Тема: «АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ ДИБЕНЗОДИАЗЕПИНА, 1,5-БЕНЗОТИАЗЕПИНА, ИМИНОСТИЛЬБЕНА, 10,11-ДИГИДРОДИБЕНЗОЦИКЛОГЕПТАНА» Цель изучения темы: обобщить и систематизировать знания по методам
Тема: «АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ПРОИЗВОДНЫХ ДИБЕНЗОДИАЗЕПИНА, 1,5-БЕНЗОТИАЗЕПИНА, ИМИНОСТИЛЬБЕНА, 10,11-ДИГИДРОДИБЕНЗОЦИКЛОГЕПТАНА» Цель изучения темы: обобщить и систематизировать знания по методам
II. Практическая часть:
 Тема: Общие методы определения качества лекарственных средств. Определение внешнего вида (описание), растворимости, температуры плавления и плотности. Приготовление титрованных растворов, индикаторов и
Тема: Общие методы определения качества лекарственных средств. Определение внешнего вида (описание), растворимости, температуры плавления и плотности. Приготовление титрованных растворов, индикаторов и
(срок реализации - 1год, возраст детей лет)
 МБОУ «Лашманская СОШ» Черемшанского МР РТ ДОПОЛНИТЕЛЬНАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ОБЩЕРАЗВИВАЮЩАЯ ПРОГРАММА «Юный химик» на 2016-2017 уч. год (срок реализации - 1год, возраст детей 15-17 лет) Руководитель Сибгатуллина
МБОУ «Лашманская СОШ» Черемшанского МР РТ ДОПОЛНИТЕЛЬНАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ОБЩЕРАЗВИВАЮЩАЯ ПРОГРАММА «Юный химик» на 2016-2017 уч. год (срок реализации - 1год, возраст детей 15-17 лет) Руководитель Сибгатуллина
«Химия для самых маленьких»
 Департамент образования города Москвы ГБОУ Гимназия 1504 Программа дополнительного образования «Химия для самых маленьких» Вводный уровень Направленность: естественно научная Тип программы: модифицированная
Департамент образования города Москвы ГБОУ Гимназия 1504 Программа дополнительного образования «Химия для самых маленьких» Вводный уровень Направленность: естественно научная Тип программы: модифицированная
docplayer.ru
Антоцианы - природные индикаторы | Социальная сеть работников образования
МУНИЦИПАЛЬНАЯ УЧЕБНО-ИССЛЕДОВАТЕЛЬСКАЯ
КОНФЕРЕНЦИЯ ШКОЛЬНИКОВ
«ЛОМОНОСОВСКИЕ ЧТЕНИЯ»
НАПРАВЛЕНИЕ: ХИМИЯ
ТЕМА
Антоцианы – природные индикаторы
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА
Выполнена учащейся 9 «б» класса
МОУ «Средняя общеобразовательная
школа №76», МО «Котлас»
Колтыриной Виктории
Научный руководитель:
учитель химии и биологии
МОУ «Средняя общеобразовательная
школа №76», МО «Котлас»
Архангельской области
Ковкова Наталья Сергеевна
Содержание
Глава 1 Введение……………..…………………………………………………………………...3
Глава 2. Основная часть …………………………………………………………………………..4
2.1. Природные индикаторы. Характеристика и классификация………………………………4
2.2. Биохимическая роль природных индикаторов……………………………………….…….6
Глава 3. Экспериментальная часть………...………………………………….………………….8
3.1. Определение наличия антоцианов в исследуемых объектах
3.2. Методика изготовления индикаторов из природного сырья…………………………………..8
3.3. Определение среды растворов моющих средств для посуды с помощью растительных индикаторов
3.3.
Заключение
Литература………………………………………………………………………………………....11
Приложение ………………………………………………………………………………………12
Глава 1. Введение
Природа – это уникальное творение Вселенной. Это мир красив, таинственен и сложен. Данная работа посвящена уникальным свойствам растений, которые не перестают удивлять человечество каждый раз.
Царство растений, во-первых, удивляет нас своим многообразием цветовых оттенков. Цветовая палитра настолько разнообразна, что невозможно сказать, сколько цветов и их оттенков существует в мире растений. Какова же структура растений? Что они содержат в себе? И каковы их свойства? Цвет растений определяется химическим составом клеточного содержимого каждого растения. А точнее, всему виной являются так называемые биофлавониды. Это химические природные соединения, придающие определенный цветовой оттенок и свойства любому растению. Поэтому биофлавонидов существует множество. К ним относятся антоцианы, ксантофиллы, каротиноиды, катехины, флавонолы, флавононы и другие.
В данной работе будут рассмотрены такие флавониды, как антоцианы. По литературным данным антоцианы содержатся в таких природных объектах как анютины глазки, малина, клубника, земляника, вишня, слива, краснокочанная капуста, черный виноград, свекла, черника, голубика, клюква и многие другие.
Актуальность темы заключается в том, что свойства растительных объектов могут быть использованы для применения в разных областях науки, таких как химия, биология и медицина.
Цель работы – с помощью исследования доказать наличие природных индикаторов – антоцианов в растительных объектах и изучить их свойства.
Задачи исследования:
1) Исследовать природные объекты на наличие индикаторов – антоцианов;
2) Доказать индикаторные свойства растительных пигментов – антоцианов;
3) Выявить значение и биохимическую роль природных объектов, содержащих антоцианы.
Объекты исследования: ягоды черники, клюквы, краснокочанная капуста свекла, морковь, черный чай, черный виноград.
Гипотеза исследования: если растения изменяют цвет в различных средах, то их можно использовать в качестве индикаторов
Методы исследования:
1. Изучение научной литературы. 2.Качественный анализ.
3. Наблюдение.
Глава 2. Основная часть
2.1. Природные индикаторы. Характеристика и классификация.
С древности люди уделяли большое внимание наблюдениям за природой. И в наше время учение многих стран все больше и больше стали обращаться к природным индикаторам.
Пигменты многих растений способны изменять цвет в зависимости от кислотности клеточного сока. Поэтому растительные пигменты являются индикаторами, которые можно применять для исследования кислотности других растворов. Общее название природных пигментов флавониды. В эту группу входят каротиноиды, ксантофиллы, антоцианы, соответственно определяющие желтую, оранжевую, красную, синюю, фиолетовую окраску растений.
Антоцианы - природный индикатор.
Антоцианы – это природный краситель из группы флавонидов.
Известно большое количество объектов, богатыми антоцианами. Это малина, клубника, земляника, вишня, слива, краснокочанная капуста, черный виноград, свекла, черника, голубика, клюква и многие другие.
Антоцианы придают фиолетовый, синий, коричневый, красный или оранжевый цвета плодам. Такое многообразие объясняется тем, что цвет изменяется в зависимости от баланса кислот и щелочей.
Строение антоцианов установлено в 1913 году немецким биохимиком Р. Вильштеттером. Первый химический синтез осуществлен в 1928 году английским химиком Р.Робинсоном. Разнообразие окраски объясняется не только особенностями их строения, но и образованием комплексов с ионными К (пурпурная соль), Мg и Са (синяя соль), а также адсорбцией на полисахаридах. Образованию антоцианов благоприятствуют низкая температура, интенсивное освещение.
Антоцианы обладают хорошими индикаторными свойствами: в нейтральной среде приобретают пурпурную окраску, в кислой среде – красный цвет, в щелочной среде – зелено-желтый цвет.
Антоцианы очень часто определяют цвет лепестков, плодов и осенних листьев. Они обычно придают фиолетовую, синюю, коричневую, красную окраску. Эта окраска часто зависит от рН клеточного содержимого, и потому может меняться при созревании плодов, отцветании цветков в процессах, сопровождающихся закислением клеточного сока.
Растения с повышенной концентрацией антоцианов популярны в ландшафтном дизайне.
Многие считают, что цвет осенних листьев (включая красный цвет) просто результат разрушения хлорофилла, который маскировал уже имевшиеся желтые, оранжевые и красные пигменты (каротиноид, ксантофилл и антоциан, соответственно). И если для каротиноидов и ксантофиллов это действительно так, то антоцианы не присутствуют в листьях до тех пор, пока в листьях не начнет снижаться уровень хлорофиллов. Именно тогда растения начинают синтезировать антоцианы.
К сожалению, почти у всех природных индикаторов есть серьезный недостаток: их отвары довольно быстро портятся – скисают или плесневеют. Другой недостаток – слишком широкий интервал изменения цвета. При этом трудно или невозможно отличить, например, нейтральную среду от слабокислой или слабощелочную от сильнощелочной.
2.2. Биохимическая роль индикаторов.
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких сред, следить за изменением их состава или за протеканием химической реакции.
Как уже было сказано, общее название всех природных пигментов, природных индикаторов – флавониды.
Флавониды - гетероциклические соединения. В зависимости от структуры и степени окисления делятся на антоцианы, катехины, флавонолы, флавононы, каротиноиды, ксантофиллы и т. д. Находятся в растениях в свободном состоянии и в виде гликозидов (исключение - катехины).
Антоцианы – это биофлавониды, придающие плодам фиолетовую, синюю, коричневую, красную окраску.
Поступая в организм человека с фруктами и овощами, антоцианы проявляют действие, схожее с витамином Р, они поддерживают нормальное состояние кровяного давления и сосудов, предупреждая внутренние кровоизлияния. Антоцианы требуются клеткам головного мозга, улучшают память.
Антоцианы – мощные антиоксиданты, которые сильнее в 50 раз витамина С. Многие исследования подтвердили пользу антоцианов для зрения. Наибольшая концентрация антоцианов содержится в чернике. Поэтому препараты, содержащие чернику, наиболее востребованы в медицине.
Так как антоцианы обладают хорошими индикаторными свойствами, то их можно применять как индикаторы для идентификации кислотной, щелочной или нейтральной среды, как в химии, так и в быту.
Глава 3. Экспериментальная часть.
В качестве природных индикаторов были отобраны ягоды черники, клюквы, краснокочанная капуста, свекла, морковь, черный чай, черный виноград.
3.1. Определение наличия антоцианов в исследуемых объектах.
Зная о способности антоцианов изменять свою окраску в различных средах, можно доказать их присутствие или опровергнуть. Для этого необходимо исследуемый материал порезать или потереть, затем прокипятить, так как это приводит к разрушению мембран клеток, и антоцианы свободно выходят из клеток, окрашивая воду. Растворы наливают в прозрачную посуду и добавляют в одну порцию раствор соды, а в другую наливают уксус. Если окраска изменится под их воздействием, значит продукты содержат антоцианы и они особенно полезны. Результаты определения занесены в таблицу 1 (приложение 1)
3.1. Методика изготовления индикаторов из природного сырья
Для приготовления растительных индикаторов взяла по 50 г сырья, измельчила, залила 200 мл воды и прокипятила в течение 1-2 минут. Полученные отвары были охлаждены и профильтрованы. С целью предохранения от порчи, в полученный фильтрат добавила спирт в соотношении 2:1.
Получив таким образом растворы индикаторов, я проверила, какую окраску они имеют в разных средах.
Брала пипеткой несколько капель самодельного индикатора и добавляла их поочередно в кислый или щёлочной растворы. Результаты всех этих опытов записывала в таблицу 1 (Приложение 2).
3.2. Определение среды растворов моющих средств для посуды с помощью растительных индикаторов
При использовании моющих средств для посуды, имеющих щелочную и нейтральные среды, мы нарушаем нормальную кислотную среду кожи рук.
С помощью приготовленных растворов природных индикаторов можно проверить, какую среду имеют различные моющие средства для посуды.
Результаты определения занесены в таблицу 3.
Таблица 3. Реакция среды растворов моющих средств для посуды.
«Fairy» | «Капля» | Среда раствора | |
ягоды черники | |||
Ягоды клюквы | |||
Краснокочанная капуста | |||
Свекла | |||
Морковь | |||
Черный чай | |||
Черный виноград |
Обычный чай можно использовать в домашних условиях как индикатор. Вы замечали, что чай с лимоном гораздо светлее, чем без лимона. В кислой среде он обесцвечивается, а в щелочной становится более темным.
чай нейтральная среда чай в кислой и щелочной среде
Заключение
Проведя исследовательскую работу, я пришла к следующим выводам:
- многие природные растения обладают свойствами кислотно-основных индикаторов, способных изменять свою окраску в зависимости от среды, в которую они попадают;
- растворы растительных индикаторов можно использовать, например, в качестве кислотно-основных индикаторов для определения среды растворов моющих средств для посуды в домашних условиях;
- моющие средства для посуды «Fairy», «Мила» имеют нейтральную среду; «Капля» - слабощелочную среду и при их применении необходимо использовать резиновые перчатки для защиты кожи рук от негативного воздействия, так как щелочная и нейтральная среды разрушает кислотную мантию эпидермиса;
- самодельные индикаторы из природного сырья можно применять на уроках химии в сельских школах, если существует проблема обеспечения школы химическими индикаторами.
По результатам нашего исследования были доказаны индикаторные свойства исследуемых объектов . Причем ,здесь наблюдается следующая закономерность – все данные природные объекты в кислотной среде преимущественно окрашиваются в красный цвет, а в щелочной среде – в зелено-желтый. И это доказывает, что они действительно содержат антоцианы. Данное исследование нам показало, что в природе существуют такие растительные объекты, которые меняют свою окраску в зависимости от кислотности среды. Поэтому мы можем назвать их природными индикаторами.
Рекомендации
- Природные индикаторы можно использовать на уроках химии, элективных курсах.
- Растительные индикаторы можно использовать в быту. Сок столовой свеклы в кислой среде изменяет свой рубиновый цвет на ярко-красный, а в щелочной – на желтый. Зная свойство свекольного сока, можно сделать цвет борща ярким. Для этого к борщу следует добавить немного столового уксуса или лимонной кислоты.
- Для определения состава лекарств, которые употребляют для лечения, можно использовать природные индикаторы. Многие лекарственные препараты представляют собою кислоты, соли и основания. Изучив их свойства, можно обезопасить себя. Например, аспирин (ацетилсалициловая кислота), многие витамины нельзя принимать на голодный желудок, так как кислоты, входящие в их состав, будут повреждать слизистую желудка.
- Результаты исследовательской работы можно использовать для определения рН (водородный показатель) различных растворов, например, молочных продуктов, бульонов, лимонада и других, а также для определения кислотности почвы, так как на одной и той же почве в зависимости от ее кислотности один вид растений может давать высокий урожай, а другие будут угнетенными.
- Работу с природными индикаторами можно продолжить, исследуя индикаторные свойства других растений.
Литература.
1. Ветчинский К.М. Растительный индикатор.М.: Просвещение, 2002. – 256с.
2. Вронский В.А. Растительный индикатор. - СПб.: Паритет, 2002. – 253с.
3. Галин Г.А. Растения помогают геологам. – М.: Наука, 1989. - 99с.
4. Зацер Л.М. К вопросу об использовании растений-индикаторов в химии. – М.: Наука, 2000. – 253с.
5. Леенсон И.А. Занимательная химия: 8-11 классы. - М.: Просвещение, 2001. – 102с.
6. Соколов В.А. Природные красители.М.: Просвещения, 1997.
7. Журнал « Химия в школе» №2, №8 – 2002 год.
8. http://festival. 1september.ru.
9. alchemic.ru «Добрые советы».
Приложение 1
Таблица 1. Определение наличия антоцианов в исследуемых объектах.
Приложение 2
Таблица 1. Изменение окраски природных индикаторов в различных средах.
Сырье для приготовления индикатора | Естественный цвет индикатора | Окраска в кислой среде | Окраска в щелочной среде |
ягоды черники | Коричневый | Коричневый | Темно-коричневый |
Ягоды клюквы | Красно-коричневый | Красно-малиновый | Зеленый |
Краснокочанная капуста | Красно-оранжевый | Оранжевый | Темно-желтый |
Свекла | Темно-оранжевый | Желтый | Темно-красный |
Морковь | Сине-фиолетовый | Красный | Зеленый |
Черный чай | Темно-зеленый | Розовый | Зеленый |
Черный виноград | Коричневый | Красный | Темно - коричневый |
nsportal.ru
Природные кислотно-основные индикаторы

Разделы: Химия
Цель:
- Рассмотреть историю открытия некоторых кислотно-основных индикаторов.
- Изучить методику приготовления природных индикаторов.
- Определить экспериментальным путем возможность использования природных индикаторов для определения среды некоторых бытовых растворов.
- Развитие и укрепление интереса к предмету.
- Совершенствование экспериментальных умений и навыков, развитие опыта самореализации, положительной мотивации к обучению, опыта коллективного взаимодействия.
1. Теоретическая часть. Индикаторы (от английского indicate-указывать) - это вещества, которые изменяют свой цвет в зависимости от среды раствора. С помощью индикаторов качественно определяют реакцию среды. Впервые индикаторы обнаружил в 17 веке английский химик и физик Роберт Бойль. Чтобы понять, как устроен мир, Бойль провел тысячи опытов. Вот один из них. В лаборатории горели свечи, в ретортах что-то кипело, когда некстати зашел садовник. Он принес корзину с фиалками. Бойль очень любил цветы, но предстояло начать опыт. Он взял несколько цветков, понюхал и положил их на стол. Опыт начался, открыли колбу, из нее повалил едкий пар. Когда же опыт кончился, Бойль случайно взглянул на цветы, они дымились. Чтобы спасти цветы, он опустил их в стакан с водой. И – что за чудеса- фиалки, их темно- фиолетовые лепестки, стали красными. Случайный опыт? Случайная находка? Роберт Бойль не был бы настоящим ученым, если бы прошел мимо такого случая. Ученый велел готовить помощнику растворы, которые потом переливали в стаканы и в каждый опустили по цветку. В некоторых стаканах цветы немедленно начали краснеть. Наконец, ученый понял, что цвет фиалок зависит от того, какой раствор находится в стакане, какие вещества содержатся в растворе. Затем Бойль заинтересовался, что покажут не фиалки, а другие растения. Эксперименты следовали один за другим. Лучшие результаты дали опыты с лакмусовым лишайником. Тогда Бойль опустил в настой лакмусового лишайника обыкновенные бумажные полоски. Дождался, когда они пропитаются настоем, а затем высушил их. Эти хитрые бумажки Роберт Бойль назвал индикаторами, что в переводе с латинского означает «указатель», так как они указывают на среду раствора. Именно индикаторы помогли ученому открыть новую кислоту - фосфорную, которую он получил при сжигании фосфора и растворении образовавшегося белого продукта в воде. В настоящее время на практике широко применяют следующие индикаторы: лакмус, фенолфталеин, метиловый оранжевый.
Одним из давно известных индикаторов является лакмус. Хотя лакмус уже в течение нескольких столетий, верно, служит людям, его состав так до конца и не изучен. Лакмус- это сложная смесь природных соединений. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолетовой краски- заменителя дорогостоящего пурпура. Затем рецепт приготовления лакмуса был утерян. Лишь в начале 14 века во Флоренции вновь была открыта фиолетовая краска орсейль, тождественная лакмусу, причем способ ее приготовления в течение многих лет держали в секрете.
Готовили лакмус из специальных видов лишайников. Измельченные лишайники увлажняли, а затем добавляли в эту смесь золу и соду. Приготовленную таким образом густую массу помещали в деревянные бочки, добавляли мочу и выдерживали долгое время. Постепенно раствор приобретал темно- синий цвет. Его упаривали и в таком виде применяли для окрашивания тканей. В 17 веке производство орсейли было налажено во Фландрии и Голландии, а в качестве сырья использовали лишайники, которые привозили с Канарских островов.
Похожее на орсейль красящее вещество было выделено в 17 веке из гелиотропа - душистого садового растения с темно- лиловыми цветками. Именно с этого времени, благодаря Р. Бойлю, орсейль и гелиотроп стали использовать в химической лаборатории. И лишь в 1704 году немецкий ученый М. Валентин назвал эту краску лакмусом.
Сегодня для производства лакмуса измельченные лишайники сбраживают в растворах поташа (карбоната калия) и аммиака, затем в полученную смесь добавляют мел и гипс.
В 19 веке на смену лакмусу пришли более прочные и дешевые синтетические красители, поэтому использование лакмуса ограничивается лишь грубым определением кислотности среды. На смену лакмусу в аналитической химии пришел лакмоид - краситель резорциновый синий, который отличается от природного лакмуса и по строению, но сходен с ним по окраске: в кислой среде он красный, а в щелочной - синий.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины 19 века. Индикатор метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной – оранжевый, а в щелочной – синий.
Более яркая цветовая гамма свойственна индикатору тимоловому синему: в кислой среде он малиново-красный, в нейтральной – желтый, а в щелочной – синий. Индикатор фенолфталеин (в медицинской практике его раньше называли пургеном, сейчас редко применяют в качестве слабительного) в кислой и нейтральной среде – бесцветен, а в щелочной имеет малиновую окраску. Поэтому фенолфталеин используют лишь для определения щелочной среды. В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зеленый (его спиртовой раствор используется как дезинфицирующее средство – зеленка). В сильнокислой среде его окраска желтая, а в сильнощелочной среде раствор обесцвечивается.
Однако в последнее время в лабораторной практике используется универсальный индикатор- смесь нескольких индикаторов. Он позволяет легко определить не только характер среды, но и значение кислотности (рН) раствора.
2. Экспериментальная. Далее детям предлагается исследовать природные вещества на предмет создания и выявления методики приготовления индикаторов из природных веществ.
Для установления методики приготовления растительных индикаторов дети изучали и исследовали соки ярко окрашенных плодов и ягод, клеточный сок лепестков цветков разных растений, таких как: ромашки, шиповника, календулы, свеклы, пиона, черники, черной смородины, чая, отвар коры дуба, брюссельской капусты. Наилучшие результаты были получены при использовании следующих растений: черники и смородины.
Методика приготовления самодельных растительных индикаторов.
- Приготовили отвар из сока ягод черники или черной смородины.
- К 30 г. ягод добавили 1 столовую ложку горячей воды.
- Довели раствор до кипения.
- Охладили, дали раствору отстояться.
- Отфильтровали. Для фильтрования использовали воронку, приготовленную из пластмассовой бутылки и фильтровальную бумагу.
- Нарезали фильтровальную бумагу.
- Пропитали полоски фильтровальной бумаги приготовленным отваром.
- Высушили полоски, не допуская попадания яркого свет.
- Хранили приготовленные индикаторные бумажки в темной посуде.
- Испытали действие приготовленных индикаторов в стандартных кислотно- основных растворах: уксусной кислоты и соды.
вещества |
Раствор уксусной кислоты |
Раствор соды |
черника |
красный |
синий |
Черная смородина |
красный |
синий |
- Приготовленные индикаторы использовали для определения среды разных бытовых растворов: растворов мыла, зубной пасты, сока, кефира, молока, шампуня. Сделали вывод о среде этих растворов. Результаты занесите в таблицу.
Вещества |
Цвет |
Характер среды |
|
|
|
- Проанализируйте результаты полученных исследований. Сделайте выводы.
Литература.
- А.А. Карцова. Химия без формул или знакомые незнакомцы.Авалон, Азбука-классика, СПб.-2005.
- Г.И.Штремплер. Домашняя лаборатория. ( Химия на досуге). М., Просвещение, Учебная литература.- 1996.
- Химия: Энциклопедия для детей.- М.: Аванта+, 2000.
- О.С.Габриэлян. Настольная книга учителя. Химия.8 класс, Дрофа, М.-2002.
- Б.Д.Степин, Л.Ю. Аликберова. Книга по химии для домашнего чтения., М. Химия.-1995
xn--i1abbnckbmcl9fb.xn--p1ai











