Питательные среды и их классификация (стр. 1 из 2). Питательная среда для микроорганизмов и растений
Среды питательные в микробиологии
Исследования бактерий требуют скрупулезной работы с многочисленным оборудованием и инструментарием. Чтобы микроорганизмы в лабораторных условиях максимально быстро размножались и могли поддерживать нормальную жизнедеятельность, используются специальные среды питательные. Их состав и биофизические условия подходят для активного роста бактериальной культуры.
Питательные среды. Микробиология и другие области применения
Колонии бактерий в лабораторных условиях выращиваются на чашках Петри, которые заполнены желеобразным или полужидким содержимым. Это и есть среды питательные, состав и свойства которых максимально приближены к естественным для качественного роста культуры.
Применяются такие среды в микробиологических исследованиях и в медицинских диагностических лабораториях. Последние ведут работу чаще всего с мазками патогенных или условно-патогенных бактерий, систематические положение которых определяются непосредственно в учреждении.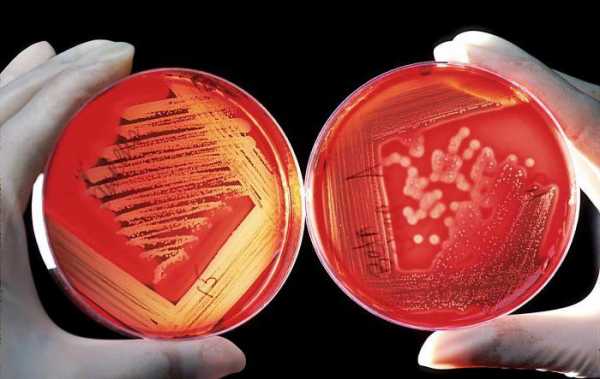
Естественные и синтетические среды
Основное правило работы с бактериями – это правильный подбор питательной среды. Она должна подходить по многочисленным критериям, среди которых содержание микро- и макроэлементов, ферментов, постоянное значение кислотности, осмотического давления и даже процент кислорода в воздухе.
Среды питательные классифицируются на две большие группы:
- Естественные среды. Готовятся такие смеси из природных компонентов. Это может быть речная вода, части растений, навоз, овощи, растительные и животные ткани, дрожжи и т. д. Такие среды характеризуются высоким содержанием природных химических веществ, многообразие которых способствует росту культуры бактерий. Несмотря на такие очевидные преимущества, естественные среды не позволяют вести специализированные исследования с конкретными штаммами бактерий.
- Синтетические среды. Они отличаются тем, что их химический состав известен в точных соотношениях всех составляющих. Такие среды готовятся для определенной культуры бактерий, метаболизм которой заранее известен исследователю. Собственно, по этой причине возможно приготовить подобную синтетическую среду для развития микроорганизмов. Применяются они для анализа жизнедеятельности бактерий. Например, можно узнать, какие вещества они выделяют в окружающую среду и сколько. На естественных средах микроорганизмы также будут расти, но отслеживать какие-то количественные изменения в составе невозможно из-за незнания изначальных пропорций веществ.

Дифференциально-диагностические среды
В работе с бактериями могут использоваться не только обычные питательные среды. Микробиология – обширная наука, и поэтому при проведении исследования иногда нужно сделать отбор микроорганизмов по какому-либо признаку. Использование дифференциально-диагностических сред в лаборатории дает возможность отобрать нужные колонии бактерий на чашке Петри по биохимическому признаку их жизнедеятельности.
В состав таких сред всегда входят следующие компоненты:
1. Питательные элементы для роста клеток.
2. Анализируемый субстрат (вещество).
3. Индикатор, который будет давать характерную окраску при протекании определенной реакции.
Примером может служить дифференциально-диагностическая среда питательная «Эндо». Она используется для отбора колоний бактерий, которые могут расщеплять лактозу. Изначально такая среда имеет розоватую окраску. Если колония микроорганизмов не способна расщеплять лактозу, она принимает обычный белый цвет. Если же бактерии могут расщеплять этот субстрат, они окрашиваются в характерный ярко-красный цвет.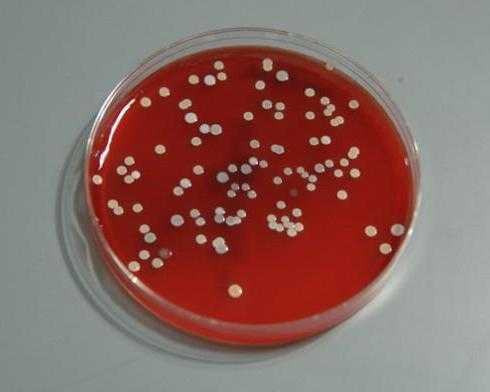
Элективные среды
В диагностических лабораториях часто ведется работа с мазками, в которых содержится много различных видов бактерий. Очевидно, что для качественной работы необходимо каким-то образом отобрать нужные нам колонии из десятков посторонних. Здесь может помочь питательная среда для бактерий, состав которой идеально подобран для жизнедеятельности только одного вида микроорганизмов.
Например, такая элективная среда пригодна только для размножения кишечной палочки. Тогда из посева множества бактерий на чашке Петри мы увидим только колонии той самой кишечной палочки и никакие больше. Прежде чем приступать к работе, необходимо хорошо знать метаболизм исследуемой бактерии, чтобы удачно ее отобрать из смеси других видов.
Твердые, полужидкие и жидкие питательные среды
Бактерии могут выращиваться не только на твердых субстратах. Среды питательные отличаются между собой по агрегатному состоянию, что зависит от состава при изготовлении. Изначально все они имеют жидкую консистенцию, а при добавлении желатина или агара в определенном процентном соотношении смесь застывает.
Жидкие питательные среды обычно находятся в пробирках. Если появляется необходимость выращивать бактерии в таких условиях, добавляют раствор с пробой культуры и ждут 2-3 суток. Результат может быть различным: выпадает осадок, появляется пленка, плавают мелкие хлопья или образуется мутный раствор.
Плотная питательная среда часто используется в микробиологическом исследовании для изучения свойств колоний бактерий. Такие среды всегда прозрачные или полупрозрачные, чтобы была возможность правильно определить цвет и форму культуры микроорганизмов.
Приготовление питательных сред
Очень просто готовятся такие субстраты, как мясопептонные смеси на основе бульона, желатина или агара. Если нужно сделать твердый или полужидкий субстрат, в жидкость добавляют соответственно 2-3% или 0,2-0,3% желатина или агара. Они играют главную роль в затвердевании смеси, но никак не являются источником питательных веществ. Таким образом, и получают среды питательные, которые пригодны для роста бактериальной культуры.
fb.ru
Питательные среды для культивирования микроорганизмов
Все питательные среды являются собой смесью необходимых веществ обеспечивающих для успешного культивирования микроорганизмов. На сегодняшний день используются довольно большое разнообразие биологических сред на которых выращиваются прокариотические клетки.
 Основные требования, предъявляемые к средам культивирования:
Основные требования, предъявляемые к средам культивирования:
- Полноценная среда для культивирования обязательно должна вмещать простые, быстро усваиваемые вещества, нужные для обеспечения метаболических и энергетических нужд микробов. При культивировании микроорганизмов в среды обычно добавляют факторы роста. К ним относятся нужные аминокислоты, витамины, а также те элементы, которые клеточный организм не в состоянии вырабатывать самостоятельно;
- Питательная среда обязательно должна иметь нужную (оптимальную) кислотность (pH), т. е. содержать нужный состав водородных ионов, влияющих на транспортные процессы клеточной мембраны и позволяющей клетке усваивать полезные вещества, которые находятся в среде. Для опасных штаммов хорошо подходит слабощелочная среда, за исключением возбудителя холеры. Здесь необходимы щелочные условия питательной среды (pH 8,5—9,0) и палочки Коха (ей необходима слабокислая среда (pH 6,2—6,8)). Чтобы в период культивирования отходы метаболизма микробов не изменяли кислотность среды, в ней непременно обязаны быть вещества, которые могут нивелировать такие выделения, таким образом питательная среда должна характеризоваться необходимой буферностью.
- Питательные среды для культивирования микроорганизмов должны быть изотонными. Это означает, что осмотическое давление в используемой среде обязано быть таким же, как и в цитоплазме клетки. Большинство оптимальных сред соответствует полупроцентному раствору поваренной соли;
- Обладать стерильностью во избежание попадания в питательную среду некультивируемых микробов. Они будут менять физико-химические показатели среды и загрязнять выращиваемую культуру;
- Среда для культивирования должна определенным образом быть увлажнена и обладать соответствующей для данного штамма консистенцией;
- Иметь достаточный окислительно-восстановительный потенциал. Это означает, что должен быть выдержан баланс между элементами, принимающими и отдающими свободные электроны, который выражается индексом Rh3. Так для бактерий развивающихся в кислородной среде пригодны параметры где Rh3 не меньше 10, а для анаэробных подойдут обстоятельства при Rh3, не больше 5;
- В среде для культивирования необходимо создать унифицированные условия, при которых будут сохраняться постоянные количества нужных веществ.
- Среду нужно сделать максимально прозрачной, что значительно облегчает отслеживание процесса развития микроорганизмов и облегчает своевременное обнаружение загрязнений среды другими (некультивируемыми) штаммами.
Классификация сред для культивирования
Все питательные среды для культивирования микроорганизмов классифицируют следующим образом:
- По оригинальным элементам, составляющим основу: Натуральные среды. Изготавливаются на основе естественной продукции растительного или животного происхождения. Первоначальными материалами могут служить: костная мука, кровь, мясо, дрожжи и так далее. Не натуральные или синтетические среды. Это питательные среды, сделанные только из химических веществ, при соблюдении точных пропорций, растворенных в очищенной или дистиллированной воде;
- По консистенции среды для культивирования различают: Жидкие, Полужидкие, Плотные. Для изготовления полужидких и плотных сред применяют агар-агар. Его добавляют в заранее приготовленную жидкую среду, доводя ее до необходимой консистенции. Для этих целей часто применяют желатин. Следует заметить, что есть ряд бактерий, использующих для питания желатин, при этом их деятельность приводит к тому, что питательная среда постепенно разжижается по мере развития колонии. Для создания плотных сред отлично подходит коагулированный яичный или молочный протеин.
- В зависимости от состава питательные среды делят на простые и сложные. К простым причисляют мясной бульон и питательный желатин. Для получения сложной среды для культивирования к простой примешивают разные полезные для микробов вещества, например, аминокислоты, витамины, микроэлементы и т. д.
- В зависимости от предназначения среды разделяют на: Основные. Самые распространенные простые питательные среды, которые используются для выращивания многих видов прокариот. Они также применяются для культивирования некоторых штаммов, не прорастающих на простых средах. Элективные. Иное их название – избирательные. Данные среды применяют для выращивания определенных штаммов микробов для их выявления. При этом сопутствующие популяции бактерий будут подавляться благодаря добавлению в среду ингибирующих соединений, не влияющих на культивируемую культуру. Например, это могут быть соли металлов или антибиотики. Средами накопления именуют жидкие избирательные среды. Дифференциально-диагностические. Здесь главную роль играют ферментативные особенности культивируемых бактерий, которые в этой среде помогают определить один вид микроорганизма от иного. Консервирующие. Название говорит само за себя. Такие питательные среды применяют для посева, хранения или транспортировки микробиологической культуры.
Основные особенности изготовления питательных сред
Среды для культивирования необходимо приготовлять в чистой простерилизованной посуде. В качестве основного сырья используют растительные и животные исходные продукты, а также заранее приготовленные в лаборатории полуфабрикаты.
Сначала среду варят. Затем проверяют ее кислотность. Для этого используют индикаторную бумагу, а для более точных данных пользуются лабораторными приборами, например, потенциометром. Поскольку во время стерилизации кислотность питательной среды несколько уменьшается, изначально ее делают несколько основной. После этого делают осветление среды. Для этой процедуры используют сыворотку крови или яичный белок, поскольку при варке питательная среда может затемняться.
Потом питательную среду отфильтровывают при помощи фильтровальной бумаги или ватно-марлевого фильтра. Полученную среду размещают в чашках Петри или пробирках и ставят на стерилизацию. По окончании описанных манипуляций питательная среда обязана пройти необходимый контроль.Для проверки стерильности среда помещается на 48 часов в термостат. В случае если приготовленная среда стерильна на ней ничего не вырастет. Химический контроль подразумевает определение окончательной кислотности, концентрации содержащегося в ней азота и хлоридов. Последним проводится биологический контроль. Он представляет собой засев культурой. По ее развитию определяется питательность среды. После всех совершенных процедур получают готовую среду пригодную для культивирования микроорганизмов.
phct-biotechnology.ru
Питательные среды для бактерий
Содержание:
Введение
Типы питательных сред
Жидкие питательные среды
Твердые питательные среды
Заключение
Список литературы
Под питательными средами подразумевают различного рода субстраты, приготовляемые для изучения жизнедеятельности микроорганизмов при определенных условиях, изменяемых по воле экспериментатора. Микрохимические анализы и опыты искусственной культуры выяснили потребность бактерий в питательных веществах. Согласно этим указаниям и составляются питательные среды. Существенным условием при этом является определенное содержание воды . Сухие органические вещества не заселяются микробами; соление консервирует мясо, отнимая у него известное количество воды. Первенствующее значение для жизнедеятельности микроорганизмов имеет затем реакция питательной среды; для большинства бактерий она должна быть нейтральной или слабощелочной , рост холерного вибриона прекращается уже при слабокислой реакции. Вас. erythosporus и micrococcus aquatilis размножаются даже в дистиллированной, 2 раза перегнанной воде, удовлетворяясь, очевидно, тем ничтожным количеством органических веществ, какое содержится и в чистой перегнанной воде, или, быть может, питаясь за счет азота и углерода атмосферного воздуха. Некоторые микроорганизмы заимствуют нужный им для питания азот из аммиачных или азотнокислых соединений, другие безусловно требуют наличности в питательной среде белковых веществ.
Большинство болезнетворных микроорганизмов хорошо растут в бульоне, мясопептонной желатине и на агаре; другие, наоборот, нуждаются в питательной среде (кровяной сыворотке, агаре, смазанном кровью, и т.п.), по составу своему приближающейся к составу тканей и соков животного организма.
Некоторые строго паразитные бактерии совершенно не выращиваются на мертвом субстрате, размножаясь лишь в организме живого существа и даже иногда определенного животного. До сих пор не удается культивировать на какой-либо искусственной питательной среде лепрозную палочку, некоторые слюнные бактерии, спирохету возвратной горячки и др.
Питательные среды бывают жидкие и твердые . Главное преимущество жидких сред заключается в возможно равномерном распределении в них зародышей; этим дается возможность всегда работать с точно отмеренным количеством бактерий, что особенно важно при опытах с впрыскиванием последних животным для изучения силы болезнетворного действия микрофитов. Разводка микроорганизма в жидкой среде, введенная в полое предметное стекло, дает нам возможность изучить непосредственно под микроскопом рост и деление клеток, образование микрофитом различных сочетаний, появление в нем спор и их прорастание. Бульонные культуры патогенных бактерий, освобожденные соответственной фильтрацией от живых зародышей, представляют чистые растворы продуктов вещественного обмена микроорганизмов, различного рода бактерийные яды (токсины), знакомство с которыми имеет первенствующее значение для уразумения сущности заразных болезней. Разводки в молоке, пептонной воде и др. дают нам ценные указания для биологической характеристики многих микроорганизмов, для отличия их друг от друга. Жидкими средами можно пользоваться, однако, лишь тогда, когда в распоряжении имеется уже чистая разводка того или другого микроорганизма; разъединение же зародышей, вылавливание одного из них из той смеси различнейших видов бактерий, которая встречается в окружающей нас природе, возможно лишь при помощи плотного субстрата, консистенция которого препятствует смешиванию между собой различных микроорганизмов, растущих здесь совершенно особняком и на надлежащем друг от друга расстоянии. Неожиданно быстрое развитие, достигнутое бактериологией в последние 10 - 15 лет, главным образом обязано введению Р. Кохом в бактериологическую технику твердых прозрачных субстратов. Питательные среды до посева исследуемого микроорганизма должны быть тщательно обеспложены, с целью устранения случайно поселившихся в них посторонних бактерий.
Мясопептон-бульон . 5 00 г мяса, освобожденного от жира, костей, сухожилий и апоневрозов и пропущенного через мясорубку, обливают литром дистиллированной воды, после чего смесь оставляется для полного выщелачивания в прохладном месте. Через сутки получившийся настой пропускают через несколько слоев марли, сильно выжимая при этом задерживаемое марлей мясо, до получения 1 литра мясной воды; к последней прибавляют 10 г пептона и 5 г поваренной соли и затем жидкость кипятят с 3 /4 часа на голом огне до полного свертывания всех нерастворимых белков, после чего она охлаждается и фильтруется. Полученный кислый бульон (свежее мясо обладает кислой реакцией) нейтрализуется едким натром до слабощелочной реакции, кипятится затем ровно 5 минут и в горячем виде отфильтровывается. Разливают готовый бульон в колбочки, пастеровские ballons-pipettes или в пробирки и стерилизуют нагреванием в коховском текучепаровом аппарате в течение 2 часов или в папиновом котле (при 115°) в течение 15 минут. Вместо мяса для приготовления мясопептон-бульона пользуются также готовым мясным экстрактом Либиха, что значительно упрощает дело. На 1 литр воды берут 30 г пептона, 5 г виноградного или тростникового сахара и столько же экстракта. Жидкость подвергается продолжительному кипячению и после полного охлаждения пропускается через толстый слой животного угля, насыпанного в обыкновенный фильтр из шведской бумаги. Этим путем удается получить прозрачный и неокрашенный субстрат. - Мясопептон-бульон употребляется или сам по себе, как прекрасная среда для питания и размножения многих сапрофитов и болезнетворных микроорганизмов, или как исходный материал для приготовления твердых субстратов. В бульонных разводках обращают внимание, остается ли жидкость в главной своей массе чистой, или она помутнела. Неподвижные бактерии, размножаясь в бульоне, опускаются на дно пробирки в виде облачка, хлопьев или порошковидного осадка; обладающие же самостоятельным движением вызывают равномерное помутнение жидкости, осаждаясь лишь впоследствии. Образование пленки на поверхности бульона позволяет в грубых чертах судить о степени потребности засеянного микроорганизма в кислороде. Прибавлением к бульону 6-8% глицерина получается среда, весьма благоприятная для бугорчатых палочек, разрастающихся здесь на поверхности в виде толстых, складчатых пленок; особенно пригоден для этой цели бульон (с глицерином), приготовленный из телячьих легких.
Пептонная вода. Многие микроорганизмы вырабатывают из белковых веществ ароматические основания - главным образом индол, отчасти также фенол, скатол и тирозин; другие (холерный вибрион) одновременно с индолом вырабатывают также и азотистые продукты. Индоловая реакция служит для отличия друг от друга некоторых бактерий. Она получается лишь при наличности в питательной среде пептонов; присутствие сахара вредит реакции, а потому для получения последней пользуются чистым раствором панкреатического пептона или, что проще, нейтрализованным раствором пептона (1%) и поваренной соли (0,5%) в воде.
Молоко весьма часто употребляется для испытания способности микроорганизма разлагать молочный сахар с выделением кислот (молочной, уксусной и др.), свертывающих молоко; одни микроорганизмы свертывают молоко, другие этой способностью не обладают. Молоко, даже только что выдоенное, весьма нередко содержит споры, упорно противостоящие высокой температуре, а потому обеспложивание его требует особенной тщательности. Нагревают его 1 /4 часа в автоклаве при 120°; но так как вследствие карамелизации сахара при такой высокой температуре оно нередко буреет и вообще несколько изменяется в своих свойствах, то рациональнее стерилизовать молоко четыре дня подряд, по 1 /2 часа, в коховском текучепаровом аппарате.
Молочную сыворотку предложил Petruschky для определения количества вырабатываемых бактериями свободных щелочей и кислот. Совершенно свежее молоко, разбавленное равным объемом воды, слегка нагревается, после чего к нему прибавляют разведенной соляной кислоты в количестве, достаточном для выпадения казеина, который затем отфильтровывается. Жидкость нейтрализуется содой, нагревается часа 2 в аппарате Коха и снова фильтруется от выпадающего при нагревании последнего остатка казеина. Получающаяся сыворотка должна быть строго нейтральной реакции и прозрачна как вода, лишь с легким желтовато-зеленым оттенком. По прибавлении к жидкости чувствительной лакмусовой настойки ее разливают в пробирки совершенно одинакового размера и стерилизуют 3 дня подряд при 100°.
Безбелковые питательные растворы. Пастер еще в 1858 г. показал, что дрожжевые грибки для своего роста не нуждаются в белковых веществах, заимствуя, подобно зеленым растениям, нужный им азот из аммиака. Предложенная Пастером безбелковая жидкость изменена была Мейером, Коном, Ушинским и К. Френкелем. Раствор последнего (0,5% поваренной соли, 0,2% двуфосфорнокислого калия, 0,6% молочнокислого аммония, 0,1% аспарагина) дает весьма благоприятные условия для роста многих гнилостных и патогенных бактерий. Особенное место между безбелковыми питательными средами занимает жидкость Капальди и Проскауера, представляющая одно из драгоценнейших средств для отличия друг от друга брюшнотифозной палочки и bac. coli communis, как известно, сходных между собою по морфологическому характеру, неспособностью окрашиваться по Грамму и одинаковому росту на желатине и агаре. Жидкость эта готовится растворением в 100 куб. см воды 0,2 аспарагина, 0,2 маннита, 0,02 хлористого кальция и 0,02 двукислого фосфорнокислого натрия. Она нейтрализуется щелочью и после прибавления к ней лакмуса стерилизуется. Тифозная палочка для удовлетворения потребности в азоте безусловно нуждается в белковых веществах, а потому и не растет в этой жидкости и не изменяет ее реакции; кишечная же палочка менее требовательна к питательным средам, нужный ей для питания азот она берет из амидных соединений (аспарагина, креатина, сукцинамида и др.) и даже из аммиачных солей некоторых органических и минеральных кислот, а потому, в противоположность тифозной палочке, хорошо размножается в питательных средах Капальди и Проскауера и благодаря разложению маннита сообщает ей через 20 часов резко кислую реакцию.
mirznanii.com
Питательные среды
Известно очень много питательных сред для культивирования микроорганизмов (более двух тысяч наименований было классифицировано Левином и Шёнлейном еще в 1930 г.), но число ингредиентов, являющихся их неотъемлемыми компонентами, относительно невелико. Однако качественный диапазон этих сред весьма широк — от растворов неорганических солей, на которых могут расти автотрофы, до сложных питательных сред, приготавливаемых из мясных гидролизатов, обогащенных кровью или сывороткой; ими обычно пользуются для выделения патогенных микроорганизмов типа стрептококков, отличающихся высокой требовательностью к составу питательной среды. Различают два основных типа питательных сред: так называемые синтетические среды, главные составные части которых точно известны (например, глюкозо-солевая питательная среда), и эмпирически подобранные питательные среды природного происхождения, состав которых точно неизвестен (к ним относятся пептоны, приготавливаемые из частично гидролизованного белка).
Выбор питательной среды зависит в значительной степени от цели эксперимента. Герберт настойчиво высказывался за повсеместное использование синтетических питательных сред. Однако следует признать, что они обладают рядом практических неудобств. Микроорганизмы, выращенные на таких питательных средах, обычно фенотипически отличаются от выращенных на питательных средах естественного происхождения типа бульона (например, по составу и по скорости деления). Размножение микроорганизмов на таких средах обычно легче подавляется избыточной аэрацией или токсическими катионами; они также более чувствительны к нарушениям баланса между некоторыми составными частями питательной среды, особенно аминокислотами. Многие бактерии нуждаются в большом числе факторов роста, и для некоторых из них до сих пор не найдены искусственные среды, на которых они могли бы размножаться. Возможно, что все эти неудобства ее временем будут преодолены, но пока среды неизвестного состава типа бульонов, приготовленных из перевара, используются весьма широко, хотя они и вносят в эксперимент неконтролируемые факторы.
В состав сред, применяемых для выращивания бактерий, входят необходимые для построения белков цитоплазмы органогены: азоты, углерод, водород, кислород, неорганические соединения, содержащие фосфор, калий, серу, натрий, магний, железо, микроэлементы: кобальт, йод, марганец, бор, цинк, молибден, медь и др. Все перечисленные элементы должны находиться в питательной среде в удобоусвояемом для данного микроорганизма соединении, причем требования различных микробов в этом отношении неодинаковы. Потребность в кислороде и водороде бактерии удовлетворяют главным образом за счет поступающей в клетку воды. По характеру усвоения азота патогенные микроорганизмы делятся следующим образом: одни из них извлекают азот из простых аммонийных соединений, другие нуждаются в аминокислотах, третьи расщепляют высокомолекулярные вещества — пептоны, представляющие собой продукты неполного ферментативного переваривания белков. Строго паразитические виды бактерий размножаются только в присутствии нативного, т. е. неизмененного, белка. Источником углерода для бактерий являются главным образом различные углеводы: сахар, многоатомные спирты, органические кислоты и их соли. Потребность бактерий в неорганических элементах удовлетворяется прибавляемыми к питательной среде солями: NaCI, Kh3P04, K2HP04и т. д. Микроэлементы, выполняющие роль катализаторов химических процессов, необходимы в ничтожно малых количествах и поступают в питательную среду с пептоном, неорганическими солями и водой. Наряду с перечисленными органическими и неорганическими элементами бактерии нуждаются в ростовых факторах, которые по своей роли соответствуют витаминам для животных. Источником факторов роста являются прибавляемые к питательной среде продукты растительного и животного происхождения, содержащие в своем составе никотиновую, пантотеновую, парабензойную кислоты, витамины. Питательные вещества могут усваиваться микробами только при определенной реакции питательной среды, так как проницаемость оболочек микробных клеток изменяется в зависимости от рН среды. Потребность в питательных веществах и физических условиях у различных видов микробов неодинакова и этим исключается возможность создания универсальной питательной среды.
По консистенции различаютплотные и жидкиепитательные среды. Плотные питательные среды готовят из; жидких питательных сред посредством прибавления к ним клеевых веществ агара или желатина. Агар-агар (по-малайски желе) - продукт растительного происхождения, добываемый из морских водорослей. В воде агар-агар растворяется при температуре 80 - 86° С, застудневает при 36 - 40° С. Применение агаровых сред благодаря их способности сохранять плотность при температуре 37°С дало возможность выращивать патогенных микробов при оптимальной для большинства из них температуре на плотных средах. Желатин—вещество белковой природы животного происхождения. В теплой воде при температуре 32—34°С он набухает и растворяется, а при более низкой температуре превращается в студень. Однако при рН ниже 6,3 и выше 7,0 плотность желатина уменьшается, и он плохо застывает.
Требования, предъявляемые к питательным средам.Питательные среды должны:1. Содержать необходимые для питания микроба питательные вещества. 2. Иметь реакцию рН, оптимальную для выращиваемого вида микроба. 3. Иметь достаточную влажность, так как микробы питаются по законам диффузии и осмоса. 4. Обладать изотоничностью. 5. Быть стерильными, обеспечивая тем самым возможность выращивания чистых культур микробов.
Питательные среды подразделяются на среды общего назначения и специальные. К первой группе относятся мясопептонные: агар, бульон, питательный желатин. Среды общего назначения используют для выращивания многих патогенных микробов и применяют в качестве основы для приготовления специальных сред, добавляя к ним кровь, сахар, молоко, сыворотку и другие ингредиенты, необходимые для размножения того или иного вида микроба.К специальным питательнымсредам относятся элективные (избирательные) и дифференциально-днагностическне.
Элективные (избирательные) среды.Принцип создания элективных питательных сред основан на удовлетворении основных биохимических и энергетических потребностей того вида микроба, для культивирования которого они предназназначены. Определенный состав и концентрация питательных микроэлементов, ростовых факторов при строго значении рН обеспечивают оптимальные условия для выращивания одного или нескольких видов микроорганизмов. При посеве на них материала, содержащего смесь различных микроорганизмов, раньше всего будет проявляться рост того вида, для которого данная среда будет элективной.Дифференциально-диагностические среды. Дифференциально-диагностические питательные среды используют для определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ. По своему назначению дифференциально-диагностические питательные среды подразделяются следующим образом: 1. Среды для выявления протеолитической и гемолитической способности микробов, содержащие в своем составе белковые вещества: кровь, молоко, желатин и т. п. 2. Среды с индифферентными химическими веществами, которые служат источником питания для одних видов микробов и не усваиваются другими видами. 3. Среды с углеводами и многоатомными спиртами для обнаружения соответствующих ферментов. 4. Среды для определения редуцирующей способности микробов. В состав дифференциально-диагностических сред, предназначенных для выявления сахаролитических и окислительно-восстановительных ферментов, вводят индикаторы: нейтральную красную, метиленовый синий, лакмусовую настойку, кислый фуксин, бромтимоловый синий, водный голубой краситель и розоловую кислоту. Изменяя свою окраску при различных значениях рН, индикатор указывает на наличие или отсутствие расщепления, окисления или восстановления введенного в среду ингредиента. Однако индикатор не является обязательной составной частью сред, предназначенных для выявления ферментов. Так, наличие желатиназы и других протеолитических ферментов в культуре определяют по разжижению желатина, свернутого яичного или сывороточного белка.
Сухие питательные среды.Приготовление питательных сред — один из наиболее ответственных участков работы бактериологической лаборатории. В связи с этим биопромышленность выпускает стандартные, консервированные, сухие питательные среды, различного назначения, для культивирования микроорганизмов. Готовят среды по прописи, указанной на этикетке. Постоянство состава, стандартность среды, простота и удобство в работе, легкость транспортировки и хранения являются большим преимуществом сухих питательных сред. После установления соответствующего рН среду кипятят, фильтруют, осветляют, разливают во флаконы, пробирки и стерилизуют. Следует учитывать, что после стерилизации среда становится более кислой.
Стерилизация питательных сред.Стерилизацию питательных сред осуществляют различными способами в зависимости от тех ингредиентов, которые входят в их состав. 1. Синтетические среды и все агаровые среды, не содержащие в своем составе нативного белка и углеводов, стерилизуют 15—20 мин в автоклаве при температуре 115—120°С. 2. Среды с углеводами и молоком (в состав которого входит лактоза), питательный желатин стерилизуют текучим паром при температуре 100°С дробно или в автоклаве при 112° С. 3. Среды, в состав которых входят белковые вещества (сыворотка крови, асцитическая жидкость), обеспложиваются тиндализацией или фильтрованием. 4. Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры Зейтца. Подготовленные питательные среды проверяют на стерильность. Для этого их ставят в термостат при температуре 37° С. Среды, простерилизованные в автоклаве, выдерживают в термостате 1 сут, простерилизованные текучим паром -3 сут.
ЗАНЯТИЕ 6. Методы и техника культивирования микроорганизмов на питательных средах. Методы выделения чистых культур микроорганизмов. Изучение культуральных свойств микроорганизмов.
Цель занятия.Изучить способы посевов и пересевов микроорганизмов на питательные среды. Изучить методы выделения чистых культур микроорганизмов. Ознакомиться с формами колоний. Произвести посев культур микробов на МПБ и МПА (в пробирки), а также посев смеси микробных культур (для выделения чистых) методом рассева на чашки Петри с МПА.
Оборудование и материалы.Штативы, пробирки со средами, микробиологические петли, шпатели, пипетки, чашки Петри с МПА. Культуры микроорганизмов.
studfiles.net
Питательные среды для микроорганизмов приготовление стерилизация
Питательные среды — это субстраты, используемые для культивирования в искусственных условиях различных микроорганизмов. Питательные среды широко применяют в повседневной микробиологической практике для постановки лабораторного диагноза инфекционных заболеваний, для выделения микробов из различных предметов внешней среды с целью выяснения источников заражения, а также при эпидемиологическом обследовании людей и животных для выяснения носительства возбудителей инфекционных заболеваний. Питательные среды применяют также для получения микробных масс, используемых при приготовлении вакцин и диагностических антигенов, в производстве антибиотиков и пр.
Питательная среда, предназначенная для культивирования микробов, должна иметь оптимальные условия для их роста и размножения. С этой целью при создании питательных сред предусматривают наличие в них соединений, служащих источниками азота, углерода и водорода, набор необходимых ионов в виде неорганических солей. В ряде случаев в среду добавляют так называемые факторы роста, то есть соединения, которые не синтезируются культивируемым микробом (см. Бактериальные факторы роста). Но наличие в питательной среде всех указанных компонентов еще не может обеспечить оптимальные условия для роста и размножения микробов, так как эти процессы зависят также от физико-химических свойств среды. К ним относятся: рН, окислительно-восстановительный потенциал, вязкость, влажность и осмотические свойства.
Если питательная среда отвечает биологическим особенностям микроба и обеспечивает его рост и размножение, то ее называют оптимальной или полноценной, если же в ней не хватает какого-либо компонента, необходимого для роста и размножения микроба, такую среду характеризуют как дефицитную. Так как различные виды бактерий и даже штаммы, относящиеся к одному виду, могут значительно отличаться друг от друга по физиологии и характеру обмена веществ, то, естественно, что для их выращивания используют различные питательные среды.
Источником углерода в питательных средах служат углеводы, спирты и некоторые органические кислоты, источником азота — минеральные или органические соединения. Очень широко используют пептоны — продукты ферментативного или кислотного гидролиза белков различного происхождения и представляющие собой смесь аминокислот и полипептидов различной сложности. Различия в аминокислотном и пептидном составе пептонов зависят от свойств исходного белка и степени его расщепления. Питательная ценность пептона определяется его аминокислотным и пептидным составом.
Сырьем для изготовления пептонов служат белки мяса, рыбы, дрожжей, казеин и др. Наряду с пептонами как источниками азота в микробиологической практике применяют также мясную воду, которую для выращивания ряда бактерий приготовляют чаще из мяса животных. Для приготовления мясной воды мясо освобождают от костей, сухожилий и жира и перемалывают в мясорубке. Полученный фарш заливают холодной водопроводной водой (на 1 ч. фарша 2 ч. воды), хорошо размешивают и оставляют на сутки в прохладном месте. Мясной настой фильтруют через несколько слоев марли, кипятят и вновь фильтруют через бумажный фильтр, а затем доливают водой до исходного объема.
В пептонах, мясном настое или тканевых экстрактах, кроме органического азота, содержатся бактериальные факторы роста, и поэтому среды, приготовленные на их основе с добавлением соли (NaCl), пригодны для культивирования многих микроорганизмов. Однако для выращивания ряда патогенных микробов (дифтерийная палочка, возбудитель коклюша, бруцеллы и др.) мясопептонная питательная среда непригодна, и поэтому в этих случаях используют специальные среды, например яичные среды с сыворотками, кровью и пр.
В зависимости от свойств, состава и назначения питательные среды делят на группы. По консистенции различают питательные среды твердые, полужидкие и жидкие. Примером твердых сред являются 1,5—2% агаровые среды (мясо-пептонный агар, агар Хоттингера), питательная желатина, свернутая сыворотка, свернутый яичный белок, картофель и др. Для приготовления твердых питательных сред наиболее часто используют агар-агар, получаемый из морских водорослей. Агар-агар является веществом полисахаридной природы. В воде набухает, образуя студень. Разжижается при t° 70-100° и застывает при 40-50°.
Полужидкой средой является 0,5% агар мясо-пептонный (см.).
К жидким средам относят бульон мясо-пептонный (см.), пептонную воду сахарный бульон, бульон Хоттингера, представляющий собой разведенный (в 4—9 раз) мясной фильтрат, подвергшийся ферментативному гидролизу панкреатином и содержащий 0,5—1% поваренной соли.
Питательные среды бывают простые и сложные. Простыми средами являются пептонная вода, мясо-пептонный бульон, мясо-пептонный агар, питательная желатина. На основе простых сред готовят сложные (мясо-пептонный сахарный бульон, кровяной агар, асцит-агар и др.). Сложность той или иной питательной среды зависит от биологических особенностей выращиваемого микроба, а также от целей исследования. Так, например, для выращивания гемоглобинофильных бактерий используют сложную среду Борде — Жангу, в которой дефибринированную кровь человека или кролика добавляют к картофельно-глицериновому бульону или агару. Многие сложные питательные среды используют для выявления у культивируемого микроба специфических свойств, выражающихся в морфологии колоний, характере роста или в особенностях обмена веществ. Питательные среды, которые позволяют установить специфику микроба, называют дифференциально-диагностическими (см. Дифференциально-диагностические среды). Например, для выявления способности у бактерий расщеплять глюкозу с выделением ацетил-метил-карбинола (реакция Фогеса — Проскауэра) используют среду Кларка, в которой содержатся пептон, глюкоза, К2НРO4 и щелочь (КОН). Ацетил-метил-карбинол в присутствии щелочи и кислорода окисляется в диацетил, а последний, соединяясь с гуанидином, находящимся в пептоне, дает красное окрашивание.
Особую группу составляют селективные среды, в которых создаются наилучшие условия для выращивания определенного вида микробов и неблагоприятные для других видов, например среды Мюллера, Кауфмана, Лифсона, Шустовой для выделения кишечных бактерий, щелочной агар — селективная среда для холерного и холероподобных вибрионов, среды с добавлением антибиотиков дают возможность селекционировать антибиотикорезистентных бактерий от чувствительных. Из перечисленных сред широкое распространение имеет среда Кауфмана, используемая в качестве обогатительной среды для бактерий группы сальмонелл и брюшного тифа. Основными ингредиентами среды являются гипосульфитный бульон, бриллиантгрюн и желчь. Селективность для анаэробных микроорганизмов создается путем снижения в среде концентрации растворенного кислорода. Одной из распространенных питательных сред, используемых для выращивания анаэробов, является среда Китта — Тароцци, в которой роль адсорбента кислорода и редуцирующего фактора выполняют находящиеся в среде кусочки печени животных.
К сложным питательным средам относят также синтетические (см. Синтетические питательные среды). Своеобразие сред этой группы выражается в том, что все их компоненты являются химически чистыми соединениями, в отличие от ранее упоминавшихся сред, содержащих в качестве питательных субстратов продукты естественного происхождения (пептоны, кровь, асцитическая жидкость и пр.). Минимальные синтетические питательные среды содержат набор солей, а источником энергии служит глюкоза или молочная кислота, источником азота — аммонийные соли. Такие среды пригодны для выращивания прототрофных микробов. Ауксотрофные микробы, не способные синтезировать какое-либо из жизненно важных соединений (аминокислоту, витамины, пуриновое или пиримидиновое основание), культивируют на средах, содержащих, кроме набора солей, тот или иной дополнительный ингредиент, по которому данный микроб ауксотрофен. Например, если культивируемые бактерии не способны синтезировать триптофан или другую аминокислоту, то к солевой минимальной среде добавляют соответствующую аминокислоту. Обычно 1-аминокислоты вносят в концентрации 20 мкг/мл, а dl-аминокислоты — 50 мкг/мл. Синтетические питательные среды используют для изучения физиологии бактерий, в частности обмена веществ, и особенно при изучении некоторых проблем биохимической генетики. Синтетические питательные среды применяют и в селекции микробов для отбора ауксотрофных или прототрофных штаммов.
В лабораторных условиях для приготовления, хранения и розлива питательных сред используют бактериальные пробирки, плоскодонные колбы, флаконы и пр.
Для пластинчатых твердых сред применяют чашки Петри. В массовом микробиологическом производстве бактериальные культуры выращивают в металлических котлах (реакторы) большой емкости (500—1000 л).
В посуде, используемой для питательных сред, нельзя хранить дезинфицирующие вещества, антибиотики, так как малейшие их следы делают среду непригодной для выращивания микробов. Перед употреблением посуду тщательно моют и высушивают. Новую посуду предварительно кипятят в 1 % растворе соляной кислоты и промывают в проточной дистиллированной воде. Питательные среды обычно должны быть прозрачными, поэтому их до употребления фильтруют или отстаивают. Отстоявшиеся расплавленные агаровые среды фильтруют через ватно-марлевый фильтр (при фильтровании через вату качество среды может снизиться за счет адсорбции на ней соединений среды, стимулирующих рост микроба). Жидкие среды фильтруют через фильтровальную бумагу или полотно. Если агар после фильтрования или отстаивания остается мутным, то его осветляют, добавляя яичный белок или сыворотку из расчета на 1 л среды одно куриное яйцо или 20—25 мл сыворотки. Добавленные белки свертываются, адсорбируют взвешенные частицы и, оседая, просветляют среду. Готовые питательные среды разливают в соответствующую стерильную посуду и стерилизуют.
Стерилизация (см.) — это весьма ответственный этап приготовления питательных сред. Режим ее не должен изменять свойства сред. Наиболее распространена и эффективна стерилизация при помощи высокой температуры в автоклавах (см.) под давлением или текучим паром. Обычно питательные среды стерилизуют в автоклаве при 1 атм. (120,6°) в течение 15—30 мин., в отдельных случаях и при объемах среды, превышающих 1 л, — в течение 1—1,5 час. Указанным способом пользуются для стерилизации сред, не содержащих углеводы и нативные белки или другие термолабильные субстанции. При наличии в среде термолабильных субстанций пользуются бактериальными фильтрами или дробной стерилизацией. При стерилизации бульонных сред или сред, содержащих другие органические источники питания, возможно изменение рН в кислую сторону на 0,1—0,2.
Готовые питательные среды хранят в холодном и темном помещении с достаточной влажностью. Длительно хранить питательные среды нежелательно: плотные среды подсыхают, а в жидких возможно выпадение осадков.
Для стандартизации условий культивирования микробов и облегчения лабораторных работ применяют сухие питательные среды — гигроскопические порошки, растворяющиеся в воде. Перед употреблением такие питательные среды растворяют в дистиллированной воде и затем стерилизуют.
www.medical-enc.ru
Питательные среды и их классификация
МГАВМиБ им. К.И. Скрябина
Кафедра микробиологии и
иммунологии
Руководитель Бурлакова Г.И.
Р Е Ф Е Р А Т
Питательные среды и их классификация
Выполнен студенткой
II курса 1-й группы ФВМ
Куринновой С.В.
Москва-2007 г.
Оглавление
1. Введение……………………………………………………………….2
2. Культивирование микроорганизмов………………………………...2
3. Классификация питательных сред и способы их получения………3
4. Культивирование грибов……………………………………………..7
5. Вывод…………………………………………………………………..8
6. Список использованной литературы…………………………………9
1. Введение.
Микробы, как любые другие живые организмы свое развитие и рост, обновление строительного материала, обеспечение энергетических процессов осуществляют за счёт постоянного обмена веществ с окружающей его внешней средой, т.е. путём питания и дыхания. В зависимости от типа питания микробы подразделяют на аутотрофы (способные усваивать углерод из СО2 , а также молекулярный азот из воздуха, а минеральные вещества путём хемо- или фотосинтеза) и гетеротрофы (способны усваивать углерод и другие вещества только из готовых органических соединений). К аутотрофам относятся в основном многие почвенные бактерии, к гетеротрофам (параторофам) – микробы инфекционных болезней животных и растений.
Типы питания, дыхания (аэробы и анаэробы), индукцию и активность ферментов, токсинов, пигментов, рост и размножение являются основными физиологическими параметрами, которые учитывают при разработке составов питательных сред и условий культивирования микробов invitro.
2. Культивирование микроорганизмов .
Культивировать микроорганизмы – это значит искусственно создавать условия для их роста и размножения invitro, взаимосвязанных, но не обязательно сопряжённых процесса. Рост и размножение –циклический 4-х фазный процесс (латентная, логарифмического роста, стационарная, гибель). Период между образованием новых клеток и их делением называется периодом генерации, на длительность которого, кроме особенностей микроба, влияет состав питательной среды. Формы колоний разных микробов на питательной среде одного и того же состава отличаются, что учитывают при их дифференциации.
Для культивирования invitro необходимы субстраты, которые микроорганизмы могут использовать в качестве питательных веществ для своего роста и размножения. Такие питательные субстраты – плотные или жидкие – называют культуральными или питательным средами. В большинстве случаев в микробиологических лабораториях микроорганизмы культивируют invitro, т.е. в стеклянных колбах, пробирках и других сосудах.
К любой питательной среде предъявляют ряд основных требований:
1). Стерильность и по возможности прозрачность.
2). При составлении питательных сред учитывают потребность микроорганизмов в элементах питания (необходимые для жизнедеятельности клеток биохимические факторы – источники энергии, С, N, S, а также неорганические ионы – доступные для усвоения микроорганизмами).
3). Оптимальные значения ряда биофизических показателей: концентрации водородных ионов (pH), окислительно-восстановительного потенциала (Eh), активности воды (aw ), осмотического давления.
3. Классификация питательных сред и способы их получения.
В зависимости от видовой принадлежности микробов и целей культивирования консистенция и составы культуральных сред бывают разными и варьируют в широких пределах. Среда, отвечающая биологическим особенностям микроба и обеспечивающая его рост и размножение, называется полноценной, не имеющая какого- либо компонента, необходимого для его жизнедеятельности – дефицитной .
Питательные среды классифицируют в зависимости от:
- химического состава и исходных компонентов;
- консистенции;
· целевого назначения.
В зависимости от химического состава и исходных компонентов различают следующие типы питательных сред:
- среды неопределенного химического состава (естественные или натуральные среды) – это среды, которые состоят из продуктов животного или растительного происхождения, имеющие сложный неопределенный химических состав:
1) среды животного происхождения (исходные продукты – мясо, рыба, яйца, молоко и т.д.)
2) среды растительного происхождения (исходные продукты – соя, горох, картофель, морковь и т.д.)
На естественных средах хорошо развиваются микроорганизмы, однако эти среды малопригодны для контролируемого изучения физиологии обмена веществ микроорганизмов и диагностических исследований, поскольку они не позволяют учитывать потребности ряда компонентов среды, а с другой стороны определять вещества, образующие микроорганизмами. Естественные среды используют главным образом для поддержания культур микроорганизмов, накопления их биомассы и диагностических целей.
«Полусинтетические» среды (гидролизатные), относящиеся к средам с неопределенным составом. В них, наряду с соединениями известной химической природы, входят вещества неопределенного состава. Их используют в микробиологической практике для получения витаминов, антибиотиков, аминокислот и других продуктов жизнедеятельности микроорганизмов (продукты гидролиза мяса, молока, дрожжей, крови и др. белковых веществ).
Среды известного химического состава (синтетические) – в их состав включают известные химические соединения (соли, углеводы, аминокислоты, витамины и т.д.) в оптимальном количественном соотношении. Синтетические среды по составу бывают простыми или имеют относительно большой набор компонентов. Их используют, когда выращиваемую клеточную массу необходимо максимально освободить от балластных органических соединений, входящих в состав обычных сред, например при получении диагностических аллергенов или при изучении метаболических потребностей микроорганизма в том или ином конкретном химическом соединение. Кроме того, исследователи стремятся определить для каждого микроорганизма минимальные потребности в питательных веществах и, исходя из этого, создать минимальную среду, содержащую лишь необходимы для его размножения химические соединения.
По консистенции питательные среды дифференцируют на плотные, полужидкие и жидкие.
Жидкие питательные среды . Готовят, используя экстракты, гидролизаты, растворы исходных продуктов.
Полужидкие и плотные питательные среды. Используют для учёта количества бактерий, выделения их в виде «чистой» культуры и других целей. Необходимую консистенцию среде придают добавлением различных уплотнителей -агар-агар или желатину.
Агар-агар (малайское желе)- растительный коллоид, получаемый из некоторых морских водорослей. В его состав входят главным образом полисахариды с ничтожным количеством азотистых веществ. Для получения плотных сред его добавляют в количестве 1,5-2%,полужидких –0,3-0,7%.
Желатина – кислый азотистосодержащий продукт, добываемый при выварке костей и хрящей. Обычно в питательные среды вносят 10-20% желатины. Но ряд бактерий выделяют протеолитические ферменты, разлагающие желатину, что делает его неудобным для применения.
По целевому назначению различают:
А).Общеупотребительные (основные) среды.
Их применяют для культивирования относительно неприхотливых микроорганизмов.
Мясная вода: Получение – мясной фарш заливают водопроводной водой 1:2, кипятят 1ч., затем фильтруют, доливают водой до первоначального объема, разливают по емкостям, плотно закрывают и стерилизуют автоклавированием при 120О С 20 мин.
Перевар Хоттингера готовят из мясных отходов путем их триптического гидролиза. Жир, фасции, сухожилия нарезают, заливают кипящей водой 1:2, кипятят, охлаждают до 45О С, добавляют панкреатин, подщелачивают раствором карбоната натрия, встряхивают, добавляют хлороформ, закрывают и выдерживают в теплом месте 10 дней.
Мясо-пептонный бульон (МПБ). Для приготовления используют мясной бульон. К 1 л мясного бульона добавляют 5-10 г пептона (первый продукт гидролиза белка с высокой молекулярной массой) для повышения калорийности среды и 5 г NaCI для создания осмотической активности. Затем устанавливают нейтральную или слабощелочную реакцию среды. Кипятят. Фильтруют через бумажный фильтр, разливают по колбам, пробиркам и стерилизуют автоклавированием при 1200 С 20 мин.
Мясо–пептонный агар (МПА): к 1 л МПБ добавляют 15-20 г мелко нарезанного агар-агара. Среду нагревают до растворения агара, устанавливают слабощелочную реакцию среды 20%-ным раствором Na2 CO3 , фильтруют и через воронки разливают в пробирки, стерилизуют автоклавированием при1200 20 мин.
Мясо-пептонная желатина (МПЖ). К 1 литру МПБ добавляют желатин до конечной концентрации 10-20%, нагревают, устанавливают слабо-щелочную pH, кипятят, фильтруют, разливают по пробиркам и стерилизуют в кипятильнике Коха текучим паром 3 дня или однократно автоклавированием при 1200 С при 1 атм. течение 20 мин.
Полужидкий мясо-пептонный агар (ПЖА) готовят, как МПА, но добавляют 0,25% агара, кипятят до его расплавления, устанавливают требуемую pH, фильтруют в горячем виде и стерилизуют автоклавированием.
Бульон Хоттингера : основной перевар Хоттингера разводят водой 1:5 (1:8), добавляют 0,5% NaСI, 0,1 г гидрофосфата калия, устанавливают pH, кипятят 150-20 мин, фильтруют, разливают по емкостям и стерилизуют автоклавированием при 1200 20 мин.
Агар Хоттингера готовят, добавляя к бульону Хоттингера 2% агар-агара.
Питательный бульон содержит: триптический гидролизат кильки –10,05, NaCI- 4,95. 15 г порошка этого бульона растворяют а 1 л дист. Воды, кипятят 2 мин, фильтруют, разливают по емкостям и стерилизуют а автоклаве при 1200 С 20 мин (Ph 7,3).
mirznanii.com
Питательная среда микроорганизмов. Её виды
С тех пор, как были открыты микробы, и течение многих десятилетий микробиологи учились выращивать их в лабораторных условиях (а позже и условиях производства, на специальных заводах). Понятно, почему это так важно.— ведь недостаточно увидеть микробов под микроскопом, нужно изучить их образ жизни, способы питания и т. д. Собственно говоря, только с того момента, когда их научились выращивать и культивировать, микробиология стала точной наукой.
В лабораториях их выращивают на питательных средах; сейчас микробиологи располагают огромным количеством таких сред (больше тысячи). Но самой первой был сенной настой: в нем всегда в изобилии встречается множество простейших и бактерий.
Однако на такой среде могут найти себе пищу далеко не все микробы. Поэтому число жидких питательных сред быстро увеличивалось, по мере того как возникали новые и новые отрасли микробиологии: микробиология виноделия, пивоварения, молочных продуктов и т. д.
Один из основоположников науки о микробах — Луи Пастер использовал в качестве питательной среды пивное сусло, вино, виноградный сок, мясной бульон... Круг микробов, которых можно было выращивать в лаборатории, все время расширялся.
Питательные среды — субстраты, используемые в лабораторной практике для выращивания микроорганизмов и других биологических объектов. Рост микроорганизмов зависит от наличия в питательной среде достаточного количества органических и неорганических веществ в виде различных солей, витаминов и др. Питательные среды должны обладать также оптимальными физико-химическими свойствами: рН, вязкостью, влажностью, осмотическими свойствами. Наиболее часто в качестве органического компонента питательных сред применяют продукты частичного расщепления белков — пептоны или различные мясные настои и экстракты. Эти компоненты используют при изготовлении многих так называемых обычных питательных сред, чаще всего применяемых для выращивания микробных культур, а также являющихся основой более сложных питательных сред. К числу обычных питательных сред относится мясо-пептонный бульон и бульон Хоттингера. В зависимости от вида культивируемого микроорганизма общие питательные среды содержат добавки различных бактериальных факторов роста. В одних случаях это могут быть чистые витамины, аминокислоты, в других — экстракты всевозможных натуральных субстратов. Так, например, для выращивания возбудителей бруцеллеза используются добавки перевара ткани печени, а возбудитель коклюша культивируют на средах, содержащих кровь. К специальным питательным средам относятся среды, применяемые при необходимости избирательного выявления в исследуемом материале какого-либо вида микроорганизма или его отдельного биохимического или физиологического свойства. К числу специальных питательных сред относятся следующие.
1. Элективные, или избирательные, и обогатительные среды. В таких средах созданы благоприятные условия для развития какого-нибудь одного вида микроорганизма, размножение всех остальных видов микробов угнетается. Для этого к среде добавляют либо питательные вещества, которые может использовать только изучаемый микроб, либо различные факторы угнетения, к которым этот микроб нечувствителен. Этот тип питательных сред используется для выделения и установления природы микроорганизмов, присутствующих в исследуемом материале в очень небольшом количестве по сравнению с другими формами. Примерами избирательных сред являются среды, содержащие желчь или соли желчных кислот и бриллиантовую зелень, а также среды, содержащие селенит, которые применяются для выделения патогенных кишечных бактерий. На этих средах подавляется рост кишечной палочки. Для первичных посевов возбудителей дифтерии используют свернутую лошадиную сыворотку, на которой все другие виды микробов растут значительно медленнее.
2. Дифференциально-диагностические среды. Эти питательные среды применяются для идентификации бактериальных культур. Использование дифференциально-диагностических питательных сред основано на том, что при росте на них бактерий происходят химические изменения компонентов среды, которые легко можно наблюдать. В качестве изменяющегося компонента дифференциально-диагностических питательных сред чаще всего применяются различные белковые вещества, сахара и многоатомные спирты, в результате расщепления которых микробами изменяется реакция среды, что учитывается по изменению окраски добавленных к среде индикаторов, появлению пузырьков газа и т. п. Примерами широко используемых дифференциально-диагностических питательных сред могут служить среды так называемого пестрого ряда, применяемые для выяснения способности микробов сбраживать различные сахара (среды Гисса и др.). См. также Дифференциально-диагностические среды.
3. Синтетические питательные среды применяются в тех случаях, когда требуется изучить биохимические свойства микроорганизмов, например потребности в тех или иных факторах роста (см. Бактерии), а также при необходимости выращивать микробы в строго контролируемых условиях. Обязательными компонентами синтетических питательных сред являются неорганические соли, источники углеводов и азота (как правило, глюкоза и аммонийные соли). Особенностью синтетических питательных сред является то, что всегда известен химический состав среды, который можно изменять в соответствии с целями исследования. При изготовлении синтетических питательных сред следует соблюдать ряд предосторожностей во избежание их загрязнения следовыми количествами посторонних веществ. Так, например, следует использовать только химически чистые вещества и посуду и дистиллированную воду. В качестве примера синтетических питательных сред можно привести глюкозо-солевые среды с добавками различных аминокислот, применяющиеся для выращивания микробов кишечной группы, и среду Модели, содержащую в качестве источника азота аммонийные соли органических кислот, на которой культивируют туберкулезные бактерии.
В некоторых случаях при культивировании микроорганизмов необходимо создать условия, максимально приближающиеся к условиям их естественного обитания. Для этого используют так называемые натуральные среды. В качестве основного компонента многих питательных сред используют естественные биологические субстраты в неизмененном виде, например кровь, молоко, желчь и т. п. На натуральных питательных средах выращивают гонококки, спирохеты, менингококки и некоторые другие виды микробов. Натуральные питательные среды применяют также при культивировании клеток и тканей животного вне организма (так называемые клеточные и тканевые культуры). К числу натуральных питательных сред можно отнести также среды, используемые для культивирования вирусов, содержащие неразрушенные клетки (например, тканевые культуры и куриные эмбрионы).
По консистенции среды могут быть жидкими, полужидкими и плотными. Плотные среды получают путем свертывания натуральных биологических субстратов, например сыворотки крови, или путем добавления к соответствующим жидким средам желеобразующих веществ. Чаще всего в качестве желеобразующих веществ используют желатину или агар-агар. Добавление к жидкой среде 2% агар-агара дает плотную среду, а 0,5—0,7% — полужидкую. Плотные питательные среды используют для получения чистых культур микроорганизмов, для точного определения количества микробов в исследуемом материале и для изучения некоторых культуральных свойств и морфологии бактериальных колоний.
В питательной среде необходимо поддерживать оптимальную концентрацию кислорода. При культивировании аэробов (см.) концентрация кислорода в среде должна быть высокой, что достигается путем выращивания микробов на поверхности плотных питательных сред или благодаря аэрации жидких питательных сред. Растущие микробные культуры аэрируют либо с помощью постоянного встряхивания среды (шуттелирование), либо пропусканием через среду пузырьков стерильного воздуха. При культивировании анаэробов необходимо понизить концентрацию кислорода. В этих случаях используют следующие методы: выращивание в глубине плотных питательных сред; выращивание в жидких питательных средах под слоем масла; выращивание в атмосфере углекислоты и других газов; добавление к плотным и жидким питательным средам биологических и химических агентов, связывающих кислород.
Для поддержания оптимальной реакции питательных сред используются различные буферные растворы. Для большинства микроорганизмов оптимальная реакция среды близка к нейтральной (рН=6,5—7,5). Встречаются, однако, некоторые виды, для которых оптимальны кислые или щелочные условия (рН=5, рН=8—9 соответственно). Следует помнить, что в процессе жизнедеятельности многие микроорганизмы могут изменять реакцию среды в ту или другую сторону. Реакция среды может также изменяться при стерилизации. Поэтому исходная реакция среды должна быть установлена с учетом этих факторов. Реакцию питательной среды регулируют путем добавления кислот или щелочей и контролируют по изменению цвета различных индикаторов (лакмуса, фенолфталеина и др.) или с помощью специальных приборов (рН-метров).
При приготовлении питательной среды рекомендуется пользоваться продажными компонентами, хорошо очищенными и приготовленными в стандартных условиях. Наиболее удобны сухие среды, например сухой пептон или мясо-пептонный бульон, гидролизаты казеина и др. В случае необходимости, экстракты и гидролизаты могут быть приготовлены в лабораторных условиях, однако их качество будет значительно ниже. Приготовление питательной среды производится по соответствующим прописям, после чего среда фильтруется и в ней устанавливают необходимую реакцию рН. Некоторые компоненты среды иногда следует стерилизовать отдельно и добавить к среде после охлаждения, соблюдая правила стерильности. Все питательные среды стерилизуют во избежание прорастания в них посторонних микроорганизмов; сосуды, содержащие питательные среды, должны быть тщательно закрыты. Наиболее эффективный метод стерилизации — термообработка. Выбор метода стерилизации зависит от термостабильности компонентов питательной среды. Иногда компоненты питательной среды стерилизуют отдельно различными методами, а затем смешивают. Питательные среды, не выдерживающие высокой температуры, стерилизуют фильтрованием. Стерильные питательные среды хранят в темных помещениях на холоде с достаточным уровнем влажности. Обычно допускается довольно продолжительное хранение питательных сред. Перед употреблением питательные среды рекомендуется прокипятить (в тех случаях, когда допустима термообработка) для удаления растворенного в них воздуха. Агаровые и желатиновые среды расплавляют в водяных банях и в таком состоянии разливают.
Расфасовка питательных сред различна в зависимости от способа их применения. Как правило, питательные среды приготовляют, стерилизуют и хранят в больших емкостях и их розлив производится непосредственно перед опытом с соблюдением правил стерильности. Жидкие питательные среды разливают по колбам и пробиркам различной емкости, твердые — по пробиркам, чашкам Петри и так называемым бактериологическим матрацам. Следует помнить, что твердые среды, заготовленные в матрацах, чашках Петри и скошенные среды — в пробирках, нельзя хранить длительное время во избежание высыхания.
На многих новых средах, например, на мясном бульоне, могли расти и некоторые микроорганизмы, вызывающие болезни человека и животных. Особенно хорошо они росли, если к бульону добавлялись такие вещества, как кровь, кровяная сыворотка, спинномозговая жидкость.
Дело в том, что при кипячении мясного бульона (а это, в общем-то, самый настоящий, съедобный бульон, только обезжиренный, с особыми пропорциями солей и потому невкусный) разрушаются некоторые вещества, содержащиеся в мясе. Вместе с кровью они вносятся вновь. Поэтому микробы-паразиты находят в такой среде те же вещества, которыми они питались и в организме. Но у жидких сред есть важный недостаток.
Если посеять на жидкую питательную среду один какой-нибудь вид микроба, то этот вид на ней и вырастет. Что посеешь, то и пожнешь, так сказать. Но если в «посевном материале» будет несколько микробных видов или бульон окажется сильно загрязненным, то на нем вырастет смесь микробов. Разобраться в этой смеси будет трудно.
biofile.ru








