Загрязнение тяжелыми металлами: содержание и предельно-допустимые концентрации в воде. Пдк элементов в растениях
4.6. Пдк загрязнений для растений
Растения–фотосинтетики, открывающие пищевые цепи в экосистемах, как и другие живые организмы, чувствительны к присутствию загрязняющих веществ в окружающей среде. Многочисленные факты снижения продуктивности и гибели древесных, кустарниковых и травянистых растений вследствие загрязнения воздуха хорошо известны. Поэтому нормирование содержания загрязняющих веществ применительно к растениям – важная, трудная и до конца пока не решенная задача.
Трудности заключаются в том, что разные виды совместно произрастающих растений в разной степени устойчивы к одним и тем же веществам. Поэтому в экосистеме диапазон общей устойчивости данного трофического уровня достаточно широк. Во-вторых, устойчивость зависит от условий места обитания, т.е. от режимов экологических фактов (например, увлажнения, освещенности, минерального питания). В-третьих, одно и то же растение в разной степени устойчиво к тем или иным веществам в разные периоды своего развития: распускания листьев, бутонизации и цветения, созревания семян. В-четвертых, разные физиологические процессы у растения неодинаково уязвимы для загрязняющих веществ, и необходимо в качестве теста выбирать наиболее демонстративное свойство.
Таким наиболее чувствительным к помехам процессом считается фотосинтез, определяющий продукцию экосистемы. Метод определения допустимых норм загрязнений воздуха основан на определении минимальных изменений фотосинтеза у растений. Для этого используются чувствительные биофизические методы определения изменения спонтанного сверхслабого свечения и свободных радикалов в клетках под влиянием низких концентраций газов. Интенсивность фотосинтеза определяют методом электрохемилюминесценции.
За предельно допустимую разовую дозу загрязненного воздуха для каждого вида растений принимают концентрацию газа, при которой после 5 мин действия наблюдается уменьшение фотосинтеза более чем на 10%. Допустимые нормы загрязнения воздуха диоксидом серы, аммиаком и формальдегидом для растений определяли по влиянию этих веществ на интенсивность фотосинтеза. Слабые концентрации этих веществ вызывают активацию фотосинтеза как у стойких, так и у чувствительных видов. Степень снижения интенсивности фотосинтеза под влиянием, например, диоксида серы, пропорциональна увеличению концентрации газа в опыте. Стойкие виды растений (клен) обладают пониженной интенсивностью фотосинтеза, а нестойкие (барбарис) – повышенной. Диоксид серы у первых вызывает значительно меньшее снижение фотосинтеза, чем у вторых.
Допустимую санитарную норму устанавливают по минимальной концентрации газа, не вызывающей изменения исследуемых показателей через 5мин действия газа. К настоящему времени установлены ПДКм.р.и ПДКс.с.для 12 загрязняющих веществ в воздухе для растений, включая древесные (табл. 4.2).
Таблица 4.2– ПДК загрязняющих веществ в атмосферном воздухе для
растений и древесных пород
| Загрязняющие вещества | Значения ПДК, мг/м3 | |||
| Для растений в целом ПДКм.р. | Для древесных пород | Для человека ПДКм.р. | ||
| ПДКм.р. | ПДКс.с. | |||
| Аммиак | 0,05 | 0,1 | 0,04 | 0,2 |
| Бензол | 0,1 | 0,1 | 0,05 | 1,5 |
| Диоксид серы | 0,02 | 0,03 | 0,15 | 0,5 |
| Метанол | 0,2 | 0,2 | 0,1 | 1,0 |
| Оксиды азота | 0,02 | 0,04 | 0,02 | 0,085 |
| Пыль, цемент | – | 0,2 | 0,05 | 0,5 |
| Сероводород | 0,02 | 0,008 | 0,008 | 0,008 |
| Формальдегид | 0,02 | 0,02 | 0,003 | 0,035 |
| Хлор | 0,25 | 0,025 | 0,015 | 0,1 |
Характерно, что в большинстве случаев величины ПДК для растений ниже по сравнению с ПДК для человека, что свидетельствует о более высокой чувствительности растений к различным загрязнениям.
studfiles.net
Тяжелые металлы в почве
Содержание тяжелых металлов (ТМ) в почвах зависит, как установлено многими исследователями, от состава исходных горных пород, значительное разнообразие которых связано со сложной геологической историей развития территорий. Химический состав почвообразующих пород, представленный продуктами выветривания горных пород, предопределен химическим составом исходных горных пород и зависит от условий гипергенного преобразования.
В последние десятилетия в процессы миграции ТМ в природной среде интенсивно включилась антропогенная деятельность человечества.
Одной из важнейших групп токсикантов, загрязняющих почву, являются тяжелые металлы. К ним относятся металлы с плотностью более 8 тыс. кг/м3 (кроме благородных и редких): Pb, Cu, Zn, Ni, Cd, Hg, Co, Sb, Sn, Be. В прикладных работах к списку тяхелых металлов нередко добавляют также Pt, Ag, W, Fe, Mn. почти все тяжелые металлы токсичны. Антропогенное рассеивание этой группы загрезнителей (в том числе и в виде солей) в биосфере приводит к отравлению или угрозе отравления живого.
Отнесение тяжелых металлов, попадающих в почву из выбросов, отбросов, отходов, к классам опасности (по ГОСТу 17.4.1.02-83. Охрана природы. Почвы) представлено в табл. 1.
Таблица 1. Классификация химических веществ по классам опасности
| Класс опасности | Химическое вещество |
| 1 | Мышьяк, кадмий, ртуть, свинец, цинк |
| 2 | Кобальт, никель, молибден, медь, сурьма, хром |
| 3 | Барий, ванадий, вольфрам, марганец, стронций |
Медь – является одним из важнейших незаменимых элементов, необходимых для живых организмов. В растениях она активно участвует в процессах фотосинтеза, дыхания, восстановления и фиксации азота. Медь входит в состав целого ряда ферментов-оксидаз – цитохромоксидазы, церулоплазмина, супероксидадисмутазы, уратоксидазы и других, и участвует в биохимических процессах как составная часть ферментов, осуществляющих реакции окисления субстратов молекулярным кислородом.
Кларк в земной коре 47 мг/кг. В химическом отношении медь – малоактивный металл. Основополагающим фактором, влияющим на величину содержания Cu, является концентрация ее в почвообразующих породах. Из изверженных пород наибольшее количество элемента накапливают основные породы – базальты (100-140 мг/кг) и андезиты (20-30 мг/кг). Покровные и лессовидные суглинки (20-40 мг/кг) менее богаты медью. Наименьшее же ее содержание отмечается в песчаниках, известняках и гранитах (5-15 мг/кг). Концентрация металла в глинах европейской части территории России достигает 25 мг/кг, в лессовидных суглинках – 18 мг/кг. Супесчаные и песчаные почвообразующие породы Горного Алтая накапливают в среднем 31 мг/кг меди, юга Западной Сибири – 19 мг/кг.
В почвах медь является слабомиграционным элементом, хотя содержание подвижной формы бывает достаточно высоким. Количество подвижной меди зависит от многих факторов: химического и минералогического состава материнской породы, рН почвенного раствора, содержания органического вещества и др. Наибольшее количество меди в почве связано с оксидами железа, марганца, гидроксидами железа и алюминия и, особенно, с монтмориллонитом вермикулитом. Гуминовые и фульвокислоты способны образовывать устойчивые комплексы с медью. При рН 7-8 растворимость меди наименьшая.
ПДК меди в России – 55 мг/кг, ОДК для песчаных и супесчаных почв – 33 мг/кг.
Данные по токсичности элемента для растений немногочисленны. В настоящее время основной проблемой считается недостаток меди в почвах или ее дисбаланс с кобальтом. Основные признаки дефицита меди для растений – замедление, а затем и прекращение формирования репродуктивных органов, появление щуплого зерна, пустозернистых колосьев, снижение устойчивости к неблагоприятным факторам внешней среды. Наиболее чувствительны к ее недостатку пшеница, овес, ячмень, люцерна, столовая свекла, лук и подсолнечник.
Марганец широко распространён в почвах, но находится там, в меньших количествах по сравнению с железом. В почве марганец находится в нескольких формах. Единственные формы, доступные для растений, – это обменные и водорастворимые формы марганца. Доступность почвенного марганца снижается с ростом pH (при уменьшении кислотности почвы). Однако редко встречаются почвы, истощённые выщелачиванием до такой степени, что доступного марганца не хватает для питания растений.
В зависимости от типа почв содержание марганца колеблется: каштановая 15,5 ± 2,0 мг/кг, сероземная 22,0 ± 1,8 мг/кг, луговая 6,1 ± 0,6 мг/кг, желтоземная 4,7 ± 3,8 мг/кг, песчаная 6,8 ± 0,7 мг/кг.
Соединения марганца являются сильными окислителями. Предельно допустимая концентрация для черназемных почв составляет 1500 мг/кг почвы.
Содержание марганца в растительных пищевых продуктах, выращенных на луговых, желтоземных и песчаных почвах, коррелирует с его содержанием в этих почвах. Количество марганца в суточном пищевом рационе в этих геохимических провинциях более чем в 2 раза меньше суточной потребности человека и пищевого рациона людей, проживающих в зонах каштановых и сероземных почв.
biofile.ru
ПДК химических веществ в почве и допустимые уровни содержания по показателям вредности
РАБОТА 5
ОПРЕДЕЛЕНИЕ УРОВНЯ ЗАГРЯЗНЕНИЯ ПОЧВЫ НАСЕЛЕННОГО ПУНКТА И ОЦЕНКА СТЕПЕНИ ОПАСНОСТИ ДЛЯ ЗДОРОВЬЯ НАСЕЛЕНИЯ
Цель работы: определение категории загрязнения почв по наличию в них повышенных концентраций загрязняющих веществ (ЗВ) и, на основе этого, оценка влияния суммарного загрязнения на здоровье населения.
Задание
5.1. Определить категорию загрязнения почвы населенного пункта.
(Приложение 11)
5.2. Определить уровень загрязнения почвы населенного пункта и оценить влияние суммарного загрязнения на здоровье населения.(Приложение 12)
5.3. Сделать краткие выводы.
Порядок выполнения работы
5.1. При оценке опасности загрязнения почв загрязняющими веществами (ЗВ) необходимо учитывать следующие закономерности (табл.5.1, 5.2):
1 Опасность загрязнения тем выше, чем больше фактическое содержание ЗВ в почве (обычно выражается концентрацией вещества Сi, мг/кг), т.е., чем больше значение коэффициента Кiпревышает единицу; коэффициент опасности определяется следующим образом:
Кi=Сi / ПДКi(5.1)
2 Опасность загрязнения тем выше, чем выше класс опасности ЗВ. Отнесение ЗВ, попадающих в почву из выбросов, сбросов, отходов, к тому или иному классу опасности зависит от свойств ЗВ, в частности, от их способности накапливаться в организме, нарушать работу различных систем и органов, токсичности и др. Примеры ЗВ различных классов опасности приведеныв таблице 5.1;
Отнесение химических веществ, попадающих в почву, к классам опасности (по ГОСТ 17.4.1.02-83)
Таблица 5.1.
| Класс опасности | Химическое вещество |
| I | Мышьяк, кадмий, ртуть, свинец, цинк, фтор,бенз(а)пирен |
| II | Бор, кобальт, никель, молибден, медь, сурьма, хром |
| III | Барий, ванадий, вольфрам, марганец, стронций, ацетофенол |
3 Опасность загрязнения тем выше, чем ниже буферные свойства почв. Это свойство почвы поглощать загрязнение из окружающей среды и прочно фиксировать его в почве зависит от содержания в почве органического вещества (гумуса почвы), кислотности почвы, механического состава, водного режима и ряда других свойств почвы. Буферность почвы определяет ее барьерную функцию, которая, в свою очередь, обусловливает уровни вторичного загрязнения химическими веществами сред, контактирующих с почвой: растительности, атмосферного воздуха, поверхностных и подземных вод.
Принципиальная схема оценки почв сельскохозяйственного использования, загрязненных химическими веществами
Таблица 5.2.
| Категория загрязненности почв | Характеристика загрязненности | Возможное использование территории | Предлагаемые мероприятия |
| I. Допустимая | Содержание химических веществ в почве превышает фоновое, но не выше ПДК | Использование под любые культуры | Снижение уровня воздействия источников загрязнения почвы. Осуществление мероприятий по снижению доступности токсикантов для растений (известкование, внесение органических удобрений) |
| II. Умеренно опасная | Содержание химических веществ в почве превышает ПДК при лимитирующем общесанитарном, миграционном водном и миграционном воздушном показателях вредности, но ниже допустимого уровня по транслокационномупоказателю | Использование под любые культуры при условии контроля качества сельскохозяйственных растений | Мероприятия, аналогичные категории I. При наличии веществ с лимитирующим миграционным водным и миграционным воздушным показателями проводится контроль за содержанием этих веществ в рабочих зонах и в воде местных водоисточников |
| III. Высоко опасная | Содержание химических веществ в почве превышает их ПДК при лимитирующем транслокационном показателе вредности | Использование под технические культуры. Использование под сельскохозяйственные культуры ограничено с учетом растений - концентраторов | Кроме мероприятий, указанных для категории I, обязательный контроль за содержанием токсикантов в растениях- продуктах питания и кормах. При необходимости выращивания растений -продуктов питания - рекомендуется их перемешивание с продуктами, выращенными на чистой почве |
| IV. Чрезвычайно опасная | Содержание химических веществ в почве превышает их ПДК в почве по всем показателям вредности | Использование под технические культуры или исключение из сельскохозяйственного использования. Лесозащитные полосы | Мероприятия по снижению уровня загрязнения и связыванию токсикантов в почве. Контроль за содержанием токсикантов в зоне дыхания сельскохозяйственных рабочих и в воде местных источников |
ЗАДАНИЕ 5.1. Определить категорию загрязнения почвы и возможность её использования.(Приложение 10-11)
ПРИМЕР 5.1 (Варианты задач для задания 5.1 даны в приложении 11).
На определенном участке территории установлено присутствие в почве меди с солесодержанием подвижных форм, равном 3,2 мг/кг, и свинца с концентрацией 25 мг/кг. Определить категорию загрязненности почвы и возможность ее использования для выращивания сельскохозяйственной продукции; установить характер возможного использования данной территории и мероприятия по снижению токсического воздействия почвенных загрязнений.
Решение
На основании данных приложения 10 находим: ПДК меди с учетом фона - 3,0 мг/кг; ПДК свинца с учетом фона - 30,0 мг/кг. Допустимые уровни содержания:
• по транслокационному показателю вредности - меди - 3,5 мг/кг; свинца- 30,0 мг/кг
• по миграционному водному показателю вредности - меди - 72,0 мг/кг; свинца - 260,0 мг/кг;
• по общесанитарному показателю вредности - меди -3,0 мг/кг; свинца - 30,0 мг/кг.
На основании полученных данных составим таблицу:
Таблица 5.3.
| Элемент-токсикант | Содержание в почве, мг/кг | ПДК с учетом фона, мг/кг | Лимитирующие показатели вредности (Допустимые уровни содержания, мг/кг) | |||
| по транслокационному показателю | по миграционному водному показателю | по миграционному воздушному показателю | по общесанитарному показателю | |||
| медь | 3,2 | 3,0 | 3,5 | 72,0 | - | 3,0 |
| свинец | 30,0 | 260,0 | - | 30,0 |
Уровень содержания меди в почве превышает ее ПДК (3,0 мг/кг) с учётом фона и допустимый уровень при лимитирующем общесанитарном показателе вредности (3,0 мг/кг), но ниже допустимого уровня по транслокационному показателю вредности (3,5 мг/кг), следовательно, в соответствии с табл.5.2 категория загрязненности почв медью - умеренно опасная.
Уровень содержания свинца в почве не превышает ПДК и допустимые уровни по всем лимитирующим показателям вредности, следовательно, в соответствии с табл.5.2 категория загрязненности почв свинцом - допустимая.
ВЫВОД:Исходя из комплексной оценки загрязненности почвы (по худшему показателю), устанавливаем, что категория ее загрязненности - умеренно опасная.
Данная территория может использоваться под любые культуры при условии контроля качества сельскохозяйственных растений и проведения мероприятий по снижению доступности для них имеющихся токсикантов, т.е. меди и свинца.
ЗАДАНИЕ 5.2.Определить уровень загрязнения почвы населенного пункта и оценить влияние суммарного загрязнения на здоровье населения.(Приложение 12)
Оценка уровня загрязнения почв населенных пунктов проводится по двум показателям: Кс - коэффициенту концентрации отдельного веществаи
Zc - суммарному показателю загрязнения -при наличии в почве нескольких загрязняющих компонентов.
Коэффициент концентрации ЗВ определяется отношением
Кс = С/Сф (5.2)
где С - реальная концентрация данного химического вещества в почве, мг/кг;
Сф- фоновая концентрация в почве данного вещества, мг/кг.
Суммарный показатель загрязнения равен сумме коэффициентов концентраций загрязняющих почву химических элементов:
| (5.3) |
где п- число учитываемых ЗВ.
Оценка опасности загрязнения почв по найденному суммарному показателюZc проводится с помощью данных табл.5.4.
Ориентировочная оценочная шкала опасности загрязнения почв по суммарному показателю загрязнения Zc
Таблица 5.4
| Категория загрязнения почв | Показатель Zc | Изменения показателей здоровья населения в очагах загрязнения |
| I. Допустимая | Менее 16 | Наиболее низкий уровень заболеваемости детей и минимум функциональных отклонений |
| II. Умеренно опасная | 16-32 | Увеличение общего уровня заболеваемости |
| III. Высоко опасная | 32-128 | Увеличение общего уровня заболеваемости, числа часто болеющих детей с хроническими заболеваниями, нарушениями функционирования сердечнососудистой системы |
| IV. Чрезвычайно опасная | Более 128 | Увеличение заболеваемости детей, нарушение репродуктивной функции женщин (увеличение случаев токсикоза беременности, преждевременных родов, мертворождаемости, гипотрофии новорожденных) |
ПРИМЕР 5.2 (Варианты задач для задания 5.2 приведены в приложении 12.)
Необходимо определить категорию загрязнения почвы населенного пункта химическими веществами по суммарному показателю загрязнения, на основании чего дать характеристику показателей здоровья населения, проживающего на данной территории.
Исходные данные приведены в табл.5.5. Фоновые концентрации загрязняющих веществ в почве даны в приложении 12.
Таблица 5.5.
| Загрязняющие вещества | Реальная концентрация в почве С, мг/кг | Фоновая концентрация в почве Сф, мг/кг |
| Фтор | ||
| Бериллий | 4,9 | 1,5 |
| Цинк | 41,3 |
Решение
По формуле (5.2) находим коэффициенты концентрации загрязняющих веществ:
КcF = 470/208 = 2,3;
КсВе = 4,9/1,5 = 3,3;
KcZn= 255/41,3 = 6,2.
По формуле (5.3) определим суммарный показатель загрязнения:
Zc = (2,3 + 3,3 + 6,2) - (3 - 1) = 9,8.
ВЫВОДВ соответствии с данными табл.5.4 рассматриваемые почвы относятся к категории допустимого загрязнения и характеризуются наиболее низким уровнем заболеваемости детей и минимумом функциональных отклонений.
КОНТРОЛЬНЫЕ ВОПРОСЫ (необходим письменный ответ)
1. Перечислите основные источники загрязнения почв.
2. Какие виды загрязнений почв наиболее опасны для человека? Для функционирования экосистемы?
3. Дать определение ПДКп.
4. Дать определения понятиям: миграционный водный показатель загрязнения среды, миграционный воздушный показатель загрязнения среды, общесанитарный показатель загрязнения, транслокационный показатель загрязнения.
5. Что такое коэффициент концентрации загрязняющего вещества в почве?
6. Что такое суммарный показатель загрязнения почвы? Зачем он определяется?
Приложение 10
ПДК химических веществ в почве и допустимые уровни содержания по показателям вредности
| Вещество | ПДК почвы с учетом фона, мг/кг | Показатели вредности | |||||
| Транслокационный | Миграционный | Общесанитарный | |||||
| водный | воздушный | ||||||
| Подвижная форма | |||||||
| Сu | 3,0 | 3,5 | 72,0 | - | 3,0 | ||
| Ni | 4,0 | 6,7 | 14,0 | - | 4,0 | ||
| Zn | 23,0 | 23,0 | 7,0 | ||||
| Со | 5,0 | 25,0 | >1000 | - | 5,0 | ||
| Водорастворимая форма | |||||||
| F | 2,8 | 2,8 | - | - | 5,0 | ||
| Валовое содержание | |||||||
| Sb | 4,5 | 4,5 | 4,5 | - | |||
| Mn | - | ||||||
| V | - | ||||||
| Mn+V | 1000+100 | 1500+150 | 2000+200 | - | 1000+100 | ||
| Pb | - | 30,0 | |||||
| As | 2,0 | 2,0 | - | 10,0 | |||
| Hg | 2,1 | 2,1 | 33,3 | 2,5 | 5,0 | ||
| Pb+Hg | 20+1,0 | 20+1,0 | 30+2,0 | - | 30+2,0 | ||
| КСl Нитраты Бенз(а)пирен Бензол Толуол Изопропилбензол Альфаметилстирол Стирол Ксилолы h3S S элементарная h3S04 Отходы флотации угля Комплексные гранулированные удобрения (КГУ) Жидкие комплексные удобрения (ЖКУ) | 0,02 0,3 0,3 0,5 0,5 0,1 0,3 0,4 | 0,2 3,0 0,3 3,0 3,0 0,3 0,3 >800 | 0,5 10,0 | - - 0,3 0,3 0,5 0,5 0,1 0,4 0,4 - - >800 | 0,02 50,0 50,0 50,0 50,0 1,0 1,0 | ||
Приложение 11
Варианты задач для задания5.1
| Вариант | Токсикант | Концентрация, мг/кг | Вариант | Токсикант | Концентрация мг/кг |
| Никель | 8,0 | Бенз(а)пирен | 0,4 | ||
| Медь | 75,0 | Никель | 13,0 | ||
| Цинк | 20,0 | Бензол | 0,25 | ||
| Фтор | 4,0 | Кобальт | 1300,0 | ||
| Кобальт | 12,0 | Толуол | 0,45 | ||
| Ванадий | 120,0 | Марганец | 2000,0 | ||
| Фтор | 1,5 | Изопропилбензол | 2,5 | ||
| Мышьяк | 8,0 | Сурьма | 55,0 | ||
| Сурьма | 46,0 | Изопропилбензол | 4.0 | ||
| Ртуть | 2,8 | Никель | 12,0 | ||
| Марганец | 3000,0 | Альфаметилстирол | 0,4 | ||
| Мышьяк | 3,0 | Нитраты | 400,0 | ||
| Ванадий | 115,0 | Стирол | 0,2 | ||
| Цинк | 38,0 | КГУ | 650,0 | ||
| Свинец | 240,0 | Ксилол | 92,0 | ||
| Никель | 3,5 | Кобальт | 75,0 | ||
| Свинец | 42,0 | Сероводород | 150,0 | ||
| Сурьма | 10,0 | Фтор | 3,0 | ||
| Мышьяк | 4,0 | Элементарная сера | 190,0 | ||
| Свинец | 60,0 | Бенз(а)пирен | 0,4 | ||
| Ртуть | 3,5 | Серная кислота | 145,0 | ||
| Цинк | 20,0 | Сурьма | 5,0 | ||
| Нитраты | 150,0 | ОФУ | 8000,0 | ||
| Медь | 65,0 | Бензол | 44,0 | ||
| Бенз(а)пирен | 0,15 | КГУ | 600,0 | ||
| Свинец | 39,0 | Толуол | 98,0 |
Приложение 12
Варианты задач для задания 5.2
| Вари- ант | Концентрация загрязняющих веществ в почве, мг/кг | |||||||||||
| Li | Be | S | V | Сr | Со | Ni | Сu | Zn | Cd | Hg | Pb | |
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | ||||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | 0,3 | - | ||||||
| - | - | - | - | - | - | 0,1 | ||||||
| - | - | - | - | - | 0,09 | - | ||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | 0,07 | ||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | 0,15 | ||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | 0,03 | - | ||||||
| - | - | - | - | 0,6 | ||||||||
| - | - | - | - | - | - | 0,8 | ||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | |||||||
| . | - | - | - | - | - | 0,02 | ||||||
| - | - | - | - | - | - | 0,4 | ||||||
| - | - | - | - | - | - | 0,08 | ||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | |||||||
| - | - | - | - | - | - | |||||||
| Фоновые концентрации, мг/кг | ||||||||||||
| все | 23,5 | 1,5 | 63,5 | 8,4 | 23,2 | 15,3 | 41,3 | 0,7 | 0,01 | 11,5 |
megaobuchalka.ru
Загрязнение тяжелыми металлами: содержание и предельно-допустимые концентрации в воде
Тяжелые металлы - очень опасные токсические вещества. В наши дни, мониторинг уровня разных таких веществ особо важен в промышленных и городских районах.
Хотя все знают, что такое тяжелые металлы, не все знают какие химические элементы всё-таки входят в эту категорию. Есть очень много критерий, по которому, разные учёные определяют тяжелые металлы: токсичность, плотность, атомная масса, биохимические и геохимические циклы, распространение в природе. По одним критериям в число тяжелых металлов входят мышьяк (металлоид) и висмут (хрупкий металл).
Содержание:
Общие факты про тяжелые металлы
Известно более 40 элементов, которые относят к тяжелым металлам. Они имеют атомную массу больше 50 а.е. Как не странно именно эти элементы обладают большой токсичностью даже при малой кумуляции для живых организмов. V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo...Pb, Hg, U, Th...все они входят в эту категорию. Даже при их токсичности, многие из них являются важными микроэлементами, кроме кадмия, ртути, свинца и висмута для которых не нашли биологическую роль.

По другой классификации (а именно Н. Реймерса) тяжелые металлы - это элементы которые имеют плотность больше 8 г/см3. Таким образом получится меньше таких элементов: Pb, Zn, Bi, Sn, Cd, Cu, Ni, Co, Sb.
Теоретически, тяжелыми металлами можно назвать всю таблицу элементов Менделеева начиная с ванадия, но исследователи нам доказывают, что это не совсем так. Такая теория вызвана тем, что не все они присутствуют в природе в токсических пределах, да и замешательство в биологических процессах для многих минимальна. Вот почему в эту категорию многие включают только свинец, ртуть, кадмий и мышьяк. Европейская Экономическая Комиссия ООН не согласна с этим мнением и считает что тяжелые металлы это - цинк, мышьяк, селен и сурьма. Тот же Н. Реймерс считает, что удалив редкие и благородные элементы из таблицы Менделеева, остаются тяжелые металлы. Но и это тоже не правило, другие к этому классу добавляют и золото, платину, серебро, вольфрам, железо, марганец. Вот почему я вам говорю, что не всё ещё понятно по этой теме...
Обсуждая про баланс ионов различных веществ в растворе, мы обнаружим, что растворимость таких частиц связанно со многими факторами. Главные факторы солюбилизации являются рН, наличие лигандов в растворе и окислительно-восстановительный потенциал. Они причастны к процессам окисления этих элементов с одной степени окисления к другой, в которой растворимость иона в растворе выше.
В зависимости от природы ионов, в растворе могут происходить различные процессы:
Из-за этих процессов, ионы могут переходить в осадок или оставаться стабильными в растворе. От этого зависит и каталитические свойства определённого элемента, и его доступность для живых организмов.
Многие тяжелые металлы образуют с органическими веществами довольно стабильные комплексы. Эти комплексы входят в механизм миграции этих элементов в прудах. Почти все хелатные комплексы тяжелых металлов устойчивы в растворе. Также, комплексы почвенных кислот с солями разных металлов (молибден, медь, уран, алюминий, железо, титан, ванадий) имеют хорошую растворимость в нейтральной, слабощелочной и слабокислой среды. Это факт очень важен, потому что такие комплексы могут продвигаться в растворенном состоянии на большие расстояния. Самые подверженные водные ресурсы - это маломинерализованные и поверхностные водоёмы, где не происходит образование других таких комплексов. Для понимания факторов, которые регулируют уровень химического элемента в реках и озерах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю свободных и связанных форм металла.
В результате миграции тяжелых металлов в металлокомплексы в растворе могут произойти такие последствия:
- В первых, увеличивается кумуляция ионов химического элемента за счёт перехода этих из донных отложений в природные растворы;
- Во вторых, возникает возможность изменения мембранной проницаемости полученных комплексов в отличие от обычных ионов;
- Также, токсичность элемента в комплексной форме может отличаться от обычной ионной формы.
Например, кадмий, ртуть и медь в хелатные формы, имеют меньшую токсичность, чем свободные ионы. Вот почему не правильно говорить о токсичности, биологической доступности, химической реакционной способности только по общему содержанию определённого элемента, при этом, не учитывая долю свободных и связанных форм химического элемента.
Откуда же берутся тяжелые металлы в нашу среду обитания? Причины присутствия таких элементов могут быть сточные воды с разных промышленных объектов занимающийся черной и цветной металлургией, машиностроением, гальванизацией. Некоторые химические элементы входят в состав пестицидов и удобрений и таким образом могут быть источником загрязнения местных прудов.
А если войти в тайны химии, то самым главным виновником повышения уровня растворимых солей тяжелых металлов является кислотные дожди (закисление). Понижение кислотности среды (уменьшение рН) тянет за собою переход тяжелых металлов из малорастворимых соединений (гидроксиды, карбонаты, сульфаты) в более хорошо растворимые (нитраты, гидросульфаты, нитриты, гидрокарбонаты, хлориды) в почвенном растворе.
Ванадий (V)
Надо отметить в первую очередь, что загрязнение этим элементом натуральными способами маловероятна, потому что этот элемент очень рассеян в Земной коре. В природе обнаруживается в асфальтах, битумах, углях, железных рудах. Важным источником загрязнения является нефть.
Содержание ванадия в природных водоёмах
Природные водоёмы содержит ничтожное количество ванадия:
В процессах перехода ванадия в растворённом состоянии очень важны анионные комплексы (V10O26)6- и (V4O12)4-. Также очень важны растворимые ванадиевые комплексы с органическими веществами, типа гумусовых кислот.
Предельно-допустимая концентрация ванадия для водной среды
Ванадий в повышенных дозах очень вреден для человека. Предельно-допустимая концентрация для водной среды (ПДК) составляет 0,1 мг/л, а в рыбохозяйственных прудах, ПДКрыбхоз ещё ниже - 0,001 мг/л.
Висмут (Bi)
Главным образом, висмут может поступать в реки и озера в результате процессов выщелачивания минералов содержащих висмут. Есть и техногенные источники загрязнения этим элементом. Это могут быть предприятия по производству стекла, парфюмерной продукций и фармацевтические фабрики.
Содержание висмута в природных водоёмах
Предельно-допустимая концентрация висмута для водной среды
ПДК висмута для водной среды - 0,1 мг/л.
Железо (Fe)
Железо - химический элемент не редкий, оно содержится во многих минералах и пород и таким образом в природных водоёмах уровень этого элемента повыше других металлов. Оно может происходить в результате процессов выветривания горных пород, разрушения этих пород и растворением. Образуя разные комплексы с органическими веществами из раствора, железо может быть в коллоидальном, растворённом и в взвешенном состояниях. Нельзя не упомнить про антропогенные источники загрязнения железом. Сточные воды с металлургических, металлообрабатывающих, лакокрасочных и текстильных заводов зашкаливают иногда из-за избытка железа.
Количество железа в реках и озерах зависит от химического состава раствора, рН и частично от температуры. Взвешенные формы соединений железа имеют размер более 0,45 мкг. Основные вещества которые входят в состав этих частиц являются взвеси с сорбированными соединениями железа, гидрата оксида железа и других железосодержащих минералов. Более малые частицы, то есть коллоидальные формы железа, рассматриваются совместно с растворенными соединениями железа. Железо в растворённом состоянии состоит из ионов, гидроксокомплексов и комплексов. В зависимости от валентности замечено что Fe(II) мигрирует в ионной форме, а Fe(III) в отсутствии разных комплексов остаётся в растворённом состоянии.
В балансе соединений железа в водном растворе, очень важно и роль процессов окисления, так химического так и биохимического (железобактерии). Эти бактерии ответственны за переход ионов железа Fe(II) в состояние Fe(III). Соединения трехвалентного железа имеют склонность гидролизовать и выпадать в осадок Fe(OH)3. Как Fe(II), так и Fe(III) склоны к образованию гидроксокомплексов типа [Fe(OH)3]-, [Fe(OH)2]+, [Fe2(OH)3]3+, [Fe2(OH)2]4+, [Fe(OH)3]+, в зависимости от кислотности раствора. В нормальных условиях в реках и озерах, Fe(III) находятся в связи с разными растворёнными неорганическими и органическими веществами. При рН больше 8, Fe(III) переходит в Fe(OH)3. Коллоидные формы соединений железа самые малоизучены.
Содержание железа в природных водоёмах
В реках и озерах уровень железа колеблется на уровне n*0,1 мг/л, но может повыситься вблизи болот до несколько мг/л. В болотах железо концентрируется в форме солей гуматов (соли гуминовых кислот).
Подземные водохранилища с низким рН содержат рекордные количества железа - до нескольких сотен миллиграммов на литр.
Железо - важный микроэлемент и от него зависят разные важные биологические процессы. Оно влияет на интенсивность развития фитопланктона и от него зависит качество микрофлоры в водоёмах.
Уровень железа в реках и озерах имеет сезонный характер. Самые высокие концентрации в водоёмах наблюдаются зимою и летом из-за стагнации вод, а вот весною и осенью заметно снижается уровень этого элемента по причине перемешивания водных масс.
Таким образом, большое количество кислорода ведёт к окислению железа с двухвалентной формы в трехвалентной, формируясь гидроксид железа, который падает в осадок.
Предельно-допустимая концентрация железа для водной среды
Вода с большим количеством железа (больше 1-2 мг/л) характеризуется плохими вкусовыми качествами. Она имеет неприятный вяжущий вкус и непригодна для промышленных целей.
ПДК железа для водной среды - 0,3 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз - 0,1 мг/л.
Кадмий (Cd)
Загрязнение кадмием может возникнуть во время выщелачивания почв, при разложения разных микроорганизмов которые его накапливают, а также из-за миграции из медных и полиметаллических руд.
Человек тоже виноват в загрязнении этим металлом. Сточные воды с разных предприятий занимающеюся рудообогащением, гальваническим, химическим, металлургическим производством могут содержать большие количества соединений кадмия.
Естественные процессы по снижению уровня соединений кадмия являются сорбция, его потребление микроорганизмами и выпадение в осадок малорастворимого карбоната кадмия.
В растворе, кадмий находится, как правило, в форме органо-минеральных и минеральных комплексов. Сорбированные вещества на базе кадмия - важнейшие взвешенные формы этого элемента. Очень важна миграция кадмия в живых организмов (гидробиониты).
Содержание кадмия в природных водоёмах
Уровень кадмия в чистых реках и озерах колеблется на уровне меньше микрограмма на литр, в загрязнённых водах уровень этого элемента доходит до нескольких микрограммов на литр.
Некоторые исследователи считают, что кадмий, в малых количествах, может быть важным для нормального развития животных и человека. Повышенные концентрации кадмия очень опасных для живых организмов.
Предельно-допустимая концентрация кадмия для водной среды
ПДК для водной среды не превышает 1 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз - меньше 0,5 мкг/л.
Кобальт (Co)
Реки и озера могут загрязниться кобальтом как следствие выщелачивания медных и других руд, из почв во время разложения вымерших организмов (животные и растения), ну и конечно же в результате активности химических, металлургических и металлообрабатывающих предприятии.
Главные формы соединений кобальта находится в растворенном и взвешенном состояниях. Вариации между этими двумя состояниями могут происходить, из-за изменений рН, температуры и состава раствора. В растворённом состоянии, кобальт содержится в виде органических комплексов. Реки и озера имеют характерность, что кобальт представлен двухвалентным катионом. При наличии большого количества окислителей в растворе, кобальт может окисляться до трехвалентного катиона.
Он входит в состав растений и животным, потому что играет важную роль в их развитии. Входит в число основных микроэлементов. Если в почве наблюдается дефицит кобальта, то его уровень в растениях будет меньше обычного и как следствие могут появиться проблемы со здоровьем у животных (возникает риск возникновения малокровия). Этот факт наблюдается особенно в таежно-лесной нечерноземной зоне. Он входит в состав витамина В12, регулирует усвоение азотистых веществ, повышает уровень хлорофилла и аскорбиновой кислоты. Без него растения не могут наращивать необходимое количество белка. Как и все тяжелые металлы, он может быть токсичным в больших количествах.
Содержание кобальта в природных водоёмах
Предельно-допустимая концентрация кобальта для водной среды
ПДК кобальта для водной среды - 0,1 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз - 0,01 мг/л.
Марганец (Mn)
Марганец поступает в реки и озера по таким же механизмам, как и железо. Главным образом, освобождение этого элемента в растворе происходит при выщелачивании минералов и руд, которые содержат марганец (черная охра, браунит, пиролюзит, псиломелан). Также марганец может поступать вследствие разложения разных организмов. Промышленность имеет, думаю, самую большую роль в загрязнении марганцем (сточные воды с шахт, химическая промышленность, металлургия).
Снижение количества усваиваемого металла в растворе происходит, как и в случае с другими металлами при аэробных условиях. Mn(II) окисляется до Mn(IV), вследствие чего выпадает в осадок в форме MnO2. Важными факторами при таких процессах считаются температура, количество растворённого кислорода в растворе и рН. Снижение растворённого марганца в растворе может возникнуть при его употреблении водорослями.
Мигрирует марганец в основном в форме взвеси, которые, как правило, говорят о составе окружающих пород. В них он содержится как смесь с другими металлами в виде гидроксидов. Преобладание марганца в коллоидальной и растворенной форме говорят о том что он связан с органическими соединениями образуя комплексы. Стабильные комплексы замечаются с сульфатами и бикарбонатами. С хлором, марганец образует комплексы реже. В отличие от других металлов, он слабее удерживается в комплексах. Трехвалентный марганец образует подобные соединения только при присутствии агрессивных лигандов. Другие ионные формы (Mn4+, Mn7+)менее редки или вовсе не встречаются в обычных условиях в реках и озерах.
Содержание марганца в природных водоёмах
Самыми бедными в марганце считаются моря - 2 мкг/л, в реках содержание его больше - до 160 мкг/л, а вот подземные водохранилища и в этот раз являются рекордсменами - от 100 мкг до несколько мг/л.
Для марганца характерны сезонные колебания концентрации, как и у железа.
Выявлено множество факторов, которые влияют на уровень свободного марганца в растворе: связь рек и озер с подземными водохранилищами, наличие фотосинтезирующих организмов, аэробные условия, разложение биомассы (мертвые организмы и растения).
Немаловажная биохимическая роль этого элемента ведь он входит в группу микроэлементов. Многие процессы при дефиците марганца угнетаются. Он повышает интенсивность фотосинтеза, участвует в метаболизме азота, защищает клетки от негативного воздействия Fe(II) при этом окисляя его в трехвалентную форму.
Предельно-допустимая концентрация марганца для водной среды
ПДК марганца для водоёмов - 0,1 мг/л.
Медь (Cu)
Такой важной роли для живых организмов не имеет ни один микроэлемент! Медь - один из самых востребованных микроэлементов. Он входит в состав многих ферментов. Без него почти ничего не работает в живом организме: нарушается синтез протеинов, витаминов и жиров. Без него растения не могут размножаться. Всё-таки избыточное количество меди вызывает большие интоксикации во всех типов живых организмов.
Уровень меди в природных водоёмах
Содержание меди в реках, как правило, 2 - 30 мкг/л, в морях - 0,5 - 3,5 мкг/л. Высокий уровень меди в реках и озерах говорит о загрязнении.
Хотя медь имеет две ионные формы, чаще всего в растворе встречается Cu(II). Обычно, соединения Cu(I) трудно растворимые в растворе (Cu2S, CuCl, Cu2O). Могут возникнуть разные акваионны меди при наличии всяких лигандов.
При сегодняшнем высоком употреблении меди в промышленности и сельское хозяйство, этот металл может послужить причиной загрязнения окружающей среды. Химические, металлургические заводы, шахты могут быть источниками сточных вод с большим содержанием меди. Процессы эрозии трубопроводов тоже имеют свои вклад в загрязнении медью. Самыми важными минералами с большим содержанием меди считаются малахит, борнит, халькопирит, халькозин, азурит, бронтантин.
Предельно-допустимая концентрация меди для водной среды
ПДК меди для водной среды считается 0,1 мг/л, в рыбохозяйственных прудах ПДКрыбхоз меди уменьшается до 0,001 мг/л.
Молибден (Mo)
Во время выщелачивания минералов с высоким содержанием молибдена, освобождаются разные соединения молибдена. Высокий уровень молибдена может замечаться в реках и озерах, которые находятся рядом с фабриками по обогащению и предприятиями занимающиеся цветной металлургией. Из-за разных процессов осаждения труднорастворимых соединений, адсорбции на поверхности разных пород, а также употребления водными водорослями и растениями, его количество может заметно уменьшится.
В основном в растворе, молибден может находиться в форме аниона MoO42-. Есть вероятность присутствия молибденоорганических комплексов. Из-за того что при окисления молибденита формируются рыхлые мелкодисперсные соединения, повышается уровень коллоидального молибдена.
Содержание молибдена в природных водоёмах
Уровень молибдена в реках колеблется между 2,1 и 10,6 мкг/л. В морях и океанах его содержание - 10 мкг/л.
При малых концентрациях, молибден помогает нормальному развитию организма (так растительного, как и животного), ведь он входит в категорию микроэлементов. Также он является составной частью разных ферментов как ксантиноксилазы. При недостатке молибдена возникает дефицит этот фермента и таким образом могут проявляться отрицательные эффекты. Избыток этого элемента тоже не приветствуется, потому что нарушается нормальный обмен веществ.
Предельно-допустимая концентрация молибдена для водной среды
ПДК молибдена в поверхностных водоёмах должен не превышать 0,25 мг/л.
Мышьяк (As)
Загрязнены мышьяком в основном районы, которые находятся близко к минеральным рудников с высоким содержанием этого элемента (вольфрамовые, медно-кобальтовые, полиметаллические руды). Очень малое количество мышьяка может произойти при разложении живых организмов. Благодаря водным организмам, он может усваиваться этими. Интенсивное усваивание мышьяка из раствора замечается в период бурного развития планктона.
Важнейшими загрязнителями мышьяком считаются обогатительная промышленность, предприятия по производству пестицидов, красителей, а также сельское хозяйство.
Озера и реки содержат мышьяк в два состояния: во взвешенном и растворённом. Пропорции между этими формами может меняться в зависимости от рН раствора и химической композиции раствора. В растворённом состоянии, мышьяк может быть трехвалентном или пятивалентном, входя в анионные формы.
Уровень мышьяка в природных водоёмах
В реках, как правило, содержание мышьяка очень низкое (на уровне мкг/л), а в морях - в среднем 3 мкг/л. Некоторые минеральные воды могут содержать большие количества мышьяка (до несколько миллиграммов на литр).
Больше всего мышьяка могут, содержат подземные водохранилища - до несколько десяток миллиграммов на литр.
Его соединения очень токсичны для всех животных и для человека. В больших количествах, нарушаются процессы окисления и транспорт кислорода к клеткам.
Предельно-допустимая концентрация мышьяка для водной среды
ПДК мышьяка для водной среды - 50 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз - тоже 50 мкг/л.
Никель (Ni)
На содержание никеля в озерах и реках влияют местные породы. Если рядом с водоёмом находятся месторождения никелевых и железно-никелевых руд концентрации могут быть и ещё больше нормального. Никель может поступить в озера и реки при разложении растениях и животных. Сине-зеленые водоросли содержат рекордные количества никеля по сравнению с другими растительными организмами. Важные отходные воды с высоким содержанием никеля освобождаются при производстве синтетического каучука, при процессах никелирования. Также никель в больших количествах освобождается во время сжигания угля, нефти.
Высокий рН может послужить причиной осаждения никеля в форме сульфатов, цианидов, карбонатов или гидроксидов. Живые организмы могут снизить уровень подвижного никеля, употребляя его. Важны и процессы адсорбции на поверхности пород.
Вода может содержать никель в растворённой, коллоидальной и взвешенной формах (баланс между этими состояниями зависит от рН среды, температуры и состава воды). Гидроксид железа, карбонат кальция, глина хорошо сорбируют соединения содержащие никель. Растворённый никель находится в виде комплексов с фульвовой и гуминовой кислот, а также с аминокислотами и цианидами. Самой стабильной ионной формой считается Ni2+. Ni3+, как правило, формируется при большом рН.
В середине 50ых годов никель был внесён в список микроэлементов, потому что он играет важную роль в разных процессах как катализатор. В низких дозах он имеет положительный эффект на кроветворные процессы. Большие дозы всё-таки очень опасны для здоровья, ведь никель - канцерогенный химический элемент и может спровоцировать разные заболевания дыхательной системы. Свободный Ni2+ более токсичный, чем в форме комплексов (примерно в 2 раза).
Уровень никеля в природных водоёмах
В реках, содержание никеля - 0,8 - 10 мкг/л, а при загрязнении даже несколько десяток микрограммов на литр. В морях в среднем содержание этого металла - 2 мкг/л, а в подземных водохранилищах даже несколько миллиграммов на литр воды. Рядом с породами содержащие никелевые минералы, подземные водохранилища могут содержать до 20 г/л.
Предельно-допустимая концентрация никеля для водной среды
ПДК никеля для водной среды - 0,1 мг/л, а вот в рыбохозяйственных прудах ПДКрыбхоз - 0,01 мг/л.
Олово (Sn)
Природными источниками олова являются минералы, которые содержат этот элемент (станнин, касситерит). Антропогенными источниками считаются заводы и фабрики по производству разных органических красок и металлургическая отрасль работающая с добавлением олова.
Олово - малотоксичный металл, вот почему употребляя пищу из металлических консервов мы не рискуем своим здоровьем.
Содержание олова в природных водоёмах
Озера и реки содержат меньше микрограмма олова на литр воды. Подземные водохранилища могут содержать и несколько микрограммов олова на литр.
Предельно-допустимая концентрация олова для водной среды
ПДК олова для водной среды - 2 мг/л.
Ртуть (Hg)
Главным образом, повышенный уровень ртути в воде замечается в районах где есть месторождения ртути. Самые частые минералы - ливингстонит, киноварь, метациннабарит. Сточная вода с предприятий по производству разных лекарств, пестицидов, красителей может содержать важные количества ртути. Другим важным источником загрязнения ртутью считаются тепловые электростанции (которые используют как горючее уголь).
Его уровень в растворе уменьшается главным образом за счёт морских животных и растений, которые накапливают и даже концентрировать ртуть! Иногда содержание ртути в морских обитателей поднимается в несколько раз больше чем в морской среде.
Природная вода содержит ртуть в две формы: взвешенную (в виде сорбированных соединений) и растворённую (комплексные, минеральные соединения ртути). В определённых зонах океанов, ртуть может появляться в виде метилртутных комплексов.
Содержание ртути в природных водоёмах
Содержание ртути в реках в среднем - десятки доли микрограмма на литр воды, в морях - 0,03 мкг/л. Самый большой уровень ртути содержится в подземной воде - 1 - 3 мкг/л.
Ртуть и его соединения очень токсичны. При больших концентрациях, имеет отрицательное действие на нервную систему, провоцирует изменения в крови, поражает секрецию пищеварительного тракта и двигательную функцию. Очень опасны продукты переработки ртути бактериями. Они могут синтезировать органические вещества на базе ртути, которые во много раз токсичнее неорганических соединений. При употреблении рыбы, соединения ртути могут попасть в наш организм.
Предельно-допустимая концентрация ртути для водной среды
ПДК ртути в обычной воде - 0,5 мкг/л, а в рыбохозяйственных прудах ПДКрыбхоз - меньше 0,1 мкг/л.
Свинец (Pb)
Реки и озера могут загрязняться свинцом натуральным путём при смывании минералов свинца (галенит, англезит, церуссит), так и антропогенным путём (сжигание угля, применение тетраэтилсвинца в топливе, сбросы фабрик по рудообогащению, сточные воды с шахт и металлургических заводов). Осаждение соединений свинца и адсорбция этих веществ на поверхности разных пород являются важнейшими натуральными методами понижения его уровня в растворе. Из биологических факторов, к уменьшению уровня свинца в растворе ведут гидробионты.
Свинец в реках и озерах находится во взвешенной и растворённой форме (минеральные и органоминеральные комплексы). Также свинец находится в виде нерастворимых веществ: сульфаты, карбонаты, сульфиды.
Содержание свинца в природных водоёмах
Содержание свинца в реках - несколько микрограммов на литр. В реках и озерах, находящийся рядом с полиметаллическими рудниками, уровень свинца может подниматься до несколько десятков миллиграммов на литр. Термальные хлорные воды тоже могут содержать до несколько миллиграммов свинца на литр.
Про токсичность этого тяжелого металла мы наслышаны. Он - очень опасный даже при малых количествах и может стать причиной интоксикации. Проникновение свинца в организм осуществляется через дыхательную и пищеварительную систему. Его выделение из организма протекает очень медленно, и он способен накапливаться в почках, костях и печени.
Предельно-допустимая концентрация свинца для водной среды
ПДК свинца для водной среды - 0,03 мг/л, а в рыбохозяйственных прудах ПДКрыбхоз - 0,1 мг/л.
Тетраэтилсвинец
Он служит в качестве антидетонатора в моторном топливе. Таким образом, основными источниками загрязнения этим веществом - транспортные средства.
Это соединение - очень токсичное и может накапливаться в организме.
Предельно-допустимая концентрация тетраэтилсвинца для водной средыПредельно-допустимый уровень этого вещества приближается к нулю.
Тетраэтилсвинец вообще не допускается в составе вод.
Серебро (Ag)
Серебро главным образом попадает в реки и озера из подземных водохранилищах и как следствие сброса сточных вод с предприятий (фотопредприятия, фабрики по обогащению) и рудников. Другим источником серебра могут быть альгицидные и бактерицидные средства.
В растворе, самые важные соединения являются галоидные соли серебра.
Содержание серебра в природных водоёмах
В чистых реках и озерах, содержание серебра - меньше микрограмма на литр, в морях - 0,3 мкг/л. Подземные водохранилища содержат до несколько десяток микрограммов на литр.
Серебро в ионной форме (при определённых концентрациях) имеет бактериостатический и бактерицидный эффект. Для того чтобы можно было стерилизовать воду при помощи серебра, его концентрация должна быть больше 2*10-11 моль/л. Биологическая роль серебра в организм ещё недостаточно известна.
Предельно-допустимая концентрация серебра для водной среды
Предельно-допустимая серебра для водной среды - 0,05 мг/л.
www.net-bolezniam.ru
4.2 Токсичные элементы для растений
В почвах содержатся элементы, которые могут быть токсичными для растений, угнетая их рост и развитие, хотя при этом в небольших количествах они являются жизненно необходимыми.
Сера. В почвах с непромывным водным режимом и при аэробных условиях сера накапливается в виде гипса или входит в состав легкорастворимых солей. Сульфаты магния и натрия - важнейшие компоненты засоленных почв, отрицательно влияющие на плодородие почв. Такие почвы требуют промывки или других видов мелиорации. Гипс оказывает положительное влияние при умеренном содержании, предупреждая образование солонцов или способствуя их мелиорации. При высоких уровнях накопления гипс образует плотные скопления, резко ухудшая физические свойства почв.
В анаэробных условиях образование Н2S ведет к снижению продуктивности почв. Восстановительные зоны можно рассматривать как геохимические барьеры для железа и многих других металлов, образующих трудно растворимые сульфиды, которые способствуют увеличению щелочности и развитию солонцов.
Вместе с тем сера - необходимый для живых организмов элемент. Она является обязательным компонентом белков, и жизнь без серы невозможна.
Другой источник серы - поступление в почву сульфатов и серной кислоты техногенного происхождения с атмосферными осадками. Оксиды серы поступают в атмосферу с продуктами сгорания различных видов серосодержащего топлива. Образующаяся в атмосфере серная кислота вместе с атмосферными осадками поступает в почву, вызывая в гумидных районах нежелательное увеличение почвенной кислотности. В северном полушарии с осадками выпадает в среднем 3-15 кг серы на га в год. В промышленных районах эта нагрузка возрастает до 100-150 кг серы на га в год. Многие исследователи считают. Что если ежегодно на 1 га пашни поступает 12 кг серы, то этого достаточно для обеспечения потребностей сельскохозяйственных культур.
Цинк, кадмий, ртуть при высоких содержаниях являются токсичными для растений. Эти три металла являются наиболее опасными при накоплении в почвах и водах. Все соединения кадмия являются токсичными. Пределы колебаний в незагрязненных почвах достаточно велики и для цинка составляют 10-300 мг/кг, для кадмия - от 0,01 до 0,7 мг/кг, для ртути - от 0,01 до 0,8 мг/кг. Для этих элементов характерна низкая растворимость карбонатов, некоторых фосфатов и сульфидов. В автоморфных почвах продуктами накопления цинка, кадмия и ртути могут быть их карбонаты, а в бескарбонатных почвах в твердых фазах - фосфаты этих металлов.
В породах цинк распределён очень неравномерно. Важнейший минерал цинка – сфалерит, также цинк встречается в слюдах и амфиболах. Цинк находится в рассеянном состоянии в километровой толще гранитного слоя земли в виде свинцово-цинковых руд. Цинк – один из главных биофильных микроэлементов, он входит в состав нескольких ферментов и поэтому участвует в белковом, углеводном, липоидном, фосфорном обмене веществ. В его отсутствии или недостатке нарушается биосинтез витаминов и ростовых веществ. Коэффициент биологического поглощения цинка в 12 раз выше, чем у свинца. Большая часть цинка в растениях сосредоточена в легко разрушающихся тканях и быстро удаляется из растения (Безуглова О.С., Орлов Д.С., 2000).
В почвах наблюдается биогенная аккумуляция цинка. Большая часть цинка находится в комплексах с органическом веществом почвы или сорбирована плёнками гидроксидов железа. В нейтральных и щелочных условиях цинк малоподвижен, так как рН выпадения гидроксида цинка в осадок – 6,8. Однако при дальнейшем повышении рН цинк снова переходит в раствор за счёт образования солей цинковой кислоты – цинкатов. На сероводородном барьере цинк накапливается в виде практически нерастворимого сульфида.
Накопление цинка происходит в зонах напряжённого автотранспорта, вдоль автострад, в индустриальных центрах. Некоторое количество цинка поступает в атмосферу, а также при вулканических извержениях и в результате выделения летучих органических соединений бактериями.
Кадмий содержится в сернистых рудах цинка, свинца и меди. Источником загрязнения кадмием является металлургия цинка и свинца. Пылистые загрязнения, включающие кадмий, могут передвигаться на расстояния свыше 50 км и загрязнять почвы, расположенные далеко от промышленных заводов и электростанций. Существенным источником загрязнения почв кадмием могут быть фосфорные удобрения. Содержание кадмия в суперфосфате достигает 170 мг/кг (в среднем – 36-40 мг/кг). До 15 мг кадмия на 1 кг содержится в известняке, от 1 до 170 мг – в калийных удобрениях, 0,4 мг – в сухой массе навоза, до 50 мг – в осадках городских сточных вод, до 180 мг/кг – в сапропеле (Минеев В.Г., 1990). Ежегодное внесение в почву удобрений и мелиорантов, содержащих кадмий, приводит к его накоплению в почве и растениях. При этом до 80 % кадмия, внесенного в почву, может удерживаться в пахотном слое. Предельно допустимая концентрация внесения кадмия в почву с удобрениями составляет до 4 г/га в год (содержание его в пахотном слое – около 0,55 кг/га). Пределы варьирования ПДК для кадмия в почве находится в диапазоне 1-5 мг/кг. Официальные ПДК в России по кадмию отсутствуют. Существует только официально утвержденный фон – 0,5 мг/кг.
По геохимическим свойствам кадмий похож на цинк, но он легче соединяется с серой и проявляет большую подвижность в природе. В кислой среде кадмий характеризуется большой мобильностью (рН 4,5-5,5). Изменение реакции почвы на близкую к нейтральной или щелочную и внесение органического вещества снижает сорбцию кадмия почвой и поглощение этого металла растениями.
Кадмий является одним из металлов, производящих самые большие изменения в биологических свойствах почвы, так как отрицательно действует на количество почвенных микроорганизмов. Сильное подавляющее действие оказывает кадмий на актиномицеты, меньше происходит снижение численности бактерий, а меньше всего – грибов (Нейтрализация загрязнённых почв, 2008). Поглощение кадмия растениями в излишке вызывает физиологические изменения: нарушение процессов фотосинтеза, транспирации, поглощения макро- и микроэлементов, нарушая ионные равновесия растений. Больше кадмия накапливают в себе корни, листья и стебли, меньше – фрукты, семена и клубни растений.
Симптомами токсичности перенасыщения кадмием являются покраснение жилок, хлоротичные и бурые пятна на листовых пластинках, вызванные изменением хлоропластов, специфичное скручивание листьев, утолщение и укорачивание корней.
Ртуть отличается исключительно сильной биологической и химической активностью, а также лёгкостью изменения агрегатного состояния из жидкого к газообразному и наоборот. По таблице Менделеева она принадлежит к элементам подгруппы цинка.
Рост концентрации ртути в почвах может происходить под влиянием геологических факторов и в результате антропогенного действия. Поступающая в почву ртуть накапливается в верхнем горизонте, так как не подвергается вымыванию в глубокие слои, что связано с большой способностью почвы к сорбированию ртути.
Повышенное содержание ртути в среде является вредным для растений. Признаки токсичности: хлоротичные пятна, побурения по краям листовых пластинок, сокращение и деформация проростков и корней растений.
На биодоступность ртути очень влияют кислотность почвы и содержание органического вещества. Самое большое поглощение ртути растениями происходит при рН 3-5, но находящееся в питательной среде органическое вещество в кислых почвах повышает, а в щелочных понижает количество связываемого металла. Таким образом, для кислых почв одним из основных агротехнических приёмов, ведущих к образованию труднорастворимых соединений ртути, является известкование (Нейтрализация загрязнённых почв, 2008).
Ртуть – классический пример естественного компонента окружающей среды, который становится загрязнителем благодаря человеку. ПДК ртути в почве составляет всего 2 мгкг.
Мышьяк относится к семейству азота. Мышьяк – полуметалл и обладает некоторыми металлическими свойствами, проявляет высокую активность, входит в состав свыше 200 минералов (арсенопирит FeAsS, никелин NiAs), чаще всего связан в сульфидах.
Среднее содержание Аs в почве около 5-6 мг/кг, при колебаниях от 0,1-0,2 до 30-40 мг/кг. Мышьяк и все его соединения очень токсичны. В литературе упоминаются некоторые почвы Аргентины и Новой Зеландии со столь высоким содержанием Аs, что их продукция токсична для млекопитающих.
Среди соединений мышьяка важны мышьяковистая Н3АsО3 и особенно мышьяковая Н3АsО4 кислоты и их соли - арсениты и арсенаты соответственно. Арсенаты аналогичны фосфатам по общим свойствам и по химическому поведению в почвах. В нейтральной и щелочной средах арсенаты соосаждаются с гидроксидами железа и алюминия или адсорбируются на их поверхности. Наиболее прочно полуторные оксиды удерживают арсенат-ионы при низких значениях рН.
Находящиеся в почве соединения и минералы мышьяка легко растворимы, особенно в кислой среде в восстановительных условиях. Миграция мышьяка в гидросферу ограничена сильной сорбцией глинистыми минералами, гидроксидами железа и алюминия, органическими веществами. Кроме того, некоторые минералы (слюды, гетит) связывают мышьяк и оказывают влияние на его накопление в осадочных породах и почвах. Способность мышьяка связываться со многими почвенными компонентами – причина его накопления в верхних слоях и, следовательно, загрязнения почв этим элементом.
Повышенные концентрации мышьяка обнаруживаются в пахотных почвах, на которых сельскохозяйственные растения обрабатывались мышьяковистыми препаратами, и на почвах, подверженных техногенному загрязнению (добыча и переработка цветных металлов, добыча и сжигание углей, металлургическая и химическая промышленность, большие городские агломерации, очистки сточных вод, в почвах огородов и садов).
Накопление мышьяка возможно и при использовании минеральных и органических удобрений, загрязненных этим элементом. В двойном суперфосфате содержание мышьяка может достигать 300, аммиачной селитре – 60 мг/кг. С нитратами, сульфатами, мочевиной в почву попадает от 1 до 10 г/га мышьяка (Минеев В.Г., 1993). Токсичная концентрация мышьяка в почве, принятая за рубежом, соответствует 50 мг/кг. Официальное ПДК в России на содержание мышьяка в почве составляет 2,0 мг/кг (Временная инструкция …, 1992).
Поведение мышьяка в почве проявляется и зависит от микробиологической активности. Находящиеся в почве микроорганизмы могут влиять на образование различных видов этого вещества, благодаря им происходит окисление арсенидов на арсенаты и др. процессы. Окисление серных минералов мышьяка может быть причиной повышения кислотности почвы в случае, когда концентрация карбонатов слишком мала, чтобы нейтрализовать этот процесс. Снижение рН почвы приводит к уменьшению количества адсорбированного мышьяка, и тем самым к увеличению его концентрации в почвенном растворе. Последствием этого процесса является более высокая способность мышьяка ассимилироваться растениями, а также перемещаться в более глубокие слои почвы. Кроме того, неблагоприятная для бактерий сильнокислая среда приводит к уменьшению распада вредных органических веществ, а также растительных отходов.
Мышьяк поглощается всеми растениями, но до сих пор не выявлена его биологическая роль. Самое низкое содержание мышьяка обнаружено в зерне хлебных культур (за исключением риса), а самое высокое – в шпинате. Поглощение мышьяка растениями соответствует его содержанию в почве. Симптомы токсичности мышьяка в растениях сводятся к изменению цвета листьев и повреждению корневой системы, рост растений останавливается, а более чувствительные растения могут погибнуть (Нейтрализация загрязнённых почв, 2008).
Известкование, вызывая повышение рН почвы, влияет на понижение подвижности мышьяка в данной среде, а значит, на уменьшение поглощения мышьяка растениями. Большое влияние на мобильность мышьяка оказывает органическое вещество, которое способствует его детоксикации. Удобрения, богатые соединениями серы, могут ограничить доступность мышьяка путём связывания его в слаборастворимые и мало мобильные сульфаты. Обогащение почвы фосфатами способствует образованию слаборастворимых сульфатов мышьяка, которые менее вредны для окружающей среды.
Свинец. Этот элемент является высоко токсичным: ингибирует ферментативные реакции, вступая в химическое взаимодействие с белками и осаждая их; повышенные концентрации представляют угрозу для здоровья человека; действие свинца проявляется в заболеваниях нервной системы, печени, почек и других органов.
Свинец широко используется в промышленности и на транспорте и вместе с отходами производства попадает в почву. Например, в США только за счет выхлопных газов автотранспорта в атмосферу попадает до 100000 т свинца ежегодно.
Резкое увеличение содержания свинца наблюдается в почвах вблизи автомобильных дорог. Если при плотности движения на автостраде в 11000 машин в час содержание Рb в почве было около 6,4 мг/кг, то при плотности движения 32000 в час оно растет до 36-37 мг/кг. Наибольшему загрязнению подвержена прилегающая к автостраде полоса шириной 10-15 м (по обе стороны дороги). При интенсивном движении загрязнение свинцом прослеживается в зоне до 100-150 м. Быстро нарастающее содержание подвижных соединений свинца в почвах приводит к повышению его содержания в растениях.
Наибольшее влияние на состояние свинца в почвах оказывают следующие анионы: СО32-, ОН-, S2-, РО43-, SО42-. Попадающий в почву Рb сравнительно легко образует гидроксид в условиях нейтральной и щелочной реакции. Если почва содержит растворимые фосфаты, то Рb(ОН)2 переходит постепенно в Рb3(РО4)2 или другие трудно растворимые фосфаты. Эти соединения определяют уровень концентрации Рb в почвенных растворах.
Свинец находится в минеральных удобрениях, извести и навозе, достигая в некоторых удобрениях до 300 мг/кг, навозе – до 10, в осадках городских сточных вод – от 13 до 19370 мг на 1 кг сухой массы. Доля выпадения свинца с осадками – 11-38 %.
Ванадий. Среднее содержание ванадия близко к 100 мг/кг при колебаниях от 20 до 500 мг/кг. Известно большое число ванадийсодержащих минералов различных классов, в том числе оксиды (корвусит, алаит, монтрозеит), сульфиды (сульванит Cu3VS4), ванадаты (карнотит), различные силикаты.
В почвах ванадий может находиться как в составе первичных минералов, так и в различных вторичных. Ванадат-ион адсорбируется гидроксидами Fe и Аl, связывается органическими веществами (особенно в щелочных почвах), а также образует нерастворимые соединения с тяжелыми металлами.
Из числа галогенов почвы содержат в макроколичествах только хлор, фтор, йод – важнейшие микроэлементы.
Фтор. Недостаток фтора приводит к развитию кариеса, так как постепенно разрушается эмаль. Избыток фтора в почвах оказывает токсичное влияние на травоядных животных. Глубокие изменения свойств почв возможны в районах промышленных комплексов, выбросы которых обогащены фтором.
Источниками загрязнения почв фтором являются предприятия по производству алюминия, фосфорных удобрений, тепловые электростанции. Фтор поступает в почву также с пестицидами и фосфорными удобрениями до 15-20 кг/га в год. В наиболее загрязненных районах содержание фтора может достигать 1000-2000 мг/кг почвы. Среднее содержание фтора в незагрязненных почвах также сравнительно велико – около 200 мг/кг, при колебаниях от 30 до 300 мг/кг. ПДК содержания фтора в почвах составляет 2,8 мг/кг. Источниками фтора являются такие минералы, как фторапатит Са10(РО4)6F2, слюды, криолит Na3AlF6, флюорит CaF2.
Попадающие за счет выбросов предприятий фториды достаточно интенсивно поглощаются твердыми фазами. Высокое содержание фторидов вызывает существенные изменения химических свойств почвы: смещение рН в щелочную область, увеличивается содержание водорастворимых органических веществ, снижаются окислительные потенциалы, происходит мобилизация соединений железа и марганца. Все это неблагоприятно отражается на показателях биологической активности почв. Загрязнение почв фтором представляет значительную опасность для почвенного покрова, снижает плодородие почв, вызывает их деградацию.
Хлор. В почвах накапливаются соли НСl – хлориды. Все встречающиеся в почве хлориды натрия, калия, кальция, магния и большинства микроэлементов легко растворимы. Исключения составляют хлорид серебра и некоторые соединения ртути. Уровень содержания хлоридов колеблется в широких пределах – от 1-10 мг/кг в почвах гумидных областей до целых процентов в засоленных почвах (солончаках, солонцах). Предельно допустимая концентрация хлоридов в почвах составляет 0,01 % или 0,3 мг-экв/100г почвы. Хлориды являются наиболее токсичными солями.
studfiles.net
| № п/п | Наименование Вещества | ПДК, мг/кг почвы | Лимитирующий показатель | Класс опасности |
| 1 | 2 | 3 | 4 | 5 |
| Органические вещества | ||||
| 97 | Альфаметилстирол | 0,5 | Воздушно-миграционный | 3 |
| 98 | Ацетальдегид | 10,0 | Воздушно-миграционный | 3 |
| 99 | Бенз(а)пирен | 0,02 | Общесанитарный | 1 |
| 100 | Бензин | 0,1 | Воздушно-миграционный | 2 |
| 101 | Бензол | 0,3 | Воздушно-миграционный | 1 |
| 102 | Изопропилбензол | 0,5 | Воздушно-миграционный | 3 |
| 103 | Изопропилбензол + альфаметилстирол | 0,5 | Воздушно-миграционный | 2 |
| 104 | Ксилолы (орто-, мета-, пара-) | 0,3 | Транслокационный | 3 |
| 105 | Отходы флотации угля (далее - ОФУ) | 3000 | Водно-миграционный и общесанитарный | 1 |
| 106 | Стирол | 0,1 | Воздушно-миграционный | 3 |
| 107 | Толуол | 0,3 | Транслокационный и воздушно-миграционный | 2 |
| 108 | Фенантрен | 0,01 | Фитотоксический | 1 |
| 109 | Формальдегид | 7,0 | Воздушно-миграционный | 2 |
| 110 | Фурфурол | 3,0 | Общесанитарный | 3 |
| Неорганические вещества | ||||
| 111 | Ванадий | 150,0 | Общесанитарный | 3 |
| 112 | Ванадий+марганец | 100,0+1000,0 | Общесанитарный | 2 |
| 113 | Мышьяк | 2,0 | Транслокационный | 1 |
| 114 | Нитраты | 130,0 | Водно-миграционный | 1 |
| 115 | Свинец | 32,0 | Общесанитарный | 1 |
| 116 | Сера (препараты – Суперсикс, Польсульколь, Сульфарид) | 160,0 | Общесанитарный | 3 |
| 117 | Сероводород | 0,4 | Воздушно-миграционный | 4 |
| 118 | Суперфосфат (Р2О5) | 200,0 | Транслокационный | 4 |
| 119 | Сурьма | 4,5 | Воздушно-миграционный | 2 |
| 120 | Ртуть | 2,1 | Транслокационный | 1 |
| 121 | Хлористый калий | 360,0 | Водно-миграционный | 4 |
studfiles.net
ПРЕДЕЛЬНО ДОПУСТИМАЯ КОНЦЕНТРАЦИЯ ВРЕДНЫХ ВЕЩЕСТВ
ПРЕДЕЛЬНО ДОПУСТИМАЯ КОНЦЕНТРАЦИЯ (ПДК) ВРЕДНЫХ ВЕЩЕСТВ – это максимальная концентрация вредного вещества, которая за определенное время воздействия не влияет на здоровье человека и его потомство, а также на компоненты экосистемы и природное сообщество в целом.
В атмосферу поступает множество примесей от различных промышленных производств и автотранспорта. Для контроля их содержания в воздухе нужны вполне определенные стандартизированные экологические нормативы, поэтому и было введено понятие о предельно допустимой концентрации. Величины ПДК для воздуха измеряются в мг/м3. Разработаны ПДК не только для воздуха, но и для пищевых продуктов, воды (питьевая вода, вода водоемов, сточные воды), почвы.
Предельной концентрацией для рабочей зоны считают такую концентрацию вредного вещества, которая при ежедневной работе в течение всего рабочего периода не может вызвать заболевания в процессе работы или в отдаленные сроки жизни настоящего и последующих поколений.
Предельные концентрации для атмосферного воздуха измеряются в населенных пунктах и относятся к определенному периоду времени. Для воздуха различают максимальную разовую дозу и среднесуточную.
В зависимости от значения ПДК химические вещества в воздухе классифицируют по степени опасности. Для чрезвычайно опасных веществ (пары ртути, сероводород, хлор) ПДК в воздухе рабочей зоны не должна превышать 0,1 мг/м3. Если ПДК составляет более 10 мг/м3, то вещество считается малоопасным. К таким веществам относят, например, аммиак.
| Таблица 1. ПРЕДЕЛЬНО ДОПУСТИМЫЕ КОНЦЕНТРАЦИИ некоторых газообразных веществ в атмосферном воздухе и воздухе производственных помещений | ||
| Вещество | ПДК в атмосферном воздухе, мг/м3 | ПДК в воздухе произв. помещений, мг/м3 |
| Диоксид азота | Максимальная разовая 0,085Среднесуточная 0,04 | 2,0 |
| Диоксид серы | Максимальная разовая 0,5Среднесуточная 0,05 | 10,0 |
| Монооксид углерода | Максимальная разовая 5,0Среднесуточная 3,0 | В течение рабочего дня 20,0В течение 60 мин.* 50,0В течение 30 мин.* 100,0В течение 15 мин.* 200,0 |
| Фтороводород | Максимальная разовая 0,02Среднесуточная 0,005 | 0,05 |
| * Повторные работы в условиях повышенного содержания СО в воздухе рабочей зоны могут проводиться с перерывом не менее 2 часов | ||
| Таблица 2. ПРЕДЕЛЬНО ДОПУСТИМЫЕ КОНЦЕНТРАЦИИ некоторых ионов в питьевой воде | |
| Ион | ПДК, г/м3 |
| Катион алюминия | 0,2 |
| Катион железа | 0,2 |
| Катион меди | 0,01 |
| Катион ртути | 0,01 |
| Катион цинка | 0,01 |
| Нитрат-ион | 0,5 |
| Сульфат-ион | 20 |
| Хлорид-ион | 20 |
| Таблица 3. ПРЕДЕЛЬНО ДОПУСТИМЫЕ КОНЦЕНТРАЦИИ некоторых вредных веществ в питьевой воде | |
| Вещество | ПДК, мкг/л |
| Гидрохинон | 200 |
| Дихлорфенол | 2 |
| Крезол | 4 |
| Пентахлорфенол | 10 |
| Трихлорфенол | 4 |
| Трихлорэтилен | 70 |
| Фенол | 1 |
| Хлороформ | 60 |
| Четыреххлористый углерод | 6 |
| Таблица 4. ПРЕДЕЛЬНО ДОПУСТИМЫЕ КОНЦЕНТРАЦИИ некоторых химических элементов в почве | |
| Элемент | ПДК, мг/кг |
| Кобальт | 5 |
| Медь | 3 |
| Мышьяк | 2 |
| Ртуть | 2 |
| Свинец | 20 |
| Сурьма | 5 |
| Фтор | 3 |
| Цинк | 20 |
ПДК устанавливаются для среднестатистического человека, однако ослабленные болезнью и другими факторами люди могут почувствовать себя дискомфортно при концентрациях вредных веществ, меньших ПДК. Это, например, относится к заядлым курильщикам.
Величины предельно допустимых концентраций некоторых веществ в ряде стран существенно различаются. Так, ПДК сероводорода в атмосферном воздухе при 24-часовом воздействии в Испании составляет 0,004 мг/м3, а в Венгрии – 0,15 мг/м3 (в России – 0,008 мг/м3).
В нашей стране нормативы предельно допустимой концентрации разрабатываются и утверждаются органами санитарно-эпидемиологической службы и государственными органами в области охраны окружающей среды. Нормативы качества окружающей среды являются едиными для всей территории РФ. С учетом природноклиматических особенностей, а также повышенной социальной ценности отдельных территорий для них могут быть установлены нормативы предельно допустимой концентрации, отражающие особые условия.
При одновременном присутствии в атмосфере нескольких вредных веществ однонаправленного действия сумма отношений их концентраций к ПДК не должна превышать единицу, однако это выполняется далеко не всегда. По некоторым оценкам, 67% населения России живут в регионах, где содержание вредных веществ в воздухе выше установленной предельно допустимой концентрации. В 2000 содержание вредных веществ в атмосфере в 40 городах с суммарным населением около 23 млн. человек время от времени превышало предельно допустимую концентрацию более чем в десять раз.
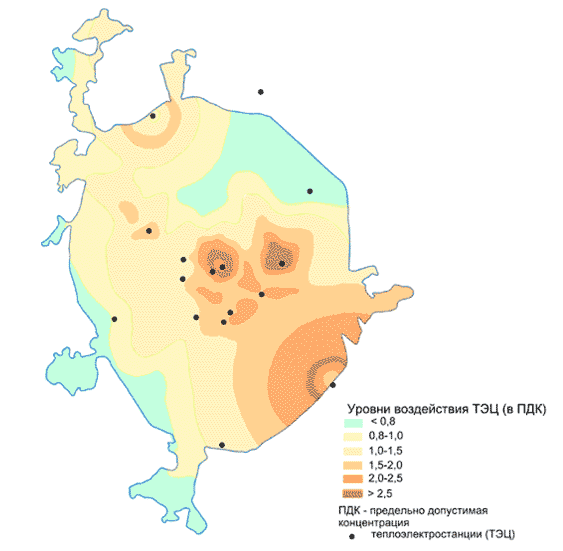
При оценке опасности загрязнения в качестве образца сравнения служат исследования, проводимые в биосферных заповедниках. А вот в крупных городах природная среда далека от идеальной. Так, по содержанию вредных веществ Москву-реку в пределах города считают «грязной рекой» и «очень грязной рекой». На выходе Москвы-реки из Москвы содержание нефтепродуктов в 20 раз больше предельно допустимых концентраций, железа – в 5 раз, фосфатов – в 6 раз, меди – в 40 раз, аммонийного азота – в 10 раз. Содержание серебра, цинка, висмута, ванадия, никеля, бора, ртути и мышьяка в донных отложениях Москвы-реки превышает норму в 10–100 раз. Тяжелые металлы и другие ядовитые вещества из воды попадают в почву (например, при половодьях), растения, рыбу, сельскохозяйственную продукцию, питьевую воду, как в Москве, так и ниже по ее течению в Подмосковье.
Химические методы оценки качества окружающей среды очень важны, однако они не дают прямой информации о биологической опасности загрязняющих веществ – это задача биологических методов. Предельно допустимые концентрации являются определенными нормами щадящего воздействия загрязняющих веществ на здоровье человека и природную среду.
Елена Савинкина
Проверь себя!Ответь на вопросы викторины «Неизвестные подробности»
Какой музыкальный инструмент не может звучать в закрытом помещении?
www.krugosvet.ru