6.8.3. Клональное микроразмножение и оздоровление растений. Клональное микроразмножение растений
6.8.3. Клональное микроразмножение и оздоровление растений
Клональным микроразмножением называют неполовое размножение растений с помощью метода культуры тканей, позволяющее получать растения идентичные исходному. В основе получения таких растений лежит способность соматических клеток растений полностью реализовывать свой потенциал развития, т.е. свойство тотипотентности. Метод клонального микроразмножения получает все более широкое распространение во всем мире. В большинстве стран эта технология приобрела коммерческий характер.
В России первые работы по клональному микроразмножению были проведены в 60-х годах XX в. в лаборатории Р. Г. Бутенко (Институт физиологии растений им. К.А.Тимирязева). В настоящее время созданы и развиваются лаборатории клонального микроразмножения, связанные с нуждами селекции, размножением декоративных, лекарственных и других растений. Кроме того, технология используется для размножения лучших экземпляров взрослых лесных деревьев, особенно хвойных, для сохранения редких и исчезающих видов растений.
Свое название эта технология размножения получила от термина «клон» (от греч. clon — отпрыск), который предложил Веб- бер в 1903 г. Клональное микроразмножение имеет существенные преимущества перед традиционными способами размножения:
Высокий коэффициент размножения. Одно растение герберы за год при микроклональном размножении дает до 1 млн новых растений, тогда как при обычных способах размножения — только 50 — 100 растений. Большинство культивируемых в настоящее время сортов лилий размножается только вегетативно. Луковички возникают на материнских луковицах или на побеге в небольших количествах. Технология микроклонального размножения позволяет получить из одной чешуи луковицы за 6 месяцев 105 новых растений (сорт Red Carpet).
Получение генетически однородного посадочного материала.
Возможность оздоровления растений, освобождения их от вирусов благодаря клонированию меристематических тканей.
Возможность размножения растений, которые в естественных условиях репродуцируются с большим трудом.
Воспроизведение посадочного материала круглый год, что значительно экономит площади, занимаемые маточными и размножаемыми растениями.
6. Сокращение продолжительности селекционного периода, ускорение перехода растений от ювенильной фазы развития к репродуктивной.
Технология микроклонального размножения. Обязательное условие клонального микроразмножения — использование объектов, полностью сохраняющих генетическую стабильность на всех этапах процесса, от экспланта до растений в поле. Такому требованию удовлетворяют апексы и пазушные почки органов стеблевого происхождения, т. е. меристематические ткани. Их устойчивость к генетическим изменениям, вероятно, связана с высокой активностью систем репарации ДНК, а также с негативной селекцией измененных клеток.
Процесс клонального микроразмножения можно подразделить на 3 этапа:
Получение хорошо растущей стерильной культуры. На этом этапе необходимо правильно выбрать растение-донор, получить свободную от инфекции культуру, добиться ее выживания и быстрого роста на питательной среде.
Собственно размножение, осуществляемое несколькими способами:
активизация пазушных меристем;
индукция образования адвентивных почек тканями листа, стебля, чешуйками и донцем луковиц, корневищем и зачатками соцветий без первоначального образования каллусной ткани;
микрочеренкование побега, сохраняющего апикальное доминирование;
стимуляция образования микроклубней и микролуковичек;
индукция соматического эмбриогенеза.
Подготовка к высадке в поле или к реализации. Это очень важный этап, во время которого в теплице укорененные растения, полученные in vitro, адаптируют к новым условиям внешней среды: проводят закаливание растений, повышают их устойчивость к патогенным микроорганизмам и различным неблагоприятным факторам внешней среды. Существует много различных способов адаптирования растений к пересадке in vivo. Это подбор почвенного субстрата, создание определенной влажности, обработка химическими веществами (глицерин, парафин) для предотвращения обезвоживания листьев. Некоторые древесные растения лучше приживаются, если их заразить in vitro микоризооб- разующими грибами (Е.А.Калашникова, 1993). Упрощенный способ адаптации пробирочных растений винограда был разработан в Институте физиологии растений им. К. А. Тимирязева РАН. Адаптацию проводят прямо в пробирках, снимая с них пробки, когда растения винограда дорастают до верха пробирки. Через 1,5 — 2 недели, когда верхушки побега с двумя развитыми листьями появляются над пробиркой, растение готово к пересадке в почву.Для предотвращения механических повреждений корневой системы растение пересаживают в почву вместе с агаром, заглубляя его так, что над поверхностью почвы остаются только 2 развитых листа, которые выросли из пробирки и уже адаптировались к внешним условиям. Такая методика позволяет значительно упростить, ускорить и удешевить этап акклиматизации растений.
Клональное микроразмножение растений проводят разными способами. Первый и основной способ — активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот способ основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается или удалением апикальной меристемы побега, или благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламино- пурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде. Активизацию пазушных меристем широко используют в промышленном размножении овощных сельскохозяйственных культур (картофель, томаты, огурцы, сахарная свекла, топинамбур и др.), цветов (гвоздика, роза, гербера), плодовых и ягодных культур (яблоня, вишня, малина, крыжовник и др.), древесных растений (туя, можжевельник и др.). Однако бесконечно размножать таким способом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда — гибель растений. В опытах с размножением земляники было показано, что при клонировании необходимо чередовать 2 — 3 цикла получения побегов с их укоренением.
Второй способ — индукция развития адвентивных почек, т. е. почек, возникающих из растительных клеток и тканей, которые их обычно не образуют. Этот метод в значительной мере обусловлен тотипотентностью клеток. Почти любой орган или ткань растения, свободные от инфекции, могут быть использованы в качестве экспланта и в определенных условиях образуют адвентивные почки. Данный процесс вызывают внесением в питательную среду определенных концентраций цитокининов и ауксинов, причем цитокинина должно быть гораздо больше, чем ауксина. Это наиболее распространенный способ микроразмножения высших растений. Развивая адвентивные почки на апикальных и пазушных меристемах, размножают растения томата, лука, чеснока; на сегментах листовых пластинок — салат, глоксинию, фиалки; на тканях донца луковиц — лук, чеснок, гладиолусы, тюльпаны и другие луковичные растения.Факторы, влияющие на клональное микроразмножение. Питательная среда. Состав питательной среды — один из наиболее важных факторов при микроразмножении. Обычно используют стандартные среды: Мурасиге-Скуга, Нича и др., но с добавлением на каждом этапе различных веществ. На первом этапе в питательную среду часто вносят антиоксиданты, чтобы предотвратить гибель клеток из-за активизации гидролитических ферментов. Особое значение имеют концентрация и соотношение фитогормонов в среде. Например, на втором этапе для усиления морфогенеза обычно добавляют цитокинины. Напротив, на третьем этапе при укоренении в питательной среде должно быть только небольшое количество ауксинов (либо используется безгормональная среда). Иногда в среду добавляют гиббереллин (ГК), который стимулирует рост сформировавшихся почек. Важным регуляторным фактором служит сахароза. Обычная концентрация ее в среде составляет 3 %. На растениях каперса было показано, что более высокая концентрация сахарозы в среде приводила к образованию пурпурных, содержащих антоциан, почек возобновления. При концентрациях сахарозы менее 3 % наблюдалось формирование зеленых почек, способных к размножению.
Кроме того, существенное значение имеет состояние среды. Например, культивирование меристем земляники, вишни, черной смородины лучше происходит в жидкой питательной среде, чем в агаризованной.
Состояние экспланта. Морфогенез в значительной мере определяется возрастом и размером экспланта. Так, у эхеверии экспланты из молодых листьев образуют корни, из старых листьев — побеги. И только у листьев среднего возраста возникают и побеги, и корни, т.е. появляется возможность регенерации целого растения. Размер экспланта прямо пропорционально связан с регенера- ционной способностью: чем крупнее эксплант, тем выше эта способность. Большие экспланты могут самопроизвольно независимо от соотношения в питательной среде ауксинов и цитокининов образовывать почки. Но увеличение размера может привести к негативным последствиям, так как появляется вероятность присутствия в экспланте клеток, содержащих вирусную, грибковую и другие виды инфекции. Оптимальная величина экспланта должна обеспечивать как активный морфогенез, так и полную стерильность.
На регенерационную способность экспланта влияют также физиологическое состояние и таксономическая принадлежность растения-донора. Например, экспланты, выделенные из растений в фазу покоя, обладают более низкой способностью к укоренению и развитию побегов по сравнению с эксплантами, изолированными в фазу активного роста. Двудольные травянистые растения характеризуются большей регенерационной способностью, чем однодольные.
Чем больше размер экспланта, тем легче идет морфогенез, в результате которого получается целое растение, но тем больше вероятность присутствия вирусов в экспланте. У многих видов и сортов растений зона, свободная от вирусных частиц, различна. Так, при клонировании апикальной меристемы картофеля размером 0,2 мм (конус нарастания с одним листовым зачатком) 70 % полученных растений были свободны от Y-вируса картофеля, но только 10 % — от Х-вируса. В некоторых случаях не удается найти оптимальное соотношение между размером меристематического экспланта и морфогенезом в нем, и при этом избавиться от вирусной инфекции. Приходится дополнять метод культуры меристем термо- или(и) хемитерапией. Так, предварительная термотерапия исходных растений позволяет получать свободные от вирусов растения-регенеранты из меристемных эксплантов размером от 0,3 мм до 0,8 мм. Вместе с тем этот прием может вызвать отставание растений в росте, деформацию органов, увеличение латентных (скрытых) инфекций.
Хорошие результаты дает совместное применение метода культуры тканей и хемитерапии. При внесении в питательную среду препарата «Вирозол» (1-рибофуранозил-1,2,4-триазолкарбоксамид) количество безвирусных растений увеличивается до 80 — 100%.
В настоящее время для диагностики вирусных растений используют иммуноферментную технику, моноклональные антитела, метод молекулярной гибридизации меченых фрагментов РНК- и ДНК-вироидов и вирусов с вирусами тестируемого объекта. Эти методы очень чувствительны, но трудоемки и дорогостоящи.
После оздоровления с помощью вышеперечисленных технологий нормальные растения-регенеранты размножают обычными методами клонального микроразмножения. Для некоторых растений, например цитрусовых, получить морфогенез из меристем малого размера не удается, поэтому требуется разработка оригинальных методов. Лимоны и апельсины оздоровляют и размножают, используя прививки меристем размером 0,14 — 0,18 мм на пробирочные подвои, полученные из семян. Достоинство такого подхода состоит и в том, что развивающиеся из меристем побеги не имеют ювенильных признаков, при этом цветение и плодоношение ускоряются.
6.8.4. Криосохранение
Сохранение разнообразия форм жизни — важнейшая проблема, с которой столкнулось современное человечество. Еще Г. Ф. Гаузе доказал, что устойчивость сообщества тем выше, чем больше число составляющих его видов. Следовательно, сохранение биоразнообразия — единственный механизм стабильности жизни на Земле.Кроме того, для обеспечения питанием растущего населения нашей планеты необходимо выведение новых, более продуктивных сортов сельскохозяйственных растений, а для успешной селекции важен постоянный приток генов из новых источников. Традиционным источником генетического материала служат дикие виды растений. Однако в связи с расширением городов, сельскохозяйственных угодий, вырубкой лесов, ухудшением экологии эти виды постепенно вытесняются, а многие из них находятся на грани вымирания, поэтому их необходимо сохранить.
Существует несколько способов сохранения генофонда высших растений: заповедники, национальные парки, банки семян. В последнее время большое внимание уделяется созданию и развитию новых способов: пересадочных коллекций каллусных клеток, депонированию культур клеток и, наконец, криосохранению, т. е. хранению объектов при очень низкой температуре, обычно это температура жидкого азота (-196 °С). Криосохранение имеет существенные преимущества по сравнению с остальными методами. При сохранении в глубоко замороженном состоянии полностью прекращается обмен веществ, отсутствуют значительные физико- химические молекулярные изменения не только в клетке, но и в окружающей водной среде. Сохраняется генофонд, а следовательно, все свойства замороженного объекта. Единственный негативный фактор, которого не удается избежать, — это фоновая ионизирующая радиация. Однако, по мнению М.Ашвуд-Смита, потребуется примерно 32 000 лет для накопления 10% летальных хромосомных повреждений. Следовательно, криогенный метод дает возможность неограниченно долго хранить растительный материал без существенных изменений: сохраняются жизнеспособность клеток, их свойства, а также способность к морфогенезу и регенерации целых растений.
Сущность метода криосохранения сводится к замораживанию специально подготовленных растительных клеток при использовании криопротекторов — веществ, ослабляющих повреждения клеток при замораживании и оттаивании. В настоящее время известны * два метода криосохранения: программное (медленное) и сверхбыстрое замораживание. Программное замораживание изучалось уже : давно, поэтому оно довольно широко применяется для сохранения животных и растительных клеток. Разработка сверхбыстрого замо-^ раживания началась сравнительно недавно, однако считается, что | именно этот метод со временем станет наиболее перспективным. |
Трудности криосохранения растений связаны со спецификой 1 растительных клеток. Клетки растений имеют большие размеры! (в культуре тканей они изменяются от 15 до 1000 мкм), прочную! целлюлозную стенку и вакуоли. Причем именно степень вакуоли-! зации играет основную роль в устойчивости клеток к действию! низких температур. В зрелой клетке центральная вакуоль занимает!
до 90 % общего объема клетки, т. е. клетка представляет собой как бы резервуар с водой, которая необходима для ее нормальной жизнедеятельности. Поэтому основные факторы, способные привести клетку к гибели при замораживании, — это образование льда и дегидратация. Обычно кристаллы льда сначала образуются во внешнем растворе вокруг клеток. Максимальная скорость их роста в зависимости от состава раствора находится в пределах температур от -20 до -60 "С. При температуре -140 °С рост кристаллов льда совершенно прекращается. Следовательно, и при замораживании, и при оттаивании клеткам очень важно с оптимальной скоростью «проскочить» температуру образования льда. Кристаллы внеклеточного льда могут механически разрушать клетки. Кроме того, они играют водоотнимающую роль, что приводит к значительной дегидратации клетки и возможной ее гибели от осмотического стресса. При очень быстром замораживании лед может образовываться и внутри клеток, что ведет к разрушению в ней многочисленных мембран.
Избежать кристаллизации льда помогла бы витрификация воды, т. е. затвердение ее в аморфном состоянии. Получить витрифика- цию чистой воды практически невозможно. Но в коллоидных растворах скорость образования центров кристаллизации и роста кристаллов льда снижается и повышается температура, при которой их рост прекращается. Все это облегчает витрификацию. Добавление криопротекторов также затрудняет кристаллизацию льда и способствует витрификации.
Наиболее известны такие криопротекторы, как диметилсуль- фоксид (ДМСО), различные сахара, глицерин, этиленгликоль и их производные. Действие криопротекторов состоит в снижении количества свободной воды, повышении вязкости раствора. Все криопротекторы делят на две группы: проникающие и непроникающие. Это разделение достаточно условно. Так, глицерин — первое вещество, определенное как криопротектор, может проникать в клетку, если его добавлять при комнатной температуре, или выступать как непроникающее соединение, если его добавлять при температуре 0 °С. Принято считать, что непроникающие криопротекторы специфически влияют на мембрану, повышая ее проницаемость. Применение сильных, проникающих в клетку криопротекторов ограничено их токсичностью. Поэтому обычно используют смеси криопротекторов, так как в них токсичность одного из веществ снижается за счет присутствия другого.
Жизнеспособность клеток после замораживания зависит не только от предупреждения образования льда, но и от их состояния. Крупные вакуолизированные клетки погибают гораздо чаще, чем мелкие меристемоидные. Поэтому на этапе подготовки культуры к замораживанию ее культивируют в условиях, способствующих образованию мелких клеток и синхронизации их деления.Кроме того, концентрирование клеток в культуре, т.е. увеличение ее плотности, способствует повышению выживаемости клеток после замораживания.
Таким образом, криосохранение достаточно надежно обеспечивает сохранение генофонда. Перспективность этого метода подтверждается возобновлением после хранения в жидком азоте суспензионных культур моркови, явора, кукурузы, риса, сахарного тростника; каллусных — тополя, маршанции, сахарного тростника; андрогенных эмбриоидов — беладонны, табака и др. Из восстановленных после замораживания культур моркови и табака удалось регенерировать целые растения. После быстрого замораживания сохранили жизнеспособность меристемы земляники, малины, гвоздики, томатов, картофеля и ряда других растений. Однако для криосохранения требуется сложная работа по подбору условий, обеспечивающих выживание клеток и, следовательно, возможность последующей регенерации из них целых растений. Необходимо учитывать генетические и морфофизиологичес- кие особенности клеток, способность к закаливанию, уровень проницаемости клеточных мембран, подбор криопротекторов, скорость снижения температуры при замораживании, условия оттаивания.ЗАКЛЮЧЕНИЕ
Круг вопросов, к решению которых привлекают биотехнологические методы и достижения, достаточно широк. Большинство из них прямо или косвенно связано с глобальными проблемами, стоящими перед современной цивилизацией, такими, как загрязнение окружающей среды, угроза экологического кризиса, истощение запасов полезных ископаемых, опасность мирового энергетического кризиса, нехватка продовольствия, борьба с болезнями.
Благодаря достижениям фундаментальных исследований в молекулярной биологии, биохимии, генетической инженерии и новейшим технологиям в биоиндустрии получают новые продукты заданного состава и качества, очищенные от экотоксикантов и обладающие не только питательной ценностью, но и профилактическими свойствами. Таким путем получена серия продуктов на основе сои, созданы бесхолестериновые и малохолестериновые спрэды («намазки») типа хальварина и «легкого» сливочного масла, а также безжирового мороженого.
Переработка растительной и микробной биомассы позволяет получать высококачественные белки, масла, пектиновые вещества, пищевые волокна, а также белок, сбалансированный по аминокислотному составу, и компоненты нуклеиновых кислот, необходимые для медицинской, пищевой, косметической и других отраслей промышленности.
Возникла новая научная дисциплина — экологическая биотехнология, осуществляющая новейший подход к охране и сохранению окружающей среды. Разработаны технологии рекультивации почвы, биологической очистки воды и воздуха и биосинтеза препаратов, компенсирующих вредное влияние измененной окружающей среды на людей и животных. Одна из важнейших задач биотехнологии — ограничение масштабов загрязнения нашей планеты промышленными, сельскохозяйственными и бытовыми отходами, токсичными компонентами автомобильных выхлопов. Современные научные исследования нацелены на создание безотходных технологий, на получение легкоразрушаемых полимеров, в том числе биогенного происхождения, а также на поиск новых активных микроорганизмов — разрушителей полимеров (полиэтилена, полипропилена, полихлорвинила). Усилия биотехнологии направлены на борьбу с пестицидными загрязнениями — следствием неумеренного и нерационального применения ядохимикатов. Ведутся разработки технологий по утилизации вредных выбросов (химикалии, нефть), загрязняющих воду и почву, и сельскохозяйственных отходов типа молочной сыворотки для получения пищевых и кормовых белковых продуктов, в том числе специальных препаратов, обогащенных, например, селеном дрожжей.
Повышение цен на традиционные источники энергии (природный газ, нефть, уголь) и угроза их исчерпания побудили ученых обратиться к альтернативным путям получения энергии. Роль биотехнологии в создании экономичных возобновляемых энергетических источников (спиртов, биогенных углеводородов, водорода) чрезвычайно велика. Эти экологически чистые виды топлива можно получать путем биоконверсии отходов промышленного и сельскохозяйственного производства. Перспективно продолжение исследований по усовершенствованию и внедрению процессов производства метана, этанола, созданию на основе микроорганизмов (и ферментов) элементов, эффективно производящих электричество, а также по организации искусственного фотосинтеза, в частности биофотолиза воды, при котором можно получать богатые энергией водород и кислород.
Развитие сельскохозяйственной биотехнологии на современном этапе направлено на решение таких глобальных проблем, как повышение плодородия почв, урожайности и качества сельскохозяйственной продукции; рекультивация сельскохозяйственных угодий; улучшение экологической обстановки, способствующей восстановлению биоценоза почв; повышение качества кормов и др. В области медицины весьма перспективной является разработка новых технологий использования молекулярных антител в области диагностики и лечения заболеваний, направленного транспорта лекарственных средств, трансплантологии органов, тканей, клеток, формирования нового класса медицинской техники — индивидуальных биотехнологических систем для контроля состояния организма.
Особый интерес представляют принципиально новые направления, развитие которых предполагается осуществить в XXI в: электрохемитерапия, молекулярное моделирование, отдельные области клеточной инженерии (клеточная инкапсуляция, энергетические межклеточные взаимодействия)
.ЛИТЕРАТУРА
Основная
Биология культивируемых клеток и биотехнология растений / Под ред. Р. Г. Бутенко. — М., 1991.
Биотехнология / Под ред. А. А. Баева. — М., 1988.
Биотехнология растений: культура клеток / Под ред. Р. Г. Бутенко. — М., 1989.
Бейли Дж.Э., Оллис Д.Ф. Основы биохимической инженерии. — М., 1989.-Ч. II.
Бутенко Р. Г. Биология клеток высших растений in vitro и биотехнология на их основе. — М., 1999.
Бутенко Р. Г. и др. Клеточная инженерия. — М., 1987.
Блинов Н.П. Основы биотехнологии. — СПб., 1995.
Мишустин Е.Н. Биотехнология. — М., 1989.
Муромцев Г. С. и др. Основы сельскохозяйственной биотехнологии. — М., 1990.
Промышленная микробиология и успехи генетической инженерии. — М., 1984.
Рыбальский Н.Г., Скуратовская О.Д. Белковая инженерия. — М, 1990.
Сассон А. Биотехнология: свершения и надежды. — М., 1987.
Сельскохозяйственная биотехнология / Под ред. В. С. Шевелухи. — М., 1998.
Сидоров В.А. Биотехнология растений. — Киев, 1990.
Фогарти М. и др. Микробные ферменты и биотехнология. — М., 1986.
Шабарова З.А., Богданов А. А., Золотухин А. С. Химические основы генетической инженерии. — М., 1994.
Дополнительная
Безбородое А. М. Основы биотехнологии микробных синтезов. — Ростов, 1989.
Березин И. В., Клесов А. А. Инженерная энзимология. — М., 1987.
Биосенсоры // Итоги науки и техники. Сер. «Биотехнология». — М.: ВИНИТИ, 1990.-Т. 26.
Биотехнология, охрана среды. — М., 1990.
Биотехнология: Принципы и применение. — М., 1988.
Буков В.А. Производство белковых веществ. — М., 1987.
Волиханова Г., Рахимбаев И. Культура клеток и биотехнология растений. — Алма-Ата, 1989.
Катаева Н. В., Бутенко Р. Г. Клональное микроразмножение растений. — М„ 1983.
Кефели В. И., Дмитриева Г. А. Биотехнология. — Пущино, 1989.
Кучек Н.В. Генетическая инженерия высших растений. — Киев, 1997.
Новые направления биотехнологии: Материалы международной VIII конференции. — М., 1998.
Скрябин Г., Головлева Л. Биотехнология защиты окружающей среды от ксенобиотиков// Изв. АН СССР. Сер. «Биология». — М., 1986. — № 6. — С. 805-813.
Спирин А. С. Биосинтез белка и перспективы бесклеточной биотехнологии//Вестник АН СССР.-М., 1989. -№ 11.-С. 30-38.
Терешин И.М. Молекулярно-биологические основы биотехнологии. — Л., 1981.
Ферментные электроды // Итоги науки и техники. Сер. «Биотехнология». - М.: ВИНИТИ, 1988. - Т. 18.
Экологическая биотехнология. — Л., 1990
.ОГЛАВЛЕНИЕ
О 79
IV 88
studfiles.net
6.8.3. Клональное микроразмножение и оздоровление растений
Клональным микроразмножением называют неполовое размножение растений с помощью метода культуры тканей, позволяющее получать растения идентичные исходному. В основе получения таких растений лежит способность соматических клеток растений полностью реализовывать свой потенциал развития, т.е. свойство тотипотентности. Метод клонального микроразмножения получает все более широкое распространение во всем мире. В большинстве стран эта технология приобрела коммерческий характер.
В России первые работы по клональному микроразмножению были проведены в 60-х годах XX в. в лаборатории Р. Г. Бутенко (Институт физиологии растений им. К.А.Тимирязева). В настоящее время созданы и развиваются лаборатории клонального микроразмножения, связанные с нуждами селекции, размножением декоративных, лекарственных и других растений. Кроме того, технология используется для размножения лучших экземпляров взрослых лесных деревьев, особенно хвойных, для сохранения редких и исчезающих видов растений.
Свое название эта технология размножения получила от термина «клон» (от греч. clon — отпрыск), который предложил Веб- бер в 1903 г. Клональное микроразмножение имеет существенные преимущества перед традиционными способами размножения:
Высокий коэффициент размножения. Одно растение герберы за год при микроклональном размножении дает до 1 млн новых растений, тогда как при обычных способах размножения — только 50 — 100 растений. Большинство культивируемых в настоящее время сортов лилий размножается только вегетативно. Луковички возникают на материнских луковицах или на побеге в небольших количествах. Технология микроклонального размножения позволяет получить из одной чешуи луковицы за 6 месяцев 105 новых растений (сорт Red Carpet).
Получение генетически однородного посадочного материала.
Возможность оздоровления растений, освобождения их от вирусов благодаря клонированию меристематических тканей.
Возможность размножения растений, которые в естественных условиях репродуцируются с большим трудом.
Воспроизведение посадочного материала круглый год, что значительно экономит площади, занимаемые маточными и размножаемыми растениями.
6. Сокращение продолжительности селекционного периода, ускорение перехода растений от ювенильной фазы развития к репродуктивной.
Технология микроклонального размножения. Обязательное условие клонального микроразмножения — использование объектов, полностью сохраняющих генетическую стабильность на всех этапах процесса, от экспланта до растений в поле. Такому требованию удовлетворяют апексы и пазушные почки органов стеблевого происхождения, т. е. меристематические ткани. Их устойчивость к генетическим изменениям, вероятно, связана с высокой активностью систем репарации ДНК, а также с негативной селекцией измененных клеток.
Процесс клонального микроразмножения можно подразделить на 3 этапа:
Получение хорошо растущей стерильной культуры. На этом этапе необходимо правильно выбрать растение-донор, получить свободную от инфекции культуру, добиться ее выживания и быстрого роста на питательной среде.
Собственно размножение, осуществляемое несколькими способами:
активизация пазушных меристем;
индукция образования адвентивных почек тканями листа, стебля, чешуйками и донцем луковиц, корневищем и зачатками соцветий без первоначального образования каллусной ткани;
микрочеренкование побега, сохраняющего апикальное доминирование;
стимуляция образования микроклубней и микролуковичек;
индукция соматического эмбриогенеза.
Подготовка к высадке в поле или к реализации. Это очень важный этап, во время которого в теплице укорененные растения, полученные in vitro, адаптируют к новым условиям внешней среды: проводят закаливание растений, повышают их устойчивость к патогенным микроорганизмам и различным неблагоприятным факторам внешней среды. Существует много различных способов адаптирования растений к пересадке in vivo. Это подбор почвенного субстрата, создание определенной влажности, обработка химическими веществами (глицерин, парафин) для предотвращения обезвоживания листьев. Некоторые древесные растения лучше приживаются, если их заразить in vitro микоризооб- разующими грибами (Е.А.Калашникова, 1993). Упрощенный способ адаптации пробирочных растений винограда был разработан в Институте физиологии растений им. К. А. Тимирязева РАН. Адаптацию проводят прямо в пробирках, снимая с них пробки, когда растения винограда дорастают до верха пробирки. Через 1,5 — 2 недели, когда верхушки побега с двумя развитыми листьями появляются над пробиркой, растение готово к пересадке в почву.Для предотвращения механических повреждений корневой системы растение пересаживают в почву вместе с агаром, заглубляя его так, что над поверхностью почвы остаются только 2 развитых листа, которые выросли из пробирки и уже адаптировались к внешним условиям. Такая методика позволяет значительно упростить, ускорить и удешевить этап акклиматизации растений.
Клональное микроразмножение растений проводят разными способами. Первый и основной способ — активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот способ основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается или удалением апикальной меристемы побега, или благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламино- пурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде. Активизацию пазушных меристем широко используют в промышленном размножении овощных сельскохозяйственных культур (картофель, томаты, огурцы, сахарная свекла, топинамбур и др.), цветов (гвоздика, роза, гербера), плодовых и ягодных культур (яблоня, вишня, малина, крыжовник и др.), древесных растений (туя, можжевельник и др.). Однако бесконечно размножать таким способом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда — гибель растений. В опытах с размножением земляники было показано, что при клонировании необходимо чередовать 2 — 3 цикла получения побегов с их укоренением.
Второй способ — индукция развития адвентивных почек, т. е. почек, возникающих из растительных клеток и тканей, которые их обычно не образуют. Этот метод в значительной мере обусловлен тотипотентностью клеток. Почти любой орган или ткань растения, свободные от инфекции, могут быть использованы в качестве экспланта и в определенных условиях образуют адвентивные почки. Данный процесс вызывают внесением в питательную среду определенных концентраций цитокининов и ауксинов, причем цитокинина должно быть гораздо больше, чем ауксина. Это наиболее распространенный способ микроразмножения высших растений. Развивая адвентивные почки на апикальных и пазушных меристемах, размножают растения томата, лука, чеснока; на сегментах листовых пластинок — салат, глоксинию, фиалки; на тканях донца луковиц — лук, чеснок, гладиолусы, тюльпаны и другие луковичные растения.
1 ПС
Факторы, влияющие на клональное микроразмножение. Питательная среда. Состав питательной среды — один из наиболее важных факторов при микроразмножении. Обычно используют стандартные среды: Мурасиге-Скуга, Нича и др., но с добавлением на каждом этапе различных веществ. На первом этапе в питательную среду часто вносят антиоксиданты, чтобы предотвратить гибель клеток из-за активизации гидролитических ферментов. Особое значение имеют концентрация и соотношение фитогормонов в среде. Например, на втором этапе для усиления морфогенеза обычно добавляют цитокинины. Напротив, на третьем этапе при укоренении в питательной среде должно быть только небольшое количество ауксинов (либо используется безгормональная среда). Иногда в среду добавляют гиббереллин (ГК), который стимулирует рост сформировавшихся почек. Важным регуляторным фактором служит сахароза. Обычная концентрация ее в среде составляет 3 %. На растениях каперса было показано, что более высокая концентрация сахарозы в среде приводила к образованию пурпурных, содержащих антоциан, почек возобновления. При концентрациях сахарозы менее 3 % наблюдалось формирование зеленых почек, способных к размножению.
Кроме того, существенное значение имеет состояние среды. Например, культивирование меристем земляники, вишни, черной смородины лучше происходит в жидкой питательной среде, чем в агаризованной.
Состояние экспланта. Морфогенез в значительной мере определяется возрастом и размером экспланта. Так, у эхеверии эксплантат из молодых листьев образуют корни, из старых листьев — побеги. И только у листьев среднего возраста возникают и побеги, и корни, т.е. появляется возможность регенерации целого растения. Размер экспланта прямо пропорционально связан с регенера- ционной способностью: чем крупнее эксплант, тем выше эта способность. Большие экспланты могут самопроизвольно независимо от соотношения в питательной среде ауксинов и цитокининов образовывать почки. Но увеличение размера может привести к негативным последствиям, так как появляется вероятность присутствия в экспланте клеток, содержащих вирусную, грибковую и другие виды инфекции. Оптимальная величина экспланта должна обеспечивать как активный морфогенез, так и полную стерильность.
На регенерационную способность экспланта влияют также физиологическое состояние и таксономическая принадлежность растения-донора. Например, экспланты, выделенные из растений в фазу покоя, обладают более низкой способностью к укоренению и развитию побегов по сравнению с эксплантами, изолированными в фазу активного роста. Двудольные травянистые растения характеризуются большей регенерационной способностью, чем однодольные.
Чем больше размер экспланта, тем легче идет морфогенез, в результате которого получается целое растение, но тем больше вероятность присутствия вирусов в экспланте. У многих видов и сортов растений зона, свободная от вирусных частиц, различна. Так, при клонировании апикальной меристемы картофеля размером 0,2 мм (конус нарастания с одним листовым зачатком) 70 % полученных растений были свободны от Y-вируса картофеля, но только 10 % — от Х-вируса. В некоторых случаях не удается найти оптимальное соотношение между размером меристематического экспланта и морфогенезом в нем, и при этом избавиться от вирусной инфекции. Приходится дополнять метод культуры меристем термо- или(и) хемитерапией. Так, предварительная термотерапия исходных растений позволяет получать свободные от вирусов растения-регенеранты из меристемных эксплантов размером от 0,3 мм до 0,8 мм. Вместе с тем этот прием может вызвать отставание растений в росте, деформацию органов, увеличение латентных (скрытых) инфекций.
Хорошие результаты дает совместное применение метода культуры тканей и хемитерапии. При внесении в питательную среду препарата «Вирозол» (1-рибофуранозил-1,2,4-триазолкарбоксамид) количество безвирусных растений увеличивается до 80 — 100%.
В настоящее время для диагностики вирусных растений используют иммуноферментную технику, моноклональные антитела, метод молекулярной гибридизации меченых фрагментов РНК- и ДНК-вироидов и вирусов с вирусами тестируемого объекта. Эти методы очень чувствительны, но трудоемки и дорогостоящи.
После оздоровления с помощью вышеперечисленных технологий нормальные растения-регенеранты размножают обычными методами клонального микроразмножения. Для некоторых растений, например цитрусовых, получить морфогенез из меристем малого размера не удается, поэтому требуется разработка оригинальных методов. Лимоны и апельсины оздоровляют и размножают, используя прививки меристем размером 0,14 — 0,18 мм на пробирочные подвои, полученные из семян. Достоинство такого подхода состоит и в том, что развивающиеся из меристем побеги не имеют ювенильных признаков, при этом цветение и плодоношение ускоряются.
6.8.4. Криосохранение
Сохранение разнообразия форм жизни — важнейшая проблема, с которой столкнулось современное человечество. Еще Г. Ф. Гаузе доказал, что устойчивость сообщества тем выше, чем больше число составляющих его видов. Следовательно, сохранение биоразнообразия — единственный механизм стабильности жизни на Земле.Кроме того, для обеспечения питанием растущего населения нашей планеты необходимо выведение новых, более продуктивных сортов сельскохозяйственных растений, а для успешной селекции важен постоянный приток генов из новых источников. Традиционным источником генетического материала служат дикие виды растений. Однако в связи с расширением городов, сельскохозяйственных угодий, вырубкой лесов, ухудшением экологии эти виды постепенно вытесняются, а многие из них находятся на грани вымирания, поэтому их необходимо сохранить.
Существует несколько способов сохранения генофонда высших растений: заповедники, национальные парки, банки семян. В последнее время большое внимание уделяется созданию и развитию новых способов: пересадочных коллекций каллусных клеток, депонированию культур клеток и, наконец, криосохранению, т. е. хранению объектов при очень низкой температуре, обычно это температура жидкого азота (-196 °С). Криосохранение имеет существенные преимущества по сравнению с остальными методами. При сохранении в глубоко замороженном состоянии полностью прекращается обмен веществ, отсутствуют значительные физико- химические молекулярные изменения не только в клетке, но и в окружающей водной среде. Сохраняется генофонд, а следовательно, все свойства замороженного объекта. Единственный негативный фактор, которого не удается избежать, — это фоновая ионизирующая радиация. Однако, по мнению М.Ашвуд-Смита, потребуется примерно 32 000 лет для накопления 10% летальных хромосомных повреждений. Следовательно, криогенный метод дает возможность неограниченно долго хранить растительный материал без существенных изменений: сохраняются жизнеспособность клеток, их свойства, а также способность к морфогенезу и регенерации целых растений.
Сущность метода криосохранения сводится к замораживанию специально подготовленных растительных клеток при использовании криопротекторов — веществ, ослабляющих повреждения клеток при замораживании и оттаивании. В настоящее время известны * два метода криосохранения: программное (медленное) и сверхбыстрое замораживание. Программное замораживание изучалось уже : давно, поэтому оно довольно широко применяется для сохранения животных и растительных клеток. Разработка сверхбыстрого замо-^ раживания началась сравнительно недавно, однако считается, что | именно этот метод со временем станет наиболее перспективным. |
Трудности криосохранения растений связаны со спецификой 1 растительных клеток. Клетки растений имеют большие размеры! (в культуре тканей они изменяются от 15 до 1000 мкм), прочную! целлюлозную стенку и вакуоли. Причем именно степень вакуоли-! зации играет основную роль в устойчивости клеток к действию! низких температур. В зрелой клетке центральная вакуоль занимает!
до 90 % общего объема клетки, т. е. клетка представляет собой как бы резервуар с водой, которая необходима для ее нормальной жизнедеятельности. Поэтому основные факторы, способные привести клетку к гибели при замораживании, — это образование льда и дегидратация. Обычно кристаллы льда сначала образуются во внешнем растворе вокруг клеток. Максимальная скорость их роста в зависимости от состава раствора находится в пределах температур от -20 до -60 "С. При температуре -140 °С рост кристаллов льда совершенно прекращается. Следовательно, и при замораживании, и при оттаивании клеткам очень важно с оптимальной скоростью «проскочить» температуру образования льда. Кристаллы внеклеточного льда могут механически разрушать клетки. Кроме того, они играют водоотнимающую роль, что приводит к значительной дегидратации клетки и возможной ее гибели от осмотического стресса. При очень быстром замораживании лед может образовываться и внутри клеток, что ведет к разрушению в ней многочисленных мембран.
Избежать кристаллизации льда помогла бы витрификация воды, т. е. затвердение ее в аморфном состоянии. Получить витрифика- цию чистой воды практически невозможно. Но в коллоидных растворах скорость образования центров кристаллизации и роста кристаллов льда снижается и повышается температура, при которой их рост прекращается. Все это облегчает витрификацию. Добавление криопротекторов также затрудняет кристаллизацию льда и способствует витрификации.
Наиболее известны такие криопротекторы, как диметилсуль- фоксид (ДМСО), различные сахара, глицерин, этиленгликоль и их производные. Действие криопротекторов состоит в снижении количества свободной воды, повышении вязкости раствора. Все криопротекторы делят на две группы: проникающие и непроникающие. Это разделение достаточно условно. Так, глицерин — первое вещество, определенное как криопротектор, может проникать в клетку, если его добавлять при комнатной температуре, или выступать как непроникающее соединение, если его добавлять при температуре 0 °С. Принято считать, что непроникающие криопротекторы специфически влияют на мембрану, повышая ее проницаемость. Применение сильных, проникающих в клетку криопротекторов ограничено их токсичностью. Поэтому обычно используют смеси криопротекторов, так как в них токсичность одного из веществ снижается за счет присутствия другого.
Жизнеспособность клеток после замораживания зависит не только от предупреждения образования льда, но и от их состояния. Крупные вакуолизированные клетки погибают гораздо чаще, чем мелкие меристемоидные. Поэтому на этапе подготовки культуры к замораживанию ее культивируют в условиях, способствующих образованию мелких клеток и синхронизации их деления.Кроме того, концентрирование клеток в культуре, т.е. увеличение ее плотности, способствует повышению выживаемости клеток после замораживания.
Таким образом, криосохранение достаточно надежно обеспечивает сохранение генофонда. Перспективность этого метода подтверждается возобновлением после хранения в жидком азоте суспензионных культур моркови, явора, кукурузы, риса, сахарного тростника; каллусных — тополя, маршанции, сахарного тростника; андрогенных эмбриоидов — беладонны, табака и др. Из восстановленных после замораживания культур моркови и табака удалось регенерировать целые растения. После быстрого замораживания сохранили жизнеспособность меристемы земляники, малины, гвоздики, томатов, картофеля и ряда других растений. Однако для криосохранения требуется сложная работа по подбору условий, обеспечивающих выживание клеток и, следовательно, возможность последующей регенерации из них целых растений. Необходимо учитывать генетические и морфофизиологичес- кие особенности клеток, способность к закаливанию, уровень проницаемости клеточных мембран, подбор криопротекторов, скорость снижения температуры при замораживании, условия оттаивания.ЗАКЛЮЧЕНИЕ
Круг вопросов, к решению которых привлекают биотехнологические методы и достижения, достаточно широк. Большинство из них прямо или косвенно связано с глобальными проблемами, стоящими перед современной цивилизацией, такими, как загрязнение окружающей среды, угроза экологического кризиса, истощение запасов полезных ископаемых, опасность мирового энергетического кризиса, нехватка продовольствия, борьба с болезнями.
Благодаря достижениям фундаментальных исследований в молекулярной биологии, биохимии, генетической инженерии и новейшим технологиям в биоиндустрии получают новые продукты заданного состава и качества, очищенные от экотоксикантов и обладающие не только питательной ценностью, но и профилактическими свойствами. Таким путем получена серия продуктов на основе сои, созданы бесхолестериновые и малохолестериновые спрэды («намазки») типа хальварина и «легкого» сливочного масла, а также безжирового мороженого.
Переработка растительной и микробной биомассы позволяет получать высококачественные белки, масла, пектиновые вещества, пищевые волокна, а также белок, сбалансированный по аминокислотному составу, и компоненты нуклеиновых кислот, необходимые для медицинской, пищевой, косметической и других отраслей промышленности.
Возникла новая научная дисциплина — экологическая биотехнология, осуществляющая новейший подход к охране и сохранению окружающей среды. Разработаны технологии рекультивации почвы, биологической очистки воды и воздуха и биосинтеза препаратов, компенсирующих вредное влияние измененной окружающей среды на людей и животных. Одна из важнейших задач биотехнологии — ограничение масштабов загрязнения нашей планеты промышленными, сельскохозяйственными и бытовыми отходами, токсичными компонентами автомобильных выхлопов. Современные научные исследования нацелены на создание безотходных технологий, на получение легкоразрушаемых полимеров, в том числе биогенного происхождения, а также на поиск новых активных микроорганизмов — разрушителей полимеров (полиэтилена, полипропилена, полихлорвинила). Усилия биотехнологии направлены на борьбу с пестицидными загрязнениями — следствием неумеренного и нерационального применения ядохимикатов. Ведутся разработки технологий по утилизации вредных выбросов (химикалии, нефть), загрязняющих воду и почву, и сельскохозяйственных отходов типа молочной сыворотки для получения пищевых и кормовых белковых продуктов, в том числе специальных препаратов, обогащенных, например, селеном дрожжей.
Повышение цен на традиционные источники энергии (природный газ, нефть, уголь) и угроза их исчерпания побудили ученых обратиться к альтернативным путям получения энергии. Роль биотехнологии в создании экономичных возобновляемых энергетических источников (спиртов, биогенных углеводородов, водорода) чрезвычайно велика. Эти экологически чистые виды топлива можно получать путем биоконверсии отходов промышленного и сельскохозяйственного производства. Перспективно продолжение исследований по усовершенствованию и внедрению процессов производства метана, этанола, созданию на основе микроорганизмов (и ферментов) элементов, эффективно производящих электричество, а также по организации искусственного фотосинтеза, в частности биофотолиза воды, при котором можно получать богатые энергией водород и кислород.
Развитие сельскохозяйственной биотехнологии на современном этапе направлено на решение таких глобальных проблем, как повышение плодородия почв, урожайности и качества сельскохозяйственной продукции; рекультивация сельскохозяйственных угодий; улучшение экологической обстановки, способствующей восстановлению биоценоза почв; повышение качества кормов и др. В области медицины весьма перспективной является разработка новых технологий использования молекулярных антител в области диагностики и лечения заболеваний, направленного транспорта лекарственных средств, трансплантологии органов, тканей, клеток, формирования нового класса медицинской техники — индивидуальных биотехнологических систем для контроля состояния организма.
Особый интерес представляют принципиально новые направления, развитие которых предполагается осуществить в XXI в: электрохемитерапия, молекулярное моделирование, отдельные области клеточной инженерии (клеточная инкапсуляция, энергетические межклеточные взаимодействия)
.ЛИТЕРАТУРА
Основная
Биология культивируемых клеток и биотехнология растений / Под ред. Р.Г.Бутенко. — М., 1991.
Биотехнология / Под ред. А. А. Баева. — М., 1988.
Биотехнология растений: культура клеток / Под ред. Р. Г. Бутенко. — М., 1989.
Бейли Дж.Э., Оллис Д.Ф. Основы биохимической инженерии. — М., 1989.-Ч. II.
Бутенко Р. Г. Биология клеток высших растений in vitro и биотехнология на их основе. — М., 1999.
Бутенко Р. Г. и др. Клеточная инженерия. — М., 1987.
Блинов Н.П. Основы биотехнологии. — СПб., 1995.
Мишустин Е.Н. Биотехнология. — М., 1989.
Муромцев Г. С. и др. Основы сельскохозяйственной биотехнологии. — М., 1990.
Промышленная микробиология и успехи генетической инженерии. — М., 1984.
Рыбальский Н.Г., Скуратовская О.Д. Белковая инженерия. — М, 1990.
Сассон А. Биотехнология: свершения и надежды. — М., 1987.
Сельскохозяйственная биотехнология / Под ред. В. С. Шевелухи. — М., 1998.
Сидоров В.А. Биотехнология растений. — Киев, 1990.
Фогарти М. и др. Микробные ферменты и биотехнология. — М., 1986.
Шабарова З.А., Богданов А. А., Золотухин А. С. Химические основы генетической инженерии. — М., 1994.
Дополнительная
Безбородое А. М. Основы биотехнологии микробных синтезов. — Ростов, 1989.
Березин И. В., Клесов А. А. Инженерная энзимология. — М., 1987.
Биосенсоры // Итоги науки и техники. Сер. «Биотехнология». — М.: ВИНИТИ, 1990.-Т. 26.
Биотехнология, охрана среды. — М., 1990.
Биотехнология: Принципы и применение. — М., 1988.
Буков В.А. Производство белковых веществ. — М., 1987.
Волиханова Г., Рахимбаев И. Культура клеток и биотехнология растений. — Алма-Ата, 1989.
Катаева Н. В., Бутенко Р. Г. Клональное микроразмножение растений. — М„ 1983.
Кефели В. И., Дмитриева Г. А. Биотехнология. — Пущино, 1989.
Кучек Н.В. Генетическая инженерия высших растений. — Киев, 1997.
Новые направления биотехнологии: Материалы международной VIII конференции. — М., 1998.
Скрябин Г., Головлева Л. Биотехнология защиты окружающей среды от ксенобиотиков// Изв. АН СССР. Сер. «Биология». — М., 1986. — № 6. — С. 805-813.
Спирин А. С. Биосинтез белка и перспективы бесклеточной биотехнологии//Вестник АН СССР.-М., 1989. -№ 11.-С. 30-38.
Терешин И.М. Молекулярно-биологические основы биотехнологии. — Л., 1981.
Ферментные электроды // Итоги науки и техники. Сер. «Биотехнология». - М.: ВИНИТИ, 1988. - Т. 18.
Экологическая биотехнология. — Л., 1990
.ОГЛАВЛЕНИЕ
О 79
IV 88
studfiles.net
Методы клонального микроразмножения растений
Клональным микроразмножением называют неполовое размножениерастений с помощью методакультуры тканей, позволяющее получать растения идентичные исходному. В основе получения таких растений лежит способность соматических клеток растений полностью реализовать свой потенциал развития, т.е. свойство тотипотентности. Методы клонального микроразмножения получают всё более широкое распространение во всём мире. В большинстве стран эта технология приобрела коммерческий характер. Существует 6 следующих методов:
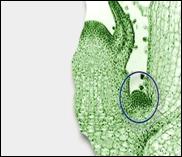
 Первый и основной метод – активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот метод основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается: 1. Удалением апикальной меристемы побега; 2. Благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламино-пурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде (рис. 3.23).
Первый и основной метод – активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот метод основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается: 1. Удалением апикальной меристемы побега; 2. Благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламино-пурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде (рис. 3.23).
Активизацию пазушных меристем широко используют в промышленном размножении овощных сельскохозяйственных культур (картофель, томаты, огурцы, сахарная свекла, топинамбур и др.), цветов (гвоздика, роза, гербера), плодовых и ягодных культур (яблоня, вишня, малина, крыжовник и др.), древесных растений (туя, можжевельник и др.).
Однако бесконечно размножать таким методом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда гибель растений. При клонировании следует чередовать 2-3 цикла получения побегов и их укоренением.
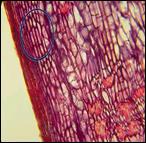
Данный метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис. 3.24.


2 4
3

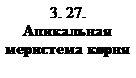
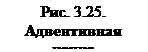
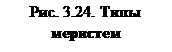
Второй метод – индукция развития адвентивных почек на верхушечных и пазушных меристемах, которые их обычно не образуют. Этот метод в значительной мере обусловлен тотипотентностью клеток. Любой орган или ткань растения, свободные от инфекции, могут быть использованы в качестве экспланта и в определённых условиях образуют адвентивные почки. Данный процесс вызывают внесением в питательную среду определённых концентраций цитокининов и ауксинов, причём цитокинина должно быть значительно больше, чем ауксина. Это наиболее распространённый способ микроразмножения высших растений. Развивая адвентивные почки на верхушечных и пазушных меристемах, размножают растения томата, лука, чеснока; на сегментах листовых пластинок – салат, глоксинию, фиалки; на тканях донца луковиц – лук, чеснок, гладиолусы, тюльпаны и др. луковичные растения. Таким образом, данный метод микроклонального размножения растений с помощью выращивания верхушечных меристем проходит в стерильных условиях на среде с фитогормонами – цитокининами.
Образуется большое количество почек, каждая из которых при пересадке на свежую питательную среду, дает начало новому растению (рис. 3.25).
Третий метод – микрочеренкование побега, сохраняющего апикальное доминирование. Растения регенераторы, полученные любым другим способом, можно черенковать в стерильных условиях, высаживать на свежую питательную среду, укоренять и адаптировать к полевым условиям, либо снова подвергать микрочеренкованию для того, чтобы увеличить количество посадочного материала.
Чаще всего исследователи активизируют развитие пазушных меристем путём удаления верхушечной меристемы побега, так как фитогормоны, вырабатываемые верхушечной меристемой, тормозят развитие пазушных меристем. При удалении верхушечных меристем - из пазушных образуются побеги, которые черенкуют и пересаживают на новую питательную среду для укоренения.
Четвёртый заключается в том, что новообразование меристемы в стебле растения возможно при его повреждении. Происходит дедифференциация клеток, возвращающая их в состояние, близкое к эмбриональному. Эти клетки снова приобретают способность к делению. На этой способности основано вегетативное размножение растений (рис 3.26).
Пятый метод. Апикальная (конечная) меристема корня отличается от верхушечной меристемы тем, что собственно инициальные клетки делятся очень редко, составляя покоящийся центр. Объём меристемы увеличивается за счёт интенсивного деления производных клеток конечной меристемы, а также основана на действии мутагенных факторов, облучения и др. (рис. 3.27).
Шестой метод микроклонального размножения основан на соматическом эмбриогенезе. Впервые это явление было отмечено в середине 50-х годов 20 века в культуре клеток моркови. Формирование эмбриоидов в культуре осуществляется в 2 этапа.
На первом – соматические клетки дифференцируются в эмбриональные в присутствии в питательной среде ауксинов, обычно это 2,4-дихлорфеноксиуксусная кислота (2,4-D).
На втором - развиваются эмбриоиды. Этот процесс идёт только при значительном снижении концентрации ауксина или полном отсутствии его в питательной среде. Соматический эмбриогенез может происходить в тканях первичного экспланта, в каллусной и суспензионной культурах.
Поскольку соматические зародыши представляют собой полностью сформированные растения, данный метод позволяет сократить затраты, связанные с подбором условий укоренения и адаптации растений регенерантов. Кроме того, преимущество получения соматических эмбриоидов состоит в том, что при использовании соответствующей техники капсулирования из них можно получать искусственные семена.
Похожие статьи:
poznayka.org
Глава 10 клональное микроразмножение древесных растений
Как уже отмечалось ранее, традиционным способом получения клонов у древесных видов растений является черенкование с последующим укоренением черенков или прививкой. Клональное микроразмножение является принципиально новым способом получения клонов, основанным на методе культуры органов и клеток in vitro. С помощью этого способа за довольно короткий срок можно получить большое количество однородного посадочного материала. Клональным микроразмножением называют массовое бесполое размножение растений в культуре тканей и клеток, при котором возникшие формы растений генетически идентичны исходному экземпляру (Н.В. Катаева, Р.Г. Бутенко, 1983). Клональное микроразмножение значительно ускоряет селекционный процесс; при размножении растений в культуре тканей происходит оздоровление посадочного материала, освобождение его от патогенных микроорганизмов и во многих случаях от вирусов. Методом культуры тканей удается размножить растения, которые с трудом или совсем не размножаются вегетативно.
10.1. Общая характеристика метода клонального микроразмножения
В зависимости от вида исходного материала (эксплантата, или экспланта) и характера морфогенетических процессов различаются типы, или методы клонального микроразмножения. Для древесных растений наиболее распространенной является классификация, согласно которой микроклонирование можно проводить тремя путями:
индукцией образования придаточных почек и адвентивных побегов из них;
соматическим эмбриогенезом. Для лиственных пород применимы все три пути; для хвойных — только второй и третий.
Метод клонального микроразмножения путем стимуляции распускания существующих на побеге пазушных почек основан на снятии апикального доминирования, что достигается или удалением апекса побега, или гормональной обработкой, или сочетанием того и другого. При этом во всех случаях развившиеся побеги отделяют и повторно культивируют на питательной среде, стимулирующей пролиферацию (прорастание) пазушных меристем.
Образование адвентивных (придаточных) побегов как метод микроразмножения основан на способности изолированных частей растения при определенных условиях регенерировать целое растение. Почти любые органы и ткани растений можно использовать в качестве эксплантата, если их удается надежно стерилизовать.
Соматические эмбрионы могут возникать или в культуре каллуса, или непосредственно в культуре тканей экспланта. Для индукции соматического эмбриогенеза у разных видов растений необходимы специфичные для данного вида регуляторы роста.
Накопленный к настоящему времени значительный опыт по клональному микроразмножению древесных растений свидетельствует о том, что эффективность этого метода зависит от морфогенетической и регенерационной активности изолированных органов, тканей и клеток растения, что в значительной степени связано с видовыми и генотипическими особенностями дерева, его возрастом и физиологическим состоянием, условиями культивирования эксплантов и особенности питательной среды. Поэтому универсальной технологии клонального микроразмножения, пригодной для всех растений или даже одной группы растений, нет. Питательные среды и условия культивирования, так же как тип клонального микроразмножения, для каждого вида, а часто и для конкретного генотипа подбираются опытным путем.
studfiles.net
Клональное микроразмножение растений
Клональное микроразмножение (микроклональное размножение) - это массовое бесполое размножение растений в культуре тканей и клеток, при котором, возникшие формы растений генетически идентичны исходному экземпляру. В основе метода лежит использование уникальной способности растительной клетки реализовать присущую ей тотипотентность (способность реализовать генетическую информацию ядра клетки) и дать начало целому растительному организму. Этот метод позволяет за короткий срок получать огромное количество однородного в генетическом плане посадочного материала растений, причем свободного от патогенных микроорганизмов и во многих случаях от вирусов. Применение клонального микроразмножения ускоряет селекцию новых сортов растений до 2-3 лет вместо 10-12 лет. Существует несколько основных разновидностей метода:
I) Образование придаточных (адвентивных) побегов непосредственно из тканей эксплантанта основано на способности изолированных частей растения при благоприятных условиях восстанавливать недостающие органы и регенерировать целое растение. На среде Мурасиге-Скуга, содержащей 2,68 мкМ нафтилуксусной кислоты НУК и 2,31 мкМ кинетина, на поперечных срезах черешков листьев фиалки за 6-8 недель формируется множество придаточных побегов, дающих начало целым растениям.
2) Индукция развития пазушных меристем основана на активизации роста заложенных в пазухах листьев растений почек и получении из них побегов и затем целых растений. Достигается это путем снятия апикального доминирования или удалением главного побега и микрочеренкованием в пробирке или введением в питательную среду цитокининов, индуцирующих развитие пазушных побегов. Во всех случаях развившиеся побеги отделяют друг от друга и повторно культивируют на питательной среде, в свою очередь стимулирующей пролиферацию пазушных меристем и возникновение побегов. Так верхушку побега герберы помещают на среду Мурасиге-Скуга, содержащую 4,62 мкМ кинетина. Вегетативный побег, несущий у своего основания листья, формируется через 5-6 недель. В основании побега на агаризованной среде развивается каллус и дифференцируются корни, в пазухах листьев закладываются почки. Введение этих почек в среду с кинетином приводит к развитию побегов. Они растут, в пазухах их листьев, в свою очередь, наблюдается активизация пазушных почек, каждая из которых может дать побег.
3) Пролиферация каллуса и последующая регенерация из него растений (морфогенез) наблюдается на питательных средах с определенной концентрацией и соотношением в них фитогормонов цитокинины/ауксины. Так пролиферация каллуса побегов герберы происходит на среде с 4,62 мкМ кинетина и 5,37 мкМ (НУК). При этом из каллусной ткани могут образоваться одновременно почки, побеги и корни. Только корни образуются из каллуса на среде с 5,4 мкМ НУК или 0,9 мкМ 2,4-дихлорфеноксиуксусной кислоты (2-4-Д). Привыкшие каллусные клетки, т.е. полученные в результате многих пересевов, иногда сами начинают синтезировать фитогормоны. Регенерацию растений лучше осуществлять из первичного каллуса, так как при многочисленных пересевах изменяется плоидность каллусных клеток и т.п., растения из таких клеток получаются с пониженной жизнеспособностью, низкорослые, с неправильным жилкованием листьев, уродствами.
4) Соматический эмбриогенез характеризуется тем, что зародышеподобные структуры (эмбриоиды) развиваются из соматических клеток культивируемых тканей эксплантанта (каллуса) при уменьшении концентрации или полном исключении из среды ауксинов.
На этапе высадки растений "из пробирки" в почву проводят закалку растений - снижают температуру выращивания до 20-250С, увеличивают интенсивность освещения до 5-10 тысяч люкс в течение 14-16 часов в сутки, повышают влажность воздуха до 70-75%, создавая в итоге даже атмосферу тумана.
Похожие статьи:
poznayka.org
Клональное микроразмножение растений
Клональное микроразмножение (микроклональное размножение) - это массовое бесполое размножение растений в культуре тканей и клеток, при котором, возникшие формы растений генетически идентичны исходному экземпляру. В основе метода лежит использование уникальной способности растительной клетки реализовать присущую ей тотипотентность (способность реализовать генетическую информацию ядра клетки) и дать начало целому растительному организму. Этот метод позволяет за короткий срок получать огромное количество однородного в генетическом плане посадочного материала растений, причем свободного от патогенных микроорганизмов и во многих случаях от вирусов. Применение клонального микроразмножения ускоряет селекцию новых сортов растений до 2-3 лет вместо 10-12 лет. Существует несколько основных разновидностей метода:
I) Образование придаточных (адвентивных) побегов непосредственно из тканей эксплантанта основано на способности изолированных частей растения при благоприятных условиях восстанавливать недостающие органы и регенерировать целое растение. На среде Мурасиге-Скуга, содержащей 2,68 мкМ нафтилуксусной кислоты НУК и 2,31 мкМ кинетина, на поперечных срезах черешков листьев фиалки за 6-8 недель формируется множество придаточных побегов, дающих начало целым растениям.
2) Индукция развития пазушных меристем основана на активизации роста заложенных в пазухах листьев растений почек и получении из них побегов и затем целых растений. Достигается это путем снятия апикального доминирования или удалением главного побега и микрочеренкованием в пробирке или введением в питательную среду цитокининов, индуцирующих развитие пазушных побегов. Во всех случаях развившиеся побеги отделяют друг от друга и повторно культивируют на питательной среде, в свою очередь стимулирующей пролиферацию пазушных меристем и возникновение побегов. Так верхушку побега герберы помещают на среду Мурасиге-Скуга, содержащую 4,62 мкМ кинетина. Вегетативный побег, несущий у своего основания листья, формируется через 5-6 недель. В основании побега на агаризованной среде развивается каллус и дифференцируются корни, в пазухах листьев закладываются почки. Введение этих почек в среду с кинетином приводит к развитию побегов. Они растут, в пазухах их листьев, в свою очередь, наблюдается активизация пазушных почек, каждая из которых может дать побег.
3) Пролиферация каллуса и последующая регенерация из него растений (морфогенез) наблюдается на питательных средах с определенной концентрацией и соотношением в них фитогормонов цитокинины/ауксины. Так пролиферация каллуса побегов герберы происходит на среде с 4,62 мкМ кинетина и 5,37 мкМ (НУК). При этом из каллусной ткани могут образоваться одновременно почки, побеги и корни. Только корни образуются из каллуса на среде с 5,4 мкМ НУК или 0,9 мкМ 2,4-дихлорфеноксиуксусной кислоты (2-4-Д). Привыкшие каллусные клетки, т.е. полученные в результате многих пересевов, иногда сами начинают синтезировать фитогормоны. Регенерацию растений лучше осуществлять из первичного каллуса, так как при многочисленных пересевах изменяется плоидность каллусных клеток и т.п., растения из таких клеток получаются с пониженной жизнеспособностью, низкорослые, с неправильным жилкованием листьев, уродствами.
4) Соматический эмбриогенез характеризуется тем, что зародышеподобные структуры (эмбриоиды) развиваются из соматических клеток культивируемых тканей эксплантанта (каллуса) при уменьшении концентрации или полном исключении из среды ауксинов.
На этапе высадки растений "из пробирки" в почву проводят закалку растений - снижают температуру выращивания до 20-250С, увеличивают интенсивность освещения до 5-10 тысяч люкс в течение 14-16 часов в сутки, повышают влажность воздуха до 70-75%, создавая в итоге даже атмосферу тумана.
Похожие статьи:
www.poznayka.org
Методы клонального микроразмножения растений
Клональным микроразмножением называют неполовое размножениерастений с помощью методакультуры тканей, позволяющее получать растения идентичные исходному. В основе получения таких растений лежит способность соматических клеток растений полностью реализовать свой потенциал развития, т.е. свойство тотипотентности. Методы клонального микроразмножения получают всё более широкое распространение во всём мире. В большинстве стран эта технология приобрела коммерческий характер. Существует 6 следующих методов:

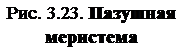 Первый и основной метод – активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот метод основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается: 1. Удалением апикальной меристемы побега; 2. Благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламино-пурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде (рис. 3.23).
Первый и основной метод – активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот метод основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается: 1. Удалением апикальной меристемы побега; 2. Благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламино-пурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде (рис. 3.23).
Активизацию пазушных меристем широко используют в промышленном размножении овощных сельскохозяйственных культур (картофель, томаты, огурцы, сахарная свекла, топинамбур и др.), цветов (гвоздика, роза, гербера), плодовых и ягодных культур (яблоня, вишня, малина, крыжовник и др.), древесных растений (туя, можжевельник и др.).
Однако бесконечно размножать таким методом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда гибель растений. При клонировании следует чередовать 2-3 цикла получения побегов и их укоренением.
Данный метод клонального микроразмножения, основанный на использовании таких меристематических тканей, как меристемы верхушечные (1) стебля (2) и корня (3), камбий (4) представлены на рис. 3.24.




2 4
3

Второй метод – индукция развития адвентивных почек на верхушечных и пазушных меристемах, которые их обычно не образуют. Этот метод в значительной мере обусловлен тотипотентностью клеток. Любой орган или ткань растения, свободные от инфекции, могут быть использованы в качестве экспланта и в определённых условиях образуют адвентивные почки. Данный процесс вызывают внесением в питательную среду определённых концентраций цитокининов и ауксинов, причём цитокинина должно быть значительно больше, чем ауксина. Это наиболее распространённый способ микроразмножения высших растений. Развивая адвентивные почки на верхушечных и пазушных меристемах, размножают растения томата, лука, чеснока; на сегментах листовых пластинок – салат, глоксинию, фиалки; на тканях донца луковиц – лук, чеснок, гладиолусы, тюльпаны и др. луковичные растения. Таким образом, данный метод микроклонального размножения растений с помощью выращивания верхушечных меристем проходит в стерильных условиях на среде с фитогормонами – цитокининами.
Образуется большое количество почек, каждая из которых при пересадке на свежую питательную среду, дает начало новому растению (рис. 3.25).
Третий метод – микрочеренкование побега, сохраняющего апикальное доминирование. Растения регенераторы, полученные любым другим способом, можно черенковать в стерильных условиях, высаживать на свежую питательную среду, укоренять и адаптировать к полевым условиям, либо снова подвергать микрочеренкованию для того, чтобы увеличить количество посадочного материала.
Чаще всего исследователи активизируют развитие пазушных меристем путём удаления верхушечной меристемы побега, так как фитогормоны, вырабатываемые верхушечной меристемой, тормозят развитие пазушных меристем. При удалении верхушечных меристем - из пазушных образуются побеги, которые черенкуют и пересаживают на новую питательную среду для укоренения.
Четвёртый заключается в том, что новообразование меристемы в стебле растения возможно при его повреждении. Происходит дедифференциация клеток, возвращающая их в состояние, близкое к эмбриональному. Эти клетки снова приобретают способность к делению. На этой способности основано вегетативное размножение растений (рис 3.26).
Пятый метод. Апикальная (конечная) меристема корня отличается от верхушечной меристемы тем, что собственно инициальные клетки делятся очень редко, составляя покоящийся центр. Объём меристемы увеличивается за счёт интенсивного деления производных клеток конечной меристемы, а также основана на действии мутагенных факторов, облучения и др. (рис. 3.27).
Шестой метод микроклонального размножения основан на соматическом эмбриогенезе. Впервые это явление было отмечено в середине 50-х годов 20 века в культуре клеток моркови. Формирование эмбриоидов в культуре осуществляется в 2 этапа.
На первом – соматические клетки дифференцируются в эмбриональные в присутствии в питательной среде ауксинов, обычно это 2,4-дихлорфеноксиуксусная кислота (2,4-D).
На втором - развиваются эмбриоиды. Этот процесс идёт только при значительном снижении концентрации ауксина или полном отсутствии его в питательной среде. Соматический эмбриогенез может происходить в тканях первичного экспланта, в каллусной и суспензионной культурах.
Поскольку соматические зародыши представляют собой полностью сформированные растения, данный метод позволяет сократить затраты, связанные с подбором условий укоренения и адаптации растений регенерантов. Кроме того, преимущество получения соматических эмбриоидов состоит в том, что при использовании соответствующей техники капсулирования из них можно получать искусственные семена.
Похожие статьи:
www.poznayka.org










