Области применения генной инженерии растений. Генетическая инженерия растений
Направления генетической инженерии
Можно выделить три направления генной инженерии:
Генетическая трансформация клеток бактерий
Введение генов в клетки млекопитающих
Генная инженерия растений
Более подробно остановимся на пунктах 2 и 3.
Лечение заболеваний с помощью генов получило название генотерапии. Сейчас в мире насчитывается порядка 400 проектов, посвященных лечению с помощью генотеропии.
Огромные перспективы открывает использование генотерапии для лечения онкологических заболеваний. Многолетние усилия ученых привели к пониманию того, что рак — это генетическое заболевание и его развитие происходит многостадийно, в результате серии генетических нарушений, накапливающихся в клетке. Следовательно, каждый из таких отдельных генетических эффектов может стать точкой приложения генотерапевтического подхода.
Получение трансгенных животных
Если вводить ДНК в клетки многоклеточного организма, то результатом трансформации будет изменение свойств лишь небольшого числа клеток, которые приобрели новый ген или гены. Следовательно, для изменения свойств всего организма следует изменять геном половых клеток, которые перенесут новые свойства потомкам. У растений и животных целесообразно изменять такие свойства, как скорость роста, устойчивость к заболеваниям, способность адаптироваться к новым внешним условиям. В качестве маркеров в этом случае можно использовать полиморфизм длины рестрикционных фрагментов (AFLP), анализ мини-сателлитов, анализ микросателлитной ДНК (SSR), гибридизацию и т.д. Трансгенных животных можно использовать для изучения наследственных заболеваний мозга и нервной системы. Гены болезни Альцгеймера (отложение белка β-амилоида приводит к образованию характерных бляшек) и гены, отвечающие за развитие эпилепсии, болезней мозга вводятся в геном нормальных животных; при этом получают трансгенных животных-моделей, на которых можно испытывать различные терапевтические приемы.
Трансгенных животных стали использовать для исследования воспалительных и иммунологических заболеваний человека, например, ревматоидного артрита. Моделируются болезни, связанные с липидным обменом.
Генетическая инженерия растений
Генетическая инженерия растений, принадлежащая к так называемым высоким технологиям, вызывает наибольшее количество споров и дискуссий среди различных кругов общественности.
Развитие генетической инженерии растений очень актуально в настоящее время в связи с тем, что число населения мира растет, а количество пахотных земель уменьшается. С помощью генной инженерии можно повысить питательную ценность пищевых продуктов, повысить устойчивость растений к внешним условиям и многое другое. Помимо производства продуктов питания обширными областями применения генетически модифицированных растений являются создание лекарственных средств, обеспечение промышленности сырьем и прочее.
В настоящее время получением и испытанием генетически модифицированных растений занимаются сотни коммерческих фирм во всем мире с совокупным капиталом более ста миллиардов долларов. В 1999 г. трансгенные растения были высажены на общей площади порядка 40 млн. га, что превышает размеры такой страны, как Великобритания. В США генетически модифицированные растения (GM Crops) составляют сейчас около 50% посевов кукурузы и сои и более 30-40% посевов хлопчатника. Это говорит о том, что генно-инженерная биотехнология растений уже стала важной отраслью производства продовольствия и других полезных продуктов, привлекающей значительные людские ресурсы и финансовые потоки. В ближайшие годы ожидается дальнейшее быстрое увеличение площадей, занятых трансгенными формами культурных растений.
Первая волна трансгенных растений, допущенных для практического применения, содержала дополнительные гены устойчивости (к болезням, гербицидам, вредителям, порче при хранении, стрессам).
Нынешний этап развития генетической инженерии растений получил название "метаболическая инженерия". При этом ставится задача не столько улучшить те или иные имеющиеся качества растения, как при традиционной селекции, сколько научить растение производить совершенно новые соединения, используемые в медицине, химическом производстве и других областях. Этими соединениями могут быть, например, особые жирные кислоты, полезные белки с высоким содержанием незаменимых аминокислот, модифицированные полисахариды, съедобные вакцины, антитела, интерфероны и другие "лекарственные" белки, новые полимеры, не засоряющие окружающую среду и многое, многое другое. Использование трансгенных растений позволяет наладить масштабное и дешевое производство таких веществ и тем самым сделать их более доступными для широкого потребления.
Достижения генетической инженерии растений:
Улучшение качества запасных белков
Создание гербицидоустойчивых растений
Повышение устойчивости растений к стрессовым условиям
Повышение эффективности биологической азотфиксации
Повышение эффективности фотосинтеза
Получение растений с новыми свойствами
studfiles.net
Области применения генной инженерии растений
Метаболическая инженерия растений направлена на проведение трансгенной клеткой новых биохимических реакций путем введения чужеродных генов или модификацией генов клетки-хозяина. Растения представляют один из наиболее привлекательных объектов для метаболической инженерии. Имея одинаковые пути синтеза основных биологических соединений, растения отличаются поразительным разнообразием своих конечных продуктов: сахаров, ароматических соединений, жирных кислот, стероидных соединений и других биологически активных веществ. Растения дают человечеству десятки тысяч природных продуктов, многие из которых представляют большую ценность для фармакологии и промышленности.Иногда такими продуцентами важных лекарственных веществ являются уникальные тропические и эндемические растения, недоступные для их агротехнического производства в умеренных климатических зонах большинства развитых стран мира. Выделение из таких растений генов, определяющих направленный синтез специфических органических соединений, и их перенос в подобранные соответствующие растения превращают их в новые продуценты важных биологически активных веществ.
Многие растения содержат предшественников биосинтеза ценных биологических соединений, однако они не имеют ферментов для их превращений в эти соединения. Часто для метаболической инженерии достаточно переноса в клетку только одного гена. Примером такого типа метаболической инженерии является получение новых растений-продуцентов резвератрола, ценного лекарственного препарата широкого спектра действия, замедляющего старение. Резвератрол был обнаружен в винограде, где фермент стилбенсинтаза катализирует реакцию синтеза резвератрола из трех молекул малонил-СоА и одной молекулы 4-кумарил-СоА (рис. 2.15). Переносом гена стилбенсинтазы были получены другие растения, синтезирующие резвератрол.
 Рис. 2.15. Схема синтез резвератрола, найденного в винограде ценного препарата антиоксидантного типа с широким спектром действия. Исходные соединения присутствуют в клетках любых растений
Создание растений с улучшенными лечебно-диетическими свойствами поможет улучшить пищевую ценность растений. Ранее было практически невозможно с помощью селекции вывести растения с повышенным содержанием витаминов. Однако с развитием биохимии растений стало более ясным, какие метаболические пути являются критическими для биосинтеза витаминов. Например, для синтезав -каротина (провитамина А) в растениях необходима фитоен-синтетаза.
Рис. 2.15. Схема синтез резвератрола, найденного в винограде ценного препарата антиоксидантного типа с широким спектром действия. Исходные соединения присутствуют в клетках любых растений
Создание растений с улучшенными лечебно-диетическими свойствами поможет улучшить пищевую ценность растений. Ранее было практически невозможно с помощью селекции вывести растения с повышенным содержанием витаминов. Однако с развитием биохимии растений стало более ясным, какие метаболические пути являются критическими для биосинтеза витаминов. Например, для синтезав -каротина (провитамина А) в растениях необходима фитоен-синтетаза. Этот фермент участвует в конденсации двух молекул геранил-геранил дифосфата. Ген фитоен-синтетазы из нарцисса был введен в рис и экспрессирован в эндосперме риса. Таким образом, получен «золотой рис», который может помочь 2 млрд чел., страдающих от дефицита витамина А, для них рис - основная пища. Получены трансгенные растения рапса, экспрессирующие ген фитоен-синтетазы, в семенах которых значительно повысилось содержание каротиноидов. Показана экспрессия этого же фермента в клубнях картофеля, что приводило к повышенному синтезу каротиноидов и лютеина.
Недавно получены трансгенные растения земляники с повышенным синтезом L-аскорбиновой кислоты. Эти растения отличались суперэкспрессией гена НАДФ-зависимой Д-галактуронат-редуктазы (GalUR). Созданы растения сои с повышенным в пять раз содержанием витамина Е в семенах. Получены растения арабидопсиса с повышенным содержанием фолатов за счет экспрессии в них бактериального гена ГТФ-циклогидролазы-1 (EcGCH).
Уже существует салат с увеличенным содержанием железа, обогащенная лизином кукуруза. Ждет своего запуска в практику сорт сои с повышенным содержанием ненасыщенных жирных кислот (омега-3, омега-6 НЖК и др.), которые не синтезируются в организме человека, а попадают по пищевым цепям в основном через морепродукты из водорослей. Гены, встраиваемые в геном соевых бобов, были выделены из клеток водорослей (разработчик -компания Monsanto).
Разработаны в лабораториях и другие разнообразные трансгенные формы растений с улучшенными лечебно-диетическими свойствами.
Самый первый коммерческий успех получили растения, устойчивые к гербицидам, поскольку позволили очень успешно бороться с сорняками. Самыми распространенными являются трансгенные растения, устойчивые к глифосату (Раундап) - самому популярному гербициду, разлагающемуся в почве на нетоксичные составляющие и потому безопасному для окружающей среды. Ген был выделен из глифосат-устойчивого штамма E. coli.
Выведение растений, устойчивых к вредителям и болезням, поможет резко сократить применение химических средств защиты растений и уменьшить стоимость культивирования. Одними из первых в широкую практику вошли инсектицидные хлопок и кукуруза - так называемые Bt-сорта, которые были получены введением в них гена дельта-эндотоксина из Bacillus. thuringiensis (Bt или Cry-белок).
Bt-белок высокотоксичен для насекомых, но безопасен для других видов животных и человека. Он является протоксином, который расщепляется в кишечнике личинок насекомых, образуя активированный токсин.
Активированный токсин, в свою очередь, специфично связывается с рецепторами в средней кишке насекомых, что приводит к лизису клеток кишечного эпителия. Данный энтомотоксин - смертельный яд для ряда насекомых (в том числе и колорадского жука), но в то же время вполне безопасен для человека и животных, поскольку в организме млекопитающих нет ферментов для его расщепления и усвоения. Взаимодействие Bt-токсина с рецепторами насекомых строго специфично. В природе найдено большое количество штаммов B. thuringiensis, чьи токсины действуют на строго определенные виды насекомых.
Ранее препараты бактерий B. thuringiensis, содержащие Bt-белок, с успехом применяли для борьбы с насекомыми-вредителями, хотя использование таких препаратов достаточно дорого и не всегда эффективно. Введение гена протоксина в растения привело к тому, что Bt-растения перестали поедаться насекомыми. Этим путем был получен трансгенный картофель, устойчивый к колорадскому жуку.
Устойчивость к вирусам может обладать исключительной важностью для повышения сельскохозяйственной продуктивности. В настоящее время в различных странах мира проводят полевые испытания устойчивых к вирусам сортов батата (вирус SPFMV, sweet potato feathery mottle virus), кукурузы (MSV, maize streak virus) и африканской маниоки (мозаичный вирус). Возможно, эти культуры будут коммерциализованы в течение ближайших 3-5 лет.
Из-за сложности генома пшеницы, работа над созданием сортов, устойчивых к вирусу желтой карликовости ячменя (barley yellow-dwarf virus), продвигается очень медленно и до сих пор находится на стадии лабораторных экспериментов. Разработан также устойчивый к нематодам (корневым червям) ГМ-картофель.
Генно-инженерная биотехнология растений для фармакологии делает свои первые успешные практические шаги.
Растения являются удобной, безопасной и экономически выгодной альтернативой для получения различных белков, вакцин и антител по сравнению с системами экспрессии на основе микроорганизмов, культур животных клеток или трансгенных животных. За последние 20 лет множество ценных белков эффективно экпрессировано в растениях. Это белки человеческой сыворотки, регуляторы роста, антитела, вакцины, промышленные ферменты, биополимеры и реагенты для молекулярной биологии. Следует отметить перспективность получения ГМ-растений, синтезирующих новые формы антимикробных пептидов.
Растительные системы имеют все перспективы успешного использования для производства рекомбинантных белков в промышленном масштабе. Некоторые белки, синтезируемые трансгенными растениями, уже производятся западными компаниями или будут выпущены на рынок в ближайшие годы. Например, авидин, трипсин ив -глюкуронидаза, выделяемые из трансгенной кукурузы, производятся фирмой Sigma-Aldrich (США). В скором времени должны быть подготовлены к промышленному производству коллаген, липаза, лактоферрин, лизоцим, синтезируемые трансгенными растениями.
Синтез субъединичных вакцин в трансгенных растениях. Выявленно, что при экспрессии различных антигенов в растениях сохраняется их структурная идентичность и иммуногенность. Антигены, синтезируемые растениями, вызывали иммунный ответ при введении, например, HBs-антиген, синтезируемый растениями картофеля, вызывал у мышей более сильный иммунный ответ, чем дрожжевой. В настоящее время более пятидесяти различных антигенов были экспрессированы в ГМ-растениях, для некоторых из них показана иммуногенность при оральном введении.
Интенсивно разрабатывается концепция «съедобных вакцин» на основе трансгенных растений, чьи плоды, листья и семена годятся в пищу. В случае успеха исчезнет потребность в дорогостоящей очистке антигенов, которая необходима при создании вакцин для парентерального введения. Антигены, экспрессируемые в растениях, защищены растительными клеточными стенками от протеолиза при прохождении пищеварительного тракта и могут быть легко доставлены к клеткам слизистой оболочки кишечника, ответственным за мукозную систему иммунитета.
Таким образом, непрерывно разрабатываются все новые виды пищевых и технических растений с измененными свойствами - с улучшенным составом жиров, повышенным содержанием белков и витаминов, сладкие без сахара и накапливающие меньше вредных для здоровья нитратов, с повышенными декоративными свойствами. Опытные испытания проходят сотни пород деревьев, у которых часть ненужного человеку лигнина заменена полезной целлюлозой. При этом растут ГМ-деревья вдвое быстрее обычных. Трансгенные растения вырабатывают вакцины и лекарства, очищают почву от химического и радиоактивного загрязнения, синтезируют биодеградируемые полимеры для производства упаковки и белок паутины, из которого можно делать колготки и бронежилеты повышенной прочности.
Н.А. Воинов, Т.Г. Волова
medbe.ru
Генетическая инженерия растений итоги перспективы и
 Генетическая инженерия растений – итоги, перспективы и … опасения
Генетическая инженерия растений – итоги, перспективы и … опасения
 Что такое генетические модифицированные организмы? -это организмы (растения, животные, бактерии), ДНК которых искусственно изменена путем введения трансгенных конструкций (генов от других организмов).
Что такое генетические модифицированные организмы? -это организмы (растения, животные, бактерии), ДНК которых искусственно изменена путем введения трансгенных конструкций (генов от других организмов).
 • Генная инженерия (молекулярная биотехнология, молекулярное клонирование) – это технология получения рекомбинантных ДНК • Рекомбинантная ДНК (генномодифицированная, ГМ) – молекула ДНК, полученная объединением in vitro разнородных, вместе нигде в природе не существующих фрагментов ДНК • Рекомбинантный (ГМ) белок – белок, кодируемый рекобинантной ДНК (ГМ ДНК)
• Генная инженерия (молекулярная биотехнология, молекулярное клонирование) – это технология получения рекомбинантных ДНК • Рекомбинантная ДНК (генномодифицированная, ГМ) – молекула ДНК, полученная объединением in vitro разнородных, вместе нигде в природе не существующих фрагментов ДНК • Рекомбинантный (ГМ) белок – белок, кодируемый рекобинантной ДНК (ГМ ДНК)
 • Трансгеноз – введение чужеродного гена в растительную или животную клетку и его передача в ряду поколений • Трансдукция – перенос чужеродного гена из одной бактериальной клетки в другу с помощью бактериофага • ГМО-технология – технология, основанная на использовании генетически модифицированных организмов
• Трансгеноз – введение чужеродного гена в растительную или животную клетку и его передача в ряду поколений • Трансдукция – перенос чужеродного гена из одной бактериальной клетки в другу с помощью бактериофага • ГМО-технология – технология, основанная на использовании генетически модифицированных организмов
 Нужна ли людям генетическая инженерия растения? • Население земного шара превышает 6 млрд. человек. К 2020 году составит 7, 7 млрд. • Каждый восьмой не имеет достаточного количества пищи • 40 тысяч людей умирают ежедневно от недоедания, половина из них дети • Чтобы обеспечить население продовольствием через 7 лет производство продуктов питания должно увеличиться в 1, 5 раза
Нужна ли людям генетическая инженерия растения? • Население земного шара превышает 6 млрд. человек. К 2020 году составит 7, 7 млрд. • Каждый восьмой не имеет достаточного количества пищи • 40 тысяч людей умирают ежедневно от недоедания, половина из них дети • Чтобы обеспечить население продовольствием через 7 лет производство продуктов питания должно увеличиться в 1, 5 раза
 Из истории генетически модифицированных растений • Первое трансгенное растение создано в 1982 году. Это был табак. К 1995 году около 60 видов домашних растений было генетически модифицированы и «улучшенные продукты» поступили в продажу.
Из истории генетически модифицированных растений • Первое трансгенное растение создано в 1982 году. Это был табак. К 1995 году около 60 видов домашних растений было генетически модифицированы и «улучшенные продукты» поступили в продажу.
 Проблемы в мировом сельском хозяйстве • Не исключено, что к 2020 году площадь поливных земель снизится на 20 -25 % только в результате засоления грунтов и недостатка воды для орошения. • Решение данной проблемы возможно путем более эффективного использования занятых в сельском хозяйстве земель, на основе новых высокопродуктивных сортов растений. Получить новые сорта в необходимом количестве и в короткие сроки методами традиционной селекции невозможно. Ускорить процесс можно путем крупномасштабного использования новых молекулярно-генетических технологий для получения трансгенных растений, позволяющих применять эффективные методы агротехники и получать гарантированно высокий урожай.
Проблемы в мировом сельском хозяйстве • Не исключено, что к 2020 году площадь поливных земель снизится на 20 -25 % только в результате засоления грунтов и недостатка воды для орошения. • Решение данной проблемы возможно путем более эффективного использования занятых в сельском хозяйстве земель, на основе новых высокопродуктивных сортов растений. Получить новые сорта в необходимом количестве и в короткие сроки методами традиционной селекции невозможно. Ускорить процесс можно путем крупномасштабного использования новых молекулярно-генетических технологий для получения трансгенных растений, позволяющих применять эффективные методы агротехники и получать гарантированно высокий урожай.
 • Для России это проблема пока не злободневна, но при вступлении России в ВТО, нашим производителям придется покупать более качественные семена ГМР, обладающие улучшенными агротехническими и потребительскими свойствами, гарантирующие стабильную прибыль.
• Для России это проблема пока не злободневна, но при вступлении России в ВТО, нашим производителям придется покупать более качественные семена ГМР, обладающие улучшенными агротехническими и потребительскими свойствами, гарантирующие стабильную прибыль.
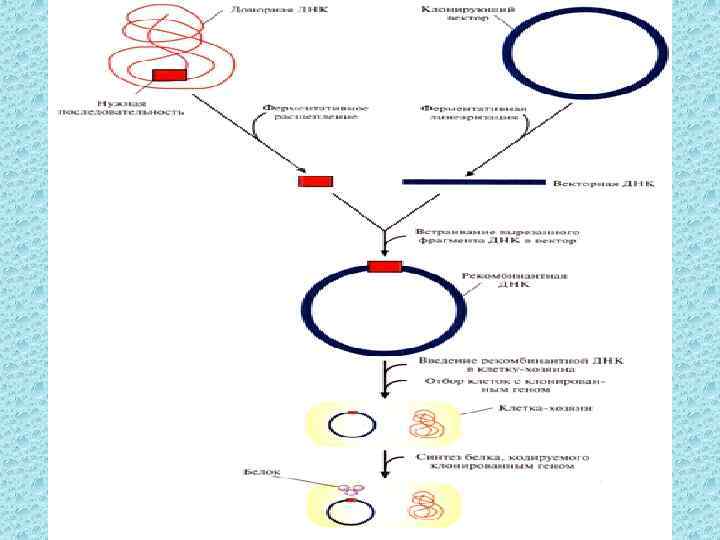
 Как получают рекомбинантные ДНК и ГМО? 1. Поиск организма-донора целевого гена 2. Извлечение ДНК, рестрикция 3. Лигирование (сшивание) с клонирующим вектором, введение «сильного» промотора Результат: образование рекомбинантной молекулы (конструкция «векторцелевой ген» )
Как получают рекомбинантные ДНК и ГМО? 1. Поиск организма-донора целевого гена 2. Извлечение ДНК, рестрикция 3. Лигирование (сшивание) с клонирующим вектором, введение «сильного» промотора Результат: образование рекомбинантной молекулы (конструкция «векторцелевой ген» )
 4. Введение конструкции в клеткухозяина а) выбор вектора (переносчика) целевого гена • Бактериальные плазмиды • Вирусы • Космиды (векторы, сочетающие признаки плазмид и фага λ) • Химерные конструкции (плазмидный вектор на основе фага P 1)
4. Введение конструкции в клеткухозяина а) выбор вектора (переносчика) целевого гена • Бактериальные плазмиды • Вирусы • Космиды (векторы, сочетающие признаки плазмид и фага λ) • Химерные конструкции (плазмидный вектор на основе фага P 1)
 4. Введение конструкции в клеткухозяина б) выбор метода переноса генов • Электропорация (укол) • Баллистические (ДНК-пушка) • Бактериальная трансформации (Agrobacterium tumefaciens) • Вирусная трансдукция 5. Размножение/клонирование клеток
4. Введение конструкции в клеткухозяина б) выбор метода переноса генов • Электропорация (укол) • Баллистические (ДНК-пушка) • Бактериальная трансформации (Agrobacterium tumefaciens) • Вирусная трансдукция 5. Размножение/клонирование клеток
 Природный переносчик генов Распространенный способ внедрения чужих генов в наследственный аппарат растений основан на свойствах болезнетворной для растений бактерии Agrobacterium tumefaciens (в буквальном переводе с латыни - полевая бактерия, вызывающая опухоли). Эта бактерия умеет встраивать в хромосомы заражаемого растения часть своей ДНК, которая заставляет растение усилить производство гормонов, и в результате некоторые клетки бурно делятся, возникает опухоль. Для генной инженерии специально выведен штамм агробактерии, лишенный способности вызывать опухоли, но сохранивший возможность вносить свою ДНК в растительную клетку
Природный переносчик генов Распространенный способ внедрения чужих генов в наследственный аппарат растений основан на свойствах болезнетворной для растений бактерии Agrobacterium tumefaciens (в буквальном переводе с латыни - полевая бактерия, вызывающая опухоли). Эта бактерия умеет встраивать в хромосомы заражаемого растения часть своей ДНК, которая заставляет растение усилить производство гормонов, и в результате некоторые клетки бурно делятся, возникает опухоль. Для генной инженерии специально выведен штамм агробактерии, лишенный способности вызывать опухоли, но сохранивший возможность вносить свою ДНК в растительную клетку
 Agrobacterium tumifaciens – природный генный инженер растений
Agrobacterium tumifaciens – природный генный инженер растений
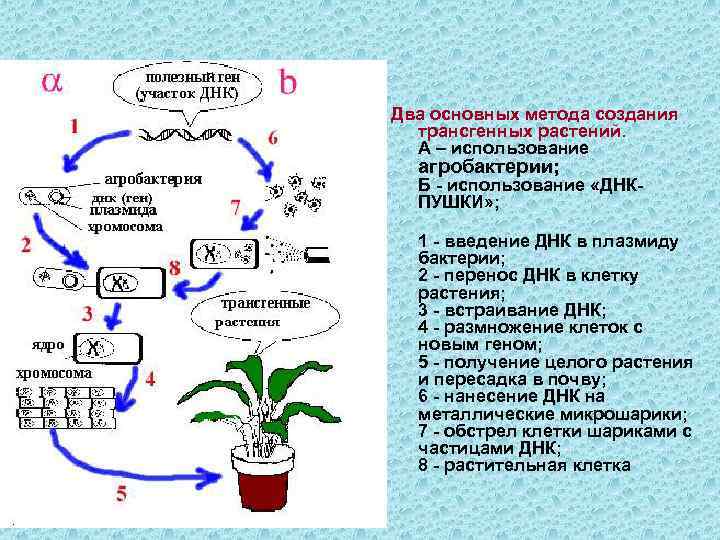 Два основных метода создания трансгенных растений. A – использование агробактерии; Б - использование «ДНКПУШКИ» ; 1 - введение ДНК в плазмиду бактерии; 2 - перенос ДНК в клетку растения; 3 - встраивание ДНК; 4 - размножение клеток с новым геном; 5 - получение целого растения и пересадка в почву; 6 - нанесение ДНК на металлические микрошарики; 7 - обстрел клетки шариками с частицами ДНК; 8 - растительная клетка
Два основных метода создания трансгенных растений. A – использование агробактерии; Б - использование «ДНКПУШКИ» ; 1 - введение ДНК в плазмиду бактерии; 2 - перенос ДНК в клетку растения; 3 - встраивание ДНК; 4 - размножение клеток с новым геном; 5 - получение целого растения и пересадка в почву; 6 - нанесение ДНК на металлические микрошарики; 7 - обстрел клетки шариками с частицами ДНК; 8 - растительная клетка
 7. Получение продукта целевого гена, что является доказательством его экспрессии 8. Клонирование (размножение) генетически модифицированного организма
7. Получение продукта целевого гена, что является доказательством его экспрессии 8. Клонирование (размножение) генетически модифицированного организма
 Достоинства генетически модифицированных растений
Достоинства генетически модифицированных растений
 • Повышение урожайности • Сокращение сроков вегетации и получение нескольких урожаев в год (в России созданы ремонтантные сорта клубники, дающие два урожая за лето).
• Повышение урожайности • Сокращение сроков вегетации и получение нескольких урожаев в год (в России созданы ремонтантные сорта клубники, дающие два урожая за лето).
 Повышение устойчивости неблагоприятным климатическим условиям - томаты получили ген морозоустойчивости от арктической камбалы - к засухе - путем переноса в геном растения гена скорпиона - лосося, который может жить как в соленой, так и в пресной воде
Повышение устойчивости неблагоприятным климатическим условиям - томаты получили ген морозоустойчивости от арктической камбалы - к засухе - путем переноса в геном растения гена скорпиона - лосося, который может жить как в соленой, так и в пресной воде
 • Приобретение растениями способности синтезировать определенные белки животного происхождения • сорт табака, синтезирующий лактоферрин человека) • в рис внесли ген человека, отвечающий за состав женского молока, который делает злак более питательным.
• Приобретение растениями способности синтезировать определенные белки животного происхождения • сорт табака, синтезирующий лактоферрин человека) • в рис внесли ген человека, отвечающий за состав женского молока, который делает злак более питательным.
 • Получение растений со свойствами «живых вакцин получены лабораторные образцы бананов, содержащих "вакцины" и лекарства ( например, анальгин), способные излечивать некоторые инфекционные заболевания, которыми страдает человечество, например, гепатит Б.
• Получение растений со свойствами «живых вакцин получены лабораторные образцы бананов, содержащих "вакцины" и лекарства ( например, анальгин), способные излечивать некоторые инфекционные заболевания, которыми страдает человечество, например, гепатит Б.
 • Устойчивость к гербицидам позволяет трансгенному растению быть невосприимчивым к смертельным для других дозам химикатов. В результате поле очищается от сорняков, а культуры, толерантные к гербицидам, выживают.
• Устойчивость к гербицидам позволяет трансгенному растению быть невосприимчивым к смертельным для других дозам химикатов. В результате поле очищается от сорняков, а культуры, толерантные к гербицидам, выживают.
 • Устойчивость к насекомым позволяет существенно уменьшить потери урожая от насекомых-вредителей. Например, колорадский жук, съедая лист ГМ- картофеля, погибает. Почти все такие растения содержат встроенный ген природного токсина земляной бактерии Bacillus thuringiensis (Bt-ген).
• Устойчивость к насекомым позволяет существенно уменьшить потери урожая от насекомых-вредителей. Например, колорадский жук, съедая лист ГМ- картофеля, погибает. Почти все такие растения содержат встроенный ген природного токсина земляной бактерии Bacillus thuringiensis (Bt-ген).
 • Качество продукции улучшенный соевый белок, получен рис, обогащенный железом и витаминами, рапсовое масло с низким содержанием эруковой кислоты, тополь без «пуха» и т. д.
• Качество продукции улучшенный соевый белок, получен рис, обогащенный железом и витаминами, рапсовое масло с низким содержанием эруковой кислоты, тополь без «пуха» и т. д.
 • • лучший вкус легче перерабатываются, дольше хранятся, урожаи ГМР примерно на 15 -25% выше, чем у традиционных культур.
• • лучший вкус легче перерабатываются, дольше хранятся, урожаи ГМР примерно на 15 -25% выше, чем у традиционных культур.
 • Профессор биологии Норман Терри из университета Калифорнии в Беркли с помощью генной инженерии более чем в пять раз увеличил способность растения поглощать из почвы селен, загрязняющих почву. Традиционные способы очистки достаточно дороги. • В качестве основы для своего исследования он взял индийскую горчицу, обладающую естественной способностью поглощать селен из почвы. Биолог модифицировал растение так, что оно смогло "откачивать" в 5, 3 раза больше яда, не будучи самим убитым. Растение преобразовывало селен в нетоксичное соединение. • Что будет, если насекомое съест такое растение, а само насекомое - съест птица и так далее.
• Профессор биологии Норман Терри из университета Калифорнии в Беркли с помощью генной инженерии более чем в пять раз увеличил способность растения поглощать из почвы селен, загрязняющих почву. Традиционные способы очистки достаточно дороги. • В качестве основы для своего исследования он взял индийскую горчицу, обладающую естественной способностью поглощать селен из почвы. Биолог модифицировал растение так, что оно смогло "откачивать" в 5, 3 раза больше яда, не будучи самим убитым. Растение преобразовывало селен в нетоксичное соединение. • Что будет, если насекомое съест такое растение, а само насекомое - съест птица и так далее.
 Опасения, связанные с генной инженерией и ГМО-технологиями
Опасения, связанные с генной инженерией и ГМО-технологиями
 - Окажут ли ГМО вредное воздействие на другие живые организмы и окружающую среду? - Приведет ли создание и распространение ГМО к уменьшению природного биоразнообразия? - Правомочно ли изменять генетическую природу живых организмов вообще и человека в частности? - Нанесет ли генная инженерия ущерб традиционным сельскому хозяйству и медицине? - Смогут ли воспользоваться преимуществами современных биотехнологий все люди? - Патентовать ли ГМО? Права на использование?
- Окажут ли ГМО вредное воздействие на другие живые организмы и окружающую среду? - Приведет ли создание и распространение ГМО к уменьшению природного биоразнообразия? - Правомочно ли изменять генетическую природу живых организмов вообще и человека в частности? - Нанесет ли генная инженерия ущерб традиционным сельскому хозяйству и медицине? - Смогут ли воспользоваться преимуществами современных биотехнологий все люди? - Патентовать ли ГМО? Права на использование?
 НЕДОСТАТКИ ГМ-растений
НЕДОСТАТКИ ГМ-растений
 Искусственное добавление чужеродных генов сильно нарушает точно отрегулированный генетический контроль нормальной клетки. Манипулирование генами коренным образом отличается от комбинирования материнских и отцовских хромосом, которое происходит при естественном скрещивании
Искусственное добавление чужеродных генов сильно нарушает точно отрегулированный генетический контроль нормальной клетки. Манипулирование генами коренным образом отличается от комбинирования материнских и отцовских хромосом, которое происходит при естественном скрещивании
 ГЕННАЯ ИНЖЕНЕРИЯ ЕЩЕ ТЕХНИЧЕСКИ несовершенна, так как она не в состоянии управлять процессом встраивания нового гена. Поэтому невозможно предвидеть место встраивания и эффекты гена.
ГЕННАЯ ИНЖЕНЕРИЯ ЕЩЕ ТЕХНИЧЕСКИ несовершенна, так как она не в состоянии управлять процессом встраивания нового гена. Поэтому невозможно предвидеть место встраивания и эффекты гена.
 В РЕЗУЛЬТАТЕ ИСКУСТВЕННОГО ДОБАВЛЕНИЯ ЧУЖЕРОДНОГО ГЕНА непредвиденно могут образоваться опасные вещества. В худшем случае это могут быть токсические вещества, аллергены или другие вредные для здоровья вещества.
В РЕЗУЛЬТАТЕ ИСКУСТВЕННОГО ДОБАВЛЕНИЯ ЧУЖЕРОДНОГО ГЕНА непредвиденно могут образоваться опасные вещества. В худшем случае это могут быть токсические вещества, аллергены или другие вредные для здоровья вещества.
 СУЩЕСТВУЮЩИЕ В НАСТОЯЩЕЕ ВРЕМЯ ТРЕБОВАНИЯ ПО ПРОВЕРКЕ на безвредность крайне недостаточны. Они совершенно явно составлены таким образом, чтобы упростить процедуру утверждения. Они позволяют использовать крайне нечувствительные методы проверки на безвредность. Поэтому существует значительный риск того, что опасные для здоровья продукты питания смогут пройти проверку незамеченными.
СУЩЕСТВУЮЩИЕ В НАСТОЯЩЕЕ ВРЕМЯ ТРЕБОВАНИЯ ПО ПРОВЕРКЕ на безвредность крайне недостаточны. Они совершенно явно составлены таким образом, чтобы упростить процедуру утверждения. Они позволяют использовать крайне нечувствительные методы проверки на безвредность. Поэтому существует значительный риск того, что опасные для здоровья продукты питания смогут пройти проверку незамеченными.
 Осложнения, вызванные в окружающей среде, вероятно, невозможно будет исправить, так как «выпущенные» гены невозможно вернуть обратно.
Осложнения, вызванные в окружающей среде, вероятно, невозможно будет исправить, так как «выпущенные» гены невозможно вернуть обратно.
 МОГУТ ВОЗНИКНУТЬ НОВЫЕ И ОПАСНЫЕ ВИРУСЫ. Экспериментально показано, что встроенные в геном гены вирусов могут соединяться с генами инфекционных вирусов. Такие новые вирусы могут быть более агрессивными, чем исходные. Вирусы могут стать также менее видоспецифичными. Например, вирусы растений могут стать вредными для полезных насекомых, животных, а также людей.
МОГУТ ВОЗНИКНУТЬ НОВЫЕ И ОПАСНЫЕ ВИРУСЫ. Экспериментально показано, что встроенные в геном гены вирусов могут соединяться с генами инфекционных вирусов. Такие новые вирусы могут быть более агрессивными, чем исходные. Вирусы могут стать также менее видоспецифичными. Например, вирусы растений могут стать вредными для полезных насекомых, животных, а также людей.
 • Дефицит семян ТР и их значительное удорожание • Уменьшение сортового и видового разнообразия возделываемых культур вследствие массового внедрения более урожайных, и, часто, более рентабельных сортов ТР
• Дефицит семян ТР и их значительное удорожание • Уменьшение сортового и видового разнообразия возделываемых культур вследствие массового внедрения более урожайных, и, часто, более рентабельных сортов ТР
 Есть сведения, что генетически модифицированные растения требуют, на самом деле, большего использования сельскохозяйственной химии: по оценкам исследований Университета Миннесоты, для производства модифицированной сои требуется в 2 -5 раз больше гербицидов, чем для обычной сои
Есть сведения, что генетически модифицированные растения требуют, на самом деле, большего использования сельскохозяйственной химии: по оценкам исследований Университета Миннесоты, для производства модифицированной сои требуется в 2 -5 раз больше гербицидов, чем для обычной сои
 • Доктор Тердж Траавик из Норвегии сделал три тревожных открытия, проанализировав влияния генетически измененных зерновых культур на здоровье человека. Во-первых, согласно результатам проведенных исследований, фермеры на Филиппинах, живущие в областях, где растет ГМ-кукуруза, встретились с необычной болезнью, которая может быть реакцией на токсин в пыльце этого растения.
• Доктор Тердж Траавик из Норвегии сделал три тревожных открытия, проанализировав влияния генетически измененных зерновых культур на здоровье человека. Во-первых, согласно результатам проведенных исследований, фермеры на Филиппинах, живущие в областях, где растет ГМ-кукуруза, встретились с необычной болезнью, которая может быть реакцией на токсин в пыльце этого растения.
 • Во-вторых, испытания на крысах показали, что вирус мозаики цветной капусты, который используется в зерновых генетически изменённых культурах для включения чужого гена в геном растения, найден неповреждённым в клетках тканей некоторых из подопытных животных. Ранее считалось, что такое невозможно, и потому метод был принят в промышленной биотехнологии, как безопасный.
• Во-вторых, испытания на крысах показали, что вирус мозаики цветной капусты, который используется в зерновых генетически изменённых культурах для включения чужого гена в геном растения, найден неповреждённым в клетках тканей некоторых из подопытных животных. Ранее считалось, что такое невозможно, и потому метод был принят в промышленной биотехнологии, как безопасный.
 В-третьих, такой вирус может быть активным. Это означает, что он мог потенциально включить какую-либо бездействующую ДНК в нашем собственном геноме. Траавик предполагает, что это открывает возможность пробуждения опасных вирусов, которые долго бездействовали в нашей ДНК.
В-третьих, такой вирус может быть активным. Это означает, что он мог потенциально включить какую-либо бездействующую ДНК в нашем собственном геноме. Траавик предполагает, что это открывает возможность пробуждения опасных вирусов, которые долго бездействовали в нашей ДНК.
 В Австралии прекращен проект по внедрению генетически модифицированных сортов гороха и бобов, который осуществлялся на протяжении последних 10 лет и обошелся примерно в 5 миллионов долларов. Причиной остановки проекта стали негативные результаты проверки на безопасность новых сортов бобовых культур. В частности, они вызывали воспалительные процессы в легких подопытных мышей.
В Австралии прекращен проект по внедрению генетически модифицированных сортов гороха и бобов, который осуществлялся на протяжении последних 10 лет и обошелся примерно в 5 миллионов долларов. Причиной остановки проекта стали негативные результаты проверки на безопасность новых сортов бобовых культур. В частности, они вызывали воспалительные процессы в легких подопытных мышей.
 При перекрестном опылении сорняки могут получить от ГМО ген устойчивости к вредителям и пестицидам. Тогда размножение сорняков будет неконтролируемым. Саморегуляция в экосистемах нарушится. Сорняки вытеснят многие виды, неспособные к конкурентной борьбе с ними и займут огромные территории, которые будут постоянно расширяться.
При перекрестном опылении сорняки могут получить от ГМО ген устойчивости к вредителям и пестицидам. Тогда размножение сорняков будет неконтролируемым. Саморегуляция в экосистемах нарушится. Сорняки вытеснят многие виды, неспособные к конкурентной борьбе с ними и займут огромные территории, которые будут постоянно расширяться.
 • Британский ученый Арпад Пуштаи (Arpad Pusztai) Он проводил эксперименты, давая крысам в качестве корма трансгенный картофель. На основании своих наблюдений ученый установил, что потребление этого продукта негативно сказалось на иммунной системе крыс, вызывало аномальные изменения кишечника, болезни печени, почек, головного мозга. • Подобное заявление Пуштаи вызвало волну протеста, и ученый был уволен из научно-исследовательского института Роуэтт. Его коллега, Стенли Юэн (Stanley Ewan), перепроверил результаты эксперимента и подтвердил их.
• Британский ученый Арпад Пуштаи (Arpad Pusztai) Он проводил эксперименты, давая крысам в качестве корма трансгенный картофель. На основании своих наблюдений ученый установил, что потребление этого продукта негативно сказалось на иммунной системе крыс, вызывало аномальные изменения кишечника, болезни печени, почек, головного мозга. • Подобное заявление Пуштаи вызвало волну протеста, и ученый был уволен из научно-исследовательского института Роуэтт. Его коллега, Стенли Юэн (Stanley Ewan), перепроверил результаты эксперимента и подтвердил их.
 Таким образом, ГМО и ГМО-технологии порождают проблемы биобезопасности Особенно остро они стоят в настоящее время, на этапе, когда биотехнология и биоинженерия стали выходить на уровень важнейших научных и технических приоритетов XXI века.
Таким образом, ГМО и ГМО-технологии порождают проблемы биобезопасности Особенно остро они стоят в настоящее время, на этапе, когда биотехнология и биоинженерия стали выходить на уровень важнейших научных и технических приоритетов XXI века.
 • Биобезопасность - это состояние защищённости человека, общества и природы от возможного опасного воздействия на них генетически модифицированных и иных биологических объектов, а также полученных из них продуктов и веществ различного назначения.
• Биобезопасность - это состояние защищённости человека, общества и природы от возможного опасного воздействия на них генетически модифицированных и иных биологических объектов, а также полученных из них продуктов и веществ различного назначения.
 Тем не менее, • ГМО выращивают на продажу с 1996 года. Сейчас 98 процентов мирового промышленного производства ГМО (соя, кукуруза, рапс, хлопок и картофель) сосредоточено в США, Бразилии, Чили, Канаде, Аргентине и Китае. Общая площадь посевов ГМ-растений – более 50 млн. га. • Деятельность корпораций, производящих ГМО, не ограничивается сельским хозяйством, они постепенно овладевают рынком медикаментов, лесным бизнесом, внедряются в рыбоводство и другие области.
Тем не менее, • ГМО выращивают на продажу с 1996 года. Сейчас 98 процентов мирового промышленного производства ГМО (соя, кукуруза, рапс, хлопок и картофель) сосредоточено в США, Бразилии, Чили, Канаде, Аргентине и Китае. Общая площадь посевов ГМ-растений – более 50 млн. га. • Деятельность корпораций, производящих ГМО, не ограничивается сельским хозяйством, они постепенно овладевают рынком медикаментов, лесным бизнесом, внедряются в рыбоводство и другие области.
 • Масштабы этой деятельности возрастают: за последние 15 лет прошли испытания 25 тыс. трансгенных растений, предназначенных для использования в сельскохозяйственном производстве и полученных с заранее заданными качествами (40% устойчивы к вирусам, 25% - к инсектицидам, 25% к гербицидам) Среди них соя, кукуруза, картофель, хлопок.
• Масштабы этой деятельности возрастают: за последние 15 лет прошли испытания 25 тыс. трансгенных растений, предназначенных для использования в сельскохозяйственном производстве и полученных с заранее заданными качествами (40% устойчивы к вирусам, 25% - к инсектицидам, 25% к гербицидам) Среди них соя, кукуруза, картофель, хлопок.
 • Для «провинциальной» России диллема «есть или не есть модификанты? » встала не так давно. В этом вопросе наше правительство последовало примеру ЕС: все генетические продукты, которые ввозятся в страну, подвергаются жесткой оценке безопасности по отечественным стандартам. Однако, «генохозяйственное производство» уже набирает ход и у нас: на «рязанских» экспериментальных полях взрастают свекла, картофель, кукуруза. Существует и теневая экономика на рынке гено-продуктов: уже появились первые известия о том, что избранные российские компании поставляют не маркированные модификанты в магазины.
• Для «провинциальной» России диллема «есть или не есть модификанты? » встала не так давно. В этом вопросе наше правительство последовало примеру ЕС: все генетические продукты, которые ввозятся в страну, подвергаются жесткой оценке безопасности по отечественным стандартам. Однако, «генохозяйственное производство» уже набирает ход и у нас: на «рязанских» экспериментальных полях взрастают свекла, картофель, кукуруза. Существует и теневая экономика на рынке гено-продуктов: уже появились первые известия о том, что избранные российские компании поставляют не маркированные модификанты в магазины.
 • В 2004 году страны Евросоюза приняли новые правила, предписывающие соответствующим образом помечать ГМП и позволяющие прослеживать их транспортировку. К этим правилам присоединилась и Россия. Согласно этим правилам любые продукты и корма содержащие более 0. 9% генетически модифицированного материала (Россия – 5%).
• В 2004 году страны Евросоюза приняли новые правила, предписывающие соответствующим образом помечать ГМП и позволяющие прослеживать их транспортировку. К этим правилам присоединилась и Россия. Согласно этим правилам любые продукты и корма содержащие более 0. 9% генетически модифицированного материала (Россия – 5%).
 Опасения российских ученых • Академик РАСХН И. А. Рогов, указывает, что непредсказуемость поведения генетически модифицированных белков в модельных системах и готовых продуктах требует всестороннего и систематического исследования. Дабы не получить в результате подобного «правильного» питания последствия, с которыми столкнулось общество после Чернобыльской АЭС. • Пресса тех лет пестрит сообщениями о рождении детей – мутантов: гермафродитов, шестипалых, с недоразвитыми конечностями, без волосяного покрова… • Не известно как проявится в следующем поколении причудливая игра генов, остается только догадываться! Поэтому, во имя сохранения человека, как биологического вида, имеет смысл серьезно изучить «генный» вопрос.
Опасения российских ученых • Академик РАСХН И. А. Рогов, указывает, что непредсказуемость поведения генетически модифицированных белков в модельных системах и готовых продуктах требует всестороннего и систематического исследования. Дабы не получить в результате подобного «правильного» питания последствия, с которыми столкнулось общество после Чернобыльской АЭС. • Пресса тех лет пестрит сообщениями о рождении детей – мутантов: гермафродитов, шестипалых, с недоразвитыми конечностями, без волосяного покрова… • Не известно как проявится в следующем поколении причудливая игра генов, остается только догадываться! Поэтому, во имя сохранения человека, как биологического вида, имеет смысл серьезно изучить «генный» вопрос.
 • Эксперты Всемирной организации здравоохранения подчеркивают, что в каждом конкретном случае для создания нового растения используются различные методы и гены, поэтому необходимо проводить экспертизы по каждому новому продукту.
• Эксперты Всемирной организации здравоохранения подчеркивают, что в каждом конкретном случае для создания нового растения используются различные методы и гены, поэтому необходимо проводить экспертизы по каждому новому продукту.
 Основные производители ГМО “Monsanto”, “Dupont”, “Celera”, “Norvatis”, “Florigene” и др. Основные потребители ГМО и ГМИ Kellog's, Nestle, Unilever, Heinz Foods, Hershey's, Coca-Cola, Mc. Donald's, Danon, Similac, Cadbury, Mars, Pepsi. Co и другие.
Основные производители ГМО “Monsanto”, “Dupont”, “Celera”, “Norvatis”, “Florigene” и др. Основные потребители ГМО и ГМИ Kellog's, Nestle, Unilever, Heinz Foods, Hershey's, Coca-Cola, Mc. Donald's, Danon, Similac, Cadbury, Mars, Pepsi. Co и другие.
 ВЫВОД Человек сам в праве выбирать, как жить и чем питаться. Главное, чтобы этот выбор был осознанным и основывался на научно доказанных фактах, а не на слухах.
ВЫВОД Человек сам в праве выбирать, как жить и чем питаться. Главное, чтобы этот выбор был осознанным и основывался на научно доказанных фактах, а не на слухах.
 Смелые эксперименты • Научный интерес толкает генетиков на создание таких мутантов, как, например, светящийся в темноте кролик, получивший от медузы ген, отвечающий за флуоресценцию.
Смелые эксперименты • Научный интерес толкает генетиков на создание таких мутантов, как, например, светящийся в темноте кролик, получивший от медузы ген, отвечающий за флуоресценцию.
present5.com
генная инженерия
Генная инженерия в животноводстве
Применение методов генной инженерии в животноводстве позволяет повышать продуктивность животных (например, удои молока), сопротивляемость их организма к болезням и т. д. Животных, имеющих в своем геноме чужой ген, принято называть трансгенными. Благодаря переносу генов у трансгенных животных возникают новые качества, а дальнейшая селекция позволяет закрепить их в потомстве и создавать трансгенные линии.
Так, были получены животные-биореакторы, способные выделять ценные биологические вещества. Например, в России группой ученых под руководством Л. К. Эрнста была выведена трансгенная овечка, которая с молоком выделяет химозин фермент, используемый в производ-стве сыра. Не так давно для сыроваренной промышленности требовалось огромное количество желудков телят. В последние несколько десятков лет практически все сыроделы пользуются химозином, полученным методом микробиологического синтеза из культур бактерий и микро-скопических грибков. Очевидно, что такое получение химозина не только гуманнее, но и выгоднее традиционных способов, требующих убийства сотни телят. Всего из 3 л молока трансгенной овцы можно получить достаточно химозина для производства тонны сыра – и при этом не тратиться ни на работу ферментера, ни на выделение из культуральной жидкости нужного фермента и его очистку.
Другой пример – трансгенная корова, которая выделяет с молоком лекарственный препарат эритропоэтин, применяемый в терапии лейкозов. Ведутся исследования по получению многих других лекарств из молока животных. Применяемые для этого биотехнологические методы с использованием бактерий дороги и сложны. А трансгенные животные быстро размножаются, и выход полезных веществ с их молоком превосходит таковой у бактерий.
Другая важная задача – выведение животных, устойчивых к заболеваниям. Потери в животноводстве, вызванные болезнями, достаточно велики, но уже созданы популяции трансгенных коров и кур, устойчивых к некоторым паразитам.
Применение методов генетической инженерии в животноводстве открывает перспективу изменения ряда свойств организма: повышение продуктивности, резистентности к заболеваниям, увеличение скорости роста, улучшение качества продукции и др. Животных, несущих в своем геноме рекомбинантный (чужеродный) ген, принято называть трансгенными, а ген, интегрированный в геном реципиента, – трансгеном. Продукт этого гена (белок) является трансгенным. Благодаря переносу генов у трансгенных животных возникают новые качества, а дальнейшая селекция позволяет закрепить их в потомстве и создавать трансгенные линии.
Генетический анализ родившихся трансгенных животных и полученного от них потомства показал, что, несмотря на инъекцию ДНК на ранних стадиях, в трансгенных линиях могут появляться так называемые мозаики. К мозаикам относят животных, происходящих из одной зиготы, но имеющих разные генотипы. Подсчитано, что около 30% первичных трансгенных животных, полученных методом микроинъекции ДНК, – мозаики, что затрудняет создание чистых трансгенных линий животных.
Первые трансгенные мыши с ГР были получены в 1982 г. У них отмечалось повышение скорости роста и увеличение конечной живой массы. Однако у трансгенных свиней с геном ГР (1989) увеличение роста не наблюдалось.
По данным Л.К. Эрнста (1996), у трансгенных свиней с геном рилизинг-фактора гормона роста (РФ ГР) конечная живая масса была на 15,7% выше по сравнению с контрольными животными. Однако у трансгенных овец с генами Гр и РФ ГР, несмотря на повышенный уровень ГР, скорость роста не увеличивалась.
Одна из важнейших задач использования трансгенных животных в медицине – получение биологически активных соединений за счет включения в клетки организма генов, вызывающих у них синтез новых белков.
В Эдинбурге в 1992 г. были выведены трансгенные овцы с геном α-1-антитрипсина человека и β-глобулиновым промотором. Содержание этого белка у разных трансгенных овец составляло от 1 до 35 г./л, что соответствует половине всех белков в молоке. При таком уровне продукции белка может быть получено около 10 кг трансгенного белка от одного животного в год, что достаточно для 50 пациентов при лечении эмфиземы легких. В России группой ученых под руководством Л.К. Эрнста получены трансгенные овцы с геном химозина, в 1 л молока которых содержится 200–300 мг химозина – основного компонента для производства сыра. Крупное достижение сделано учёными научного центра, в котором была создана первая клонированная овечка – Долли. Исследователи из института Рослина произвели пять поколений птиц, в яичном белке которых содержатся человеческий интерферон и miR24 антитела для борьбы с меланомой[20].
Генно-инженерные методы, в частности технология рекомбинантных ДНК, позволяют создавать новые генотипы и, следовательно, новые формы растений гораздо быстрее, чем классические методы селекции. Кроме того, появляется возможность целенаправленного изменения генотипа – трансформации – благодаря введению определенных генов.
На схеме 1. представлены основные стадии технологической схемы получения генно-инженерного инсулина человека.

http://fizmathim.com/novaya-tehnologicheskaya-shema-polucheniya-genno-inzhenernogo-insulina-cheloveka
Биосинтез соматотропина
Гормон роста человека, или соматотропин, синтезируется в головном мозге человека в передней доли гипофиза. Впервые он был выделен из трупного материала и очищен в 1963 г. При недостатке соматотропина развивается гипофизарная карликовость, частота встречаемости которой оценивается от 7 до 10 случаев на миллион человек. Гормон обладает видовой специфичностью, т. е. в отличие от инсулина гормоны роста животных не имеют активности в организме человека. Следовательно, единственным средством излечения гипофизарной карликовости является гормон гипофиза, который выделяли из трупов. Исследования показали, что при внутримышечном введении соматотропина в дозах 10 мг на 1 кг массы в течение года по три инъекции в неделю дает увеличение роста примерно на 8-18 см в год. Больные дети четырех-пяти лет при непрерывном лечении догоняли в росте своих сверстников к половой зрелости (14-16 лет). Если учесть тот факт, что из одного трупа можно получить 4-6 мг соматотропина, то можно понять, что лечение этого заболевания природным соматотропином - дело совершенно безнадежное. Помимо недостатка препарата возникли и другие проблемы, связанные с гетерогенностью гормона, выделяемого из трупного материала. Существовала также опасность, что гипофизарный материал заражен медленно развивающимися вирусами. Такие вирусы обладают необычайно длительным инкубационным периодом, поэтому дети, получавшие препарат, нуждались в многолетнем медицинском наблюдении. Гормон роста человека, синтезированный в специально сконструированных клетках бактерий, имеет очевидные преимущества: он доступен в больших количествах, его препараты являются биохимически чистыми и свободны от вирусных загрязнений. Биосинтез соматотропина (состоящего из 191-го аминокислотного остатка) специально сконструированными бактериями на основе кишечной палочки был осуществлен фирмой «Генентек». Поскольку при синтезе ДНК на и-РНК получается ген, кодирующий предшественник соматотропина, не расщепляющийся в бактериальных клетках с образованием активного гормона, то поступили следующим образом: на 1 этапе клонировали двунитевую ДНК-копию и-РНК и расщеплением рестрикционными эндонуклеазами получили последовательность, которая кодирует всю аминокислотную последовательность гормона, кроме 23-х первых аминокислот. Затем клонировали синтетический полинуклеотид, соответствующий аминокислотам от 1-й до 23-й. Далее два фрагмента объединили вместе и «подстроили» в плазмиду E. coli, после чего клетки бактерии начали синтезировать этот гормон. К 1980 г. были закончены клинические испытания препарата и тесты на токсичность и были начаты массовые эксперименты на детях, близких по возрасту к половой зрелости. Результаты были обнадеживающими, и синтетический соматотропин с 1982 г. начал производиться в промышленном масштабе.
МЕТОДЫ ГЕНЕТИЧЕСКОЙ
ТРАНСФОРМАЦИИ РАСТЕНИЙ
Отсчет истории генетической инженерии растений принято вести с 1982 года, когда впервые были получены генетически трансформированные растения [30]. Метод трансформации основывался на природной способности бактерии Agrobacterium tumefaciens генетически модифицировать растения. Реконструированные штаммы Agrobacterium, содержащие неонкогенные варианты Ti-плазмид и обладающие повышенной вирулентностью, стали основой одного из наиболее популярных методов трансформации. Первоначально трансформация применялась для генетической инженерии двудольных, однако работы последних лет [5, 14] свидетельствуют, что этот метод эффективен и в отношении кукурузы, риса, пшеницы.
Другим широко распространенным методом трансформации является технология, основанная на обстреле ткани микрочастицами золота (или других тяжелых металлов), покрытыми раствором ДНК [15]. Все выращиваемые ныне коммерческие трансгенные сорта получены с помощью названных выше двух методов. Современный арсенал методов трансформации, однако, довольно обширен и включает такие подходы, как введение ДНК в голые клетки (протопласты), электропорация клеток, микроинъекции ДНК в клетки, прокалывание клеток путем встряхивания их в суспензии микроигл, опосредованная вирусами инфекция и т.д. [1, 9, 10, 17].
УСТОЙЧИВОСТЬ К ГЕРБИЦИДАМ
Генетически измененные растения с устойчивостью к различным классам гербицидов в настоящее время являются наиболее успешным биотехнологическим продуктом. Классическая сельскохозяйственная химия стремилась к созданию гербицидов селективного типа, которые бы угнетали рост возможно большего числа видов сорняков, не подавляя при этом роста культурных сортов. Несмотря на прогресс в 1960-1970-х годах в создании чрезвычайно эффективных гербицидов (сульфонил мочевины, имидазолиноны и др.), которые используются в низких концентрациях (менее 100 г/га и даже 10 г/га), чрезвычайно малотоксичны для животных и человека и весьма селективны, за последние двадцать лет качественно новых химических препаратов не появилось.
Биотехнология позволила совершить качественный прыжок, так как оказалось возможным генетически изменять устойчивость растений к тем или иным гербицидам либо путем введения генов, кодирующих белки, нечувствительные к данному классу гербицидов, либо за счет введения генов, обеспечивающих ускоренный метаболизм гербицида в растении. К настоящему времени клонированы гены, кодирующие нечувствительные к действию гербицидов ферменты-мишени, что дало возможность получать трансгенные растения, устойчивые к таким гербицидам, как глифосат (коммерческое название Roundup) [6, 14] и хлорсульфуроновым и имидазолиноновым гербицидам [18, 20]. Изолированы также гены, которые кодируют ферменты деградации некоторых гербицидов, что позволило получать трансгенные растения, устойчивые к фосфинотрицину (коммерческое название BASTA) [7], 2,4 D [3], далапону [4]. В 1997 году устойчивая к Roundup соя, распространяемая компанией "Asgrow", была признана в США сельскохозяйственным продуктом года.
УСТОЙЧИВОСТЬ К НАСЕКОМЫМ
Интересный подход, обеспечивающий устойчивость растений к насекомым, предложила генетическая инженерия растений. Уже довольно давно известна бактерия Bacillus thuringiensis, продуцирующая белок, являющийся очень токсичным для многих видов насекомых, в то же время безопасный для млекопитающих. Белок (дельта-эндотоксин, СRY-белок) продуцируется различными штаммами В. thuringiensis. Это прототоксин, который протеолитически расщепляется в кишечнике насекомых, образуя активизированный токсин. Активизированный белок специфично связывается с рецепторами в средней кишке насекомых, что приводит к образованию пор и лизису клеток кишечного эпителия. Взаимодействие токсина с рецепторами строго специфично, что усложняет подбор комбинации токсин-насекомое. В природе найдено большое количество штаммов В. thuringiensis, чьи токсины действуют только на определенные виды насекомых. Препараты В. thuringiensis в течение десятилетий использовали для контроля насекомых на полях.
Безопасность токсина и его составных белков для человека и других млекопитающих полностью доказана. Оказалось, что встраивание гена этого белка в геном растений дает возможность получить трансгенные растения, не поедаемые насекомыми [27]. В то же время практическое применение генноинженерных методов по созданию растений, устойчивых к конкретным насекомым-вредителям, потребовало большой работы по подбору необходимых штаммов В. thuringiensis и созданию генноинженерных конструкций, которые дают наибольший эффект для конкретных классов насекомых. Кроме видоспецифичности по действию на насекомых встраивание прокариотических генов дельта-токсинов в геном растений даже под контролем сильных эукариотических промоторов не привело к высокому уровню экспрессии. Предположительно такое явление возникло в связи с тем, что эти бактериальные гены содержат значительно больше адениновых и тиминовых нуклеотидных оснований, чем растительная ДНК. Эта проблема была решена путем создания модифицированных генов, где из природного гена вырезали и добавляли те или иные фрагменты с сохранением доменов, кодирующих активные части дельта-токсина. Так, например, с помощью таких подходов был получен картофель, устойчивый к колорадскому жуку [23]. В настоящее время так называемые Вt-растения (от В. thuringiensis) хлопка [22] и кукурузы [16] занимают основную долю в общем объеме генетически модифицированных растений этих культур, которые выращивают на полях США.
БЕЛКИ
Растения являются безусловно наиболее дешевым продуцентом белков. Стоимость белка, полученного путем сельскохозяйственного культивирования сои или кукурузы, составляет менее 1 долл./кг. Кроме того, использование в настоящее время микробных клеток в закрытых системах (ферментерах) и особенно культивируемых клеток животных в качестве продуцентов фармацевтических белков обходится в сотни и тысячи раз дороже. К сожалению, львиную долю стоимости производства зачастую составляет не наращивание клеток, а последующая очистка белка. Стоимость очистки тем выше, чем ниже концентрация белка в клетках. Это особенно важно в случае фармацевтических белков, требующих высокой степени чистоты. Поэтому исследования последних лет имели целью, с одной стороны, показать возможность получения биологически эквивалентных форм того или иного белка в трансгенных растениях, а с другой - повысить содержание белка и облегчить и удешевить его последующую очистку.
К настоящему времени уже показано, что растения могут производить белки животного происхождения. Так, встраивание в геном растений Arabidopsis thaliana и Brassica napus химерного гена, состоящего из части гена запасного 2S-белка арабидопсиса и кодирующей части для нейропептида - энкефалина, приводило к синтезу химерного белка до 200 нг на 1 г семени. Два структурных белковых домена были связаны последовательностью, узнаваемой трипсином, что давало возможность в дальнейшем легко изолировать чистый энкефалин [28]. В другом эксперименте удалось после скрещивания трансгенных растений, в одном из которых был встроен ген гамма-субъединицы, а во втором - ген каппа-субъединицы иммуноглобулина, получить у потомства экспрессию обеих цепей. В результате растение формировало антитела, составляющие до 1,3% суммарного белка листьев [13]. Также было показано, что в растениях табака могут собираться полностью функциональные секреторные моноклональные иммуноглобулины [19]. Секреторные иммуноглобулины обычно выделяются в ротовую полость и желудок человека и животных и служат первым барьером на пути кишечных инфекций. В упомянутой выше работе получили продукцию в растениях моноклональных антител, которые были специфичны для Streptococcus mutans - бактерий, вызывающих зубной кариес. Предполагается, что на основе таких моноклональных антител, продуцируемых трансгенными растениями, удастся создать действительно антикариесную зубную пасту.
Из других белков животного происхождения, которые представляют интерес для медицины, показана продукция в растениях человеческого b-интерферона [8]. Разработаны также подходы, позволяющие получать бактериальные антигены в растениях и использовать их в качестве вакцин [12]. Получен картофель, экспрессирующий олигомеры нетоксичной субъединицы В-токсина холеры. Эти трансгенные растения могут быть использованы для получения дешевой вакцины против такого заболевания, как холера. Причем в случае холеры иммунизация вполне эффективно происходит при пероральном приеме вакцины [2].
ЖИРЫ
Генетическая инженерия метаболизма жиров уже привела к новым коммерческим продуктам. Важнейшим сырьем для получения разного рода химических веществ являются жирные кислоты - основной компонент растительного масла. По своей структуре это углеродные цепи, которые обладают различными физико-химическими свойствами в зависимости от своей длины и степени насыщения углеродных связей. В 1995 году была закончена экспериментальная проверка и получено разрешение от федеральных властей США на выращивание и коммерческое использование трансгенных растений рапса с измененным составом растительного масла, включающего вместе с обычными 16- и 18-членными жирными кислотами также и до 45% 12-членной жирной кислоты - лаурата. Это вещество широко используется для производства стиральных порошков, шампуней, косметики.
Экспериментальная работа заключалась в том, что был клонирован ген специфической тиоэстеразы из растения Umbellularia californica, где содержание лаурата в жире семян достигало 70%. Структурная часть гена этого фермента под контролем промотора-терминатора гена белка, специфического для ранней стадии семяобразования, была встроена в геном рапса и арабидопсиса, что и привело к увеличению содержания лаурата в масле этих растений [29].
Из других проектов, связанных с изменением состава жирных кислот, можно упомянуть работы, ставящие целью повышение или снижение содержания ненасыщенных жирных кислот в растительном масле. Интересными представляются эксперименты с петрозелиновой кислотой - изомером олеиновой кислоты, где двойная связь находится за шестым углеродным членом. Эта жирная кислота входит в состав масла кориандра и определяет его более высокую температуру плавления (33?C), в то время как при наличии олеиновой кислоты температура плавления составляет только 12?С. Предполагается, что после переноса генов, определяющих синтез петрозелиновой кислоты, в растения - продуценты растительного масла удастся производить диетический маргарин, содержащий ненасыщенную жирную кислоту. Кроме того, из петрозелиновой кислоты очень легко получать лаурат путем окисления озоном [21, 26].
Дальнейшее изучение специфики биохимического синтеза жирных кислот, по-видимому, приведет к возможности управлять этим синтезом с целью получения жирных кислот различной длины и различной степени насыщения, что позволит значительно изменить производство детергентов, косметики, кондитерских изделий, затвердителей, смазочных материалов, лекарств, полимеров, дизельного топлива и многого другого, что связано с использованием углеводородного сырья.
ПОЛИСАХАРИДЫ И ДРУГИЕ САХАРА
Растения являются важнейшим источником сахаров и продуктов на их основе. Среди наиболее важных для нас продуктов следует упомянуть целлюлозу, крахмал, а также пищевые моно- и дисахариды. Проводится работа по созданию трансгенных растений картофеля и других крахмалнакапливающих культур, в которых это вещество будет находиться в основном в виде амилопектина, то есть разветвленной форме крахмала, или же в основном только в виде амилозы, то есть линейных форм крахмала. Раствор амилопектина в воде более жидкий и прозрачный, чем у амилозы, которая при взаимодействии с водой образует ригидный гель. Так, например, крахмал, состоящий в основном из амилопектина, по-видимому, будет иметь спрос на рынке производителей различных питательных смесей, где сейчас в качестве наполнителя используется модифицированный крахмал [24].
ИЗМЕНЕНИЕ СВОЙСТВ СЕЛЬСКОХОЗЯЙСТВЕННЫХ
И ТЕХНИЧЕСКИХ РАСТЕНИЙ
Современная биотехнология в состоянии манипулировать многими важными признаками, которые можно разделить на две группы. Одни из них важны для собственно сельскохозяйственного производства. К ним можно отнести повышение общей продуктивности растений за счет регулирования синтеза фитогормонов или дополнительного снабжения кислородом растительных клеток, а также признаки, обеспечивающие устойчивость к разного рода вредителям (насекомые, грибы, бактерии, вирусы, нематоды) или же к абиотическим факторам (засуха, засоленность, оксидативный стресс). К этой же группе можно отнести устойчивость к разного рода гербицидам, создание форм растений с мужской стерильностью, возможность гораздо дольше сберегать выращенный урожай.
К признакам, которые влияют на качество получаемой продукции, относится возможность манипулирования молекулярным весом жирных кислот. Растения будут производить биодеградирующий пластик, по цене сопоставимый с полиэтиленом, получаемым из нефти. Открылась возможность получения крахмала с заданными физико-химическими свойствами. Аминокислотный состав у растительных запасных белков становится более сбалансированным и легкоусвояемым для млекопитающих. Растения также становятся продуцентами вакцин, фармакологических белков и антител, что позволит значительно удешевить лечение разных заболеваний, в том числе и онкологических. Получены и испытываются трансгенные растения хлопка с уже окрашенным волокном. В будущем натуральное хлопковое волокно будет крепче, не будет ни мяться, ни садиться и будет иметь различную окраску без применения химических красителей. Необходимо отметить, что рынок для продуктов с новыми качествами более значителен, чем рынок продуктов с улучшеными чисто сельскохозяйственными признаками, хотя в настоящее время именно признаки первой группы, такие, как устойчивость к гербицидам и насекомым, получили первый коммерческий успех на полях США.
ГЕНЕТИЧЕСКАЯ МОДИФИКАЦИЯ ПЛАСТИД
Во многих случаях генетической модификации будут подвергаться не ядерные геномы, а геномы пластид [25] или митохондрий. Такие системы уже сегодня позволяют значительно увеличить содержание продукта в трансгенном материале. Управляемая активность генов (за счет использования индуцибельных генетических систем, когда активность гена включается добавлением небольших молекул типа тетрациклина, стероидов, тяжелых металлов и т.д.), селективная экспрессия трансгена в определенных тканях, а также направления компартментализации продукта действия гена (в эндоплазматическом ретикулуме, вакуолях, пластидах, митохондриях, секреция в окружающую среду) - все эти направления улучшения генноинженерных растений активно исследуются. Наконец, нелишне упомянуть систему экспрессии в растениях чужеродной генетической информации, опосредованной вирусами. Разработанная усилиями компании "Biosource" (США) технология позволяет быстро и в больших количествах нарабатывать в растениях белки и небольшие молекулы за счет инфицирования растений генетически модифицированными вирусами, содержащими встроенные чужеродные гены тех или иных белков / ферментов. За этой системой большое будущее, так как она позволяет изменить биосинтетические процессы в растениях без длительных и дорогостоящих манипуляций с растительным геномом.
СИСТЕМЫ И ИНСТРУМЕНТЫ
ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ БУДУЩЕГО
Применяемые в настоящее время методы и технологии генетического конструирования весьма несовершенны. Например, существующие методы трансформации растений малоэффективны, видо- и сортоспецифичны, приводят к случайному встраиванию чужеродной ДНК в геном реципиента, накладывают ограничения на количество переносимой информации и т.д.
Переброс трансгенов из одного сорта в другой требует многократных возвратных скрещиваний и, главное, не является генетически чистой процедурой, поскольку вместе с чужеродной ДНК в процессе случайной рекомбинации происходит перенос различных кусков ДНК сорта-донора. Трансгены в сегодняшних коммерческих сортах постоянно включены (экспрессируются) и, как правило, работают во всех органах и тканях растения. Поскольку эффективной процедуры встраивания трансгенов в заранее заданный участок генома не существует, манипулирование даже несколькими независимыми признаками и их координированный переброс в сотни сортов превращаются в логистический кошмар для селекционных компаний.
Очевидно поэтому, что любой прогресс биотехнологии растений будет зависеть от разработки генетических систем и инструментов, которые позволят более эффективно управлять трансгенами. Ситуация аналогична той, которая наблюдается в компьютерной индустрии, где помимо увеличения объемов обрабатываемой информации и улучшения самих компьютеров нужны еще операционные системы управления информацией типа микрософтовских "окон".
Для чистого вшивания / вырезания трансгенной ДНК в растительный геном все больше применяют заимствованные из микробной генетики системы гомологичной рекомбинации, такие, как системы Cre-lox (от англ. Control of recomdination и locus of crossover) и Flp-frt. Будущее, очевидно, будет за управляемым переносом генов от сорта к сорту, основанным на применении предварительно подготовленного растительного материала, который уже содержит в нужных хромосомах / местах участки гомологии, необходимые для гомологичного встраивания трансгена. Помимо интегративных систем экспрессии будут опробованы автономно реплицирующиеся векторы. Особый интерес представляют искусственные хромосомы растений, которые теоретически не накладывают никаких ограничений на объем вносимой чужеродной информации.
ПОИСКИ ГЕНОВ, КОДИРУЮЩИХ
НОВЫЕ ПОЛЕЗНЫЕ ПРИЗНАКИ
Ситуация в этой области меняется радикальным образом, прежде всего благодаря существованию публичных и коммерческих баз данных, содержащих информацию о большинстве генов бактерий, дрожжей, человека и растений, а также вследствие разработки методов, позволяющих одновременно анализировать экспрессию большого количества генов с очень высокой пропускной способностью. Применяемые на практике методы можно разделить на две категории.
К первой категории относятся методы, позволяющие вести экспрессионное профилирование, такие, как субтракционная гибридизация, электронное сравнение EST-библиотек, полученных из различных тканей либо при различных физиологических / генетических параметрах, серийный анализ экспрессии генов SAGE, а также "генные чипы" типа изготовляемых компаниями "Affymetrix", "Synteni", "Hyseq". Эти методы позволяют быстро установить корреляцию между тем или иным фенотипическим признаком (болезнь, устойчивость к болезни, новое содержание / качество тех или иных практически важных молекул и т.д.) и активностью конкретных генов.
Второй подход, называемый позиционным клонированием, заключается в создании за счет инсерционного мутагенеза (Т-ДНК-опосредованные либо транспозоновые инсерции) мутантов с нарушениями в интересующем нас признаке или свойстве, с последующим клонированием соответствующего гена как такового, который заведомо содержит известную последовательность (инсерция).
Как можно заметить, названные выше методы не предполагают никаких изначальных сведений о генах, контролирующих тот или иной признак. Отсутствие рационального компонента в данном случае является положительным обстоятельством, поскольку поиск не ограничен нашими сегодняшними (по определению, неполными) представлениями о природе и генетическом контроле конкретного интересующего нас признака.
studfiles.net
Генная инженерия - vechnayamolodost.ru
Генная инженерия (генетическая инженерия) – совокупность методов и технологий, в том числе технологий получения рекомбинантных рибонуклеиновых и дезоксирибонуклеиновых кислот, по выделению генов из организма, осуществлению манипуляций с генами и введению их в другие организмы [1].
Генная инженерия – составная часть современной биотехнологии, теоретической основой ее является молекулярная биология, генетика. Суть новой технологии заключается в направленном, по заранее заданной программе конструировании молекулярных генетических систем вне организма (in vitro) с последующим внедрением созданных конструкций в живой организм. В результате достигается их включение и активность в данном организме и у его потомства. Возможности генной инженерии – генетическая трансформация, перенос чужеродных генов и других материальных носителей наследственности в клетки растений, животных и микроорганизмов, получение генно-инженерно-модифицированных (генетически модифицированных, трансгенных) организмов с новыми уникальными генетическими, биохимическими и физиологическими свойствами и признаками, делают это направление стратегическим.
С точки зрения методологии генная инженерия сочетает в себе фундаментальные принципы (генетика, клеточная теория, молекулярная биология, системная биология), достижения самых современных постгеномных наук: геномики, метаболомики, протеомики с реальными достижениями в прикладных направлениях: биомедицина, агробиотехнология, биоэнергетика, биофармакология, биоиндустрия и т.д.
Генная инженерия относится (наряду с биотехнологией, генетикой, молекулярной биологией, и рядом других наук о жизни) к сфере естественных наук.
Историческая справка
Генная инженерия появилась благодаря работам многих исследователей в разных отраслях биохимии и молекулярной генетики. В 1953 году Дж. Уотсон и Ф. Крик создали двуспиральную модель ДНК, на рубеже 50 – 60-х годов 20 века были выяснены свойства генетического кода, а к концу 60-х годов его универсальность была подтверждена экспериментально. Шло интенсивное развитие молекулярной генетики, объектами которой стали E.coli, ее вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов. ДНК вирусов и плазмид вводили в клетки в биологически активной форме, обеспечивая ее репликацию и экспрессию соответствующих генов. В 1970 году Г.Смитом был впервые выделен ряд ферментов – рестриктаз, пригодных для генно-инженерных целей. Г.Смит установил, что полученный из бактерий очищенный фермент HindII сохраняет способность разрезать молекулы нуклеиновых кислот (нуклеазная активность), характерную для живых бактерий. Комбинирование ДНК-рестриктаз (для разрезания молекул ДНК на определенные фрагменты) и выделенных еще в 1967 г. ферментов – ДНК-лигаз (для «сшивания» фрагментов в произвольной последовательности) по праву можно считать центральным звеном в технологии генной инженерии.
Датой рождения генной инженерии можно считать 1972 год, когда П. Берг, С. Коэн, Х. Бойер с сотрудниками (Стенфордский университет) создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса SV40, бактериофага и E. Coli.
Таким образом, к началу 70-х годов были сформулированы основные принципы функционирования нуклеиновых кислот и белков в живом организме и созданы теоретические предпосылки генной инженерии
Академик А.А. Баев был первым в нашей стране ученым, который поверил в перспективность генной инженерии и возглавил исследования в этой области. Генетическая инженерия (по его определению) – конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или иначе – создание искусственных генетических программ.
Задачи и методы генной инженерии
Хорошо известно, что традиционная селекция имеет целый ряд ограничений, которые препятствуют получению новых пород животных, сортов растений или рас практически ценных микроорганизмов:
1. отсутствие рекомбинации у неродственных видов. Между видами существуют жесткие барьеры, затрудняющие естественную рекомбинацию. 2. невозможность управлять процессом рекомбинации в организме извне. Отсутствие гомологии между хромосомами приводит к неспособности сближаться и обмениваться отдельными участками (и генами) в процессе образования половых клеток. В результате становится невозможным перенос нужных генов и обеспечение оптимального сочетания в новом организме генов, полученных от разных родительских форм; 3. невозможность точно задать признаки и свойства потомства, т.к. процесс рекомбинации – статистический.
Природные механизмы, стоящие на страже чистоты и стабильности генома организма, практически невозможно преодолеть методами классической селекции.
Технология получения генетически модифицированных организмов (ГМО) принципиально решает вопросы преодоления всех естественных и межвидовых рекомбинационных и репродуктивных барьеров. В отличие от традиционной селекции, в ходе которой генотип подвергается изменениям лишь косвенно, генная инженерия позволяет непосредственно вмешиваться в генетический аппарат, применяя технику молекулярного клонирования. Генная инженерия позволяет оперировать любыми генами, даже синтезированными искусственно или принадлежащими не родственным организмам, переносить их от одного вида к другому, комбинировать в произвольном порядке.
Технология включает несколько этапов создания ГМО:
1. Получение изолированного гена. 2. Введение гена в вектор для встраивания в организм. 3. Перенос вектора с конструкцией в модифицируемый организм-рецепиент. 4. Молекулярное клонирование. 5. Отбор ГМО.
Первый этап – синтез, выделение и идентификация целевых фрагментов ДНК или РНК и регуляторных элементов очень хорошо разработан и автоматизирован. Изолированный ген может быть также получен из фаговой библиотеки.
Второй этап – создание in vitro (в пробирке) генетической конструкции (трансгена), которая содержит один или несколько фрагментов ДНК (кодирующих последовательность аминокислот белков) в совокупности с регуляторными элементами (последние обеспечивают активность трансгенов в организме). Далее трансгены встраивают в ДНК вектора для клонирования, используя инструментарий генной инженерии – рестриктазы и лигазы. За открытие рестриктаз Вернер Арбер, Даниел Натанс и Хамилтон Смит были удостоены Нобелевской премии (1978 г.). Как правило, в качестве вектора используют плазмиды – небольшие кольцевые молекулы ДНК бактериального происхождения.
Следующий этап – собственно «генетическая модификация» (трансформация), т.е. перенос конструкции «вектор – встроенная ДНК» в отдельные живые клетки. Введение готового гена в наследственный аппарат клеток растений и животных представляет собой сложную задачу, которая была решена после изучения особенностей внедрения чужеродной ДНК (вируса или бактерии) в генетический аппарат клетки. Процесс трансфекции был использован как принцип введения генетического материала в клетку.
Если трансформация прошла успешно, то после эффективной репликации из одной трансформированной клетки возникает множество дочерних клеток, содержащих искусственно созданную генетическую конструкцию. Основой для появления у организма нового признака служит биосинтез новых для организма белков – продуктов трансгена, например, растений – устойчивости к засухе или насекомым-вредителям у ГМ растений.
Для одноклеточных организмов процесс генетической модификации ограничивается встраиванием рекомбинантной плазмиды с последующим отбором модифицированных потомков (клонов). Для высших многоклеточных организмов, например, растений, то обязательным является включение конструкции в ДНК хромосом или клеточных органелл (хлоропластов, митохондрий) с последующей регенерацией целого растения из отдельной изолированной клетки на питательных средах. В случае животных, клетки с измененным генотипом вводят в бластоциды суррогатной матери. Первые ГМ растения были получены в 1982 году учеными из Института растениеводства в Кельне и компании Monsanto.
Основные направления
Постгеномная эра в первой декаде XXI-ого века подняла на новый уровень развитие генной инженерии. Так называемый Кельнский Протокол «На пути к биоэкономике, основанной на знаниях» [2], определил биоэкономику как «преобразование знаний наук о жизни в новую, устойчивую, экологически эффективную и конкурентоспособную продукцию». Дорожная карта генной инженерии содержит целый ряд направлений: генотерапия, биоиндустрия, технологии, основанные на стволовых клетках животных, ГМ растения, ГМ животные и т.д.
Генетически модифицированные растения
Ввести чужеродную ДНК в растения можно различными способами.
Для двудольных растений существует естественный вектор для горизонтального переноса генов: плазмиды агробактерий. Что касается однодольных, то, хотя в последние годы достигнуты определенные успехи в их трансформации агробактериальными векторами, все же подобный путь трансформации встречает существенные затруднения.
Для трансформации устойчивых к агробактериям растений разработаны приемы прямого физического переноса ДНК в клетку они включают: бомбардировку микрочастицами или баллистический метод; электропорацию; обработку полиэтиленгликолем; перенос ДНК в составе липосом и др.
После проведения тем или иным способом трансформации растительной ткани ее помещают in vitro на специальную среду с фитогормонами, способствующую размножению клеток. Среда обычно содержит селективный агент, в отношении которого трансгенные, но не контрольные клетки приобретают устойчивость. Регенерация чаще всего проходит через стадию каллуса, после чего при правильном подборе сред начинается органогенез (побегообразование). Сформированные побеги переносят на среду укоренения, часто также содержащую селективный агент для более строгого отбора трансгенных особей.
Первые трансгенные растения (растения табака со встроенными генами из микроорганизмов) были получены в 1983 г. Первые успешные полевые испытания трансгенных растений (устойчивые к вирусной инфекции растения табака) были проведены в США уже в 1986 г.
После прохождения всех необходимых тестов на токсичность, аллергенность, мутагенность и т.д. первые трансгенные продукты появились в продаже в США в 1994 г. Это были томаты Flavr Savr с замедленным созреванием, созданные фирмой «Calgen», а также гербицид-устойчивая соя компании «Monsanto». Уже через 1-2 года биотехнологические фирмы поставили на рынок целый ряд генетически измененных растений: томатов, кукурузы, картофеля, табака, сои, рапса, кабачков, редиса, хлопчатника.
В РФ возможность получения трансгенного картофеля методом бактериальной трансформации с использованием Agrobacterium tumefaciens была показана в 1990 г.
В настоящее время получением и испытанием генетически модифицированных растений занимаются сотни коммерческих фирм во всем мире с совокупным капиталом более 100 миллиардов долларов. Генно-инженерная биотехнология растений уже стала важной отраслью производства продовольствия и других полезных продуктов, привлекающей значительные людские ресурсы и финансовые потоки.
В России под руководством академика К.Г. Скрябина (Центр «Биоинженерия» РАН) получены и охарактеризованы ГМ сорта картофеля Елизавета плюс и Луговской плюс, устойчивые к колорадскому жуку. По результатам проверки Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека на основании экспертного заключения ГУ НИИ питания РАМН данные сорта прошли государственную регистрацию, внесены в государственный реестр и разрешены для ввоза, изготовления и оборота на территории РФ.
Данные ГМ сорта картофеля принципиально отличается от обычных наличием в его геноме встроенного гена, определяющего 100%-ю защиту урожая от колорадского жука без использования каких-либо химических средств.
Первая волна трансгенных растений, допущенных для практического применения, содержала дополнительные гены устойчивости (к болезням, гербицидам, вредителям, порче при хранении, стрессам).
Нынешний этап развития генетической инженерии растений получил название «метаболическая инженерия». При этом ставится задача не столько улучшить те или иные имеющиеся качества растения, как при традиционной селекции, сколько научить растение производить совершенно новые соединения, используемые в медицине, химическом производстве и других областях. Этими соединениями могут быть, например, особые жирные кислоты, полезные белки с высоким содержанием незаменимых аминокислот, модифицированные полисахариды, съедобные вакцины, антитела, интерфероны и другие «лекарственные» белки, новые полимеры, не засоряющие окружающую среду и многое, многое другое. Использование трансгенных растений позволяет наладить масштабное и дешевое производство таких веществ и тем самым сделать их более доступными для широкого потребления.
Генетически модифицированные животные
Клетки животных существенно отличаются от бактериальных по своей способности поглощать чужеродную ДНК, поэтому методы и способы способы введения генов в эмбриональные клетки млекопитающих, мух и рыб остаются в центре внимания генных инженеров.
Наиболее изученное в генетическом отношении млекопитающее – мыши. Первый успех относится к 1980 году, когда Д. Гордон с сотрудниками продемонстрировал возможность введения и интеграции чужеродной ДНК в геном мышей. Интеграция была стабильной и сохранялась у потомства. Трансформацию производят микроинъекцией клонированных генов в один или оба пронуклеуса (ядра) только что эмбриона на стадии одной клетки (зиготы). Чаще выбирают мужской пронуклеус, привнесенный сперматозоидом, так как его размеры больше. После инъекции яйцеклетку немедленно имплантируют в яйцевод приемной матери, или дают возможность развиваться в культуре до стадии бластоцисты, после чего имплантируют в матку.
Таким образом были инъецированы гены интерферона и инсулина человека, ген β-глобина кролика, ген тимидинкиназы вируса простого герпеса и кДНК вируса лейкемии мышей. Число молекул, вводимое за одну инъекцию, колеблется от 100 до 300 000, а их размер – от 5 до 50 кб. Выживает обычно 10 – 30% яйцеклеток, а доля мышей, родившихся из трансформированных яйцеклеток варьирует от нескольких до 40%. Таким образом, реальная эффективность составляет около 10%.
Таким методом получены генно-инженерные крысы, кролики, овцы, свиньи, козы, телята и другие млекопитающие. В нашей стране получены свиньи, несущие ген соматотропина. Они не отличались по темпам роста от нормальных животных, но изменение обмена веществ сказалось на содержании жира. У таких животных ингибировались процессы липогенеза и активировался синтез белка. К изменению обмена веществ приводило и встраивание генов инсулиноподобного фактора. ГМ свиньи были созданы для изучения цепочки биохимических превращений гормона, а побочным эффектом явилось укрепление иммунной системы.
Самая мощная белоксинтезирующая система находится в клетках молочной железы. Если поставить гены чужих белков под контроль казеинового промотора, то экспрессия этих генов будет мощной и стабильной, а белок будет накапливаться в молоке. С помощью животных-биореакторов (трансгенные коровы) уже получено молоко, в котором содержится человеческий белок лактоферрин. Этот белок планируется применять для профилактики гастроэнтерологических заболеваний у людей с низкой иммунорезистентностью: больные СПИДом, недоношенные младенцы, больные раком, прошедшие радиотерапию.
Важное направление трансгеноза – получение устойчивых к болезням животных. Ген интерферона, относящийся к защитным белкам, встраивали различным животным. Трансгенные мыши получили устойчивость – они не болели или болели мало, а вот у свиней такого эффекта не обнаружено.
Применение в научных исследованиях
Нокаут гена (gene knockout) – техника удаления одного или большего количества генов, что позволяет исследовать функции гена. Для получения нокаутных мышей полученную генно-инженерную конструкцию вводят в эмбриональные стволовые клетки, где конструкция подвергается соматической рекомбинации и замещает нормальный ген, а измененные клетки имплантируют в бластоцист суррогатной матери. Сходным способом получают нокаут у растений и микроорганизмов.
Искусственная экспрессия – добавление в организм гена, которого у него ранее не было, также с целями изучения функции генов. Визуализация продуктов генов – используется для изучения локализации продукта гена. Замещение нормального гена на сконструрованный ген, слитый с репортёрным элементом, (например, с геном зелёного флуоресцентного белка) обеспечивает визуализацию продукта генной модификации.
Исследование механизма экспрессии. Небольшой участок ДНК, расположенный перед кодирующей областью (промотор) и служащий для связывания факторов транскрипции, вводят в организм, поставив после него вместо собственного гена репортерный, например, GFP, катализирующий легко обнаруживаемую реакцию. Кроме того, что функционирование промотора в тех или иных тканях в тот или иной момент становится хорошо заметным, такие эксперименты позволяют исследовать структуру промотора, убирая или добавляя к нему фрагменты ДНК, а также искусственно усиливать экспрессию генов.
Биобезопасность генно-инженерной деятельности
Еще в 1975 г. ученые всего мира на Асиломарской конференции подняли важнейший вопрос: не окажет ли появление ГМО потенциально негативного воздействия на биологическое разнообразие? С этого момента одновременно с бурным развитием генной инженерии стало развиваться новое направление — биобезопасность. Главная ее задача — оценить не несет ли использование ГМО нежелательное воздействие на окружающую среду, здоровье человека и животных, а главная цель — открыть путь к использованию достижений современной биотехнологии, гарантируя при этом безопасность.
Стратегия биобезопасности основывается на научном исследовании особенностей ГМО, опыте обращения с ним, а также информации о его предполагаемом использовании и окружающей среде, в которую он будет интродуцирован. Совместными многолетними усилиями международных организаций (ЮНЕП, ВОЗ, ОЭСР), экспертов из разных стран, в т. ч. России, были разработаны базовые понятия и процедуры: биологическая безопасность, биологическая опасность, риск, оценка рисков. Только после того, как полный цикл проверок будет успешно осуществлен, готовится научное заключение о биобезопасности ГМО. В 2005 г. ВОЗ опубликовало доклад, согласно которому употребление зарегистрированных в качестве пищи ГМ растений также безопасно, как их традиционных аналогов.
Как обеспечивается биобезопасность в России? Началом включения России в мировую систему биобезопасности можно считать ратификацию «Конвенции о биоразнообразии» в 1995 году. С этого момента началось формирование национальной системы биобезопасности, отправной точкой которой явилось вступление в силу Федерального закона РФ «О государственном регулировании в области генно-инженерной деятельности» (1996 г.). ФЗ устанавливает основные понятия и принципы государственного регулирования и контроля всех видов работ с ГМО. ФЗ устанавливает уровни риска в зависимости от типа ГМО и вида работ, дает определения замкнутой и открытой систем, выпуска ГМО и т.д.
За прошедшие годы в России сформировалась одна из самых жестких систем регулирования. Неординарен тот факт, что система государственного регулирования ГМО стартовала превентивно, в 1996 году, до того, как реальные генно-инженерные организмы были заявлены для коммерциализации на территории России (первый ГМО – ГМ соя — была зарегистрирована для пищевого использования в 1999г.). Базовыми правовыми инструментами служат государственная регистрация генно-инженерно-модифицированных организмов, а также продукции, полученной из них или их содержащей, предназначенных для использования в качестве пищи и кормов.
Для понимания современной ситуации важен факт, что в течение 25 лет, прошедших с момента первого выхода ГМ растений на рынок, не было выявлено ни одного достоверного отрицательного воздействия их на окружающую среду и здоровье человека и животных ни в ходе испытаний, ни при коммерческом использовании. Только в одном из мировых источников – отчете авторитетного общества AGBIOS «Essential Biosafety» содержится более 1000 ссылок[3] на исследования, доказывающие, что пища и корма, полученные из биотехнологических культур, настолько же безопасны, насколько безопасны и традиционные продукты. Однако на сегодняшний день в России отсутствует нормативно-правовая база, которая позволила бы осуществлять на территории нашей страны выпуск в окружающую среду ГМ растений, а также продукции, полученной из них или их содержащей. Как следствие – на 2010 год ни одно ГМ растение не выращивается на территории Российской Федерации в коммерческих целях.
По прогнозу, согласно Кельнскому Протоколу (2007 г), к 2030 г. отношение к сельскохозяйственным ГМ культурам изменится в сторону одобрения их использования.
Достижения и перспективы развития
Генная инженерия в медицине
Потребности здравоохранения, необходимость решения проблем старения населения формируют устойчивый спрос на генно-инженерные фармпрепараты (с годовым объемом продаж в 26 млрд. долл. США) и лечебно-косметические средства из растительного и животного сырья (с годовым объемом продаж около 40 млрд. долл. США).
Среди многих достижений генной инженерии, получивших применение в медицине, наиболее значительное – получение человеческого инсулина в промышленных масштабах.
В настоящее время по данным ВОЗ в мире насчитывается около 110 млн. людей, страдающих диабетом. Инсулин, инъекции которого показаны больным этим заболеванием, уже давно получают из органов животных и используют в медицинской практике. Однако многолетнее применение животного инсулина ведет к необратимому поражению многих органов пациента из-за иммунологических реакций, вызываемых инъекцией чужеродного человеческому организму животного инсулина. Но даже потребности в животном инсулине до недавнего времени удовлетворялись всего на 60 – 70%. Генные инженеры в качестве первой практической задачи клонировали ген инсулина. Клонированные гены человеческого инсулина были введены с плазмидой в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. Начиная с 1982 года фирмы США, Японии, Великобритании и других стран производят генно-инженерный инсулин. В России получение генно-инженерного человеческого инсулина – Инсурана ведется в Институте биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН. Сегодня отечественный инсулин производится в объеме, достаточном для обеспечения больных диабетом г. Москвы. Вместе с тем, потребность всего российского рынка в генно-инженерном инсулине удовлетворяется, в основном, импортными поставками. Мировой рынок инсулина составляет в настоящее время более 400 млн. долларов, ежегодное потребление около 2500 кг.
Развитие генной инженерии в 80-х годах прошлого столетия обеспечило хороший задел России в создании генно-инженерных штаммов микроорганизмов с заданными свойствами – продуцентов биологически активных веществ, в разработке генно-инженерных методов реконструирования генетического материала вирусов, в получении лекарственных субстанций, в том числе и с использованием компьютерного моделирования. До стадии производства доведены рекомбинантный интерферон и лекарственные формы на его основе медицинского и ветеринарного назначения, интерлейкин (b-лейкин), эритропоэтин. Несмотря на растущий спрос на высокоочищенные препараты, отечественное производство иммуноглобулинов, альбумина, плазмола обеспечивает 20% потребностей внутреннего рынка.
Активно ведутся исследования по разработке вакцин для профилактики и лечения гепатитов, СПИДа и ряда других заболеваний, а также конъюгированных вакцин нового поколения против наиболее социально значимых инфекций. Полимер-субъединичные вакцины нового поколения состоят из высокоочищенных протективных антигенов различной природы и носителя – иммуностимулятора полиоксидония, обеспечивающего повышенный уровень специфического иммунного ответа. Прививки против подавляющего большинства известных инфекций Россия могла бы обеспечить на базе собственного иммунологического производства. Полностью отсутствует только производство вакцины против краснухи.
Генная инженерия для сельского хозяйства
Генетическое улучшение сельскохозяйственных культур и декоративных растений представляет собой длительный и непрерывный процесс с использованием все более точных и предсказуемых технологий. В научном отчете ООН (за 1989 год) сказано следующее: «Поскольку молекулярные методы наиболее точны, те, кто их применяет, в большей степени уверены в том, какими признаками они наделяют растения, и, следовательно, реже получают незапланированные эффекты, чем при использовании обычных методов селекции.»
Преимущества новых технологий уже широко используются в таких странах, как США, Аргентина, Индия, Китай и Бразилия, где генетически модифицированные культуры возделывают на больших территориях.
Новые технологии также имеют большое значение для малоимущих фермеров и жителей бедных стран, особенно женщин и детей. Например, генетически модифицированные, устойчивые к вредителям, хлопчатник и кукуруза требуют применения инсектицидов в значительно меньших объемах (что делает труд на ферме более безопасным). Такие культуры способствуют повышению урожайности, получению фермерами более высоких доходов, снижению уровня бедности и риска отравления населения химическими пестицидами, что особенно характерно для ряда стран, в том числе для Индии, Китая, ЮАР и Филиппин.
Самыми распространенными ГМ растениями являются культуры, устойчивые к недорогим, наименее токсичным и наиболее широко используемым гербицидам. Возделывание таких культур позволяет получать более высокий урожай с гектара, избавиться от изнурительной ручной прополки, тратить меньше средств за счет минимальной или беспахотной обработки земли, что, в свою очередь, приводит к снижению эрозии почвы.
В 2009 году произошла замена генетически модифицированных культур первого поколения продуктами второго поколения, что впервые привело к увеличению урожайности per se. Пример биотехнологической культуры нового класса (над созданием которой работали многие исследователи) – устойчивая к глифосату соя RReady2Yield™ , выращивалась в 2009 году в США и Канаде более чем на 0.5 миллионах га.
Внедрение генной инженерии в современную агробиологию может быть проиллюстрировано следующими фактами из ряда зарубежных экспертных обзоров, в том числе, из ежегодного обзора независимой Международной службы по мониторингу за применением агробиотехнологий (ISAАA), возглавляемой известным в мире экспертом Клайвом Джеймсом (Claiv James): (www.isaaa.org)
В 2009 году в 25 странах мира выращивали ГМ культуры на площади 134 млн. га (что составляет 9% от 1,5 млрд. га всех пахотных земель в мире). Шесть стран ЕС (из 27) возделывали Bt кукурузу, и в 2009 году площади ее посевов достигли более 94 750 га. Анализ мирового экономического эффекта использования биотехнологических культур за период с 1996 по 2008 г.г. показывает рост прибыли в размере 51,9 миллиардов долларов благодаря двум источникам: во-первых, это сокращение производственных затрат (50%) и, во-вторых, значительная прибавка урожая (50%) в размере 167 миллионов тонн.
В 2009 году общая рыночная стоимость семян ГМ культур в мире составила 10.5 миллиардов долларов. Общая стоимость по зерну биотех кукурузы и сои, а также хлопчатника в 2008 году составила 130 млрд. долларов, и ожидается, что ее ежегодный рост составит 10 – 15%.
Подсчитано, что в случае полного принятия биотехнологии, к концу периода 2006 – 2015 г. прибыль всех стран в пересчете на ВВП вырастет на 210 млрд. долл. США в год.
Наблюдения, проводимые с начала применения в сельском хозяйстве устойчивых к гербицидам сельскохозяйственных культур, убедительно доказывают, что фермеры получили возможность более эффективно бороться с сорняками. При этом рыхление и распахивание полей утрачивают свое значение как средства борьбы с сорняками. В итоге снижается расход тракторного топлива, улучшается структура почвы и предотвращается ее эрозия. Целевые инсектицидные программы выращивания Bt хлопчатника предусматривают меньшее число опрыскиваний посевов и, следовательно, меньшее количество выездов техники на поля, что приводит к сокращению эрозии почв. Все это невольно содействует внедрению консервирующей технологии обработки почвы, направленной на снижение почвенной эрозии, уровня углекислого газа и уменьшения потери воды.
Для современного состояния науки характерен комплексный подход, создание единых технологических платформ для проведения широкого спектра исследований. Они объединяют не только биотехнологию, молекулярную биологию и генную инженерию, но также и химию, физику, биоинформатику, транскриптомику, протеомику, метаболомику.
Рекомендуемая литература1. Дж. Уотсон. Молекулярная биология гена. М.: Мир. 1978. 2. Стент Г., Кэлиндар Р. Молекулярная генетика. М.: Мир. 1981 3. С.Н. Щелкунов «Генетическая инженерия». Новосибирск, издательство Сибирского Университета, 2008 4. Глик Б. Молекулярная биотехнология. Принципы и применение / Б. Глик, Дж. Пастернак. М.: Мир, 2002 5. Генная инженерия растений. Лабораторное руководство. Под редакцией Дж. Дрейпера, Р.Скотта, Ф. Армитиджа, Р. Уолдена. М.: «Мир». 1991. 6. Агробиотехнология в мире. Под ред. Скрябина К.Г. М.: Центр «Биоинженерия» РАН, 2008. – 135 с. 7. Кларк. Д., Рассел Л. Молекулярная биология простой и занимательный подход. М.: ЗАО «Компания КОНД». 2004
Ссылки1. «О государственном регулировании генно-инженерной деятельности». ФЗ-86 в ред. 2000 г., ст.1 2. Кельнский Протокол, Cologne Paper, принят на конференции «На пути к Биоэкономике, основанной на знаниях» (Кельн, 30 мая 2007 г.), организованной Европейским Союзом в период президентства Германии в ЕС. 3. http://www.www.essentialbiosafety.info
Источник: энциклопедия Фонда знаний «Ломоносов».
Портал «Вечная молодость» http://vechnayamolodost.ru 27.01.2010
www.vechnayamolodost.ru











