Фенилуксусная кислота. Фенилуксусная кислота в растениях
Фенилуксусная кислота — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Фенилуксусная кислота (α-толуиловая кислота) — блестящие иглы с запахом меда. Хорошо растворима в диэтиловом эфире, этаноле и других органических растворителях, плохо растворима в воде.
Синтез
Большинство синтезов фенилуксусной кислоты исходят из бензилгалогенидов. Фенилуксусная кислота может быть синтезирована гидролизом бензилнитрила, получаемого, в свою очередь взаимодействием бензилбромида с цианидом натрия: [1]
Другой метод синтеза - взаимодействие бензилхлорида с магнием и дальнейшее взаимодействие образовавшегося реактива Гриньяра с углекислотой[2]:
PhCh3Cl + Mg <math>\to</math> PhCh3MgCl PhCh3MgCl + CO2 <math>\to</math> PhCh3COOMgCl PhCh3COOMgCl + h3O <math>\to</math> PhCh3COOH + Mg(OH)ClФенилуксусная кислота также может быть синтезирована карбонилированием бензилового спирта в присутствии родиевых катализаторов[3]
Применение
Фенилуксусную кислоту и её эфиры применяют при составлении парфюмерных композиций и пищевых эссенций (как отдушку восков и меда). Фенилуксусная кислота служит исходным продуктом для синтеза амфетамина, обладающим сильным стимулирующим действием и, вследствие этого, входит в список прекурсоров, подлежащих контролю в РФ[4]. Добавление фенилуксусной кислоты в культуральные среды используется в микробиологическом синтезе бензилпенициллина плесенями Penicillium chrisogenum или Penicillium notatum.
Нахождение в природе
Содержится в растениях (в частности, табаке) и некоторых эфирных маслах. По некоторым данным, фенилуксусная кислота, синтезируемая растениями, может проявлять ауксинподобную активность[5],[6].
У животных фенилуксусная кислота синтезируется из фенилаланина через фенилпировиноградную кислоту, у человека наличие фенилуксусной кислоты в моче и поте при фенилкетонурии, обуславливающее их специфический «мышиный» запах является одним из диагностических признаков.
Напишите отзыв о статье "Фенилуксусная кислота"
Литература
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 147
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 188
Примечания
- ↑ (1963) «Phenylacetic acid». Organic Syntheses 1: 436.
- ↑ [www.sciencedirect.com/science/article/B6TGW-42TC3TP-X/2/ec8833324f7e488537a9d09c1f37b496 Robert A. Benkeser, Alvin E. Trevillyan, Jean M. Mallan, The reaction of the methylbenzylmagnesium halides with carbon dioxide, Journal of Organometallic Chemistry, Volume 2, Issue 4, October 1964, Pages 322-328, ISSN 0022-328X], DOI: 10.1016/S0022-328X(00)82218-4.
- ↑ [www.sciencedirect.com/science/article/B6TGM-40T9H9G-G/2/41b98c636866fd3533ca593585e6dc8b Jiarong Duan, Jing Jiang, Junfang Gong, Qinghua Fan, Dazhi Jiang, Synthesis of phenylacetic acid by carbonylation, Journal of Molecular Catalysis A: Chemical, Volume 159, Issue 1, 22 September 2000, Pages 89-96, ISSN 1381-1169], DOI: 10.1016/S1381-1169(00)00175-8.
- ↑ Постановление Правительства РФ от 30.061998 №681 "Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ" (в редакции 22.01.2010 г.)
- ↑ Wightman, Frank; Lighty, Douglas L. (1982). «Identification of phenylacetic acid as a natural auxin in the shoots of higher plants». Physiologia Plantarum 55: 17. DOI:10.1111/j.1399-3054.1982.tb00278.x.
- ↑ Victoria Leuba; Duane LeTourneau. «Auxin activity of phenylacetic acid in tissue culture». Journal of Plant Growth Regulation 9: 71-76. DOI:10.1007/BF02041944.
Отрывок, характеризующий Фенилуксусная кислота
«И дела нет до моего существования!» подумал князь Андрей в то время, как он прислушивался к ее говору, почему то ожидая и боясь, что она скажет что нибудь про него. – «И опять она! И как нарочно!» думал он. В душе его вдруг поднялась такая неожиданная путаница молодых мыслей и надежд, противоречащих всей его жизни, что он, чувствуя себя не в силах уяснить себе свое состояние, тотчас же заснул.На другой день простившись только с одним графом, не дождавшись выхода дам, князь Андрей поехал домой. Уже было начало июня, когда князь Андрей, возвращаясь домой, въехал опять в ту березовую рощу, в которой этот старый, корявый дуб так странно и памятно поразил его. Бубенчики еще глуше звенели в лесу, чем полтора месяца тому назад; всё было полно, тенисто и густо; и молодые ели, рассыпанные по лесу, не нарушали общей красоты и, подделываясь под общий характер, нежно зеленели пушистыми молодыми побегами. Целый день был жаркий, где то собиралась гроза, но только небольшая тучка брызнула на пыль дороги и на сочные листья. Левая сторона леса была темна, в тени; правая мокрая, глянцовитая блестела на солнце, чуть колыхаясь от ветра. Всё было в цвету; соловьи трещали и перекатывались то близко, то далеко. «Да, здесь, в этом лесу был этот дуб, с которым мы были согласны», подумал князь Андрей. «Да где он», подумал опять князь Андрей, глядя на левую сторону дороги и сам того не зная, не узнавая его, любовался тем дубом, которого он искал. Старый дуб, весь преображенный, раскинувшись шатром сочной, темной зелени, млел, чуть колыхаясь в лучах вечернего солнца. Ни корявых пальцев, ни болячек, ни старого недоверия и горя, – ничего не было видно. Сквозь жесткую, столетнюю кору пробились без сучков сочные, молодые листья, так что верить нельзя было, что этот старик произвел их. «Да, это тот самый дуб», подумал князь Андрей, и на него вдруг нашло беспричинное, весеннее чувство радости и обновления. Все лучшие минуты его жизни вдруг в одно и то же время вспомнились ему. И Аустерлиц с высоким небом, и мертвое, укоризненное лицо жены, и Пьер на пароме, и девочка, взволнованная красотою ночи, и эта ночь, и луна, – и всё это вдруг вспомнилось ему. «Нет, жизнь не кончена в 31 год, вдруг окончательно, беспеременно решил князь Андрей. Мало того, что я знаю всё то, что есть во мне, надо, чтобы и все знали это: и Пьер, и эта девочка, которая хотела улететь в небо, надо, чтобы все знали меня, чтобы не для одного меня шла моя жизнь, чтоб не жили они так независимо от моей жизни, чтоб на всех она отражалась и чтобы все они жили со мною вместе!»
Возвратившись из своей поездки, князь Андрей решился осенью ехать в Петербург и придумал разные причины этого решенья. Целый ряд разумных, логических доводов, почему ему необходимо ехать в Петербург и даже служить, ежеминутно был готов к его услугам. Он даже теперь не понимал, как мог он когда нибудь сомневаться в необходимости принять деятельное участие в жизни, точно так же как месяц тому назад он не понимал, как могла бы ему притти мысль уехать из деревни. Ему казалось ясно, что все его опыты жизни должны были пропасть даром и быть бессмыслицей, ежели бы он не приложил их к делу и не принял опять деятельного участия в жизни. Он даже не понимал того, как на основании таких же бедных разумных доводов прежде очевидно было, что он бы унизился, ежели бы теперь после своих уроков жизни опять бы поверил в возможность приносить пользу и в возможность счастия и любви. Теперь разум подсказывал совсем другое. После этой поездки князь Андрей стал скучать в деревне, прежние занятия не интересовали его, и часто, сидя один в своем кабинете, он вставал, подходил к зеркалу и долго смотрел на свое лицо. Потом он отворачивался и смотрел на портрет покойницы Лизы, которая с взбитыми a la grecque [по гречески] буклями нежно и весело смотрела на него из золотой рамки. Она уже не говорила мужу прежних страшных слов, она просто и весело с любопытством смотрела на него. И князь Андрей, заложив назад руки, долго ходил по комнате, то хмурясь, то улыбаясь, передумывая те неразумные, невыразимые словом, тайные как преступление мысли, связанные с Пьером, с славой, с девушкой на окне, с дубом, с женской красотой и любовью, которые изменили всю его жизнь. И в эти то минуты, когда кто входил к нему, он бывал особенно сух, строго решителен и в особенности неприятно логичен. – Mon cher, [Дорогой мой,] – бывало скажет входя в такую минуту княжна Марья, – Николушке нельзя нынче гулять: очень холодно. – Ежели бы было тепло, – в такие минуты особенно сухо отвечал князь Андрей своей сестре, – то он бы пошел в одной рубашке, а так как холодно, надо надеть на него теплую одежду, которая для этого и выдумана. Вот что следует из того, что холодно, а не то чтобы оставаться дома, когда ребенку нужен воздух, – говорил он с особенной логичностью, как бы наказывая кого то за всю эту тайную, нелогичную, происходившую в нем, внутреннюю работу. Княжна Марья думала в этих случаях о том, как сушит мужчин эта умственная работа.
Князь Андрей приехал в Петербург в августе 1809 года. Это было время апогея славы молодого Сперанского и энергии совершаемых им переворотов. В этом самом августе, государь, ехав в коляске, был вывален, повредил себе ногу, и оставался в Петергофе три недели, видаясь ежедневно и исключительно со Сперанским. В это время готовились не только два столь знаменитые и встревожившие общество указа об уничтожении придворных чинов и об экзаменах на чины коллежских асессоров и статских советников, но и целая государственная конституция, долженствовавшая изменить существующий судебный, административный и финансовый порядок управления России от государственного совета до волостного правления. Теперь осуществлялись и воплощались те неясные, либеральные мечтания, с которыми вступил на престол император Александр, и которые он стремился осуществить с помощью своих помощников Чарторижского, Новосильцева, Кочубея и Строгонова, которых он сам шутя называл comite du salut publique. [комитет общественного спасения.]
wiki-org.ru
Фенилуксусная кислота Википедия
Фенилуксусная кислота (α-толуиловая кислота) — блестящие иглы с запахом меда. Хорошо растворима в диэтиловом эфире, этаноле и других органических растворителях, плохо растворима в воде.
Синтез
Большинство синтезов фенилуксусной кислоты исходят из бензилгалогенидов. Фенилуксусная кислота может быть синтезирована гидролизом бензилнитрила, получаемого, в свою очередь взаимодействием бензилбромида с цианидом натрия: [1]
Другой метод синтеза - взаимодействие бензилхлорида с магнием и дальнейшее взаимодействие образовавшегося реактива Гриньяра с углекислотой[2]:
PhCh3Cl + Mg →{\displaystyle \to } PhCh3MgCl PhCh3MgCl + CO2→{\displaystyle \to } PhCh3COOMgCl PhCh3COOMgCl + h3O →{\displaystyle \to } PhCh3COOH + Mg(OH)ClФенилуксусная кислота также может быть синтезирована карбонилированием бензилового спирта в присутствии родиевых катализаторов[3]
Применение
Фенилуксусную кислоту и её эфиры применяют при составлении парфюмерных композиций и пищевых эссенций (как отдушку восков и меда). Фенилуксусная кислота служит исходным продуктом для синтеза амфетамина, обладающим сильным стимулирующим действием и, вследствие этого, входит в список прекурсоров, подлежащих контролю в РФ[4]. Добавление фенилуксусной кислоты в культуральные среды используется в микробиологическом синтезе бензилпенициллина плесенями Penicillium chrisogenum или Penicillium notatum.
Нахождение в природе
Содержится в растениях (в частности, табаке) и некоторых эфирных маслах. По некоторым данным, фенилуксусная кислота, синтезируемая растениями, может проявлять ауксинподобную активность[5],[6].
У животных фенилуксусная кислота синтезируется из фенилаланина через фенилпировиноградную кислоту, у человека наличие фенилуксусной кислоты в моче и поте при фенилкетонурии, обуславливающее их специфический «мышиный» запах является одним из диагностических признаков.
Литература
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 147
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 188
Примечания
- ↑ (1963) «Phenylacetic acid». Organic Syntheses 1: 436.
- ↑ Robert A. Benkeser, Alvin E. Trevillyan, Jean M. Mallan, The reaction of the methylbenzylmagnesium halides with carbon dioxide, Journal of Organometallic Chemistry, Volume 2, Issue 4, October 1964, Pages 322-328, ISSN 0022-328X, DOI: 10.1016/S0022-328X(00)82218-4.
- ↑ Jiarong Duan, Jing Jiang, Junfang Gong, Qinghua Fan, Dazhi Jiang, Synthesis of phenylacetic acid by carbonylation, Journal of Molecular Catalysis A: Chemical, Volume 159, Issue 1, 22 September 2000, Pages 89-96, ISSN 1381-1169, DOI: 10.1016/S1381-1169(00)00175-8.
- ↑ Постановление Правительства РФ от 30.061998 №681 "Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ" (в редакции 22.01.2010 г.)
- ↑ Wightman, Frank; Lighty, Douglas L. (1982). «Identification of phenylacetic acid as a natural auxin in the shoots of higher plants». Physiologia Plantarum 55: 17. DOI:10.1111/j.1399-3054.1982.tb00278.x.
- ↑ Victoria Leuba; Duane LeTourneau. «Auxin activity of phenylacetic acid in tissue culture». Journal of Plant Growth Regulation 9: 71-76. DOI:10.1007/BF02041944.
wikiredia.ru
 Опубликовать Опубликовать | скачать Реферат на тему: План:
ВведениеФенилуксусная кислота (α-толуиловая кислота) — блестящие иглы с запахом меда. Хорошо растворима в диэтиловом эфире, этаноле и других органических растворителях, плохо растворима в воде. 1. СинтезБольшинство синтезов фенилуксусной кислоты исходят из бензилгалогенидов. Фенилуксусная кислота может быть синтезирована гидролизом бензилнитрила, получаемого, в свою очередь взаимодействием бензилхлорида с цианидом натрия: [1] Другой метод синтеза - взаимодействие бензилхлорида с магнием и дальнейшее взаимодействие образовавшегося реактива Гриньяра с углекислотой[2]: PhCh3Cl + Mg PhCh3MgCl PhCh3MgCl + CO2 PhCh3COOMgCl PhCh3COOMgCl + h3O PhCh3COOH + Mg(OH)ClФенилуксусная кислота также может быть синтезирована карбонилированием бензилового спирта в присутствии родиевых катализаторов[3] 2. ПрименениеФенилуксусную кислоту и ее эфиры применяют при составлении парфюмерных композиций и пищевых эссенций (как отдушку восков и меда). Фенилуксусная кислота служит исходным продуктом для синтеза фенамина, обладающим сильным стимулирующим действием и, вследствие этого, входит в список прекурсоров, подлежащих контролю в РФ[4]. Добавление фенилуксусной кислоты в культуральные среды используется в микробиологическом синтезе бензилпенициллина плесенями Penicillium chrisogenum или Penicillium notatum. 3. Нахождение в природеСодержится в растениях (в частности, табаке) и некоторых эфирных маслах. По некоторым данным, фенилуксусная кислота, синтезируемая растениями, может проявлять ауксинподобную активность[5],[6]. У животных фенилуксусная кислота синтезируется из фенилаланина через фенилпировиноградную кислоту, у человека наличие фенилуксусной кислоты в моче и поте при фенилкетонурии, обуславливающее их специфический «мышиный» запах является одним из диагностических признаков. Литература
Примечания
Категории: Карбоновые кислоты. Текст доступен по лицензии Creative Commons Attribution-ShareAlike. |
wreferat.baza-referat.ru
Фенилуксусная кислота - это... Что такое Фенилуксусная кислота?
Фенилуксусная кислота (α-толуиловая кислота) — блестящие иглы с запахом меда.
Хорошо растворима в диэтиловом эфире, этаноле и других органических растворителях, плохо растворима в воде.Синтез
Большинство синтезов фенилуксусной кислоты исходят из бензилгалогенидов. Фенилуксусная кислота может быть синтезирована гидролизом бензилнитрила, получаемого, в свою очередь взаимодействием бензилхлорида с цианидом натрия: [1]
Другой метод синтеза - взаимодействие бензилхлорида с магнием и дальнейшее взаимодействие образовавшегося реактива Гриньяра с углекислотой[2]:
PhCh3Cl + Mg PhCh3MgCl PhCh3MgCl + CO2 PhCh3COOMgCl PhCh3COOMgCl + h3O PhCh3COOH + Mg(OH)ClФенилуксусная кислота также может быть синтезирована карбонилированием бензилового спирта в присутствии родиевых катализаторов[3]
Применение
Фенилуксусную кислоту и ее эфиры применяют при составлении парфюмерных композиций и пищевых эссенций (как отдушку восков и меда). Фенилуксусная кислота служит исходным продуктом для синтеза фенамина, обладающим сильным стимулирующим действием и, вследствие этого, входит в список прекурсоров, подлежащих контролю в РФ[4]. Добавление фенилуксусной кислоты в культуральные среды используется в микробиологическом синтезе бензилпенициллина плесенями Penicillium chrisogenum или Penicillium notatum.
Нахождение в природе
Содержится в растениях (в частности, табаке) и некоторых эфирных маслах. По некоторым данным, фенилуксусная кислота, синтезируемая растениями, может проявлять ауксинподобную активность[5],[6].
У животных фенилуксусная кислота синтезируется из фенилаланина через фенилпировиноградную кислоту, у человека наличие фенилуксусной кислоты в моче и поте при фенилкетонурии, обуславливающее их специфический «мышиный» запах является одним из диагностических признаков.
Литература
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 147
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 188
Примечания
- ↑ (1963) «Phenylacetic acid». Organic Syntheses 1: 436.
- ↑ Robert A. Benkeser, Alvin E. Trevillyan, Jean M. Mallan, The reaction of the methylbenzylmagnesium halides with carbon dioxide, Journal of Organometallic Chemistry, Volume 2, Issue 4, October 1964, Pages 322-328, ISSN 0022-328X, DOI: 10.1016/S0022-328X(00)82218-4.
- ↑ Jiarong Duan, Jing Jiang, Junfang Gong, Qinghua Fan, Dazhi Jiang, Synthesis of phenylacetic acid by carbonylation, Journal of Molecular Catalysis A: Chemical, Volume 159, Issue 1, 22 September 2000, Pages 89-96, ISSN 1381-1169, DOI: 10.1016/S1381-1169(00)00175-8.
- ↑ Постановление Правительства РФ от 30.061998 №681 "Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ" (в редакции 22.01.2010 г.)
- ↑ Wightman, Frank; Lighty, Douglas L. (1982). «Identification of phenylacetic acid as a natural auxin in the shoots of higher plants». Physiologia Plantarum 55: 17. DOI:10.1111/j.1399-3054.1982.tb00278.x.
- ↑ Victoria Leuba; Duane LeTourneau. «Auxin activity of phenylacetic acid in tissue culture». Journal of Plant Growth Regulation 9: 71-76. DOI:10.1007/BF02041944.
dic.academic.ru
Фенилуксусная кислота - WikiVisually
1. Химическая формула – These are limited to a single typographic line of symbols, which may include subscripts and superscripts. A chemical formula is not a name, and it contains no words. Although a chemical formula may imply certain simple chemical structures, it is not the same as a full chemical structural formula. Chemical formulas can fully specify the structure of only the simplest of molecules and chemical substances, the simplest types of chemical formulas are called empirical formulas, which use letters and numbers indicating the numerical proportions of atoms of each type. Molecular formulas indicate the numbers of each type of atom in a molecule. For example, the formula for glucose is Ch3O, while its molecular formula is C6h22O6. This is possible if the relevant bonding is easy to show in one dimension, an example is the condensed molecular/chemical formula for ethanol, which is Ch4-Ch3-OH or Ch4Ch3OH. For reasons of structural complexity, there is no condensed chemical formula that specifies glucose, chemical formulas may be used in chemical equations to describe chemical reactions and other chemical transformations, such as the dissolving of ionic compounds into solution. A chemical formula identifies each constituent element by its chemical symbol, in empirical formulas, these proportions begin with a key element and then assign numbers of atoms of the other elements in the compound, as ratios to the key element. For molecular compounds, these numbers can all be expressed as whole numbers. For example, the formula of ethanol may be written C2H6O because the molecules of ethanol all contain two carbon atoms, six hydrogen atoms, and one oxygen atom. Some types of compounds, however, cannot be written with entirely whole-number empirical formulas. An example is boron carbide, whose formula of CBn is a variable non-whole number ratio with n ranging from over 4 to more than 6.5. When the chemical compound of the consists of simple molecules. These types of formulas are known as molecular formulas and condensed formulas. A molecular formula enumerates the number of atoms to reflect those in the molecule, so that the formula for glucose is C6h22O6 rather than the glucose empirical formula. However, except for very simple substances, molecular chemical formulas lack needed structural information, for simple molecules, a condensed formula is a type of chemical formula that may fully imply a correct structural formula. For example, ethanol may be represented by the chemical formula Ch4Ch3OH
2. Плотность – The density, or more precisely, the volumetric mass density, of a substance is its mass per unit volume. The symbol most often used for density is ρ, although the Latin letter D can also be used. Mathematically, density is defined as mass divided by volume, ρ = m V, where ρ is the density, m is the mass, and V is the volume. In some cases, density is defined as its weight per unit volume. For a pure substance the density has the numerical value as its mass concentration. Different materials usually have different densities, and density may be relevant to buoyancy, purity, osmium and iridium are the densest known elements at standard conditions for temperature and pressure but certain chemical compounds may be denser. Thus a relative density less than one means that the floats in water. The density of a material varies with temperature and pressure and this variation is typically small for solids and liquids but much greater for gases. Increasing the pressure on an object decreases the volume of the object, increasing the temperature of a substance decreases its density by increasing its volume. In most materials, heating the bottom of a results in convection of the heat from the bottom to the top. This causes it to rise relative to more dense unheated material, the reciprocal of the density of a substance is occasionally called its specific volume, a term sometimes used in thermodynamics. Density is a property in that increasing the amount of a substance does not increase its density. Archimedes knew that the irregularly shaped wreath could be crushed into a cube whose volume could be calculated easily and compared with the mass, upon this discovery, he leapt from his bath and ran naked through the streets shouting, Eureka. As a result, the term eureka entered common parlance and is used today to indicate a moment of enlightenment, the story first appeared in written form in Vitruvius books of architecture, two centuries after it supposedly took place. Some scholars have doubted the accuracy of this tale, saying among other things that the method would have required precise measurements that would have been difficult to make at the time, from the equation for density, mass density has units of mass divided by volume. As there are units of mass and volume covering many different magnitudes there are a large number of units for mass density in use. The SI unit of kilogram per metre and the cgs unit of gram per cubic centimetre are probably the most commonly used units for density.1,000 kg/m3 equals 1 g/cm3. In industry, other larger or smaller units of mass and or volume are often more practical, see below for a list of some of the most common units of density
3. Температура плавления – The melting point of a solid is the temperature at which it changes state from solid to liquid at atmospheric pressure. At the melting point the solid and liquid phase exist in equilibrium, the melting point of a substance depends on pressure and is usually specified at standard pressure. When considered as the temperature of the change from liquid to solid. Because of the ability of some substances to supercool, the point is not considered as a characteristic property of a substance. For most substances, melting and freezing points are approximately equal, for example, the melting point and freezing point of mercury is 234.32 kelvins. However, certain substances possess differing solid-liquid transition temperatures, for example, agar melts at 85 °C and solidifies from 31 °C to 40 °C, such direction dependence is known as hysteresis. The melting point of ice at 1 atmosphere of pressure is close to 0 °C. In the presence of nucleating substances the freezing point of water is the same as the melting point, the chemical element with the highest melting point is tungsten, at 3687 K, this property makes tungsten excellent for use as filaments in light bulbs. Many laboratory techniques exist for the determination of melting points, a Kofler bench is a metal strip with a temperature gradient. Any substance can be placed on a section of the strip revealing its thermal behaviour at the temperature at that point, differential scanning calorimetry gives information on melting point together with its enthalpy of fusion. A basic melting point apparatus for the analysis of crystalline solids consists of an oil bath with a transparent window, the several grains of a solid are placed in a thin glass tube and partially immersed in the oil bath. The oil bath is heated and with the aid of the melting of the individual crystals at a certain temperature can be observed. In large/small devices, the sample is placed in a heating block, the measurement can also be made continuously with an operating process. For instance, oil refineries measure the point of diesel fuel online, meaning that the sample is taken from the process. This allows for more frequent measurements as the sample does not have to be manually collected, for refractory materials the extremely high melting point may be determined by heating the material in a black body furnace and measuring the black-body temperature with an optical pyrometer. For the highest melting materials, this may require extrapolation by several hundred degrees, the spectral radiance from an incandescent body is known to be a function of its temperature. An optical pyrometer matches the radiance of a body under study to the radiance of a source that has been previously calibrated as a function of temperature, in this way, the measurement of the absolute magnitude of the intensity of radiation is unnecessary. However, known temperatures must be used to determine the calibration of the pyrometer, for temperatures above the calibration range of the source, an extrapolation technique must be employed
4. Температура кипения – The boiling point of a substance is the temperature at which the vapor pressure of the liquid equals the pressure surrounding the liquid and the liquid changes into a vapor. The boiling point of a liquid varies depending upon the environmental pressure. A liquid in a vacuum has a lower boiling point than when that liquid is at atmospheric pressure. A liquid at high pressure has a boiling point than when that liquid is at atmospheric pressure. For a given pressure, different liquids boil at different temperatures, for example, water boils at 100 °C at sea level, but at 93.4 °C at 2,000 metres altitude. The normal boiling point of a liquid is the case in which the vapor pressure of the liquid equals the defined atmospheric pressure at sea level,1 atmosphere. At that temperature, the pressure of the liquid becomes sufficient to overcome atmospheric pressure. The standard boiling point has been defined by IUPAC since 1982 as the temperature at which boiling occurs under a pressure of 1 bar, the heat of vaporization is the energy required to transform a given quantity of a substance from a liquid into a gas at a given pressure. Liquids may change to a vapor at temperatures below their boiling points through the process of evaporation, evaporation is a surface phenomenon in which molecules located near the liquids edge, not contained by enough liquid pressure on that side, escape into the surroundings as vapor. On the other hand, boiling is a process in which molecules anywhere in the liquid escape, a saturated liquid contains as much thermal energy as it can without boiling. The saturation temperature is the temperature for a corresponding saturation pressure at which a liquid boils into its vapor phase, the liquid can be said to be saturated with thermal energy. Any addition of energy results in a phase transition. If the pressure in a system remains constant, a vapor at saturation temperature will begin to condense into its liquid phase as thermal energy is removed, similarly, a liquid at saturation temperature and pressure will boil into its vapor phase as additional thermal energy is applied. The boiling point corresponds to the temperature at which the pressure of the liquid equals the surrounding environmental pressure. Thus, the point is dependent on the pressure. Boiling points may be published with respect to the NIST, USA standard pressure of 101.325 kPa, at higher elevations, where the atmospheric pressure is much lower, the boiling point is also lower. The boiling point increases with increased pressure up to the critical point, the boiling point cannot be increased beyond the critical point. Likewise, the point decreases with decreasing pressure until the triple point is reached
5. SMILES – The simplified molecular-input line-entry system is a specification in form of a line notation for describing the structure of chemical species using short ASCII strings. SMILES strings can be imported by most molecule editors for conversion back into two-dimensional drawings or three-dimensional models of the molecules, the original SMILES specification was initiated in the 1980s. It has since modified and extended. In 2007, a standard called OpenSMILES was developed in the open-source chemistry community. Other linear notations include the Wiswesser Line Notation, ROSDAL and SLN, the original SMILES specification was initiated by David Weininger at the USEPA Mid-Continent Ecology Division Laboratory in Duluth in the 1980s. The Environmental Protection Agency funded the project to develop SMILES. It has since modified and extended by others, most notably by Daylight Chemical Information Systems. In 2007, a standard called OpenSMILES was developed by the Blue Obelisk open-source chemistry community. Other linear notations include the Wiswesser Line Notation, ROSDAL and SLN, in July 2006, the IUPAC introduced the InChI as a standard for formula representation. SMILES is generally considered to have the advantage of being slightly more human-readable than InChI, the term SMILES refers to a line notation for encoding molecular structures and specific instances should strictly be called SMILES strings. However, the term SMILES is also used to refer to both a single SMILES string and a number of SMILES strings, the exact meaning is usually apparent from the context. The terms canonical and isomeric can lead to confusion when applied to SMILES. The terms describe different attributes of SMILES strings and are not mutually exclusive, typically, a number of equally valid SMILES strings can be written for a molecule. For example, CCO, OCC and CC all specify the structure of ethanol, algorithms have been developed to generate the same SMILES string for a given molecule, of the many possible strings, these algorithms choose only one of them. This SMILES is unique for each structure, although dependent on the algorithm used to generate it. These algorithms first convert the SMILES to a representation of the molecular structure. A common application of canonical SMILES is indexing and ensuring uniqueness of molecules in a database, there is currently no systematic comparison across commercial software to test if such flaws exist in those packages. SMILES notation allows the specification of configuration at tetrahedral centers, and these are structural features that cannot be specified by connectivity alone and SMILES which encode this information are termed isomeric SMILES
6. International Chemical Identifier – Initially developed by IUPAC and NIST from 2000 to 2005, the format and algorithms are non-proprietary. The continuing development of the standard has supported since 2010 by the not-for-profit InChI Trust. The current version is 1.04 and was released in September 2011, prior to 1.04, the software was freely available under the open source LGPL license, but it now uses a custom license called IUPAC-InChI Trust License. Not all layers have to be provided, for instance, the layer can be omitted if that type of information is not relevant to the particular application. InChIs can thus be seen as akin to a general and extremely formalized version of IUPAC names and they can express more information than the simpler SMILES notation and differ in that every structure has a unique InChI string, which is important in database applications. Information about the 3-dimensional coordinates of atoms is not represented in InChI, the InChI algorithm converts input structural information into a unique InChI identifier in a three-step process, normalization, canonicalization, and serialization. The InChIKey, sometimes referred to as a hashed InChI, is a fixed length condensed digital representation of the InChI that is not human-understandable. The InChIKey specification was released in September 2007 in order to facilitate web searches for chemical compounds and it should be noted that, unlike the InChI, the InChIKey is not unique, though collisions can be calculated to be very rare, they happen. In January 2009 the final 1.02 version of the InChI software was released and this provided a means to generate so called standard InChI, which does not allow for user selectable options in dealing with the stereochemistry and tautomeric layers of the InChI string. The standard InChIKey is then the hashed version of the standard InChI string, the standard InChI will simplify comparison of InChI strings and keys generated by different groups, and subsequently accessed via diverse sources such as databases and web resources. Every InChI starts with the string InChI= followed by the version number and this is followed by the letter S for standard InChIs. The remaining information is structured as a sequence of layers and sub-layers, the layers and sub-layers are separated by the delimiter / and start with a characteristic prefix letter. The six layers with important sublayers are, Main layer Chemical formula and this is the only sublayer that must occur in every InChI. The atoms in the formula are numbered in sequence, this sublayer describes which atoms are connected by bonds to which other ones. Describes how many hydrogen atoms are connected to each of the other atoms, the condensed,27 character standard InChIKey is a hashed version of the full standard InChI, designed to allow for easy web searches of chemical compounds. Most chemical structures on the Web up to 2007 have been represented as GIF files, the full InChI turned out to be too lengthy for easy searching, and therefore the InChIKey was developed. With all databases currently having below 50 million structures, such duplication appears unlikely at present, a recent study more extensively studies the collision rate finding that the experimental collision rate is in agreement with the theoretical expectations. Example, Morphine has the structure shown on the right, as the InChI cannot be reconstructed from the InChIKey, an InChIKey always needs to be linked to the original InChI to get back to the original structure
7. ChemSpider – ChemSpider is a database of chemicals. ChemSpider is owned by the Royal Society of Chemistry, the database contains information on more than 50 million molecules from over 500 data sources including, Each chemical is given a unique identifier, which forms part of a corresponding URL. This is an approach to develop an online chemistry database. The search can be used to widen or restrict already found results, structure searching on mobile devices can be done using free apps for iOS and for the Android. The ChemSpider database has been used in combination with text mining as the basis of document markup. The result is a system between chemistry documents and information look-up via ChemSpider into over 150 data sources. ChemSpider was acquired by the Royal Society of Chemistry in May,2009, prior to the acquisition by RSC, ChemSpider was controlled by a private corporation, ChemZoo Inc. The system was first launched in March 2007 in a release form. ChemSpider has expanded the generic support of a database to include support of the Wikipedia chemical structure collection via their WiChempedia implementation. A number of services are available online. SyntheticPages is an interactive database of synthetic chemistry procedures operated by the Royal Society of Chemistry. Users submit synthetic procedures which they have conducted themselves for publication on the site and these procedures may be original works, but they are more often based on literature reactions. Citations to the published procedure are made where appropriate. They are checked by an editor before posting. The pages do not undergo formal peer-review like a journal article. The comments are moderated by scientific editors. The intention is to collect practical experience of how to conduct useful chemical synthesis in the lab, while experimental methods published in an ordinary academic journal are listed formally and concisely, the procedures in ChemSpider SyntheticPages are given with more practical detail. Comments by submitters are included as well, other publications with comparable amounts of detail include Organic Syntheses and Inorganic Syntheses
8. Бензилхлорид – Benzyl chloride, or α-chlorotoluene, is an organic compound with the formula C6H5Ch3Cl. This colourless liquid is an organochlorine compound that is a widely used chemical building block. The reaction proceeds by the free radical process, involving the intermediacy of free chlorine atoms, side products of the reaction include benzal chloride and benzotrichloride. Other methods of production exist, such as the Blanc chloromethylation of benzene, benzyl chloride was first prepared from treatment of benzyl alcohol with hydrochloric acid. Industrially, benzyl chloride is the precursor to benzyl esters which are used as plasticizers, flavorants, phenylacetic acid, a precursor to pharmaceuticals, is produced from benzyl cyanide, which is generated by treatment of benzyl chloride with sodium cyanide. Quaternary ammonium salts, used as surfactants, are formed by alkylation of tertiary amines with benzyl chloride. Benzyl chloride also reacts readily with magnesium to produce a Grignard Reagent. It is preferable over benzyl bromide for the preparation of this reagent, since the reaction of the bromide with magnesium tends to form the Wurtz-coupling product 1, benzyl chloride is an alkylating agent. Indicative of its reactivity, benzyl chloride reacts with water in a hydrolysis reaction to form benzyl alcohol. Since benzyl chloride is volatile at room temperature. In contact with mucous membranes, hydrolysis produces hydrochloric acid, thus, benzyl chloride is a lachrymator and has been used in chemical warfare. It is also irritating to the skin. It is classified as a hazardous substance in the United States as defined in Section 302 of the U. S. Emergency Planning and Community Right-to-Know Act, and is subject to reporting requirements by facilities which produce, store
9. Бензиловый спирт – Benzyl alcohol is an aromatic alcohol with the formula C6H5Ch3OH. The benzyl group is often abbreviated Bn, thus benzyl alcohol is denoted as BnOH, Benzyl alcohol is a colorless liquid with a mild pleasant aromatic odor. It is a useful solvent due to its polarity, low toxicity, Benzyl alcohol has moderate solubility in water and miscible in alcohols and diethyl ether. The anion produced by deprotonation of the group is known as benzylate or benzyloxide. Benzyl alcohol is produced naturally by plants and is commonly found in fruits. It is also found in a variety of oils including jasmine, hyacinth. It is also found in castoreum from the castor sacs of beavers, like most alcohols, it reacts with carboxylic acids to form esters. In organic synthesis, benzyl esters are popular protecting groups because they can be removed by mild hydrogenolysis, Benzyl alcohol reacts with acrylonitrile to give N-benzylacrylamide. This is an example of a Ritter reaction, C6H5Ch3OH + NCCHCh3 → C6H5Ch3NCCHCh3 Benzyl alcohol is used as a solvent for inks, waxes, shellacs, paints, lacquers. Thus it can be used in paint strippers, especially combined with compatible viscosity enhancers to encourage the mixture to cling to painted surfaces. It is a precursor to a variety of esters, used in the soap, perfume and it is also used in e-liquid for e-cigarettes to enhance the flavors used. When applied to damaged skin or mucous membranes at a 10% concentration it acts as an anesthetic and antimicrobial agent. As a dye solvent, it enhances the process of dying wool, nylon and it also has use as a photographic developer, and as an insect repellent. Benzyl alcohol has been used as a solvent for the dielectrophoretic reconfiguration of nanowires. Benzyl alcohol is used as a bacteriostatic preservative at low concentration in intravenous medications, cosmetics, the use of benzyl alcohol as a 5% solution has been approved by the U. S. FDA for the treatment of head lice in children older than 6 months and in adults. It affects the louses spiracles, preventing them from closing and these then become clogged with water or mineral oil or other matter and cause the insect to die from asphyxiation. Benzyl alcohol is used effectively for treating lice infestations as the ingredient in lotion shampoo with 5% benzyl alcohol. Benzyl alcohol has nearly the same refraction index as quartz and wool fiber, if a clear quartz object is immersed in benzyl alcohol, it becomes almost invisible
10. Плесневые грибы – A mold or mould is a fungus that grows in the form of multicellular filaments called hyphae. In contrast, fungi that can adopt a single-celled growth habit are called yeasts, molds are a large and taxonomically diverse number of fungal species in which the growth of hyphae results in discoloration and a fuzzy appearance, especially on food. The network of these tubular branching hyphae, called a mycelium, is considered a single organism, the hyphae are generally transparent, so the mycelium appears like very fine, fluffy white threads over the surface. Cross-walls may delimit connected compartments along the hyphae, each containing one or multiple, the dusty texture of many molds is caused by profuse production of asexual spores formed by differentiation at the ends of hyphae. The mode of formation and shape of spores is traditionally used to classify molds. Many of these spores are colored, making the much more obvious to the human eye at this stage in its life-cycle. Molds are considered to be microbes and do not form a taxonomic or phylogenetic grouping. In the past, most molds were classified within the Deuteromycota, molds cause biodegradation of natural materials, which can be unwanted when it becomes food spoilage or damage to property. They also play important roles in biotechnology and food science in the production of foods, beverages, antibiotics, pharmaceuticals. There are thousands of species of molds, which have diverse life-styles including saprotrophs, mesophiles, psychrophiles and thermophiles. They all require moisture for growth and some live in aquatic environments, like all fungi, molds derive energy not through photosynthesis but from the organic matter on which they live, utilising heterotrophy. Typically, molds secrete hydrolytic enzymes, mainly from the hyphal tips and these enzymes degrade complex biopolymers such as starch, cellulose and lignin into simpler substances which can be absorbed by the hyphae. In this way molds play a role in causing decomposition of organic material. Many molds also synthesise mycotoxins and siderophores which, together with lytic enzymes, molds can also grow on stored food for animals and humans, making the food unpalatable or toxic and are thus a major source of food losses and illness. Many strategies for food preservation are to prevent or slow growth as well as growth of other microbes. Molds reproduce by producing large numbers of spores, which may contain a single nucleus or be multinucleate. Mold spores can be asexual or sexual, many species can produce both types, other mold spores have slimy sheaths and are more suited to water dispersal. Mold spores are spherical or ovoid single cells, but can be multicellular
wikivisually.com
Фенилуксусная кислота
Фенилуксусная кислота (α-толуиловая кислота) — блестящие иглы с запахом меда. Хорошо растворима в диэтиловом эфире, этаноле и других органических растворителях, плохо растворима в воде.Содержание
- 1 Синтез
- 2 Применение
- 3 Нахождение в природе
- 4 Литература
- 5 Примечания
Синтез
Большинство синтезов фенилуксусной кислоты исходят из бензилгалогенидов. Фенилуксусная кислота может быть синтезирована гидролизом бензилнитрила, получаемого, в свою очередь взаимодействием бензилбромида с цианидом натрия:
Другой метод синтеза - взаимодействие бензилхлорида с магнием и дальнейшее взаимодействие образовавшегося реактива Гриньяра с углекислотой:
PhCh3Cl + Mg → {\displaystyle \to } PhCh3MgCl PhCh3MgCl + CO2 → {\displaystyle \to } PhCh3COOMgCl PhCh3COOMgCl + h3O → {\displaystyle \to } PhCh3COOH + Mg(OH)ClФенилуксусная кислота также может быть синтезирована карбонилированием бензилового спирта в присутствии родиевых катализаторов
Применение
Фенилуксусную кислоту и её эфиры применяют при составлении парфюмерных композиций и пищевых эссенций (как отдушку восков и меда). Фенилуксусная кислота служит исходным продуктом для синтеза фенамина, обладающим сильным стимулирующим действием и, вследствие этого, входит в список прекурсоров, подлежащих контролю в РФ. Добавление фенилуксусной кислоты в культуральные среды используется в микробиологическом синтезе бензилпенициллина плесенями Penicillium chrisogenum или Penicillium notatum.
Нахождение в природе
Содержится в растениях (в частности, табаке) и некоторых эфирных маслах. По некоторым данным, фенилуксусная кислота, синтезируемая растениями, может проявлять ауксинподобную активность,.
У животных фенилуксусная кислота синтезируется из фенилаланина через фенилпировиноградную кислоту, у человека наличие фенилуксусной кислоты в моче и поте при фенилкетонурии, обуславливающее их специфический «мышиный» запах является одним из диагностических признаков.
Литература
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 147
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 188
Примечания
- ↑ (1963) «Phenylacetic acid». Organic Syntheses 1: 436.
- ↑ Robert A. Benkeser, Alvin E. Trevillyan, Jean M. Mallan, The reaction of the methylbenzylmagnesium halides with carbon dioxide, Journal of Organometallic Chemistry, Volume 2, Issue 4, October 1964, Pages 322-328, ISSN 0022-328X, DOI: 10.1016/S0022-328X(00)82218-4.
- ↑ Jiarong Duan, Jing Jiang, Junfang Gong, Qinghua Fan, Dazhi Jiang, Synthesis of phenylacetic acid by carbonylation, Journal of Molecular Catalysis A: Chemical, Volume 159, Issue 1, 22 September 2000, Pages 89-96, ISSN 1381-1169, DOI: 10.1016/S1381-1169(00)00175-8.
- ↑ Постановление Правительства РФ от 30.061998 №681 "Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ" (в редакции 22.01.2010 г.)
- ↑ Wightman, Frank; Lighty, Douglas L. (1982). «Identification of phenylacetic acid as a natural auxin in the shoots of higher plants». Physiologia Plantarum 55: 17. DOI:10.1111/j.1399-3054.1982.tb00278.x.
- ↑ Victoria Leuba; Duane LeTourneau. «Auxin activity of phenylacetic acid in tissue culture». Journal of Plant Growth Regulation 9: 71-76. DOI:10.1007/BF02041944.
Фенилуксусная кислота Информация о
 Фенилуксусная кислотаФенилуксусная кислота
Фенилуксусная кислотаФенилуксусная кислота Фенилуксусная кислота Информация Видео
Фенилуксусная кислота Просмотр темы.Фенилуксусная кислота что, Фенилуксусная кислота кто, Фенилуксусная кислота объяснение
There are excerpts from wikipedia on this article and video
www.turkaramamotoru.com
Фенилуксусная кислота — Википедия
Материал из Википедии — свободной энциклопедии
Фенилуксусная кислота (α-толуиловая кислота) — блестящие иглы с запахом меда. Хорошо растворима в диэтиловом эфире, этаноле и других органических растворителях, плохо растворима в воде.
Синтез
Большинство синтезов фенилуксусной кислоты исходят из бензилгалогенидов. Фенилуксусная кислота может быть синтезирована гидролизом бензилнитрила, получаемого, в свою очередь взаимодействием бензилбромида с цианидом натрия: [1]
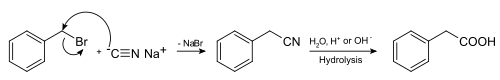
Другой метод синтеза - взаимодействие бензилхлорида с магнием и дальнейшее взаимодействие образовавшегося реактива Гриньяра с углекислотой[2]:
PhCh3Cl + Mg →{\displaystyle \to } PhCh3MgCl PhCh3MgCl + CO2→{\displaystyle \to } PhCh3COOMgCl PhCh3COOMgCl + h3O →{\displaystyle \to } PhCh3COOH + Mg(OH)ClФенилуксусная кислота также может быть синтезирована карбонилированием бензилового спирта в присутствии родиевых катализаторов[3]
Видео по теме
Применение
Фенилуксусную кислоту и её эфиры применяют при составлении парфюмерных композиций и пищевых эссенций (как отдушку восков и меда). Фенилуксусная кислота служит исходным продуктом для синтеза амфетамина, обладающим сильным стимулирующим действием и, вследствие этого, входит в список прекурсоров, подлежащих контролю в РФ[4]. Добавление фенилуксусной кислоты в культуральные среды используется в микробиологическом синтезе бензилпенициллина плесенями Penicillium chrisogenum или Penicillium notatum.
Нахождение в природе
Содержится в растениях (в частности, табаке) и некоторых эфирных маслах. По некоторым данным, фенилуксусная кислота, синтезируемая растениями, может проявлять ауксинподобную активность[5],[6].
У животных фенилуксусная кислота синтезируется из фенилаланина через фенилпировиноградную кислоту, у человека наличие фенилуксусной кислоты в моче и поте при фенилкетонурии, обуславливающее их специфический «мышиный» запах является одним из диагностических признаков.
Литература
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 147
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 188
Примечания
- ↑ (1963) «Phenylacetic acid». Organic Syntheses 1: 436.
- ↑ Robert A. Benkeser, Alvin E. Trevillyan, Jean M. Mallan, The reaction of the methylbenzylmagnesium halides with carbon dioxide, Journal of Organometallic Chemistry, Volume 2, Issue 4, October 1964, Pages 322-328, ISSN 0022-328X, DOI: 10.1016/S0022-328X(00)82218-4.
- ↑ Jiarong Duan, Jing Jiang, Junfang Gong, Qinghua Fan, Dazhi Jiang, Synthesis of phenylacetic acid by carbonylation, Journal of Molecular Catalysis A: Chemical, Volume 159, Issue 1, 22 September 2000, Pages 89-96, ISSN 1381-1169, DOI: 10.1016/S1381-1169(00)00175-8.
- ↑ Постановление Правительства РФ от 30.061998 №681 "Об утверждении Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в РФ" (в редакции 22.01.2010 г.)
- ↑ Wightman, Frank; Lighty, Douglas L. (1982). «Identification of phenylacetic acid as a natural auxin in the shoots of higher plants». Physiologia Plantarum 55: 17. DOI:10.1111/j.1399-3054.1982.tb00278.x.
- ↑ Victoria Leuba; Duane LeTourneau. «Auxin activity of phenylacetic acid in tissue culture». Journal of Plant Growth Regulation 9: 71-76. DOI:10.1007/BF02041944.
wikipedia.green











