Стволовые клетки растений и их влияние на кожу. Стволовые клетки растений википедия
Эмбриональные стволовые клетки — Википедия
 | Данные в этой статье приведены по состоянию на 2010. Вы можете помочь, обновив информацию в статье. |
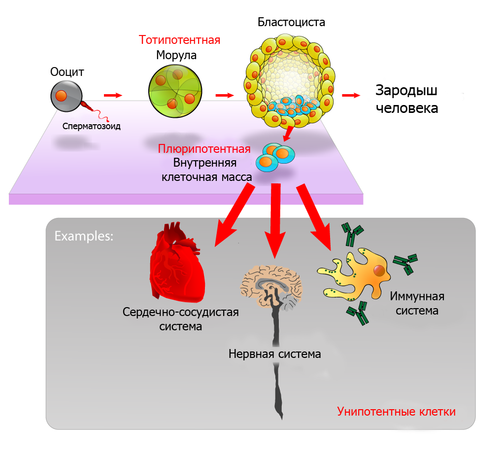
Эмбриональные стволовые клетки (ЭСК) — тип плюрипотентных клеток млекопитающих, поддерживаемых в культуре, которые получают из внутренней клеточной массы бластоцисты на ранней стадии развития эмбриона[1]. Эмбрион человека достигает стадии бластоцисты спустя 5-6 дней после оплодотворения, внутренняя клеточная масса бластоцисты человека состоит из 50-150 клеток.
Эмбриональные стволовые клетки являются плюрипотентными. Это означает, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму. Плюрипотентные клетки способны к дифференцировке во все типы клеток взрослого организма, которых насчитывается около 220. Свойство плюрипотентности отличает эмбриональные стволовые клетки от мультипотентных клеток, которые могут дать начало лишь ограниченному количеству типов клеток. В отсутствие стимулов к дифференцировке in vitro эмбриональные стволовые клетки могут поддерживать плюрипотентность в течение многих клеточных делений. Это свойство называется способность к самообновлению (англ. self-renewal). Наличие плюрипотентных клеток у взрослого организма остается объектом научных дискуссий, хотя исследования показали, что существует возможность получения плюрипотентных клеток из фибробластов взрослого человека в лабораторных условиях в процессе так называемого репрограммирования клеток [2].
Ввиду пластичности и потенциально неограниченного потенциала самообновления эмбриональные стволовые клетки имеют перспективы применения в регенеративной медицине и замещении поврежденных тканей. Однако в настоящий момент не существует никакого медицинского применения эмбриональных стволовых клеток. Стволовые клетки взрослых организмов и стволовые клетки костного мозга используются для терапии различных заболеваний. Некоторые заболевания крови и иммунной системы (в том числе генетические) могут быть излечены стволовыми клетками неэмбрионального происхождения.[источник не указан 2164 дня]К:Википедия:Статьи без источников (тип: не указан) Разрабатываются методы лечения с помощью стволовых клеток таких патологий, как онкологические заболевания, юношеский диабет, синдром Паркинсона, слепота и нарушения работы спинного мозга[источник не указан 2164 дня]К:Википедия:Статьи без источников (тип: не указан)
Существуют как этические, так и технические затруднения, связанные с трансплантацией гематопоэтических стволовых клеток. Эти проблемы связаны, в том числе, с гистосовместимостью. Такие проблемы могут быть разрешены при использовании собственных стволовых клеток или путём терапевтического клонирования.
Для дифференцировки эмбриональных стволовых клеток достаточно подействовать на них факторами роста. Например, эмбриональные стволовые клетки мыши, дифференцированные in vitro в нейральные клетки, были использованы для восстановления повреждённого спинного мозга крысы. Для получения гепатоцитов был использован бутират натрия, а для получения гемопоэтических стволовых клеток эмбриональные стволовые клетки трансфецировали генами Cdx, HoxB4.
История исследований и разработок
Выделение и культура in vitro
Стволовые клетки были выделены при анализе тератокарциномы. В 1964 году исследователи показали, что клетки тератокарциномы остаются недифференцированными в культуре клеток. Такие стволовые клетки называют эмбриональными клетками карциномы.[3] Исследователи показали, что первичные эмбриональные зародышевые клетки могут размножаться в культуре и могут образовывать разные типы клеток.
Эмбриональные стволовые клетки выделили из мышиных эмбрионов в 1981 году Мартин Эванс и Мэтью Кауфман, а также независимо от них Гэйл Мартин[4][5]. Прорыв в исследовании эмбриональных стволовых клеток человека произошел в ноябре 1998 года в группе Джеймса Томсона в Университете Висконсина. Ученые выделили такие клетки из бластоцисты человека[6].
Загрязнения веществами, которые используют для поддержания клеточных культур
Сетевая версия журнала Nature Medicine опубликовало в январе 2005 года материал, согласно которому стволовые клетки человека, которые доступны для исследований, финансируемых федеральными грантами, загрязнены молекулами сред для культивирования клеток животного происхождения[7]. Для поддержания плюрипотентности активно делящихся клеток часто используют клетки животного происхождения (обычно это клетки мышей). Выяснилось, что это порождает ряд проблем; в частности, оказалось, что сиаловая кислота животного происхождения сужает возможности применения эмбриональных стволовых клеток для терапевтических целей[8].
В работе, опубликованной в журнале Lancet Medical Journal 7 марта 2005 года[9], детально описана методика культивирования новой линии стволовых клеток в среде, полностью свободной от клеток и сыворотки животного происхождения. После более чем шестимесячного периода культивирования в недифференцированном состоянии эти клетки могли дифференцироваться в клетки всех трех зародышевых листков как в составе тератом, так и в культуре.
Видео по теме
Терапевтические применения
23 января 2009 года началась первая фаза клинических испытаний по трансплантации популяции человеческих эмбриональных стволовых клеток пациентам с травмами спинного мозга[10]. Данное исследование было основано на результатах, полученных группой Ханса Кейрстеда с соавт. в университете города Ирвин, Калифорния, США, финансируемых Корпорацией Geron (Menlo Park, Калифорния, США). Результаты данного эксперимента показали улучшение локомоторной проводимости у крыс с травмами спинного мозга. На седьмой день после трансплантации, эмбриональные стволовые клетки человека дифференцировались в олигодендроциты.[11]. В том же году было начато клиническое исследование по использованию дифференцированных производных ЭСК человека для терапии наследственной макулодистрофии сетчатки глаза, которое успешно завершилось в 2015 году [12]. Сейчас мультицентровое продолжение исследований проходит в США, Англии, Австралии, странах Азии. В 2015 году американская компания Viacyte начала клинические испытания лечения диабета с использованием клеток поджелудочной железы, полученных из эмбриональных стволовых клеток человека[13].
В Российской Федерации терапевтическое применение и изучение эмбриональных стволовых клеток человека будет регулироваться законом «Об обращении биомедицинских клеточных продуктов»[14], который должен быть рассмотрен Госдумой РФ в середине 2016 года.
Индуцированные плюрипотентные стволовые клетки
Индуцированные плюрипотентные стволовые клетки (induced pluripotent stem cells, iPSC или iPS) удалось получить из клеток различных тканей (в первую очередь фибробластов) с помощью их репрограммирования методами генетической инженерии.
В ранних работах iPS пытались получить путём слияния «взрослых» клеток с ЭСК[15]. В 2006 году были получены iPS из сперматогониев мышей и людей[16]
В 2006 году были разработаны методы репрограммирования клеток путём введения в них генов, кодирующих транскрипционные факторы, характерные для плюрипотентных клеток, (в первую очередь, генов транскрипционных факторов Oct4, Sox2, Klf4, c-Myc и Nanog) с помощью лентивирусов и других векторов"[17][18] Репрограммирование клеток с целью превращения их в iPS было признано журналом Science главным научным прорывом 2008 г[19]
В 2009 году была опубликована работа, в которой с помощью метода тетраплоидной комплементации впервые было показано, что iPS могут давать полноценный организм, в том числе и клетки зародышевого пути[20]. iPS, полученные из фибробластов кожи мышей с помощью трансформации с использованием ретровирусного вектора, в некотором проценте случаев дали здоровых взрослых мышей, которые были способны нормально размножаться. Таким образом, впервые были получены клонированные животные без примеси генетического материала яйцеклеток (при стандартной процедуре клонирования митохондриальная ДНК передается потомству от яйцеклетки реципиента). В 2012 г за разработку технологии клонирования и генетического репрграммирования Нобелевская премия по физиологии и медицине была вручена Джону Гердону (Англия) и Шинья Яманака (Япония). А в 2014 г проф. М Такахаши и Ш. Яманака впервые произвели трансплантацию пигментного эпителия сетчатки глаза, полученного из iPS клеток пациентке с возрастной дегенерацией сетчатки[21].
В Японии есть государственная программа, предусматривающая, чтобы в будущем у 100% населения были банки IPS клеток [22]
См. также
Примечания
- ↑ Киселев С.Л., Лагарькова М.А. Эмбриональные стволовые клетки человека // Природа. — 2006. — Т. 10. — С. 49-64.
- ↑ Department of Stem Cell Biology, Institute for Frontier Medical Sciences, Kyoto University, Kyoto (August 25, 2006). «Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors». Cell.
- ↑ Andrews P, Matin M, Bahrami A, Damjanov I, Gokhale P, Draper J (2005). «Embryonic stem (ES) cells and embryonal carcinoma (EC) cells: opposite sides of the same coin». Biochem Soc Trans 33 (Pt 6): 1526–30. DOI:10.1042/BST20051526. PMID 16246161.
- ↑ Evans M, Kaufman M (1981). «Establishment in culture of pluripotential cells from mouse embryos». Nature 292 (5819): 154–6. DOI:10.1038/292154a0. PMID 7242681.
- ↑ Martin G (1981). «Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells». Proc Natl Acad Sci U S A 78 (12): 7634–8. DOI:10.1073/pnas.78.12.7634. PMID 6950406.
- ↑ Thomson J, Itskovitz-Eldor J, Shapiro S, Waknitz M, Swiergiel J, Marshall V, Jones J (1998). «Embryonic stem cell lines derived from human blastocysts». Science 282 (5391): 1145–7. DOI:10.1126/science.282.5391.1145. PMID 9804556.
- ↑ Ebert, Jessica (24 January 2005). «Human stem cells trigger immune attack». News from "Nature" (Nature Publishing Group). DOI:10.1038/news050124-1. Проверено 2015-03-17.
- ↑ Access to articles : Nature Medicine (Проверено 17 марта 2015)
- ↑ Irina Klimanskaya (7 May 2005). «Human embryonic stem cells derived without feeder cells». The Lancet 365 (9471): 1636—1641. DOI:10.1016/S0140-6736(05)66473-2. Проверено 2015-03-17.
- ↑ FDA approves human embryonic stem cell study - CNN.com. Архивировано 28 марта 2012 года.
- ↑ Keirstead HS, Nistor G, Bernal G, et al (May 2005). «Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury». J. Neurosci. 25 (19): 4694–705. DOI:10.1523/JNEUROSCI.0311-05.2005. PMID 15888645.
- ↑ name="PMID 25937371"
- ↑ VC-01 Diabetes Therapy — Viacyte, Inc
- ↑ Проект Федерального закона от 18 января 2013 г
- ↑ http://elementy.ru/news/164751 Источником эмбриональных стволовых клеток может стать человеческая кожа
- ↑ Элементы - новости науки: Получены «этичные» эмбриональные стволовые клетки
- ↑ http://elementy.ru/news/430912 Позже было показано, что репрограммирование может происходить при временной экспрессии указанных генов, без их интеграции в геном
- ↑ Matthias Stadtfeld, Masaki Nagaya, Jochen Utikal, Gordon Weir, Konrad Hochedlinger. Induced Pluripotent Stem Cells Generated Without Viral Integration // Science. V. 322. P. 945—949 (7 November 2008). DOI: 10.1126/science.1162494.
- ↑ Год перепрограммированных клеток. П. Петров
- ↑ Xiao-yang Zhao1, Wei Li1, Zhuo Lv1,, Lei Liu1, Man Tong1, Tang Hai1, Jie Hao1, Chang-long Guo1, Qing-wen Ma, Liu Wang, Fanyi Zeng, Qi Zhou. iPS cells produce viable mice through tetraploid complementation. Nature 461, (3 September 2009), 86-90
- ↑ Transplantation of iPSC-derived RPE sheet into first AMD patient Center for Developmental Biology | RIKEN CDB
- ↑ Как делают трехмерные органы, и кому они нужны
Ссылки
wikipedia.green
Стволовые клетки — WiKi
Стволовые клетки можно разделить на три основные группы в зависимости от источника их получения: эмбриональные, фетальные и постнатальные (стволовые клетки взрослого организма).
Эмбриональные стволовые клетки
Эмбриональные стволовые клетки (ЭСК) образуют внутреннюю клеточную массу (ВКМ), или эмбриобласт, на ранней стадии развития эмбриона. Они являются плюрипотентными. Важный плюс ЭСК состоит в том, что они не экспрессируют HLA (human leucocyte antigens), то есть не вырабатывают антигены тканевой совместимости. Каждый человек обладает уникальным набором этих антигенов, и их несовпадение у донора и реципиента является важнейшей причиной несовместимости при трансплантации. Соответственно, шанс того, что донорские эмбриональные клетки будут отторгнуты организмом реципиента очень невысок. При пересадке иммунодефицитным животным эмбриональные стволовые клетки способны образовывать опухоли сложного (многотканевого) строения — тератомы, некоторые из них могут стать злокачественными. Достоверных данных, о том как ведут себя эти клетки в иммунокомпетентном организме, например, в организме человека, нет. Вместе с тем, следует отметить, что клинические испытания с применением дифференцированных дериватов (производных клеток) ЭСК уже начаты.
Одним из главных недостатков ЭСК является невозможность использования аутогенного, то есть собственного материала, при трансплантации, поскольку выделение ЭСК из эмбриона несовместимо с его дальнейшим развитием.
Фетальные стволовые клетки
Фетальные стволовые клетки получают из плодного материала после аборта (обычно срок гестации, то есть внутриутробного развития плода, составляет 9—12 недель)[27]. Фетальные стволовые клетки являются смесью мультипотентных и унипотентных стволовых клеток[28][29]. Естественно, изучение и использование такого биоматериала также порождает этические проблемы. Проблемой является и нелегальный рынок препаратов фетальных стволовых клеток в России[30]. Британская компания ReNeuron исследует возможности использования фетальных стволовых клеток для терапии инсульта. Эти клетки уже начали дифференцировку, и, следовательно, каждая из них, во-первых, может пройти только ограниченное число делений, и, во-вторых, дать начало не любым, а достаточно определённым видам специализированных клеток. Так, из клеток фетальной печени могут развиться специализированные клетки печени и кроветворные клетки. Из фетальной нервной ткани, соответственно, развиваются более специализированные нервные клетки.
Постнатальные стволовые клетки
Несмотря на то, что стволовые клетки зрелого организма обладают меньшей потентностью в сравнении с эмбриональными и фетальными стволовыми клетками, то есть могут порождать меньшее количество различных типов клеток, этический аспект их исследования и применения не вызывает серьёзной полемики. Кроме того, возможность использования аутогенного материала обеспечивает эффективность и безопасность лечения. Стволовые клетки взрослого организма можно подразделить на три основных группы: гемопоэтические (кроветворные), мультипотентные мезенхимальные (стромальные) и тканеспецифичные прогениторные клетки.
Иногда в отдельную группу выделяют клетки пуповинной крови, поскольку они являются наименее дифференцированными из всех клеток зрелого организма[источник не указан 1665 дней], то есть обладают наибольшей потентностью. Пуповинная кровь в основном содержит гемопоэтические стволовые клетки, а также мультипотентные мезенхимальные, но в ней присутствуют малые количества других разновидностей стволовых клеток, при определённых условиях способные дифференцироваться в клетки различных органов и тканей.
Гемопоэтические стволовые клетки
Гемопоэтические стволовые клетки (ГСК) — мультипотентные стволовые клетки, дающие начало всем клеткам крови миелоидного (моноциты, макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты и тромбоциты, дендритные клетки) и лимфоидного рядов (Т-лимфоциты, В-лимфоциты и естественные киллеры). Определение гемопоэтических клеток было основательно пересмотрено в течение последних 20 лет. Гемопоэтическая ткань содержит клетки с долгосрочными и краткосрочными возможностями к регенерации, включая мультипотентные, олигопотентные и клетки-предшественники. Миелоидная ткань содержит одну ГСК на 10 000 клеток. ГСК являются неоднородной популяцией. Различают три субпопуляции ГСК, в соответствии с пропорциональным отношением лимфоидного потомства к миелоидному (Л/M). У миелоидно ориентированных ГСК низкое Л/М соотношение (>0, <3), у лимфоидно ориентированных — высокое (>10). Третья группа состоит из «сбалансированных» ГСК, для которых 3 ≤ Л/M ≤ 10. В настоящее время активно исследуются свойства различных групп ГСК, однако промежуточные результаты показывают, что только миелоидно ориентированные и «сбалансированные» ГСК способны к продолжительному самовоспроизведению. Кроме того, эксперименты по трансплантации показали, что каждая группа ГСК преимущественно воссоздаёт свой тип клеток крови, что позволяет предположить наличие наследуемой эпигенетической программы для каждой субпопуляции.
Популяция ГСК формируется во время эмбриогенеза, то есть эмбрионального развития. Доказано, что у млекопитающих первые ГСК обнаруживаются в областях мезодермы, называемых аорта, гонада и мезонефрос, до формирования костного мозга популяция расширяется в фетальной печени. Такие исследования способствуют пониманию механизмов, ответственных за генезис (формирование) и расширение популяции ГСК, и, соответственно, открытию биологических и химических агентов (действующих веществ), которые в конечном счёте могут быть использованы для культивации ГСК in vitro.
Основным источником ГСК является костный мозг. Этот источник и сегодня наиболее широко используется в трансплантологии (см. Трансплантация гемопоэтических стволовых клеток). ГСК располагаются в костном мозге у взрослых, включая тазовые кости, рёбра, грудину и другие кости. Клетки могут быть получены непосредственно из тазовых костей при помощи иглы и шприца или из крови, после предварительной обработки цитокинами, включая G-CSF (гранулоцитарный колониестимулирующий фактор), способствующий выходу стволовых клеток из костного мозга.
Мультипотентные мезенхимальные стромальные клетки
Мультипотентные мезенхимальные стромальные клетки (ММСК) — мультипотентные стволовые клетки, способные дифференцироваться в остеобласты (клетки костной ткани), хондроциты (хрящевые клетки) и адипоциты (жировые клетки).
Предшественниками ММСК в эмбриогенный период развития являются мезенхимальные стволовые клетки (МСК). Они могут быть обнаружены в местах распространения мезенхимы, то есть зародышевой соединительной ткани.
Основным источником ММСК является костный мозг. Кроме того, они обнаружены в жировой ткани и ряде других тканей с хорошим кровоснабжением. Существует ряд доказательств того, что естественная тканевая ниша ММСК расположена периваскулярно — вокруг кровеносных сосудов. Кроме того, ММСК были обнаружены в пульпе молочных зубов, амниотической (околоплодной) жидкости, пуповинной крови и вартоновом студне. Эти источники исследуются, но редко применяются на практике. Например, выделение молодых ММСК из вартонова студня представляет собой крайне трудоёмкий процесс, поскольку клетки в нём также располагаются периваскулярно. В 2005—2006 годах специалисты по ММСК официально определили ряд параметров, которым должны соответствовать клетки, чтобы отнести их к популяции ММСК. Были опубликованы статьи, в которых представлен иммунофенотип ММСК и направления ортодоксальной дифференцировки. К ним относится дифференцировка в клетки костной, жировой и хрящевой тканей. Был проведён ряд экспериментов по дифференцировке ММСК в нейроноподобные клетки, но исследователи по-прежнему сомневаются, что полученные нейроны являются функциональными. Эксперименты также проводятся в области дифференцировки ММСК в миоциты — клетки мышечной ткани. Важнейшей и наиболее перспективной областью клинического применения ММСК является которансплантация совместно с ГСК в целях улучшения приживления образца костного мозга или стволовых клеток пуповинной крови. Многочисленные исследования показали, что ММСК человека могут избегать отторжения при трансплантации, вступать во взаимодействие с дендритными клетками и Т-лимфоцитами и создавать иммуносупрессивную микросреду посредством выработки цитокинов. Было доказано, что иммуномодулирующие функции ММСК человека повышаются, когда их пересаживают в воспалённую среду с повышенным уровнем гамма-интерферона. Другие исследования противоречат этим выводам, что обусловлено гетерогенной природой изолированных МСК и значительными различиями между ними, в зависимости от способа культивирования.
МСК могут быть активированы в случае необходимости. Однако эффективность их использования относительно низка. Так, к примеру, повреждение мышц даже при трансплантации МСК заживает очень медленно. В настоящее время проводятся исследования по активации МСК. Ранее проведённые исследования по внутривенной трансплантации МСК показали, что этот способ трансплантации часто приводит к кризу отторжения и сепсису. Сегодня признано, что заболевания периферических тканей, например, воспаление кишечника лучше лечить не трансплантацией, а методами, повышающими локальную концентрацию МСК.
Однако, исследования эффективности применения МСК для реэпителизации поврежденных кожных покровов, например, при синдроме диабетической стопы, показали свою результативность в клинических исследованиях[31].
Тканеспецифичные прогениторные клетки
Тканеспецифичные прогениторные клетки (клетки-предшественницы) — малодифференцированные клетки, которые располагаются в различных тканях и органах и отвечают за обновление их клеточной популяции, то есть замещают погибшие клетки. К ним, например, относятся миосателлитоциты (предшественники мышечных волокон), клетки-предшественницы лимфо- и миелопоэза. Эти клетки являются олиго- и унипотентными и их главное отличие от других стволовых клеток в том, что клетки-предшественницы могут делиться лишь определённое количество раз, в то время как другие стволовые клетки способны к неограниченному самообновлению. Поэтому их принадлежность к истинно стволовым клеткам подвергается сомнению. Отдельно исследуются нейральные стволовые клетки, которые также относятся к группе тканеспецифичных. Они дифференцируются в процессе развития эмбриона и в плодный период, в результате чего происходит формирование всех нервных структур будущего взрослого организма, включая центральную и периферическую нервные системы. Эти клетки были обнаружены и в ЦНС взрослого организма, в частности, в субэпендимальной зоне, в гиппокампе, обонятельном мозге и т. д. Несмотря на то, что большая часть погибших нейронов не замещается, процесс нейрогенеза во взрослой ЦНС всё-таки возможен за счёт нейральных стволовых клеток, то есть популяция нейронов может «восстанавливаться», однако это происходит в таком объёме, что не сказывается существенно на исходах патологических процессов.
В 2012 году для глиобластомы, папилломы и карциномы кожи и аденомы кишечника было доказано существование ограниченного пула особых раковых стволовых клеток (англ.)русск., которые являются предшественниками других клеток, и именно они отвечают за образование и рост опухоли[32].
Сейчас в СМИ активно идут дебаты, привели ли инъекции эмбриональных стволовых клеток к заболеванию раком и последующей преждевременной смерти многих известных людей, в основном артистов — Александра Абдулова, Веры Глаголевой, Ильи Олейникова, Любови Полищук, Дмитрия Хворостовского, Жанны Фриске, Михаила Задорнова, Валентины Толауновой, Клары Лучко, Анны Самохиной, Олега Янковского и других[1] Анализы знаменитых пациентов показывали, что в организме актеров происходит обновление, ускорение жизнедеятельности. Однако вскорости появилась страшная статистика: те, кто применял инъекции стволовых клеток, сначала реально молодели, а потом очень быстро «сгорали» от рака, в основном глоибластомы (рака мозга), заболеванием во многом загадочным, которое характеризуется множественной генетической поломкой в клетках глии мозга, что приводит к быстрому экспансивному росту злокачественной опухоли.
После инъекций стволовых клеток, начинается активное деление не только здоровых, но и патологичных клеток организма, включая злокачественные, которых тем больше, чем старше организм. Временный импульс молодости проходит и возвращается упадок, а потом проявляются разные последствия. Так, если введенные клетки приживаются, то вследствие противоречия с клетками организма и иммунной системой они сами часто перерождаются в раковые. В любом случае это стрессовое воздействие на иммунитет, на фоне которого способна реализоваться патология.
В России
Распоряжением Правительства РФ от 23 декабря 2009 г. № 2063-р (п.6) Минздравосцразвития России, Минпромторгу России и Минобрнауки России было поручено до конца 2010 г. разработать и представить на рассмотрение в Государственную думу РФ проект закона «О применении биомедицинских технологий в медицинской практике», регламентирующего медицинское применение стволовых клеток[40][41], как одной из биомедицинских технологий. Поскольку законопроект вызвал[42] возмущение общественности и ученых, он был отправлен на доработку и на тот момент не принят.
1 июля 2010 года Федеральная служба по надзору в сфере здравоохранения и социального развития выдала первое[уточнить] разрешение на применение новой медицинской технологии ФС № 2010/255 (лечение собственными стволовыми клетками).[43]
3 февраля 2011 года Федеральная служба по надзору в сфере здравоохранения и социального развития выдала разрешение на применение новой медицинской технологии ФС № 2011/002 (лечение донорскими стволовыми клетками следующих патологий: возрастные изменения кожи лица второй или третьей степени, наличие раневого дефекта кожи, трофической язвы, лечение аллопеции, атрофическое поражение кожи, в том числе атрофические полосы (striae), ожоги, диабетической стопы)
В 2015 Госдума приняла в первом чтении проект закона «О биомедицинских клеточных продуктах», регламентирующего разработку, испытания, регистрацию, производство, хранение и продажу стволовых и других клеточных продуктов[44]. В 2016 году данный закон, легализующий использование клеточных технологий, включая применение стволовых клеток[45], был окончательно принят Госдумой, одобрен Советом Федерации и вступил в силу с января 2017 года[46][47].
На Украине
С апреля 2013 года Минздрав Украины разрешил проведение клинических испытаний (Приказ МЗ Украины № 630 «О проведении клинических испытаний стволовых клеток», 2007 г.[48]) по лечению следующих патологий с применением стволовых клеток: панкреонекроз, ожоговая болезнь, хроническая ишемия нижних конечностей.[49]
ru-wiki.org
Стволовые клетки растений и их влияние на кожу
 Научная косметология, находясь в постоянном поиске альтернативных технологий омоложения, не так давно вывела на рынок новую группу субстанций, уже успевшую заявить о себе высокой эффективностью, – это стволовые клетки растений. Биологическая активность растительных стволовых клеток позволяет прогнозировать большое будущее их применению в составе косметических средств. Они доказали свою эффективность в устранении следов времени на коже, а также в коррекции других ее проблем.Автор: Наталия Кищенко, биохимик, провизор-косметолог, руководитель информационного отдела ООО «Интеркосметик Групп» (Киев)Источник: Les Nouvelles Esthetiques Украина, №2 (84), 2014, стр.108-115
Научная косметология, находясь в постоянном поиске альтернативных технологий омоложения, не так давно вывела на рынок новую группу субстанций, уже успевшую заявить о себе высокой эффективностью, – это стволовые клетки растений. Биологическая активность растительных стволовых клеток позволяет прогнозировать большое будущее их применению в составе косметических средств. Они доказали свою эффективность в устранении следов времени на коже, а также в коррекции других ее проблем.Автор: Наталия Кищенко, биохимик, провизор-косметолог, руководитель информационного отдела ООО «Интеркосметик Групп» (Киев)Источник: Les Nouvelles Esthetiques Украина, №2 (84), 2014, стр.108-115Источники стволовых клеток растений
В отличие от животных растения образуют новые клетки на протяжении всей жизни. Рост их обеспечивается меристемами – ограниченными участками тканей, постоянно сохраняющих эмбриональное состояние. Меристемы (образовательные ткани) находятся в определенных местах – в точках или зонах роста, наприме: на верхушке побега или на кончике корня. Основной функцией зон роста является активное деление и порождение новых клеток. Развивающиеся из меристем клетки растут и дифференцируются в постоянные ткани. Они определяют рост стеблей и корней, отвечают за заживление их поврежденных участков. В меристеме сосредоточены клетки, способные к неограниченному делению на протяжении всей жизни растения, а это десятки и сотни лет. Такие клетки называют инициальными. Именно из клеток меристемы различных растений получают стволовые клетки. Растительные клетки, которые используются сегодня в косметике, правильнее называть не стволовыми, а меристемальными.Для стволовых клеток растений характерно асимметричное деление. Это значит, что их потомки могут иметь различную судьбу – либо оставаться стволовыми (тотипотентными), либо подвергаться дифференцировке. Тотипотентность означает, что в дальнейшем из стволовой клетки может развиться любая другая клетка растительного организма.
Стволовые клетки растений несут всю информацию о будущем организме и обладают молекулярным потенциалом для обеспечения его развития. Имея уникальный концентрат исключительно активных веществ и интенсивный внутриклеточный обмен, стволовые клетки растений обладают мощнейшим жизненным потенциалом и практически неограниченными регенеративными возможностями.
Стволовые клетки животных и растений: сходство и различия
Несмотря на значительные различия в физиологии животных и растений, они имеют много точек соприкосновения. Ряд биохимических процессов у животных и растений базируется на общих механизмах, активные компоненты стволовых клеток сходны по строению и выполняют одинаковые функции. Сравнивая животные и растительные клетки, следует выделить ряд общих черт и принципиальных отличий.Чем сходны?
- Животные и растительные стволовые клетки являются недифференцированными. Это общее свойство, характерное для животного и растительного мира. В дальнейшем, эволюционируя, эти клетки дают начало специализированным тканям, причем дифференциация во многом зависит от микроокружения, в котором клетка находится.
- Растительные и животные клетки делятся асимметрично, образуя два типа клеток: одни остаются стволовыми, другие становятся на путь дифференциации.
- Растительные и животные стволовые клетки синтезируют специфические вещества, отличающие их от всех других клеток организма. Экспериментально установлено, что многие активные компоненты, которые в стволовых клетках содержатся в значительных концентрациях, в дифференцированных тканях обнаруживаются лишь в следовых количествах.
- В отличие от стволовых клеток животных и человека все растительные стволовые клетки способны дифференцироваться в любую из клеток растения, то есть обладают тотипотентностью. У животных и человека тотипотентность (возможность превращаться в любые виды клеток и тем самым создавать целый организм) характерна только для клеток эмбриона в первые несколько циклов деления зиготы. Впоследствии в человеческом организме остаются мультипотентные стволовые клетки, создающие специализированные клеточные линии нескольких типов (например, кроветворные или клетки жировой ткани) и унипотентные, воспроизводящие только один тип дифференцированных клеток.
- Второе важное различие состоит в том, что многие клетки взрослых растений в ответ на повреждение способны двигаться «назад в прошлое», то есть утрачивать свою специализацию и возвращаться в недифференцированное состояние. Этим объясняется свойственное растениям вегетативное размножение. У животных такая возможность до недавнего времени вообще отрицалась.
Активные компоненты стволовых клеток растений
У каждого растения стволовые клетки имеют свои свойства. Вот несколько примеров.Эдельвейс (Leontopodium alpinum)
В стволовых клетках этого растения выработано множество защитных механизмов, необходимых для выживания растения в экстремальных климатических и экологических условиях. Научные исследования подтвердили наличие мощных антиоксидантов и других веществ с противовоспалительными и цитопротективными свойствами. Стволовые клетки эдельвейса ценны содержанием в них леонтоподовых кислот А, В и хлорной кислоты, проявляющих антигиалуронидазную и антиколлагеназную активность, а также 3,5-дикаффелоилхиновой кислоты, обладающей сильным антиоксидантным действием.Центелла азиатская (Centella asiatica)
Стволовые клетки центеллы азиатской проявляют выраженную антиоксидантную активность, содержат каффеоилхиновые кислоты, помогающие убирать воспаление, повышать тонус кожи и кровеносных сосудов. Механизм действия основан на способности значительно подавлять продукцию цитокина TNF-?, участвующего в запуске воспалительной реакции, и оксида азота (NO) – сигнальной молекулы, вызывающей расслабление сосудов.Сирень обыкновенная (Syringa vulgaris L.)
Стволовые клетки сирени способны напрямую воздействовать на митохондрии клеток кожи человека, выступая как мощный биоактиватор, и обновлять глубокие слои дермы благодаря содержащемуся в них веществу с сильным восстанавливающим и антиоксидантным эффектом – вербаскозиду. Вербаскозид – фенилпропаноидный гликозид (гликозид кофейной кислоты), имеющий значимую противовоспалительную активность, поскольку вызывает дозозависимое снижение экспрессии провоспалительных цитокинов в первичных культурах человеческих кератиноцитов. Кроме того, вербаскозид защищает клетки от окислительного повреждения в ходе воспалительной реакции, ингибируя выброс активных форм кислорода из лейкоцитов и хелатируя ионы железа. В результате научных изысканий было выявлено, что металлокомплексы природных полифенолов, особенно вербаскозид Fe2+, способны заметно отбеливать кожу. Прямой отбеливающий эффект осуществляется за счет связывания ионов железа, необходимых для работы тирозиназы (происходит ее ингибирование и прерывается процесс меланогенеза), опосредованный за счет выраженного антиоксидантного действия, защищающего от УФ-излучения. Кроме высокой антирадикальной и осветляющей активности, вербаскозид отличается способностью повышать устойчивость клеток и тканей к недостатку кислорода, обладая заметным антигипоксическим эффектом. Вербаскозид также мощно подавляет рост дрожжей Malassezia furfur. Продукт, полученный из клеток сирени, эффективен против 5?-редуктазы – фермента, участвующего в производстве кожного сала, и, следовательно, способствует сокращению всех видов угревых поражений.Гардения жасминовидная (Gardenia jasminoides)
Благодаря высокой концентрации феруловой кислоты стволовые клетки этого растения проявляют антиоксидантные свойства. Эксперементально доказано, что культура клеток гардении жасминовидной имеет чрезвычайно высокую способность бороться с процессом старения «коллагеновой системы», оказывая тройное действие: эффективно стимулирует синтез нового коллагена и гиалуроновой кислоты, ингибирует активность фермента коллагеназы, замедляет деградацию коллагеновых волокон. Стволовые клетки гардении восстанавливают сложное равновесие компонентов внеклеточного матрикса, поддерживают функционирование фибробластов, снижают секрецию металлопротеиназ ММП1, разрушающих коллагеновые волокна. Использование стволовых клеток гардении жасминовидной позволяет осуществить комплексный подход к ослаблению прогрессивной атрофии дермы, которая сопровождает старение кожи.Дуб черешчатый (Quercus robur), бук лесной (Fagus sylvatica), акация сенегальская (Acacia senegal)
Стволовые клетки этих растений, вследствие прямого влияния на митохондрии, стимулируют клеточное дыхание, поддерживают энергетический баланс, защищают ДНК от повреждений и способствуют полной биоревитализации кожи.Швейцарская яблоня (Uttwiler spatlauber)
Восстанавливает стволовые клетки кожи, стимулирует процессы регенерации, уменьшает и предотвращает проявление признаков старения, борется с морщинами. Биофлавоноиды яблока – мощные антиоксиданты, защищающие кожу от неблагоприятных воздействий окружающей среды, восстанавливают ее эластичность и упругость, а также поддерживают систему кровообращения и укрепляют стенки сосудов.Морской фенхель (Crithmum мaritimum)
Стволовые клетки обладают глобальным защитным действием по отношению к эпидермису. Обеспечивают защиту клеток от окислительного стресса, сохраняют здоровье и молодость кожи, нормализуют процессы обновления эпидермиса, улучшают внешний вид и гидратацию кожи. Обладают антитирозиназным (осветляющим) и омолаживающим действием, укрепляют дермоэпидермальное сцепление, повышают тургор кожи.Буддлея Давида (Buddleja Davidii)
Стволовые клетки активно борются с фотостарением кожи, делают морщины менее заметными, улучшают клеточное дыхание и укрепляют жизненную силу митохондрий. Обладают мощным антиоксидантным действием, предупреждают обезвоживание и потерю кожей эластичности.Аргания (Argania spinosa)
Обладает особыми свойствами, поскольку произрастает в сложных климатических условиях, что заставляет растение вырабатывать уникальные механизмы защиты и репарации. Последние исследования показали, что культура стволовых клеток аргании оживляет стволовые клетки дермы, ускоряет регенерационные процессы кожи, активизирует работу фибробластов, синтез коллагена, что ведет к разглаживанию кожи и способствует процесу омоложения.Томаты (Sol?num lycop?rsicum)
Стволовые клетки специализируются на защите клеток кожи от окислительного стресса, защищают целостность ядерной ДНК клетки от повреждений тяжелыми металлами, а также активируют гены, отвечающие за восстановление ДНК и ее защиту.Красный виноград (Vitis vinifera)
Благодаря мощнейщим антиоксидантным свойствам укрепляет стволовые клетки кожи, поддерживает их жизненный цикл и защищает от повреждений.
Влияние растительных стволовых клеток на кожу
Стволовые клетки растений обладают высокой биологической активностью в отношении клеток кожи человека. В косметические средства их вводят для передачи биоэнергетического потенциала, свойственного проростку в фазе активного роста растения. Как действуют экстракты стволовых клеток растений, введенные в космецевтические препараты? Основа благотворного действия растительных меристем – это детоксикация, которую они запускают на молекулярно-клеточном уровне, и эффективное выведение уже образовавшихся токсинов из организма. Компоненты экстрактов с антиокислительными свойствами прерывают цепные реакции перекисного окисления липидов клеточных мембран, тем самым обеспечивают сохранение их барьерной, транспортной и сигнальной функций. Корректируются многие патологические сдвиги в клеточных программах, оптимизируется синтез коллагена, эластина и гликозамингликанов. Вещества-хелаторы тяжелых металлов защищают функции жизненно важных ферментов. Белки-шапероны исправляют нарушенную укладку белковых молекул. Присутствие фактора роста (кинетина) способствует улучшению тургора, исчезновению мелких и уменьшению крупных морщин. В результате улучшения работы митохондрий активизируется клеточная оксигенация. Кроме того, растительные стволовые клетки обладают свойством замедлять хронологическое старение дермальных и эпидермальных клеток кожи, защищать клетки ДНК от окисления свободными радикалами и обеспечивать видимое оздоровление кожи.Биохимические особенности стволовых клеток растений
Обменные процессы недифференцированных тканей растений (меристем) значительно отличаются от тех, что происходят во всех других тканях. Основные биохимические процессы в них направлены на сохранение генетической информации и бесперебойность процесса деления, а также на максимальную защиту от повреждающих факторов окружающей среды. Этим объясняется синтез и накопление в высокой концентрации веществ, которые встречаются исключительно в стволовых клетках, а в зрелых тканях либо отсутствуют, либо есть в следовых количествах.Клетки меристем богаты нуклеиновыми и аминокислотами, витаминами и минералами (кофакторами), ферментами и антиоксидантами, энергоемкими соединениями и компонентами дыхательных систем. Присутствуют в стволовых клетках и фитогормоны, которые в ничтожных количествах оказывают регуляторное влияние, координируют физиологические процессы и играют ведущую роль в адаптации растений к условиям среды. Известны следующие группы фитогормонов: ауксины, гиббереллины, цитокинины, брассинолиды, жасмонаты, полиамины, пептиды. Важной особенностью меристем является присутствие в них высоких концентраций рибонуклеиновых кислот (РНК), роль которых исключительно важна в процессе деления, в поддержании клеточных коммуникаций, синхронизации функционирования клеток. Обнаружено, что одна из функций ауксинов – активация ферментов РНК-полимераз, которые контролируют синтез РНК в стволовых клетках, а представитель класса цитокининов – кинетин препятствует возникновению дефектов в РНК при их сборке. Кроме того, доказано, что кинетин, основная функция которого – замедлять процессы старения растений, у человека выполняет ту же самую функцию. Следует отметить, что в растительных стволовых клетках найдены вещества, которые встречаются и в организме человека, например: антиоксидантные ферменты (супероксиддисмутаза, глутатионпероксидаза, каталаза), нейтрализующие свободные радикалы как у растений, так и у человека; компоненты системы цитохрома, которые в человеческом организме обеспечивают клеточное дыхание; элементы сигнальных путей (G-белки, митогенактивируемые протеинкиназы (МАРК)), которые определяют рост, деление и старение человеческих клеток; белки-шапероны, влияющие на пространственную организацию белковых молекул, и др.
Стволовые клетки в косметологии
Наиболее часто экстракты стволовых клеток применяют в антивозрастных программах. Косметика для старшего возраста должна быть особенно эффективной, ведь в этом случае речь идет не о профилактике, а о действенной борьбе с проявлениями старения. Одна из главных надежд современной anti-age-медицины – стволовые клетки растений с их практически неограниченным регенеративным потенциалом.Уникальность растительных стволовых клеток состоит в том, что они влияют сразу на несколько причин старения кожи, таких как окислительный стресс, накопление «молекулярных ошибок», интоксикация клеток. Они повышают устойчивость кожи к УФ-излучению и другим негативным факторам, восстанавливают способность стареющих стволовых клеток человека формировать многослойный эпидермис.С возрастом стволовые клетки человека снижают скорость своего деления и хуже отвечают на стимуляцию. Их низкая активность приводит к тому, что обновление тканей замедляется, в них начинают накапливаться дефекты. К примеру, в волокнах коллагена появляются так называемые сшивки, из-за чего снижается упругость и эластичность кожи, на лице появляются признаки птоза. Эксперименты показали, что экстракты стволовых клеток растений способны стимулировать деление стволовых клеток кожи человека, а также могут повышать эффективность регенерации и скорость обновления клеток зрелой кожи. Это не только позволяет добиваться омолаживающего эффекта, но и значительно повышает эффективность таких процедур, как пилинги, дермабразия и лазерная шлифовка, основанных на стимуляции обновления кожи.Так, например, после 20 дней применения экстракта стволовых клеток эдельвейса на поверхности кожи в зоне вокруг глаз зарегистрировано уменьшение глубины контурных морщин на 15%. Под воздействием экстракта стволовых клеток яблока у человека на 80% увеличивается количество собственных стволовых клеток, а после облучения УФ-лучами выживает приблизительно в 7 раз больше клеток. Эти и другие примеры успешного применения экстрактов стволовых клеток позволили начать использование стволовых клеток растений для создания различных anti-age-средств.Растительные стволовые клетки – это реальное достижение современной биотехнологии, которое успешно используется при разработке косметики интенсивного действия.Способы получения растительных стволовых клеток
Необходимо подчеркнуть, что клеточная масса – растительные клетки целиком – в косметические средства не вводится. Обычно используют лишь активные ингредиенты стволовых клеток растений, экстракты которых можно получить двумя способами.Первый способ – прямое экстрагирование из зон активного роста растений. Для этого почки, побеги, корешки и проростки собирают ранней весной, когда растения обладают максимальным энергетическим потенциалом. Собранный материал очищают, измельчают и помещают в водно-спиртовую или водно-глицериновую смесь. Полученные таким образом экстракты имеют особую ценность, так как в них сохраняется комплекс активных компонентов в естественном сочетании. Однако этот способ слишком затратный и трудоемкий, а потому непригоден для массового производства.
Второй способ – биотехнологический синтез. Сначала из исходного растения получают жизнеспособную ткань, затем в ней делается небольшой надрез. Клетки в месте повреждения начинают активно делиться и образуют бесцветную клеточную массу (каллус), которая обладает свойствами стволовых клеток. Затем каллус помещают в питательную среду для наращивания биомассы. В заключение из биомассы выделяют нужные компоненты, очищают и стабилизируют их для дальнейшего использования в косметике. Основное преимущество биотехнологического способа – возможность получения больших количеств стандартизованных экстрактов недифференцированных клеток растения.
Этот способ получения экстрактов имеет свои сложности, что делает конечный продукт достаточно дорогим. Каллусные клетки вне организма растут хаотично, в процессе культивирования постепенно теряют способность к регенерации, являются генетически нестабильными (число и «качество» хромосом в них может сильно различаться), гетерогенны по возрасту. И главное, для каждого вида растений приходится подбирать свои, особые условия культивирования. Это замедляет работу по расширению перечня культур недифференцированных клеток растений.
Благодаря биотехнологическому методу можно получать экстракты растительных стволовых клеток с заранее заданными свойствами и четко определенным количеством активных веществ. Культивируя растительные стволовые клетки в защищенных и строго контролируемых условиях, удается добиться производства этих веществ со значительной биологической активностью. Искусственные условия культивирования позволяют получать стволовой материал из очень редких растений, например из высокогорного эдельвейса или глубоководных арктических водорослей, извлекая необходимое количество сырья из небольших фрагментов растений, и при этом сохранять окружающую среду.
Резюме
Использование в составе косметических средств растительных стволовых клеток – очень перспективное направление с нескольких точек зрения. Все продукты, их содержащие:- безопасны: не содержат пестицидов, тяжелых металлов и других вредных для организма веществ;
- доступны: нет сезонной и климатической зависимости, а также существует возможность получения растительного материала редких растений;
- стандартизированы: современные технологии позволяют получать экстракт с четко определенным количеством активных веществ и значительной биологической активностью.
Поделись ссылкой с друзьями
milomarket.com
Эмбриональные стволовые клетки — WiKi
Данные в этой статье приведены по состоянию на 2010. Вы можете помочь, обновив информацию в статье. |
Эмбриональные стволовые клетки (ЭСК) — тип плюрипотентных клеток млекопитающих, поддерживаемых в культуре, которые получают из внутренней клеточной массы бластоцисты на ранней стадии развития эмбриона[1]. Эмбрион человека достигает стадии бластоцисты спустя 5-6 дней после оплодотворения, внутренняя клеточная масса бластоцисты человека состоит из 50-150 клеток.
Эмбриональные стволовые клетки являются плюрипотентными. Это означает, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму. Плюрипотентные клетки способны к дифференцировке во все типы клеток взрослого организма, которых насчитывается около 220. Свойство плюрипотентности отличает эмбриональные стволовые клетки от мультипотентных клеток, которые могут дать начало лишь ограниченному количеству типов клеток. В отсутствие стимулов к дифференцировке in vitro эмбриональные стволовые клетки могут поддерживать плюрипотентность в течение многих клеточных делений. Это свойство называется способность к самообновлению (англ. self-renewal). Наличие плюрипотентных клеток у взрослого организма остается объектом научных дискуссий, хотя исследования показали, что существует возможность получения плюрипотентных клеток из фибробластов взрослого человека в лабораторных условиях в процессе так называемого репрограммирования клеток [2].
Ввиду пластичности и потенциально неограниченного потенциала самообновления эмбриональные стволовые клетки имеют перспективы применения в регенеративной медицине и замещении поврежденных тканей. Однако в настоящий момент не существует никакого медицинского применения эмбриональных стволовых клеток. Стволовые клетки взрослых организмов и стволовые клетки костного мозга используются для терапии различных заболеваний. Некоторые заболевания крови и иммунной системы (в том числе генетические) могут быть излечены стволовыми клетками неэмбрионального происхождения.[источник не указан 2128 дней] Разрабатываются методы лечения с помощью стволовых клеток таких патологий, как онкологические заболевания, юношеский диабет, синдром Паркинсона, слепота и нарушения работы спинного мозга[источник не указан 2128 дней]
Существуют как этические, так и технические затруднения, связанные с трансплантацией гематопоэтических стволовых клеток. Эти проблемы связаны, в том числе, с гистосовместимостью. Такие проблемы могут быть разрешены при использовании собственных стволовых клеток или путём терапевтического клонирования.
Для дифференцировки эмбриональных стволовых клеток достаточно подействовать на них факторами роста. Например, эмбриональные стволовые клетки мыши, дифференцированные in vitro в нейральные клетки, были использованы для восстановления повреждённого спинного мозга крысы. Для получения гепатоцитов был использован бутират натрия, а для получения гемопоэтических стволовых клеток эмбриональные стволовые клетки трансфецировали генами Cdx, HoxB4.
История исследований и разработок
Выделение и культура in vitro
Стволовые клетки были выделены при анализе тератокарциномы. В 1964 году исследователи показали, что клетки тератокарциномы остаются недифференцированными в культуре клеток. Такие стволовые клетки называют эмбриональными клетками карциномы.[3] Исследователи показали, что первичные эмбриональные зародышевые клетки могут размножаться в культуре и могут образовывать разные типы клеток.
Эмбриональные стволовые клетки выделили из мышиных эмбрионов в 1981 году Мартин Эванс и Мэтью Кауфман, а также независимо от них Гэйл Мартин[4][5]. Прорыв в исследовании эмбриональных стволовых клеток человека произошел в ноябре 1998 года в группе Джеймса Томсона в Университете Висконсина. Ученые выделили такие клетки из бластоцисты человека[6].
Загрязнения веществами, которые используют для поддержания клеточных культур
Сетевая версия журнала Nature Medicine опубликовало в январе 2005 года материал, согласно которому стволовые клетки человека, которые доступны для исследований, финансируемых федеральными грантами, загрязнены молекулами сред для культивирования клеток животного происхождения[7]. Для поддержания плюрипотентности активно делящихся клеток часто используют клетки животного происхождения (обычно это клетки мышей). Выяснилось, что это порождает ряд проблем; в частности, оказалось, что сиаловая кислота животного происхождения сужает возможности применения эмбриональных стволовых клеток для терапевтических целей[8].
В работе, опубликованной в журнале Lancet Medical Journal 7 марта 2005 года[9], детально описана методика культивирования новой линии стволовых клеток в среде, полностью свободной от клеток и сыворотки животного происхождения. После более чем шестимесячного периода культивирования в недифференцированном состоянии эти клетки могли дифференцироваться в клетки всех трех зародышевых листков как в составе тератом, так и в культуре.
Терапевтические применения
23 января 2009 года началась первая фаза клинических испытаний по трансплантации популяции человеческих эмбриональных стволовых клеток пациентам с травмами спинного мозга[10]. Данное исследование было основано на результатах, полученных группой Ханса Кейрстеда с соавт. в университете города Ирвин, Калифорния, США, финансируемых Корпорацией Geron (Menlo Park, Калифорния, США). Результаты данного эксперимента показали улучшение локомоторной проводимости у крыс с травмами спинного мозга. На седьмой день после трансплантации, эмбриональные стволовые клетки человека дифференцировались в олигодендроциты.[11]. В том же году было начато клиническое исследование по использованию дифференцированных производных ЭСК человека для терапии наследственной макулодистрофии сетчатки глаза, которое успешно завершилось в 2015 году [12]. Сейчас мультицентровое продолжение исследований проходит в США, Англии, Австралии, странах Азии. В 2015 году американская компания Viacyte начала клинические испытания лечения диабета с использованием клеток поджелудочной железы, полученных из эмбриональных стволовых клеток человека[13].
В Российской Федерации терапевтическое применение и изучение эмбриональных стволовых клеток человека будет регулироваться законом «Об обращении биомедицинских клеточных продуктов»[14], который должен быть рассмотрен Госдумой РФ в середине 2016 года.
Индуцированные плюрипотентные стволовые клетки
Индуцированные плюрипотентные стволовые клетки (induced pluripotent stem cells, iPSC или iPS) удалось получить из клеток различных тканей (в первую очередь фибробластов) с помощью их репрограммирования методами генетической инженерии.
В ранних работах iPS пытались получить путём слияния «взрослых» клеток с ЭСК[15]. В 2006 году были получены iPS из сперматогониев мышей и людей[16]
В 2006 году были разработаны методы репрограммирования клеток путём введения в них генов, кодирующих транскрипционные факторы, характерные для плюрипотентных клеток, (в первую очередь, генов транскрипционных факторов Oct4, Sox2, Klf4, c-Myc и Nanog) с помощью лентивирусов и других векторов"[17][18] Репрограммирование клеток с целью превращения их в iPS было признано журналом Science главным научным прорывом 2008 г[19]
В 2009 году была опубликована работа, в которой с помощью метода тетраплоидной комплементации впервые было показано, что iPS могут давать полноценный организм, в том числе и клетки зародышевого пути[20]. iPS, полученные из фибробластов кожи мышей с помощью трансформации с использованием ретровирусного вектора, в некотором проценте случаев дали здоровых взрослых мышей, которые были способны нормально размножаться. Таким образом, впервые были получены клонированные животные без примеси генетического материала яйцеклеток (при стандартной процедуре клонирования митохондриальная ДНК передается потомству от яйцеклетки реципиента). В 2012 г за разработку технологии клонирования и генетического репрграммирования Нобелевская премия по физиологии и медицине была вручена Джону Гердону (Англия) и Шинья Яманака (Япония). А в 2014 г проф. М Такахаши и Ш. Яманака впервые произвели трансплантацию пигментного эпителия сетчатки глаза, полученного из iPS клеток пациентке с возрастной дегенерацией сетчатки[21].
В Японии есть государственная программа, предусматривающая, чтобы в будущем у 100% населения были банки IPS клеток[22][неавторитетный источник? 17 дней].
См. также
Примечания
- ↑ Киселев С.Л., Лагарькова М.А. Эмбриональные стволовые клетки человека // Природа. — 2006. — Т. 10. — С. 49-64.
- ↑ Department of Stem Cell Biology, Institute for Frontier Medical Sciences, Kyoto University, Kyoto (August 25, 2006). «Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors». Cell.
- ↑ Andrews P, Matin M, Bahrami A, Damjanov I, Gokhale P, Draper J (2005). «Embryonic stem (ES) cells and embryonal carcinoma (EC) cells: opposite sides of the same coin». Biochem Soc Trans 33 (Pt 6): 1526–30. DOI:10.1042/BST20051526. PMID 16246161.
- ↑ Evans M, Kaufman M (1981). «Establishment in culture of pluripotential cells from mouse embryos». Nature 292 (5819): 154–6. DOI:10.1038/292154a0. PMID 7242681.
- ↑ Martin G (1981). «Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells». Proc Natl Acad Sci U S A 78 (12): 7634–8. DOI:10.1073/pnas.78.12.7634. PMID 6950406.
- ↑ Thomson J, Itskovitz-Eldor J, Shapiro S, Waknitz M, Swiergiel J, Marshall V, Jones J (1998). «Embryonic stem cell lines derived from human blastocysts». Science 282 (5391): 1145–7. DOI:10.1126/science.282.5391.1145. PMID 9804556.
- ↑ Ebert, Jessica (24 January 2005). «Human stem cells trigger immune attack». News from "Nature" (Nature Publishing Group). DOI:10.1038/news050124-1. Проверено 2015-03-17.
- ↑ Access to articles : Nature Medicine (Проверено 17 марта 2015)
- ↑ Irina Klimanskaya (7 May 2005). «Human embryonic stem cells derived without feeder cells». The Lancet 365 (9471): 1636—1641. DOI:10.1016/S0140-6736(05)66473-2. Проверено 2015-03-17.
- ↑ FDA approves human embryonic stem cell study - CNN.com. Архивировано 28 марта 2012 года.
- ↑ Keirstead HS, Nistor G, Bernal G, et al (May 2005). «Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury». J. Neurosci. 25 (19): 4694–705. DOI:10.1523/JNEUROSCI.0311-05.2005. PMID 15888645.
- ↑ name="PMID 25937371"
- ↑ VC-01 Diabetes Therapy — Viacyte, Inc
- ↑ Проект Федерального закона от 18 января 2013 г
- ↑ http://elementy.ru/news/164751 Источником эмбриональных стволовых клеток может стать человеческая кожа
- ↑ Элементы - новости науки: Получены «этичные» эмбриональные стволовые клетки
- ↑ http://elementy.ru/news/430912 Позже было показано, что репрограммирование может происходить при временной экспрессии указанных генов, без их интеграции в геном
- ↑ Matthias Stadtfeld, Masaki Nagaya, Jochen Utikal, Gordon Weir, Konrad Hochedlinger. Induced Pluripotent Stem Cells Generated Without Viral Integration // Science. V. 322. P. 945—949 (7 November 2008). DOI: 10.1126/science.1162494.
- ↑ Год перепрограммированных клеток. П. Петров
- ↑ Xiao-yang Zhao1, Wei Li1, Zhuo Lv1,, Lei Liu1, Man Tong1, Tang Hai1, Jie Hao1, Chang-long Guo1, Qing-wen Ma, Liu Wang, Fanyi Zeng, Qi Zhou. iPS cells produce viable mice through tetraploid complementation. Nature 461, (3 September 2009), 86-90
- ↑ Transplantation of iPSC-derived RPE sheet into first AMD patient Center for Developmental Biology | RIKEN CDB
- ↑ Как делают трехмерные органы, и кому они нужны
Ссылки
ru-wiki.org
Стволовые клетки — Википедия РУ
Стволовые клетки можно разделить на три основные группы в зависимости от источника их получения: эмбриональные, фетальные и постнатальные (стволовые клетки взрослого организма).
Эмбриональные стволовые клетки
Эмбриональные стволовые клетки (ЭСК) образуют внутреннюю клеточную массу (ВКМ), или эмбриобласт, на ранней стадии развития эмбриона. Они являются плюрипотентными. Важный плюс ЭСК состоит в том, что они не экспрессируют HLA (human leucocyte antigens), то есть не вырабатывают антигены тканевой совместимости. Каждый человек обладает уникальным набором этих антигенов, и их несовпадение у донора и реципиента является важнейшей причиной несовместимости при трансплантации. Соответственно, шанс того, что донорские эмбриональные клетки будут отторгнуты организмом реципиента очень невысок. При пересадке иммунодефицитным животным эмбриональные стволовые клетки способны образовывать опухоли сложного (многотканевого) строения — тератомы, некоторые из них могут стать злокачественными. Достоверных данных, о том как ведут себя эти клетки в иммунокомпетентном организме, например, в организме человека, нет. Вместе с тем, следует отметить, что клинические испытания с применением дифференцированных дериватов (производных клеток) ЭСК уже начаты.
Одним из главных недостатков ЭСК является невозможность использования аутогенного, то есть собственного материала, при трансплантации, поскольку выделение ЭСК из эмбриона несовместимо с его дальнейшим развитием.
Фетальные стволовые клетки
Фетальные стволовые клетки получают из плодного материала после аборта (обычно срок гестации, то есть внутриутробного развития плода, составляет 9—12 недель)[27]. Фетальные стволовые клетки являются смесью мультипотентных и унипотентных стволовых клеток[28][29]. Естественно, изучение и использование такого биоматериала также порождает этические проблемы. Проблемой является и нелегальный рынок препаратов фетальных стволовых клеток в России[30]. Британская компания ReNeuron исследует возможности использования фетальных стволовых клеток для терапии инсульта. Эти клетки уже начали дифференцировку, и, следовательно, каждая из них, во-первых, может пройти только ограниченное число делений, и, во-вторых, дать начало не любым, а достаточно определённым видам специализированных клеток. Так, из клеток фетальной печени могут развиться специализированные клетки печени и кроветворные клетки. Из фетальной нервной ткани, соответственно, развиваются более специализированные нервные клетки.
Постнатальные стволовые клетки
Несмотря на то, что стволовые клетки зрелого организма обладают меньшей потентностью в сравнении с эмбриональными и фетальными стволовыми клетками, то есть могут порождать меньшее количество различных типов клеток, этический аспект их исследования и применения не вызывает серьёзной полемики. Кроме того, возможность использования аутогенного материала обеспечивает эффективность и безопасность лечения. Стволовые клетки взрослого организма можно подразделить на три основных группы: гемопоэтические (кроветворные), мультипотентные мезенхимальные (стромальные) и тканеспецифичные прогениторные клетки.
Иногда в отдельную группу выделяют клетки пуповинной крови, поскольку они являются наименее дифференцированными из всех клеток зрелого организма[источник не указан 1665 дней], то есть обладают наибольшей потентностью. Пуповинная кровь в основном содержит гемопоэтические стволовые клетки, а также мультипотентные мезенхимальные, но в ней присутствуют малые количества других разновидностей стволовых клеток, при определённых условиях способные дифференцироваться в клетки различных органов и тканей.
Гемопоэтические стволовые клетки
Гемопоэтические стволовые клетки (ГСК) — мультипотентные стволовые клетки, дающие начало всем клеткам крови миелоидного (моноциты, макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты и тромбоциты, дендритные клетки) и лимфоидного рядов (Т-лимфоциты, В-лимфоциты и естественные киллеры). Определение гемопоэтических клеток было основательно пересмотрено в течение последних 20 лет. Гемопоэтическая ткань содержит клетки с долгосрочными и краткосрочными возможностями к регенерации, включая мультипотентные, олигопотентные и клетки-предшественники. Миелоидная ткань содержит одну ГСК на 10 000 клеток. ГСК являются неоднородной популяцией. Различают три субпопуляции ГСК, в соответствии с пропорциональным отношением лимфоидного потомства к миелоидному (Л/M). У миелоидно ориентированных ГСК низкое Л/М соотношение (>0, <3), у лимфоидно ориентированных — высокое (>10). Третья группа состоит из «сбалансированных» ГСК, для которых 3 ≤ Л/M ≤ 10. В настоящее время активно исследуются свойства различных групп ГСК, однако промежуточные результаты показывают, что только миелоидно ориентированные и «сбалансированные» ГСК способны к продолжительному самовоспроизведению. Кроме того, эксперименты по трансплантации показали, что каждая группа ГСК преимущественно воссоздаёт свой тип клеток крови, что позволяет предположить наличие наследуемой эпигенетической программы для каждой субпопуляции.
Популяция ГСК формируется во время эмбриогенеза, то есть эмбрионального развития. Доказано, что у млекопитающих первые ГСК обнаруживаются в областях мезодермы, называемых аорта, гонада и мезонефрос, до формирования костного мозга популяция расширяется в фетальной печени. Такие исследования способствуют пониманию механизмов, ответственных за генезис (формирование) и расширение популяции ГСК, и, соответственно, открытию биологических и химических агентов (действующих веществ), которые в конечном счёте могут быть использованы для культивации ГСК in vitro.
Основным источником ГСК является костный мозг. Этот источник и сегодня наиболее широко используется в трансплантологии (см. Трансплантация гемопоэтических стволовых клеток). ГСК располагаются в костном мозге у взрослых, включая тазовые кости, рёбра, грудину и другие кости. Клетки могут быть получены непосредственно из тазовых костей при помощи иглы и шприца или из крови, после предварительной обработки цитокинами, включая G-CSF (гранулоцитарный колониестимулирующий фактор), способствующий выходу стволовых клеток из костного мозга.
Мультипотентные мезенхимальные стромальные клетки
Мультипотентные мезенхимальные стромальные клетки (ММСК) — мультипотентные стволовые клетки, способные дифференцироваться в остеобласты (клетки костной ткани), хондроциты (хрящевые клетки) и адипоциты (жировые клетки).
Предшественниками ММСК в эмбриогенный период развития являются мезенхимальные стволовые клетки (МСК). Они могут быть обнаружены в местах распространения мезенхимы, то есть зародышевой соединительной ткани.
Основным источником ММСК является костный мозг. Кроме того, они обнаружены в жировой ткани и ряде других тканей с хорошим кровоснабжением. Существует ряд доказательств того, что естественная тканевая ниша ММСК расположена периваскулярно — вокруг кровеносных сосудов. Кроме того, ММСК были обнаружены в пульпе молочных зубов, амниотической (околоплодной) жидкости, пуповинной крови и вартоновом студне. Эти источники исследуются, но редко применяются на практике. Например, выделение молодых ММСК из вартонова студня представляет собой крайне трудоёмкий процесс, поскольку клетки в нём также располагаются периваскулярно. В 2005—2006 годах специалисты по ММСК официально определили ряд параметров, которым должны соответствовать клетки, чтобы отнести их к популяции ММСК. Были опубликованы статьи, в которых представлен иммунофенотип ММСК и направления ортодоксальной дифференцировки. К ним относится дифференцировка в клетки костной, жировой и хрящевой тканей. Был проведён ряд экспериментов по дифференцировке ММСК в нейроноподобные клетки, но исследователи по-прежнему сомневаются, что полученные нейроны являются функциональными. Эксперименты также проводятся в области дифференцировки ММСК в миоциты — клетки мышечной ткани. Важнейшей и наиболее перспективной областью клинического применения ММСК является которансплантация совместно с ГСК в целях улучшения приживления образца костного мозга или стволовых клеток пуповинной крови. Многочисленные исследования показали, что ММСК человека могут избегать отторжения при трансплантации, вступать во взаимодействие с дендритными клетками и Т-лимфоцитами и создавать иммуносупрессивную микросреду посредством выработки цитокинов. Было доказано, что иммуномодулирующие функции ММСК человека повышаются, когда их пересаживают в воспалённую среду с повышенным уровнем гамма-интерферона. Другие исследования противоречат этим выводам, что обусловлено гетерогенной природой изолированных МСК и значительными различиями между ними, в зависимости от способа культивирования.
МСК могут быть активированы в случае необходимости. Однако эффективность их использования относительно низка. Так, к примеру, повреждение мышц даже при трансплантации МСК заживает очень медленно. В настоящее время проводятся исследования по активации МСК. Ранее проведённые исследования по внутривенной трансплантации МСК показали, что этот способ трансплантации часто приводит к кризу отторжения и сепсису. Сегодня признано, что заболевания периферических тканей, например, воспаление кишечника лучше лечить не трансплантацией, а методами, повышающими локальную концентрацию МСК.
Однако, исследования эффективности применения МСК для реэпителизации поврежденных кожных покровов, например, при синдроме диабетической стопы, показали свою результативность в клинических исследованиях[31].
Тканеспецифичные прогениторные клетки
Тканеспецифичные прогениторные клетки (клетки-предшественницы) — малодифференцированные клетки, которые располагаются в различных тканях и органах и отвечают за обновление их клеточной популяции, то есть замещают погибшие клетки. К ним, например, относятся миосателлитоциты (предшественники мышечных волокон), клетки-предшественницы лимфо- и миелопоэза. Эти клетки являются олиго- и унипотентными и их главное отличие от других стволовых клеток в том, что клетки-предшественницы могут делиться лишь определённое количество раз, в то время как другие стволовые клетки способны к неограниченному самообновлению. Поэтому их принадлежность к истинно стволовым клеткам подвергается сомнению. Отдельно исследуются нейральные стволовые клетки, которые также относятся к группе тканеспецифичных. Они дифференцируются в процессе развития эмбриона и в плодный период, в результате чего происходит формирование всех нервных структур будущего взрослого организма, включая центральную и периферическую нервные системы. Эти клетки были обнаружены и в ЦНС взрослого организма, в частности, в субэпендимальной зоне, в гиппокампе, обонятельном мозге и т. д. Несмотря на то, что большая часть погибших нейронов не замещается, процесс нейрогенеза во взрослой ЦНС всё-таки возможен за счёт нейральных стволовых клеток, то есть популяция нейронов может «восстанавливаться», однако это происходит в таком объёме, что не сказывается существенно на исходах патологических процессов.
В 2012 году для глиобластомы, папилломы и карциномы кожи и аденомы кишечника было доказано существование ограниченного пула особых раковых стволовых клеток (англ.)русск., которые являются предшественниками других клеток, и именно они отвечают за образование и рост опухоли[32].
Сейчас в СМИ активно идут дебаты, привели ли инъекции эмбриональных стволовых клеток к заболеванию раком и последующей преждевременной смерти многих известных людей, в основном артистов — Александра Абдулова, Веры Глаголевой, Ильи Олейникова, Любови Полищук, Дмитрия Хворостовского, Жанны Фриске, Михаила Задорнова, Валентины Толауновой, Клары Лучко, Анны Самохиной, Олега Янковского и других[1] Анализы знаменитых пациентов показывали, что в организме актеров происходит обновление, ускорение жизнедеятельности. Однако вскорости появилась страшная статистика: те, кто применял инъекции стволовых клеток, сначала реально молодели, а потом очень быстро «сгорали» от рака, в основном глоибластомы (рака мозга), заболеванием во многом загадочным, которое характеризуется множественной генетической поломкой в клетках глии мозга, что приводит к быстрому экспансивному росту злокачественной опухоли.
После инъекций стволовых клеток, начинается активное деление не только здоровых, но и патологичных клеток организма, включая злокачественные, которых тем больше, чем старше организм. Временный импульс молодости проходит и возвращается упадок, а потом проявляются разные последствия. Так, если введенные клетки приживаются, то вследствие противоречия с клетками организма и иммунной системой они сами часто перерождаются в раковые. В любом случае это стрессовое воздействие на иммунитет, на фоне которого способна реализоваться патология.
В России
Распоряжением Правительства РФ от 23 декабря 2009 г. № 2063-р (п.6) Минздравосцразвития России, Минпромторгу России и Минобрнауки России было поручено до конца 2010 г. разработать и представить на рассмотрение в Государственную думу РФ проект закона «О применении биомедицинских технологий в медицинской практике», регламентирующего медицинское применение стволовых клеток[40][41], как одной из биомедицинских технологий. Поскольку законопроект вызвал[42] возмущение общественности и ученых, он был отправлен на доработку и на тот момент не принят.
1 июля 2010 года Федеральная служба по надзору в сфере здравоохранения и социального развития выдала первое[уточнить] разрешение на применение новой медицинской технологии ФС № 2010/255 (лечение собственными стволовыми клетками).[43]
3 февраля 2011 года Федеральная служба по надзору в сфере здравоохранения и социального развития выдала разрешение на применение новой медицинской технологии ФС № 2011/002 (лечение донорскими стволовыми клетками следующих патологий: возрастные изменения кожи лица второй или третьей степени, наличие раневого дефекта кожи, трофической язвы, лечение аллопеции, атрофическое поражение кожи, в том числе атрофические полосы (striae), ожоги, диабетической стопы)
В 2015 Госдума приняла в первом чтении проект закона «О биомедицинских клеточных продуктах», регламентирующего разработку, испытания, регистрацию, производство, хранение и продажу стволовых и других клеточных продуктов[44]. В 2016 году данный закон, легализующий использование клеточных технологий, включая применение стволовых клеток[45], был окончательно принят Госдумой, одобрен Советом Федерации и вступил в силу с января 2017 года[46][47].
На Украине
С апреля 2013 года Минздрав Украины разрешил проведение клинических испытаний (Приказ МЗ Украины № 630 «О проведении клинических испытаний стволовых клеток», 2007 г.[48]) по лечению следующих патологий с применением стволовых клеток: панкреонекроз, ожоговая болезнь, хроническая ишемия нижних конечностей.[49]
http-wikipediya.ru
Индуцированные плюрипотентные стволовые клетки Википедия
Данные в этой статье приведены по состоянию на 2010. Вы можете помочь, обновив информацию в статье. |
Эмбриональные стволовые клетки (ЭСК) — тип плюрипотентных клеток млекопитающих, поддерживаемых в культуре, которые получают из внутренней клеточной массы бластоцисты на ранней стадии развития эмбриона[1]. Эмбрион человека достигает стадии бластоцисты спустя 5-6 дней после оплодотворения, внутренняя клеточная масса бластоцисты человека состоит из 50-150 клеток.
Эмбриональные стволовые клетки являются плюрипотентными. Это означает, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму. Плюрипотентные клетки способны к дифференцировке во все типы клеток взрослого организма, которых насчитывается около 220. Свойство плюрипотентности отличает эмбриональные стволовые клетки от мультипотентных клеток, которые могут дать начало лишь ограниченному количеству типов клеток. В отсутствие стимулов к дифференцировке in vitro эмбриональные стволовые клетки могут поддерживать плюрипотентность в течение многих клеточных делений. Это свойство называется способность к самообновлению (англ. self-renewal). Наличие плюрипотентных клеток у взрослого организма остается объектом научных дискуссий, хотя исследования показали, что существует возможность получения плюрипотентных клеток из фибробластов взрослого человека в лабораторных условиях в процессе так называемого репрограммирования клеток [2].
Ввиду пластичности и потенциально неограниченного потенциала самообновления эмбриональные стволовые клетки имеют перспективы применения в регенеративной медицине и замещении поврежденных тканей. Однако в настоящий момент не существует никакого медицинского применения эмбриональных стволовых клеток. Стволовые клетки взрослых организмов и стволовые клетки костного мозга используются для терапии различных заболеваний. Некоторые заболевания крови и иммунной системы (в том числе генетические) могут быть излечены стволовыми клетками неэмбрионального происхождения.[источник не указан 2163 дня] Разрабатываются методы лечения с помощью стволовых клеток таких патологий, как онкологические заболевания, юношеский диабет, синдром Паркинсона, слепота и нарушения работы спинного мозга[источник не указан 2163 дня]
Существуют как этические, так и технические затруднения, связанные с трансплантацией гематопоэтических стволовых клеток. Эти проблемы связаны, в том числе, с гистосовместимостью. Такие проблемы могут быть разрешены при использовании собственных стволовых клеток или путём терапевтического клонирования.
Для дифференцировки эмбриональных стволовых клеток достаточно подействовать на них факторами роста. Например, эмбриональные стволовые клетки мыши, дифференцированные in vitro в нейральные клетки, были использованы для восстановления повреждённого спинного мозга крысы. Для получения гепатоцитов был использован бутират натрия, а для получения гемопоэтических стволовых клеток эмбриональные стволовые клетки трансфецировали генами Cdx, HoxB4.
История исследований и разработок
Выделение и культура in vitro
Стволовые клетки были выделены при анализе тератокарциномы. В 1964 году исследователи показали, что клетки тератокарциномы остаются недифференцированными в культуре клеток. Такие стволовые клетки называют эмбриональными клетками карциномы.[3] Исследователи показали, что первичные эмбриональные зародышевые клетки могут размножаться в культуре и могут образовывать разные типы клеток.
Эмбриональные стволовые клетки выделили из мышиных эмбрионов в 1981 году Мартин Эванс и Мэтью Кауфман, а также независимо от них Гэйл Мартин[4][5]. Прорыв в исследовании эмбриональных стволовых клеток человека произошел в ноябре 1998 года в группе Джеймса Томсона в Университете Висконсина. Ученые выделили такие клетки из бластоцисты человека[6].
Загрязнения веществами, которые используют для поддержания клеточных культур
Сетевая версия журнала Nature Medicine опубликовало в январе 2005 года материал, согласно которому стволовые клетки человека, которые доступны для исследований, финансируемых федеральными грантами, загрязнены молекулами сред для культивирования клеток животного происхождения[7]. Для поддержания плюрипотентности активно делящихся клеток часто используют клетки животного происхождения (обычно это клетки мышей). Выяснилось, что это порождает ряд проблем; в частности, оказалось, что сиаловая кислота животного происхождения сужает возможности применения эмбриональных стволовых клеток для терапевтических целей[8].
В работе, опубликованной в журнале Lancet Medical Journal 7 марта 2005 года[9], детально описана методика культивирования новой линии стволовых клеток в среде, полностью свободной от клеток и сыворотки животного происхождения. После более чем шестимесячного периода культивирования в недифференцированном состоянии эти клетки могли дифференцироваться в клетки всех трех зародышевых листков как в составе тератом, так и в культуре.
Терапевтические применения
23 января 2009 года началась первая фаза клинических испытаний по трансплантации популяции человеческих эмбриональных стволовых клеток пациентам с травмами спинного мозга[10]. Данное исследование было основано на результатах, полученных группой Ханса Кейрстеда с соавт. в университете города Ирвин, Калифорния, США, финансируемых Корпорацией Geron (Menlo Park, Калифорния, США). Результаты данного эксперимента показали улучшение локомоторной проводимости у крыс с травмами спинного мозга. На седьмой день после трансплантации, эмбриональные стволовые клетки человека дифференцировались в олигодендроциты.[11]. В том же году было начато клиническое исследование по использованию дифференцированных производных ЭСК человека для терапии наследственной макулодистрофии сетчатки глаза, которое успешно завершилось в 2015 году [12]. Сейчас мультицентровое продолжение исследований проходит в США, Англии, Австралии, странах Азии. В 2015 году американская компания Viacyte начала клинические испытания лечения диабета с использованием клеток поджелудочной железы, полученных из эмбриональных стволовых клеток человека[13].
В Российской Федерации терапевтическое применение и изучение эмбриональных стволовых клеток человека будет регулироваться законом «Об обращении биомедицинских клеточных продуктов»[14], который должен быть рассмотрен Госдумой РФ в середине 2016 года.
Индуцированные плюрипотентные стволовые клетки
Индуцированные плюрипотентные стволовые клетки (induced pluripotent stem cells, iPSC или iPS) удалось получить из клеток различных тканей (в первую очередь фибробластов) с помощью их репрограммирования методами генетической инженерии.
В ранних работах iPS пытались получить путём слияния «взрослых» клеток с ЭСК[15]. В 2006 году были получены iPS из сперматогониев мышей и людей[16]
В 2006 году были разработаны методы репрограммирования клеток путём введения в них генов, кодирующих транскрипционные факторы, характерные для плюрипотентных клеток, (в первую очередь, генов транскрипционных факторов Oct4, Sox2, Klf4, c-Myc и Nanog) с помощью лентивирусов и других векторов"[17][18] Репрограммирование клеток с целью превращения их в iPS было признано журналом Science главным научным прорывом 2008 г[19]
В 2009 году была опубликована работа, в которой с помощью метода тетраплоидной комплементации впервые было показано, что iPS могут давать полноценный организм, в том числе и клетки зародышевого пути[20]. iPS, полученные из фибробластов кожи мышей с помощью трансформации с использованием ретровирусного вектора, в некотором проценте случаев дали здоровых взрослых мышей, которые были способны нормально размножаться. Таким образом, впервые были получены клонированные животные без примеси генетического материала яйцеклеток (при стандартной процедуре клонирования митохондриальная ДНК передается потомству от яйцеклетки реципиента). В 2012 г за разработку технологии клонирования и генетического репрграммирования Нобелевская премия по физиологии и медицине была вручена Джону Гердону (Англия) и Шинья Яманака (Япония). А в 2014 г проф. М Такахаши и Ш. Яманака впервые произвели трансплантацию пигментного эпителия сетчатки глаза, полученного из iPS клеток пациентке с возрастной дегенерацией сетчатки[21].
В Японии есть государственная программа, предусматривающая, чтобы в будущем у 100% населения были банки IPS клеток[22][неавторитетный источник? 52 дня].
См. также
Примечания
- ↑ Киселев С.Л., Лагарькова М.А. Эмбриональные стволовые клетки человека // Природа. — 2006. — Т. 10. — С. 49-64.
- ↑ Department of Stem Cell Biology, Institute for Frontier Medical Sciences, Kyoto University, Kyoto (August 25, 2006). «Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors». Cell.
- ↑ Andrews P, Matin M, Bahrami A, Damjanov I, Gokhale P, Draper J (2005). «Embryonic stem (ES) cells and embryonal carcinoma (EC) cells: opposite sides of the same coin». Biochem Soc Trans 33 (Pt 6): 1526–30. DOI:10.1042/BST20051526. PMID 16246161.
- ↑ Evans M, Kaufman M (1981). «Establishment in culture of pluripotential cells from mouse embryos». Nature 292 (5819): 154–6. DOI:10.1038/292154a0. PMID 7242681.
- ↑ Martin G (1981). «Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells». Proc Natl Acad Sci U S A 78 (12): 7634–8. DOI:10.1073/pnas.78.12.7634. PMID 6950406.
- ↑ Thomson J, Itskovitz-Eldor J, Shapiro S, Waknitz M, Swiergiel J, Marshall V, Jones J (1998). «Embryonic stem cell lines derived from human blastocysts». Science 282 (5391): 1145–7. DOI:10.1126/science.282.5391.1145. PMID 9804556.
- ↑ Ebert, Jessica (24 January 2005). «Human stem cells trigger immune attack». News from "Nature" (Nature Publishing Group). DOI:10.1038/news050124-1. Проверено 2015-03-17.
- ↑ Access to articles : Nature Medicine (Проверено 17 марта 2015)
- ↑ Irina Klimanskaya (7 May 2005). «Human embryonic stem cells derived without feeder cells». The Lancet 365 (9471): 1636—1641. DOI:10.1016/S0140-6736(05)66473-2. Проверено 2015-03-17.
- ↑ FDA approves human embryonic stem cell study - CNN.com. Архивировано 28 марта 2012 года.
- ↑ Keirstead HS, Nistor G, Bernal G, et al (May 2005). «Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury». J. Neurosci. 25 (19): 4694–705. DOI:10.1523/JNEUROSCI.0311-05.2005. PMID 15888645.
- ↑ name="PMID 25937371"
- ↑ VC-01 Diabetes Therapy — Viacyte, Inc
- ↑ Проект Федерального закона от 18 января 2013 г
- ↑ http://elementy.ru/news/164751 Источником эмбриональных стволовых клеток может стать человеческая кожа
- ↑ Элементы - новости науки: Получены «этичные» эмбриональные стволовые клетки
- ↑ http://elementy.ru/news/430912 Позже было показано, что репрограммирование может происходить при временной экспрессии указанных генов, без их интеграции в геном
- ↑ Matthias Stadtfeld, Masaki Nagaya, Jochen Utikal, Gordon Weir, Konrad Hochedlinger. Induced Pluripotent Stem Cells Generated Without Viral Integration // Science. V. 322. P. 945—949 (7 November 2008). DOI: 10.1126/science.1162494.
- ↑ Год перепрограммированных клеток. П. Петров
- ↑ Xiao-yang Zhao1, Wei Li1, Zhuo Lv1,, Lei Liu1, Man Tong1, Tang Hai1, Jie Hao1, Chang-long Guo1, Qing-wen Ma, Liu Wang, Fanyi Zeng, Qi Zhou. iPS cells produce viable mice through tetraploid complementation. Nature 461, (3 September 2009), 86-90
- ↑ Transplantation of iPSC-derived RPE sheet into first AMD patient Center for Developmental Biology | RIKEN CDB
- ↑ Как делают трехмерные органы, и кому они нужны
Ссылки
wikiredia.ru
Индуцированные плюрипотентные стволовые клетки - Википедия
| Данные в этой статье приведены по состоянию на 2010. Вы можете помочь, обновив информацию в статье. |
Эмбриональные стволовые клетки (ЭСК) — тип плюрипотентных клеток млекопитающих, поддерживаемых в культуре, которые получают из внутренней клеточной массы бластоцисты на ранней стадии развития эмбриона[1]. Эмбрион человека достигает стадии бластоцисты спустя 5-6 дней после оплодотворения, внутренняя клеточная масса бластоцисты человека состоит из 50-150 клеток.
Эмбриональные стволовые клетки являются плюрипотентными. Это означает, что они могут дифференцироваться во все три первичных зародышевых листка: эктодерму, энтодерму и мезодерму. Плюрипотентные клетки способны к дифференцировке во все типы клеток взрослого организма, которых насчитывается около 220. Свойство плюрипотентности отличает эмбриональные стволовые клетки от мультипотентных клеток, которые могут дать начало лишь ограниченному количеству типов клеток. В отсутствие стимулов к дифференцировке in vitro эмбриональные стволовые клетки могут поддерживать плюрипотентность в течение многих клеточных делений. Это свойство называется способность к самообновлению (англ. self-renewal). Наличие плюрипотентных клеток у взрослого организма остается объектом научных дискуссий, хотя исследования показали, что существует возможность получения плюрипотентных клеток из фибробластов взрослого человека в лабораторных условиях в процессе так называемого репрограммирования клеток [2].
Ввиду пластичности и потенциально неограниченного потенциала самообновления эмбриональные стволовые клетки имеют перспективы применения в регенеративной медицине и замещении поврежденных тканей. Однако в настоящий момент не существует никакого медицинского применения эмбриональных стволовых клеток. Стволовые клетки взрослых организмов и стволовые клетки костного мозга используются для терапии различных заболеваний. Некоторые заболевания крови и иммунной системы (в том числе генетические) могут быть излечены стволовыми клетками неэмбрионального происхождения.[источник не указан 1874 дня] Разрабатываются методы лечения с помощью стволовых клеток таких патологий, как онкологические заболевания, юношеский диабет, синдром Паркинсона, слепота и нарушения работы спинного мозга[источник не указан 1874 дня]
Существуют как этические, так и технические затруднения, связанные с трансплантацией гематопоэтических стволовых клеток. Эти проблемы связаны, в том числе, с гистосовместимостью. Такие проблемы могут быть разрешены при использовании собственных стволовых клеток или путём терапевтического клонирования.
Для дифференцировки эмбриональных стволовых клеток достаточно подействовать на них факторами роста. Например, эмбриональные стволовые клетки мыши, дифференцированные in vitro в нейральные клетки, были использованы для восстановления повреждённого спинного мозга крысы. Для получения гепатоцитов был использован , а для получения гемопоэтических стволовых клеток эмбриональные стволовые клетки трансфецировали генами Cdx, HoxB4.
История исследований и разработок[ | ]
Выделение и культура in vitro[ | ]
Стволовые клетки были выделены при анализе . В 1964 году исследователи показали, что клетки тератокарциномы остаются недифференцированными в культуре клеток. Такие стволовые клетки называют эмбриональными клетками карциномы.[3] Исследователи показали, что первичные эмбриональные зародышевые клетки могут размножаться в культуре и могут образовывать разные типы клеток.
Эмбриональные стволовые клетки выделили из мышиных эмбрионов в 1981 году Мартин Эванс и Мэтью Кауфман, а также независимо от них Гэйл Мартин[4][5]. Прорыв в исследовании эмбриональных стволовых клеток человека произошел в ноябре 1998 года в группе Джеймса Томсона в Университете Висконсина. Ученые выделили такие клетки из бластоцисты человека[6].
Загрязнения веществами, которые используют для поддержания клеточных культур[ | ]
Сетевая версия журнала Nature Medicine опубликовало в январе 2005 года материал, согласно которому стволовые клетки человека, которые доступны для исследований, финансируемых федеральными грантами, загрязнены молекулами сред для культивирования клеток животного происхождения[7]. Для поддержания плюрипотентности активно делящихся клеток часто используют клетки животного происхождения (обычно это клетки мышей). Выяснилось, что это порождает ряд проблем; в частности, оказалось, что сиаловая кислота животного происхождения сужает возможности применения эмбриональных стволовых клеток для терапевтических целей[8].
В работе, опубликованной в журнале Lancet Medical Journal 7 марта 2005 года[9], детально описана методика культивирования новой линии стволовых клеток в среде, полностью свободной от клеток и сыворотки животного происхождения. После более чем шестимесячного периода культивирования в недифференцированном состоянии эти клетки могли дифференцироваться в клетки всех трех зародышевых листков как в составе тератом, так и в культуре.
Терапевтические применения[ | ]
23 января 2009 года началась первая фаза клинических испытаний по трансплантации популяции человеческих эмбриональных стволовых клеток пациентам с травмами спинного мозга[10]. Данное исследование было основано на результатах, полученных группой Ханса Кейрстеда с соавт. в университете города Ирвин, Калифорния, США, финансируемых Корпорацией Geron (Menlo Park, Калифорния, США). Результаты данного эксперимента показали улучшение локомоторной проводимости у крыс с травмами спинного мозга. На седьмой день после трансплантации, эмбриональные стволовые клетки человека дифференцировались в олигодендроциты.[11]. В том же году было начато клиническое исследование по использованию дифференцированных производных ЭСК человека для терапии наследственной макулодистрофии сетчатки глаза, которое успешно завершилось в 2015 году [12]. Сейчас мультицентровое продолжение исследований проходит в США, Англии, Австралии, странах Азии. В 2015 году американская компания Viacyte начала клинические испытания лечения диабета с использованием клеток поджелудочной железы, полученных из эмбриональных стволовых клеток человека[13].
В Российской Федерации терапевтическое применение и изучение эмбриональных стволовых клеток человека будет регулироваться законом «Об обращении биомедицинских клеточных продуктов»[14], который должен быть рассмотрен Госдумой РФ в середине 2016 года.
Индуцированные плюрипотентные стволовые клетки[ | ]
Индуцированные плюрипотентные стволовые клетки (induced pluripotent stem cells, iPSC или iPS) удалось получить из клеток различных тканей (в первую очередь фибробластов) с помощью их репрограммирования методами генетической инженерии.
В ранних работах iPS пытались получить путём слияния «взрослых» клеток с ЭСК[15]. В 2006 году были получены iPS из сперматогониев мышей и людей[16]
В 2006 году были разработаны методы репрограммирования клеток путём введения в них генов, кодирующих транскрипционные факторы, характерные для плюрипотентных клеток, (в первую очередь, генов транскрипционных факторов Oct4, Sox2, Klf4, c-Myc и Nanog) с помощью лентивирусов и других векторов"[17][18] Репрограммирование клеток с целью превращения их в iPS было признано журналом Science главным научным прорывом 2008 г[19]
В 2009 году была опубликована работа, в которой с помощью метода тетраплоидной комплементации впервые было показано, что iPS могут давать полноценный организм, в том числе и клетки зародышевого пути[20]. iPS, полученные из фибробластов кожи мышей с помощью трансформации с использованием ретровирусного вектора, в некотором проценте случаев дали здоровых взрослых мышей, которые были способны нормально размножаться. Таким образом, впервые были получены клонированные животные без примеси генетического материала яйцеклеток (при стандартной процедуре клонирования митохондриальная ДНК передается потомству от яйцеклетки реципиента). В 2012 г за разработку технологии клонирования и генетического репрграммирования Нобелевская премия по физиологии и медицине была вручена Джону Гердону (Англия) и Шинья Яманака (Япония). А в 2014 г проф. М Такахаши и Ш. Яманака впервые произвели трансплантацию пигментного эпителия сетчатки глаза, полученного из iPS клеток пациентке с возрастной дегенерацией сетчатки[21].
См. также[ | ]
Примечания[ | ]
- ↑ Киселев С.Л., Лагарькова М.А. Эмбриональные стволовые клетки человека // Природа. — 2006. — Т. 10. — С. 49-64.
- ↑ Department of Stem Cell Biology, Institute for Frontier Medical Sciences, Kyoto University, Kyoto (August 25, 2006). «Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors». .
- ↑ Andrews P, Matin M, Bahrami A, Damjanov I, Gokhale P, Draper J (2005). «Embryonic stem (ES) cells and embryonal carcinoma (EC) cells: opposite sides of the same coin». Biochem Soc Trans 33 (Pt 6): 1526–30. DOI:10.1042/BST20051526. PMID 16246161.
- ↑ Evans M, Kaufman M (1981). «Establishment in culture of pluripotential cells from mouse embryos». Nature 292 (5819): 154–6. DOI:10.1038/292154a0. PMID 7242681.
- ↑ Martin G (1981). «Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells». Proc Natl Acad Sci U S A 78 (12): 7634–8. DOI:10.1073/pnas.78.12.7634. PMID 6950406.
- ↑ Thomson J, Itskovitz-Eldor J, Shapiro S, Waknitz M, Swiergiel J, Marshall V, Jones J (1998). «Embryonic stem cell lines derived from human blastocysts». Science 282 (5391): 1145–7. DOI:10.1126/science.282.5391.1145. PMID 9804556.
- ↑ Ebert, Jessica (24 January 2005). «Human stem cells trigger immune attack». News from "Nature" (Nature Publishing Group). DOI:10.1038/news050124-1. Проверено 2015-03-17.
- ↑ Access to articles : Nature Medicine (Проверено 17 марта 2015)
- ↑ Irina Klimanskaya (7 May 2005). «Human embryonic stem cells derived without feeder cells». The Lancet 365 (9471): 1636—1641. DOI:10.1016/S0140-6736(05)66473-2. Проверено 2015-03-17.
- ↑ FDA approves human embryonic stem cell study - CNN.com. Архивировано 28 марта 2012 года.
- ↑ Keirstead HS, Nistor G, Bernal G, et al (May 2005). «Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury». J. Neurosci. 25 (19): 4694–705. DOI:10.1523/JNEUROSCI.0311-05.2005. PMID 15888645.
- ↑ name="PMID 25937371"
- ↑ VC-01 Diabetes Therapy — Viacyte, Inc
- ↑ Проект Федерального закона от 18 января 2013 г
- ↑ http://elementy.ru/news/164751 Источником эмбриональных стволовых клеток может стать человеческая кожа
- ↑ Элементы - новости науки: Получены «этичные» эмбриональные стволовые клетки
- ↑ http://elementy.ru/news/430912 Позже было показано, что репрограммирование может происходить при временной экспрессии указанных генов, без их интеграции в геном
- ↑ Matthias Stadtfeld, Masaki Nagaya, Jochen Utikal, Gordon Weir, Konrad Hochedlinger. Induced Pluripotent Stem Cells Generated Without Viral Integration // Science. V. 322. P. 945—949 (7 November 2008). DOI: 10.1126/science.1162494.
- ↑ Год перепрограммированных клеток. П. Петров
- ↑ Xiao-yang Zhao1, Wei Li1, Zhuo Lv1,, Lei Liu1, Man Tong1, Tang Hai1, Jie Hao1, Chang-long Guo1, Qing-wen Ma, Liu Wang, Fanyi Zeng, Qi Zhou. iPS cells produce viable mice through tetraploid complementation. Nature 461, (3 September 2009), 86-90
- ↑ Transplantation of iPSC-derived RPE sheet into first AMD patient Center for Developmental Biology | RIKEN CDB
Ссылки[ | ]
encyclopaedia.bid











