Содержание
Клеточные включения (эргастические вещества). Запасные вещества (белки, жиры, масла), их форма, функции и значение для растительных клеток
Образование
включений вызвано избыточным накоплением
некоторых продуктов обмена веществ в
определенных участках клетки – в
вакуоли, гиалоплазме, различных
органеллах, реже в клеточной стенке.
Эти вещества часто выпадают в осадок в
аморфном виде или в форме кристаллов –
включений.
Включения имеют определенную форму и
хорошо видны в световой микроскоп. По
наличию тех или иных включений, их форме
и распределению можно отличить одни
виды, роды и семейства растений от
других, поэтому они часто служат важным
диагностическим признаком при анализе
лекарственного растительного сырья.
Включения
представляют собой либо запасные
вещества
(временно выведенные из обмена веществ
соединения), либо конечные
продукты
обмена. К первой категории включений
относятся крахмальные
зерна,
липидные
капли
и отложения
белков;
ко второй – кристаллы
некоторых веществ.
Крахмальные
зерна
– наиболее распространенные включения
растительных клеток. Полисахарид крахмал
– основной тип запасных питательных
веществ растений. Он является и самым
важным соединением, используемым в пищу
растительноядными животными. Крахмал
зерновок хлебных злаков, клубней
картофеля, плодов банана – важнейший
источник питания людей. Пшеничная мука
состоит из зерен крахмала почти на 75%,
в клубнях картофеля крахмал составляет
20-30%. В химическом отношении крахмал
представляет собой альфа-1,4-D-глюкан,
молекулы имеют вид разветвленных цепей,
в крахмальном зерне они располагаются
по радиусам.
Крахмальные
зерна образуются в строме пластид. В
хлоропластах на свету откладываются
зерна ассимиляционного
(первичного)
крахмала,
образующиеся при избытке сахаров –
продуктов фотосинтеза. Образование
осмотически неактивного крахмала
предотвращает повышение осмотического
давления в хлоропласте. Ночью, когда
фотосинтез не происходит, ассимиляционный
крахмал с помощью ферментов гидролизуется
до сахаров и транспортируется в другие
части растения. Запасной
Запасной
(вторичный)
крахмал
откладывается в амилопластах клеток
различных органов растений (корнях,
подземных побегах, семенах) из сахаров,
притекающих из фотосинтезирующих
клеток. При необходимости запасной
крахмал также превращается в сахара.
Образование
крахмальных зерен начинается в
определенных точках стромы пластиды,
называемых образовательными
центрами.
Рост зерна происходит путем последовательного
отложения слоев крахмала вокруг
образовательного центра. Смежные слои
в одном зерне могут иметь различный
показатель преломления света, и тогда
они видны под микроскопом – слоистые
крахмальные зерна. Расположение слоев
может быть концентрическим
(пшеница) или эксцентрическим
(картофель) (рис.
2.10
). Если в амилопласте имеется один
образовательный центр, вокруг которого
откладываются слои крахмала, то возникает
простое
зерно,
если два и более – то образуется сложное
зерно,
состоящее как бы из нескольких простых.
Полусложное
зерно
образуется в том случае, если крахмал
сначала откладывается вокруг нескольких
точек, а затем, после соприкосновения
простых зерен, вокруг них возникают
общие слои (рис.
2.10
).
Форма,
размер, количество в амилопласте и
строение (положение образовательного
центра, слоистость, наличие или отсутствие
трещин) крахмальных зерен часто специфичны
для вида растения (рис.
2.10
). Обычно крахмальные зерна имеют
сферическую, яйцевидную или линзовидную
форму, однако у картофеля она неправильная.
Наиболее крупные зерна (до 100 мкм)
характерны для клеток клубней картофеля,
в зерновке пшеницы они двух размеров –
мелкие (2-9 мкм) и более крупные (30-45 мкм).
Для клеток зерновки кукурузы характерны
мелкие зерна (5-30 мкм). Сложные крахмальные
зерна у риса, овса, гречихи.
Рис.
2.10.
Крахмальные
зерна различных видов растений
: А – картофель; Б – пшеница; В – овес;
Г – рис; Д – кукуруза; Е – гречиха; 1 –
простое зерно; 2 – сложное зерно; 3 –
полусложное зерно.
Реактивом
на крахмал является раствор йода в
растворе калия йодида – реактив
Люголя.
Он окрашивает крахмальные зерна в
сине-фиолетовый цвет.
Отложения
крахмала широко распространены во всех
органах растения, но особенно богаты
им семена, подземные побеги (клубни,
луковицы, корневища), паренхима проводящих
тканей корней и стеблей древесных
растений.
Липидные
капли
встречаются
практически во всех растительных
клетках. Жирные масла накапливаются у
огромного количества растений и по
своему значению являются второй после
крахмала формой запасных питательных
веществ. Особенно богаты ими семена и
плоды. Семена некоторых растений
(подсолнечник, хлопчатник, арахис) могут
содержать до 40% масла от массы сухого
вещества. Поэтому растительные жиры
получают, главным образом, из семян.
Липидные
капли накапливаются непосредственно
в гиалоплазме. Они выглядят как мелкие
сферические тела, каждая капля отделена
от гиалоплазмы мембраной. Иногда липидные
капли называют сферосомами.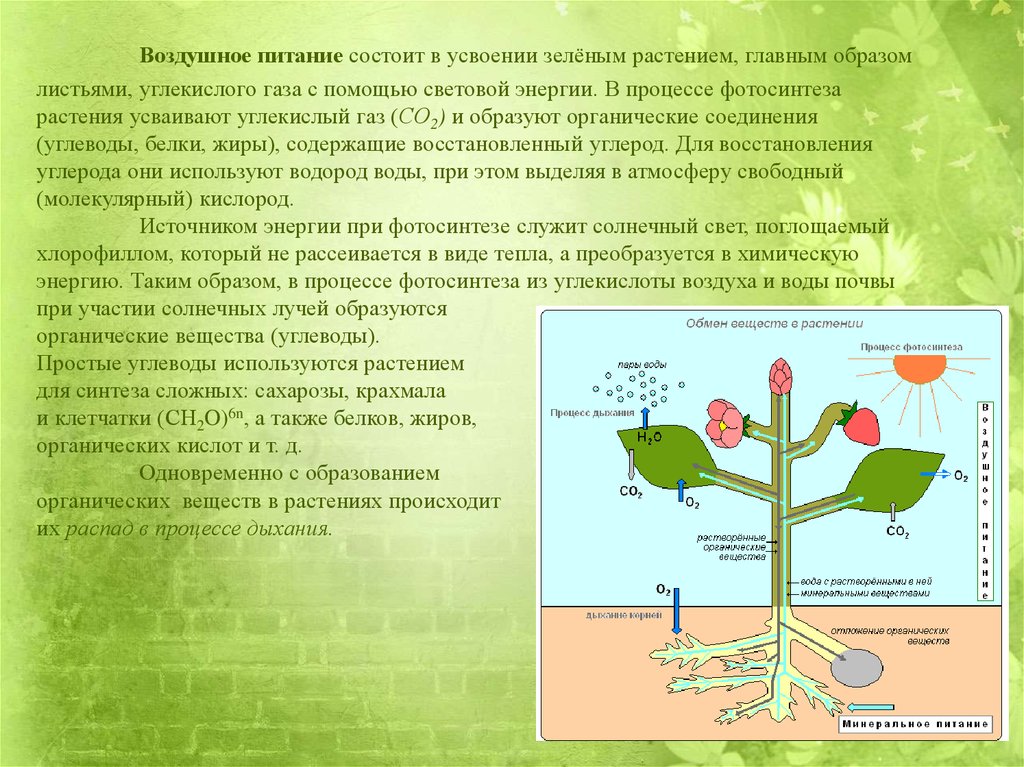
Реактивом
на жирное масло является краситель
судан
III,
липидные капли окрашиваются им в
оранжево-красный цвет.
Белковые
включения
в виде разнообразных аморфных или
кристаллических отложений образуются
в различных органеллах клетки. Наиболее
часто белковые кристаллы можно встретить
в ядре, реже — в гиалоплазме, строме
пластид, в расширениях цистерн
эндоплазматической сети, матриксе
пероксисом и митохондрий. Размер белковых
кристаллов чаще всего находится за
пределами разрешающей способности
светового микроскопа.
Запасные
белки относятся к категории простых
белков – протеинов,
в отличие от сложных белков – протеидов,
составляющих основу протопласта. В
наибольшем количестве они откладываются
в запасающей ткани сухих семян в виде
алейроновых
зерен,
или белковых
телец.
Алейроновые
зерна обычно имеют сферическую форму
и различный размер (0,2-20 мкм). Они окружены
мембраной и содержат аморфный белковый
матрикс, в который погружены кристаллические
включения – один (реже, 2-3) белковый
кристалл ромбоэдрической формы и
округлые глобоиды
(от одного до многих) (рис.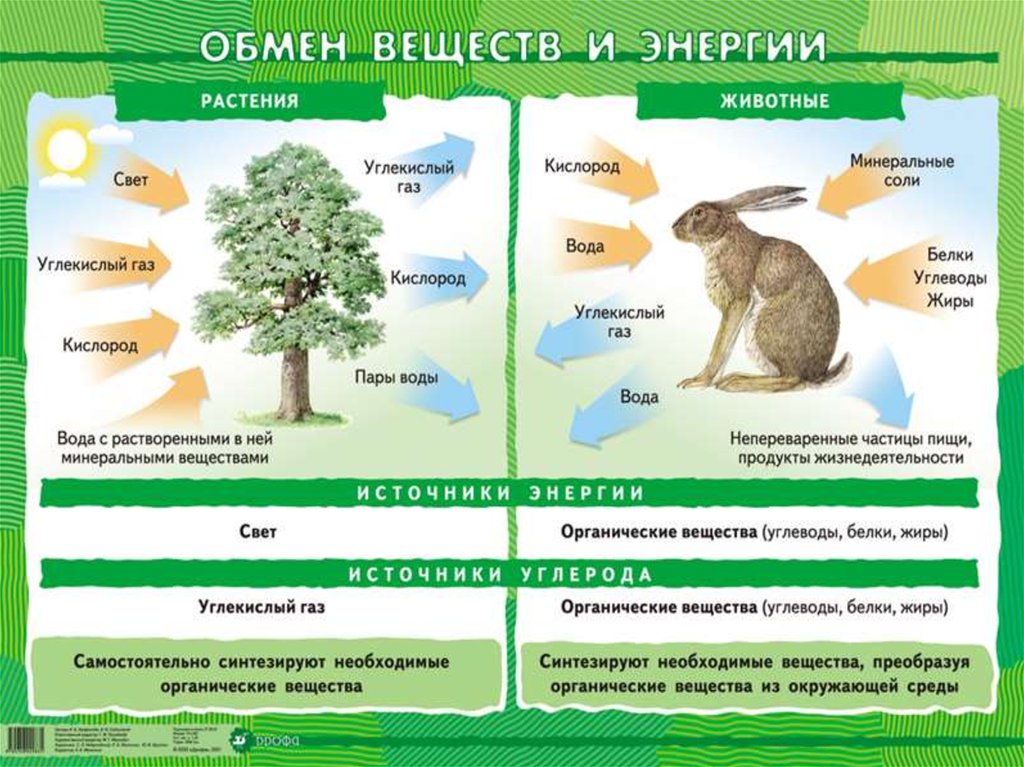
2.11
). Глобоиды состоят из фитина (соли
инозитгексафосфорной кислоты) и являются
местом хранения запасного фосфора.
Алейроновые зерна, содержащие кристаллы,
называют сложными.
Они характерны для запасающих клеток
семян масличных растений (лен, подсолнечник,
тыква, горчица, клещевина и др.). Реже
встречаются простые
алейроновые зерна, не содержащие
кристаллов, а только аморфный белок
(бобовые, рис, кукуруза) (рис.
2.12
).
Рис.
2.11.
Алейроновые
зерна в клетках эндосперма семян
клещевины
: Кр
– белковые кристаллы; Гл
– глобоиды; Ма
– белковый матрикс.
Запасные
белки во время развития семян откладываются
в вакуоли. При созревании семян,
сопровождающемся их обезвоживанием,
белковые вакуоли высыхают, белок и фитин
выпадают из раствора в осадок и могут
кристаллизоваться. При прорастании
семян алейроновые зерна поглощают воду,
набухают и постепенно превращаются в
типичные вакуоли. Белки и вещества
глобоидов расходуются на рост и развитие
проростка.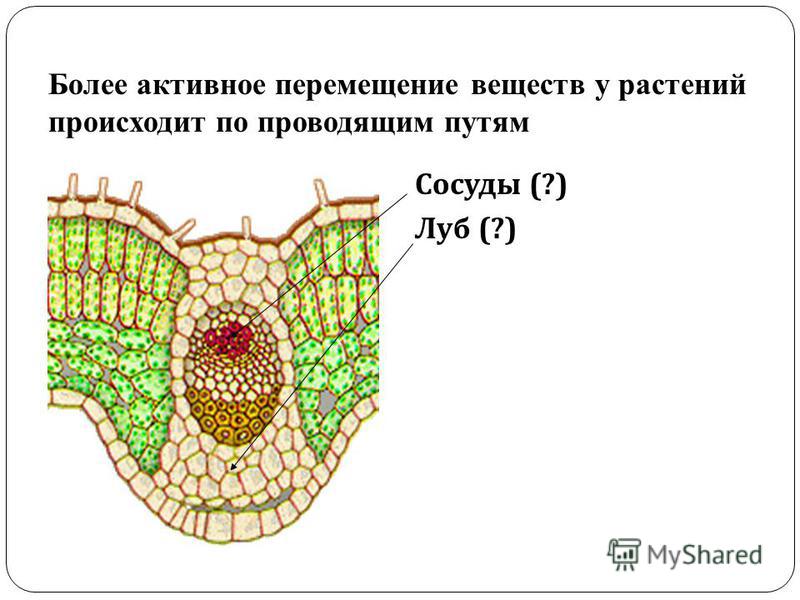
Рис.
2.12.
Простые
алейроновые и крахмальные зерна в клетке
семядоли семени фасоли
: 1 – простые алейроновые зерна; 2 –
крахмальное зерно.
Белковые
включения можно окрасить реактивом
Люголя в золотисто-желтый цвет.
🚀 Реферат: «Запасные вещества клетки», Медицина
- Выдержка
- Другие работы
- Помощь в написании
Основные понятия по теме
Избыток накопленных в клетке веществ не участвует в обмене веществ и часто в кристаллическом или аморфном состоянии выпадает в осадок в виде включений. В функциональном отношении включения представляют собой либо временно выведенные из обмена веществ соединения — запасные вещества — либо его конечные продукты.
К запасным веществам относятся углеводы, белки и жиры (липиды).
Из углеводов наиболее распространенным запасным питательным веществом в клетке является крахмал. Если бы ассимиляционный крахмал накапливался в хлоропластах, то тормозился бы процесс фотосинтеза. Поэтому пластические вещества по мере образования оттекают в виде растворимых сахаров из листьев в другие органы растения и там накапливаются в значительных количествах. Очень часто органические вещества откладываются в виде зерен вторичного (запасного) крахмала. Их величина и форма специфичны для определенных растений.
Поэтому пластические вещества по мере образования оттекают в виде растворимых сахаров из листьев в другие органы растения и там накапливаются в значительных количествах. Очень часто органические вещества откладываются в виде зерен вторичного (запасного) крахмала. Их величина и форма специфичны для определенных растений.
Крахмальные зерна по структуре бывают простые, полусложные и сложные, а в зависимости от положения центра их образования — концентрические и эксцентрические.
Запасной крахмал накапливается в лейкопластах (амилопластах). При этом в их строме возникает центр крахмалообразования, вокруг которого и откладываются слои крахмала. Так как сахаров в запасающие органы днем поступает меньше, чем ночью, характер этих слоев в течение суток меняется: ночью откладывается широкий, рыхлый, темный слой, а днем — более узкий, плотный, светлый. Это обусловливает слоистость крахмальных зерен.
Крахмальные зерна разнообразны по величине и форме (рисунок 3.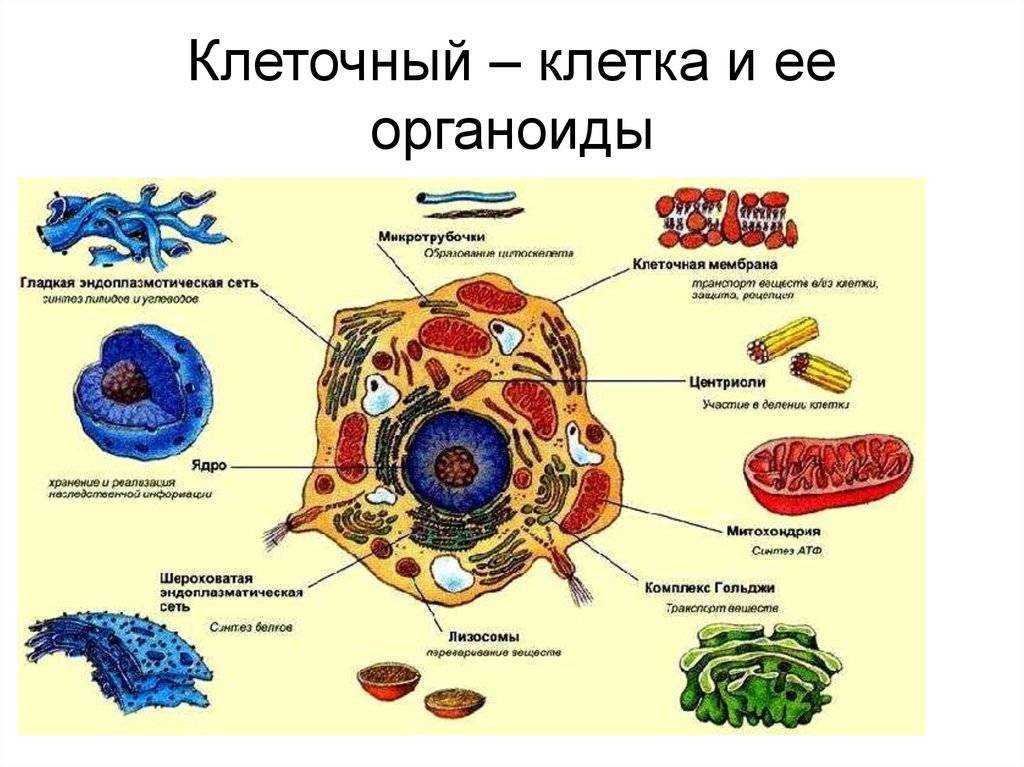 1), так, для картофеля типичны крупные зерна почти правильной яйцевидной формы, состоящие из бесцветных, но не одинаково преломляющих свет слоев, чередующихся вокруг образовательного центра и сдвинутых к его более тонкому концу (эксцентрическая слоистость). Для клубней картофеля характерны сложные, полусложные и простые крахмальные зерна.
1), так, для картофеля типичны крупные зерна почти правильной яйцевидной формы, состоящие из бесцветных, но не одинаково преломляющих свет слоев, чередующихся вокруг образовательного центра и сдвинутых к его более тонкому концу (эксцентрическая слоистость). Для клубней картофеля характерны сложные, полусложные и простые крахмальные зерна.
Запасные белки наиболее часто откладываются в виде зерен округлой или овальной формы, называемых алейроновыми. Эти зерна образуются вследствие выпадения в осадок белка, находящегося в вакуолях при их высыхании. Они аморфны. Если алейроновые зерна не имеют заметной внутренней структуры, их называют простыми. Иногда же в алейроновых зернах среди аморфного белка можно заметить один или несколько белковых кристаллов. В отличие от настоящих кристаллов кристаллы белка набухают в воде, слабых кислотах и щелочах, окрашиваются красителями, поэтому их называют кристаллитами. Кроме того, в алейроновых зернах встречают блестящие бесцветные тельца округлой формы — глобоиды. Алейроновые зерна, содержащие кристаллиты и глобоиды, называют сложными. При обогащении клетки водой алейроновые зерна растворяются. Алейроновые зерна каждого вида растений, подобно крахмальным зернам, имеют определенную структуру.
Алейроновые зерна, содержащие кристаллиты и глобоиды, называют сложными. При обогащении клетки водой алейроновые зерна растворяются. Алейроновые зерна каждого вида растений, подобно крахмальным зернам, имеют определенную структуру.
Запасные белки — это простые белки в отличие от конституционных белков, которые составляют основу протопласта (живой части клетки) и являются сложными белками.
Конечные продукты (катаболиты) обмена веществ клеток растений, рассматриваемые как отбросы, чаще всего имеют вид кристаллов минеральных солей (оксалата кальция, карбоната калия, кремнезема). Различают одиночные кристаллы, рафиды (пучки игловидных кристаллов), друзы (звездчатые сростки кристаллов) и др. Особенно много кристаллов щавелевокислого кальция образуется в коре деревьев, в листьях, в отмирающих чешуях луковиц (https://ukrmova.com.ua, 10).
Как правило, друзы встречаются у двудольных растений, а рафиды — у однодольных.
Практическое занятие
Цель: изучить морфоструктуру крахмальных и алейроновых зерен; рассмотреть кристаллические включения.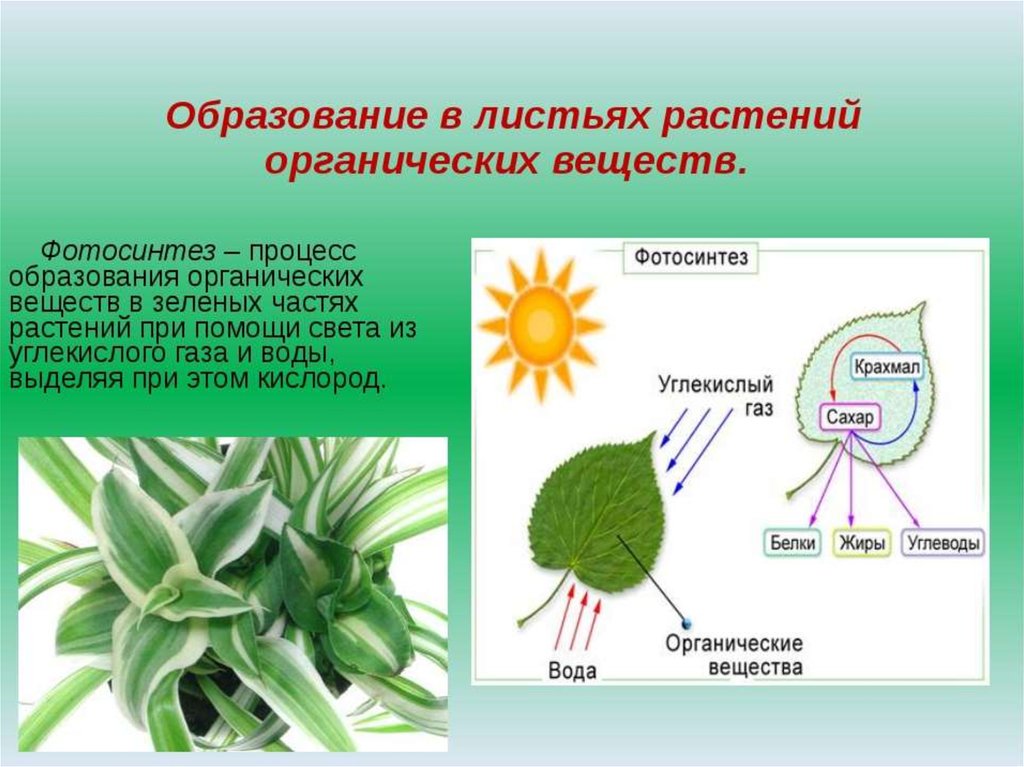
Материалы и оборудование: клубни картофеля; семена гороха посевного; сухие чешуи лука репчатого; листья бегонии; иод, растворенный в иодиде калия; глицерин; микроскопы, пинцеты, лезвия, препарировальные иглы, предметные и покровные стекла, чашечки с водой и пипеткой, фильтровальная бумага.
Вторичный крахмал запасающих органов картофеля (Solanum tuberosum L.)
Ход работы
- 1 Разрезать клубень картофеля. С поверхности среза иглой соскоблить немного мутноватой массы, перенести ее на предметное стекло в каплю воды (можно кусочком клубня несколько раз провести по капле) и накрыть покровным стеклом.
- 2 Под микроскопом при малом увеличении найти, а при большом — рассмотреть крупное простое зерно, сложные и полусложные зерна крахмала.
- 3 Рядом с покровным стеклом, не поднимая его, нанести каплю йода, растворенного в йодиде калия, и при малом увеличении проследить возникновение цветной реакции.
- (Запомните! Йод, растворенный в йодиде калия, является специальным реактивом на крахмал.
 При действии этого реактива крахмальные зерна окрашиваются (в результате образования нестойкого соединения — йодистого крахмала) в синий цвет (от светло-синего до темно-фиолетового). Пользуясь этой реакцией, можно установить присутствие крахмала в любом органе.
При действии этого реактива крахмальные зерна окрашиваются (в результате образования нестойкого соединения — йодистого крахмала) в синий цвет (от светло-синего до темно-фиолетового). Пользуясь этой реакцией, можно установить присутствие крахмала в любом органе. - 4 Зарисовать простые, сложные и полусложные крахмальные зерна картофеля (рисунок 3.1). Отметить на рисунке образовательный центр, концентричность (или эксцентричность) слоев крахмала.
Рисунок 3.1 — Крахмальные зерна разных видов растений: А — картофель (Solanum tuberosum); Б — пшеница (Triticum); В — овес (Avena); Г — кукуруза (Zea); Д — рис; Е — гречка (Fagopyrum). 1 — простое крахмальное зерно, 2 — сложное, 3 — полусложное (из В. Г. Хржановский, С. Ф. Пономаренко, 1979)
крахмальное зерно клетка запасной.
Запасные вещества в клетках семян гороха посевного (Pisum sativum L.)
Ход работы
- 1 С предварительно замоченного в воде семени гороха снять кожуру, отделить одну семядолю, сделать с нее тонкие срезы и поместить их на предметное стекло в каплю воды, смешанную с глицерином.

- 2 При малом увеличении микроскопа рассмотреть форму клеток семядоли, найти в них крупные зерна крахмала и более мелкие алейроновые зерна.
- 3 Нанести на препарат каплю йода, растворенного в йодиде калия, и пронаблюдать за изменением окраски крахмальных (станут темно-фиолетовыми) и белковых (станут желтыми) зерен.
- 4 Зарисовать несколько клеток (рисунок 3.2), отметив крахмальные зерна, их концентрическую слоистость и трещины; алейроновые зерна; оболочку и межклетники.
Рисунок 3.2 — Клетка семядоли гороха (Pisum sativum) с крахмальными и алейроновыми зернами: к.з. — крахмальное зерно; а.з. — алейроновое зерно; м.ж. — межклетник; о.к. — оболочка клетки (из В. Г. Хржановский, С. Ф. Пономаренко, 1979)
Кристаллы в клетках сухой чешуи луковицы лука репчатого (Аllium сера L.)
Ход работы
Выбрать более тонкий прозрачный кусочек чешуи лука, выдержанной в глицерине, и поместить его на предметное стекло в каплю глицерина.
При малом увеличении микроскопа рассмотреть чешую. Среди удлиненных мертвых паренхимных клеток, на большом увеличении, найти бесцветные призматические кристаллы, одиночные или попарно крестообразно сросшиеся.
4 Зарисовать несколько клеток (рисунок 3.3), отметив оболочку, одиночные, двойниковые и тройниковые кристаллы оксалата кальция.
Кристаллы в клетках черешка бегонии (Begonia sp.)
Ход работы
- 1 Сделать продольные срезы черешка бегонии, перенести их на предметное стекло в каплю воды и накрыть покровным стеклом.
- 2 При малом увеличении микроскопа найти, а при большом — рассмотреть наиболее тонкий участок среза, состоящий из тонкостенных паренхимных клеток с постенным слоем цитоплазмы.
В полости клеток, в клеточном соке локализуются одиночные кристаллы в виде ромбоэдров или их сростки — друзы. Кристаллы и друзы состоят из щавелевокислого кальция, они растворяются в минеральных кислотах (соляной, азотной, серной) без выделения пузырьков газа.
3 Зарисовать несколько клеток с одиночными кристаллами и друзами (рисунок 3.3), обозначив их на рисунке.
Рисунок 3.3 — Клетки различных растений с включениями щавелевокислого кальция: а — одиночные, двойниковые и тройниковые кристаллы в клетках сухой чешуи лука; б — последовательные стадии формирования друз в клетках черешка листа бегонии; в — пучок рафид в клетке корневища купены (из В. Г. Хржановский, С. Ф. Пономаренко, 1979).
Вопросы для самоконтроля
- 1 Что собой представляют включения клетки?
- 2 Какие типы клеточных включений Вам известны?
- 3 В какой форме накапливается крахмал?
- 4 Чем различаются простые, сложные и полусложные крахмальные зерна?
- 5 Чем объясняется слоистость крахмальных зерен?
- 6 В какой форме в клетках запасается белок?
- 7 Каково строение алейроновых зерен?
- 8 В какой форме запасаются в клетке минеральные соли?
- 1 Васильев, А.
 Е. Ботаника: Морфология и анатомия растений: учеб. пособие для студентов пед. ин-тов по биолог. и хим. спец. / А. Е. Васильев [и др]; — 2-е изд., перераб. — М.: Просвещение, 1988. — С. 73 — 78.
Е. Ботаника: Морфология и анатомия растений: учеб. пособие для студентов пед. ин-тов по биолог. и хим. спец. / А. Е. Васильев [и др]; — 2-е изд., перераб. — М.: Просвещение, 1988. — С. 73 — 78. - 2 Бавтуто, Г. А. Ботаника. Морфология и анатомия растений / Г. А. Бавтуто, В. М. Еремин. — Мн.: Высшая школа, 1997. — С. 91- 94.
- 3 Бавтуто, Г. А. Практикум по анатомии и морфологии растений: учеб. пособие / Г. А. Бавтуто, Л. М. Ерей — Мн.: Новое знание, 2002. — С. 39−47.
Показать весь текст
Заполнить форму текущей работой
Исследование накопления запасного белка семян путем эктопической экспрессии у Arabidopsis
- ID корпуса: 80742426
title={Изучение накопления запасных белков семян путем эктопической экспрессии у арабидопсиса},
автор={Гордон М. Гропп},
год = {2013}
} - Gordon M. Gropp
- Опубликовано 1 декабря 2013 г.

- Биология
Понимание механизмов, используемых растениями для синтеза запасных белков семян (SSP), транспорта и отложения, может иметь потенциальные преимущества в виде обеспечения высоких урожаев модифицированных или чужеродных белков. . Хаяши и др. (1999) показали, что механизм, связанный с синтезом запасающих белок вакуолей в клетках семядолей, может быть индуцирован в вегетативной ткани посредством конститутивной экспрессии слияния генов тыквенного 2S альбумина фосфинотрицин-ацетилтрансферазы (тыквенный 2S-PAT), что приводит к…
yield.usask.ca
ПОКАЗЫВАЕТСЯ 1-10 ИЗ 215 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантности Наиболее влиятельные документыНедавность
Накопление слитого белка, содержащего 2S альбумин, индуцирует новые везикулы в вегетативных клетках арабидопсиса.
- М. Хаяси, К. Торияма, М. Кондо, И. Хара-Нисимура, М. Нисимура
Биология
Физиология растений и клеток
- 1999
- H. Höfte, L. Hubbard, J. Reizer, D. Ludevid, E. Herman, M. Chrispeels
Биология
Физиология растений
- 1992
- Verena Ibl, E. Stoger
Биология
Protoplasma
- 2011
- Takashi Mori, Yohei Saruta, S. Utsumi
Biology
Bioscience, biotechnology, and biochemistry
- 2009
- Misoon Park, Soo-Jin Kim, A.
 Vitale, I. Hwang
Vitale, I. Hwang Биология, наука об окружающей среде
Физиология растений фасоль обыкновенная и ткань листа арабидопсиса нацелены на PSV или эквивалентную органеллу в клетках листа, и что белки могут транспортироваться в PSV двумя различными путями: Golgi-зависимым и GolGI-независимым путями, в зависимости от отдельных грузовых белков.
ИЗДАТЕЛЬСТВО CSIRO | Функциональная биология растений
You are here: Home > Journals > FP > FP14035
ОБЗОР
Предыдущий
Следующий
Содержание Том 41(7)
Джошуа С. Милн A D , Икуко Хара-Нишимура B и К. Йохан Розенгрен C
+ Принадлежности автора
— Принадлежности автора
A Университет Западной Австралии, Школа химии и биохимии и Центр передового опыта ARC в области биологии энергии растений, 35 Stirling Highway, Crawley, Perth, WA 6009, Австралия.

B Кафедра ботаники, Высшая школа наук, Киотский университет, Китасиракава-ойвакэ чо Сакио-ку, Киото, 606-8502, Япония.
C Университет Квинсленда, Школа биомедицинских наук, Брисбен, Квинсленд, 4072, Австралия.
D Автор, ответственный за переписку. Электронная почта: [email protected]
Этот обзор основан на премии Питера Голдакра 2012 года Австралийского общества ученых-растениеводов, которая была получена первым автором .
Функциональная биология растений 41(7) 671-677 https://doi.org/10.1071/FP14035
Подано: 24 января 2014 г. Принято: 24 марта 2014 г. Опубликовано: 6 мая 2014 г.Аннотация
Альбумины для хранения семян представляют собой водорастворимые и очень распространенные белки, которые расщепляются во время прорастания семян, чтобы обеспечить азот и серу для развивающихся проростков. Во время созревания семян эти белки подвергаются посттрансляционным модификациям и перемещению, прежде чем они отложатся в большом количестве и с большой стабильностью в специальных вакуолях.
 Этот обзор будет охватывать внутриклеточное движение, биохимическую обработку и зрелые структуры напинов для хранения семян.
Этот обзор будет охватывать внутриклеточное движение, биохимическую обработку и зрелые структуры напинов для хранения семян.Дополнительные ключевые слова: аспарагинилэндопептидаза, напин, запасной белок семян, фермент вакуолярного процессинга, 2S альбумин.
Каталожные номера
Alcocer MJC, Murtagh GJ, Bailey K, Dumoulin M, Sarabia Meseguer A, Parker MJ, Archer DB
(2002 ) Дисульфидное картирование, укладка и характеристика рекомбинантного Ber e 1, аллергенного белка, и SFA8, двух богатых серой 2 S растительных альбуминов. Журнал молекулярной биологии 324 , 165–175.
| Дисульфидное картирование, укладка и характеристика рекомбинантного Ber e 1, аллергенного белка, и SFA8, двух богатых серой 2 S растительных альбуминов. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD38XotlWmsb8%3D&md5=cb669d8c1250f0f8b398325e1fcf5531CAS |Аллен Р.
 , Коэн Э., Вондер Хаар Р., Адамс С., Ма Д., Несслер С., Томас Т.
, Коэн Э., Вондер Хаар Р., Адамс С., Ма Д., Несслер С., Томас Т.
(1987 ) Последовательность и экспрессия гена, кодирующего запасной белок альбумина в подсолнечнике. Молекулярная и общая генетика 210 , 211–218.
| Последовательность и экспрессия гена, кодирующего запасной белок альбумина, в подсолнечнике.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaL1cXhvVWiuro%3D&md5=b60102ad11e4f53bc96ae034056d8e00CAS |Эриксон М.Л., Редин Дж., Ленман М., Глимелиус К., Йозефссон Л.Г., Раск Л.
(1986 ) Структура запасного белка 1.7 S семян рапса, напина и его предшественника. Журнал биологической химии 261 , 14 576–14 581Груис Д.Ф., Селинджер Д.А., Карран Дж.М., Юнг Р.
(2002 ) Избыточные протеолитические механизмы обрабатывают запасные белки семян в отсутствие членов семейства вакуолярных ферментов процессинга цистеиновых протеаз типа семян. Растительная клетка 14 , 2863–2882.
| Избыточные протеолитические механизмы обрабатывают запасные белки семян в отсутствие членов семейства вакуолярных ферментов процессинга цистеиновых протеаз типа семян. Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD38XovF2qurc%3D&md5=ff8bedd63438ac0f0cd20951a27df19eCAS | 12417707PubMed |Груис Д., Шульце Дж., Юнг Р.
(2004 ) Накопление запасного белка в отсутствие вакуолярного процессингового фермента семейства цистеиновых протеаз. Растительная клетка 16 , 270–290.
| Накопление запасного белка в отсутствие вакуолярного процессингового фермента семейства цистеиновых протеаз.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD2cXosVektg%3D%3D&md5=b03139f3dec21cd2b1aca261930d3a59CAS | 14688293ПубМед |Хара-Нисимура I, Нисимура М.
(1987 ) Фермент процессинга проглобулина в вакуолях, выделенных из развивающихся семядолей тыквы. Физиология растений 85 , 440–445.
| Фермент процессинга проглобулина в вакуолях, выделенных из развивающихся семядолей тыквы. Академия GoogleАкадемия Google | 1:CAS:528:DyaL1cXptVCqsQ%3D%3D&md5=5c99410a9e21d58f73cef8a113141a90CAS | 16665717PubMed |Хара-Нисимура И, Иноуэ К, Нисимура М
(1991 ) Уникальный фермент вакуолярного процессинга, ответственный за преобразование нескольких предшественников пропротеина в зрелые формы. Письма FEBS 294 , 89–93.
| Уникальный фермент вакуолярного процессинга, ответственный за преобразование нескольких предшественников пропротеина в зрелые формы. Академия GoogleАкадемия Google | 1:CAS:528:DyaK38XhtVWmsLo%3D&md5=603a0192b6b6dd38a3fb6eae279ebd11CAS | 1743299PubMed |Хара-Нисимура И., Такеучи Ю., Иноуэ К., Нисимура М.
(1993 ) Везикулярный транспорт и процессинг предшественника 2S альбумина в тыкве. Журнал завода 4 , 793–800.
| Транспорт везикул и процессинг предшественника альбумина 2S в тыкве. Crossref | Академия GoogleАкадемия Google |
Crossref | Академия GoogleАкадемия Google |Харли С.М., Лорд М.Дж.
(1985 ) In vitro Эндопротеолитическое расщепление предшественников лектина клещевины. Растениеводство 41 , 111–116.
| Эндопротеолитическое расщепление предшественников лектина клещевины in vitro . Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaL28XhtVKiu70%3D&md5=7ef5ad3856a31201ceb4d75671a4e688CAS |Хацугай Н., Куроянаги М., Ямада К., Меши Т., Цуда С., Кондо М., Нисимура М., Хара-Нисимура I
(2004 ) Растительная вакуолярная протеаза, VPE, опосредует индуцированную вирусом гибель гиперчувствительных клеток. Наука 305 , 855–858.
| Растительная вакуолярная протеаза, VPE, опосредует вызванную вирусом гибель гиперчувствительных клеток.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD2cXmt1Krsbw%3D&md5=22be6d427ca0d5a6939afe30c417c70aCAS | 15297671PubMed |Хит Дж.
 , Уэлдон Р., Моннот С., Мейнке Д.
, Уэлдон Р., Моннот С., Мейнке Д.
(1986 ) Анализ запасных белков в нормальных и абортированных семенах эмбриолетальных мутантов Arabidopsis thaliana . Планта 169 , 304–312.
| Анализ запасных белков в нормальных и абортированных семенах эмбриолетальных мутантов Arabidopsis thaliana .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaL2sXkslaltw%3D%3D&md5=6cb2a7bba436a3f175521d91a2d2e742CAS | 24232640PubMed |Хираива Н., Кондо М., Нисимура М., Хара-Нисимура И.
(1997 ) Аспарагиновая эндопептидаза участвует в расщеплении пропептидов запасных белков в запасающих белок вакуолях растений. Европейский журнал биохимии 246 , 133–141.
| Аспарагиновая эндопептидаза участвует в расщеплении пропептидов запасных белков в запасных белках вакуолей растений. Академия GoogleАкадемия Google | 1:CAS:528:DyaK2sXjslSjtb8%3D&md5=c3fa8219a06397c4beddf5331aa93fa5CAS | 9210475PubMed |Ирвин С.
 , Кин Дж., Финдли Дж. К., Лорд Дж. М.
, Кин Дж., Финдли Дж. К., Лорд Дж. М.
(1990 ) Прекурсор альбумина Ricinus communis 2S: один препропротеин может быть процессирован в два разных гетеродимерных запасных белка. Молекулярная и общая генетика 222 , 400–408.
| Предшественник альбумина Ricinus communis 2S: один препропротеин может быть процессирован в два разных гетеродимерных запасных белка. Академия GoogleАкадемия Google | 1:CAS:528:DyaK3cXls1Klsr0%3D&md5=5554d486f8b7e4472eb894f51bbb5bd0CAS |Кортт А.А., Колдуэлл Дж.Б., Лилли Г.Г., Хиггинс Т.Дж.В.
(1991 ) Последовательности аминокислот и кДНК богатого метионином 2S белка из семян подсолнечника ( Helianthus annuus L.). Европейский журнал биохимии 195 , 329–334.
| Последовательности аминокислот и кДНК 2S-белка, богатого метионином, из семян подсолнечника ( Helianthus annuus L.). Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK3MXks1Kqt7o%3D&md5=85e2aaf0231f869a27242589bcd452a9CAS | 1997318PubMed |Куроянаги М.
 , Ямада К., Хацугай Н., Кондо М., Нисимура М., Хара-Нисимура И.
, Ямада К., Хацугай Н., Кондо М., Нисимура М., Хара-Нисимура И.
(2005 ) Фермент вакуолярного процессинга необходим для индуцированной микотоксинами гибели клеток у Arabidopsis thaliana . Журнал биологической химии 280 , 32 914–32 920
| Фермент вакуолярного процессинга необходим для гибели клеток, вызванной микотоксинами, у Arabidopsis thaliana .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD2MXhtVWiurrN&md5=4a0bb841a2345a4a8d1d7c33cdd6040aCAS |Леманн К., Шваймер К., Риз Г., Рандоу С., Зур М., Беккер В.М., Витс С., Рёш П.
(2006 )Структура и стабильность 2S аллергенов арахиса типа альбумина: влияние на тяжесть аллергических реакций на арахис. Биохимический журнал 395 , 463–472.
| Структура и стабильность 2S аллергенов арахиса типа альбумина: влияние на тяжесть аллергических реакций на арахис. Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD28XjtlCgsLs%3D&md5=f7fff07e575780316e6b14bfa3ad74abCAS | 16372900PubMed |Ли Л.
 , Шимада Т., Такахаши Х., Уэда Х., Фукао Ю., Кондо М., Нисимура М., Хара-Нисимура И.
, Шимада Т., Такахаши Х., Уэда Х., Фукао Ю., Кондо М., Нисимура М., Хара-Нисимура И.
( 2006 ) MAIGO2 участвует в выходе запасных белков семян из эндоплазматического ретикулума Arabidopsis thaliana . Растительная клетка 18 , 3535–3547.
| MAIGO2 участвует в выходе запасных белков семян из эндоплазматического ретикулума у Arabidopsis thaliana .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD2sXhvVKru74%3D&md5=f3e8b58e11b3ba322acfee85c42dc3f9КАС | 17194767PubMed |Ли Д.Ф., Цзян П., Чжу Д.И., Ху И., Макс М., Ван Д.К.
(2008 ) Кристаллическая структура Мабинлина II: новый структурный тип сладких белков и основная структурная основа его сладости. Журнал структурной биологии 162 , 50–62.
| Кристаллическая структура Мабинлина II: новый структурный тип сладких белков и основная структурная основа его сладости.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD1cXksleju7k%3D&md5=4193906a986ca8e3085991b9bf1accb3CAS | 18308584PubMed |Ли Л.
 , Шимада Т., Такахаши Х., Комото Ю., Сиракава М., Такаги Дж., Чжао Х., Ту Б., Джин Х., Шен З., Хан Б., Цзя М., Кондо М., Нисимура М., Хара-Нисимура И.
, Шимада Т., Такахаши Х., Комото Ю., Сиракава М., Такаги Дж., Чжао Х., Ту Б., Джин Х., Шен З., Хан Б., Цзя М., Кондо М., Нисимура М., Хара-Нисимура И.
(2013 ) MAG2 и три MAG2-INTERACTING PROTEIN образуют ER-локализованный комплекс для облегчения транспорта запасных белков в Arabidopsis thaliana . Журнал завода 76 , 781–791.
| MAG2 и три MAG2-ВЗАИМОДЕЙСТВУЮЩИХ БЕЛКА образуют ER-локализованный комплекс для облегчения транспорта запасных белков в Arabidopsis thaliana .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC3sXhvVGgsrvN&md5=ce7cf0c234a9ae185570c2b6ca534fdeCAS | 24118572PubMed |Лю Х, Маэда С, Ху Зи, Аючи Т, Накая К, Курихара Ю
(1993 ) Очистка, полная аминокислотная последовательность и структурная характеристика термостабильного сладкого белка, мабинлина II. Европейский журнал биохимии 211 , 281–287.
| Очистка, полная аминокислотная последовательность и структурная характеристика термостабильного сладкого белка мабинлина II. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK3sXltFWmtrc%3D&md5=e16f3909ee9fda77681bd5cd27b15cfaCAS | 8425538PubMed |
Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK3sXltFWmtrc%3D&md5=e16f3909ee9fda77681bd5cd27b15cfaCAS | 8425538PubMed |Лакетт С., Гарсия Р.С., Баркер Дж.Дж., Конарев А.В., Шьюри П.Р., Кларк А.Р., Брэди Р.Л.
(1999 ) Структура с высоким разрешением мощного циклического ингибитора протеиназы из семян подсолнечника. Журнал молекулярной биологии 290 , 525–533.
| Структура сильнодействующего циклического ингибитора протеиназы из семян подсолнечника с высоким разрешением. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK1MXktFehsb0%3D&md5=61ff80e5f1c6a1a284a91526c7e5e8c7CAS | 103PubMed |
Мин В, Джонс ДХ
(1994 ) Сплайсинг конканавалина А in vitro катализируется аспарагинилэндопептидазой. Nature Структурная и молекулярная биология 1 , 502–504.
| Сплайсинг конканавалина А in vitro катализируется аспарагинилэндопептидазой. Академия GoogleАкадемия Google | 1:CAS:528:DyaK2MXitVGhs70%3D&md5=a6ee57b1075a2d4b54953a8a47af1686CAS |Морено Ф.
 Дж., Клементе А.
Дж., Клементе А.
(2008 ) Запасные белки 2S альбумина: что делает их пищевыми аллергенами? Open Biochemistry Journal 2 , 16–28.
| Запасные белки 2S альбумина: что делает их пищевыми аллергенами?Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD1cXlsleht78%3D&md5=a5290e95b6bd5ab69e93baec2a935e6bCAS | 18949071PubMed |Mylne JS, Colgrave ML, Daly NL, Chanson AH, Elliott AG, McCallum EJ, Jones A, Craik DJ
(2011 ) Альбумины и оборудование для их обработки используются для циклических пептидов подсолнечника. Nature Chemical Biology 7 , 257–259.
| Альбумины и механизмы их обработки используются для циклических пептидов подсолнечника.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC3MXjsVKrsrs%3D&md5=8f74c2813832dee47884851edb84752cCAS | 21423169PubMed |Mylne JS, Chan LY, Chanson AH, Daly NL, Schaefer H, Bailey TL, Nguyencong P, Cascales L, Craik DJ
(2012 ) Циклические пептиды, возникающие в результате эволюционного параллелизма посредством биосинтеза, опосредованного аспарагинил-эндопептидазой. Растительная клетка 24 , 2765–2778.
Растительная клетка 24 , 2765–2778.
| Циклические пептиды, возникающие в результате эволюционного параллелизма посредством биосинтеза, опосредованного аспарагинил-эндопептидазой. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC38XhtlChsb%2FN&md5=5b8cb09e5790e6fd4794bd10837ef153CAS | 22822203PubMed |Онда Й, Нагамин А, Сакурай М, Кумамару Т, Огава М, Кавагоэ Й
(2011 ) Различная роль протеиндисульфидизомеразы и сульфгидрилоксидоредуктазы P5 во многих путях окисления структурно разнообразных запасных белков в рисе. Растительная клетка 23 , 210–223.
| Различная роль протеиндисульфидизомеразы и сульфгидрилоксидоредуктазы P5 во многих путях окисления структурно разнообразных запасных белков в рисе.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC3MXpsFaluro%3D&md5=6e362b96158c207879550233a7474409CAS | 21278127PubMed |Отеги М.С., Гердер Р., Шульце Дж.
 , Юнг Р., Штехелин Л.А.
, Юнг Р., Штехелин Л.А.
(2006 ) Протеолитическая обработка запасных белков семян в Клетки зародыша Arabidopsis начинаются в мультивезикулярных тельцах. Растительная клетка 18 , 2567–2581.
| Протеолитический процессинг запасных белков семян в эмбриональных клетках Arabidopsis начинается в мультивезикулярных тельцах. Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD28Xht1ejurvO&md5=c5063ff25239a342ba9e005aa03ec68dCAS | 17012602PubMed |Пэтцель М., Карла А., Стринадка NCJ, Долби Р.Е.
(2002 ) Сигнальные пептидазы. Chemical Reviews 102 , 4549–4580.
| Сигнальные пептидазы.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD38XosFSgu7k%3D&md5=0c586814e9b76a074664ff0f0a011009CAS | 12475201PubMed |Пантоха-Уседа Д., Брюикс М., Хименес-Гальего Г., Рико М., Санторо Х.
(2003 ) Структура раствора RicC3, запасного белка 2S альбумина из Ricinus communis . Биохимия 42 , 13 839–13 847
Биохимия 42 , 13 839–13 847
| Структура раствора RicC3, запасного белка 2S альбумина из Ricinus communis .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD3sXoslKrtLs%3D&md5=8c2d321ba224475928242f84051856f2CAS |Пантоха-Уседа Д., Паломарес О., Брюикс М., Вильяльба М., Родригес Р., Рико М., Санторо Х.
(2004 a ) Структура раствора и устойчивость к расщеплению rproBnIb, рекомбинантного 2S альбумина из семян рапса: связь с его аллергенными свойствами. Биохимия 43 , 16 036–16 045
| Структура раствора и устойчивость к расщеплению rproBnIb, рекомбинантного 2S-альбумина из семян рапса: отношение к его аллергенным свойствам.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD2cXhtVWhsbrO&md5=26ee30b42846dc4ef55ca6711c6ff344CAS |Pantoja-Uceda D, Shewry PR, Bruix M, Tatham AS, Santoro J, Rico M
(2004 b ) Структура раствора богатого метионином 2S альбумина из семян подсолнечника: связь с его аллергенными и эмульгирующими свойствами. Биохимия 43 , 6976–6986.
Биохимия 43 , 6976–6986.
| Структура раствора богатого метионином 2S-альбумина из семян подсолнечника: связь с его аллергенными и эмульгирующими свойствами. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD2cXjslOitbs%3D&md5=3a5c41e4f6503e6365d72928692516b6CAS | 15170335PubMed |Рико М., Брюикс М., Гонсалес С., Монсальве Р.И., Родригес Р.
(1996 ) Назначение 1H ЯМР и глобальная кратность напина BnIb, репрезентативного белка семян 2S альбумина. Биохимия 35 , 15 672–15 682
| 1 Н-ЯМР-сопоставление и глобальная кратность напина BnIb, репрезентативного белка семян альбумина 2S. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK28XmvVOisbo%3D&md5=3ff0df4c7b04632047a4ec7e5912d74dCAS |Рундквист Л., Тенгель Т., Здунек Дж., Бьорн Э., Шлейхер Дж., Alcocer MJC, Ларссон Г.
(2012 ) Структура раствора, связывание меди и динамика скелета рекомбинантного Ber e 1 – основного аллергена из бразильского ореха. PLoS ONE 7 , e46435
PLoS ONE 7 , e46435
| Структура раствора, связывание меди и динамика скелета рекомбинантного Ber e 1 – основного аллергена бразильского ореха. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC38XhsFalu7fL&md5=3b3893844e6f12b999b40d261eaeca9dCAS | 23056307PubMed |Шиллинг С., Вастернак С., Демут Х.У.
(2008 ) Глутаминилциклазы животных и растений: случай функционально конвергентной эволюции белков. Биологическая химия 389 , 983–991.
| Глутаминилциклазы животных и растений: случай функционально конвергентной эволюции белков.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD1cXps1Ohtbc%3D&md5=fe06a35e748c7abea0564b18ba831073CAS | 18979624PubMed |Шариф Ф.С., Ли СС-Л
(1982 ) Аминокислотная последовательность малых и больших субъединиц запасного белка семян из Ricinus communis . Журнал биологической химии 257 , 14 753–14 759.
Shewry P, Pandya M (1999)Запасные белки 2S альбумина. В «Семенных белках». (Eds P Shewry, R Casey), стр. 563–586. (Клувер: Дордрехт, Нидерланды)
Shewry PR, Napier JA, Tatham AS
(1995 ) Запасные белки семян: структура и биосинтез. Растительная клетка 7 , 945–956.Шимада Т., Куроянаги М., Нисимура М., Хара-Нисимура I.
(1997 ) Мембранный белок 72-кДа тыквы везикул, накапливающих предшественники, обладает характеристиками вакуолярного сортирующего рецептора. Физиология растений и клеток 38 , 1414–1420.
| Мембранный белок тыквенных везикул с молекулярной массой 72 кДа обладает характеристиками вакуолярного сортирующего рецептора. Академия GoogleАкадемия Google | 1:CAS:528:DyaK1cXlsVem&md5=279dfae7c78a68d04828267df84b25b3CAS |Симада Т., Фудзи К., Тамура К., Кондо М., Нисимура М., Хара-Нисимура И.

(2003 a ) Рецептор вакуолярной сортировки для запасных белков семян в Arabidopsis thaliana . Proceedings of the National Academy of Sciences of the United States of America 100 , 16 095–16 100
| Рецептор вакуолярной сортировки для запасных белков семян в Arabidopsis thaliana .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD2cXhtVGjtQ%3D%3D&md5=a97e114931ad333f72874305ce30c9e8CAS |Шимада Т., Ямада К., Катаока М., Накаунэ С., Комото Ю., Куроянаги М., Табата С., Като Т., Шинозаки К., Секи М., Кобаяши М., Кондо М., Нисимура М., Хара-Нисимура И.
(2003 b ) Ферменты вакуолярного процессинга необходимы для правильного процессинга запасных белков семян у Arabidopsis thaliana . Журнал биологической химии 278 , 32 292–32 299.
| Ферменты вакуолярного процессинга необходимы для правильной обработки запасных белков семян в Arabidopsis thaliana .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD3sXmsVOmsbk%3D&md5=2f986a0b57b41798662af944d5a9a439CAS |Шимада Т.
 , Комото Ю., Ли Л., Ямадзаки М., Кондо М., Нисимура М., Хара-Нисимура И.
, Комото Ю., Ли Л., Ямадзаки М., Кондо М., Нисимура М., Хара-Нисимура И.
(2006 ) AtVPS29, предполагаемый компонент ретромерного комплекса, необходим для эффективной сортировки запасных белков семян. Физиология растений и клеток 47 , 1187–1194.
| AtVPS29, предполагаемый компонент ретромерного комплекса, необходим для эффективной сортировки запасных белков семян. Академия GoogleАкадемия Google | 1:CAS:528:DC%2BD28XhtFCgur7L&md5=1d3bc4015a575d0df1bb7c3ae71d6a54CAS |Такаги Дж., Ренна Л., Такахаши Х., Комото Ю., Тамура К., Стефано Г., Фукао Ю., Кондо М., Нисимура М., Шимада Т., Брандизи Ф., Хара-Нисимура И.
(2013 ) MAIGO5 функционирует в экспорте белка из Golgi-ассоциированных сайтов выхода эндоплазматического ретикулума у Arabidopsis . Растительная клетка 25 , 4658–4675.
| MAIGO5 участвует в экспорте белка из участков выхода эндоплазматического ретикулума, связанных с аппаратом Гольджи, у Arabidopsis . Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC2cXitVOqsrs%3D&md5=c5c8f7a84bebb20aa8567f89e14ce753CAS | 24280388PubMed |
Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC2cXitVOqsrs%3D&md5=c5c8f7a84bebb20aa8567f89e14ce753CAS | 24280388PubMed |Такахаши Х., Тамура К., Такаги Дж., Комото Ю., Хара-Нисимура И., Шимада Т.
(2010 ) MAG4/Atp115 является локализованным по Гольджи связывающим фактором, который обеспечивает эффективный антероградный транспорт у Arabidopsis . Физиология растений и клеток 51 , 1777–1787.
| MAG4/Atp115 представляет собой локализованный по Гольджи фактор привязки, который обеспечивает эффективный антероградный транспорт у Arabidopsis .Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC3cXht1OgsrfK&md5=8bd936b5cb7a91794a8f361c4330ff18CAS |Thoyts PJE, Napier JA, Millichip M, Stobart AK, Griffiths WT, Tatham AS, Shewry PR
(1996 ) Характеристика альбумина семян подсолнечника, который связывается с масляными телами. Растениеводство 118 , 119–125.
| Характеристика альбумина семян подсолнечника, который связывается с масляными телами.Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK28XktlSitbg%3D&md5=7cd6ec1a105e95a6047f034c56a09c0eCAS |Ямада К., Шимада Т., Кондо М., Нисимура М., Хара-Нисимура И.
(1999 ) Множественные функциональные белки продуцируются путем расщепления связей Asn-Gln одного предшественника ферментом вакуолярного процессинга. Журнал биологической химии 274 , 2563–2570.
| Множественные функциональные белки образуются путем расщепления связей Asn-Gln одного предшественника вакуолярным ферментом процессинга. Академия GoogleАкадемия Google | 1:CAS:528:DyaK1MXovVKjsQ%3D%3D&md5=2eb07b620a30ba63fe59d7ce1a3d43baCAS | 9891029PubMed |Ямазаки М., Шимада Т., Такахаши Х., Тамура К., Кондо М., Нисимура М., Хара-Нисимура И.
(2008 ) Arabidopsis VPS35, ретромерный компонент, необходим для сортировки вакуолярных белков и участвует в росте растений и старении листьев.
- может быть индуцирован в вегетативных клетках путем эктопической экспрессии белка, которому суждено быть разделенным на везикулы PAC.
Вегетативные и специфичные для семян формы внутреннего белка тонопласта в вакуолярной мембране Arabidopsis thaliana.
9003 описанные здесь, и эволюционные взаимоотношения, обозначенные филогенетическим древом, предполагают функциональную специализацию этих белков.
Вакуолярный сортирующий рецептор для запасных белков семян у Arabidopsis thaliana
Показано, что мембранный белок типа I, AtVSR1/AtELP, у Arabidopsis функционирует как сортирующий рецептор для запасных белков, демонстрируя опосредованный рецептором транспорт запасных белков семян к Вакуоли для запасания белка у высших растений.
Формирование, функция и судьба компартментов для хранения белка в семенах
5 900 обобщены запасающие органеллы и описаны инструменты, которые можно использовать для их изучения.
Роль сортировки мРНК и белков в синтезе запасных белков семян, транспорте и отложении.
В этом мини-обзоре будет предпринята попытка ответить на ряд вопросов, поднятых в ходе недавних исследований механизмов синтеза, транспорта и отложения запасных белков в рисе, и выделить уникальные особенности эндомембранной системы растений.
Ферменты вакуолярного процессинга необходимы для правильного процессинга запасных белков семян у Arabidopsis thaliana*
Общие результаты показывают, что βVPE посевного типа наиболее важен для процессинга запасных белков и что VPE растительного типа и аспарагиновая протеиназа дополняют βVPE активность в этой обработке.
Отложение запасных белков
В некоторых случаях известно, что положительная информация о нацеливании опосредует сортировку в PSV, тогда как в других случаях агрегация и мембранная ассоциация, по-видимому, являются основными механизмами сортировки.
Различные функции VTI12 и VTI11 в переносе в запасающие и литические вакуоли у Arabidopsis
Продемонстрирована специализация VTI12 и VTI11 в опосредовании переноса в запасающие и литические вакуоли соответственно, а анализ секреции VAC2 признан простым методом для изолировать гены, которые опосредуют транспортировку в PSV.
Vacuolar Sorting Behaviors of 11S Globulins in Plant Cells
The accumulation behaviors of pea and pumpkin 11S во время созревания семян и сравнили их с биогенезом 11S сои, и определяющим фактором поведения накопления может быть поверхностная гидрофобность 11S.

 При действии этого реактива крахмальные зерна окрашиваются (в результате образования нестойкого соединения — йодистого крахмала) в синий цвет (от светло-синего до темно-фиолетового). Пользуясь этой реакцией, можно установить присутствие крахмала в любом органе.
При действии этого реактива крахмальные зерна окрашиваются (в результате образования нестойкого соединения — йодистого крахмала) в синий цвет (от светло-синего до темно-фиолетового). Пользуясь этой реакцией, можно установить присутствие крахмала в любом органе.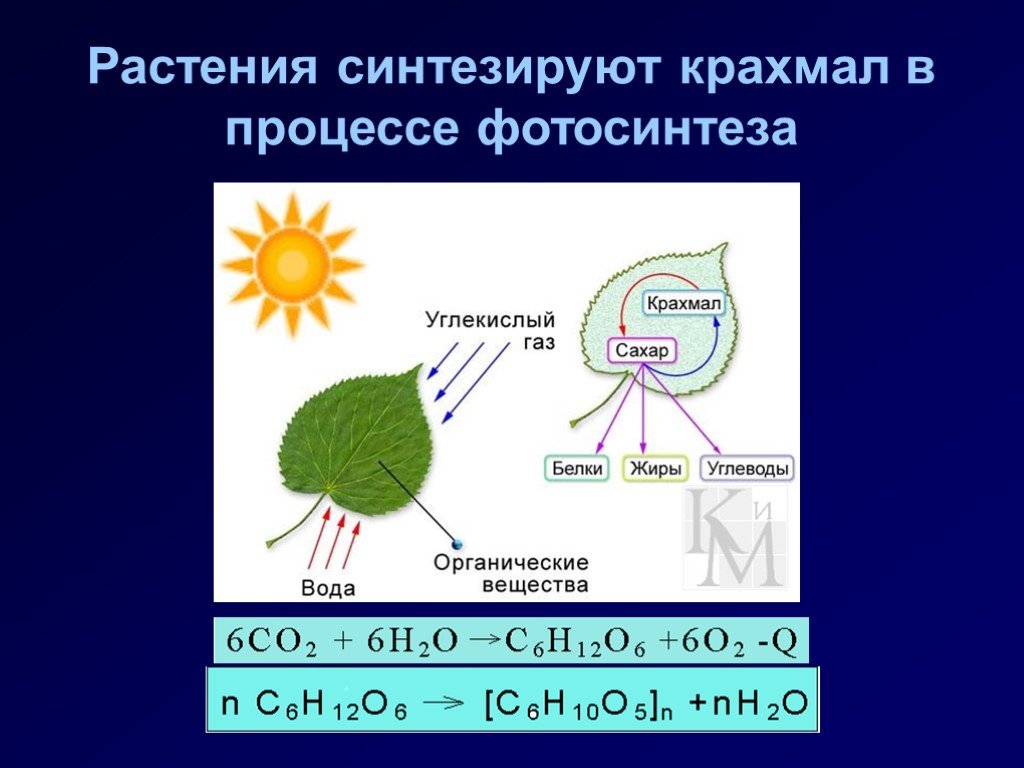
 Е. Ботаника: Морфология и анатомия растений: учеб. пособие для студентов пед. ин-тов по биолог. и хим. спец. / А. Е. Васильев [и др]; — 2-е изд., перераб. — М.: Просвещение, 1988. — С. 73 — 78.
Е. Ботаника: Морфология и анатомия растений: учеб. пособие для студентов пед. ин-тов по биолог. и хим. спец. / А. Е. Васильев [и др]; — 2-е изд., перераб. — М.: Просвещение, 1988. — С. 73 — 78.
 Vitale, I. Hwang
Vitale, I. Hwang
 Этот обзор будет охватывать внутриклеточное движение, биохимическую обработку и зрелые структуры напинов для хранения семян.
Этот обзор будет охватывать внутриклеточное движение, биохимическую обработку и зрелые структуры напинов для хранения семян. , Коэн Э., Вондер Хаар Р., Адамс С., Ма Д., Несслер С., Томас Т.
, Коэн Э., Вондер Хаар Р., Адамс С., Ма Д., Несслер С., Томас Т.
 Crossref | Академия GoogleАкадемия Google |
Crossref | Академия GoogleАкадемия Google | , Уэлдон Р., Моннот С., Мейнке Д.
, Уэлдон Р., Моннот С., Мейнке Д. , Кин Дж., Финдли Дж. К., Лорд Дж. М.
, Кин Дж., Финдли Дж. К., Лорд Дж. М. , Ямада К., Хацугай Н., Кондо М., Нисимура М., Хара-Нисимура И.
, Ямада К., Хацугай Н., Кондо М., Нисимура М., Хара-Нисимура И. , Шимада Т., Такахаши Х., Уэда Х., Фукао Ю., Кондо М., Нисимура М., Хара-Нисимура И.
, Шимада Т., Такахаши Х., Уэда Х., Фукао Ю., Кондо М., Нисимура М., Хара-Нисимура И. , Шимада Т., Такахаши Х., Комото Ю., Сиракава М., Такаги Дж., Чжао Х., Ту Б., Джин Х., Шен З., Хан Б., Цзя М., Кондо М., Нисимура М., Хара-Нисимура И.
, Шимада Т., Такахаши Х., Комото Ю., Сиракава М., Такаги Дж., Чжао Х., Ту Б., Джин Х., Шен З., Хан Б., Цзя М., Кондо М., Нисимура М., Хара-Нисимура И. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK3sXltFWmtrc%3D&md5=e16f3909ee9fda77681bd5cd27b15cfaCAS | 8425538PubMed |
Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DyaK3sXltFWmtrc%3D&md5=e16f3909ee9fda77681bd5cd27b15cfaCAS | 8425538PubMed | Дж., Клементе А.
Дж., Клементе А. Растительная клетка 24 , 2765–2778.
Растительная клетка 24 , 2765–2778.  , Юнг Р., Штехелин Л.А.
, Юнг Р., Штехелин Л.А. Биохимия 42 , 13 839–13 847
Биохимия 42 , 13 839–13 847  Биохимия 43 , 6976–6986.
Биохимия 43 , 6976–6986.  PLoS ONE 7 , e46435
PLoS ONE 7 , e46435 
 , Комото Ю., Ли Л., Ямадзаки М., Кондо М., Нисимура М., Хара-Нисимура И.
, Комото Ю., Ли Л., Ямадзаки М., Кондо М., Нисимура М., Хара-Нисимура И. Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC2cXitVOqsrs%3D&md5=c5c8f7a84bebb20aa8567f89e14ce753CAS | 24280388PubMed |
Crossref | Академия GoogleАкадемия Google | 1:CAS:528:DC%2BC2cXitVOqsrs%3D&md5=c5c8f7a84bebb20aa8567f89e14ce753CAS | 24280388PubMed |
