Содержание
Ткани растений презентация, доклад
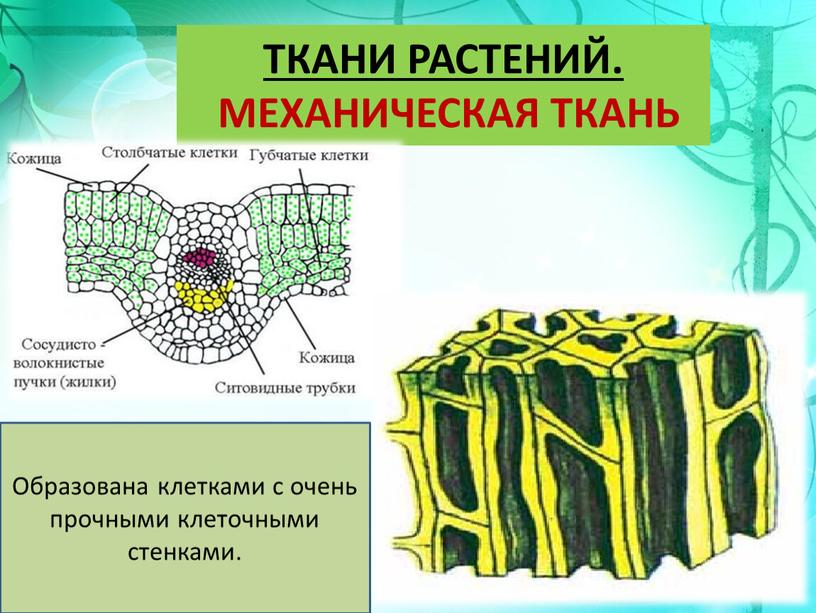
Ткани растений
Ткань — группа клеток, сходных по строению, функциям и имеющих общее происхождение
Словарь
Ткани растений
Проводящая
Покровная
Основная (паренхима)
Образовательная (меристема)
Механическая
Ксилема (древесина)
Флоэма
(луб)
Проводящая ткань
Вода
Минеральные соли
Клетки мертвые,
вытянутые в длину
Клетки живые, вытянутые, без ядра
(от греч. «xylon» — срубленное дерево) — водопроводящая ткань растений, образующая древесину, образуются годичные кольца.
(от греч. «phloios» — кора) —служит для транспортировки продуктов фотосинтеза от листьев к другим органам (корням, плодам и т. д.).
д.).
Органические вещества
Волокна
Паренхимные клетки
Сосуды
Трахеиды
Склереиды
Лубяная паренхима
Лубяные волокна
Ксилема (древесина)
Флоэма
(луб)
Ситовидные трубки
Клетки-спутницы
Проводящая ткань
Флоэма
Ксилема
Покровная ткань
Устьица (эпидермис листьев и стеблей травянистых растений), восковой налет, волоски
Кора (старые ветки и стволы деревьев)
Комплекс отмерших тканей
(основная ткань, старая пробка)
Многослойная ткань
Чечевички
Эпидермис (кожица)
Пробка, вторичная покровная кань
(стебли и корни многолетников)
Эпидермис
Волоски на листе
Устьица
Клетки живые, тонкостенные, со всеми органоидами; часто с хлоропластами
Функции – защитная, испарение воды, газообмен
Чечевички
Пробка
Клетки мертвые, с плотными оболочками, пропитанными жироподобным веществом
Функции – защитная, газообмен (через чечевички)
Кора
Клетки мертвые, заполнены воздухом, с толстыми оболочками
Функции – защитная, газообмен )через трещины коры)
Водные и болотные растения
Эндосперм
Видоизменения корня и стебля
Паренхима лубяная и древесная
Мякоть листа
Некоторые клетки коры стебля
Основная ткань (паренхима)
Ассимиляционная
(хлоренхима)
Запасающая
Воздухоносная
(аэренхима)
Функции – фотосинтез
Функции – накопление воздуха в межклетниках
Функции – запас питательных веществ, влаги
Губчатая хлоренхима
Столбчатая хлоренхима
Клеточное строение ассимиляционного участка листа
Клетки имеют тонкие стенки и много хлоропластов
Древесная паренхима
Эндосперм с запасами белка и лейкопласты
Клетки округлые или многоугольные, живые; много межклетников
Аэренхима
Клетки округлые или звездчатые, расположены рыхло; много крупных межклетников
Образовательная ткань (меристема)
Камбий
Меристемы верхушечные, боковые, вставочные и кончика корня
Строение:
клетки многогранные, тонкостенные, без вакуолей и хлоропластов, постоянно делятся
Функции:
рост растения и начало другим тканям
Механическая ткань
Колленхима
Склеренхима
Склереиды
Колленхима
Склеренхима
Клетки с толстыми одревесневшими стенками
Функции – обеспечить упругость и прочность растений
Первичная кора
Флоэма
Камбий
Древесина
Пробка
Сердцевина
Внутреннее строение стебля
http://www.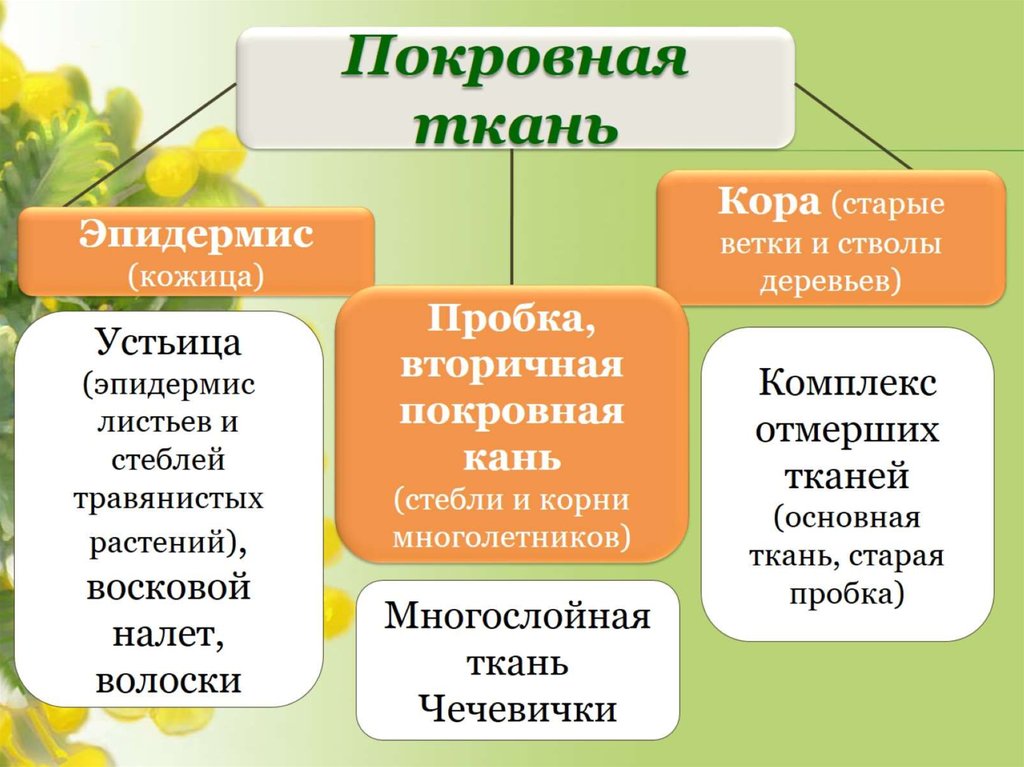 thej-files.com/news/158/993/part-6/ —
thej-files.com/news/158/993/part-6/ —
http://dic.academic.ru/pictures/ntes/137-2.jpg — ксилема
http://bugs.bio.usyd.edu.au/http://bugs.bio.usyd.edu.au/- Школа биологических наук, университет Сиднея
http://www.sakhalin.ru/boomerang/Drevesnue/images/fakt/stat/stat-(16).jpg – ксилема, флоэма
http://www.megabook.ru/MObjects2/data/pict2004/biology/biol130.jpg — ткани растений (Энциклопедия Кирилла и Мефодия)
http://www.thej-files.com/images/MedZdravNizza/GaZim/03,03Rastenia/Rastenia37.jpg — образовательная ткань
http://www.bacdefrancais.net/SVT/meristeme.jpg — меристема
http://www.microscopy-uk.org.uk/mag/imgaug04/wd/004-Aptenia-hoja.jpg — устьица
http://upload.wikimedia.org/wikipedia/commons/thumb/7/7c/Leaf_epidermis.jpg/592px-Leaf_epidermis.jpg — волоски на листе
http://tinea.narod.ru/gallery/wp/cortex_alnus_800x600.jp — кора
http://img-fotki.yandex.ru/get/19/hontor.8d/0_ea94_90e16599_XL — кора
Единая коллекция цифровых образовательных ресурсов — http://school-collection. edu.ru/
edu.ru/
http://www.biology.ru/course/content/chapter9/section2/paragraph3/theory.html — Открытая биология. Лекции
http://flowers.flowers-to-world.com/images/large_37-tilia-image-320.jpg — флоэма липы
http://st.free-lance.ru/users/BlackSnake/upload/filesWxdUO.jpg — спиральная ксилема
http://www.biology.ru/course/content/chapter9/section2/paragraph3/images/09020203.gif — сосуды и трахеиды в древесине клена
Использованные ресурсы
http://www.medbiol.ru/medbiol/botanica/001bdf70.htm — биология и медицина
http://www.medbiol.ru/medbiol/botanica/images/gif-mal/41.gif — ассимиляционная ткань листа
http://www.globalvolga.ru/images/drevesinovedenie/149.jpg — древесная паренхима
http://www.microscopy-uk.org.uk/mag/imgaug04/wd/035-aptenia.jpg — трахеиды
http://www.botany.hawaii.edu/BOT470/Cells&Tissues/images/cell/or-49blab.jpg — ткани эндосперма
http://www.sfrc.ufl.edu/4h/other_resources/contest/highlighted_ecosystem/droppropDisplay. jpghttp://www.sfrc.ufl.edu/4h/other_resources/contest/highlighted_ecosystem/droppropDisplay.jpg — растения мангровых зарослей http://www.sfrc.ufl.edu/4h/other_resources/contest/highlighted_ecosystem/aerenchyma1.jpg — аэренхима
jpghttp://www.sfrc.ufl.edu/4h/other_resources/contest/highlighted_ecosystem/droppropDisplay.jpg — растения мангровых зарослей http://www.sfrc.ufl.edu/4h/other_resources/contest/highlighted_ecosystem/aerenchyma1.jpg — аэренхима
http://www2.mcdaniel.edu/Biology/botf99/imagesfor%20questions/stemrtimagesf/woodwhf.jpg — клеточное строение стебля
http://dic.academic.ru/pictures/enc_colier/0816_024.jpg — ткани растения
http://www.biology.iastate.edu/Courses/212L/New%20Site/images%202005/cells&tissues/04GrdTis/tissues%20label2.jpg – механические ткани
http://www.biology.iastate.edu/ — Колледж сельского хозяйства и наук о жизни
Институт свободных искусств и наук. Биология программы. Айова.
http://www.botany.hawaii.edu/faculty/webb/BOT311/BOT311-00/Cells&Tissues/images/ParColSclr/LargeSclereidLayers400.jpg — склереиды
Использованные ресурсы
Скачать презентацию
Ткани растений и их виды. | Презентация к уроку по биологии (6 класс) на тему:
Слайд 1
Ткани растений и их виды
Слайд 2
Ткань — это группа клеток, сходных по строению, происхождению и выполняющих определенные функции.
Слайд 3
Гистология — наука о тканях. М. Мальпиги и Н. Грю — основоположники гистологии. Неемия Грю в 1671г. Предложил этот термин.
Слайд 4
Образовательная ткань
Слайд 5
Образовательная ткань Строение Функции Расположение Клетки молодые, небольшие по размеру, с тонкими оболочками и крупными ядрами, плотно прилегающие друг к другу, способные к постоянному делению Деление клеток, рост растения, образование новых органов Верхушка корня, стебля (конус нарастания), камбий
Слайд 6
Покровная ткань – выполняет защитные функции
Слайд 7
Покровная ткань (кожица)
Слайд 8
Кожица Строение Функции Расположение Состоит из одного слоя плотно прилегающих друг к другу клеток Уменьшение испарения и регуляция газообмена Стебли и листья молодых растений, плоды, семена, части цветка
Слайд 9
Покровная ткань (пробка)
Слайд 10
Пробка Строение Функции Расположение Несколько рядов плотно прилегающих друг к другу мертвых клеток, заполненных воздухом Защита от потери влаги, колебаний температуры, болезнетворных бактерий Однолетние побеги деревьев и кустарников
Слайд 11
Покровная ткань (корка)
Слайд 12
Корка Строение Функции Расположение Многослойная мертвая ткань Защита от механических повреждений, резких перепадов температур Стволы многолетних кустарников и деревьев
Слайд 13
Механическая ткань
Слайд 14
Механическая ткань Строение Функции Расположение Клетки чаще всего имеют вытянутую форму, с одеревеневшими оболочками; располагаются в виде тяжей, пластинок Роль скелета (опорная функция) Луб, стебли, черешки и жилки листьев
Слайд 15
Проводящая ткань (сосуды = ксилема)
Слайд 16
Проводящая ткань (ситовидные трубки = флоэма)
Слайд 17
Проводящая ткань Строение Функции Расположение Представлена сосудами, образованными длинными вытянутыми мертвыми клетками, расположенными вертикально, с разрушенными поперечными перегородками; и ситовидными трубками – живыми вытянутыми клетками с отверстиями в поперечной стенке, напоминающей сито Передвижение воды с минеральными веществами от корня к листьям и органических веществ от листьев к другим органам растения Стебли, корни и жилки листьев, луб стебля, корня
Слайд 18
Основная ткань Строение Функции Расположение Занимает пространство между покровными, механическими и проводящими тканями Зависит от положения в органах Все органы растения
Слайд 19
Основная ткань (фотосинтезирующая)
Слайд 20
Фотосинтезирующая Строение Функции Расположение Клетки с тонкими стенками, с большим числом хлоропластов, расположены рыхло с большими межклетниками Образование органических веществ в процессе фотосинтеза Листья растений, стебли трав
Слайд 21
Основная ткань (запасающая)
Слайд 22
Запасающая Строение Функции Расположение Крупные тонкостенные клетки, расположенные достаточно плотно Запасание органических веществ Корневища, клубни, луковицы, плоды, семена, стебли и листья некоторых растений
Слайд 23
Воздухоносная
Слайд 24
Воздухоносная Строение Функции Расположение Имеет крупные межклетники, соединенные между собой в вентиляционную сеть Обеспечивает клетки кислородом, позволяет плавать на поверхности В подводных органах водных и болотных растений, в воздушных корнях
Слайд 25
Выделительная ткань
Слайд 26
Выделительная Строение Функции Расположение Живые клетки с вакуолями, содержащими эфирные масла, смолы, нектар, воду и др. Выделение различных веществ в окружающую среду или внутрь растений. Защита от поедания животными, повреждения насекомыми, микроорганизмами; привлечение насекомых-опылителей На поверхности или внутри различных органов
Выделение различных веществ в окружающую среду или внутрь растений. Защита от поедания животными, повреждения насекомыми, микроорганизмами; привлечение насекомых-опылителей На поверхности или внутри различных органов
Культура тканей растений Free Essay Example
Культура тканей растений представляет собой набор методов, используемых для поддержания или выращивания растительных клеток, тканей или органов в стерильных условиях на питательной культуральной среде известного состава. Культура растительной ткани широко используется для получения клонов растения методом, известным как микроразмножение. Различные методы культивирования растительных тканей могут иметь определенные преимущества по сравнению с традиционными методами размножения, включая: • Производство точных копий растений, дающих особенно хорошие цветы, плоды или обладающих другими желательными признаками.
Не используйте плагиат. Получите индивидуальное эссе на тему
«Культура тканей растений»
НОВИНКА! Smart Matching with Writer
• Для быстрого выращивания взрослых растений.
• Производство нескольких растений при отсутствии семян или необходимых опылителей для производства семян. • Регенерация целых растений из генетически модифицированных растительных клеток. • Производство растений в стерильных контейнерах, что позволяет их перемещать, что значительно снижает вероятность передачи болезней, вредителей и патогенов. • Производство растений из семян, которые в противном случае имеют очень низкие шансы на прорастание и рост, например: орхидеи и непентесы. • Очищать определенные растения от вирусных и других инфекций и быстро размножать эти растения в качестве «очищенного поголовья» для садоводства и сельского хозяйства.
Культура растительных тканей основана на том факте, что многие растительные клетки обладают способностью регенерировать целое растение (тотипотентность). Отдельные клетки, клетки растений без клеточных стенок (протопластов), кусочки листьев или (реже) корней часто можно использовать для создания нового растения на питательной среде с учетом необходимых питательных веществ и растительных гормонов.
Методы
Современные культуры тканей растений получают в асептических условиях с воздухом, отфильтрованным HEPA, подаваемым в ламинарный бокс.
Живые растительные материалы из окружающей среды естественным образом загрязнены на своей поверхности (а иногда и внутри) микроорганизмами, поэтому требуется стерилизация поверхности исходного материала (эксплантатов) в химических растворах (обычно гипохлорите натрия или кальция или хлориде ртути). Хлорид ртути сегодня редко используется в качестве стерилизующего средства для растений, если только другие стерилизующие агенты не признаны неэффективными, поскольку его использование опасно и его трудно утилизировать. Затем эксплантаты обычно помещают на поверхность твердой культуральной среды, но иногда помещают непосредственно в жидкую среду, особенно когда желательны культуры клеточных суспензий. Твердые и жидкие среды обычно состоят из неорганических солей, а также нескольких органических питательных веществ, витаминов и фитогормонов.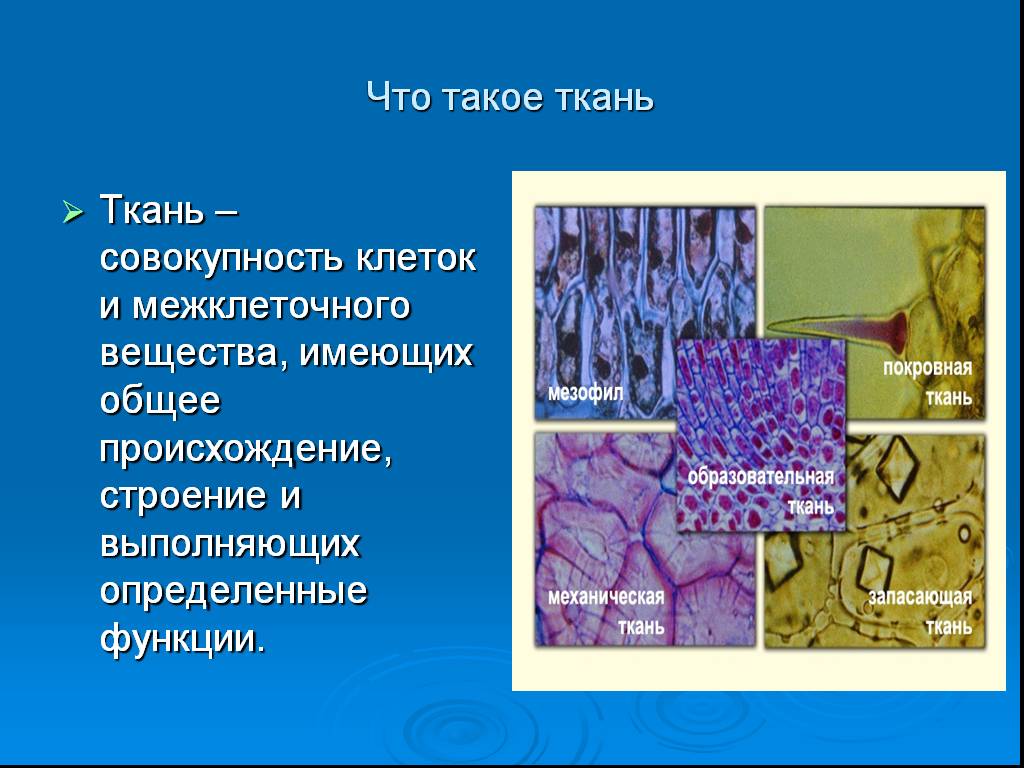 Твердые среды готовят из жидких сред с добавлением гелеобразователя, обычно очищенного агара.
Твердые среды готовят из жидких сред с добавлением гелеобразователя, обычно очищенного агара.
Картофельные эксплантаты культуры тканей in vitro
Состав среды, особенно растительные гормоны и источник азота (нитраты по сравнению с солями аммония или аминокислотами), оказывают сильное влияние на морфологию тканей, которые растут из исходного эксплантата. Например, избыток ауксина часто приводит к пролиферации корней, тогда как избыток цитокинина может давать побеги. Баланс как ауксина, так и цитокинина часто вызывает неорганизованный рост клеток или каллус, но морфология нароста будет зависеть от вида растения, а также от состава среды. По мере роста культур кусочки обычно отрезают и переносят в новую среду (субкультивируют), чтобы обеспечить рост или изменить морфологию культуры. Навыки и опыт специалиста по культивированию тканей важны при принятии решения о том, какие части следует культивировать, а какие выбрасывать. Когда из культуры появляются побеги, их можно срезать и укоренять с помощью ауксина, чтобы получить проростки, которые, когда они созреют, можно перенести в горшечную почву для дальнейшего роста в теплице в качестве обычных растений.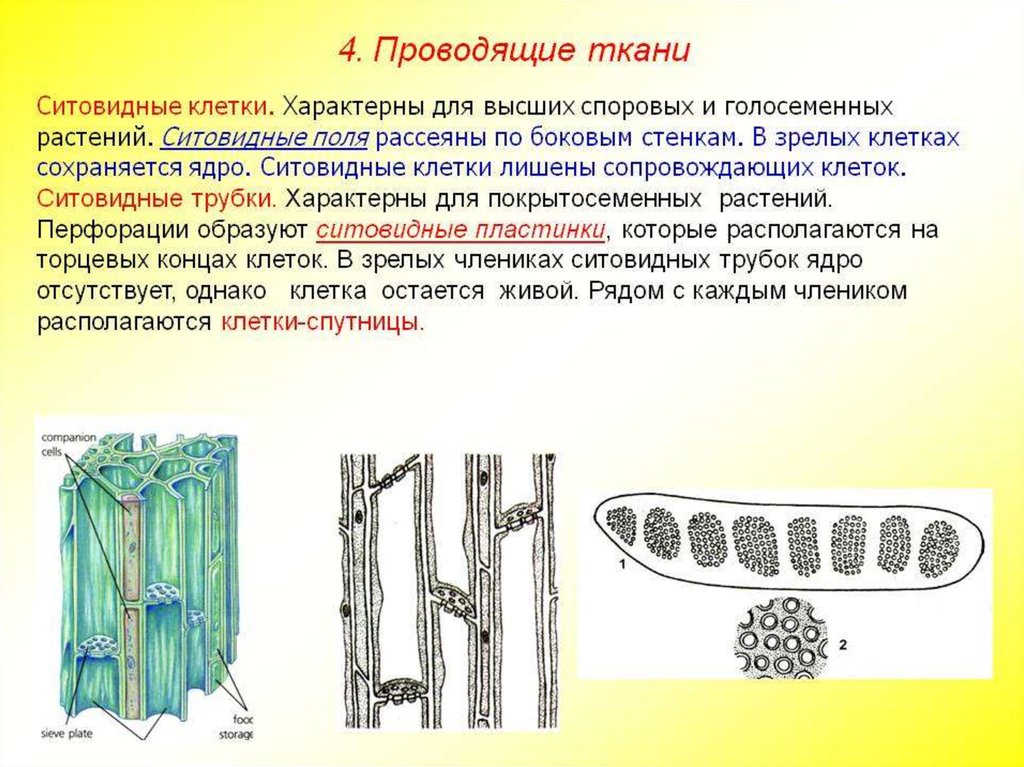
[1] Выбор эксплантата
Ткань, полученная из растения для культивирования, называется эксплантатом. На основании работы с некоторыми модельными системами, в частности с табаком, часто утверждалось, что тотипотентный эксплантат можно вырастить из любой части растения. Однако на практике эта концепция была нарушена. У многих видов экспланты различных органов различаются по скорости роста и регенерации, а некоторые вообще не растут. Выбор материала эксплантата также определяет, являются ли проростки, полученные с помощью культуры тканей, гаплоидными или диплоидными. Также повышается риск микробного заражения при использовании неподходящих эксплантатов. Таким образом, очень важно, чтобы правильный выбор эксплантата был сделан до культивирования ткани. Специфические различия в регенерационном потенциале разных органов и эксплантатов имеют различные объяснения.
Существенные факторы включают различия в стадии клеток в клеточном цикле, наличие или способность транспортировать эндогенные регуляторы роста и метаболические возможности клеток.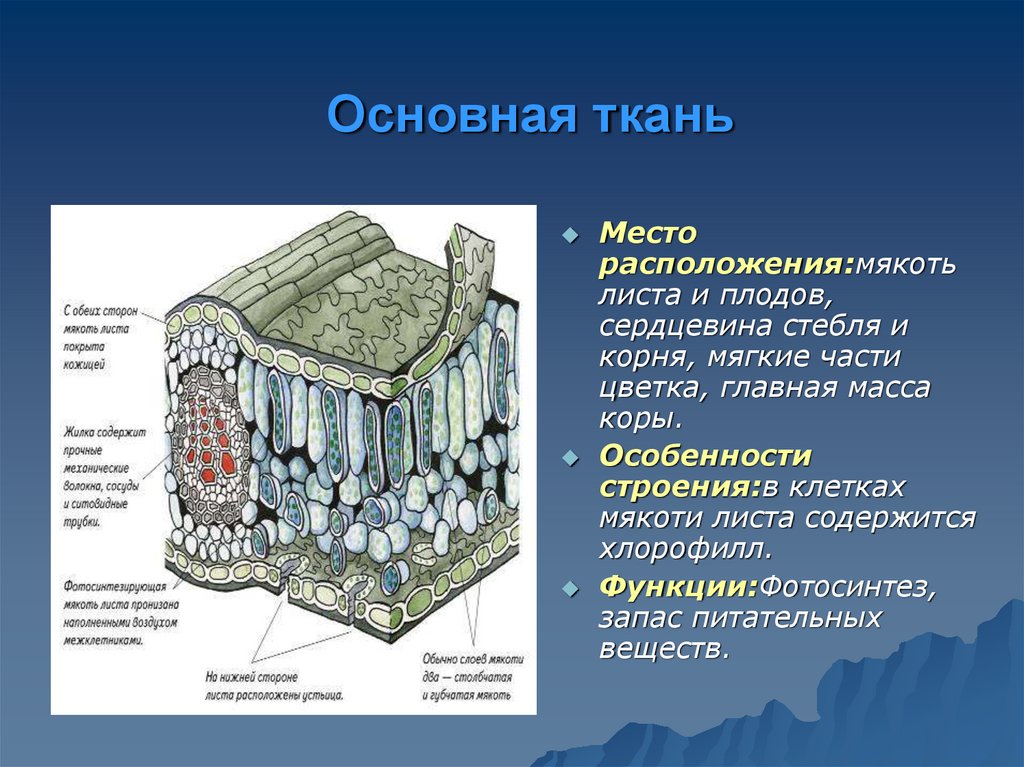 Наиболее часто используемые тканевые эксплантаты представляют собой меристематические концы растений, такие как кончик стебля, кончик вспомогательной почки и кончик корня. Эти ткани имеют высокую скорость клеточного деления и либо концентрируют, либо продуцируют необходимые вещества, регулирующие рост, включая ауксины и цитокинины. Пути регенерации целых растений из клеток и тканей или эксплантатов, таких как меристемы, можно разделить на три типа: 1. Метод, при котором экспланты, включающие меристему (т. регуляторы роста растений, чтобы вызвать пролиферацию нескольких побегов, с последующим укоренением вырезанных побегов для регенерации целых растений,
Наиболее часто используемые тканевые эксплантаты представляют собой меристематические концы растений, такие как кончик стебля, кончик вспомогательной почки и кончик корня. Эти ткани имеют высокую скорость клеточного деления и либо концентрируют, либо продуцируют необходимые вещества, регулирующие рост, включая ауксины и цитокинины. Пути регенерации целых растений из клеток и тканей или эксплантатов, таких как меристемы, можно разделить на три типа: 1. Метод, при котором экспланты, включающие меристему (т. регуляторы роста растений, чтобы вызвать пролиферацию нескольких побегов, с последующим укоренением вырезанных побегов для регенерации целых растений,
2. Способ, при котором тотипотентность клеток реализуется в форме органогенеза de novo либо непосредственно в виде индукции побеговых меристем на эксплантах, либо опосредованно через каллус (неорганизованная масса клеток, возникающая в результате пролиферации клеток эксплантата) и растения регенерируют путем индукции корней на образовавшихся побегах; 3. соматический эмбриогенез, при котором бесполые адвентивные зародыши (сопоставимые по своему строению и развитию с зиготными зародышами) индуцируются непосредственно на эксплантах или опосредованно через каллюсную фазу. Первый метод, включающий меристемы и индукцию множественных побегов, является предпочтительным методом для индустрии микроразмножения, поскольку риски сомаклональной изменчивости (генетическая изменчивость, индуцированная в культуре ткани) минимальны по сравнению с двумя другими методами. Соматический эмбриогенез — это метод, который потенциально может в несколько раз повысить скорость размножения и пригоден для работы в жидкостных культуральных системах, таких как биореакторы. Некоторые экспланты, такие как кончик корня, трудно изолировать и они загрязнены почвенной микрофлорой, что становится проблематичным в процессе культивирования тканей.
соматический эмбриогенез, при котором бесполые адвентивные зародыши (сопоставимые по своему строению и развитию с зиготными зародышами) индуцируются непосредственно на эксплантах или опосредованно через каллюсную фазу. Первый метод, включающий меристемы и индукцию множественных побегов, является предпочтительным методом для индустрии микроразмножения, поскольку риски сомаклональной изменчивости (генетическая изменчивость, индуцированная в культуре ткани) минимальны по сравнению с двумя другими методами. Соматический эмбриогенез — это метод, который потенциально может в несколько раз повысить скорость размножения и пригоден для работы в жидкостных культуральных системах, таких как биореакторы. Некоторые экспланты, такие как кончик корня, трудно изолировать и они загрязнены почвенной микрофлорой, что становится проблематичным в процессе культивирования тканей.
Определенная почвенная микрофлора может образовывать тесные ассоциации с корневой системой или даже расти внутри корня. Частицы почвы, связанные с корнями, трудно удалить без повреждения корней, что в свою очередь делает возможной атаку микробов. Эта ассоциированная микрофлора обычно перерастает среду для культивирования тканей до того, как произойдет значительный рост растительной ткани. Воздушные (надпочвенные) экспланты также богаты нежелательной микрофлорой. Однако их легче удалить из эксплантата путем осторожного ополаскивания, а остальные обычно можно уничтожить поверхностной стерилизацией. Большая часть поверхностной микрофлоры не образует тесных ассоциаций с растительной тканью.
Эта ассоциированная микрофлора обычно перерастает среду для культивирования тканей до того, как произойдет значительный рост растительной ткани. Воздушные (надпочвенные) экспланты также богаты нежелательной микрофлорой. Однако их легче удалить из эксплантата путем осторожного ополаскивания, а остальные обычно можно уничтожить поверхностной стерилизацией. Большая часть поверхностной микрофлоры не образует тесных ассоциаций с растительной тканью.
Такие ассоциации обычно можно обнаружить при визуальном осмотре в виде мозаики, обесцвечивания или локального некроза на поверхности эксплантата. Альтернативой для получения незагрязненных эксплантов является взятие эксплантов из рассады, выращенной в асептических условиях из семян со стерилизованной поверхностью. Твердая поверхность семян менее проницаема для проникновения агрессивных поверхностных стерилизующих агентов, таких как гипохлорит, поэтому приемлемые условия стерилизации, используемые для семян, могут быть гораздо более жесткими, чем для вегетативных тканей. Культивируемые растения являются клонами. Если исходное материнское растение, используемое для получения первых эксплантов, восприимчиво к патогену или условиям окружающей среды, вся культура будет восприимчива к той же проблеме. И наоборот, любые положительные черты также останутся в пределах линии.
Культивируемые растения являются клонами. Если исходное материнское растение, используемое для получения первых эксплантов, восприимчиво к патогену или условиям окружающей среды, вся культура будет восприимчива к той же проблеме. И наоборот, любые положительные черты также останутся в пределах линии.
Применение
Культура тканей растений широко используется в науке о растениях; он также имеет ряд коммерческих приложений. Области применения включают: •Микроразмножение широко используется в лесном хозяйстве и цветоводстве. Микроразмножение также можно использовать для сохранения редких или исчезающих видов растений.[2] • Селекционер может использовать культуру тканей для скрининга клеток, а не растений, на наличие благоприятных признаков, т.е. устойчивость/толерантность к гербицидам. • Крупномасштабное выращивание растительных клеток в жидкой культуре в биореакторах для производства ценных соединений, таких как вторичные метаболиты растительного происхождения и рекомбинантные белки, используемые в качестве биофармацевтических препаратов. [3] • Скрещивать отдаленно родственные виды путем слияния протопластов и регенерации нового гибрида. • Для перекрестного опыления отдаленно родственных видов и последующего культивирования ткани полученного эмбриона, который в противном случае обычно погибает (спасение эмбрионов).
[3] • Скрещивать отдаленно родственные виды путем слияния протопластов и регенерации нового гибрида. • Для перекрестного опыления отдаленно родственных видов и последующего культивирования ткани полученного эмбриона, который в противном случае обычно погибает (спасение эмбрионов).
• Для получения удвоенных моноплоидных (дигаплоидных) растений из гаплоидных культур для более быстрого получения гомозиготных линий в программах селекции, обычно путем обработки колхицином, который вызывает удвоение числа хромосом. • В качестве ткани для трансформации с последующим либо кратковременным тестированием генетических конструкций, либо регенерацией трансгенных растений. • Определенные методы, такие как культивирование верхушечной меристемы, можно использовать для получения чистого растительного материала из зараженного вирусом сырья, такого как картофель и многие виды мягких фруктов. •Микроразмножение с использованием меристемы и культуры побегов для получения большого количества идентичных особей. • Может быть получено производство идентичных стерильных гибридных видов.
• Может быть получено производство идентичных стерильных гибридных видов.
Лаборатории
Хотя некоторые производители и питомники имеют свои собственные лаборатории для размножения растений методом культуры тканей, ряд независимых лабораторий предоставляет услуги размножения на заказ. В информационном обмене по культурам тканей растений перечислены многие коммерческие лаборатории по культурам тканей. Поскольку культивирование растительных тканей является очень трудоемким процессом, это будет важным фактором при определении того, какие растения будут коммерчески жизнеспособными для размножения в лаборатории.
Эрнест Вашингтон
Помните! Это всего лишь образец.
Вы можете получить индивидуальную статью от одного из наших опытных авторов.
Помощь студентам с 2015 года
Эссе о культуре тканей растений: 7 лучших эссе | Селекция растений
Вот эссе на тему «Культура тканей растений» для 8, 9, 10, 11 и 12 классов.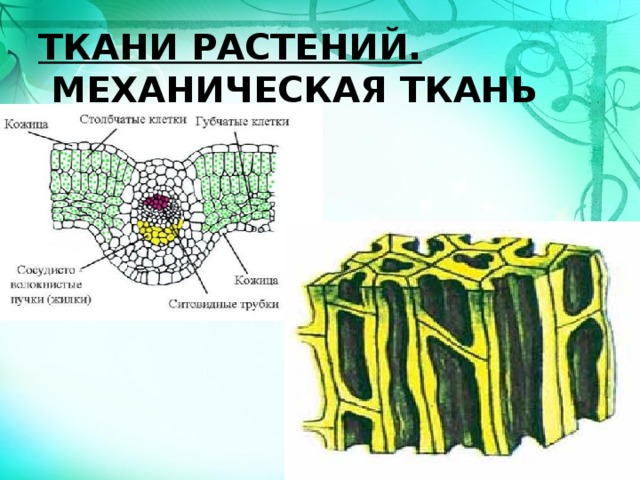 Найдите абзацы, длинные и короткие эссе на тему «Культура тканей растений», написанные специально для школьников и студентов.
Найдите абзацы, длинные и короткие эссе на тему «Культура тканей растений», написанные специально для школьников и студентов.
Содержание эссе:
- Очерк введения в культуру тканей растений
- Эссе о значении культуры тканей растений
- Очерк основных требований культуры тканей растений
- Эссе о важных этапах культивирования растительных тканей
- Очерк методов культуры тканей растений
- Эссе о применении культуры тканей растений
- Очерк преимуществ культуры тканей растений
Эссе № 1. Введение в культуру тканей растений:
Перед рассмотрением различных видов использования культур растительных тканей для улучшения сельскохозяйственных культур необходимо дать определение биотехнологии растений и терминов, обычно используемых в культурах растительных тканей. Биотехнология растений относится к комбинированному изучению культуры тканей растений и генной инженерии растений.
Основные особенности биотехнологии растений кратко представлены ниже:
1. Он состоит из применения двух основных методов, а именно:
(i) Культуры тканей растений и
(ii) Генная инженерия растений.
2. Обходит половой процесс при создании новых сортов сельскохозяйственных культур.
3. Преодолевает барьеры перекрестной несовместимости при отдаленных (межвидовых и межродовых) скрещиваниях и делает такие скрещивания практически осуществимыми.
4. Помогает в разработке трансгенных (генно-инженерных) растений с устойчивостью к гербицидам, биотическим и абиотическим стрессам и улучшенным качеством.
5. Это быстрый метод улучшения урожая. Например, тетраплоидные растения можно получить за одну стадию путем слияния протопластов.
Эссе № 2. Значение культуры тканей растений :
Культура тканей растений относится к выращиванию живых тканей растений в подходящей культуральной среде (in vitro).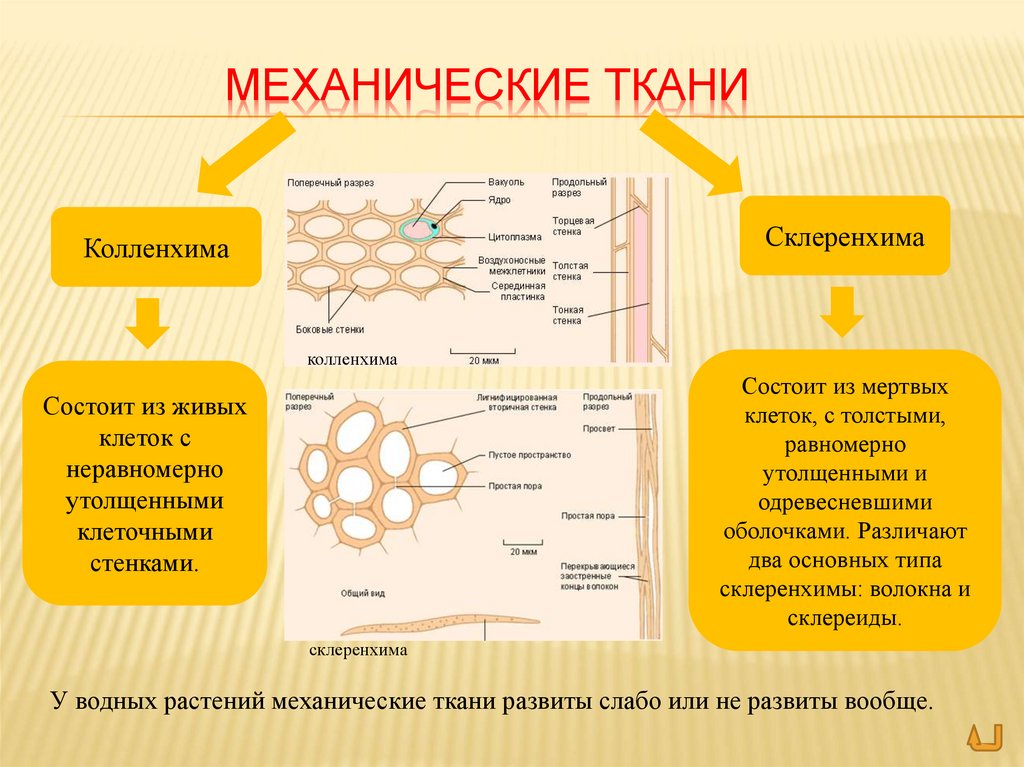 Питательная среда – это питательная среда, содержащая все необходимые микро- и макроэлементы, углеводы, витамины и гормоны. рН питательной среды должен быть 5,5.
Питательная среда – это питательная среда, содержащая все необходимые микро- и макроэлементы, углеводы, витамины и гормоны. рН питательной среды должен быть 5,5.
Однако питательная среда отличается от вида к виду. Таким образом, необходимо разработать подходящую среду для удовлетворения потребностей видов растений. В этой методике новые растения регенерируют из тканей, клеток и органов в пробирках в питательной среде. Орган включает любой орган растения, который имеет отдельную идентичность, такую как пыльник, семязачаток, зародыш и почка.
Часть растения, используемая для регенерации, называется эксплантатом. Это может быть клетка, протопласт, ткань или орган. Масса регенерированных клеток в культуральной среде называется каллюсом (плевральным каллюсом), а суспензия свободных клеток каллюса в жидкой среде известна как суспензионная культура.
Регенерационная способность или способность растительной клетки развиваться в целое растение известна как тотипотентность, которая показывает, что каждая клетка способна дать начало полноценному растению.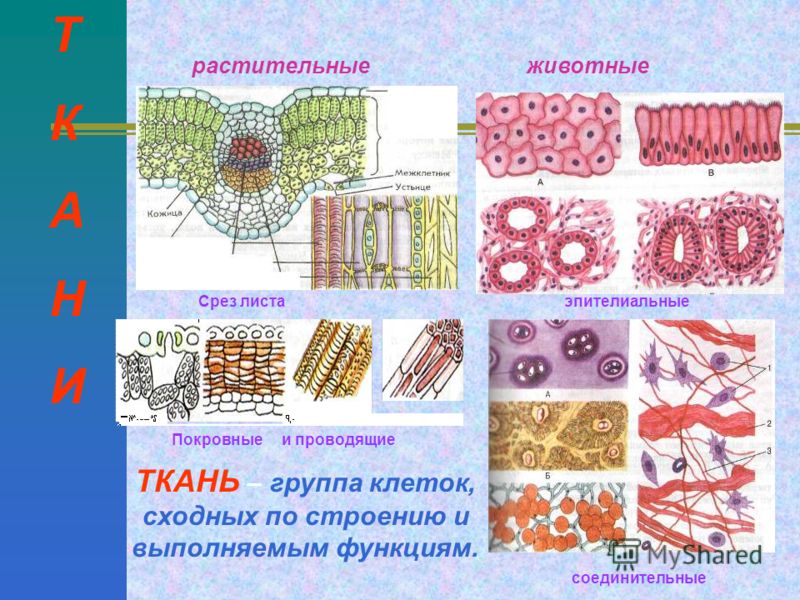 Культуры клеток и тканей приводят к регенерации всего растения. У некоторых видов, таких как морковь и сандаловое дерево, развиваются соматические зародыши, но у некоторых культур, таких как пшеница, рис, ячмень и табак, развитие как корня, так и побега происходит из каллусов.
Культуры клеток и тканей приводят к регенерации всего растения. У некоторых видов, таких как морковь и сандаловое дерево, развиваются соматические зародыши, но у некоторых культур, таких как пшеница, рис, ячмень и табак, развитие как корня, так и побега происходит из каллусов.
Эссе № 3. Основные требования к культуре тканей растений :
В методах культивирования тканей существуют некоторые основные требования, а именно:
(1) Асептические условия,
(2) Контроль температуры,
(3) Подходящие питательные среды и
(4) Субкультура.
Они кратко описаны ниже:
(1) Асептические условия:
В лаборатории тканевых культур должны быть асептические условия. Это означает, что он должен быть хорошо стерилизован от патогенов. Среда, свободная от патогенов, поможет поддерживать хорошее здоровье каллусных, клеточных или протопластных культур, что приведет к восстановлению здоровых растений из таких культур.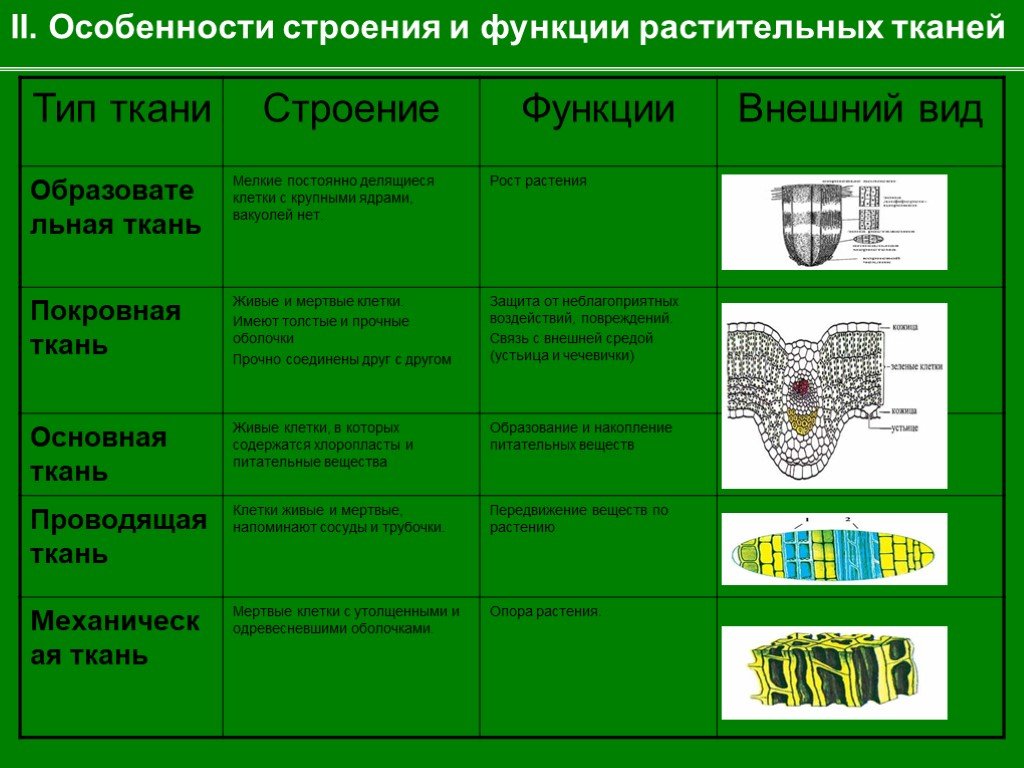 Эксплантат и стеклянная посуда должны быть должным образом стерилизованы перед их поступлением в лабораторию тканевых культур.
Эксплантат и стеклянная посуда должны быть должным образом стерилизованы перед их поступлением в лабораторию тканевых культур.
(2) Контроль температуры:
Необходимо кондиционирование воздуха в лаборатории тканевых культур. Обычно используется температура 18-25°C. Однако это варьируется от вида к виду. Высокая температура негативно влияет на рост мозоли.
(3) Подходящая культуральная среда:
Питательные среды были разработаны разными специалистами для разных видов сельскохозяйственных культур. Среда должна быть изменена в соответствии с требованиями вида. Питательные среды, разработанные Мурасиге и Скугом (1962) и Gamberg, et al. (1968) используются с некоторыми модификациями для различных видов сельскохозяйственных культур. Состав питательной среды, разработанный Мурашиге и Скугом (1962), приведен в табл. 29.1.
(4) Подкультура:
Перенос ткани или каллюса со старой питательной среды на свежую питательную среду называется пересевом.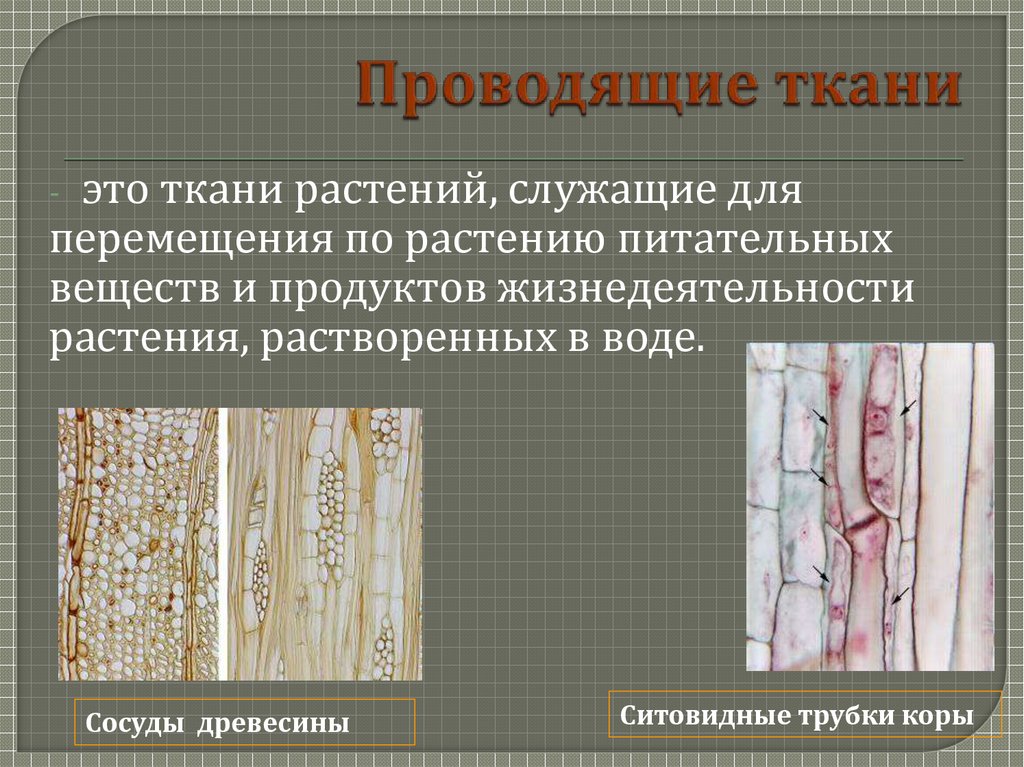 Это важно для поддержания хорошего здоровья каллюса или тканей, потому что через некоторое время некоторые питательные вещества в культуральной среде истощаются, и замена среды становится необходимой.
Это важно для поддержания хорошего здоровья каллюса или тканей, потому что через некоторое время некоторые питательные вещества в культуральной среде истощаются, и замена среды становится необходимой.
Эссе № 4. Важные этапы культивирования тканей растений :
Методика культивирования тканей обычно состоит из четырех важных этапов, а именно:
(1) Изоляция тканей,
(2) Регенерация и образование мозолей в культуральной среде,
(3) Эмбриогенез и
(4) Органогенез (рис. 29.1).
Они кратко описаны ниже:
(1) Изоляция тканей:
Ткань для регенерации может быть выделена с помощью стерилизованного лезвия из любой части растения, , а именно . лист, стебель, верхушечная почка, пазушная почка и т. д. Выделенные ткани стерилизуют и затем выращивают на питательной среде. Ткани должны быть изолированы от здоровой части.
(2) Регенерация и образование костной мозоли:
Ткани разрастаются в культуральной среде и дают начало массе клеток, называемой каллюсом.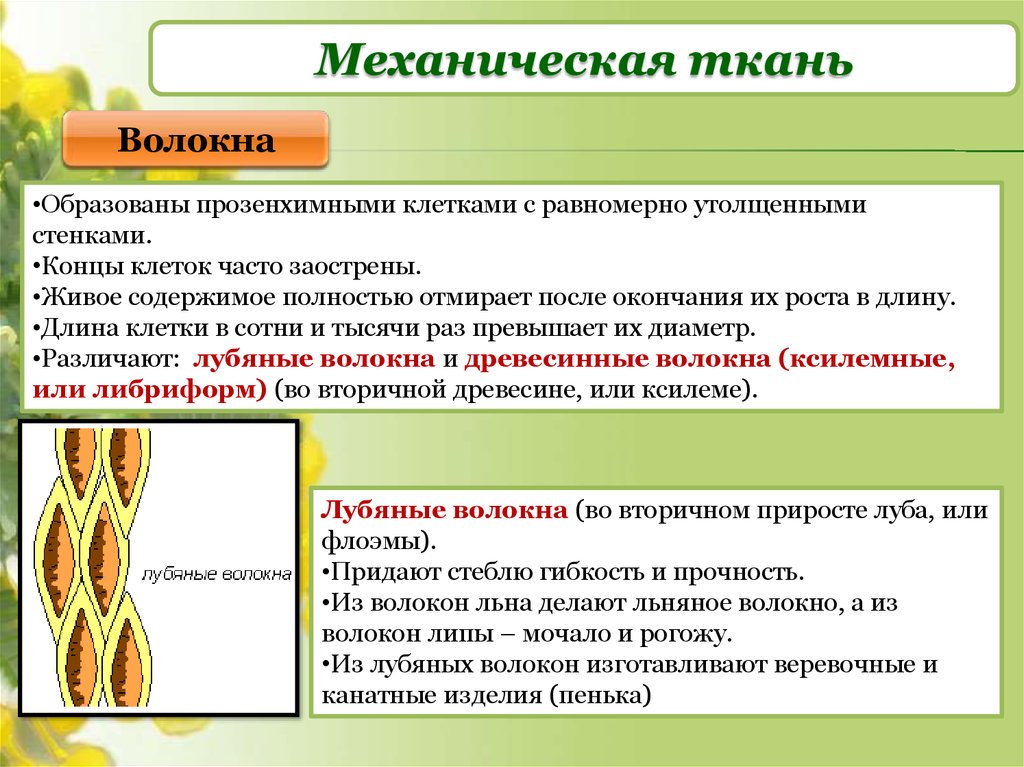 Мозоли обычно бывают двух типов, , а именно . рыхлая мозоль и компактная мозоль. Рыхлым каллюсом можно легко манипулировать для суспензионной культуры. Однако компактный каллюс не подходит для суспензионной культуры.
Мозоли обычно бывают двух типов, , а именно . рыхлая мозоль и компактная мозоль. Рыхлым каллюсом можно легко манипулировать для суспензионной культуры. Однако компактный каллюс не подходит для суспензионной культуры.
(3) Эмбриогенез :
Процесс образования соматических зародышей из каллуса называется эмбриогенезом. Иногда соматические зародыши не образуются, а образуются соматические почки, которые после прорастания дают начало растению. Субкультивирование приводит к здоровому росту каллуса и быстрому эмбриогенезу.
(4) Органогенез :
Процесс дифференцировки побега и корня из соматических зародышей называется органогенезом. Иногда целое растение развивается непосредственно из соматической почки. В таких случаях соматические зародыши не образуются. Обычно растение развивается из соматических зародышей после прорастания.
Полученные таким образом растения через некоторое время переносят в горшечную культуру из питательной среды. Перед пересадкой растений-регенерантов из питательной среды в горшки почву в горшках необходимо стерилизовать для обезвреживания патогенов.
Перед пересадкой растений-регенерантов из питательной среды в горшки почву в горшках необходимо стерилизовать для обезвреживания патогенов.
Эссе 5. Методы культивирования растительных тканей:
Методы культивирования тканей также называют методами in vitro. Методы in vitro дают новые растения путем регенерации тканей и органов в питательной среде. Различные части растений, , а именно. меристемы, зародыш, пыльник, клетки и семязачаток используются для регенерации.
В зависимости от части растения, используемой в качестве эксплантата, методы культивирования тканей растений бывают пяти основных типов, а именно:
(1) Меристемная культура
(2) Культура эмбрионов,
(3) Культура пыльников,
(4) Клеточная культура и
(5) Посев семяпочек.
Краткое описание и практическое применение этих методов улучшения урожая представлены ниже:
(1) Культура меристем:
Культура меристемы относится к регенерации всего растения из тканей активно делящейся части растения, такой как кончик стебля, кончик корня или вспомогательная почка.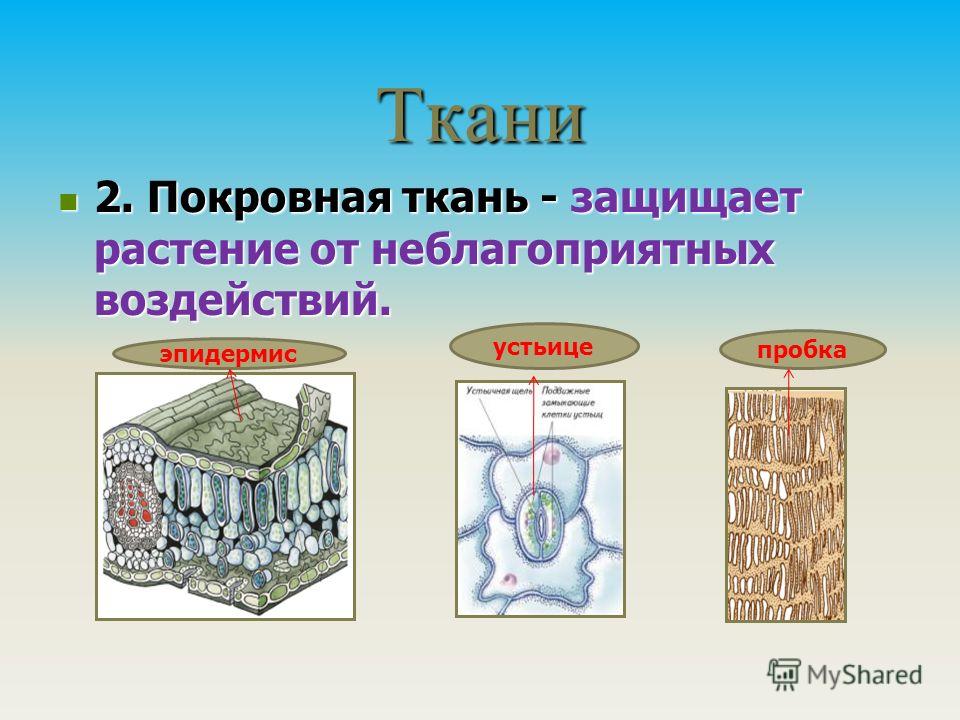 Обычно для регенерации используется верхушечная меристема побега. Другими словами, для культивирования в питательной среде используют ткани верхушки побега.
Обычно для регенерации используется верхушечная меристема побега. Другими словами, для культивирования в питательной среде используют ткани верхушки побега.
Регенерация достигается в подходящей культуральной среде. Среда отличается от вида к виду. Этот метод широко используется для вегетативно размножаемых культур, таких как сахарный тростник, картофель, бананы и некоторые виды фруктовых деревьев и древесины.
Ниже приведены основные области применения культуры меристем для улучшения сельскохозяйственных культур:
я. Он используется для микроразмножения (массовое производство клонального потомства с помощью культуры тканей) бананов, клубники, цитрусовых и некоторых древесных деревьев, таких как Delbergia sissoo (сисам).
ii. С помощью этого метода можно получить растения, свободные от вирусов, потому что клетки меристемы почти свободны от вируса даже в зараженных вирусом растениях.
III. Обмен зародышевой плазмой проростков, полученных культурой меристем, безопасен, поскольку такой материал свободен от насекомых и патогенов.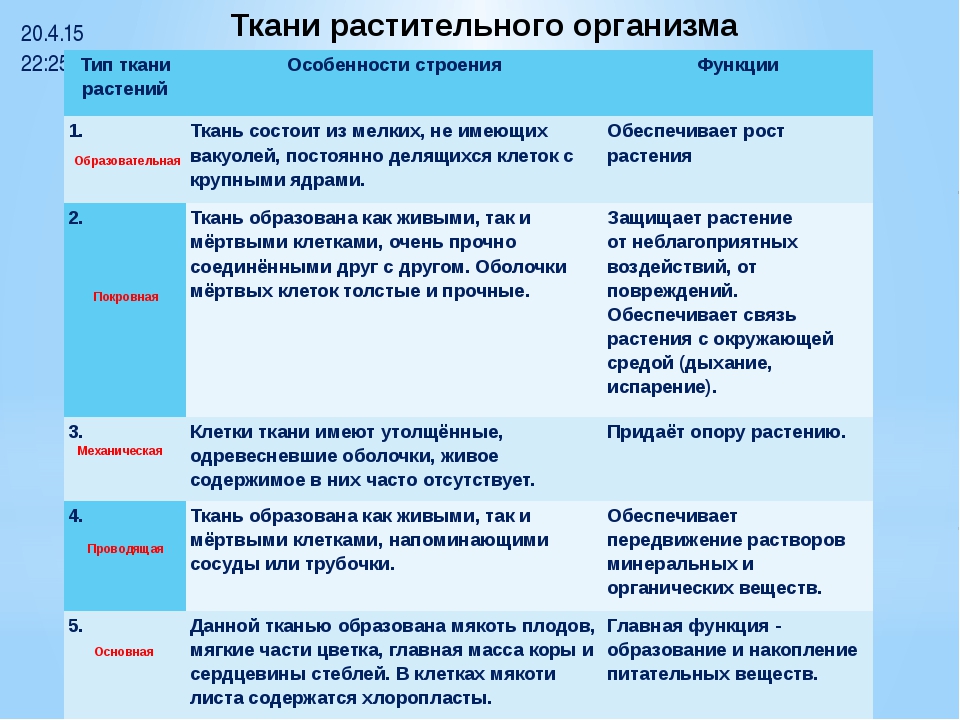 Это полезно при обмене зародышевой плазмой видов растений, размножаемых бесполым путем.
Это полезно при обмене зародышевой плазмой видов растений, размножаемых бесполым путем.
ив. Зародышевая плазма может сохраняться в виде меристем при -196°C для длительного хранения в жидком азоте. Другими словами, меристемы пригодны для криоконсервации.
(2) Культура эмбрионов:
Регенерация всего растения из зародыша в культуральной среде называется зародышевой культурой. Эмбрионы соответствующей стадии удаляют из семени и переносят в питательную среду. Этот метод используется, когда существует дисгармония между зародышем и эндоспермом.
Эта техника используется для успешных дальних кроссов. Эмбрион при отдаленных скрещиваниях удаляют перед абортом и культивируют на питательной среде. Этот метод был использован для успешной межвидовой гибридизации в Trifolium, Lycopersicon и некоторые другие роды. Он также использовался для успешного межродового скрещивания между Hordeum и Secale, Hordeum и Triticum, Triticum и Secale, Triticum и Aegilops и т. д.
д.
Ниже приведены основные области применения метода культивирования эмбрионов для улучшения урожая:
я. Это полезно для успешного отдаленного скрещивания (межвидового и межродового).
ii. Это полезно для получения гаплоидных растений от межвидовых и межродовых скрещиваний. Гоплоиды были получены в результате межвидового скрещивания ячменя, а также в результате межродового скрещивания пшеницы и ячменя.
III. У орхидей семенам не хватает пищи, и они не могут размножаться. Эмбриональная культура полезна для получения сеянцев таких видов. Таким образом, культура эмбрионов полезна в разведении орхидей.
ив. Семена некоторых видов растений имеют длительный период покоя – до двух лет. Такой покой встречается у Prunus, Iris и Taxus . У этих видов мы можем получить рассаду сразу путем культивирования зародышей. Таким образом, культура зародышей эффективна для нарушения длительного покоя семян.
(3) Культура пыльников:
Регенерация целого растения из другого или пыльцы в питательной среде называется пыльниковой или пыльцевой культурой.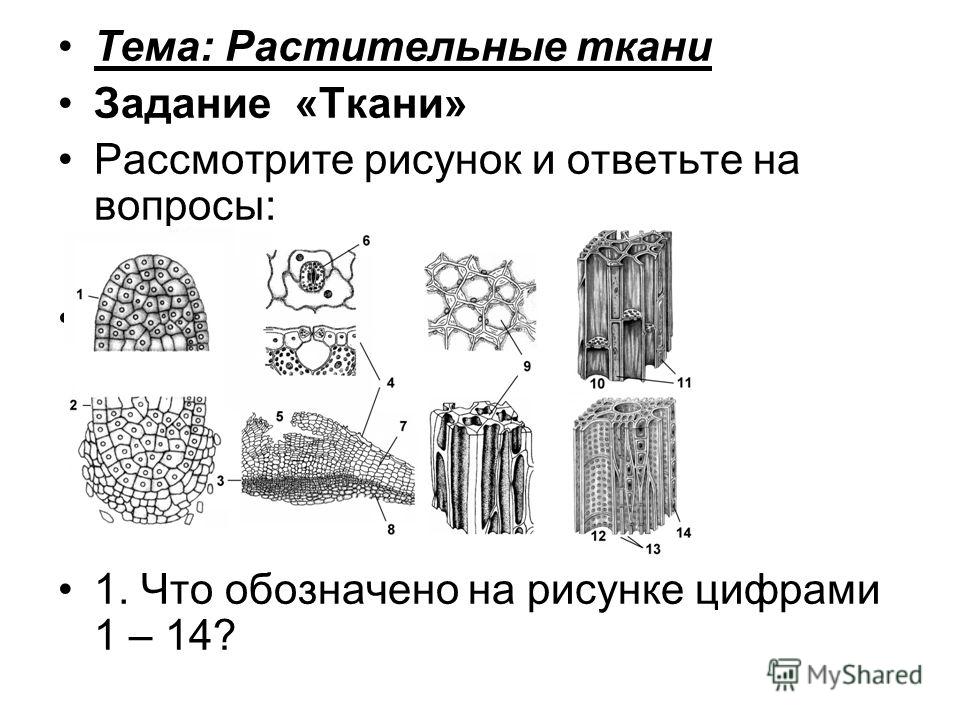 С растения берут пыльники соответствующей стадии. Оптимальная стадия может отличаться от вида к виду. Этот прием используется для получения гаплоидных растений. Этот метод использовался для различных культур, таких как , , Brassica, , , табак. Петуния, рис, ячмень, пшеница, помидоры, картофель, Тритикале , и т. д.
С растения берут пыльники соответствующей стадии. Оптимальная стадия может отличаться от вида к виду. Этот прием используется для получения гаплоидных растений. Этот метод использовался для различных культур, таких как , , Brassica, , , табак. Петуния, рис, ячмень, пшеница, помидоры, картофель, Тритикале , и т. д.
Ниже приведены основные области применения этой техники для улучшения урожая:
я. Это полезно для развития гаплоидов. Гаплоиды были получены культурой пыльцы пшеницы, ячменя, риса, Тритикале, картофеля, Brassica campestris и др.
ii. Удваивая число хромосом гаплоидов, мы получаем гомозиготные диплоиды.
(4) Культура клеток:
Регенерация всего растения из каллуса и суспензионных культур в питательной среде известна как клеточная культура. Протопласты (голые клетки или клетки без клеточной стенки) также используются для регенерации целых растений. Техника культивирования клеток использовалась на различных культурных растениях, таких как пшеница, рисовый ячмень, кукуруза, табак, а также на некоторых фруктовых и древесных деревьях.
Ниже приведены основные области применения этого метода:
я. Это полезно в массовом клональном производстве различных видов.
ii. Культура пратопластов полезна при соматической гибридизации и преодолении барьеров перекрестной несовместимости при межвидовых и межродовых скрещиваниях.
III. Культуры клеток и культуры протопластов полезны при разработке трансгенных (генетически модифицированных) растений. Этот метод используется для генетической трансформации почти всех важных сельскохозяйственных культур.
ив. Эмбриогенные культуры клеток пригодны для криоконсервации, т.е. хранения в жидком азоте при температуре -196°C. Эмбриогенные культуры используются для длительного сохранения многих видов сельскохозяйственных культур.
(5) Посев яйцеклеток:
Регенерация всего растения из семязачатка в питательной среде называется культурой семязачатка. Это также известно как культура яичников.
Два типа семязачатков, а именно:
(i) без удобрений и
(ii) Возможно наличие удобрений.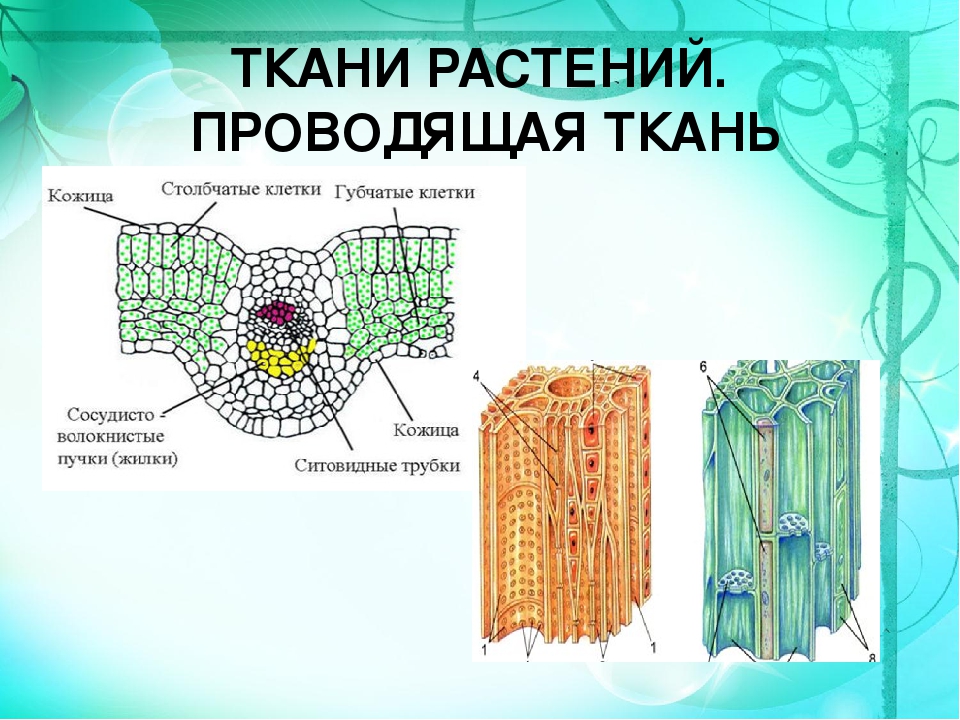
Этот метод используется для спасения эмбрионов при отдаленных скрещиваниях. Гаплоидные растения получают из культуры неоплодотворенных семязачатков, а диплоидные – из оплодотворенных семязачатков. Эта техника использовалась ограниченно.
Эссе № 6. Применение культуры тканей растений:
Ниже приводится краткое описание некоторых областей применения культур тканей растений:
I. Генерация изменчивости :
Изменчивость, индуцированная в культуре ткани, является важным источником изменчивости для улучшения урожая. В зависимости от эксплантата вариации, индуцированные тканевой культурой, бывают трех типов: а именно: гаметоклональные, сомаклональные и протоклональные.
(i) Гаметоклональная вариация:
Изменчивость, наблюдаемая среди растений, регенерированных из гаметной культуры, называется гаметоклональной изменчивостью. Такая изменчивость наблюдается среди растений-регенерантов из культуры пыльников или семязачатков.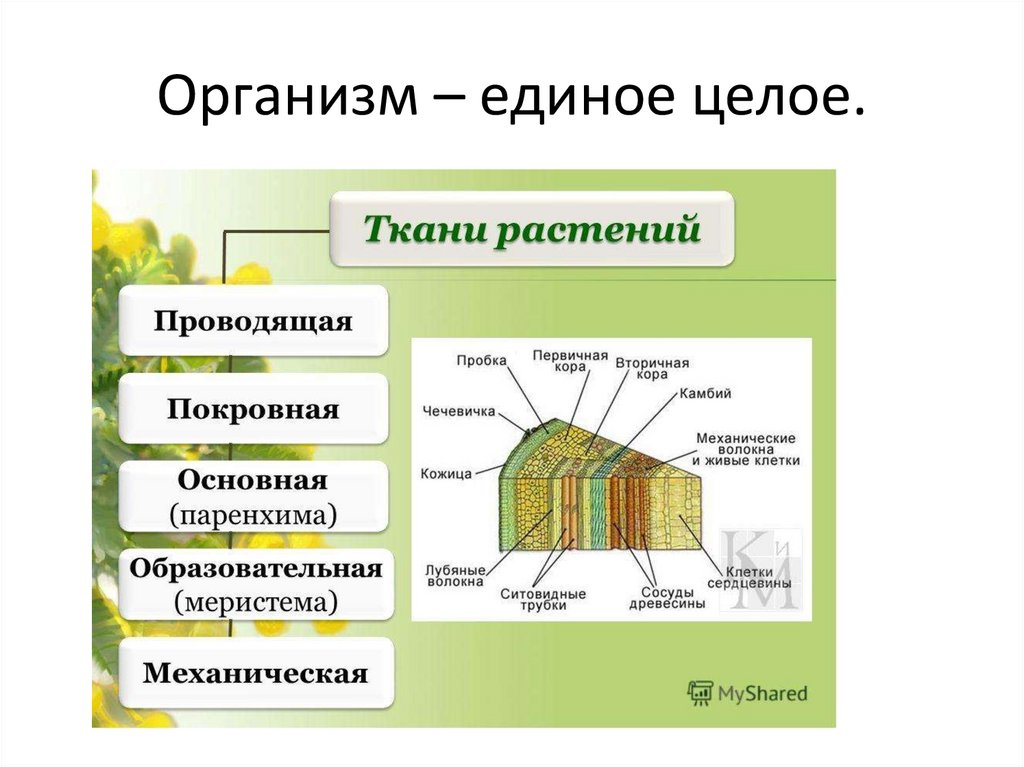
(ii) Сомаклональная вариация:
Изменчивость, наблюдаемая среди растений, регенерированных из каллусных культур соматических эксплантов, таких как меристемы, называется сомаклональной изменчивостью.
(iii) Протоклональная вариация.
Изменчивость, наблюдаемая среди растений, регенерированных из каллусных культур протопласта, называется протоклональной изменчивостью.
Основные характеристики изменчивости, индуцированной культурой, кратко представлены ниже:
(a) Изменение имеет генетическое происхождение и, следовательно, передается по наследству.
(b) Сомаклональная изменчивость встречается как у видов, размножающихся половым, так и бесполым путем. Но частота такой изменчивости очень высока у видов, размножаемых вегетативно (до 75% у картофеля и сахарного тростника), и низка у видов, размножаемых семенами (0,8-1,2% у кукурузы).
(в) Встречается как по олигогенным, так и по полигенным признакам (табл. 29.2).
29.2).
(d) В большинстве случаев сомаклональная вариация имеет гетерозиготное происхождение. Редко вариация является истинной селекции или гомозиготной, как это было зарегистрировано в сомаклонах пшеницы и горчицы.
(e) Все три типа культуральных вариаций возникают в результате хромосомных изменений, таких как делеции, дупликации, инверсии и транслокации.
(f) Частота изменчивости у протоклонов выше, чем у сомаклонов и гаметоклонов из-за стресса, вызванного процессом удаления клеточной стенки и ее последующего синтеза.
Сомаклональная вариация полезна по нескольким причинам.
Помогает в (i) изоляции устойчивых к болезням, (ii) солеустойчивых, (iii) устойчивых к гербицидам, (iv) устойчивых к токсичности металлов и (v) раннеспелых вариантов. Сомаклоны, устойчивые к болезням, были выделены в нескольких сельскохозяйственных культурах, таких как сахарный тростник, картофель, табак и декоративные растения.
У многих сельскохозяйственных культур наследуемые сомаклональные вариации приводят к развитию новой зародышевой плазмы. Из такой вариации мутанты с устойчивостью к болезням, стрессовым условиям и хорошего качества могут быть выделены после надлежащего скрининга.
Из такой вариации мутанты с устойчивостью к болезням, стрессовым условиям и хорошего качества могут быть выделены после надлежащего скрининга.
II. Развитие гаплоидов:
Гаплоиды могут быть получены методом культивирования тканей. Гаплоиды вырабатываются пыльниковой культурой. Гаплоиды становятся диплоидными при обработке колхицином. Гаплоиды были получены более чем у 250 видов растений методом культивирования пыльников. В Китае было выведено по одному сорту пшеницы [Цзинхуа 1] и риса [Гуань 18] для коммерческого выращивания с помощью культуры тканей. Новые сорта по агрономическим свойствам лучше старых сортов.
III. Спасение эмбрионов :
Техника культивирования зародыша помогает добиться успеха в межвидовых скрещиваниях, когда существует дисгармония между зародышем и эндоспермом после оплодотворения. Зародыш при межвидовом скрещивании удаляют перед абортом и культивируют на питательной среде. Техника спасения эмбрионов использовалась для успешной межвидовой гибридизации в родах Trifolium и Lycopersicon.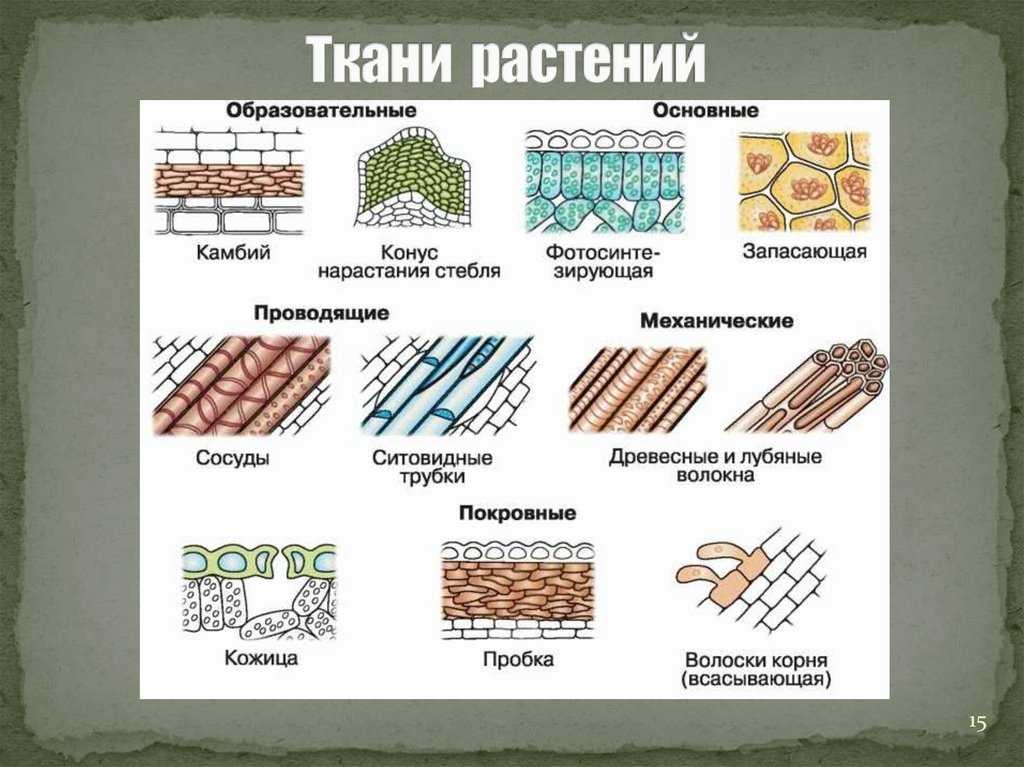
Техника культивирования эмбрионов также использовалась для получения успешных межродовых гибридов между Triticum и Aegilops, Triticum и Secale и некоторыми другими родами. У ячменя выделение семязачатков от межвидовых скрещиваний сразу после оплодотворения помогло в регенерации растений ячменя в Германии. В Международном научно-исследовательском институте риса, Филиппины, метод культивирования эмбрионов был успешно использован для переноса устойчивости к бурой цикадке (BPH) от диких видов Oryza officinalis к культурным видам O. sativa.
Аналогичным образом метод спасения эмбрионов использовался для некоторых других культур. Главный недостаток культуры зародышей заключается в том, что она применима к тем отдаленным скрещиваниям, где скрещивание возможно и проблемы связаны с постоплодотворением.
IV. Соматическая гибридизация:
Скрещивание растений путем слияния соматических клеток известно как соматическая гибридизация. При такой гибридизации обходится половой процесс. Слияние клеток происходит через протопласты. Протопласты — это голые клетки или клетки без клеточной стенки. Соматическая гибридизация посредством слияния протопластов позволяет скрещивать любые два растения независимо от их таксономического родства.
Слияние клеток происходит через протопласты. Протопласты — это голые клетки или клетки без клеточной стенки. Соматическая гибридизация посредством слияния протопластов позволяет скрещивать любые два растения независимо от их таксономического родства.
Другими словами, это делает возможным несовместимое скрещивание. Соматическая гибридизация состоит из нескольких этапов, а именно:
(i) Выделение протопластов,
(ii) Слияние протопластов,
(iii) Отбор гибридных клеток,
(iv) Культура гибридных клеток,
(v) Регенерация растений из гибридных тканей и
(vi) Характеристика гибридных растений.
V. Отбор на устойчивость к болезням:
Для селекции устойчивых к болезням линий возбудитель включают в питательную среду. Культуры каллуса восприимчивых генотипов поддерживают рост патогенных грибов, в то время как устойчивые клетки не поддерживают, как это наблюдалось в картофеле и табаке. У картофеля растения, устойчивые к увяданию и корневым гнилям, вызываемым Fusarium oxysporium, были выделены методом культивирования тканей.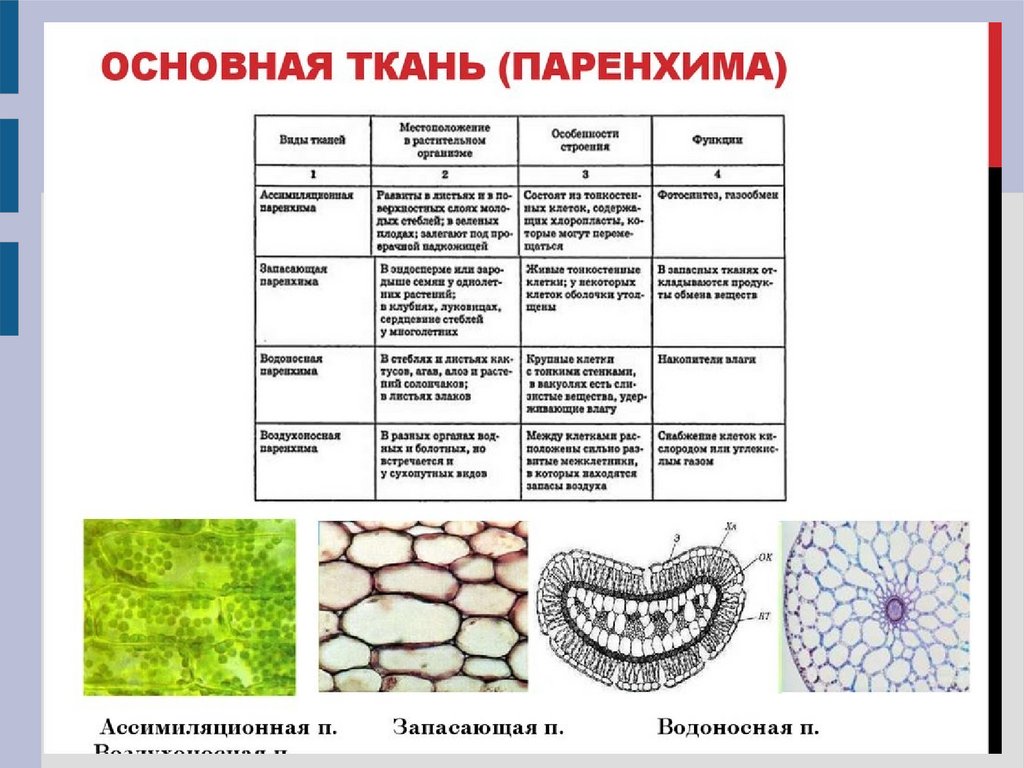
У томатов, табака и люцерны устойчивость к вирусу была получена путем заражения каллуса слабым вирусом. Культура тканей может помочь в возрождении некоторых сортов сельскохозяйственных культур, которые устарели из-за их восприимчивости к определенному заболеванию. Вирус мозаики представляет собой серьезную проблему для зернобобовых культур, таких как зеленый грамм, черный грамм, соя и других культур, таких как папайя и бамия.
Культура тканей может помочь в выделении свободных от мозаики линий в этих культурах. Свободный от болезней материал был получен из картофеля, табака, томатов, сахарного тростника и некоторых плодовых культур с помощью метода культуры тканей.
VI. Отбор на устойчивость к солености и токсичности металлов:
Культура тканей играет важную роль в идентификации и выделении солеустойчивых генотипов. Метод культивирования клеток используется для селекции устойчивых к засолению генотипов. Миллионы клеток подвергают воздействию повышенного уровня физиологического раствора в колбе. В таком растворе выживают только резистентные или толерантные клетки.
В таком растворе выживают только резистентные или толерантные клетки.
Уцелевшие клетки используют для регенерации солеустойчивых растений. Таким образом, клеточная культура является простым и быстрым методом получения устойчивых к засолению генотипов. Точно так же могут быть выделены генотипы, устойчивые к гербицидам и токсичности металлов.
VII. Отбор по засухоустойчивости:
В культуральной среде засуха вызывается использованием химического вещества, известного как ПЭГ (полиэтиленгликоль). Засухоустойчивые или устойчивые к водному стрессу генотипы были выделены с помощью метода культивирования тканей томата и 9 растений.0210 Сорго. Низкое содержание пролина является показателем устойчивости к водному стрессу. Это также помогает в выделении устойчивых к водному стрессу линий в культуре тканей.
VIII. Микроразмножение:
Техника культивирования тканей полезна для быстрого и массового размножения растительного материала. Для этой цели используется микроразмножение. Микроразмножение относится к регенерации растений из изолированных меристемных клеток или тканей или из соматических клеток. Это также известно как микроклонирование.
Для этой цели используется микроразмножение. Микроразмножение относится к регенерации растений из изолированных меристемных клеток или тканей или из соматических клеток. Это также известно как микроклонирование.
Микроразмножение можно использовать для массового размножения культурных растений, которые трудно размножить половым путем, или тех видов, которые размножаются вегетативно, скорость размножения которых низкая. Микроразмножение также можно использовать для массового размножения превосходных гибридов в качестве альтернативы производству гибридных семян.
Микроразмножение имеет несколько преимуществ, перечисленных ниже:
я. Это обеспечивает свободный от патогенов статус здоровья пропагул. Пропагулы — это небольшие растения, полученные путем микроразмножения.
ii. Это помогает в быстром умножении материала. Этим методом можно получить большое количество черенков с одного растения.
III. Материал, умноженный с помощью этой техники, можно хранить в небольшом месте. Транспортировка таких пропагул из одного места в другое также проста.
Транспортировка таких пропагул из одного места в другое также проста.
ив. Микроразмножение может дать результаты быстрее, чем обычное размножение. В основном используется в садоводстве, цветоводстве и лесном хозяйстве.
Этот метод использовался для получения ранних и свободных от болезней линий клубники, бананов, цитрусовых и некоторых древесных деревьев. В полевых культурах микроразмножение использовалось для картофеля и сахарного тростника.
Основные проблемы с этой техникой:
(а) сомаклональная вариация и
(b) Изменение числа хромосом из-за непрерывного субкультивирования.
IX. Сохранение зародышевой плазмы:
Сохранение зародышевой плазмы в виде тканей является важным применением культуры тканей для улучшения урожая. Клетка или ткани могут быть сохранены в жидком азоте при длительном хранении. Клетки или ткани обрабатывают диметилсульфоксидом для защиты от обморожения. Сохранение тканей более полезно для вегетативно размножаемых культур, которые обычно не способны давать семена.