Содержание
КЛЕТОЧНАЯ ИНЖЕНЕРИЯ • Большая российская энциклопедия
Авторы: Г. Е. Онищенко
КЛЕ́ТОЧНАЯ ИНЖЕНЕ́РИЯ, совокупность методов клеточной биологии, позволяющих конструировать клетки с новыми свойствами. К. и. возникла в кон. 19 в., когда впервые попытались выращивать изолированные кусочки растит. тканей на питательной среде. В 1907 амер. биологу Р. Гаррисону удалось культивировать в капле лимфы клетки зачатка нервной системы зародыша лягушки. В 1-й четв. 20 в. был предложен метод выращивания клеток животных в плазме крови (см. Культура клеток и тканей). Позднее разработаны приёмы получения разл. вариантов культур клеток растений, животных и человека, методы гибридизации, переноса внутрь клеток отд. органелл или белков, конструирования органелл, генетической инженерии.
Основополагающим методом К. и., наряду с культурой клеток и тканей, является метод гибридизации – слияния отд. клеток (или их фрагментов), выращенных в условиях культивирования или выделенных из организма; он позволяет объединять клетки организмов, принадлежащих разл. видам и даже царствам (напр., клетки моркови с клетками человека). С его помощью можно изменять как генетич. аппарат клеток, так и их плоидность (число хромосомных наборов). Он даёт возможность комбинировать органеллы разного происхождения (напр., ядра, центросомы, митохондрии) в цитоплазме слившейся клетки. При объединении ядерного фрагмента одной клетки (кариопласта) с цитоплазматич. фрагментом др. клетки (цитопластом) образуется реконструированная клетка. Технология переноса ядра, извлечённого из соматической клетки, внутрь яйцеклетки, из которой предварительно удалено собственное ядро, лежит в основе клонирования организмов. Введение конструкций, состоящих из фрагментов ДНК, позволяет изменять геном клетки таким образом, что в ней происходит либо гиперэкспрессия некоторых генов, либо прекращение экспрессии ряда генов, либо экспрессия чужеродных для данной клетки генов.
клеток (или их фрагментов), выращенных в условиях культивирования или выделенных из организма; он позволяет объединять клетки организмов, принадлежащих разл. видам и даже царствам (напр., клетки моркови с клетками человека). С его помощью можно изменять как генетич. аппарат клеток, так и их плоидность (число хромосомных наборов). Он даёт возможность комбинировать органеллы разного происхождения (напр., ядра, центросомы, митохондрии) в цитоплазме слившейся клетки. При объединении ядерного фрагмента одной клетки (кариопласта) с цитоплазматич. фрагментом др. клетки (цитопластом) образуется реконструированная клетка. Технология переноса ядра, извлечённого из соматической клетки, внутрь яйцеклетки, из которой предварительно удалено собственное ядро, лежит в основе клонирования организмов. Введение конструкций, состоящих из фрагментов ДНК, позволяет изменять геном клетки таким образом, что в ней происходит либо гиперэкспрессия некоторых генов, либо прекращение экспрессии ряда генов, либо экспрессия чужеродных для данной клетки генов. Используя такие приёмы, можно получить как трансгенные клетки для выращивания вне организма, так и трансгенные организмы с заданными свойствами. Введение в клетки определённых фрагментов РНК (её называют интерферирующей РНК) приводит к прекращению экспрессии тех или иных генов на короткое или продолжительное время.
Используя такие приёмы, можно получить как трансгенные клетки для выращивания вне организма, так и трансгенные организмы с заданными свойствами. Введение в клетки определённых фрагментов РНК (её называют интерферирующей РНК) приводит к прекращению экспрессии тех или иных генов на короткое или продолжительное время.
К. и. используется для решения как мн. теоретич. проблем клеточной биологии (изучения взаимодействия ядра и цитоплазмы, механизма клеточной дифференцировки и регуляции клеточного цикла, превращения нормальной клетки в опухолевую и др.), так и практич. задач медицины и с. х-ва. Являясь составной частью биотехнологии, К. и. применяется для получения высокопродуктивных линий клеток, образующих моноклональные антитела (см. Гибридомы), создания новых форм растений, устойчивых к неблагоприятным условиям среды, болезням и вредителям, с ускоренным ростом, большей продолжительностью хранения плодов, улучшением их качества и увеличением количества. Она даёт возможность сохранять генотипы отд. организмов и создавать банки генофондов целых видов, получать вакцины (напр., против кори, полиомиелита), моделировать ткани (тканевая инженерия) и органы, которые могут служить материалом для трансплантации, позволяет преодолеть мн. проблемы биоэтики, связанные с умерщвлением животных. Клеточные конструкции, выращенные вне организма, при введении в организм могут, напр., усиливать рост кровеносных сосудов или нервных отростков в поражённых участках организма, заменять суставы или способствовать восстановлению кожных покровов, повреждённых в результате ожогов или др. травм.
Она даёт возможность сохранять генотипы отд. организмов и создавать банки генофондов целых видов, получать вакцины (напр., против кори, полиомиелита), моделировать ткани (тканевая инженерия) и органы, которые могут служить материалом для трансплантации, позволяет преодолеть мн. проблемы биоэтики, связанные с умерщвлением животных. Клеточные конструкции, выращенные вне организма, при введении в организм могут, напр., усиливать рост кровеносных сосудов или нервных отростков в поражённых участках организма, заменять суставы или способствовать восстановлению кожных покровов, повреждённых в результате ожогов или др. травм.
Клеточная и генная инженерия, клонирование / Справочник :: Бингоскул
Клеточная и генная инженерия, клонирование
добавить в закладки удалить из закладок
Содержание:
Современные направления биотехнологии предполагают внедрение в клетку, в процессы метаболизма, перестройку генов. За использованием подобных манипуляций стоит желание человека добиться создания необходимых продуктов питания и химических веществ. Биотехнология – наука затратная, которая требует не только финансовых вложений, но и фундаментальных знаний в области биологии.
За использованием подобных манипуляций стоит желание человека добиться создания необходимых продуктов питания и химических веществ. Биотехнология – наука затратная, которая требует не только финансовых вложений, но и фундаментальных знаний в области биологии.
Клеточная инженерия
Клеточная инженерия предполагает создание клеток нового типа путем их культивирования, гибридизации и реконструкции. Клетки видоизменяют, вводя в них новые хромосомы, ядра, клеточные органоиды.
Направления деятельности клеточной инженерии
Клеточная инженерия научилась культивировать (выращивать) изолированные клетки и ткани на специально подобранной питательной среде в контролируемых условиях (влажность, температура, освещенность). Из одной клетки таким путем получают полноценное растение или клеточную массу (каллус). Такие эксперименты проводят благодаря способности растительной клетки к регенерации и чаще всего применяют для с/х растений и лекарственных трав.
Селекция и клеточная инженерия относятся к неразделимым понятиям. В селекции применяют новые, не стандартные методики:
В селекции применяют новые, не стандартные методики:
- соматическая гибридизация;
- гаплоидия;
- селекция на уровне клеток;
- преодоление не скрещиваемости сортов или видов растительных культур.
Такие способы позволяют экспериментировать и создавать новые гибриды и сорта, которые невозможно получить традиционными путями, используя только методы селекции.
Генетическая инженерия
Фрагмент молекулы ДНК — носителя наследственной информации в клетке
Генетическая инженерия относится к разделу молекулярной биологии, которая предполагает внедрение «скальпеля» в геном клетки и его перестройку, создание организмов с новой генетической программой по заранее продуманному плану. Основные направления деятельности генной инженерии – это перестройка генотипов и пересадка генов.
Научные работы проводятся с молекулами ДНК, которые внедряют в новую клетку. ДНК начинает размножаться и «отслеживать» синтез нужных человеку соединений по заданной программе.
Генная инженерия, соединив достижения химии и генетики, помогает:
- расшифровывать структуру гена;
- синтезировать новые гены;
- вставлять в живые клетки синтезированные гены, с заранее продуманной программой, для изменения их наследственных свойств.
Внедрение гена из одного организма в другой требует выполнение цепочки последовательных действий:
Выращены трансгенные животные, содержащие геном с не родными генами. Уже получены трансгенные мыши, кролики, свиньи, овцы. Они содержат ДНК, в которой работают чужеродные гены разного происхождения. Животные и растения в качестве наследственного материала получают гены бактерий, дрожжей, млекопитающих, человека.
Важно! Трансгенные организмы устойчивы к факторам внешней среды, вредителям и болезням, наделены теми чертами, которые запрограммировал в них человек.
Клонирование
Удачные эксперименты по клонированию, проведенные на овцах
Слово «клонирование» применялось при бесполом размножении организмов.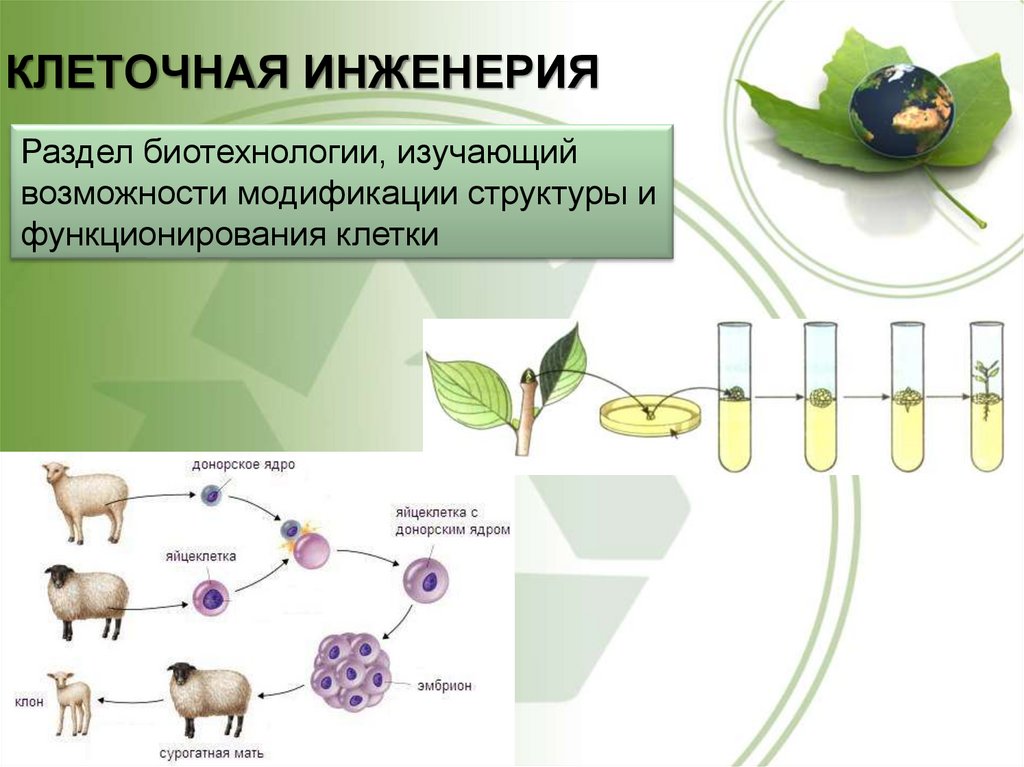 Сейчас этот термин приобрел иную направленность. Это создание копий генов и клеток в лабораторных условиях. При бесполом размножении полученные экземпляры живых организмов являются точной копией исходного материала. Но это возможно не всегда: рожденные «в пробирке» искусственные эмбрионы подвержены мутациям. Это значит, что у них развивается наследственная изменчивость.
Сейчас этот термин приобрел иную направленность. Это создание копий генов и клеток в лабораторных условиях. При бесполом размножении полученные экземпляры живых организмов являются точной копией исходного материала. Но это возможно не всегда: рожденные «в пробирке» искусственные эмбрионы подвержены мутациям. Это значит, что у них развивается наследственная изменчивость.
К сведению: Иногда клонирование путают с искусственным оплодотворением, когда оплодотворенную яйцеклетку вводят в матку будущей матери (родной или суррогатной). Это метод решения проблемы бесплодия, но он не относится к клонированию.
Смотри также:
- Биотехнология, ее направления
- Роль клеточной теории в становлении и развитии биотехнологии
- Этические аспекты развития некоторых исследований в биотехнологии (клонирование человека, направленные изменения генома)
Поделитесь в социальных сетях:
23 декабря 2019, 14:25
Could not load xLike class!
Клеточная инженерия растительных клеток для улучшения производства терапевтического белка
Обзор
. 2021 июль;40(7):1087-1099.
2021 июль;40(7):1087-1099.
doi: 10.1007/s00299-021-02693-6.
Epub 2021 10 апр.
Уддхаб Карки
1
2
, Хун Фанг
1
3
, Вэньчжэн Го
1
, Кармела Уннольд-Кофре
2
, Цзяньфэн Сюй
4
5
Принадлежности
- 1 Арканзасский институт биологических наук, Университет штата Арканзас, Джонсборо, Арканзас, 72401, США.
- 2 Факультет биологических наук, Университет штата Арканзас, Джонсборо, Арканзас, 72401, США.

- 3 Сельскохозяйственный колледж Арканзасского государственного университета, Джонсборо, Арканзас, 72401, США.
- 4 Арканзасский институт биологических наук, Университет штата Арканзас, Джонсборо, Арканзас, 72401, США. [email protected].
- 5 Сельскохозяйственный колледж Арканзасского государственного университета, Джонсборо, Арканзас, 72401, США. [email protected].
PMID:
33837823
PMCID:
PMC8035600
DOI:
10.1007/s00299-021-02693-6
Бесплатная статья ЧВК
Обзор
Uddhab Karki et al.
Представитель растительных клеток.
2021 9 июля0003
Бесплатная статья ЧВК
. 2021 июль;40(7):1087-1099.
doi: 10.1007/s00299-021-02693-6.
Epub 2021 10 апр.
Авторы
Уддхаб Карки
1
2
, Хун Фанг
1
3
, Вэньчжэн Го
1
, Кармела Уннольд-Кофре
2
, Цзяньфэн Сюй
4
5
Принадлежности
- 1 Арканзасский институт биологических наук, Университет штата Арканзас, Джонсборо, Арканзас, 72401, США.

- 2 Факультет биологических наук, Университет штата Арканзас, Джонсборо, Арканзас, 72401, США.
- 3 Сельскохозяйственный колледж Арканзасского государственного университета, Джонсборо, Арканзас, 72401, США.
- 4 Арканзасский институт биологических наук, Университет штата Арканзас, Джонсборо, Арканзас, 72401, США. [email protected].
- 5 Сельскохозяйственный колледж Арканзасского государственного университета, Джонсборо, Арканзас, 72401, США. [email protected].
PMID:
33837823
PMCID:
PMC8035600
DOI:
10.
 1007/s00299-021-02693-6
1007/s00299-021-02693-6
Абстрактный
Культивируемые in vitro растительные клетки, в частности клетки табака BY-2, продемонстрировали свой потенциал в качестве многообещающей платформы для биопродукции терапевтических белков путем объединения достоинств систем культивирования цельных растений с достоинствами культур клеток микробов и млекопитающих. За последние три десятилетия был достигнут существенный прогресс в улучшении системы культивирования клеток растений, что привело к нескольким коммерчески успешным случаям, таким как талиглюцераза альфа (Elelyso ® ), первый одобренный FDA рекомбинантный фармацевтический белок, полученный из растительных клеток. Однако по сравнению с основными хозяевами экспрессии (бактериями, дрожжами и клетками млекопитающих) растительные клетки все еще в значительной степени используются недостаточно, в основном из-за низкой продуктивности и нечеловеческого гликозилирования. Современные инструменты молекулярной биологии, в частности РНК-интерференция и новейшая технология редактирования генома CRISPR/Cas9, использовались для модулирования генома растительных клеток с целью создания новых клеточных линий, обладающих желаемыми «признаками» для производства терапевтических белков. В этом обзоре освещаются последние достижения в области клеточной инженерии растительных клеток в направлении улучшения производства рекомбинантных белков, включая создание клеточных линий с недостаточным уровнем протеазы или гуманизированным гликозилированием, а также рассматриваются потенциальные разработки в будущем.
Современные инструменты молекулярной биологии, в частности РНК-интерференция и новейшая технология редактирования генома CRISPR/Cas9, использовались для модулирования генома растительных клеток с целью создания новых клеточных линий, обладающих желаемыми «признаками» для производства терапевтических белков. В этом обзоре освещаются последние достижения в области клеточной инженерии растительных клеток в направлении улучшения производства рекомбинантных белков, включая создание клеточных линий с недостаточным уровнем протеазы или гуманизированным гликозилированием, а также рассматриваются потенциальные разработки в будущем.
Ключевые слова:
Сотовая инженерия; редактирование генома; гликоинженерия; культура клеток растений; РНК-интерференция; Рекомбинантные белки.
Заявление о конфликте интересов
org/1998/Math/MathML» xmlns:p1=»http://pubmed.gov/pub-one»> Нет. Цифры
Рис. 1
Схематическое изображение используемых стратегий…
Рис. 1
Схематическое изображение стратегий, используемых для повышения продуктивности культур клеток растений для биопродукции…
рисунок 1
Схематическое изображение стратегий, используемых для повышения продуктивности культур клеток растений для биопроизводства и коммерциализации. В дополнение к традиционным стратегиям (оптимизация экспрессии генов и разработка процессов) клеточная инженерия представляет собой альтернативный подход, который потенциально может произвести революцию в использовании культуры клеток растений в качестве биопроизводственной платформы
Рис. 2
2
Схематическое изображение гликоинженерии…
Рис. 2
Схематическое изображение технологий гликоинженерии, используемых на растительных клетках для гуманизации…
Рис. 2
Схематическое изображение технологий гликоинженерии, используемых на растительных клетках для гуманизации растительных N-гликановых структур. Здесь представлен сложный тип растительных гликанов. Нокаутированные или нокаутированные клеточные линии могут быть дополнительно сконструированы (внесены) с генами, кодирующими путь сиалирования человека, для получения гликанов растительного происхождения, несущих сиаловые кислоты
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
На пути к высокопроизводительному производству фармацевтических белков с использованием суспензионных культур растительных клеток.

Сюй Дж., Гэ Х., Долан М.С.
Сюй Дж. и др.
Биотехнология Adv. 2011 май-июнь;29(3):278-99. doi: 10.1016/j.biotechadv.2011.01.002. Epub 2011 12 января.
Биотехнология Adv. 2011.PMID: 21236330
Технологии контроля гликозилирования рекомбинантных терапевтических белков.
Гупта СК, Шукла П.
Гупта С.К. и др.
Приложение Microbiol Biotechnol. 2018 декабрь; 102 (24): 10457-10468. doi: 10.1007/s00253-018-9430-6. Epub 2018 17 октября.
Приложение Microbiol Biotechnol. 2018.PMID: 30334089
Обзор.
Временная экспрессия генов млекопитающих в N. benthamiana для модуляции N-гликозилирования.
Кастильо А., Штайнкельнер Х.
Кастильо А. и др.
Методы Мол Биол. 2016;1385:99-113. дои: 10. 1007/978-1-4939-3289-4_7.
1007/978-1-4939-3289-4_7.
Методы Мол Биол. 2016.PMID: 26614284
CRISPR/Cas9; Надежная технология производства генно-инженерных растений.
Фарук Р., Хуссейн К., Назир С., Джавед М.Р., Масуд Н.
Фарук Р. и др.
Cell Mol Biol (Нуази-ле-гранд). 2018 30 ноября; 64(14):31-38.
Cell Mol Biol (Нуази-ле-гранд). 2018.PMID: 30511631
Обзор.
Современные тенденции в редактировании генома растений: всеобъемлющий обзор набора инструментов CRISPR/Cas9.
Раззак А., Салим Ф., Канвал М., Мустафа Г., Юсаф С., Имран Аршад Х.М., Хамид М.К., Хан М.С., Джойя Ф.А.
Раззак А. и др.
Int J Mol Sci. 2019 19 августа; 20 (16): 4045. дои: 10.3390/ijms20164045.
Int J Mol Sci. 2019.PMID: 31430902
Бесплатная статья ЧВК.
Обзор.
Посмотреть все похожие статьи
Цитируется
Оптимизация экспрессии и экстракции рекомбинантных белков в растениях.
Коутс Р.Дж., Янг М.Т., Скофилд С.
Коутс Р.Дж. и соавт.
Фронт завод науч. 2022 8 декабря; 13:1074531. doi: 10.3389/fpls.2022.1074531. Электронная коллекция 2022.
Фронт завод науч. 2022.PMID: 36570881
Бесплатная статья ЧВК.Обзор.
Повышение эффективности накопления рекомбинантных белков в клетках растений: роль транспортных сигнальных пептидов.
Розов С.М., Дейнеко Е.В.
Розов С.М. и соавт.
Растения (Базель). 2022 сен 28;11(19):2561. doi: 10.3390/plants11192561.
Растения (Базель). 2022.PMID: 36235427
Бесплатная статья ЧВК.
Обзор.
Высокопроизводительная секреция эритропоэтина человека из клеток табака для дифференцировки гемопоэтических стволовых клеток ex vivo в эритроциты.
Карки Ю, Райт Т, Сюй Дж.
Карки У и др.
Дж Биотехнолог. 2022 20 августа; 355:10-20. doi: 10.1016/j.jbiotec.2022.06.010. Epub 2022 28 июня.
Дж Биотехнолог. 2022.PMID: 35777457
Бесплатная статья ЧВК.Стратегии гликоинженерии терапевтических белков.
Даммен-Брауэр К., Эплер П., Чжу С., Бернштейн З.Дж., Стабах П.Р., Брэддок Д.Т., Спенглер Д.Б., Ярема К.Дж.
Даммен-Брауэр К. и соавт.
Фронт хим. 2022 13 апр;10:863118. дои: 10.3389/fchem.2022.863118. Электронная коллекция 2022.
Фронт хим. 2022.PMID: 35494652
Бесплатная статья ЧВК.Обзор.

Оптимизация метода Knock-In генома: поиск наиболее эффективных участков генома для экспрессии трансгенов в растениях.
Розов С.М., Пермякова Н.В., Сидорчук Ю.В., Дейнеко Е.В.
Розов С.М. и соавт.
Int J Mol Sci. 2022 16 апреля; 23 (8): 4416. дои: 10.3390/ijms23084416.
Int J Mol Sci. 2022.PMID: 35457234
Бесплатная статья ЧВК.Обзор.
Просмотреть все статьи «Цитируется по»
использованная литература
Akashi H, Miyagishi M, Taira K. Векторы экспрессии РНКи в растительных клетках. Методы Мол Биол. 2004; 252: 533–543.
—
пабмед
Алмон Э.
 , Хури Т., Дрори А., Гингис-Велицки С., Алон С., Черткофф Р., Мушкат М., Шаалтиэль И., Илан И. Пероральное введение рекомбинантного слитого белка против TNF биологически активно в кишечнике, стимулируя регуляторные Т-клетки. : результаты клинического испытания фазы I с использованием новой пероральной терапии на основе анти-ФНОα. Дж Иммунол Методы. 2017; 446:21–29.
, Хури Т., Дрори А., Гингис-Велицки С., Алон С., Черткофф Р., Мушкат М., Шаалтиэль И., Илан И. Пероральное введение рекомбинантного слитого белка против TNF биологически активно в кишечнике, стимулируя регуляторные Т-клетки. : результаты клинического испытания фазы I с использованием новой пероральной терапии на основе анти-ФНОα. Дж Иммунол Методы. 2017; 446:21–29.—
пабмед
Бортези Л., Фишер Р. Система CRISPR/Cas9 для редактирования генома растений и не только. Биотехнология Adv. 2015; 33:41–52.
—
пабмед
Bosch D, Castilho A, Loos A, Schots A, Steinkellner H.
 N-гликозилирование растительных рекомбинантных белков. Курр Фарм Дез. 2013;19: 5503–5512.
N-гликозилирование растительных рекомбинантных белков. Курр Фарм Дез. 2013;19: 5503–5512.—
пабмед
Cacciatore JJ, Chasin LA, Leonard EF. Амплификация генов и разработка векторов для достижения быстрого и высокого уровня производства терапевтического белка с использованием системы селекции клеток CHO на основе DHFR. Биотехнология Adv. 2010; 28: 673–681.
—
пабмед
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- P20 GM103429/GM/NIGMS NIH HHS/США
- P20GM103429/NIH-INBRE
- 1605564/Национальный научный фонд
Зеленая биотехнология: методы генной инженерии растений
Зеленая биотехнология: методы генной инженерии растений
Тони Булл
Сегодня мы сосредоточимся на моей любимой области биотехнологии, зеленой биотехнологии. Как я упоминал в первом блоге этой серии, зеленые биотехнологии охватывают сельскохозяйственную отрасль и то, как ученые и исследователи разрабатывают более устойчивое производство сельскохозяйственных культур и улучшают эти культуры с помощью генной инженерии. В этой отрасли есть много частей, включая модификацию сельскохозяйственных культур для улучшения характеристик путем трансформации и культуры тканей, биоремедиации и производства биотоплива, биоэнергии и биоудобрений. Мое конкретное исследование сосредоточено на улучшении сельскохозяйственных культур с помощью культуры тканей и трансформации. Поэтому сегодня мы сосредоточимся на различных методах генной инженерии растений и методах, используемых для ее достижения.
Как я упоминал в первом блоге этой серии, зеленые биотехнологии охватывают сельскохозяйственную отрасль и то, как ученые и исследователи разрабатывают более устойчивое производство сельскохозяйственных культур и улучшают эти культуры с помощью генной инженерии. В этой отрасли есть много частей, включая модификацию сельскохозяйственных культур для улучшения характеристик путем трансформации и культуры тканей, биоремедиации и производства биотоплива, биоэнергии и биоудобрений. Мое конкретное исследование сосредоточено на улучшении сельскохозяйственных культур с помощью культуры тканей и трансформации. Поэтому сегодня мы сосредоточимся на различных методах генной инженерии растений и методах, используемых для ее достижения.
Но сначала давайте определимся с термином: генная инженерия. Это процесс преднамеренной модификации генетического материала (генотипа) организма с целью наблюдения желаемых изменений характеристик (фенотипа). Генная инженерия может быть достигнута за счет вставки новых фрагментов ДНК (доставки генов), удаления или редактирования существующей ДНК путем нацеливания на определенную последовательность и / или случайного мутагенеза с использованием химических веществ, УФ-излучения или транспозонов. Сегодня мы будем обсуждать только доставку генов, методы, с помощью которых мы этого добиваемся, и их применение. Если интересно, в этой статье обсуждается предыстория CRISPR и редактирования базы, а здесь вы можете узнать больше о случайном мутагенезе для генной инженерии.
Сегодня мы будем обсуждать только доставку генов, методы, с помощью которых мы этого добиваемся, и их применение. Если интересно, в этой статье обсуждается предыстория CRISPR и редактирования базы, а здесь вы можете узнать больше о случайном мутагенезе для генной инженерии.
Теперь давайте поговорим о двух основных методах, используемых для доставки генов: 1) перенос генов с помощью векторов, который включает трансформацию растений, опосредованную Agrobacterium , и 2) прямой (или безвекторный) перенос ДНК, такой как бомбардировка частицами.
Agrobacterium -опосредованная трансформация
Agrobacterium представляет собой род бактерий, которые могут вызывать развитие опухолей у растений посредством процесса, известного как горизонтальный перенос генов. В этом роде есть несколько видов, но мы сосредоточимся только на одном, Agrobacterium tumefaciens. A. tumefaciens является наиболее часто изучаемым видом этого рода и вызывает заболевание, называемое корончатым галлом, которое встречается у более чем 140 растений. В основе этого заболевания лежит уникальный процесс, при котором сегмент ДНК, называемый транспортной ДНК или Т-ДНК, переносится из бактерии в растение. Т-ДНК проникнет в ядро растения, где случайным образом интегрируется в геном растения. После интеграции само растение будет экспрессировать гены, расположенные в области Т-ДНК, вызывая обильное деление клеток, что приводит к образованию опухоли (рис. 1).
В основе этого заболевания лежит уникальный процесс, при котором сегмент ДНК, называемый транспортной ДНК или Т-ДНК, переносится из бактерии в растение. Т-ДНК проникнет в ядро растения, где случайным образом интегрируется в геном растения. После интеграции само растение будет экспрессировать гены, расположенные в области Т-ДНК, вызывая обильное деление клеток, что приводит к образованию опухоли (рис. 1).
В 1977 г. Zambryski et al. сконструировал плазмиду, индуцирующую опухоль (Ti) (кольцевой генетический материал, который содержит фрагмент Т-ДНК в A. tumefaciens ), заменив природный фрагмент Т-ДНК другим интересующим геном (GOI), и продемонстрировал, что это можно перенести сконструированную Т-ДНК в растительную клетку. Это был первый случай, когда ученые «похитили» этот естественный процесс, клонировав ГОИ в область Т-ДНК и трансформировав растительные клетки в лабораторных условиях. Спустя более 40 лет мы все еще используем этот метод в качестве основного метода генной инженерии растений и продолжаем искать способы улучшить этот процесс. Одним из примеров исследования с использованием этого метода является введение гена цитохрома Р450 в ананас, что позволяет растению контролировать и разлагать стойкие органические загрязнители из окружающей среды (Ma и др. 2012). Это использовалось для многих различных видов растений, однако не все растения восприимчивы к этому типу инфекции и, следовательно, не могут быть трансформированы с использованием A. tumefaciens .
Одним из примеров исследования с использованием этого метода является введение гена цитохрома Р450 в ананас, что позволяет растению контролировать и разлагать стойкие органические загрязнители из окружающей среды (Ma и др. 2012). Это использовалось для многих различных видов растений, однако не все растения восприимчивы к этому типу инфекции и, следовательно, не могут быть трансформированы с использованием A. tumefaciens .
Бомбардировка частицами
Из-за некоторых ограничений методов трансформации, опосредованных Agrobacterium , в 1987 году появилась другая форма трансформации. Этот метод трансформации растений известен как бомбардировка частицами. Первоначально названный «биологистикой», этот подход бомбардирует растительные клетки частицами, покрытыми ДНК, обычно золотом или вольфрамом, на очень высокой скорости (~ 1000–2000 футов в секунду) (Sanford 9).0310 и др. 1987). Оказавшись внутри растительной клетки, частицы высвобождают ДНК, где она может быть интегрирована в геном. Рисунок 2 более подробно объясняет, как работает этот процесс. Некоторые другие забавные названия этого процесса включают генную пушку и биобластер. В недавнем исследовании применялся процесс бомбардировки частицами для получения Alstroemeria , обычного декоративного и комнатного растения, устойчивого к вирусу мозаики альстромерии (Kim 2020). Подробнее об этом можно прочитать здесь.
Рисунок 2 более подробно объясняет, как работает этот процесс. Некоторые другие забавные названия этого процесса включают генную пушку и биобластер. В недавнем исследовании применялся процесс бомбардировки частицами для получения Alstroemeria , обычного декоративного и комнатного растения, устойчивого к вирусу мозаики альстромерии (Kim 2020). Подробнее об этом можно прочитать здесь.
Вам может быть интересно, что происходит после того, как мы доставляем ген в клетку, и как эта клетка превращается в полноценное растение? Мы можем достичь этого с помощью процесса, известного как культура тканей. Это in vitro , асептический метод, используемый для получения растений из одной клетки. Трансформируя растительную клетку, мы начинаем с кусочка вырезанной растительной ткани, который называется эксплантатом. Возьми? Иссеченное растение равно эксплантату. Тип эксплантата может быть из зрелых листьев, незрелых листьев (семядолей), ткани стебля, частей цветка (пыльники, завязи, рыльца и т. д.) и даже корней. После вырезания и трансформации этих тканей их помещают в чашки Петри, содержащие селективную питательную среду. Один важный момент, о котором я не упомянул ранее, заключается в том, что внутри сконструированного фрагмента Т-ДНК или фрагмента ДНК, бомбардированного растительной клеткой, находится селективный маркерный ген. Сюда могут входить гены, придающие устойчивость к антибиотикам, таким как канамицин (9).0310 nptII ) или гигромицин ( hpt ), или устойчивость к гербицидам, таким как глюфосинат ( bar ). Добавление в среду селекционного агента (антибиотика или гербицида) позволяет проводить отбор трансформированных (или трансгенных) растений. В среду также включены гормоны роста растений, ауксин и цитокинин, которые способствуют плодовитому клеточному делению и продукции тотипотентных клеток (таких как стволовые клетки), которые могут развиваться в любую дифференцированную клеточную форму. Соотношение ауксина и цитокинина поможет подтолкнуть дифференцировку клеток к росту побегов (надземной части растения) или росту корней.
д.) и даже корней. После вырезания и трансформации этих тканей их помещают в чашки Петри, содержащие селективную питательную среду. Один важный момент, о котором я не упомянул ранее, заключается в том, что внутри сконструированного фрагмента Т-ДНК или фрагмента ДНК, бомбардированного растительной клеткой, находится селективный маркерный ген. Сюда могут входить гены, придающие устойчивость к антибиотикам, таким как канамицин (9).0310 nptII ) или гигромицин ( hpt ), или устойчивость к гербицидам, таким как глюфосинат ( bar ). Добавление в среду селекционного агента (антибиотика или гербицида) позволяет проводить отбор трансформированных (или трансгенных) растений. В среду также включены гормоны роста растений, ауксин и цитокинин, которые способствуют плодовитому клеточному делению и продукции тотипотентных клеток (таких как стволовые клетки), которые могут развиваться в любую дифференцированную клеточную форму. Соотношение ауксина и цитокинина поможет подтолкнуть дифференцировку клеток к росту побегов (надземной части растения) или росту корней. Как правило, мы начинаем с развития побега в культуре, затем развиваем корни, а затем переносим в почву, где мы можем выращивать трансформированное растение в теплице. Хотя бывают случаи, когда развитие корней предшествует образованию побегов. Рисунок 3. Демонстрирует этот процесс и включает фотографии некоторых моих исследований с использованием культуры тканей в лаборатории Мишельмора.
Как правило, мы начинаем с развития побега в культуре, затем развиваем корни, а затем переносим в почву, где мы можем выращивать трансформированное растение в теплице. Хотя бывают случаи, когда развитие корней предшествует образованию побегов. Рисунок 3. Демонстрирует этот процесс и включает фотографии некоторых моих исследований с использованием культуры тканей в лаборатории Мишельмора.
Доставка генов использовалась для изучения всех аспектов биологии растений, включая патологию, физиологию и анатомию. На самом деле так много исследований, что я не смог бы коснуться поверхности того, что было достигнуто с помощью этой техники. Несколько примеров включают разработку растений для молекулярной фармации (вспомните Red Meets Green Biotech) путем доставки генов, кодирующих фармацевтические препараты, создание культур с более высоким содержанием питательных веществ (золотой рис), растений, устойчивых к болезням и гербицидам, и растений. которые могут производить свои собственные инсектициды (кукуруза Bt). Как я упоминал ранее, у зеленой биотехнологии есть много движущихся частей, но большая ее часть включает в себя улучшение урожая для обеспечения продовольственной безопасности и более устойчивые методы ведения сельского хозяйства. Мы можем использовать доставку генов, чтобы сделать это, доставить GOI в клетки растений для развития улучшенных культур. В следующий раз мы продолжим разговор о «зеленых» биотехнологиях, обсудив различные типы генетически модифицированных организмов (ГМО/ГМ), доступные в настоящее время ГМ-продукты и рассмотрим некоторые распространенные заблуждения о ГМО. Не пропустите, будет интересно!
Как я упоминал ранее, у зеленой биотехнологии есть много движущихся частей, но большая ее часть включает в себя улучшение урожая для обеспечения продовольственной безопасности и более устойчивые методы ведения сельского хозяйства. Мы можем использовать доставку генов, чтобы сделать это, доставить GOI в клетки растений для развития улучшенных культур. В следующий раз мы продолжим разговор о «зеленых» биотехнологиях, обсудив различные типы генетически модифицированных организмов (ГМО/ГМ), доступные в настоящее время ГМ-продукты и рассмотрим некоторые распространенные заблуждения о ГМО. Не пропустите, будет интересно!
Ссылки
Kim, J.B. 2020. Производство трансгенных растений Alstroemeria , содержащих гены устойчивости к вирусам, путем бомбардировки частицами. Журнал биотехнологии растений . 47:164-171.
млн лет, J. и др. 2012. Эффективная Agrobacterium опосредованная трансформация ананаса с помощью CYP1A1 методом канамициновой селекции.

