Получение растений, устойчивых к различным стрессовым факторам. Повышение устойчивости растений к различным факторам
| Устойчивость растений к различным факторам среды УСТОЙЧИВОСТЬ РАСТЕНИЙ К ЗАСУХЕ Понятие засуха включает комплекс метеорологических условий. Засуха – это длительный период бездождья, сопровождаемый непрерывным падением относительной влажности воздуха и повышением температуры. Различают засуху атмосферную и почвенную. Атмосферная засуха характеризуется низкой относительной влажностью воздуха, почвенная – отсутствием доступной для растений воды в почве. Чаще всего эти виды засухи сопровождают друг друга. К очень тяжелым последствиям приводят также явления, как мгла и суховей. Мгла – это атмосферная засуха, сопровождаемая появлением в воздухе во взвешенном состоянии твердых частиц. Суховей – это атмосферная засуха, сопровождаемая сильным ветром, при котором перемещаются большие массы горячего воздуха.
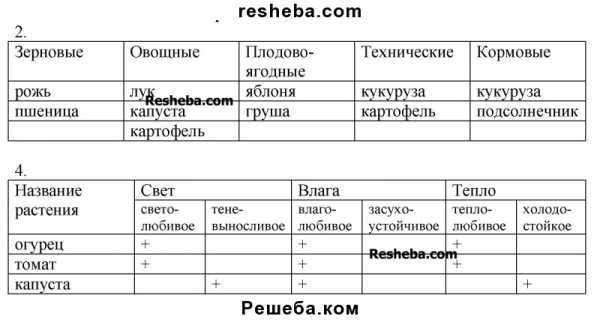
ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ЗАСУХОУСТОЙЧИВЫХ РАСТЕНИЙ По отношению к воде все растения делятся на четыре экологические группы: 1) водные растения, которые погружены в воду целиком или частично,– гидрофиты; 2) растения увлажненных местообитаний – гигрофиты; 3) растения, обитающие в среде со средним уровнем обеспеченности водой, не имеющие ясно выраженных приспособлений к избытку или недостатку воды, – мезофиты; 4) растения, обитающие в среде, характеризующейся резким недостатком воды, – ксерофиты. Остановимся на физиологической характеристике ксерофитов. Ксерофиты – растения засушливых местообитаний, которые в высокой степени обладают способностью к приспособлению процессе онтогенеза к перерывам в водоснабжении. Ксерофиты не представляют собой физиологически однородной группы. Некоторые ксерофиты обладают малой интенсивностью транспирации, вместе с тем ряд ксерофитов характеризуется интенсивной транспирацией (Н.А. Максимов). Возможность переносить резко засушливые условия достигается разными физиологическими средствами. Классификация этих растений наиболее полно разработана П.А. Генкелем. С некоторыми упрощениями ксерофиты можно разделить на следующие группы: 1. Растения, запасающие влагу (ложные ксерофиты, по Н.А. Максимову). К этой группе растений относятся суккуленты, прежде все кактусы, а также растения, принадлежащие к семейству толстянковых (Crassulaceae – Sedum, Sempervivum). Эти растения накапливают влагу в толстых, мясистых стеблях или в утолщенных листьях. Листовыми суккулентами являются агавы, алоэ, очиток, молодило. К стеблевым суккулентам относятся кактусы, молочаи. Испаряющая поверхность сильно сокращена. Листья часто редуцированы, вся поверхность покрыта толстым слоем кутикулы, благодаря этому они являются ограничено транспирирующими растениями. Суккуленты обладают неглубокой, но широко распространяющейся корневой системой. Клетки корня характеризуются сравнительно низкой концентрацией клеточного сока. Эта группа растений произрастает в районах, где резко засушливые периоды сменяются периодами дождей, их корневая система приспособлена к поглощению этой дождевой воды. В остальное время они живут за счет воды, запасаемой в мясистых органах, причем эта вода тратится чрезвычайно медленно. По мере уменьшения содержания воды в клетках интенсивность транспирации падает. Суккуленты обладают своеобразным обменом веществ, получившим название САМ – метаболизм. У растений с этим типом обмена днем устьица закрыты, а ночью они открываются, что обеспечивает резкое уменьшение расходования воды в процессе транспирации. Углекислый газ накапливается в ночной период в виде органических кислот. В дневные часы акцептированный СО2 высвобождается и используется в процессе фотосинтеза. Указанная особенность позволяет этим растениям осуществлять фотосинтез при закрытых днем устьицах. Все же фотосинтез у таких растений идет чрезвычайно медленно. Поэтому для них характерно крайне медленное накопление сухого вещества и низкие темпы роста. Следствием специфического обмена веществ является большое содержание связанной воды и высокая вязкость цитоплазмы. Растения этой группы не являются устойчивыми к засухе, к водному стрессу. Так, кактусы обезвоживание переносят сравнительно плохо (следствие невысокой эластичности цитоплазмы), начинают страдать и погибают. Вместе с тем они устойчивы к высоким температурам. Таким образом, это растения, запасающие воду и экономно ее расходующие в процессе медленного роста. 2. Эвксерофиты (настоящие ксерофиты) – растения, обладающие способностью резко сокращать транспирацию в условиях недостатка воды. Для этой группы растений характерен ряд приспособлений к сокращению потери воды: высокая эластичность цитоплазмы, низкая оводненность, высокая водоудерживающая способность и вязкость. Низкий осмотический потенциал клеточного сока позволяет поглощать воду из почвы, обделенной водой. В ряде случаев подземные органы этих растений, особенно в верхних частях, покрыты толстым слоем пробки. Иногда пробкой покрываются и стебли. Листья покрыты толстым слоем кутикулы, многие имеют волоски. Некоторые представители этой группы растений имеют различные типы дополнительной защиты устьиц. К ним можно отнести расположение устьиц в ямках, закупоривание устьичных щелей восковыми и смолистыми пробочками. Соприкосновение устьичных щелей с окружающей средой уменьшается также у некоторых растений путем свертывания листьев в трубку. Вместе с тем для этой группы растений характерна в высокой степени способность переносить обезвоживание, состояние длительного завядания. Особенно хорошо переносят потерю воды растения с жесткими листьями (склерофиты), которые и в состоянии тургора имеют сравнительно мало воды. Эти растения характеризуются большим развитием механических тканей. Листья у них жесткие, что позволяет при потере тургора избежать механических повреждений. К этой группе растений относится саксаул, песчаная акация, аристида, некоторые полыни и др. 3. Гемиксерофиты (полуксерофиты) – это растения, у которых сильно развиты приспособления к добыванию воды. У них глубоко идущая, сильно разветвленная корневая система. Клетки корня обладают, как правило, высокой концентрацией клеточного сока, низким (очень отрицательным) водным потенциалом. Благодаря указанным особенностям эти растения могут использовать для сбора воды очень большие объемы почвы. Их корневые системы достигают даже грунтовых вод, если последние лежат не слишком глубоко. Растения данного типа обладают хорошо развитой проводящей системой. Листья у них тонкие, с очень густой сетью жилок, что сокращает путь передвижения воды к живым клеткам листа до минимума. Это растения с очень высокой интенсивностью транспирации. Даже в очень жаркие, сухие дни они держат устьица открытыми. Благодаря высокой интенсивности транспирации температура листьев значительно понижается, что позволяет осуществлять процесс фотосинтеза при высоких дневных температурах. К таким тонколистным, высокотранспирирующим ксерофитам принадлежат степная люцерна, дикий арбуз, шалфей, резак. Листья некоторых из них покрыты волосками. Волоски создают как бы экран, который дополнительно защищает листья от перегрева. 4. Растения, избегающие засуху (псевдоксерофиты). Эти растения не обладают признаками засухоустойчивости, но имеют короткий вегетационный период, приурочивая весь жизненный цикл к периоду дождей. Эфемеры переносят засуху в виде семян (маки), а эфемероиды – в виде луковиц, корневищ, клубней (нарцисс, ревень и др.). 5. Пойкилоксерофиты – растения, не регулирующие своего водного режима. В период засухи эти растения впадают в состояние анабиоза (согласно П.А. Генкелю – криптобиоза). Криптобиоз – это состояние, при котором обмен веществ либо прекращается, либо резко тормозится, однако вся организация жизни сохраняется. К этой группе растений относится большинство лишайников, некоторые водоросли, папоротники и небольшое число покрытосеменных. Отличительной особенностью пойкилоксерофитов является способность протопласта при сильном обезвоживании переходить в гель. Эта группа растений может, не теряя жизнеспособности, доходить до воздушно-сухого состояния и в таком виде переносить периоды засух. После дождей растения этого типа быстро переходят к нормальной жизнедеятельности. Таким образом, обезвоживание для них является не патологией, а нормальным физиологическим состоянием. Таковы основные типы ксерофитов. Естественно, что в природе нет строгого разграничения и существует много переходных типов. В узком смысле слова устойчивыми к засухе являются лишь эвксерофиты и пойкилоксерофиты, которые действительно способны переносить обезвоживание. С практической точки зрения чрезвычайно важным является вопрос, чем определяется степень устойчивости к засухе растений среднего типа – мезофитов, к которым относятся и все наши культурные растения. Известно, что культурные растения сильно различаются по признаку засухоустойчивости. Такие сельскохозяйственные культуры, как сорго, просо, кукуруза, морковь, отличаются значительной устойчивостью к засухе. В выяснении этого вопроса большую роль сыграли работы выдающихся русских физиологов В.Р. Заленского, Н.А. Максимова, П.А. Генкеля и др. Благодаря их исследованиям выяснилось, что засухоустойчивость – это комплексный признак, связанный с целым рядом физиологических особенностей. Основным, определяющим признаком для отдельных видов и сортов культурных растений является их способность переносить недостаток воды без резкого снижения ростовых процессов и урожайности. В свою очередь это свойство определяется, по-видимому, прежде всего устойчивостью цитоплазмы, особенно мембран митохондрий и хлоропластов, или их способностью сохранять особенности структуры при уменьшении гидратных оболочек, окружающих молекулы белка, а также устойчивостью ферментных систем. Иначе говоря, засухоустойчивость определяется способностью растительного организма как можно меньше изменять процессы обмена веществ в условиях недостаточного водоснабжения. Так, засухоустойчивые сорта обладают способностью поддерживать синтетическую деятельность ферментов на высоком уровне даже при сильном завядании (Н.М. Сисакян), а также способностью сохранять сопряженность окисления и фосфорилирования. Большое значение имеют также анатомо-морфологические признаки. В 1904 г. известным русским физиологом В.Р. Заленским было показано, что анатомическая структура листьев правильно изменяется в зависимости от их ярусности. Оказалось, что чем выше расположен лист, тем более в нем выражены определенные признаки: меньше клетки и величина устьиц, большее число устьиц и жилок на единицу поверхности листа, сильнее развита палисадная паренхима. Одновременно чем выше расположен лист, тем более высокой транспирацией и большей интенсивностью фотосинтеза он обладает. Указанные закономерности получили название закона Заленского. При изучении причин данного явления выяснилось, что оно является следствием худшего водоснабжения верхних листьев. Одновременно было показано, что у листьев растений, выращенных в более засушливых условиях, проявляются те же изменения, как и у листьев более верхнего яруса. В связи с этим совокупность названных анатомо-физиологических признаков получила название ксероморфной структуры. Растения, листья которых обладают ксероморфной структурой, более устойчивы к засухе. Для характеристики устойчивости того или иного растения к засухе имеет значение величина транспирационного коэффициента. Этот показатель может служить характеристикой, указывающей на более экономное расходование воды. Сравнение расходования воды с накоплением сухого вещества растением правомерно потому, что интенсивность того и другого процесса связана в определенной мере со степенью открытости устьиц. При оценке и выведении засухоустойчивых сортов важно учитывать совокупность всех рассмотренных признаков. В настоящее время делаются попытки получения трансгенных растений, у которых в геном вводятся гены, кодирующие ферменты синтеза протекторных соединений, например, пролина. Наряду с селекционной работой предложены методы так называемого предпосевного закаливания растений к засухе. Было подмечено, что растения, перенесшие засуху, становятся более устойчивыми к обезвоживанию. Однако если завяданию подвергается взрослое растение, темпы роста и продуктивность его снижаются. В этой связи П.А. Генкелем предложено проводить подсушивание намоченных семян перед посевом. Из таких семян вырастают растения, более устойчивые к засухе. По-видимому, при подсушивании перестраивается кон-формация белков-ферментов, и они становятся менее чувствительными к потере воды. Вместе с тем новые клетки и органы, возникающие из меристем, перенесших обезвоживание, характеризуются сравнительной мелкоклеточностью и другими ксероморфными признаками и, как следствие, большей устойчивостью. В ряде исследований показано увеличение устойчивости растений к засухе при намачивании семян в растворах микроэлементов, например, бора, меди (М.Я. Школьник). Имеются также данные, что улучшение условий питания путем внесения удобрений (например, калийных) способствует более экономному расходованию воды, снижает транспирационный коэффициент. Повышению засухоустойчивости растений способствует обработка растений гормональными веществами, в частности абсцизовой кислотой. С этой целью также используют аналоги цитокининов (картолин) и ретарданты (хлорхолинхлорид). Важными мерами борьбы с засухой являются агротехнические меры, направленные на сберехение влаги (черные пары, весеннее боронование, прикатывание почвы и др.). Большое значение для создания благоприятных климатических условий имеет культивирование лесных полос. Показано, что лесные полосы повышают влажность воздуха на прилегающих плантациях, уменьшают силу ветра, что, в свою очередь, снижает потерю воды растениями в процессе транспирации.
ХОЛОДОСТОЙКОСТЬ РАСТЕНИЙ Теплолюбивые растения сильно страдают при положительных пониженных температурах. Внешними симптомами страдания растений являются завядание листьев, появление некротических пятен. Первичный эффект пониженных положительных температур связан с повреждением мембран, увеличением их проницаемости. Возрастает потеря мембранами ионов кальция, выход калия из цитоплазмы. Показано, что меняется молекулярная архитектура мембран, расположение в них липидных молекул, происходят конформационные изменения белков. Резко меняются свойства мембран митохондрий и хлоропластов. В связи с этим нарушаются процессы окислительного и фотосинтетического фосфорилирования. Степень повреждения мембран зависит от содержания насыщенных жирных кислот, которые при действии низках температур переходят в состояние геля, что снижает их подвижность, нарушает транспорт веществ и энергетические процессы. Происходит увеличение содержания супероксидных радикалов и других АФК. Благодаря нарушениям обменных процессов в организме накапливаются промежуточные продукты метаболизма. В нормальных для данного вида растений температурных условиях все реакции, протекающие в организме, хорошо согласованы друг с другом, продукты одной реакции сейчас же перерабатываются. В том случае, если растения попадают в неблагоприятные температурные условия, эта согласованность нарушается. Дело в том, что различные биохимические реакции характеризуются разной зависимостью от температуры. Одни реакции при снижении температуры резко замедляются, другие – нет. Это приводит к нарушению обмена и к накопление вредных продуктов. Так, резко тормозятся реакции цикла Кребса, благодаря тему накапливаются продукты гликолиза. Возрастает активность альтернативного пути дыхания. Уже отмечалось, что интенсификация этого процесса позволяет увеличить тепловыделение и способствует повышению температуры цветков что необходимо при опылении и оплодотворении. При продолжительном воздействии пониженной температуры наступает гибель теплолюбивых растений. Защитное значение при действии низких положительных температур на теплолюбивые растения имеет ряд приспособлений. Прежде всего, это поддержание стабильности мембран и предотвращение утечки ионов. Устойчивые растения отличаются большей долей ненасыщенности жирных кислот в составе фосфолипидов мембран. Это позволяет поддерживать подвижность мембран и предохраняет от разрушений. В этой связи большую роль выполняют ферменты ацетилтрансферазы и десатуразы. Последние приводят к образованию двойных связей в насыщенных жирных кислотах. Показано, что мутанты, у которых отсутствуют эти ферменты, не могут переносить пониженные температуры. Вместе с тем введение в геном теплолюбивых культур гена, кодирующего десатуразу, приводило к повышенной устойчивости к холоду. Трансформированные растения табака с вводом гена ацетилтрансферазы, выделенного из холодоустойчивой формы арабидопсиса, отличаются повышенным содержанием ненасыщенных жирных кислот и возрастанием холодостойкости. Приспособительные реакции к низким положительным температурам проявляются в способности поддерживать метаболизм при ее снижении. Это достигается более широким температурным диапазоном работы ферментов, синтезом протекторных соединений. У устойчивых растений возрастает роль ПФП дыхания, эффективность работы антиоксидантной системы, синтезируются стрессовые белки. Показано, что при действии низких положительных температур индуцируется синтез низкомолекулярных белков. Экспериментальные данные показали общность реакции генома на тепловое и холодовое воздействие. Это проявилось в изменении интенсивности транскрипции одних и тех же генов низкомолекулярных белков. Причем в условиях теплового шока (40°С, 2 ч) наблюдалась стимуляция, а холодового (4°С, 10 мин) ингибирование их активности. Для повышения холодостойкости используется предпосевное замачивание семян. Для этого наклюнувшиеся семена теплолюбивых культур в течение нескольких суток выдерживают в условиях чередующихся температур: 12 ч при 1–5°С, 12 ч при 15–22°С. Эффективным является и использование микроэлементов (Zn, Mn, Сu, В, Мо). Так, замачивание семян в растворах борной кислоты, сульфата цинка или сульфата меди повышает холодоустойчивость растений. Есть, данные о положительном влиянии АБК, цитокининов, хлорхолинхлорида на холодоустойчивость.
МОРОЗОУСТОЙЧИВОСТЬ РАСТЕНИЙ Двулетние и многолетние растения, растущие в умеренной полосе, периодически подвергаются воздействию низких отрицательных температур. Разные растения обладают неодинаковой устойчивостью к этому воздействию. Для того чтобы подойти к вопросу о механизме морозоустойчивости, важно уяснить причины повреждения и гибели растения при воздействии низких отрицательных температур. Изучение физиологических основ морозоустойчивости показало, что у одного и того же растения она меняется в зависимости от условий, предшествующих наступлению морозов. Закаливание растений Гибель растений в результате воздействия температур ниже 0°С зависит от генетической природы организма и от тех условий, в которых он находился в период, предшествующий морозам. Так, один и тот же растительный организм может погибнуть при температуре –5°С и перенести температуру до – 40...-50°С и даже ниже. Закаливание – это обратимое физиологическое приспособление к неблагоприятным воздействиям, происходящее под влиянием определенных внешних условий. Физиологическая природа процесса закаливания к отрицательным температурам была раскрыта благодаря работам И.И. Туманова и его школы. В результате процесса закаливания морозоустойчивость организма резко повышается. Способностью к закаливанию обладают не все растительные организмы, она зависит от вида растения, его происхождения. Растения южного происхождения к закаливанию не способны. У растений северных широт процесс закаливания приурочен лишь к определенным этапам развития. Для приобретения способности к закаливанию растения должны закончить процессы роста. Сигналом к прекращению роста и стимулом для изменений в гормональной системе для растений является сокращение фотопериода и снижение температуры. Ослабляется синтез ИУК и гиббереллинов, усиливается образование АБК и этилена. Это и приводит к торможению ростовых процессов. Другим условием для приобретения способности к закаливанию является завершение оттока веществ. Если в течение лета у древесных растений процессы роста не успели закончиться, то это может вызвать массовую гибель растений зимой. Так, зимняя гибель часто вызывается летней засухой. Засуха приостанавливает рост летом, не позволяет древесным культурам завершить ростовые процессы к осени. В результате растения оказываются неспособными пройти процессы закаливания и гибнут даже при небольших морозах. Аналогичная картина характерна для растений, выращенных при несоответствующем фотопериоде, не успевших завершить летний рост и поэтому неспособных к закаливанию. Исследования показали, что яровые злаки по сравнению с озимыми растут при более пониженных температурах, из-за этого в осенний период они почти не снижают темпов роста и не способны к закаливанию. Способность к закаливанию утрачивается весной в связи с началом ростовых процессов. Таким образом, устойчивость растений к морозу, способность пройти процессы закаливания тесно связаны с резким снижением темпов роста, с переходом растений в покоящееся состояние. Показано, что к закаливанию способен лишь целостный организм, при обязательном наличии корневой системы. Всякое нарушение процессов оттока (кольцевание) препятствует закаливанию. Роль корней не сводится только к тому, что туда оттекают продукты обмена, гормоны, способствующие ростовым процессам. Важное значение имеет то, что клетки корня вырабатывают вещества, повышающие устойчивость организма против мороза. Собственно процесс закаливания требует комплекса внешних условий и проходит в две фазы. Первая фаза закаливания проходит на свету при несколько пониженных плюсовых температурах (днем около 10°С, ночью около 2°С) и умеренной влажности. В эту фазу продолжается дальнейшее замедление, и даже полная остановка ростовых процессов. Особенное значение в развитии устойчивости растений к морозу в эту фазу имеет накопление веществ-криопротекторов, выполняющих защитную функцию: сахарозы, моносахаридов, растворимых белков и др. В этих условиях образование сахаров в процессе фотосинтеза идет с достаточной интенсивностью. Вместе с тем пониженная температура сокращает их трату, как в процессе дыхания, так и в процессах роста. Более морозостойкие виды и сорта характеризуются большей способностью к накоплению сахаров именно при пониженной температуре. Показано, что накапливающиеся в процессе закаливания сахара локализуются в разных частях клетки: клеточном соке, цитоплазме, органеллах (особенно хлоропластах). Благодаря такому распределению часть сахаров прочно удерживается в клетках. Влияние сахаров на повышение морозоустойчивости растений многосторонне. Накапливаясь в клетках, сахара повышают концентрацию клеточного сока, снижают водный потенциал. Чем выше концентрация раствора, тем ниже его точка замерзания, поэтому накопление сахаров стабилизирует клеточные структуры, в частности хлоропласты, благодаря чему они продолжают функционировать. Процесс фотофосфорилирования продолжается даже при отрицательных температурах. Особенное значение имеет защитное влияние сахара на белки, сосредоточенные в поверхностных мембранах клетки. Защитное действие сахаров проявляется только в том случае, если происходит при одновременном понижении температуры. Имеются данные, что сахара повышают устойчивость именно специфических белков, образующихся при пониженной температуре. В первую фазу закаливания происходит также уменьшение содержания свободной воды. Излишняя влажность почвы (дождливая осень) препятствует прохождению процесса закаливания. Чем меньше в клетках и тканях содержание воды, тем меньше образуется льда и тем меньше опасность повреждения. В составе мембран возрастает уровень и изменяется структура фосфолипидов. Повышается содержание ненасыщенных жирных кислот. Это позволяет поддерживать высокую проницаемость мембран, необходимую для транспорта воды. Происходит перестройка ферментных систем процесса дыхания, возрастает альтернативный путь дыхания, что усиливает рассеивание энергии в виде тепла. Влияние света в первую фазу закаливания не ограничивается увеличением накопления сахаров, помимо этого свет оказывает регуляторное влияние. Это подтверждается тем, что этиолированные растения не способны к закаливанию даже при обогащении их сахарами. В восприятии изменений освещенности важная роль принадлежит фитохрому. Фитохром оказывает влияние на генетический аппарат клетки и способствует активизации генов, участвующих в переходе в покоящееся состояние. Среди механизмов адаптации к действию пониженных температур – синтез ряда стрессовых белков, к которым относят десатуразы, дегидрины – LEA-белки, а также белки холодового шока – БХШ. Эти гидрофильные белки синтезируются в цитоплазме под действием низких температур и выделяются в клеточную стенку. БХШ располагаются на поверхности кристаллов льда, препятствуют их росту, тормозят образование межклеточного льда. БХШ разобщают окислительное фосфорилирование, что позволяет использовать энергию окисления на повышение температуры органов растений на 4–7ºС выше окружающего воздуха. В последние годы были изолированы гены, ответственные за синтез БХШ, образование которых позволяет переносить низкие температуры. В арабидопсисе идентифицирован ген – гомолог «противоморозного» гена, от которого зависит способность адаптироваться к низким температурам. Показана роль АБК в образовании этих белков. Так, мутанты арабидопсиса, не способные к синтезу АБК не обладают устойчивостью к низким температурам. Значение АБК подтверждается тем, что при низких температурах возрастание содержания АБК в растении увеличивает и устойчивость. Например, проростки люцерны переносят температуру до -10°С. Это свойство может быть увеличено путем предварительного выдерживания при 4°С или обработкой АБК, поскольку оба эти способа вызывают синтез БХШ. К концу первой фазы закаливания клетки растений переходят в покоящееся состояние. Происходит процесс обособления цитоплазмы, что, в свою очередь, снижает возможность ее повреждения образующимися в межклетниках кристаллами льда. Особенно интенсивно перестройка обмена веществ протекает в период второй фазы закаливания. Вторая фаза закаливания протекает при дальнейшем понижении температуры (около 0°С) и не требует света. В связи с этим для травянистых растений ша может протекать и под снегом. В эту фазу происходит отток воды из клеток, а также перестройка структуры протопласта. Продолжается новообразование специфических, устойчивых к обезвоживанию белков. Опыты показали, что в присутствии ингибиторов синтеза белка процесс закаливания не происходит (Т.И. Трунова). Важное значение имеет изменение межмолекулярных связей белков цитоплазмы. При обезвоживании, происходящем под влиянием льдообразования, происходит сближение белковых молекул. Связи между ними рвутся и не восстанавливаются в прежнем виде из-за слишком сильного сближения и деформации белковых молекул. В связи с этим большое значение имеет наличие сульфгидрильных и других гидрофильных группировок, которые способствуют удержанию воды и препятствуют сближению молекул белка. Перестройка цитоплазмы способствует увеличению ее проницаемости для воды. Благодаря более быстрому оттоку воды уменьшается опасность внутриклеточного льдообразования. Не для всех растений необходимо протекание процессов закаливания в две фазы. У древесных растений, обладающих достаточным количеством сахаров, сразу протекают изменения, соответствующие второй. Таким образом, в процессе закаливания возникает морозоустойчивость, которая определяется рядом изменений. У закаленных растении благодаря высокой концентрации клеточного сока, уменьшению содержания воды кристаллы льда образуются не в клетке, а в межклетниках. Количество образовавшегося в межклетниках льда у закаленных растений также значительно меньше. Изменение свойств белков цитоплазмы приводит к тому, что они становятся более устойчивыми к обезвоживанию. Накопление Сахаров оказывает дополнительное защитное влияние. Важное значение имеет повышение устойчивости мембран к обезвоживанию и механическому давлению. Имеются данные, что при закаливании увеличивается количество фосфолипидов и ненасыщенных жирных кислот. Важно отметить, что в клетках закаленных растений накапливается АТФ. Чем больше развитие указанных признаков у отдельных видов и сортов растений, тем выше их морозоустойчивость. Морозоустойчивость – комплексный признак, запрограммированный генетически, однако он проявляется в определенных условиях среды. Повышение температуры весной сопровождается противоположными изменениями. Поэтому весной растения часто гибнут даже от небольших заморозков. Повышение морозоустойчивости растений имеет большое практическое значение. Для предохранения растений от повреждения морозом важно правильно организовать их питание в осенний период. Усиление фосфорного питания повышает устойчивость растений к морозу, тогда как азотные удобрения, способствуя процессам роста, делают растения более чувствительными. Благоприятное влияние на морозоустойчивость оказывает обработка такими микроэлементами как цинк, молибден, кобальт. Очень большое значение имеет также выведение морозоустойчивых сортов растений. Делаются попытки создания морозоустойчивых трансгенных растений путем введения генов, кодирующих ферменты синтеза веществ-криопротекторов, например, пролина и бетаина.
ЗИМОСТОЙКОСТЬ РАСТЕНИЙ В зимний период растительный организм, помимо прямого влияния мороза, подвергается еще ряду неблагоприятных воздействий. Особенно многочисленные неблагоприятные воздействия испытывают травянистые многолетние и однолетние растения. Так, озимые растения могут погибать от слишком большого снежного покрова (выпревание растений). Это связано с тем, что под снегом температура несколько повышается (около 0°С) и процесс дыхания идет довольно интенсивно. В результате происходит такая сильная трата Сахаров, что растения могут погибнуть от истощения. Кроме того такие растения легко поражаются снежной плесенью, что также приводит к гибели. В связи с этим для районов с теплыми зимами и очень глубоким снежным покровом, который лежит 2–3 месяца, необходимо выведение сортов с повышенным содержанием углеводов. Частой причиной зимней гибели растений является повреждение, связанное с образованием ледяной корки (выпирание растений). Образованию ледяной корки способствует наступление морозов при отсутствии снежного покрова. При образовании в почве льда происходит оттягивание воды из нижних слоев почвы, корни растения разрываются, что, естественно, приводит к их гибели. В этом случае важно, чтобы растения обладали большой устойчивостью корневых систем, большой способностью их к растяжению. Имеет значение также глубина залегания узла кущения. Углубление зоны кущения с 0,7 до 1,4 см значительно уменьшает гибель растений. Положение узла кущения зависит от ряда условий. Показано, что пасмурная погода, загущенные посевы приводят к более поверхностному его залеганию. При более глубокой заделке семян зона кущения располагается несколько глубже. В весенний период растения погибают прежде всего от возврата холодов. Растения, перенесшие в зимний период температуру – 30°С, могут погибнуть весной при небольших заморозках. Кроме того, весной в пониженных местах в период таяния снега накапливается вода, и растения могут пострадать от вымокания. В этом случае причиной гибели растений служит резкий недостаток кислорода. При недостатке кислорода в клетках растений начинается процесс брожения, что может вызвать прямое отравление организма продуктами брожения, в частности спиртом.
УСТОЙЧИВОСТЬ РАСТЕНИЙ К ЗАСОЛЕНИЮ Большое количество почв характеризуется повышенным содержанием солей, которое может оказывать вредное и даже губительное влияние на растительный организм. Кроме того, неумелое орошение часто приводит к засолению. Вредное влияние высокой концентрации солей может проявляться и при резко повышенных дозах минеральных удобрений. В связи со сказанным вопрос о солеустойчивости растений приобретает большое значение.
Устойчивость растений к различным факторам среды Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте: |
zdamsam.ru
Получение растений, устойчивых к различным стрессовым факторам
Культура растительных клеток и тканей представляет собой биологическую систему, в которой отсутствуют регуляторные механизмы, действующие на уровне целого организма. Исследования, проведенные на однородном клеточном материале, наряду с пониманием иерархии систем регуляции физиологических процессов позволяют получить более определенные результаты по анализу действия абиотических и биотических стрессовых факторов на растительную клетку. Это отвечает требованиям современного селекционного процесса, где неотъемлемым элементом является повышение устойчивости растений к неблагоприятным условиям среды.Традиционная селекция ведется на уровне организмов, но процесс эффективно ускоряется при использовании тканевых и клеточных культур.
В условиях in vitro можно задавать различные параметры, адекватные тем, в каких позже придется жить взрослым растениям, в том числе и экстремальные условия выращивания. В культивируемых in vitro клеточных популяциях обнаружена тенденция к высокой наследственной изменчивости качественных и количественных свойств клеток.
Особый интерес у исследователей вызывают работы по получению растений-регенерантов из каллусных и суспензионных культур, прошедших отбор в стрессовых условиях.
Отбор на селективных средах может быть прямой и непрямой. Прямая селекция заключается в том, что в питательную среду добавляют в качестве селективных агентов факторы, к которым необходимо получить устойчивые линии, - повышенное содержание солей - NaCl, Na2SO4, AlCl3, K2SO4; водный стресс, отсутствие O2; продукты метаболизма фитопатогенов и т.д. Непрямая селекция заключается в получении растений, синтезирующих защитные соединения при этих стрессовых факторах.
Предложена следующая схема получения устойчивых линий клеточных культур: воздействие стрессора на культуру клеток будет приводить к частичной гибели популяции, но часть клеток может выжить, причем тем меньшая часть, чем сильнее стрессовое действие. Выжившие клетки переносят на свежую питательную среду, и культура будет толерантной к этому стрессору.
Использование токсинов фитопатогенов в отборе форм растений, устойчивых к болезням
Традиционных методов селекции недостаточно, чтобы улучшить генофонд растений в направлении устойчивости к наиболее опасным патогенам; требуются новые подходы, которые в сочетании с классическими методами позволили бы добиваться дальнейших успехов в создании новых устойчивых к биотическим стрессам, особенно к болезням, сортов сельскохозяйственных культур. Один из таких подходов - использование клеток и тканей растений для создания исходного для селекции на устойчивость к инфекционному стрессу материала. Имеется много примеров реализации таких подходов.Клеточную селекцию моркови проводили с использованием культурального фильтрата гриба Alternaria radicina, для чего применяли различные схемы селекции. Для формирования растений проростки переносили в пробирки на жидкую и агаризованную питательные среды. Растения-регенеранты контрольного варианта и полученные после клеточной селекции были проверены на устойчивость к патогену A. radicina. Для этого растения из пробирок были помещены на питательную среду, содержащую 95 %-й культуральный фильтрат гриба. Растения, полученные после клеточной селекции, обладали повышенной устойчивостью к метаболитам гриба А. radicina.
К настоящему времени созданы линии картофеля, томатов, пшеницы, моркови, риса, устойчивые, соответственно, к фитофторозу, альтернариозу, септориозу, ирукуляриозу и т.д., где в качестве селективного фактора используется культуральный фильтрат гриба.
Особую актуальность приобретают научные работы, посвященные селекции на устойчивость к корневым гнилям зерновых, из-за широкого распространения и высокой вредоносности данной болезни. В отборе форм ярового ячменя, устойчивых к корневым гнилям и перспективных для селекции на устойчивость к данному заболеванию в условиях Восточной Сибири, использовано однократное добавление токсических метаболитов корневых гнилей (20 %) в селективные среды на стадии пролиферации каллусных тканей. Выжившие каллусы обладали способностью к стеблегенезу и ризогенезу. Полученные на их основе растения регенеранты в своем большинстве отличались устойчивостью к поражению возбудителями корневой гнили.
Выделение солеустойчивых форм растений путем прямой и непрямой селекции в культуре ткани
Одним из факторов внешней среды, которые приводят к значительному снижению урожайности многих сельскохозяйственных культур, является засоленность почв. В связи с общим ухудшением экологической обстановки в мире и широким применением искусственного орошения возрастает потребность в селекции солетолерантных форм растений.В частности, такая проблема весьма актуальна и для районов рисосеяния. Скрининг уже имеющихся в местных сортах и популяциях вариантов дает положительные результаты, но существует необходимость дальнейшего повышения солеустойчивости риса, которая в целом значительно ниже, чем у других зерновых, например пшеницы и ячменя.
Механизмы солетолерантности еще недостаточно изучены, несмотря на большое количество исследований. Затрудняет селекцию солетолерантных растений и значительная вариабельность типов засоленности. Большие возможности для изучения стрессоустойчивости (в том числе и солеустойчивости) дает применение культуры растительных клеток. Как правило, при прямом отборе солетолерантных клеточных линий используют питательные среды, содержащие в качестве селективных агентов какую-либо соль.
У ряда культур уже получены путем прямой селекции клеточные линии и растения-регенеранты, обладающие свойством солеустойчивости и сохраняющие его при регенерации и семенном размножении. Кроме прямого отбора возможны и непрямые методы селекции на устойчивость к стрессам (в том числе и к засолению). Хорошо известна, например, защитная роль пролина при воздействии на бактериальные и растительные клетки ряда неблагоприятных факторов внешней среды: холодового и теплового шока, водного стресса, повышенного содержания солей и др. В связи с этим представляет интерес получение клеточных линий растений, способных в ответ на стрессовые воздействия накапливать значительные количества пролина, обеспечивая таким образом неспецифическую защиту организма.
Процесс селекции устойчивых вариантов в культуре тканей растений обычно состоит из двух основных этапов: собственно отбора устойчивых клеточных линий на соответствующих селективных средах и регенерации растений из полученных клеточных вариантов.
Путем прямой селекции на среде, содержащей 1 % хлористого натрия, получена серия регенерантов. Для проведения селекции стрессоустойчивых вариантов риса непрямым путем, т.е. путем отбора устойчивых к аналогам пролина клеточных линий с последующей регенерацией растений, была изучена чувствительность каллусных культур риса дикого типа к двум его аналогам. При этом обнаружена чрезвычайно высокая устойчивость исходных каллусных линий риса к обоим аналогам.
Удалось получить солетолерантные каллусные линии и растения риса путем прямой (отбор и регенерация на NaCl-содержащих средах) и непрямой (на средах с аналогами пролина) селекции в культуре ткани нескольких сортов риса, несмотря на обнаруженную чрезвычайно высокую естественную устойчивость каллусной культуры риса к аналогам пролина.
В Красноярском НИИСХ разработаны технологии создания регенерантов ячменя в культуре незрелых зародышей с использованием стадии каллусных тканей и селективных сред (высокие концентрации соли и низкие рН) и получены десятки линий-регенерантов, у которых подтверждена устойчивость к засолению и кислотности почв.
Однако применение селекции позволяет получать клеточные линии и растения, обладающие защитой от солевого стресса. Особенно перспективен этот подход к сортам, имеющим низкую солеустойчивость, так как такой метод повышает общую неспецифическую защиту клетки и значительно увеличивает ее устойчивость стрессам организма.
Одним из методов получения мутантов с повышенным синтезом аминокислот является отбор вариантов, устойчивых к соответствующим аналогам. Ранее путем селекции на устойчивость к одному из аналогов пролина -L-азетидин-2 карбоновой кислоте - были получены солетолерантные клеточные линии табака и сои. Выделенные регенеранты отвечали повышенным синтезом пролина при помещении в среды с NaCl и обладали повышенной осмостойкостью.
Другим аналогом пролина является L-оксипролин, который также позволяет получить солеустойчивые растения.
Выработка у растений солеустойчивости важна не только в сельском хозяйстве, но и хозяйстве городском. Применение противогололедных реагентов, в частности, технической соли, на улицах городов неблагоприятно для роста и развития растений. Используя культуру in vitro на селективных средах можно в течение короткого времени провести скрининг больших популяций клеток овсяницы и полевицы - основных газонных трав на признак солеустойчивости. Отмечается наследование толерантности к NaCl и перекрестная устойчивость к бишофиту (MgCl2) - основной противогололедной соли.
Также применяются новые селективные среды с ионами Ва2+ для отбора солеустойчивых клеточных линий.
Отбор холодоустойчивых форм
В настоящее время актуальной проблемой является повышение устойчивости теплолюбивых растений к действию пониженных положительных температур (холодоустойчивости). Известно много работ, в которых показано повышение холодоустойчивости посредством химических или физических воздействий. Однако имеются лишь единичные работы, использующие методы и технологии in vitro в целях получения холодоустойчивых форм теплолюбивых растений.В условиях in vitro можно задавать различные параметры, адекватные тем, в каких позже придется жить растениям, в том числе и экстремальные условия выращивания, например пониженные температуры. Это также одна из реальных задач в сельском хозяйстве, так как ее решение позволит успешно культивировать растения в районах с частыми весенними заморозками. Таким способом созданы более холодоустойчивые линии табака, риса, томата.
Каллусные культуры получали из различных частей стерильных этиолированных растений огурца. Холодовое повреждение (жизнеспособность) клеток каллусных тканей определяли по восстановлению трифенилтетразолия хлорида, по прижизненному окрашиванию метиленовым синим с последующим подсчетом числа живых и мертвых клеток в гемоцитометре (камере Фукса - Розенталя) и по приросту каллусной ткани в течение 10 дней после охлаждения.
В качестве критерия жизнеспособности растительных клеток использовали состояние их митохондрий, оцениваемое по восстановлению ТТХ. Из каллусов первого пассажа, выдержанных в течение 24 ч при оптимальной (25 °С) и пониженной (3 °С) температуре, экстрагировали продукт восстановления ТТХ - формазан. Поскольку различные органы теплолюбивых растений обладают неодинаковой холодовой чувствительностью, предполагали, что и каллусные линии, полученные из этих органов и сохраняющие эпигенетические особенности, различаются по чувствительности к охлаждению.
Для оценки соотношения живых и мертвых клеток в клеточных культурах использовали также прижизненное окрашивание красителями с последующим подсчетом окрашенных и неокрашенных клеток.
Способность растительных клеток переносить действие стресса отражается в образовании новой каллусной ткани после переноса в оптимальные условия. Через 10 сут после сублетального охлаждения (3 °С, 24 ч) каллусов первого пассажа измеряли параметры роста линий различного происхождения. Каллусы, полученные из семядольных листьев, показали наибольший прирост линейных размеров. Наименьший прирост к исходному размеру наблюдали у охлажденных каллусных линий, полученных из гипокотиля. Это, вероятно, также связано с эпигенетическими особенностями клеток культур.
Измерения чувствительности к охлаждению каллусных линий в I-IV пассажах позволили выявить тенденцию к постепенному повышению холодоустойчивости. В результате систематически действующего стрессового фактора происходит адаптация клеточных культур к пониженным температурам и повышение жизнеспособности клеток после стрессового воздействия.
Все исследованные факторы (различные экспланты и условия выращивания) оказывают существенное влияние на холодоустойчивость каллусных линий.
Сравнивая устойчивость каллусов различного происхождения, можно заключить, что наиболее устойчивыми к пониженным температурам являются каллусные линии, полученные из семядольных листьев и апикальной зоны побега.
Н.А. Воинов, Т.Г. Волова
medbe.ru
Биология для студентов - 08. Устойчивость растений к неблагоприятным условиям среды, пути ее повышения.
Устойчивость растений — способность растений противостоять воздействию экстремальных факторов среды. Присущий растениям тот или иной уровень устойчивости выявляется лишь при воздействии экстремального фактора среды. В результате действия такого фактора наступает фаза раздражения — резкое отклонение от нормы ряда физиологических параметров и быстрое возвращение их к норме. Затем происходит изменение интенсивности обмена веществ и повреждение внутриклеточных структур. При этом подавляются все синтетические, активизируются все гидролитические процессы и снижается общая энерго обеспеченность организма. При воздействии повышается летальный для организма порог, растение гибнет. Если же действие неблагоприятного фактора не достигло порогового значения, наступает фаза адаптации.
Гомеостаз, способность живых организмов сохранять относительное динамическое постоянство состава и свойств внутренней среды и устойчивость основных физиологических функций в условиях изменяющейся внешней среды. Механизм гомеостаза у растений изучен слабо. Одним из доказательств его существования служит избирательное поступление катионов и анионов при всасывании воды из почвы в корень и распределение их по органам растений. В критический период у них увеличиваются концентрация клеточного сока и осмотическое давление при снижении транспирации листьев. Только благодаря срабатыванию механизмов поддержания гомеостаза достигается жизнеобеспечение растений в неблагоприятных условиях существования. Типы и виды устойчивости.
Устойчивость растений к низким температурам подразделяют на холодостойкость и морозоустойчивость. Под холодостойкостью понимают способность теплолюбивых растений переносить низкие положительные температуры. Первичный эффект пониженных положительных температур связан с повреждением мембран, увеличением их проницаемости. Возрастает потеря мембранами ионов кальция, выход калия из цитоплазмы. Показано, что меняется молекулярная архитектура мембран, расположение в них липидных молекул, происходят конформационные изменения белков. Резко меняются свойства мембран митохондрий и хлоропластов. В связи с этим нарушаются процессы окислительного и фотосинтетического фосфорилирования. Степень повреждения мембран зависит от содержания насыщенных жирных кислот, которые при действии низких температур переходят в состояние геля, что снижает их подвижность, нарушает транспорт веществ и энергетические процессы.
Морозоустойчивость — способность растений переносить отрицательные температуры. Одной из наиболее ранних реакций на охлаждение является окислительный стресс. Усиление перекисного окисления липидов происходит благодаря накоплению активных форм кислорода. Изменяется соотношение ненасыщенных и насыщенных жирных кислот. Происходит повышение вязкости липидной фазы мембран, нарушаются функции мембранных белков, работа транспортных систем клетки. Плазмалемма теряет полупроницаемость. Нарушается работа ферментов, локализованных на мембранах хлоропластов и митохондрий, и связанные с ними процессы окислительного и фотосинтетического фосфорилирования. Интенсивность фотосинтеза снижается.
Жароустойчивость (жаровыносливость) — способность растений переносить действие высоких температур, перегрев. Превышение оптимального температурного уровня приводит к частичной или глобальной денатурации белков. Это вызывает разрушение белково-липидных комплексов плазмаллемы и других клеточных мембран, приводит к потере осмотических свойств клетки. В результате наблюдаются дезорганизация многих функций клеток, снижение скорости различных физиологических процессов.
Засухоустойчивость растений — это способность растений переносить значительное обезвоживание и перегрев своего организма, выживать во время засухи с наименьшим снижением урожайности. При засухе резко падает влажность воздуха, возрастает температура почвы и воздуха, растениям не хватает влаги. Начинается обезвоживание их клеток, тканей и органов. В растительном организме снижается синтез белка, нарушается структура цитоплазмы и энергетический обмен. В результате замедляется или прекращается рост растений, нарушается их развитие, снижается урожайность. При длительной засухе растения гибнут. Засухоустойчивость в основном определяется наследственными особенностями растений.
Солеустойчивость растений — это способность растений противостоять засолению, не снижая интенсивность течения основных физиологических процессов. Вредное влияние высокой концентрации солей связано с повреждением мембранных структур, в частности плазмалеммы, вследствие чего возрастает ее проницаемость, теряется способность к избирательному накоплению веществ. В этом случае соли поступают в клетку пассивно, и это усиливает повреждение клетки.
Газоустойчивость - это способность растений сохранять жизнедеятельность при действии вредных газов. Токсичные газы, попадая в листья, образуют кислоты или щелочи. Это приводит к изменению рН цитоплазмы, разрушению хлорофилла, нарушению клеточных мембран.
Пылеустойчивость — способность растений произрастать в условиях насыщенности окружающего воздуха мелкими твердыми частицами, способными оседать при безветрии.
Различают прямое и косвенное действие радиации на живые организмы. Прямое действие энергии излучения на молекулу переводит ее в возбужденное или ионизированное состояние. Особенно опасны повреждения структуры ДНК: разрывы связей сахарфосфат, дезаминирование азотистых оснований, образование димеров пиримидиновых оснований. Косвенное действие радиации состоит в повреждениях молекул, мембран, органоидов клеток, вызываемых продуктами радиолиза воды. Заряженная частица излучения, взаимодействуя с молекулой воды, вызывает ее ионизацию.
Зимостойкость растений — способность переносить неблагоприятные условия зимы: сильные морозы, оттепели, ледяную корку, вымокание, выпревание и др. Чаще всего растения гибнут зимой из-за вымерзания. Во время сильных морозов в межклетниках и клетках растения образуются кристаллы льда, которые повреждают цитоплазму. Ледяная корка появляется на посевах при оттепелях. Под таким ледяным панцирем растениям не хватает кислорода. Это ухудшает аэрацию клеток и ослабляет морозостойкость. Зимостойкость у растений развивается осенью и зимой в процессе закаливания У многолетних растений она восстанавливается ежегодно. Летом во время вегетации зимостойкость резко снижается.
Закаливание - процесс повышения устойчивости растительных организмов к низким температурам. В нашей стране теория закаливания разработана И. И. Тумановым в 1950 г. Согласно ей растения проходят три этапа подготовки:
- переход в состояние покоя;
- первая фаза закаливания;
- вторая фаза закаливания.
Процесс перехода в состояние покоя сопровождается смещением баланса фитогормонов в сторону уменьшения содержания ауксинов и гиббереллинов и увеличения содержания абсцизовой кислоты. Обработка ингибиторами роста повышает устойчивость организма к низким температурам, а обработка стимуляторами роста приводит к понижению устойчивости этих растений.
Первую фазу закаливания озимые злаки проходят на свету при низких положительных температурах за 6-9 дней, древесные - за 30 дней. Останавливается рост, в клетках накапливаются соединения, выполняющие защит¬ную функцию (сахара, растворимые белки и т. д.), в мембранах возрастает содержание ненасыщенных жирных кислот, снижается точка замерзания цитоплазмы, уменьшается объем внутриклеточной воды, что тормозит образование внутриклеточного льда.
Вторая фаза закаливания отмечается постепенным понижением температуры. Эта фаза происходит при температурах ненамного ниже нуля градусов и не зависит от света. Постепенно уменьшается объем связанной воды. Изменение структуры белковых молекул приводит к тому, что они лучше связывают воду. Увеличение объема связанной воды снижает возможность образования льда. Увеличивается проницаемость плазмалеммы. В межклетниках образуется лед, что предотвращает образование льда в протопласте.
Способы повышения зимостойкости. В питании важно соблюдать норму азот-фосфор. Оптимальное количество ускоряет развитие и созревание растений, улучшает рост корневой системы, которая более глубоко проникает в почву. Все это способствует хорошей зимовке. Калий – один из основных элементов, отвечающих за водный баланс растений и их устойчивость к неблагоприятным факторам. Полив - во второй половине сентября- в октябре проводят так называемые влагозарядковые поливы. Рыхление и окучивание. В качестве укрытия используют еловый лапник, торф, опилки, перегной, солому, сухие листья и др. Снегозадержание - у снегового покрова малая теплопроводность, и обычно температура на поверхности почвы не опускается ниже -5 град. Для снегозадержания можно использовать специальные щиты, кулисы, бороздовые посевы, формирование валков из выпавшего снега.
Растения могут бороться с действием высоких температур с помощью 3 «стратегий»:
- снизить температуру своего тела по сравнению с окружающей средой
- не снижая своей температуры, повысить устойчивость своих структур к повышенной температуре
- перейти в менее активное состояние и переждать действие высоких температур
Вода является основой всех жизненных процессов. Поэтому действие засухи на растение очень разнообразно, и практически нет тех процессов, которые бы она не затрагивала. Полив, особенно дождеванием, повышает влажность приземного слоя воздуха, снижает его температуру, создает в стеблестое (и насаждении) более ровный микроклимат. Наиболее эффективны частые поливы небольшими нормами, а в засушливых регионах — в сочетании с влагозарядковым поливом. Наибольший эффект поливы обеспечивают на высоком агротехническом фоне при оптимальных дозах удобрений.
Реакция растения на заражение патогеном может проявляться в широком диапазоне — от высокой восприимчивости до полной невосприимчивости или устойчивости. Агрессивность патогена зависит от его способности вызывать, заражение минимальным количеством заразного начала, продолжительности инкубационного периода болезни, скорости распространения патогена от растения к растению При рассмотрении возможных источников инфекции следует учитывать способы сохранения патогенов от одного вегетационного сезона до другого и пути их распространения. Иммунитет растений можно определить как полную невосприимчивость к болезням при наличии жизнеспособного возбудителя заболевания и всех необходимых условий для заражения.
Под атмосферным загрязнением понимают присутствие в воздухе газов, паров, частиц, твердых и жидких веществ, тепла, колебаний, излучений, которые неблагоприятно влияют, растения, климат. По происхождению загрязнения делят:
- на природные, вызванные естественными, часто аномальными, процессами в природе;
- антропогенные, связанные с деятельностью человека.
Газы оказывают различное влияние на растения, причем восприимчивость растений к одним и тем же газам неодинакова; наиболее вредны для них сернистый газ, фтористый водород, озон, хлор, диоксид азота, соляная кислота. Загрязняющие атмосферу вещества отрицательно влияют на сельскохозяйственные растения как за счет непосредственного отравления зеленой массы, так и за счет интоксикации почвы. Известно, что в растениях может накапливаться, не повреждая их и не снижая урожайность, такое количество радионуклидов, при котором растениеводческая продукция становится непригодной для использования.
vseobiology.ru
УСТОЙЧИВОСТЬ РАСТЕНИЙ К НЕБЛАГОПРИЯТНЫМ УСЛОВИЯМ СРЕДЫ.
УСТОЙЧИВОСТЬ РАСТЕНИЙ К НЕБЛАГОПРИЯТНЫМ УСЛОВИЯМ СРЕДЫ.
Устойчивость растений к неблагоприятным условиям - это, комплекс защитных барьеров, возникающих у растений в ответ на изменения условий окружающей среды. Это свойство вырабатывалось на протяжении эволюционного развития растений в различных условиях (под влиянием низких и высоких температур, засухи, избытка солей в почве и др.) и закрепилось генетически. Наиболее высокая устойчивость - у дикорастущих и местных сортов; менее устойчивы культурные растения.
Неблагоприятные факторы называют стрессорами, а реакцию организма на любые отклонения от нормы - стрессом. Факторы, которые вызывают стресс у растений, делят на три основных группы:
- физические - освещенность, температура, радиоактивность, излучение, влажность;
- химические - соли, газы, гербициды, фунгициды и т.д.;
- биологические - возбудители болезней, влияние животных.
Главные изменения, которые вызывают стресс, происходят на клеточном уровне, при этом повышается проницаемость мембран, возрастает вязкость цитоплазмы, увеличиваются гидролитические процессы, усиливается синтез этилена, АБК, пролина, стрессовых белков и т.д.
Эти стрессовые реакции наблюдаются при действии любых стрессоров и направлены на защиту внутриклеточных структур.
Оценка устойчивости растений к экстремальным факторам (холоду, морозу, засухе, жаре, засоленности почв) важна в селекционной и агрономической практике.
Определение солеустойчивости растений по количеству альбуминов в зеленых листьях.
По количеству альбуминов в листьях можно судить об устойчивости растений к засолению почвы. Чем больше растение содержит альбуминов, тем оно более устойчиво к засолению почвы.
Ход работы.
Взвешивают навеску в 2 г (свежие листья, размолотые семена и т.д. ) и смешивают ее в ступке с 10-15 мл воды. Переносят в центрифужную пробирку и центрифугируют 10 мин. при 5-6 тыс. об/мин.
Надосадочную жидкость переносят в стакан, добавляют 10-15 г сульфата аммония (NI-LO2SO4 до полного насыщения и оставляют на 10 мин. для осаждения. Затем центрифугируют 10 мин. при 8000 об/мин, жидкость сливают, а осадок разбавляют 5 мл дистиллированной воды.
Результаты заносят в таблицу:
|
Вид растения |
Содержание альбуминов |
Выводы |
|
|
|
|
|
|
|
|
Оборудование и реактивы:
2-3 вида растений, (Nh5)2S04, колбы на 50 мл, центрифужные пробирки, бумажные фильтры, пипетки на 50 мл, центрифуга.
Вопросы для повторения:
- Как классифицируются растения по степени солеустойчивости?
- Каковы анатомические, морфологические и физиологические особенности у растений, устойчивых к засолению?
- С помощью каких методов можно определить устойчивость растений к засолению?
Защитное действие сахара при замораживании клеточного сока.
Повышение содержания свободных Сахаров является одним из механизмов защиты растений от действия низких температур (защита от вымораживания). Роль Сахаров заключается в укреплении структуры воды, в образовании сверх структуры. Сохранение структуры воды предохраняет клеточные полимеры от коагуляции.
Ход работы
Натереть на мелкой терке свеклу, отжать сок через марлю, а затем профильтровать его через бумажный фильтр.
В три пробирки налить по 1 мл профильтрованного сока. В первую пробирку добавить раствор сахарозы I М в соотношении 1 часть сока - 3 части сахарозы. Первую и вторую пробирки поместить в охладительной смеси (снег + соль в соотношении 3 : 1) в морозильную камеру холодильника на 20 мин. Третья пробирка - контрольная.
Вынуть пробирки из холодильника и опустить их в стакан с теплой водой. Появление хлопьевидного осадка во второй пробирке говорит о нарушении структуры полимерных соединений (произошла денатурация белка), что могло явиться причиной гибели клеток.
Сделать вывод о влиянии сахарозы на устойчивость растений к низким температурам.
Оборудование и реактивы:
Свекла, мелкая терка, кристаллизатор, конические колбы на 250 мл, воронка с фильтром, пробирки, цилиндры мерные на 10 мл, стаканы на 200-300 мл, холодильник, сахароза 1 М, охладительная смесь (снег + соль).
Вопросы для повторения:
- Какие физиологические процессы происходят у растений при действии низких температур?
- Какие приспособления существуют у растений для защиты от низких температур?
Термины.
Выпревание - наблюдается у озимых растений при глубоком снеговом покрове, который лежит 2-3 месяца. При оттепелях интенсивность дыхания усиливается, количество Сахаров в тканях уменьшается с 20% до 2-4%, что приводит к истощению растений. Такие растения весной легко повреждаются снежной плесенью и гибнуг.
Вымокание - наблюдается весной, когда после таяния снега часть растений остается под водой. У таких растений нормальное дыхание прекращается, усиливается анаэробный процесс, в результате чего растения погибают от истощения и отравления.
Газоустойчивость - загрязнение атмосферы газами, пылью, аэрозолями, поступающими с промышленных предприятий. Растения резко снижают свою продуктивность и часто погибают. Вызывается это тем, что токсичный газ через устьица^ попадает в листья, образует кислоту или щелочь, которые взаимодействуют с протопластом. А уже кислоты разрушают хлорофилл, изменяют рН, усиливают окисляемость, изменяют обмен веществ в клетках листа и т.д.
Галофиты - растения, устойчивые к засолению. Это и растения, накапливающие соли, и растения, которые приспособлены к выделению солей. Для многих представителей галофитной флоры содержание солей в почве 2-3% считается безвредным. Иногда отсутствие солей отрицательно сказывается на росте и развитии таких растений. Галофиты легко перенос высокое осмотическое давление засоленного почвенного раствора.
Гликофиты - растения, не устойчивые к засолению. Это почти все культурные растения, которые не выдерживают содержания солей в почве более 0,5%.
Закаливание растений - физиологическая адаптация растений к неблагоприятному действию низких температур. Закаливание происходит в два этапа (по Туманову): а) на свету и при низких положительных температурах (днем 10°С, ночью -2°С) и умеренной влажности происходит накопление сахарозы; б) при температуре 0°С. В клетках изменяются соотношения между формами воды, больше связанной; происходит перестройка белков цитоплазмы
Засухоустойчивость - способность растений переносить значительное обезвоживание клеток, тканей и органов, а также перегрев. При обезвоживании нарушаются коллоидные и химические свойства цитоплазмы - изменяется степень ее дисперсности и адсорбционная способность. Сильно уменьшается синтез белков, нарушается метаболизм в целом, замедляется рост, снижается продуктивность. Наиболее засухоустойчивые растения - ксерофиты и часть мезофитов.
Жароустойчивость - способность растений переносить действие высоких температур. Обычно высокие температуры разрушают белково-липидный комплекс пдазмалеммы протопласта, что приводит к потере осмотических свойств клетки. Но имеются виды, которые переносят высокие температуры. Это суккуленты, некоторые кактусы. Из культурных растений - сорго, рис, хлопчатник, клещевина.
Иммунитет - устойчивость растений к болезням.
Полегание - наблюдается под влиянием ветра или дождя при избыточном питании азотом и высокой влажности почвы. Характерно для злаковых культур. Возникает ввиду нарушения равновесия между белковым и углеводным питанием, что задерживает процесс лигнификации оболочек клеток. Значительно помогают усилить устойчивость растений к полеганию биологически активные вещества - ретарданты, которые замедляют рост растений.
Морозоустойчивость - способность растений переносить температуру ниже 0°С. Разные растения переносят зимние условия в различных состояниях. У однолетних растений зимуют семена, у многолетних - клубни, луковицы, корневища.
Холодоустойчивость - способность растений длительное. время переносить низкие темературы (от 1°С до 10°С). Свойственна растениям умеренной зоны, таким как ячмень, овес, лен, вика, др.
1. Вариант опыта (1)
3. Общая длина растения. Измеряется от кончика корня до кончика верхнего листа (3).
4. Длина надземной части растения (от корневой шейки до кончика верхнего листа) (4).
Похожие статьи:
Добавить статью в закладки
portaleco.ru
Способ повышения устойчивости растений к абиотическим стрессам
Изобретение относится к биотехнологии и может быть использовано при получении микробиологических средств регуляции роста и развития растений. Способ повышения устойчивости растений к абиотическим стрессам предусматривает обработку растений ассоциативными метилотрофными бактериями, оказывающими протекторное действие на рост и развитие растений, подверженных абиотическим стрессам. В качестве бактерий с протекторным действием используют природные изоляты метилобактерий, обладающих способностью к синтезу фитогормонов, гиббереллинов, цитокинов и ауксинов. Инокуляции могут быть подвергнуты семена и микроразмножаемые растения. Изобретение позволяет повысить продуктивность и устойчивость растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности. 6 табл., 6 пр.
Изобретение относится к биотехнологии и сельскому хозяйству, а именно к микробиологическим средствам регуляции роста и развития растений.
Основной причиной снижения продуктивности сельскохозяйственных культур во всем мире являются различные неблагоприятные факторы абиотической среды.
В современном сельском хозяйстве повышение устойчивости растений к неблагоприятным условиям среды достигается сочетанием различных подходов. Так, методами традиционной селекции создаются пластичные сорта, обладающие повышенной устойчивостью к какому-либо стрессовому фактору, однако продолжительность периода выведения сорта, как правило, составляет длительный период времени - не менее 10 лет.
Существуют способы повышения толерантности к абиотическим стрессам за счет генно-инженерной трансформации клетки растений экзогенным полинуклеотидом, экспрессия которого придает клетке повышенную толерантность к абиотическому стрессу, а затем из клетки регенерируют фертильное растение [Ронен Д., Голан Е., Карчи X., Мейсснер Р. Способы повышения толерантности к абиотическому стрессу и/или биомассы у растений и получаемые таким образом растения // Патент РФ №2350653, публикация заявки 27.07.2006, БИ №9, 2009, дата приоритета 20.05.2004].
К недостаткам способа относится то, что он не может обеспечить кардинальное решение проблемы, поскольку устойчивость к абиотическим стрессам имеет полигенную природу, а способ предусматривает стратегию переноса одного-двух генов. К тому же, несовершенство генно-инженерных технологий обусловливает значительные медико-биологические и экологические риски при использовании генно-модифицированных растений.
Известны способы повышения устойчивости растений к метеорологическим и фитопатогенным стрессам за счет обработки семян и вегетирующих растений химическими средствами, обладающими одновременно ауксиновой и слабой ретардантной активностью [Гафуров Р.Г. Стресспротекторы-фиторегуляторы для растениеводства / Патент РФ №2394427, публикация заявки 20.07.2010, БИ №20, дата приоритета 05.02.2009].
Недостатки использования химических стресспротекторов-фиторегуляторов заключаются в их способности вызывать изменения в геноме растений вследствие специфики их химической природы; наличия в коммерческих препаратах примесей и образования мутагенов при их метаболизме в растениях [Хрусталева Л.И. Фиторегуляторы и их влияние на геном растений // Сельскохозяйственная биотехнология. Избранные работы / Под ред. B.C. Шевелухи. М.: «Евразия+». 2000. С. 158-169]. Существенным недостатком синтетических фиторегуляторов является их высокая стоимость, поскольку химический синтез аналогов фитогормонов сопряжен со слишком высокими затратами.
Ближайшим аналогом средства повышения устойчивости растений к неблагоприятным факторам абиотической среды является использование ризосферной ростстимулирующей бактерии Pseudomonas aureofaciens ВКМ В-2391Д для защиты и улучшения роста растений, растущих на почвах, загрязненных полициклическими ароматическими углеводородами (ПАУ) [Анохина Т.О. Кочетков В.В., Воронин A.M. Штамм бактерий Pseudomonas aureofaciens для защиты и улучшения роста растений, растущих на почвах, загрязненных полициклическими ароматическими углеводородами // Патент РФ №2352629. Публикация заявки 20.10.2007, БИ №11, дата приоритета 12.04.2006]. Техническим эффектом, который может быть получен при использовании данного штамма, является его способность улучшать рост растений, загрязненных ПАУ. Недостатком использования ризосферного штамма является зависимость эффективности его взаимодействия с растением от генетически обусловленного состава его корневых выделений. Например, активность колонизации ризосферы псевдомонадами зависит от соотношения сахаров и органических кислот в корневых выделениях, а основным условием синтеза индолил-уксусной кислоты (ИУК) ризосферными бактериями является наличие в корневых экссудатах триптофана - предшественника ИУК [Кравченко Л.В., Леонова Е.И. Использование триптофана корневых экзометаболитов при биосинтезе индолил-3-уксусной кислоты ассоциативными бактериями. // Микробиология. - 1993. - Т. 62. - №3. - С. 453-459.], содержание которого варьирует у различных видов и сортов растений. Ризосферные бактерии, как правило, не способны установить прочную ассоциативную связь с растениями из-за конкуренции с другими почвенными микроорганизмами, поэтому биопрепараты на их основе приводят к кратковременным положительным эффектам и требуют нескольких обработок в течение вегетационного периода. Недостаточная эффективность таких биопрепаратов может быть связана с потерей жизнеспособности клетками бактерий в почве или с низкой степенью приживаемости микроорганизмов на растениях.
В качестве прототипа изобретения выбрано использование ассоциативных метилобактерий для стимуляции роста и морфогенеза растений in vitro [Каляева М.А., Захарченко Н.С., Доронина Н.В., Рукавцова Е.Б., Иванова Е.Г., Алексеева В.В., Троценко Ю.А., Бурьянов Я.И. Стимуляция роста и морфогенеза растений in vitro ассоциативными метилотрофными бактериями // Физиология растений. 2001. Т. 48. №4. С. 596-599.]. Инокуляция метилотрофными бактериями изолированной растительной ткани приводила к формированию стойких микробно-растительных ассоциаций. При последующих пассажах, метилобактерий сохранялись в межклетниках и участвовали в метаболизме растений, оказывая положительное влияние на их рост и морфогенез. В этой работе рассматривали влияние на рост и развитие растений облигатных аэробных метилобактерий, а роль розовоокрашенных факультативных метилотрофных (РОФМ) бактерий в ней не показана. Кроме того, во всех перечисленных аналогах и прототипе нет сведений о возможности влияния колонизации бактериями на повышение устойчивости растений к стрессовым абиотическим факторам: дефицита влаги, токсичности ионов алюминия и кислой реакции среды.
Задачей предлагаемого изобретения является разработка способа повышения устойчивости растений к неблагоприятным факторам абиотической среды на основе фиторегуляторного и протекторного действия метилобактерий.
Поставленная задача решается тем, что семена и/или культивируемую in vitro растительную ткань инокулируют метилобактериями, используя природные немодифицированные микроорганизмы.
Сущность изобретения
Тесный ассоциативный симбиоз метилотрофных бактерий с растением, в отличие от PGPR-бактерий, не видоспецифичен. Он основан на функционировании природного «метанольного цикла», который заключается в использовании метилобактериями в качестве источника углерода и энергии метанола - естественного продукта метаболизма растений, снабжая их взамен биоактивными соединениями, вне зависимости от почвенно-климатических условий и генотипических особенностей растений. Благодаря уникальности метаболизма, метилобактерий не имеют конкурентов среди почвенных микроорганизмов. Кроме того, они способны колонизировать не только ризосферу, но и филоплану растений. Среди метилотрофных бактерий нет фитопатогенных видов, они не опасны для теплокровных животных и человека. Ассоциативные розовоокрашенные факультативные метилотрофные (РОФМ) бактерии отличаются высокой выживаемостью при высушивании и замораживании, устойчивостью к УФ радиации, низкой влажности и высокой температуре [Романовская В.А., Соколов И.Г., Малашенко Ю.П., Рокитко П.В. Мутабельность эпифитных и почвенных бактерий рода Methylobacterium и их резистентность к ультрафиолетовому и ионизирующему излучению // Микробиология. 1998. т. 67, №1. С. 106-115.]. Высокая жизнеспособность клеток РОФМ бактерий во внешней среде и хорошая приживаемость метилобактерий на растениях в сочетании со способностью к синтезу цитокининов, ауксинов, витаминов и других биологически активных веществ в строго сбалансированных количествах, благоприятствуют росту и развитию растений, повышают их устойчивость к стрессам.
Дополнительным преимуществом РОФМ бактерий является возможность инокуляции ими не только семян и посадочного материала, но и клонально микроразмножаемых растений, которые лишены естественной ассоциативной микрофлоры и особенно уязвимы к воздействию неблагоприятных факторов среды.
Условиями достижения технического результата являются использование штаммов метилотрофных бактерий, ассоциированных с растениями в местных природно-климатических условиях, использование суспензий ассоциативных бактерий для инокуляции семян с титром 106-109, а для инокуляции микроразмножаемых растений - суспензий с титром 106. Важно использовать штаммы, биосинтетическая активность которых подтверждена положительными результатами тестирования. Основным отличительным признаком используемых штаммов является их протекторное действие в отношении стрессированных растений за счет сбалансированного синтеза метаболитов с фиторегуляторной активностью.
Технический эффект, достигаемый при использовании предлагаемого изобретения, заключается в повышении устойчивости растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности.
Описание изобретения
С целью повышения устойчивости растений к неблагоприятным факторам абиотической среды проводят инокуляцию семян и микроразмножаемых растений культурами метилобактерий с фиторегуляторным и протекторным действием.
Для инокуляции растений используют штаммы метилотрофных бактерий, получая элективную культуру на минеральной среде Канеда с метанолом, содержащей (г/л): Kh3PO4 - 2, (Nh5)SO4 - 2, MgSO4·7h3O - 0.125, NaCl - 0.5, FeSO4·7h3O - 0.002, дрожжевой автолизат - 0.1. Метанол в количестве 1% (об.:об.) добавляют после стерилизации и остывания среды до 30°C, разливают среду по 50 мл в колбы, объемом 250 мл. Засев среды производят, помещая сегменты основания листа и листовые влагалища зерновых злаков или напочвенные водорослевые пленки (наиболее благоприятные места для обитания метилотрофных бактерий) из расчета 10 кв. см на 50 мл среды. Культивирование проводят при 27°C на качалке (180 об/мин) в течение 7 сут. Из колб, содержимое которых приобрело розовый оттенок, отбирают по 1 мл накопительной культуры и высевают методом серийных разведений на агар Канеда с добавлением 2% метанола. Культивируют посевы при 27°C в течение 5-7 сут. Появившиеся мелкие (0,5-2,0 мм) колонии розового цвета изолируют под контролем стереоскопического микроскопа (×6-8 раз) и выделяют в чистую культуру.
Полученные таким образом культуры метилобактерий выращивают методом жидкофазного культивирования на минеральной среде того же состава при 27°C на качалке (180 об/мин) в течение 2 суток. Для определения способности бактерий синтезировать фитогормоны используют культуральную жидкость, которую предварительно освобождают от клеток микроорганизмов центрифугированием при 6000 об/мин в течение 10 мин.
Определение способности бактерий к синтезу ауксинов. Для определения способности бактерий синтезировать ауксины используют колориметрический метод анализа с реактивом Сальковского (1 мл 0,5М FeCl3 в 50 мл 35% хлорной кислоте). При смешении реактива Сальковского с надосадочной жидкостью в соотношении 1:2 через 30-40 мин появляется розовое окрашивание, по которому судят о наличии в культуральной жидкости ауксинов. Количественное определение ауксинов в надосадочной жидкости проводят на ФЭК 56М при длине волны 540 нм. Для построения калибровочного графика используют разведения стандартного раствора ИУК ("Fluca", Швейцария). Контролем служит питательная среда, на которой выращивают бактериальные культуры.
Определение способности бактерий к синтезу цитокининов. Определение цитокинина в культуральной жидкости бактерий проводят согласно методике, основанной на способности цитокининов задерживать старение листьев, в частности замедлять их пожелтение, что возможно зарегистрировать фотометрически. Ячмень выращивают в емкостях с почвой в условиях климакамеры. В возрасте 10-15 суток у растений отбирают сходные по размеру и цвету листья первого яруса. Их разрезают, отступив 2 см от нижнего края листа, на сегменты длиной 2 см. Сегменты раскладывают на фильтровальную бумагу, смоченную 3 мл КЖ испытуемой бактерии, и помещенные в стерильные чашки Петри диаметром 10 см. В каждую чашку помещают до 9 листовых сегментов. В контроле для смачивания фильтровальной бумаги используют неинокулированную среду. Чашки инкубируют при 20-25°C в кювете под стеклом при освещении лампами дневного света. Сохранение хлорофилла в сегментах ячменя оценивают через 7-10 суток инкубации. Для этого из трех сегментов вырезают пробочным сверлом по два диска диаметром 5 мм. Диски объединяют и растирают с 80%-м этанолом в фарфоровой чашке для упаривания, добавляя на кончике ланцета кварцевый песок и CaCO3. Полученный раствор количественно переносят в центрифужную пробирку и отделяют осадок центрифугированием в течение 5 мин при 2 тыс.об/мин. Осадок отбрасывают, а объем надосадочной жидкости доводят 80% этанолом до 5 мл. Оптическую плотность раствора определяют при 665 нм против контроля, которым является раствор, полученный путем объединения экстрактов хлорофилла из отрезков листьев, экспонированных на неинокулированной среде. Результаты выражают в оптических единицах. Для построения калибровочной кривой используют отрезки листьев ячменя, которые экспонируют на фильтровальной бумаге, смоченной растворами кинетина разных концентраций - от 1 до 50 мг/л. Контролем служат отрезки листьев, экспонированные на дистиллированной воде.
Определение способности бактерий к синтезу гиббереллинов проводят методом биотестирования на гипокотилях (подсемядольное колено) проросших семян салата {Lactuca sativa L.). Семена проращивают в течение двух дней на влажной фильтровальной бумаге в чашках Петри, помещенных в термостат при 25°C в темноте. Затем отбирают проростки с одинаковыми по длине корешками 6-8 мм и гипокотелем не более 5 мм, помещают их в стерильные чашки Петри на диск фильтровальной бумаги, смоченный 3 мл КЖ испытуемых штаммов микроорганизмов. В качестве контроля используют стерильную неинокулированную среду. Для каждой пробы берут по 10 проростков. Инкубацию проводят, размещая кюветы с чашками на 15 см ниже постоянного источника света. Длину гипокотилей измеряют через 3 суток. Принимая, что величина прироста гипокотелей прямо пропорционально зависит от концентрации гормона, для определения концентрации гиббереллина в КЖ микроорганизмов строят калибровочную кривую на основе данных, полученных в результате измерения длины гипокотилей в аналогичном варианте с использованием растворов гиббереллина в концентрациях от 1 до 100 мг/л.
Основным отличительным признаком штаммов метилотрофных бактерий, пригодных для инокуляции растений в целях повышения их стрессоустойчивости, является продукция ауксинов в пределах от 3 до 15 мкг/мл, цитокининов - не менее 0,5 мкг/мл, гиббереллина - не менее 0,15 мкг/мл.
Технический эффект, который достигается при использовании предлагаемого изобретения, заключается в повышении продуктивности и устойчивости растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности. Условиями достижения технического результата являются использование штаммов метилотрофных бактерий, ассоциированных с растениями в местных природно-климатических условиях, использование суспензий ассоциативных бактерий для инокуляции семян с титром 106-109, а для инокуляции микроразмножаемых растений - суспензий с титром 106. Важно использовать штаммы, биосинтетическая активность которых подтверждена положительными результатами тестирования. Основным отличительным признаком используемых штаммов является их протекторное действие в отношении стрессированных растений за счет сбалансированного синтеза метаболитов с фиторегуляторной активностью.
Далее приводятся примеры, показывающие эффективность применения природных изолятов метилотрофных бактерий для стимуляции ростовых процессов у растений, подвергнутых различным видам абиотических стрессов.
Пример 1, демонстрирующий стимуляцию роста пшеницы (Triticum aestivum L.) и ячменя {Hordeum vulgare L.) метилобактериями в условиях осмотического стресса. Семена растений стерилизовали в 2%-ном растворе препарата Виркон C в течение 15 мин, замачивали для инокуляции в жидких культурах метилобактерий (106 КОЕ/мл) на 24 ч (пшеница) и (109 КОЕ/мл) 4 ч (ячмень). Контролем служили семена, замоченные в среде Канеда, на которой выращивали культуры метилобактерий. После замачивания семена пшеницы проращивали в водной, а ячмень - в водно-бумажной культуре в сосудах, заполненных раствором Кнопа в половинной концентрации. Для создания осмотического стресса в раствор добавляли 10 и 15% полиэтиленгликоля (ПЭГ) с относительной молекулярной массой 6000. Растения выращивали при освещенности 10 Клк, фотопериоде 16 часов и температуре 23/18°C день/ночь. Линейные размеры и сухую массу проростков пшеницы определяли через 14 суток, у проростков ячменя - через 7 суток после инокуляции.
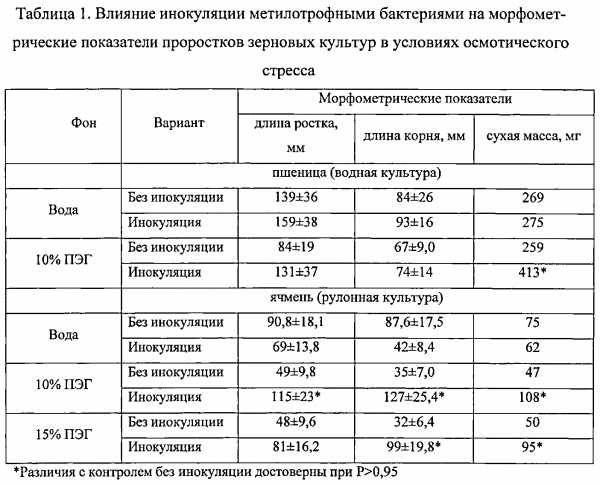
В результате инокуляции метилотрофными бактериями сухая масса проростков пшеницы в условиях дефицита влаги, обусловленного добавлением 10% ПЭГ, была на 59% выше, чем в контроле без инокуляции (табл. 1). Линейные размеры и сухая биомасса проростков ячменя, выращенных на фоне 10% ПЭГ, достоверно превысили высоту ростка, длину корня и сухую массу неинокулированных проростков в 2,3; 3,6 и в 2,3 раза соответственно. На фоне осмотического стресса, обусловленного 15% ПЭГ, длина корня и сухая масса инокулированных метилобактериями проростков ячменя превышали в 3,1 и 1,9 раза соответствующие показатели растений без инокуляции. Таким образом, в условиях осмотического стресса метилотрофные бактерии оказали на проростки пшеницы и ячменя протекторное и фиторегуляторное действие.
Пример 2, демонстрирующий изменение в результате инокуляции метилобактериями направленности морфогенеза в каллусной ткани ячменя, подвергнутой токсическому действию ионов алюминия. Для получения растений-регенерантов, устойчивых к ионам алюминия, используется каллусная ткань с продуктивным типом морфогенеза. Каллусную ткань ячменя получали и культивировали общепринятым методом на питательной среде Мурасиге и Скуга с введением 40 мг/л Al3+ при pH 3,8. Для инокуляции каллусной ткани использовали природные изоляты метилобактерий. Инокулировали 10-14 дневные каллусы, нанося культуру бактерий (107 КОЕ/мл) стерильной кисточкой на всю поверхность каллуса. Тип морфогенеза в каллусных культурах трех генотипов ячменя оценивали по наличию побегов и корней, сформированных одним каллусом на 20-й день после инокуляции (табл. 2).
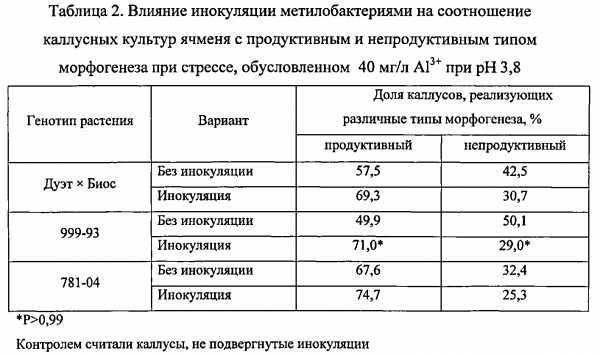
Под воздействием инокуляции метилобактериями доля каллусных линий, реализующих продуктивный тип морфогенеза в стрессовых условиях, повысилась на 7,1-21,1% по сравнению с контролем без инокуляции, в зависимости от генотипа ячменя. Увеличению регенерационной способности каллусной ткани ячменя в присутствии ионов алюминия способствовало стресспротекторное и фиторегуляторное действие метилобактерий.
Пример 3, демонстрирующий повышение частоты регенерации растений в каллусной культуре ячменя в условиях стресса, обусловленного сочетанием токсичности ионов алюминия и дефицита влаги. Каллусные культуры ячменя трех различных генотипов получали и культивировали согласно общепринятому методу. На этапе пролиферации каллус пассировали на стандартную питательную среду Мурасиге и Скуга с добавлением 20 мг/л Al3+ при pH 3,8, а на этапе морфогенеза - с добавлением 10% ПЭГ. Инокулировали природными изолятами метилотрофных бактерий 10-14-дневные каллусы ячменя, нанося культуру бактерий (107 КОЕ/мл) стерильной кисточкой на всю поверхность каллуса. Оценивали частоту регенерации растений через 35 дней после инокуляции (табл. 3).
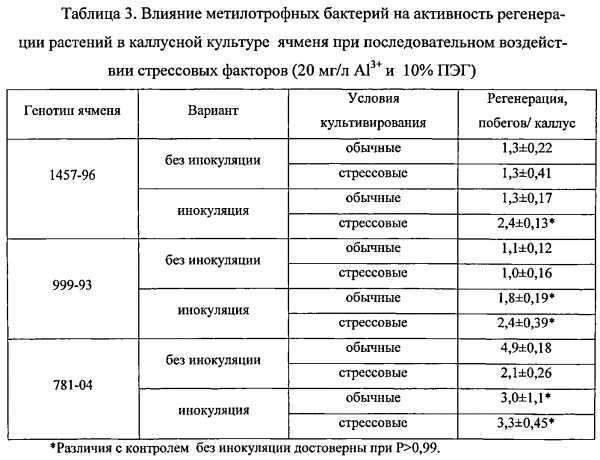
Количество растений-регенерантов, индуцированных различными генотипами ячменя в стрессовых условиях при инокуляции каллусов культурами метилобактерий, существенно превышало число растений регенерантов, полученных в контроле без инокуляции.
Пример 4, демонстрирующий стимуляцию роста растений картофеля (Solatium tuberosum L.) в меристемной культуре.
Культивирование меристемных растений картофеля проводили по стандартной методике на питательной среде Мурасиге и Скуга с добавлением 0,5 мг/л гибберелловой кислоты и 0,1 индолил-3-уксусной кислоты. Инокулировали метилобактериями микрочеренки картофеля, нанося культуру метилобактерий стерильной кисточкой на всю поверхность черенка. Эффективность инокуляции метилобактериями оценивали по морфометрическим показателям растений через 35 суток после инокуляции (табл. 4).
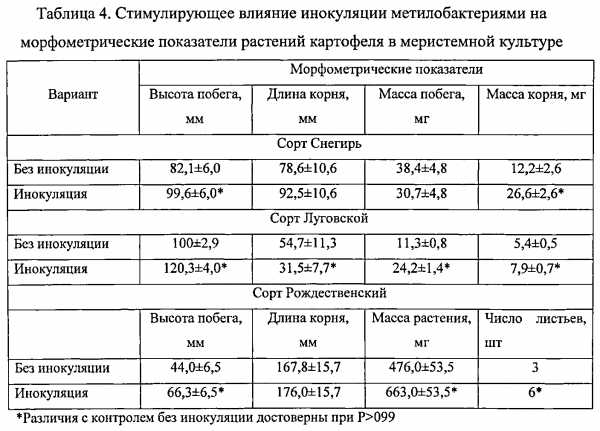
При микроклональном размножении картофеля метилобактериями инокуляция черенков приводила к более интенсивному росту побега и корня, формированию большего числа листьев, чем у неинокулированных растений в контроле.
Пример 5, демонстрирующий повышение в результате инокуляции метилобактериями адаптивности полученных при клональном микроразмножении растений земляники (Fragaria ananassa Duch.) к почвенным условиям.
Перевод клонально микроразмноженных in vitro меристемных растений в нестерильные условия часто бывает осложнен их низкой приживаемостью и слабым ростом. Для повышения адаптивности к почвенным условиям корни меристемных растений земляники инокулировали погружением на 24 ч в жидкую культуру метилобактерий (109 КОЕ/г), после чего растения высаживали в стаканчики с промытым и прокаленным речным песком. Спустя 1 месяц учитывали массу и линейные размеры растений. Контролем служили одновозрастные растения без инокуляции (табл. 5).
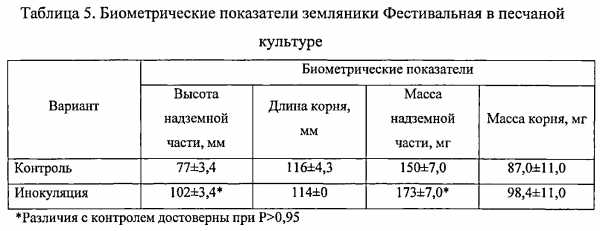
В результате инокуляции метилобактериями корней перед высадкой земляники в песчаную культуру увеличилась на 15% биомасса и на 32% - высота надземной части по сравнению с контрольными растениями. Это указывает на возможность использования метилобактерий для повышения адаптивности клонально микроразмножаемых in vitro растений земляники.
Пример 6, демонстрирующий повышение в результате инокуляции метилобактериями продуктивности клонально микроразмноженных растений картофеля при перенесении их в почвенные условия.
Меристемные растения картофеля, подвергнутые in vitro инокуляции метилобактериями, через 35 суток после инокуляции высаживали в почву и выращивали в вегетационных сосудах в контролируемых условиях климакамеры и при естественном освещении и влажности на вегетационной площадке. Учитывали количество и массу клубней с одного растения (табл. 5).
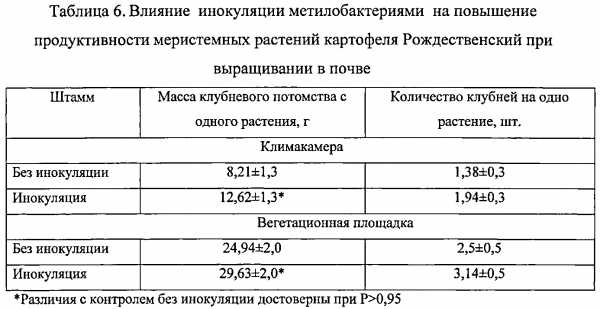
Положительный эффект колонизации метилобактериями меристемного картофеля продолжался таким образом, и при переводе растений из условий in vitro в почву. Масса клубневого потомства растенй, инокулированных метилобактериями, были достоверно выше, чем в контрольных вариантах без инокуляции.
Таким образом, заявленное изобретение обеспечивает технический эффект, заключающийся в повышении продуктивности и устойчивости растений к неблагоприятным воздействиям внешней среды: дефициту влаги, повышенной кислотности, ионной токсичности.
Способ повышения устойчивости растений к абиотическим стрессам, включающий обработку микроорганизмами со стресспротективным и фиторегуляторным действием, отличающийся тем, что колонизируют семена и/или микроразмножаемые in vitro растения выделенными из природных растительных субстратов в накопительной культуре с метанолом и отобранными тестированием на фиторегуляторную активность ассоциативными метилобактериями, выращенными в суспензионной культуре до концентрации 106-109 КОЕ/мл.
www.findpatent.ru
Повышение устойчивости растений к заболеваниям
 Растения, как и животные, имеют иммунитет, который предохраняет их от различных вредителей или неблагоприятных факторов. Иммунитет - это способность организма или растения противостоять или не воспринимать болезнь при контакте с ее возбудителем при наличии подходящих для заражения условий.
Растения, как и животные, имеют иммунитет, который предохраняет их от различных вредителей или неблагоприятных факторов. Иммунитет - это способность организма или растения противостоять или не воспринимать болезнь при контакте с ее возбудителем при наличии подходящих для заражения условий.
Устойчивость как частное проявление иммунитета заключается в том, что растения одной разновидности не поражаются болезнью или вредителями, либо страдают от них меньше, чем другие виды. Способность ослабленных или поврежденных культур сохранять урожайность называется выносливостью.
Многие культуры обладают абсолютным иммунитетом. Это значит, что патоген не может проникнуть в ткани и развиваться в них при наличии благоприятных внешних факторов. В зависимости от свойств растений и их особенностей, они могут обладать относительной устойчивостью к некоторым заболеваниям.
На степень сопротивляемости болезням влияет возраст растения, физиологическое состояние его частей. В раннюю пору сеянцы могут полечь. Спустя какое-то время им это уже не грозит. Молодые листья поражаются мучнистой росой, а старые или не заболевают, или страдают в меньшей степени.
Атмосферные условия значительно влияют на выносливость ягодников. Засушливая погода в течение летнего сезона снижает устойчивость к мучнистой росе.
Выращивание плодово-ягодных культур, а также использование эффективных современных методов их разведения ведет к активному применению удобрений и средств защиты. Ягоды, предназначенные для употребления в свежем виде, должны быть здоровыми, вкусными и экологически чистыми, без остатков пестицидов.
Активизация процессов защиты
Развитие современной науки дало профессиональным агрономам и садоводам-любителям новые знания о процессах, происходящих в растениях, о способах защиты их от вредителей.
Эти знания позволяют разрабатывать, производить и внедрять удобрения, легко усваиваемые растениями. Появилась возможность искусственно активизировать работу механизмов иммунитета сельскохозяйственных культур.
В ходе исследований выявлены элементы, способствующие увеличению сопротивляемости культур. Естественная устойчивость к неблагоприятным условиям определяется группой биологических или химических веществ - иммуностимуляторов и антистрессантов.
Повышение устойчивости земляники иммуностимуляторами
Применение иммуностимуляторов при разведении и выращивании земляники показывает высокую их эффективность для защиты листьев и ягод. В частности, в этих целях используется салициловая кислота. Она является не только иммуностимулятором, но и способствует делению клеток. Повышает устойчивость к вирусам, бактериям, грибкам, засухе, холоду.
Обработка ягодников этим препаратом ускоряет цветение. Соединения кислоты обладают свойством подавлять патогенные микроорганизмы. Виды и сорта ягодников с повышенным содержанием салициловой кислоты в тканях более устойчивы к различным болезням.
Частые применения иммуностимуляторов дают лучший результат. Но салициловая кислота в высоких пропорциях может быть токсична, что приведет к отрицательному результату.
Кроме салицилки, свойством повышать иммунитет растительных культур обладают такие органические вещества, как хитозин или жирные кислоты. Из неорганических солей силикаты, бикарбонаты или хлориды кальция повышают защитную реакцию у растений.
Неплохие результаты разведения ягодных культур получаются при выращивании на гидропонике с добавлением силиката калия.
agrodom.com
МЕХАНИЗМЫ УСТОЙЧИВОСТИ РАСТЕНИЙ
12.1. Физиология стресса
Неблагоприятные факторы внешней среды называют стрессорами, а реакцию организма на отклонения от нормы стрессом (напряжением). Для растений характерны три фазы стресса: 1) первичная стрессовая реакция, 2) адаптация, 3) истощение. Действие стрессора зависит от величины повреждающего фактора, длительности его воздействия и сопротивляемости растения. Устойчивость растений к стрессору зависит и от фазы онтогенеза. Наиболее устойчивы растения, находящиеся в состоянии покоя. Наиболее чувствительны растения в молодом возрасте.
К первичным неспецифическим процессам, происходящим в клетках растений при действии любых стрессоров, относятся следующие:
1. Повышение проницаемости мембран, деполяризация мембранного потенциала плазмалеммы.
2. Вход ионов кальция в цитоплазму из клеточных стенок и внутриклеточных компартментов (вакуоль, эндоплазматическая сеть, митохондрии).
3. Сдвиг рН цитоплазмы в кислую сторону.
4. Активация сборки актиновых микрофиламентов цитоскелета, в результате чего возрастает вязкость и светорассеяние цитоплазмы.
5. Усиление поглощения кислорода, ускоренная трата АТФ, развитие свободнорадикальных процессов.
6. Повышение содержания аминокислоты пролина, которая может образовывать агрегаты, ведущие себя как гидрофильные коллоиды и способствующие удержанию воды в клетке. Пролин может связываться с белковыми молекулами, защищая их от денатурации.
7. Активация синтеза стрессовых белков.
8. Усиление активности протонной помпы в плазмалемме и, возможно, в тонопласте, препятствующей неблагоприятным сдвигам ионного гомеостаза.
9. Усиление синтеза этилена и абсцизовой кислоты, торможение деления и роста, поглотительной активности клеток и других физиологических процессов, осуществляющихся в обычных условиях.
Кроме того, стрессоры оказывают и специфическое воздействие на клетки. В невысоких дозах повторяющиеся стрессы приводят к закаливанию организма, причем закаливание к одному стрессору способствует повышению устойчивости организма и другим повреждающим факторам.
На организменном уровне сохраняются все клеточные механизмы адаптации и дополняются новыми, отражающими взаимодействие органов в целом растении. Прежде всего, это конкурентные отношения за физиологически активные вещества и пищу. Это позволяет растениям в экстремальных условиях сформировать лишь такой минимум генеративных органов, которые они в состоянии обеспечить необходимыми веществами для созревания. При неблагоприятных условиях ускоряются процессы старения и опадения нижних листьев, а продукты гидролиза их органических соединений используются для питания молодых листьев и формирования генеративных органов. Растения способны замещать поврежденные или утраченные органы путем регенерации и роста пазушных почек. Во всех этих процессах коррелятивного роста участвуют межклеточные системы регуляции (гормональная, трофическая и электрофизиологическая).
В условиях длительного и сильного стресса в первую очередь гибнут неустойчивые растения. Они устраняются из популяции, а семенное потомство образуют более устойчивые растения. В результате общий уровень устойчивости в популяции возрастает. Таким образом, на популяционном уровне включается отбор, приводящий к появлению более приспособленных организмов и новых видов.
12.2. Засухоустойчивость и устойчивость к перегреву
Действие засухи в первую очередь приводит к уменьшению в клетках свободной воды, что влияет на гидратные оболочки белков и функционирование ферментов. При длительном завядании активируются гидролитические процессы, что ведет к увеличению содержания в клетках низкомолекулярных белков и углеводов. Под влиянием засухи в листьях снижается количество РНК вследствие уменьшения ее синтеза и активации рибонуклеаз. В цитоплазме наблюдается распад полисом. Изменения, касающиеся ДНК, происходят лишь при длительной засухе. Из-за уменьшения свободной воды возрастает концентрация вакуолярного сока. При обезвоживании у растений, не приспособленных к засухе, значительно усиливается интенсивность дыхания, а затем снижается. У засухоустойчивых растений в этих условиях существенных изменений дыхания не наблюдается.
В условиях водного дефицита быстро тормозятся клеточное деление и растяжение, что приводит к образованию мелких клеток и замедлению роста растений. Скорость роста корней в начале засухи увеличивается и снижается лишь при длительном недостатке воды в почве. При засухе в корнях ускоряется дифференцировка клеток и происходит опробковение и суберинизация экзодермы.
Во время засухи наряду с обезвоживанием происходит перегрев растений. Высокая температура увеличивает концентрацию клеточного сока и проницаемость клеточных мембран. В результате выхода веществ, растворенных в клеточном соке, постепенно снижается осмотическое давление. Однако при температуре выше 35оС осмотическое давление повышается из-за усиления гидролиза крахмала и белков, что приводит к увеличению содержания моносахаров, аминокислот и аммиака. Аммиак токсичен для клеток неустойчивых к перегреву растений. У жаростойких растений наблюдается рост содержания органических кислот, связывающих избыточный аммиак. При действии высоких температур в клетках растений индуцируется синтез стрессовых белков теплового шока. В ядре эти белки образуют гранулы, связывая ДНК и блокируя экспрессию генов. После прекращения стресса гранулы распадаются и экспрессия генов восстанавливается. Один из белков теплового шока стабилизирует плазмалемму.
Засухоустойчивость сельскохозяйственных растений повышается в результате предпосевного закаливания семян, которые перед посевом после однократного намачивания вновь высушиваются.
12.3. Устойчивость растений к низким температурам
Растения различных мест обитания имеют неодинаковую устойчивость к низким температурам. Так, многие растения Крайнего Севера без особого вреда зимой переносят охлаждение до -60оС. Большинство теплолюбивых растений южного происхождения плохо переносит низкие положительные температуры. Например, хлопчатник гибнет в течение суток при 1-3оС. Поэтому устойчивость растений к низким температурам подразделяют на холодостойкость или устойчивость теплолюбивых растений и растений умеренной зоны к низким положительным температурам и морозоустойчивость или способность растений переносить температуру ниже 0оС.
У теплолюбивых растений при низких положительных температурах происходит потеря тургора клетками надземной части, так как нарушается доставка воды. Наблюдается усиление распада белков и накопление в тканях растворимых форм азота. Изменяется функциональная активность мембран из-за перехода липидов из жидкокристаллического состояния в состояние геля.
Холодостойкость сельскохозяйственных культур можно усилить внесением калийных удобрений и предпосевным закаливанием семян. Наклюнувшиеся семена теплолюбивых культур (огурцы, томаты, дыня и др.) в течение нескольких суток выдерживают в чередующихся через 12 часов условиях низких (1-5о) и более высоких (10-20о) температур. Таким же способом можно затем закаливать рассаду. Холодостойкость повышается при замачивании семян в 0,25 % растворах микроэлементов или нитрата аммония.
Основными причинами гибели клеток растений при отрицательных температурах являются: 1) их обезвоживание и 2) повреждение клеточных структур из-за механического сжатия льдом. Обезвоживание возникает из-за оттягивания воды из клеток образующимися в межклетниках кристаллами льда. При длительном действии мороза кристаллы льда вырастают до значительных размеров и, помимо сжатия клеток, могут повреждать плазмалемму.
У морозоустойчивых растений повышено содержание ненасыщенных жирных кислот в клеточных мембранах. Поэтому фазовый переход липидов мембран из жидкокристаллического состояния в гель происходит при отрицательных температурах. В состоянии геля резко снижается проницаемость мембран. Кроме того, у морозоустойчивых растений активируется синтез криопротекторов – гидрофильных белков, моно- и олигосахаров. Вода, входящая в состав гидратных оболочек этих веществ, не замерзает и не выходит из клеток. Другой тип полимеров-криопротекторов - это гемицеллюлозы, выделяемые в клеточную стенку. Они обволакивают кристаллы льда и тормозят их рост.
12.4. Солеустойчивость
Растения, устойчивые к засолению, называют галофитами (от греч. galos - соль, Phyton - растение). Они отличаются от гликофитов - растений незасоленных водоемов и почв - рядом анатомических и метаболических особенностей. У гликофитов при засолении снижается рост клеток растяжением, нарушается азотный обмен и накапливается токсичный аммиак.
Все галофиты делят на три группы:
1. Настоящие галофиты (эугалофиты) - наиболее устойчивые растения, накапливающие в вакуолях значительные количество солей. Поэтому они обладают большой сосущей силой, позволяющей поглощать воду из сильно засоленной почвы. Для растений этой группы характерна мясистость листьев, которая исчезает при выращивании их на незасоленных почвах.
2. Солевыделяющие галофиты (криногалофиты), поглощая соли, не накапливают их внутри тканей, а выводят из клеток на поверхность листьев с помощью секреторных железок. Выделение солей железками осуществляется с помощью ионных насосов и сопровождается транспортом больших количеств воды. Соли удаляется с опадающими листьями. У некоторых растений избавление от избытка солей происходит без поглощения больших количеств воды, так как соль выделяется в вакуоль клетки-головки листового волоска с последующим ее обламыванием и восстановлением.
3. Соленепроницаемые галофиты (гликогалофиты) растут на менее засоленных почвах. Высокое осмотическое давление в их клетках поддерживается за счет продуктов фотосинтеза, а клетки малопроницаемы для солей.
Солеустойчивость растений увеличивается после предпосевного закаливания семян. Семена замачивают один час в 3 % растворе NaCl с последующим промыванием водой в течение 1,5 часа. Этот прием повышает устойчивость растений к хлоридному засолению. Для закалки к сульфатному засолению семена в течение суток вымачивают в 0,2 %-ном растворе сульфата магния.
12.5. Устойчивость к недостатку кислорода
Кислородная недостаточность (гипоксия) возникает при временном или постоянном переувлажнении, при заболачивании почвы, при образовании ледяной корки на озимых посевах и хранении сельскохозяйственной продукции. У растений, корни которых постоянно испытывают недостаток кислорода, в процессе длительной эволюции появились изменения в морфолого-анатомическом строении тканей: разрастание основания стебля, образование дополнительной поверхностной корневой системы и вентиляционных систем межклетников, необходимых для транспорта кислорода из надземной части растения в корни.
У некоторых растений для защиты от гипоксии активируется пентозофосфатный и гликолитический пути дыхания. В устойчивых к кислородному дефициту растениях не накапливаются токсичные продукты анаэробного распада. При недостатке кислорода как конечного акцептора электронов приспособительными оказываются процессы так называемого аноксического эндогенного окисления, в ходе которого электроны переносятся на такие вещества как нитраты, двойные связи ненасыщенных соединений (жирные кислоты, каротиноиды).
Для повышения устойчивости к гипоксии замачивают семена в растворах хлорхолинхлорида, никотиновой кислоты или сульфата марганца.
12.6. Газоустойчивость
Газоустойчивость - это способность растений сохранять жизнедеятельность при действии вредных газов. Токсичные газы, попадая в листья, образуют кислоты или щелочи. Это приводит к изменению рН цитоплазмы, разрушению хлорофилла, нарушению клеточных мембран. Для разных видов растений характерен свой безопасный для жизнедеятельности уровень накопления токсичных газов. Так, лох, тополь и клен более устойчивы к хлору и сернистому газу (SO2), чем липа и каштан. Растения, устойчивые к засолению и другим стрессорам, имеют более высокую газоустойчивость.
Газоустойчивость растений повышается при оптимизации минерального питания и водоснабжения, а также в результате закаливания семян. Замачивание семян в слабых растворах соляной и серной кислот повышает устойчивость растений к кислым газам.
12.7. Радиоустойчивость
Различают прямое и косвенное действие радиации на живые организмы. Прямое действие энергии излучения на молекулу переводит ее в возбужденное или ионизированное состояние. Особенно опасны повреждения структуры ДНК: разрывы связей сахар-фосфат, дезаминирование азотистых оснований, образование димеров пиримидиновых оснований. Косвенное действие радиации состоит в повреждениях молекул, мембран, органоидов клеток, вызываемых продуктами радиолиза воды. Заряженная частица излучения, взаимодействуя с молекулой воды, вызывает ее ионизацию. Ионы воды за время жизни 10-15 - 10-10 сек способны образовать химически активные свободные радикалы и пероксиды. Эти сильные окислители за время жизни 10-6 - 10-5 сек могут повредить нуклеиновые кислоты, белки-ферменты, липиды мембран. Первоначальные повреждения усиливаются при накоплении ошибок в процессах репликации ДНК, синтеза РНК и белков.
Устойчивость растений к действию радиации определяется следующими факторами:
1. Постоянное присутствие ферментных систем репарации ДНК. Они отыскивают поврежденный участок, разрушают его и восстанавливают целостность молекулы ДНК.
2. Наличие в клетках веществ – радиопротекторов (сульфгидрильные соединения, аскорбиновая кислота, каталаза, пероксидаза, полифенолоксидаза). Они ликвидируют свободные радикалы и пероксиды, возникающие при облучении.
3. Восстановление на уровне организма обеспечивается у растений: а) неоднородностью популяции делящихся клеток меристем, которые содержат клетки на разных фазах митотического цикла с неодинаковой радиоустойчивостью, б) присутствием в апикальных меристемах покоящихся клеток, которые приступают к делению при остановке деления клеток основной меристемы, в) наличием спящих почек, которые после гибели апикальных меристем начинают активно функционировать и восстанавливают повреждение.
12.8. Устойчивость растений к патогенам
Болезни растений вызываются паразитическими грибами, бактериями, вирусами, вироидами, микоплазмами, нематодами. Нематоды и растения-паразиты могут быть переносчиками вирусов. Различают следующие группы патогенов:
1. Факультативные (необязательные) паразиты, которые, являясь сапрофитами, живут на мертвых остатках растений, но могут поражать живые ослабленные растения.
2. Факультативные сапрофиты ведут в основном паразитический образ жизни и реже - сапрофитный.
3. Облигатные (обязательные) паразиты поражают только живые растения.
По характеру питания паразитов делят на некротрофов и биотрофов. Некротрофы (все факультативные паразиты и некоторые факультативные сапрофиты) поселяются на предварительно убитой ими ткани. Клетки растения-хозяина погибают и перевариваются под действием токсинов и гидролитических ферментов, выделяемых патогеном. Биотрофы (облигатные паразиты) определенное время сосуществуют с живыми клетками растения-хозяина.
Устойчивость растений к патогенам определяется, как было установлено Х. Флором в 50-е годы 20 века взаимодействием комплементарной пары генов растения-хозяина и патогена, соответственно, гена устойчивости (R) и гена авирулентности (Аvr). Специфичность их взаимодействия предполагает, что продукты экспрессии этих генов участвуют в распознавании растением патогена с последующим активированием сигнальных процессов для включения защитных реакций.
Продукты экспрессии некоторых R генов установлены. Это белки и все они содержат повтор, богатый лейцином, а также протеинкиназный и нуклеотидсвязывающий домены. Домен белка, содержащий повтор, богатый лейцином, ответственен за связывание белка с белком, то есть отвечает за распознавание патогена. Протеинкиназный и нуклеотидсвязывающий домены участвуют в фосфорилировании белков и регуляции экспрессии защитных генов, соответственно.
Со стороны патогенов в процессе узнавания участвуют элиситоры. Это вещества, индуцирующие в устойчивых растениях экспрессию защитных генов. Растительные глюканазы, разрушая полисахариды клеточных стенок грибов и бактерий, превращают их в низкомолекулярные элиситоры (b-связанные глюканы и хитозан). Элиситором является и липогликопротеиновый комплекс (активная часть – ненасыщенные жирные кислоты: арахидоновая и эйкозапентаеновая). Элиситорными свойствами обладает углеводная часть маннан-содержащих гликопротеинов.
При разрушении пектиновых полисахаридов растительных клеточных стенок полигалактуроназами патогенов образуются особые вещества (сигналы тревоги), которые мигрируют в здоровые клетки, где индуцируют защитные реакции. Эти вещества получили название констуитивных или эндогенных элиситоров или олигосахаринов. Активной частью является додека-a-1,4-галактуронин, состоящий из 12 галактуронозильных остатков.
Растение распознает элиситоры своими рецепторами, расположенными в клеточной стенке и плазмалемме. Образование комплекса элиситор-рецептор включает защитные механизмы растения. Однако взаимодействию грибных элиситоров с рецепторами препятствуют супрессоры – низкомолекулярные глюканы, выделяемые гифой гриба и конкурирующие с элиситором за связывание с рецептором. Если супрессор связывается с рецептором, то защитные реакции не включаются.
Для грибов и бактерий известно, что их элиситоры связываются с внешним (локализованным снаружи плазмалеммы) участком белкового рецептора, расположенного в плазмалемме. В результате этого связывания происходит автофосфорилирование внешнего участка рецептора и изменение его конформации. Остаток фосфорной кислоты передается на внутренний участок рецептора, что также изменяет его конформацию. Следствием взаимодействия рецептора с элиситором является активация каскада передачи сигнала для возбуждения экспрессии защитных генов. В настоящее время известно 7 сигнальных систем: циклоаденилатная, MAP-киназная (mitogen-activated protein-kinase), фосфатидокислотная, кальциевая, липоксигеназная, НАДФ·Н-оксидазная (супероксидсинтазная), NO-синтазная.
В пяти первых сигнальных системах посредником между цитоплазматической частью рецептора и первым активируемым ферментом являются G-белки. Эти белки локализованы на внутренней стороне плазмалеммы. Их молекулы состоят из трех субъединиц: a, b и g. В состоянии покоя все субъединицы образуют комплекс, где a-субъединица связана с гуанозиндифосфатом. В результате конформационных изменений после связывания с элиситором рецептор присоединяется к G-белку. При этом гуанозиндифосфат отсоединяется от a-субъединицы и его место занимает гуанозинтрифосфат. После этого a-субъединица отделяется от двух других субъединиц и связывается с каким-либо эффектором, например, аденилатциклазой. Затем a-субъединица гидролизует гуанозинтрифосфат до гуанозиндифосфата, инактивируется, отделяется от эффектора и присоединяется к свободным b- и g-субъединицами. Таким образом, G-белки, связываясь с эффекторами, включают сигнальные пути.
Кратко рассмотрим каждую сигнальную систему.
Циклоаденилатная сигнальная система. Взаимодействие стрессора с рецептором на плазмалемме приводит к активации аденилатциклазы, которая катализирует образование циклического аденозинмонофосфата (цАМФ) из АТФ. цАМФ активирует ионные каналы, включая кальциевую сигнальную систему, и цАМФ-зависимые протеинкиназы. Эти ферменты активируют белки-регуляторы экспрессии защитных генов, фосфорилируя их.
MAP-киназная сигнальная система. Активность протеинкиназ повышается у растений, подвергнутых стрессовым воздействиям (синий свет, холод, высушивание, механическое повреждение, солевой стресс), а также обработанных этиленом, салициловой кислотой или инфицированных патогеном.
В растениях функционирует протеинкиназный каскад как путь передачи сигналов. Связывание элиситора с рецептором плазмалеммы активирует киназу киназы МАР-киназы. Она катализирует фосфорилирование цитоплазматической киназы МАР-киназы, которая активирует при двойном фосфорилировании треониновых и тирозиновых остатков МАР-киназу. Она переходит в ядро, где фосфорилирует белки-регуляторы транскрипции.
Фосфатидокислотная сигнальная система. В клетках животных G белки под воздействием стрессора активируют фосфолипазы C и D. Фосфолипаза С гидролизует фосфатидилинозитол-4,5-бифосфат с образованием диацилглицерола и инозитол-1,4,5-трифосфата. Последний освобождает Са2+ из связанного состояния. Повышенное содержание ионов кальция приводит к активации Са2+-зависимых протеинкиназ. Диацилглицерол после фосфорилирования специфичной киназой превращается в фосфатидную кислоту, которая является сигнальным веществом в животных клетках. Фосфолипаза D непосредственно катализирует образование фосфатидной кислоты из липидов (фосфатидилхолин, фосфатидилэтаноламин) мембран.
У растений стрессоры активируют G белки, фосфолипазы С и D у растений. Следовательно, начальные этапы этого сигнального пути одинаковы у животных и растительных клеток. Можно предположить, что в растениях также происходит образование фосфатидной кислоты, которая может активировать протеинкиназы с последующим фосфорилированием белков, в том числе и факторов регуляции транскрипции.
Кальциевая сигнальная система. Воздействие различных факторов (красного света, засоления, засухи, холода, теплового шока, осмотического стресса, абсцизовой кислоты, гиббереллина и патогенов) приводит к повышению содержания ионов кальция в цитоплазме за счет увеличения импорта из внешней среды и выхода из внутриклеточных хранилищ (эндоплазматического ретикулума и вакуоли).
Повышение концентрации ионов кальция в цитоплазме приводит к активации растворимых и мембранносвязанных Са2+-зависимых протеинкиназ. Они участвуют в фосфорилировании белковых факторов регуляции экспрессии защитных генов. Однако было показано, что Са2+ способен непосредственно влиять на человеческий репрессор транскрипции, не задействуя каскад фосфорилирования белков. Также ионы кальция активируют фосфатазы и фосфоинозитспецифичную фосфолипазу С. Регулирующее действие кальция зависит от его взаимодействия с внутриклеточным рецептором кальция - белком кальмодулином.
Липоксигеназная сигнальная система. Взаимодействие элиситора с рецептором на плазмалемме приводит к активации мембранносвязанной фосфолипазы А2, которая катализирует выделение из фосфолипидов плазмалеммы ненасыщенных жирных кислот, в том числе линолевой и линоленовой. Эти кислоты являются субстратами для липоксигеназы. Субстратами для этого фермента могут быть не только свободные, но и входящие в состав триглицеридов ненасыщенные жирные кислоты. Активность липоксигеназ повышается при действии элиситоров, заражении растений вирусами и грибами. Увеличение активности липоксигеназ обусловлено стимуляцией экспрессии генов, кодирующих эти ферменты.
Липоксигеназы катализируют присоединение молекулярного кислорода к одному из атомов (9 или 13) углерода цис,цис-пентадиенового радикала жирных кислот. Промежуточные и конечные продукты липоксигеназного метаболизма жирных кислот обладают бактерицидными, фунгицидными свойствами и могут активировать протеинкиназы. Так, летучие продукты (гексенали и ноненали) токсичны для микроорганизмов и грибов, 12-гидрокси-9Z-додеценовая кислота стимулировала фосфорилирование белков у растений гороха, фитодиеновая, жасмоновая кислоты и метилжасмонат через активирование протеинкиназ повышают уровень экспресии защитных генов.
НАДФ·Н-оксидазная сигнальная система. Во многих случаях заражение патогенами стимулировало продукцию реактивных форм кислорода и гибель клеток. Реактивные формы кислорода не только токсичны для патогена и инфицированной клетки растения-хозяина, но и являются участниками сигнальной системы. Так, перекись водорода активирует факторы регуляции транскрипции и экспрессию защитных генов.
NO-синтазная сигнальная система. В макрофагах животных, убивающих бактерии, наряду с реактивными формами кислорода действует окись азота, усиливающая их антимикробное действие. В животных тканях L-аргинин под действием NO-синтазы превращается в цитруллин и NO. Активность этого фермента была обнаружена и в растениях, причем вирус табачной мозаики индуцировал повышение его активности в устойчивых растениях, но не влиял на активность NO-синтазы в чувствительных растениях. NO, взаимодействуя с супероксидом кислорода, образует очень токсичный пероксинитрил. При повышенной концентрации окиси азота активируется гуанилатциклаза, которая катализирует синтез циклического гуанозинмонофосфата. Он активирует протеинкиназы непосредственно или через образование циклической АДФ-рибозы, которая открывает Са2+ каналы и тем самым повышает концентрацию ионов кальция в цитоплазме, что в свою очередь, приводит к активации Са2+-зависимых протеинкиназ.
Таким образом, в клетках растений существует скоординированная система сигнальных путей, которые могут действовать независимо друг от друга или сообща. Особенностью работы сигнальной системы является усиление сигнала в процессе его передачи. Включение сигнальной системы в ответ на воздействие различных стрессоров (в том числе и патогенов) приводит к активации экспрессии защитных генов и повышению устойчивости растений.
Устойчивость растений к патогенам основана на разнообразных механизмах защиты. В целом эти механизмы подразделяют на: 1) конституционные, то есть присутствующие в тканях растения-хозяина до заражения, и 2) индуцированные, то есть возникшие в ответ на контакт с паразитом или его внеклеточными выделениями.
Конституционные механизмы: а) особенности структуры тканей, обеспечивающие механический барьер для проникновения патогена, б) способность к выделению веществ с антибиотической активностью (например, фитонцидов), в) отсутствие или недостаток веществ, жизненно важных для роста и развития паразита.
Индуцированные механизмы: а) усиление дыхания, б) накопление веществ, обеспечивающих устойчивость, в) создание дополнительных защитных механических барьеров, г) развитие реакция сверхчувствительности.
Устойчивость к нектрофам обеспечивают следующие механизмы: 1) детоксикация токсинов паразита (например, викторина - токсина возбудителя гельминтоспориоза овса в устойчивых растениях овса), 2) отсутствие у устойчивых растений рецепторов, связывающих токсин (у восприимчивых растений связывание токсина с рецептором в плазмалемме хозяина приводит к гибели клетки, 3) инактивация экзоферментов паразита неспецифическими ингибиторами типа фенолов, 4) задержка синтеза экзоферментов паразита устранением (маскировкой) их субстратов (например, синтез пектиназы и пектинметилэстеразы, осуществляемый некротрофами лишь в присутствии субстрата - пектиновых веществ, при поражении не происходит из-за усиления суберинизации и лигнификации клеточных стенок растения-хозяина в месте поражения, что маскирует пектиновые соединения), 5) повреждение клеточных стенок паразита ферментами растения-хозяина - хитиназой, глюканазой.
Взаимодействие растения и паразита происходит на поверхности растения, которая служит первой линией его обороны. Споры патогена или сам патоген вначале должны удержаться на поверхности органа. Этому у многих растений препятствует отложение воска на кутикуле эпидермальных клеток, что делает поверхность плохо смачиваемой водой, необходимой для прорастания спор. Патогены (грибы, бактерии, вирусы, передающиеся механическим путем) преодолевают этот барьер через устьица и поранения. Покровные ткани служат не только механической преградой, но и токсическим барьером, так как содержат разнообразные антибиотические вещества. Эти защитные свойства присущи поверхности растения до контакта с патогеном и усиливаются после заражения. При заболевании происходит отложение гидроксипролинбогатых гликопротеинов (экстенсинов), суберина и лигнина в клеточные стенки растений. В результате повышается их механическая прочность, ограничивается проникновение и распространение паразита и приток питательных веществ к паразиту, компоненты стенки защищены от атаки ферментами паразита. Лигнин может откладываться и в клеточной стенке гиф грибов, останавливая их рост. Немногие грибы способны расщеплять лигнин. Если возбудитель образует на поверхности листа апрессорий (орган-присоску для преодоления клеточной стенки), то непосредственно под ним клеточная стенка утолщается. Образуется бугорок-папилла, содержащий лигнин и кремний. Его своевременное формирование не позволяет паразиту проникнуть в клетку. В устойчивых растениях хлопчатника при поражении грибами родов Verticillium и Fusarium патоген, попадая через корни в проводящую систему, задерживается тиллами (выпячиваниями в сосудах, представляющими собой содержимое соседних паренхимных клеток, покрытое пектиновым чехлом). Задержанный гриб повреждается антибиотическими веществами.
Патоген, преодолев поверхностные барьеры и попав в проводящую систему и клетки растения, вызывает заболевание растения. Характер заболевания зависит от устойчивости растения. По степени устойчивости выделяют четыре категории растений: чувствительные, толерантные, сверхчувствительные и крайне устойчивые (иммунные). Кратко охарактеризуем их на примере взаимодействия растений с вирусами.
В чувствительных растениях вирус транспортируется из первично зараженных клеток по растению, хорошо размножается и вызывает разнообразные симптомы заболевания. Однако и в чувствительных растениях существуют защитные механизмы, ограничивающие вирусную инфекцию. Об этом свидетельствует, например, возобновление репродукции вируса табачной мозаики в протопластах, изолированных из зараженных листьев растений табака, в которых закончился рост инфекционности. Темно-зеленые зоны, образующиеся на молодых листьях больных чувствительных растений, характеризуются высокой степенью устойчивости к вирусам. Клетки этих зон почти не содержат вирусных частиц по сравнению с соседними клетками светло-зеленой ткани. Низкий уровень накопления вирусов в клетках темно-зеленой ткани связан с синтезом антивирусных веществ. В толерантных растениях вирус распространяется по всему растению, но плохо размножается и не вызывает симптомов. В сверхчувствительных растениях первично инфицированные и соседние клетки некротизируются, локализуя вирус в некрозах. Считается, что в крайне устойчивых растениях вирус репродуцируется только в первично зараженных клетках, не транспортируется по растению и не вызывает симптомов заболевания. Однако был показан транспорт вирусного антигена и субгеномных РНК в этих растениях, а при выдерживании зараженных растений при пониженной температуре (10-15оС) на инфицированных листьях формировались некрозы.
Наиболее хорошо изучены механизмы устойчивости сверхчувствительных растений. Образование локальных некрозов является типичным симптомом сверхчувствительной реакции растений в ответ на поражение патогеном. Они возникают в результате гибели группы клеток в месте внедрения патогена. Смерть инфицированных клеток и создание защитного барьера вокруг некрозов блокируют транспорт инфекционного начала по растению, препятствует доступу к патогену питательных веществ, вызывают элиминацию патогена, приводят к образованию антипатогенных ферментов, метаболитов и сигнальных веществ, которые активируют защитные процессы в соседних и отдаленных клетках, и в конечном итоге, способствуют выздоровлению растения. Гибель клеток происходит из-за включения генетической программы смерти и образования соединений и свободных радикалов, токсичных как для патогена, так и для самой клетки.
Некротизация инфицированных клеток сверхчувствительных растений, контролируемая генами патогена и растения-хозяина, является частным случаем программированной клеточной смерти (PCD – programmed cell death). PCD необходима для нормального развития организма. Так, она происходит, например, при дифференциации трахеидных элементов в ходе образования ксилемных сосудов и гибели клеток корневого чехлика. Эти периферические клетки погибают даже тогда, когда корни растут в воде, то есть гибель клеток является частью развития растения, а не вызвана действием почвы. Сходство между PCD и гибелью клеток при сверхчувствительной реакции заключается в том, что это два активных процесса, в некротизирующейся клетке также повышается содержание ионов кальция в цитоплазме, образуются мембранные пузырьки, увеличивается активность дезоксирибонуклеаз, ДНК распадается на фрагменты с 3’ОН концами, происходит конденсация ядра и цитоплазмы.
Помимо включения PCD, некротизация инфицированных клеток сверхчувствительных растений происходит в результате выхода фенолов из центральной вакуоли и гидролитических ферментов из лизосом вследствие нарушения целостности клеточных мембран и увеличения их проницаемости. Снижение целостности клеточных мембран обусловлено перекисным окислением липидов. Оно может происходить при участии ферментов и неферментативным путем в результате действия реактивных форм кислорода и свободных органических радикалов. Выше было показано, что в растениях при заболевании увеличивалась активность фосфолипаз и липоксигеназ. Известны такие виды реактивного кислорода, как супероксидный (О2·-), пергидроксильный (НО2·), который является протонированной формой супероксида, гидроксильный (ОН·) радикалы, перекись водорода (Н2О2), синглетно-возбужденный кислород (1О2). Реактивные формы кислорода постоянно присутствуют в растительных клетках в небольшом количестве, образуясь в процессе окислительно-восстановительных реакций. Очень быстрое накопление реактивных форм кислорода было показано для различных комбинаций растение-патоген и при обработке элиситорами. Окислительный взрыв происходил и при воздействии абиотических факторов: ультрафиолетового облучения (280-320 нм), повышенной температуре, осмотическом и механическом стрессах.
Нарушение целостности клеточных мембран и увеличение их проницаемости обусловлены также действием так называемого “киллера протопластов”, обнаруженного в некротизированных листьях сверхчувствительных растений табака, пораженных вирусом табачной мозаики или бактериями. Было показано, что водные экстракты некротизированных листьев токсичны для изолированных протопластов. В наших опытах на основании данных по гель-фильтрации и ионно-обменной хроматографии экстрактов некротизированных листьев растений табака сорта Ксанти нк было установлено, что “киллер протопластов” является кислым белком с молекулярной массой примерно 70 кДа.
Одним из характерных свойств сверхчувствительных растений является приобретенная (индуцированная) устойчивость к повторному заражению патогеном. Были предложены термины: системная приобретенная устойчивость (systemic acquired resistance - SAR) и локальная приобретенная устойчивость (localized acquired resistance - LAR). О LAR говорят в тех случаях, когда устойчивость приобретают клетки в зоне, непосредственно примыкающей к локальному некрозу (расстояние примерно 2 мм). В этом случае вторичные некрозы совсем не образуются. Приобретенная устойчивость считается системной, если она развивается в клетках больного растения, удаленных от места первоначального внедрения патогена. SAR проявляет
Похожие статьи:
poznayka.org