Происхождение митохондрий и их роль в эволюции жизни и здоровья человека | Панов
1. Wallace DC. Structure and evolution of organelle genomes. Microbiol Rev. 1982; 46(2): 208-240.
2. Wallace DC. Diseases of the mitochondrial DNA. Annu Rev Biochem. 1992; 61: 1175-1212. doi: 10.1146/annurev.bi.61.070192.005523
3. Wallace DC. A mitochondrial paradigm of metabolic and degenerative diseases, aging, and cancer: a dawn for evolutionary medicine. Annu Rev Genet. 2005; 39: 359-407. doi: 10.1146/annurev.genet.39.110304.095751
4. Wallace DC. Why do we still have a maternally inherited mitochondrial DNA? Insights from evolutionary medicine. Annu Rev Biochem. 2007; 76: 781-821. doi: 10.1146/annurev.biochem.76.081205.150955
5. Wallace DC. Mitochondria as chi. Genetics. 2008; 179(2): 727-735. doi: 10.1534/genetics.104.91769
6. Wallace DC, Fan W. Energetics, epigenetics, mitochondrial genetics. Mitochondrion. 2010; 10(1): 12-31. doi: 10.1016/j.mito.2009.09.006
7. Hörandl E, Speijer D. How oxygen gave rise to eukaryotic sex. Proc Biol Sci. 2018; 285(1872): 20172706. doi: 10.1098/rspb.2017.2706
Hörandl E, Speijer D. How oxygen gave rise to eukaryotic sex. Proc Biol Sci. 2018; 285(1872): 20172706. doi: 10.1098/rspb.2017.2706
8. Gaziev AI, Shaikhaev GO. Nuclear mitochondrial pseudogenes. Molecular Biology. 2010; 44(3): 405-417. doi: 10.1134/S0026893310030027
9. Behe MJ. Darwin’s Black Box. New York: Free Press; 1996.
10. Thompson В, Harrub B. Molecular evidence of human origins – [Part II]. Reason and Revelation. 2005; 25(5): 33-39.
11. Sagan L. On the origin of mitosing cells. J Theor Biol. 1967; 14(3): 255-274. doi: 10.1016/0022-5193(67)90079-3
12. Lang BF, Gray MW, Burger G. Mitochondrial genome revolution and the origin of eukaryotes. Annu Rev Genet. 1999; 33: 351-397. doi: 10.1146/annurev.genet.33.1.351
13. Lang BF, Burger B, O’Kelly CJ, Cedergren R, Golding GB, Lemieux C, et al. An ancestral mitochondrial DNA resembling a eubacterial genome in miniature. Nature. 1997; 387(6632): 493-497. doi: 10.1038/387493a0
14. Gray MW, Burger G, Lang BF. Mitochondrial evolution. Science. 1999; 283(5407): 1476-1481. doi: 10.1126/science.283.5407.1476
Mitochondrial evolution. Science. 1999; 283(5407): 1476-1481. doi: 10.1126/science.283.5407.1476
15. Gregersen N, Hansen J, Palmfeldt J. Mitochondrial proteomics – a tool for the study of metabolic disorders. J Inherit Metab Dis. 2012; 35(4): 715-726. doi: 10.1007/s10545-012-9480-3
16. Price DC, Chan CX, Su Yoon H, Yang EC, Qiu H, Weber AP, et al. Cyanophora paradoxa genome elucidates origin of photosynthesis in algae and plants. Science. 2012; 335(6070): 843-847. doi: 10.1126/science.1213561
17. Archibald JM. The puzzle of plastid evolution. Curr Biol. 2009; 19(2): R81-R88. doi: 10.1016/j.cub.2008.11.067
18. McFadden GI, Van Dooren GG. Evolution: red algal genome affirms a common origin of all plastids. Curr Biol. 2004; 14(13): R514-R516. doi: 10.1016/j.cub.2004.06.041
19. Greiner S, Sobanski J, Bock R. Why are most organelle genomes transmitted maternally? Bioessays. 2015; 37(1): 80-94. doi: 10.1002/bies.201400110
20. Christie JR, Beekman M. Uniparental inheritance promotes adaptive evolution in cytoplasmic genomes. Mol Biol Evol. 2017; 34(3): 677-691. doi: 10.1093/molbev/msw266
Mol Biol Evol. 2017; 34(3): 677-691. doi: 10.1093/molbev/msw266
21. Mootha VK, Bunkenborg J, Olsen JV, Hjerrild M, Wisniewski JR, Stahl E, et al. Integrated analysis of protein composition, tissue diversity, and gene regulation in mouse mitochondria. Cell. 2003; 115(5): 629-640. doi: 10.1016/S0092-8674(03)00926-7
22. Woodson JD, Chory J. Coordination of gene expression between organellar and nuclear genomes. Nat Rev Genet. 2008; 9(5): 383-395. doi: 10.1038/nrg2348
23. Chacinska A, Koehler CM, Milenkovic D, Lithgow T, Pfanner N. Importing mitochondrial proteins: machineries and mechanisms. Cell. 2009; 138(4): 628-644. doi: 10.1016/j.cell.2009.08.005
24. Bensasson D, Feldman MW, Petrov DA. Rates of DNA duplication and mitochondrial DNA insertion in the human genome. J Mol Evol. 2003; 57(3): 343-354. doi: 10.1007/s00239-003-2485-7
25. Picard M, Wallace DC, Burelle Y. The rise of mitochondria in medicine. Mitochondrion. 2016; 30: 105-116. doi: 10.1016/j.mito.2016. 07.003
07.003
26. Kazak L, Reyes A, Holt IJ. Minimizing the damage: repair pathways keep mitochondrial DNA intact. Nat Rev Mol Cell Biol. 2012; 13(10): 659-671. doi: 10.1038/nrm3439
27. Gilkerson R, Bravo L, Garcia I, Gaytan N, Herrera A, Maldonado A, et al. The mitochondrial nucleoid: integrating mitochondrial DNA into cellular homeostasis. Cold Spring Harb Perspect Biol. 2013; 5(5): a011080. doi: 10.1101/cshperspect.a011080
28. Tarnopolsky MA. Gender differences in substrate metabolism during endurance exercise. Can J Appl Physiol. 2000; 25(4): 312-327. doi: 10.1139/h00-024
29. Dionne I, Despres JP, Bouchard C, Tremblay A. Gender difference in the effect of body composition on energy metabolism. Int J Obes Relat Metab Disord. 1999; 23(3): 312-319. doi: 10.1038/sj.ijo.0800820
30. Leskanicova A, Chovancova O, Babincak M, Verboova L, Benetinova Z, Macekova D, et al. Sexual dimorphism in energy metabolism of Wistar rats using data analysis. Molecules. 2020; 25(10): 2353. doi: 10.3390/molecules25102353
doi: 10.3390/molecules25102353
31. Giles RE, Blanc H, Cann HM, Wallace DC. Maternal inheritance of human mitochondrial DNA. Proc Natl Acad Sci USA. 1980; 77(11): 6715-6719. doi: 10.1073/pnas.77.11.6715
32. Morrow JD, Awad JA, Wu A, Zackert WE, Daniel VC, Roberts LJ. Nonenzymatic free radical-catalyzed generation of thromboxane-like compounds (isothromboxanes) in vivo. J Biol Chem. 1996; 271(38): 23185-23190. doi: 10.1074/jbc.271.38.23185
33. Roberts LJ, Montine TJ, Markesbery WR, Tapper AP, Hardy H, Chemtob S, et al. Formation of isoprostane-like compounds (neuroprostanes) in vivo from docosahexaenoic acid. J Biol Chem. 1998; 273(22): 13605-13612. doi: 10.1074/jbc.273.22.13605
34. Panov A. Perhydroxyl radical (HO2•) as inducer of the isoprostane lipid peroxidation in mitochondria. Molecular Biology. 2018; 52(3): 347-359. doi: 10.1134/S0026893318020097
35. Panov AV, Dikalov SI. Mitochondrial metabolism and the age-associated cardiovascular diseases. EC Cardiology. 2018; 5.11: 750-769.
2018; 5.11: 750-769.
36. Panov AV, Golubenko MV. Human metabolic syndrome as one of the last stages of postembryonic ontogenesis. Understanding human heart diseases at old age. EC Cardiology. 2020; 7.8: 41-47.
37. Panov AV, Dikalov SI. Cardiolipin, perhydroxyl radicals and lipid peroxidation in mitochondrial dysfunctions and aging. Oxidative Medicine and Cellular Longevity. 2020; 1323028. doi: 10.1155/2020/1323028
38. Panov A, Orynbayeva Z. Determination of mitochondrial metabolic phenotype through investigation of the intrinsic inhibition of succinate dehydrogenase. Analytical Biochemistry. 2018; 552: 30-37. doi: 10.1016/j.ab.2017.10.010
39. Harman D. Aging: a theory based on free radical and radiation chemistry. J Gerontol. 1956; 11(3): 298-300. doi: 10.1196/annals.1354.003
40. Harman D. Free radical theory of aging: Consequences of mitochondrial aging. Age.1983; 6: 86-94. doi: 10.1007/BF02432509
41. Beckman KB, Ames BN. The free radical theory of aging matures. Physiol Rev. 1998; 78(2): 547-581. doi: 10.1152/physrev.1998.78.2.547
Physiol Rev. 1998; 78(2): 547-581. doi: 10.1152/physrev.1998.78.2.547
42. Kukat C, Wurm CA, Spahr H, Falkenberg M, Larsson NG, Jakobs S. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtDNA. Proc Natl Acad Sci USA. 2011; 108(33): 13534-13539. doi: 10.1073/pnas.1109263108
43. Anderson AP, Xuemei L, William R, Yin YW. Oxidative damage diminishes mitochondrial DNA polymerase replication fidelity. Nucleic Acids Research. 2020; 48(2): 817-829. doi: 10.1093/nar/gkz1018
44. Trifunovic A, Hansson A, Wredenberg A, Rovio AT, Dufour E, Khvorostov I, et al. Somatic mtDNA mutations cause aging phenotypes without affecting reactive oxygen species production. Proc Natl Acad Sci USA. 2005; 102(50): 17993-17998. doi: 10.1073/pnas.0508886102
45. Panov AV. A new look at the causes of heart failure at old age. EC Cardiology. 2020; 7.2: 01-07.
46. Neckelmann N, Li K, Wade RP, Shuster R, Wallace DC. cDNA sequence of a human skeletal muscle ADP/ATP translocator: lack of a leader peptide, divergence from a fibroblast translocator cDNA, and coevolution with mitochondrial DNA genes. Proc Natl Acad Sci USA. 1987; 84(21): 7580-7584. doi: 10.1073/pnas.84.21.7580
cDNA sequence of a human skeletal muscle ADP/ATP translocator: lack of a leader peptide, divergence from a fibroblast translocator cDNA, and coevolution with mitochondrial DNA genes. Proc Natl Acad Sci USA. 1987; 84(21): 7580-7584. doi: 10.1073/pnas.84.21.7580
47. Szczepanowska K, Trifunovic A. Origins of mtDNA mutations in ageing. Essays in Biochemistry. 2017; 61.3: 325-337. doi: 10.1042/EBC20160090
48. Back JW, Sanz MA, De Jong L, De Koning LJ, Nijtmans GL, De Koster CG, et al. A structure for the yeast prohibitin complex: Structure prediction and evidence from chemical crosslinking and mass spectrometry. Protein Sci. 2002; 11(10): 2471-2478. doi: 10.1110/ps.0212602
49. Gemmell NJ, Metcalf VJ, Allendorf FW. Mother’s curse: the effect of mtDNA on individual fitness and population viability. Trends Ecol Evol. 2004; 19: 238-244. doi: 10.1016/j.tree.2004.02.002
50. Muller M, Martin W. The genome of Rickettsia prowazekii and some thoughts on the origin of mitochondria and hydrogenosomes. Bioessays. 1999; 21(5): 377-381. doi: 10.1002/(SICI)1521-1878(199905)21:5<377::AID-BIES4>3.0.CO;2-W
Bioessays. 1999; 21(5): 377-381. doi: 10.1002/(SICI)1521-1878(199905)21:5<377::AID-BIES4>3.0.CO;2-W
51. Hoekstra RF. Evolutionary biology: why sex is good. Nature. 2005; 434(7033): 571-573. doi: 10.1038/434571a
52. Hoekstra RF. Evolutionary origin and consequences of uniparental mitochondrial inheritance. Hum Reprod. 2000; 15(Suppl 2): 102-111. doi: 10.1093/humrep/15.suppl_2.102
53. Muller HJ. The relation of recombination to mutational advance. Mutat Res. 1964; 1(1): 2-9. doi: 10.1016/0027-5107(64)90047-8
54. Jenuth JP, Peterson AC, Fu K, Shoubridge EA. Random genetic drift in the female germline explains the rapid segregation of mammalian mitochondrial DNA. Nat Genet. 1996; 14(2): 146-151. doi: 10.1038/ng1096-146
55. Bergstrom CT, Pritchard J. Germline bottlenecks and the evolutionary maintenance of mitochondrial genomes. Genetics. 1998; 149(4): 2135-2146.
56. Michaels GS, Hauswirth WW, Laipis PJ. Mitochondrial DNA copy number in bovine oocytes and somatic cells. Dev Biol. 1982; 94(1): 246-251. doi: 10.1016/0012-1606(82)90088-4
Dev Biol. 1982; 94(1): 246-251. doi: 10.1016/0012-1606(82)90088-4
57. Reynier P, May-Panloup P, Chretien MF, Morgan CJ, Jean M, Savagner F, et al. Mitochondrial DNA content affects the fertilizability of human oocytes. Mol Hum Reprod. 2001; 7(5): 425-429. doi: 10.1093/molehr/7.5.425
58. Sutovsky P, Moreno RD, Ramalho-Santos J, Dominko T, Simerly C, Schatten G. Ubiquitin tag for sperm mitochondria. Nature. 1999; 402(6760): 371-372. doi: 10.1038/46466
59. Thompson WE, Ramalho-Santos J, Sutovsky P. Ubiquitination of prohibitin in mammalian sperm mitochondria: possible roles in the regulation of mitochondrial inheritance and sperm quality control. Biol Reprod. 2003; 69(1): 254-260. doi: 10.1095/biolreprod.102.010975
60. Artal-Sanz M, Tavernarakis N. Prohibitin and mitochondrial biology. Trends Endocrinol Metab. 2009; 20(8): 394-401. doi: 10.1016/j.tem.2009.04.004
61. Frank SA, Hurst LD. Mitochondria and male disease. Nature. 1996; 383: 224. doi: 10.1038/383224a0
62. Ruiz-Pesini E, Lapena AC, Diez-Sanchez C, Perez-Martos A, Montoya J, Alvarez E, et al. Human mtDNA haplogroups associated with high or reduced spermatozoa motility. Am J Hum Genet. 2000; 67(3): 682-696. doi: 10.1086/303040
Ruiz-Pesini E, Lapena AC, Diez-Sanchez C, Perez-Martos A, Montoya J, Alvarez E, et al. Human mtDNA haplogroups associated with high or reduced spermatozoa motility. Am J Hum Genet. 2000; 67(3): 682-696. doi: 10.1086/303040
63. Gemmell NJ, Allendorf FW. Mitochondrial mutations may decrease population viability. Trends Ecol Evol. 2001; 16: 115-117. doi: 10.1016/S0169-5347(00)02087-5
64. Rand DM. The units of selection on mitochondrial DNA. Annu Rev Ecol Syst. 2001; 32: 415-449. doi: 10.1146/annurev.ecolsys.32.081501.114109
65. Lynch M, Blanchard JL. Deleterious mutation accumulation in organelle genomes. Genetica. 1998; 102-103(1-6): 29-39. doi: 10.1023/A:1017022522486
66. Lewontin RC. The units of selection. Annu Rev Ecol Syst. 1970; 1: 1-18. doi: 10.1146/annurev.es.01.110170.000245
67. Reid RA. Selfish DNA in “petite” mutants. Nature. 1980; 285: 620. doi: 10.1038/285620b0
68. Wallace DC. Mitochondrial diseases in man and mouse. Science. 1999; 283: 1482-1488.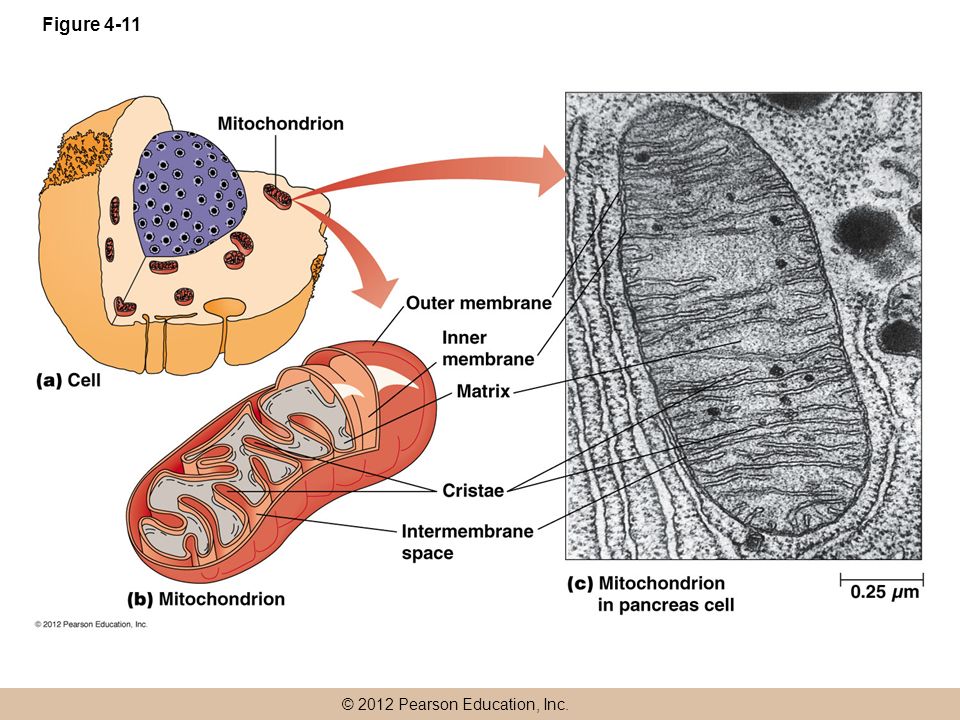 doi: 10.1126/science.283.5407.1482
doi: 10.1126/science.283.5407.1482
69. Craig DM. Group selection versus individual selection: an experimental analysis. Evolution. 1982; 36(2): 271-282. doi: 10.2307/2408045
70. Goodnight CJ, Stevens L. Experimental studies of group selection: what do they tell us about group selection in nature? Am Nat. 1997; 150(1): S59-S79. doi: 10.1086/286050
71. Swenson W, Wilson DS, Elias R. Artificial ecosystem selection. Proc Natl Acad Sci USA. 2000; 97(17): 9110-9114. doi: 10.1073/pnas.150237597
72. Goodnight CJ. Heritability at the ecosystem level. Proc Natl Acad Sci USA. 2000; 97(17): 9365-9466. doi: 10.1073/pnas.97.17.9365
73. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for coronavirus disease 2019 (COVID-19). JAMA. 2020; 323(18): 1824-1836. doi: 10.1001/jama.2020.6019
74. Blinov VM, Zverev VV, Krasnov GS, Filatov FP, Shargunov AV. Viral component of the human genome. Molecular Biology. 2017; 51, 205-215. doi: 10.1134/S0026893317020066
75. Brown JA, Sammy MJ, Ballinger SW. An evolutionary, or “mitocentric” perspective on cellular function and disease. Redox Biol. 2020; 36: 101568. doi: 10.1016/j.redox.2020.101568
Brown JA, Sammy MJ, Ballinger SW. An evolutionary, or “mitocentric” perspective on cellular function and disease. Redox Biol. 2020; 36: 101568. doi: 10.1016/j.redox.2020.101568
76. Mereschkowsky C. Über Natur und Ursprung der Chromatophoren imPflanzenreiche. Biol Centralbl. 1905; 25: 593-604.
77. Portier P. Les Symbiotes. Paris: Masson; 1918.
78. Walli IE. Symbionticism and the origin of species. Baltimore: Williams & Wilkins Company; 1927.
79. Sagan L. On the origin of mitosing cells. J Theor Biol. 1967; 14(3): 255-274. doi: 10.1016/0022-5193(67)90079-3
80. Lake JA. Lynn Margulis (1938-2011). Nature. 2011; 480(7378): 458. doi: 10.1038/480458a
81. Schwartz RM, Dayhoff MO. Origins of prokaryotes, eukaryotes, mitochondria, and chloroplasts. Science. 1978; 199(4327): 395-403. doi: 10.1126/science.202030
404 Cтраница не найдена
Размер:
AAA
Цвет:
C
C
Изображения
Обычная версия сайта
- Главная
К сожалению запрашиваемая страница не найдена.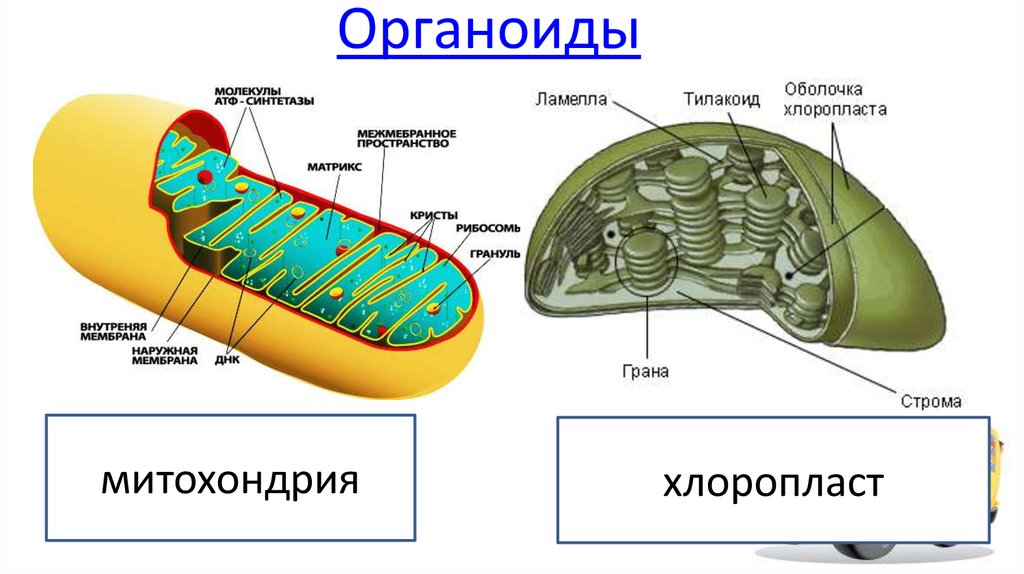
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Митохондрии, хлоропласты в клетках животных и растений: значение конформационного соответствия
1. Stefano GB, Kream RM. Психические расстройства с вовлечением митохондриальных процессов. Обозреватель психологии. 2015; 1:1–6. [Google Scholar]
Stefano GB, Kream RM. Психические расстройства с вовлечением митохондриальных процессов. Обозреватель психологии. 2015; 1:1–6. [Google Scholar]
2. Стефано Г.Б., Мантионе К.Дж., Касарес Ф.М., Крим Р.М. Анаэробно функционирующие митохондрии: эволюционная перспектива модуляции энергетического метаболизма у Mytilus edulis . Журнал выживания беспозвоночных. 2015;12:22–28. [Академия Google]
3. Снайдер С., Стефано Г.Б. Митохондрии и хлоропласты, общие в тканях животных и растений: значение коммуникации. Медицинский научный монит. 2015;21:1507–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Mantione KJ, Kream RM, Stefano GB. Изменения в критических генах биосинтеза морфина и их способность влиять на здоровье человека. Нейро Эндокринол Летт. 2010; 31:11–18. [PubMed] [Google Scholar]
5. Алиев Г., Приядаршини М., Редди В.П. и соавт. Митохондриальные и сосудистые поражения, опосредованные окислительным стрессом, как маркеры патогенеза болезни Альцгеймера. Курр Мед Хим. 2014;21:2208–17. [PubMed] [Академия Google]
Курр Мед Хим. 2014;21:2208–17. [PubMed] [Академия Google]
6. Carvalho C, Machado N, Mota PC, et al. У мышей с диабетом 2 типа и болезнью Альцгеймера наблюдаются сходные поведенческие, когнитивные и сосудистые аномалии. Дж. Альцгеймера Дис. 2013; 35: 623–35. [PubMed] [Google Scholar]
7. Chong ZZ, Li F, Maiese K. Окислительный стресс в головном мозге: новые клеточные мишени, которые определяют выживаемость при нейродегенеративных заболеваниях. Прог Нейробиол. 2005; 75: 207–46. [PubMed] [Google Scholar]
8. Ebadi M, Govitrapong P, Sharma S, et al. Убихинон (коэнзим q10) и митохондрии при окислительном стрессе болезни Паркинсона. Биол Сигналы Рецепт. 2001; 10: 224–53. [PubMed] [Академия Google]
9. Крем Р.М., Мантионе К.Дж., Касарес Ф.М., Стефано Г.Б. Нарушенная экспрессия генов транспортера кассеты, связывающей АТФ, в крови крыс ZDF с диабетом. Международный журнал исследований диабета. 2014; 3:49–55. [Google Scholar]
10. Крим Р.М., Мантионе К.Дж. , Касарес Ф.М., Стефано Г.Б. Согласованная дисрегуляция 5 основных классов генов лейкоцитов крови у диабетических крыс ZDF: рабочий трансляционный профиль прогрессирования сопутствующего ревматоидного артрита. Международный журнал профилактики и лечения. 2014; 3:17–25. [Академия Google]
, Касарес Ф.М., Стефано Г.Б. Согласованная дисрегуляция 5 основных классов генов лейкоцитов крови у диабетических крыс ZDF: рабочий трансляционный профиль прогрессирования сопутствующего ревматоидного артрита. Международный журнал профилактики и лечения. 2014; 3:17–25. [Академия Google]
11. Wang F, Guo X, Shen X, et al. Сосудистая дисфункция, связанная с диабетом II типа и болезнью Альцгеймера: потенциальная этиологическая связь. Med Sci Monit Basic Res. 2014;20:118–29. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Ван Ф., Стефано ГБ, Крим Р.М. Эпигенетическая модификация экспрессии гена нейронов DRG после повреждения нерва: этиологический вклад в комплексные региональные болевые синдромы (часть I) Med Sci Monit. 2014;20:1067–77. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Ван Ф., Стефано Г.Б., Крим Р.М. Эпигенетическая модификация экспрессии гена нейронов DRG после повреждения нерва: этиологический вклад в комплексные региональные болевые синдромы (часть II) Med Sci Monit. 2014;20:1188–200. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2014;20:1188–200. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Panksepp J, Herman B, Conner R, et al. Биология социальных привязанностей: сопиаты облегчают дистресс разлуки. Биол психиатрия. 1978; 13: 607–18. [PubMed] [Google Scholar]
15. Pierce RC, Kumaresan V. Мезолимбическая дофаминовая система: окончательный общий путь усиливающего эффекта наркотиков? Neurosci Biobehav Rev. 2006; 30: 215–38. [PubMed] [Академия Google]
16. Шмаусс С., Эмрих Х.М. Дофамин и действие опиатов: переоценка дофаминовой гипотезы шизофрении. Особое внимание уделено роли эндогенных опиоидов в патогенезе шизофрении. Биол психиатрия. 1985; 20: 1211–31. [PubMed] [Google Scholar]
17. Stepien A, Stepien M, Wlazel RN, et al. Оценка взаимосвязи между параметрами липидов и индексами ожирения у пациентов с ожирением, не страдающих диабетом: предварительный отчет. Медицинский научный монит. 2014;20:2683–88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Геринг И.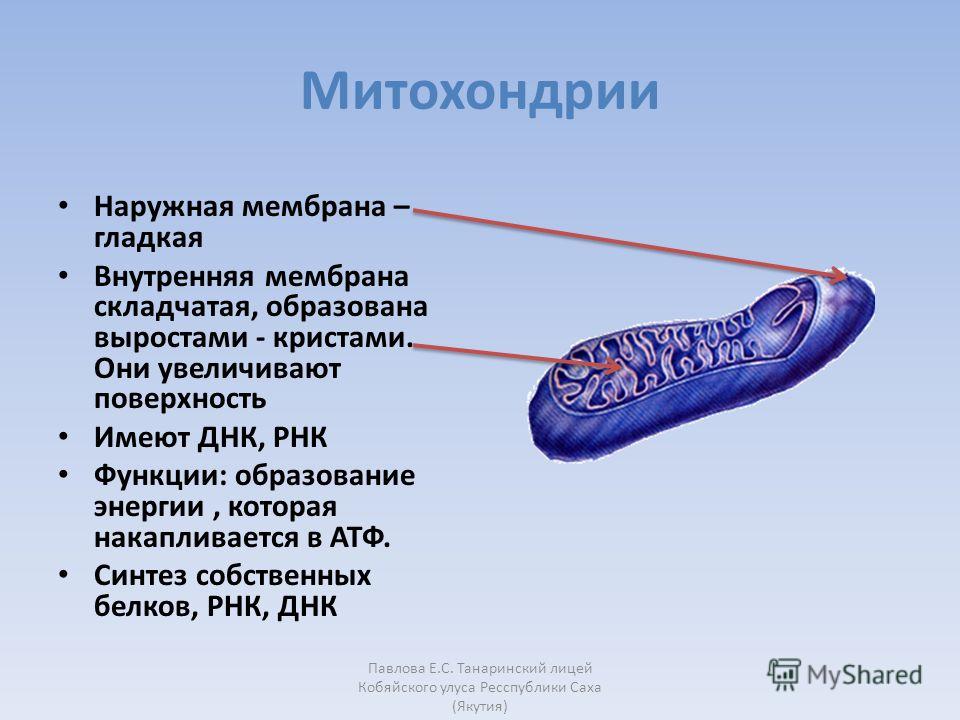 , Шаройко В.В., Мальмгрен С. и др. Хронически высокие уровни глюкозы и пирувата по-разному влияют на митохондриальную биоэнергетику и топливно-стимулированную секрецию инсулина клональными клетками INS-1 832/13. Дж. Биол. Хим. 2014; 289:3786–98. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Шаройко В.В., Мальмгрен С. и др. Хронически высокие уровни глюкозы и пирувата по-разному влияют на митохондриальную биоэнергетику и топливно-стимулированную секрецию инсулина клональными клетками INS-1 832/13. Дж. Биол. Хим. 2014; 289:3786–98. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Mantione KJ, Kream RM, Kuzelova H, et al. Сравнение биоинформационных методов профилирования экспрессии генов: Microarray и RNA-Seq. Med Sci Monit Basic Res. 2014;20:138–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Крам К.Е., Финкель С.Е. Объем культуры и сосуд влияют на долгосрочное выживание, частоту мутаций и окислительный стресс Escherichia coli . Appl Environ Microbiol. 2014; 80: 1732–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Stefano GB, Kream RM. Гипоксия определена как общий виновник/фактор инициации митохондриально-опосредованных провоспалительных процессов. Медицинский научный монит. 2015;21:1478–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Guo R, Li W, Liu B, et al. Ресвератрол защищает гладкомышечные клетки сосудов от окислительного стресса, вызванного высоким уровнем глюкозы, и пролиферации клеток in vitro . Med Sci Monit Basic Res. 2014;20:82–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Guo R, Li W, Liu B, et al. Ресвератрол защищает гладкомышечные клетки сосудов от окислительного стресса, вызванного высоким уровнем глюкозы, и пролиферации клеток in vitro . Med Sci Monit Basic Res. 2014;20:82–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Yildirim V, Doganci S, Yesildal F, et al. Нитрит натрия оказывает ангиогенное и пролиферативное действие in vivo и in vitro . Med Sci Monit Basic Res. 2015;21:41–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Давила А.Ф., Саморано П. Митохондрии и эволюционные корни рака. физ.-биол. 2013;10:026008. [PubMed] [Академия Google]
25. Доллер Дж. Э., Гришабер М. К., Краус Д. В. Хемолитогетеротрофия в тканях многоклеточных животных: продукция тиосульфата соответствует потребности в АТФ в жабрах реснитчатых мидий. J Эксперт Биол. 2001; 204:3755–64. [PubMed] [Google Scholar]
26. Doeller JE, Kraus DW, Shick JM, Gnaiger E. Тепловой поток, поток кислорода и окислительно-восстановительное состояние митохондрий как функция доступности кислорода и активности ресничек в иссеченных жабрах Mytilus edulis . Джей Эксп Зоол. 1993; 265:1–8. [PubMed] [Академия Google]
Джей Эксп Зоол. 1993; 265:1–8. [PubMed] [Академия Google]
27. Tan DX, Manchester LC, Liu X, et al. Митохондрии и хлоропласты как первоначальные места синтеза мелатонина: гипотеза, связанная с первичной функцией мелатонина и его эволюцией у эукариот. J Шишковидная рез. 2013;54:127–38. [PubMed] [Google Scholar]
28. Круз С., Каладо Р., Серодио Дж., Картаксана П. Ползающие листья: фотосинтез у сакоглоссановых морских слизней. J Опытный бот. 2013;64:3999–4009. [PubMed] [Google Scholar]
29. Серодио Дж., Круз С., Картаксана П., Каладо Р. Фотофизиология клептопластов: фотосинтетическое использование света хлоропластами, живущими в клетках животных. Philos Trans R Soc Lond B Biol Sci. 2014;369:20130242. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. de Vries J, Christa G, Gould SB. Выживаемость пластид в цитозоле животных клеток. Тенденции Растениевод. 2014;19:347–50. [PubMed] [Google Scholar]
31. Пенниси Э. Микробиология. Современные симбионты внутри клеток имитируют эволюцию органелл. Наука. 2014; 346: 532–33. [PubMed] [Google Scholar]
Наука. 2014; 346: 532–33. [PubMed] [Google Scholar]
32. Handeler K, Wagele H, Wahrmund U, et al. Последняя трапеза слизней: молекулярная идентификация секвестрированных хлоропластов водорослей различного происхождения в Sacoglossa ( Opisthobranchia , Gastropoda ) Mol Ecol Res. 2010;10:968–78. [PubMed] [Google Scholar]
33. Kerney R, Kim E, Hangarter RP, et al. Внутриклеточная инвазия зеленых водорослей у хозяина-саламандры. Proc Natl Acad Sci USA. 2011; 108:6497–502. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Kao WC, Hunte C. Молекулярная эволюция мотива Qo. Геном Биол Эвол. 2014; 6: 1894–910. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Ренато М., Патераки И., Боронат А., Азкон-Бьето Дж. Хромопласты плодов томатов во время созревания ведут себя как дыхательные биоэнергетические органеллы. Завод Физиол. 2014; 166:920–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. van Dongen JT, Licausi F. Датчики кислорода и сигнализация. Annu Rev Plant Biol. 2015;66:345–67. [PubMed] [Google Scholar]
Датчики кислорода и сигнализация. Annu Rev Plant Biol. 2015;66:345–67. [PubMed] [Google Scholar]
37. Кляйне Т., Лейстер Д. Новые функции mTERF млекопитающих и растений. Биохим Биофиз Акта. 2015; 1847(9):786–97. [PubMed] [Академия Google]
38. Maier UG, Zauner S, Woehle C, et al. Массивная конвергентная эволюция содержания генов рибосомных белков в пластидных и митохондриальных геномах. Геном Биол Эвол. 2013;5:2318–29. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Otten AB, Smeets HJ. Эволюционно определенная роль митохондриальной ДНК в фертильности, заболеваниях и старении. Обновление воспроизведения гула. 2015 [Epub перед печатью] [PubMed] [Google Scholar]
40. Hedges SB, Chen H, Kumar S, et al. Геномная шкала времени происхождения эукариот. БМС Эвол Биол. 2001; 1:4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Xavier JM, Rodrigues CM, Sola S. Митохондрии: основные регуляторы развития нервной системы. Нейробиолог. 2015 [Epub перед печатью] [PubMed] [Google Scholar]
42.

 А. И. Герцена (Профсоюзный комитет)
А. И. Герцена (Профсоюзный комитет) А. И. Герцена
А. И. Герцена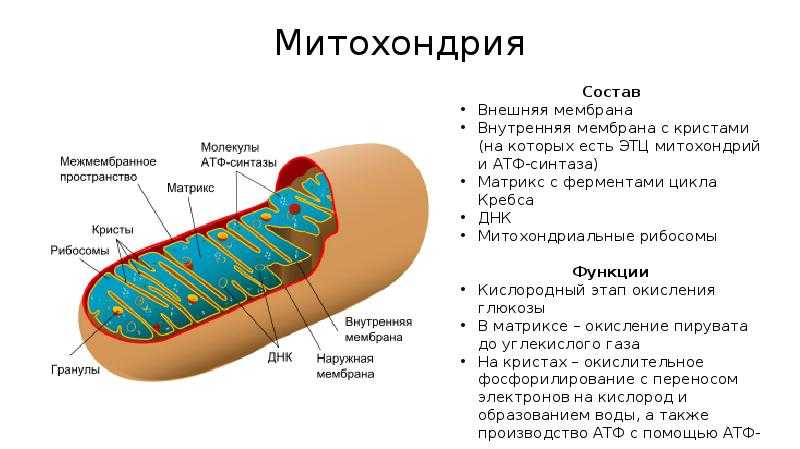 Императрицы Марии Федоровны
Императрицы Марии Федоровны А. И. Герцена
А. И. Герцена А. И. Герцена
А. И. Герцена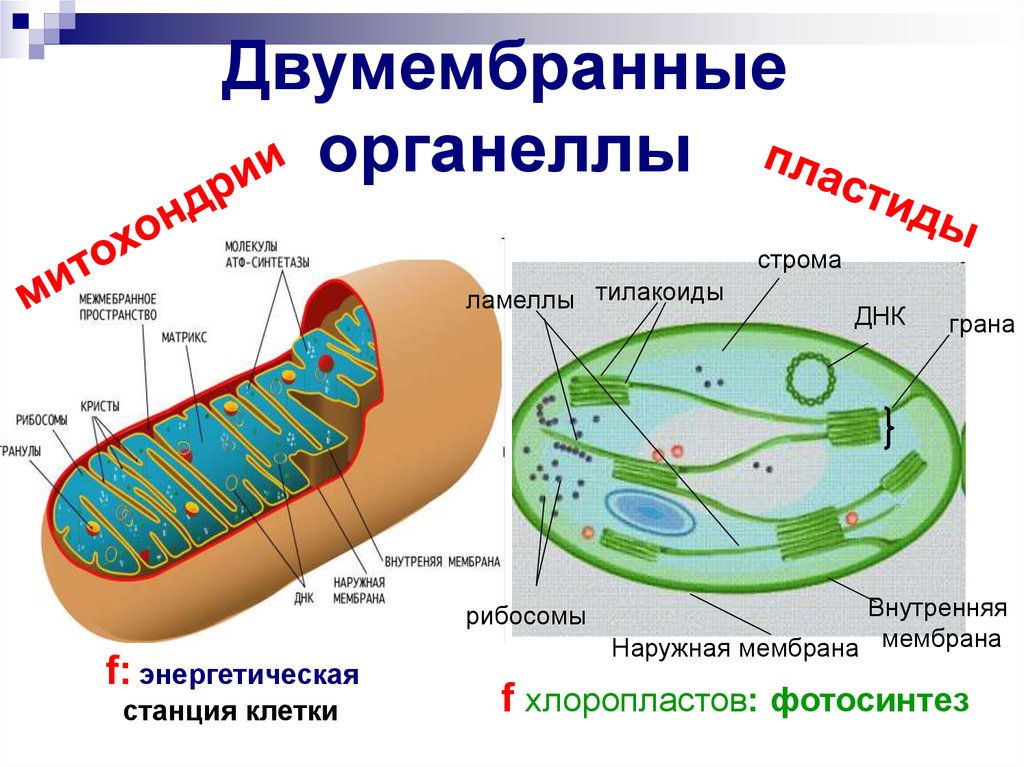 А. И. Герцена
А. И. Герцена