Способ биотестирования по длине корней тестового растения загрязненной нефтью воды. Методы биотестирования с использованием водных растений
Биотестирование воды в домашних условиях, часть I
О том, почему биотестирование в принципе небесполезно уже написано. Теперь перейдем к решению проблемы выбора подходящего тест-организма. А заодно и составим представление об общей токсичности воды в аквариуме.
 | Что можно узнать просто понаблюдав за улитками, без постановки специальных опытов? |
Оказывается можно оценить общую токсичность воды в аквариуме просто понаблюдав за улитками.
Сама по себе это очень простая и не плохая идея – посадить какой-нибудь живущий в воде организм в испытуемую пробу и посмотреть, что с ним будет. А затем решить хороша ли эта вода или плоха? Реализовать такую идею - значит провести биотест. Осталось только ответить на 2 вопроса:1. Какой организм (он будет называться тест-организмом) выбрать?
2. Что собственно с ним должно произойти, или на основании каких явлений можно судить о токсичности?
Однако, если теоретические основы биотестирования вас не волнуют, и вы просто хотите узнать, как с помощью улиток ампулярий можно определить токсичность воды, то можно пропустить часть изложенного ниже материала и сразу перейти к практическим рекомендациям.
Какой тест организм выбрать?
К настоящему времени предложено некоторое количество тест-организмов. (Тест-организм – это и есть то несчастное существо, по реакциям которого мы будем судить о токсичности воды). Разработаны строгие, официально принятые министерством Природных Ресурсов Российской Федерации биотесты. Наиболее популярными тест-организмами оказались дафнии и инфузории. Тесты построены на количественной оценке их смерности. По количеству умерших делается вывод о токсичности. Казалось бы, все это понятно, легко и просто, но на практике оказалось не очень-то информативно. Если подопытные мрут, то понятно, что вода оказывает токсическое действие, но есть ли разница в степени токсичности, когда в одном случае, к примеру, умерло 40% дафний, а в другом 60%? Ну, вроде бы там где 60% - вода токсичнее, но ведь и 40% цифра немалая. Может просто группы тест-организмов были не слишком однородны в плане устойчивости отдельных особей к вредным воздействиям, отсюда и разница в проценте смертности, а токсичность проб одинакова? В общем вопрос статистической достоверности результатов биотестирования сразу же выходит на первый план. Верить или не верить результатам биотестирования во многом зависит именно от статистической корректности постановки эксперимента. Но не только. В не меньшей степени многое зависит и от выбора самого тест-организма, как биологического вида. Тут нельзя не учитывать особенности его биологии и физиологии. Возьмем опять ту же дафнию. Где она живет в природе? Ну, прямо скажем, не в очень-то чистых водоёмах. Аквариумисты-рыбоводы ездят ее ловить на отстойники водоочистных сооружений. Дискусы (да и не только они) жить в такой воде не станут, а мы не будем пить такую воду – запах и вкус не понравятся. Но дафнии там живут и бурно размножаются, инфузории тоже. Так можно ли на основании их реакций судить о токсичности воды применительно к нам с вами (людям то есть) и аквариумным рыбкам? Сильно подозреваю, что все же нельзя, как бы многие авторы ни пытались доказать обратное. Я не буду далее углубляться в научные и наукообразные дебри споров вокруг биотестирования, а приступлю к описанию того тест-организма, который мы с вами будем использовать в биотесте. Итак, мы будем оценивать токсичность воды по поведению (именно в первую очередь по поведению, не по смертности) улиток ампулярий. О самих этих улитках можно прочитать вот тут. Чем замечательны ампулярии? Да целым рядом важных особенностей!
1. Улитки ампулярии теплолюбивы и обладают высоким уровнем обмена веществ.
При температуре воды 25-30°С, биохимические реакции в организме ампулярий идут замечательно быстро. Они много едят, много гадят и энергично растут. А это означает, что наличие токсических веществ в воде быстро окажет влияние на обменные процессы в их организме и это будет видно. Ведь суть действия токсических веществ в том и состоит, что они нарушают нормальный ход биохимических реакций. Токсическое воздействие можно будет обнаружить быстро. Под словом "быстро" подразумевается срок от нескольких часов до двух суток.
 | Фото 1. Перед вами молодые улитки ампулярии. В качестве тест-организмов они хороши благодаря интенсивному обмену веществ. Фотография наглядно демонстрирует этот тезис. Стрелочкой показаны выросты мантии, выходящие за края раковины. Возможно они увеличивают площадь контакта мантии с водой и облегчают кожное дыхание. А возможно они как-то связаны с быстрым ростом края раковины. Во всяком случае, когда эти выступы хорошо заметны у молодых улиток, последние увеличиваются в размерах чрезвычайно быстро. |
2. Высокая чувствительность и одновременно резистентность ампулярий к токсическим воздействиям.
Ампулярии обладают двумя важными для тест-организма качествами. Они чувствительны к действию токсических веществ (почему, я объяснил пунктом выше), и одновременно резистентны (устойчивы) к ним (только соли меди убивают их уже в невысоких концентрациях). Резистентны – это значит, что не мрут сразу. Кстати именно поэтому они очень хороши при запуске аквариума в качестве "животных-первопроходцев". При токсическом воздействии на организм они начинают меньше есть, медленнее ползать, нуждаться в большем или, наоборот, меньшем количестве кислорода, запираться в своей раковине крышечкой, отгораживаясь от вредного действия грязной воды. То есть поведение отравленных улиток отличается от поведения нормальных. Улитки включают все свои защитные механизмы, отвечая стрессовой реакцией на наличие токсического вещества в воде и долго остаются живыми, либо даже приспосабливаются к постоянному присутствию яда в воде (см. также токсичность). Все это можно зарегистрировать и на основании этих поведенческих реакций судить о токсичности. Ну, а когда улиткам станет совсем плохо (это случается при превышении предельно допустимых концентраций в воде в 20-100 раз или даже более) – они умирают. Таким образом нарушения в поведении ампулярий можно обнаружить уже при очень низких содержаниях токсических веществ в воде (примерно 0.01-0.1 от предельно допустимой концентрации), а умирают эти улитки только при многократных передозировках. Это означает, что биотест с их использованием будет работать в очень широком диапазоне токсичности. Важность этого обстоятельства можно пояснить на следующем примере. Главный недостаток теста на дафниях – это очень узкий диапазон. Они живут без заметных отклонений от нормы даже при значительных концентрациях токсического вещества (несколько ПДК, о том, что это такое написано в первой статье про биотестирование), не выявляя его, но сразу умирают при совсем незначительном дальнейшем повышении его концентрации.
3. Высокий уровень организации ампулярий.
Ампулярии довольно сложноорганизованные существа (в отличие от, например, инфузорий). Они обладают практически теми же анатомо-физиологическими системами, что и мы с вами: нервной, двигательной, пищеварительной, выделительной, дыхательной, половой, гуморальной (системой гормональной регуляции функций организма). Их организм в ответ на различные вредоносные внешнее воздействия отвечает неспецифической стрессовой реакцией с участием всех систем. На основании этой реакции можно судить об общей токсичности воды, которая может определяться не каким-то одним токсическим веществом, а суммарным действием многих имеющихся в воде загрязнителей.
4. Поведение ампулярий включает в себя разнообразные поведенческие реакции.
Как я уже писал, поведение ампулярий достаточно разнообразно. Это позволяет судить о токсичности среды их обитания по отклонению этих поведенческих реакций от нормы.
| Видео 1. Это одна из поведенческих реакций улиток - вентиляция легких, которая осуществляется ритмичными прокачивающими движениями.
|
У ампулярий есть и легкие, и жабры. В воде, окисляемость которой невелика, кислорода много и улитки дышат в основном при помощи жабры. На поверхность для вентиляции легких поднимаются редко - не чаще чем один раз в 5-10 минут, а то и реже, сохраняя при этом высокую двигательную активность. В хороших условиях ампулярии довольно подвижны и могут буквально "летать" по аквариуму, особенно если они голодны. Если моллюск попадает в токсичную среду, то его организм отвечает на это генерализованной стрессовой реакцией. В первые часы потребность улитки в кислороде резко возрастает. Она все чаще начинает подниматься к поверхности за свежим воздухом. Иной раз интервалы между отдельными "проветриваниями" легких начинают составлять лишь несколько десятков секунд. В отдельных случаях моллюск так и остается у поверхности выставив сифон наружу. А двигательная активность улитки заметно падает: она меньше ползает и ползает медленнее обычного. Такие симптомы наблюдаются, например, при попадании в воду поверхностно активных веществ (моющие средства). Аквариумисту бывает не вредно периодически присматриваться, как там дела с дыхательной и двигательной активностью его ампулярий? Если после подмены воды в аквариуме дыхательная активность вдруг резко возросла, то есть повод встревожиться и измерить содержание в воде аммиака и нитритов. Эти вещества тоже могут вызывать повышение дыхательной активности. А может быть вы вспомните, что мыли с мылом грот, а потом не очень тщательно его прополоскали под сильной струей воды? При все продолжающемся токсическом воздействии обмен веществ улитки начинает замедляться. Она очень мало или очень медленно ползает, ее тело почти полностью втянуто в раковину и она не вентилирует лёгкие часами - такие наблюдения должны вызвать у аквариумиста особую тревогу. В наиболее тяжелых случаях улитки лежат на дне или плавают у поверхности с закрытой крышечкой раковиной. Для лучшей изоляции от токсического воздействия внешней среды улитка может выделить изрядное количество слизи, изолирующей щель между раковиной и крышечкой. Когда моллюск умирает, крышечка приоткрывается и тело моллюска вываливается наружу. Это вводит в заблуждение неопытных аквариумистов. Они думают,что улитки живые. На самом деле уж скорее еще жива улитка с плотно закрытой раковиной, чем с сильно приоткрытой.
aquariumok.ru
Биотестирование
Биотестирование ныне является основным приемом в разработке ПДК химических веществ в воде. При этом определяют такие параметры, характеризующие токсичность, как: ЛК50 (летальная концентрация для 50% тест-организмов), ЭК50 (эффективная концентрация для 50% тест-организмов), МНК (максимально недействующая концентрация), ОБУВ (ориентировочно безопасный уровень воздействия), ОТД (острое токсическое действие), ХТД (хроническое токсическое действие) и ЛВ50 (время гибели 50% тест — организмов).[ ...]
Биотестирование водоемов основано на том, что отдельные группы гидробионтов могут жить при определенной степени загрязнения водоема органическими веществами. Способность гидробионтов выживать в загрязненной органикой среде называется сапробностъю.[ ...]
Биотестирование проведено также с использованием клеточного тест-объекта - гранулированной спермы быка, т.е. путем анализа зависимости показателя подвижности суспензии сперматазоидов от времени и определения степени подавления их подвижности (сокращения среднего времени подвижности) под воздействием содержащихся в воде токсикантов, в соответствии с [140]. Реализация метода осуществляется с применением автоматической аналитической системы, обеспечивающей сравнительную оценку показателя подвижности суспензии сперматозоидов в опытных пробах воды и в контрольных средах, определение процедур расчетов и выдачу результатов в виде соответствующих индексов токсичности. Оценка показателя подвижности осуществляется путем автоматического подсчета числа флуктуации интенсивности рассеянного излучения, вызванного прохождением клеток через оптический зонд.[ ...]
Биотестирование сточных вод, идущих на повторное использование, показало, что сточная вода в неочищенном виде подавляет прорастание семян и рост проростков на 22%, после очистных сооружений - на 12%, а разбавленная в соотношении 1:1 или 1:2 - на 9%. Контроль во всех случаях - отстоянная водопроводная вода.[ ...]
БИОТЕСТИРОВАНИЕ - оценка состояния окружающей среды по живым организмам. См. Биологические индикаторы. БИОТИЧЕСКАЯ ТРАНСФОРМАЦИЯ СРЕДЫ (Б.т.с.) - изменение абиотических условий под влиянием жизнедеятельности организмов. В.И. Вернадский рассматривал живые организмы как геохимический фактор, который создал биосферу. Благодаря живым организмам в атмосфере появился кислород, сформировались почвы, образовались толщи осадочных пород на дне океанов. В результате Б.т.с. создаются запасы детрита в виде торфа и сапропеля.[ ...]
Для биотестирования используются самые различные организмы (водные растения, водоросли, ракообразные, моллюски и рыбы). Однако наиболее чувствительным к загрязняющим веществам различной природы является пресноводный рачок дафния магна.[ ...]
Под биотестированием понимают приемы исследования, с помощью которых о качестве среды, факторах, действующих самостоятельно или в сочетании с другими, судят о выживаемости, состоянию и поведению специально помещенных в эту среду организмов — тест-обьектов. Рост особей, их продуктивность, выживаемость служат показателями для биотестирования качества среды. Для целей мониторинга природных и сточных вод предприятий оказались удобными фитопланктон и дафнии.[ ...]
Методы биотестирования основаны на оценке физиологического состояния и адаптационного стресса организмов, адаптированных к чистой среде и на время эксперимента помещенных в испытуемую среду. Эти методы также дают информацию об интегральном экологическом качестве среды. Цели прогноза обычно связаны с экстраполяцией результатов опытов на качество жизни человека и на изменения показателей биоразнообразия в экосистемах. Оценка среды по системе биотестирования и биоиндикации в каждой точке территории должна базироваться на анализе комплекса видов. Для наземных экосистем -это травянистые и древесные растения, беспозвоночные животные (например, моллюски и членистоногие) и позвоночные животные (земноводные, рептилии, птицы, млекопитающие). Оценка состояния каждого вида базируется на результатах использования системы методов: морфологических (например, регистрации признаков асимметрии внешнего строения), генетических (тесты на мутагенную активность), физиологических (тесты на интенсивность энергетического обмена), биохимических (оценка окислительного стресса у животных и фотосинтеза у растений), иммунологических (тесты на иммунную потенцию).[ ...]
Длительное биотестирование (3=20 сут.) позволяет определить хроническое токсическое действие воды на дафний по снижению их выживаемости и плодовитости. Показателем выживаемости служит среднее число исходных самок дафний, выживших в течение биотестирования, показателем плодовитости -среднее число молоди, выметанной в течение биотестирования, в пересчете на одну выжившую исходную самку. Критерием токсичности является достоверное отличие от контроля показателя выживаемости и плодовитости дафний.[ ...]
Субстрат для биотестирования собран в районе Среднеуральского медеплавильного завода (Свердловская обл., г. Ревда, Средний Урал, южная тайга). Главные ингредиенты выбросов - 802 и полиметаллическая пыль (в основном соединения Си, РЬ, Cd, 2п, Аь). Многолетнее загрязнение (начиная с 1940 г.) привело к значительному подкислению лесной подстилки и увеличению содержания в ней металлов (табл. 1). Закономерности техногенной трансформации лесных экосистем района исследований описаны ранее (Воробейчик и др., 1994).[ ...]
Таким образом, биотестирование воды представляет собой оценку качества воды по ответным реакциям водных организмов, которые являются в этих случаях тест — объектами (табл. 15.2).[ ...]
К достоинствам биотестирования можно отнести также возможность его использования с помощью портативных приборов при полевых исследованиях, а также простоту сбора и анализа проб. Так, с помощью этих методов по функциональному состоянию (поведению) тест - объектов (ракообразные - дафнии, водоросли - хлорелла, рыбы - гуппии и др.) можно оценивать качество вод и осуществлять ранжирование их по классам состояний. Таким образом появляется возможность использования этих вод для питьевых или иных целей. Наиболее информативные критерии оценки состояния поверхностных и сточных вод (по состоянию тест - объектов) приведены в табл. 42.[ ...]
Удачно дополняет метод биотестирования на дафниях биоте-стовый анализ с помощью простейших микроорганизмов - инфузорий-туфелек (Paramecium caudatum). Метод биотестового анализа водных проб основан на способности инфузорий избегать неблагоприятных и опасных для жизнедеятельности зон и активно перемещаться по градиентам концентраций химических веществ в благоприятные зоны. Метод позволяет оперативно определять острую токсичность водных проб и предназначен для контроля токсичности природных, сточных, питьевых вод, водных вытяжек из различных материалов и пищевых продуктов.[ ...]
Методические указания по биотестированию сточных вод с использованием рачка дафния магна. — М.: в/о Союзводпроект ОМПР и ВП, 1986. - 27 с.[ ...]
При использовании методов биотестирования оперируют рядом понятий и определений: под тест-объектом понимают живой организм, используемый в биотестировании; тест-реакция - изменение какого-либо показателя тест-объекта под воздействием токсичных веществ, содержащихся в воде; тест-параметр - количественное выражение тест-реакции; критерий токсичности -значение тест-параметра или правило, на основании которого делают вывод о токсичности воды.[ ...]
Особенно перспективными в биотестировании окружающей среды являются простейшие - инфузории. Их используют в экотоксикологическом тестировании вод и почв, в биотестировании химических веществ и материалов биологического происхождения .[ ...]
Методическое руководство по биотестированию [68] включает методики определения токсичности с использованием в качестве тест-объектов дафний, водорослей и рыб. Помимо обязательных тестов (на дафниях) допускается использование других рекомендованных методов биотестирования.[ ...]
В табл. 21 представлены результаты биотестирования пяти рецептур антисептика, содержащего алкил бензил аммонийхлорид (¿)), тринатрийфосфат (к2), карбонат натрия (к3) и борную кислоту (¿4).[ ...]
Гудимов A.B., Петров B.C., Гудимова Е.Н. Биотестирование на донных беспозвоночных как средство предупреждения и минимизации загрязнения акваторий в районах разработки месторождений нефти и газа на шельфе Арктики// Морские и арктические нефтегазовые месторождения и экология. М.: ВНИИГАЗ, 1996.[ ...]
В качестве критерия токсичности речных вод использовали выживаемость тестируемых организмов.[ ...]
| Поэтапная схема комплексных исследований по биотестированию предприятия | 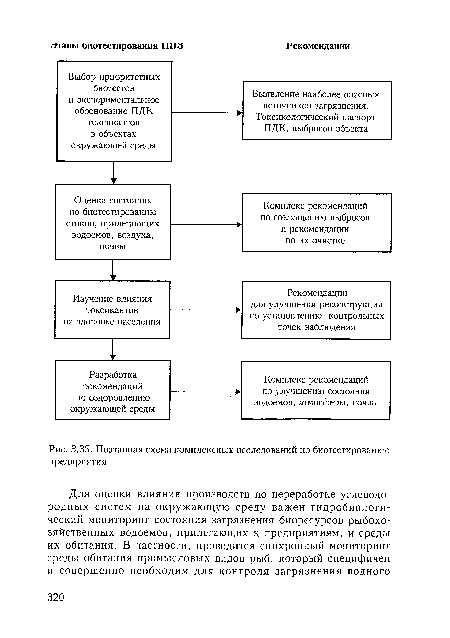 |
На практике для контроля токсичности воды наряду с известными методами биотестирования широко применяют биохимико-физиологи-ческие испытания, основанные на сравнении параметров, характеризующих нормальное поведение организма или биокультуры, с теми же параметрами, наблюдаемыми под воздействием загрязненной воды [4 ]. Как правило, контролируемыми параметрами являются изменение концентрации органического кислорода, количество поглощенного кислорода или выделившегося углекислого газа и др. Все эти методики впервые стандартизуются сразу на международном уровне.[ ...]
Другой возможностью интегральной оценки уровня загрязнения атмосферы является биотестирование токсичности вод снежного покрова города, накопившего в себе за зимний период выбросы промышленных предприятий и автотранспорта. Для этих целей нами разработаны и аттестованы оперативная методика и комплект аппаратуры для биотестирования вод по воздействию загрязнителей на рост водоросли хлореллы. Эта разработка позволяет одновременно оценивать токсичность многих проб талого снега, а также других природных и сточных вод. Проведенные исследования показали высокую эффективность данного методического подхода в определении загрязнения окружающей среды.[ ...]
На основе результатов экспериментальных исследований предлагается использовать биотестирование как метод прогнозной оценки загрязнения акваториальных вод при освоении морских нефтегазовых месторождений. Изложены преимущества рассматриваемого метода по сравнению с общепринятой системой мониторинга.[ ...]
Нами развиты, доработаны и адаптированы к производственным условиям экспресс-методы биотестирования водных объектов с помощью таких тест-организмов, как ракообразные -Daphnia magna Straus (cladocera, crustacea), далее для краткости -Daphnia magna, а также простейшие - Paramecium caudatum (рис. 3.4).[ ...]
Для оценки биологической значимости выявленных изменений структурных особенностей воды проводили ее биотестирование в соответствии с рекомендациями «Методы биотестирования вод» [73]. Использовали гид-робионты различных трофических уровней (3-х систематических групп): простейшие - инфузории Tetrahimena pyriformis, беспозвоночные - пресноводный рачок Daphnia magna и рыбы-мальки гуппи Poecilia reticulata peters.[ ...]
В настоящее время наиболее информативным и достоверным методом оценки качества ОПС и поступающих в нее веществ является биотестирование. В бурении этим способом проводится оценка токсичности промывочных жидкостей и технологических отходов бурения. Следует отметить, что биотестирование буровых сточных вод (БСВ) выполняется корректно, по утвержденной методике для сточных вод. Однако для бурового шлама и буровых технологических жидкостей, по составу и свойствам существенно отличающихся от БСВ, научно обоснованной методики биотестирования, которая учитывала бы их специфику, нет. Поэтому условия проведения исследований, например, кратность разбавления исходного вещества, не унифицированы. Соответственно, результаты исследований разных авторов зачастую несопоставимы, а в ряде случаев их достоверность сомнительна. Так, при разбавлении промывочных жидкостей их дисперсная фаза выпадает в осадок и ее токсикологический эффект фактически не учитывается. Между тем используемая в составе БПЖ глина обладает высокой адсорбирующей способностью. Поэтому в водную среду попадает не исходная глина, использованная для приготовления промывочной жидкости, а модифицированная в процессе циркуляции через скважину. Кроме того, в БПЖ попадают глинистые частицы из выбуренной породы.[ ...]
К сожалению, при использовании приведенных оценочных шкал необходимо учитывать методический аспект. Известно, что результаты биотестирования очень зависят от методики определения. И даже малейшие отклонения, незаметные для неопытного экспериментатора, приводят к значительному искажению результата.[ ...]
На протяжении ряда последних лет сформировалось самостоятельное направление биологического контроля состояния среды путем биоиндикации и биотестирования [Захаров, 1993; Шуберт (ред.), 1988; Мелехова и др., 1988, 2000; Смуров, 2000].[ ...]
| 3 |  |
Одним из методов интегральной оценки качества воды, имеющей контакт с устройством очистки, для выявления возможного негативного влияния конструкционных материалов на качество питьевой воды является биотестирование с помощью гидробионтов различных трофических уровней.[ ...]
Организмы донной фауны являются не только удобными объектами для акваториального содержания, но и прекрасными мониторами хроничекого загрязнения. Анализ их физиологических и поведенческих реакций при биотестировании позволяет достоверно определить пороговые, переносимые и летальные нагрузки, вызываемые тем или иным видом загрязнения. Биотесгирование на Мурмане пока еще не получило должного развития, хотя насущность его очевидна, а результаты нельзя заменить мониторингом. Начавшиеся в нашем институте исследования по биотестированию буровых растворов и их компонентов показали его успешность, в частности, на таких объектах, как голотурия Cucumaria frondosa, гидроид Dynamena pumita, амфипода Gammarus oceanicus, двустворки - мидия (Mytilus edulis L.) и Modiolus (рис. 1-3). Эксперименты показали, что моллюски-фильтраторы, прекрасно адаптирующиеся к лабораторным условиям, сочетают в себе одновременно высокую общую резистентность при достаточной чувствительности отдельных физиологических и поведенческих реакций по отношению к различного рода загрязнениям. Кроме того, по поведенческим актам и росту мидий, например, можно осуществлять не только тестирование загрязнителей, но и проводить непрерывный контроль за качеством природных вод, особенно в прибрежье (губа Териберка, Кольский залив), - в местах выхода подводных трубопроводов и перетранспортировки газоконденсата, нефти и газа.[ ...]
Дафния магна - мелкое ракообразное, постоянный обитатель стоячих и слабопроточных водоемов. По способу питания - активный фильтратор, размер самок достигает 3 мм, самцы в 1,5-2 раза меньше. Дафнии используются для биотестирования водоемов.[ ...]
Разработанная методика позволит осуществлять анализ фактической экологической опасности веществ. При этом процедура анализа экологического риска нетоварных веществ будет основана на сопоставлении измеренного показателя биотестирования со шкалой уровня техногенного воздействия. Таким образом, вместо утверждаемых в настоящее время эколого-рыбохозяйственных нормативов для всех используемых нетоварных веществ необходимо утвердить только методику биотестирования и несколько шкал уровня техногенного воздействия на окружающую природную среду.[ ...]
Во Франции оценка качества водной среды по токсикологическим показателям является обязательной в “Системе контроля качества пресных вод”. Производственный токсикологический контроль сточных вод проводят более чем на 150 предприятиях. Для биотестирования применяют стандартный набор биотестов на острую токсичность с использованием бактерий, водорослей, дафний и рыб .[ ...]
При обсуждении результатов биотестового анализа водных объектов возникает вопрос о критерии токсичности, т.е. о выборе значений индекса токсичности, при которых вода оказывает или не оказывает токсическое воздействие на живые организмы. Методы биотестирования апробированы нами на модельных растворах с известным содержанием токсичных веществ и реальных водных объектах [9, 72, 73].[ ...]
Величины ДФ или АФ/Фт, полученные при построении световых кривых, характеризуют удельную фотосинтетическую и общую физиологическую активность водорослей и могут использоваться в качестве самостоятельного показателя их состояния, в частности при биоиндикации и биотестирования качества воды.[ ...]
Современное загрязнение почти всегда подразумевает наличие в окружающей среде целого комплекса факторов, совместное действие которых может приводить к неожиданным эффектам. Так, специалисты в области экотоксикологии отмечают факты несогласованности результатов биотестирования (токсичность) и химического анализа («благополучные» данные). В качестве одной из возможных причин могут быть комбинированные эффекты. В частности, было обнаружено, что накопление в почве мышьяка приводит к возникновению специфических микробных сообществ. Химическое загрязнение стимулирует развитие фитопатогенных микроорганизмов. Например, при повышенной концентрации мышьяка формируются фузариозно-нематодные комплексы, представляющие двойную опасность для высших растений (Вараксина и др., 2004).[ ...]
При создании новых рецептур многокомпонентных антисептиков на основе явления синергизма главной задачей является подбор оптимального соотношения составных ингредиентов. Рецептуры антисептиков с улучшенными эксплуатационными и экологическими свойствами создают на основе биотестирования по методике "Лаборатории защиты древесины ЦНИИМОД" [49], описанной выше (1).[ ...]
Под биотестом понимают оценку (испытание) в строго определенных условиях действия вещества или комплекса веществ на водные организмы путем регистрации изменений того или иного биологического (или физиолого-биохимического) показателя исследуемого объекта, сравниваемого с контрольным. Подопытные организмы именуются тест-объектами (тест-организмами), а процесс проведения испытаний—биотестированием [97].[ ...]
Весьма информативными при экологических оценках водных экосистем являются характеристики состояния и развития всех экологических групп водного сообщества. При выделении зон чрезвычайной экологической ситуации и экологического бедствия используются показатели по бактериопланкто-ну, фитопланктону, зоопланктону и ихтиофауне. Определение степени токсичности вод проводится также на основе биотестирования преимущественно на низших ракообразных. При этом уровень токсичности водной массы должен определяться на всех основных фазах гидрологического цикла. Параметры предложенных показателей должны наблюдаться на данной территории постоянно на протяжении достаточно длительного времени с минимальным периодом не менее 3 лет.[ ...]
Приводятся данные по изменению физико-химических свойств буровых растворов в забойных условиях. Показано, что прогнозирование токсичности отходов бурения при бурении скважин становится невозможным. На примере многочисленных экологических исследований отходов бурения установлено, что наиболее уязвимым звеном экосистемы рыбохозяйственного водоема являются дафнии. В связи с этим обосновывается целесообразность применения метода биотестирования буровых растворов на стадии разработки и отходов бурения в процессе строительства скважин.[ ...]
Между тем многие из перечисленных трудностей удается преодолеть, если в традиционную схему экологического контроля ввести методы биомониторинга. Эти методы основаны на регистрации суммарного токсического действия на специальные тест-организмы сразу всех или многих из компонентов загрязнения и, таким образом, позволяют быстро и с минимальными затратами оценить, является ли анализируемая проба загрязненной или нет. После достаточно масштабной, но малозатратной процедуры биотестирования дорогостоящему химическому анализу подвергаются лишь те образцы, которые вызывают сомнения относительно их экологической безопасности. Биоиндикационный анализ качества среды, основанный на определении состояния организмов, живущих на обследуемой территории, позволяет оценить воздействие на них всех загрязнителей в течение длительного времени, что дает возможность получить интегральный показатель уровня загрязнения среды. К сожалению, из-за недостаточной научно-методической, технической и нормативно-правовой проработки биологические методы пока лишь ограниченно используются в системе экологического мониторинга.[ ...]
Индикационные критерии оценки. В последние годы б ио индикация получила достаточно широкое распространение при оценках качества поверхностных вод. Она по функциональному состоянию (поведению) тест-объектов (ракообразные — дафнии, водоросли — хлорелла, рыбы — гуппи) позволяет ранжировать воды по классам состояний (нормы, риска, кризиса, бедствия) и, по существу, дает интегральную оценку их качества и определяет возможность использования воды для питьевых целей. Лимитирующим фактором использования метода биотестирования является продолжительный срок проведения анализа (не менее 96 ч) и отсутствие информации о химическом составе воды. Пример использования биотестов для определения качества воды приводится в табл. 21.[ ...]
В качестве биотеста можно использовать одинаковые проростки гороха, фасоли, которые отбирают из партии после их прорастания. У горошин срезают половинки обеих семядолей, чтобы у них было ровное ложе. Фильтровальную бумагу, лежащую на дне химического стакана емкостью 200-250 мл смачивают 5 мл опытного раствора, на дно помещают по 5 подготовленных горошин, закрывают крышкой от чашки Петри. После того, как горошины вырастут на высоту 5-7 см и более (до крышки стакана), производят их измерение. Контроль - горошины на дистиллированной воде. Подсчет проводится так же, как и при биотестировании по прорастанию семян.[ ...]
В целях определения экологического состояния водоемов используют результаты гидробиологических наблюдений, которые дают наиболее полную информацию. Биоиндикация загрязнения водоемов включает большой набор показателей, охватывающих основные трофические уровни водной экосистемы: фитопланктон, зоопланктон, бентос и другие. При этом суммирующими (интегральными) показателями, которые способны охарактеризовать общий уровень загрязнения вод всем комплексом токсичных веществ и, следовательно, опасность водной среды для гидробионтов, являются битестовые (токсикологические) показатели. Соответствующий токсикологический анализ проводится с помощью приемов и методов биотестирования токсичности.[ ...]
К этой же группе методов следует отнести мониторинг — периодическое или непрерывное слежение за состоянием экологических объектов и за качеством среды. Большое практическое значение имеет регистрация состава и количества вредных примесей в воде, воздухе, почве, растениях в зонах антропогенного загрязнения, а также исследования переноса загрязнителей в разных средах. В настоящее время техника экологического мониторинга быстро развивается, используя новейшие методы физико-химического экспресс-анализа, дистанционного зондирования, телеметрии и компьютерной обработки данных. Важным средством экологического мониторинга, позволяющим получить интегральную оценку качества среды, являются биоиндикация и биотестирование — использование для контроля состояния среды некоторых организмов, особо чувствительных к изменениям среды и к появлению в ней вредных примесей.[ ...]
Оценена пространственная вариабельность (в пределах участка 100x100 м) загрязненности лесной подстилки тяжелыми металлами (Си, Сё, РЬ, 2п), ее кислотности и фитотоксичности (по корневому тесту на проростках из генетически однородной выборки одуванчика лекарственного). Подстилка собрана в трех зонах с разным уровнем токсической нагрузки на территории, подверженной многолетнему полиметаллическому загрязнению выбросами медеплавильного завода на Среднем Урале. Разброс фитотоксичности максимален на участке со средним уровнем загрязнения, где отмечены как очень высокие, так и очень низкие значения, что приводит к возникновению существенной нелинейности в дозовой зависимости. Фитотоксичность подстилки в первую очередь определяют обменные формы металлов. Обнаружен резко выраженный антагонизм между тяжелыми металлами и кислотностью при биотестировании образцов с максимально загрязненного участка.[ ...]
В связи с этим представляют интерес результаты исследований по ряду ключевых вопросов безопасного обращения с веществами и материалами в бурении. В общем случае используемые и образующиеся в бурении вещества можно разделить на две категории - товарные (промышленная продукция) и нетоварные (буровые технологические жидкости и технологические отходы бурения и испытания скважины). Принципиальные отличия между этими категориями веществ являются веским основанием для того, чтобы по-разному подходить к оценке их экологичности. Однако в нормативных документах федерального уровня эта специфика не учитывается и предусматривается единый подход к оценке экологической опасности веществ путем определения значения их предельно допустимой концентрации в компонентах окружающей природной среды. Применительно к нетоварным веществам целесообразно перейти от нормирования содержания вещества в окружающей среде к нормированию его воздействия. Эта задача может быть решена путем комплексного биотестирования нетоварных веществ. В целях отработки методики таких исследований проведено изучение отработанного бурового раствора и шлама с использованием различных тест-объектов, результаты которого изложены в настоящем обзоре.[ ...]
ru-ecology.info
Биотестирование как интегральный метод оценки качества воды
Значительное время контроль за загрязнением окружающей среды осуществлялся только физико-химическими методами, путем определения концентраций загрязнителей и соблюдением соответствия величин измеренных концентраций нормированных показателей предельно-допустимым концентрациям (ПДК). С развитием химической промышленности, синтезом новых соединений и их использованием в производстве перечень контролируемых загрязнителей в составе сточных вод увеличивается с каждым днем. Сегодня много загрязняющих веществ по разным причинам не контролируется: для одних не разработаны ПДК, для других отсутствуют утвержденные методики определения, а их воздействие испытывает окружающая среда. В результате поучается так, что широкий спектр соединений, токсичных веществ в водной, воздушной и почвенной средах не контролируется. Но и в случае контроля полного спектра соединений в среде на уровне ПДК нельзя утверждать об отсутствии вредного воздействия на окружающую среду. Так как информация физико-химических показателей не позволяет в принципе сделать вывод о совокупном воздействии загрязняющих веществ различной природы на живые организмы и степени их опасности.
Заполнить информационный аналитический вакуум о комбинационном воздействии загрязнителей признаны методы биотестирования. Особенность информации, получаемой с помощью методов биотестирования состоит в интегральном характере отражения всей совокупности свойств испытуемой среды с позиции восприятия ее живых объектом. И в отличии от физико-химических методов, посредством которых определяется валовое содержание того или иного загрязнителя, биотестовые методы анализа качества воды позволяют обнаружить физиологически активные формы соединений, влияющие на организм. Так, например, нет возможности разрабатывать ПДК веществ под различные значения рН среды, а именно изменение рН среды влечет за собой образование иных форм соединений, возможно более токсичных. Или же токсическое действие токсикантов усиливается в мягкой воде нежели чем в жесткой. А комплексное воздействие загрязнителей совсем непредсказуемо.
Изучено и выделены несколько вариантов воздействия токсикантов.
1. Антагонистическое воздействие токсикантов - возможно такое сочетание ионов в комбинации которых эффект токсичности будет меньше.
2. Аддитивный эффект - эффект токсичности суммы токискантов равен сумме эффектов токсичности.
3. Синергический эффект - неполное суммирование эффектов токсичности.
4. Сеисибилизационный эффект - комбинация токсикантов усиливает эффект токсичности.
Сегодня биотестовые методы, как необходимое дополнение к химическому анализу включены в стандарт по контролю качества вод различного назначения.
Принцип биотестирования сводится к регистрации изменения биомассы, выживаемости, плодовитости, а также физиологических или биохимических показателей тест-объекта в испытуемой среде.
В настоящее время в мире используется большое разнообразие тест-объектов: от одноклеточных водорослей, мхов и лишайников, бактерий и простейших микроорганизмов до высших растений, рыб и теплокровных животных.
В России в органах государственного аналитического контроля за качеством воды дафниевый тест рекомендован в качестве основного для контроля токсичности сточных вод и перспективного для оценки уровня токсического загрязнения природных вод. Дафниевый тест обязателен при установлении ПДК отдельных веществ в воде рыбохозяйственных водоемов.
Выбор тест-объекта определен следующим: 1) этот род ветвистоусых рачков распространен повсеместно в пресных водоемах, является важной составной частью зоопланктона, служит источником пищи молоди рыб; 2) легко культивируется в лабораторных условиях - испытания загрязняющих веществ можно проводить в течении года; 3) определяющая особенность -это то, что по характеру питания они являются фильтраторами и прокачивают большие объемы воды, отфильтровывая в качестве пищи бактерий и микроводоросли, поэтому, если в воде присутствует токсикант даже маленькой концентрации из-за объема отфильтрованной воды чувствительность тест-объекта высокая.
Дафниевый метод биотестирования основан на определении изменений выживаемости и плодовитости дафний при воздействии токсических веществ, содержащихся в тестируемой воде по сравнению с контролем.
Выделяют кратковременное биотестирование - до 96 час. Позволяет определить острое токсическое действие испытуемой воды на дафний по их выживаемости. Показателем выживаемости служит среднее количество особей, выживших в тестируемой воде или в контрольной за определенное время. Критерием токсичности является гибель 50% и более дафний за период времени до 96 час. в тестируемой воде по сравнению с контролем.
Длительное биотестирование - 20 и более суток - позволяет определить хроническое токсическое действие испытуемой воды на дафний по снижению их выживаемости и плодовитости. Показателем выживаемости служит среднее количество исходных самок-дафний, выживших в течение биотестирования, показателем плодовитости - среднее количество молоди, выметанной в течение биотестирования, в пересчете на одну выжившую исходную самку. Критерием токсичности является достоверное отличие от контроля показателя выживаемости или плодовитости дафний.
Выше было упомянуто о большом количестве тест-объектов, использующих в биотестировании и это неслучайно. Дело в том, что различные организмы по разному реагируют на загрязнители. И задача природоохранных органов правильно оценить ситуацию и выбрать более чувствительный тест-объект.
Пример. Результаты биотеетироваиия сточных вод завода,синтезирущего биологические активные соединения гербицидногонаправления, могут быть различными в зависимости от выбранного тест-обьекта. Дафниевый тест может показать отсутствие токсическоговоздействия, а культура водорослей может почувствовать токсикант.Почему? Дело в том, что предполагаемый токсикант, синтезируемыегербициды являются ингибиторами процессов фотосинтеза у растений иводорослей. Поэтому дафнии могут в кратковременном опыте зафиксироватьотсутствие острого токсического воздействия, а водоросли в случаенарушения работы фотосинтетической цепи оперативно отреагируют назагрязненность.
Поэтому в системе контроля за качеством сточных вод также рекомендованы водоросли: хлорелла и сцепедесмус. Критерием токсичности при биотестирозании с использованием водорослей служит достоверное снижение количества клеток в испытуемой воде по сравнению с контролем.
С целью быстрого получения информации о качестве воды используются экспресс методы биотестирования.
В Москве разработан и выпускается мелкими .партиями прибор "Биотоке". Устройство Биотоке - это портативный биолюминометр,
позволяет с помощью биосенсора "Эколюм", светящиеся бактерии, производить быстрое и объективное определение индекса обшей токсичности водных образцов, включая металлы, препараты бытовой химии и т.д. Результаты токсичности пробы воды получают через 10 мин.
В Санкт-Петербурге выпускается прибор Биотестер. В качестве тест-объекта используют одноклеточные микроорганизмы - инфузории туфелька. Этот метод основан на хемотаксической реакции организмов в ответ на загрязнитель, т.е. движение культуры в благоприятную зону. Данная тест-реакция - хемотаксис, является очень чувствительной к токсикантам определенной группы.
В России биотестирование проводят аналитические лаборатории органов природоохраны для определения токсичности сточной воды (происходят ли патологические изменения или гибель организмов, обусловленные присутствием в ней токсических веществ) на сбросе в водный объект, воды в контрольном и других створах водопользования с целью проверки соответствия качества воды нормативным требованиям:
- сточная вода на сбросе в водный объект не должна оказывать острого токсического действия, а вода в контрольном и других створах водопользования - хронического токсического действия на тест-объекты.
В соответствии с "Методическим руководством по биотестированию воды РД 118-02-90", биотестирование является дополнительным экспериментальным приемом для проверки необходимости корректировки величин ПДС по интегральному показателю "токсичность воды", который позволяет учесть ряд существенных факторов: наличие в сточной воде токсических веществ, неучтенных при установлении ПДС, вновь образованных соединений, метаболитов, различные виды взаимодействия химических веществ. Необходимость корректировки величин ПДС возникает в том случае, если при биотестировании воды из контрольного створа водного объекта установлено несоответствие ее качества требуемому нормативу: вода в контрольном створе водного объекта не должна оказывать хронического токсического действия на тест-объекты (дафний и цероидафний).
Для оценки бактериального загрязнения используются санитарно-бактериологические и гидробиологические показатели.
Микронаселение природных вод чрезвычайно разнообразно. Его качественный и количественный состав определяется в первую очередь составом воды. Для глубоко залегающих, очень чистых артезианских вод характерно почти полное отсутствие бактерий вследствие защищенности водоносного слоя от контакта с лежащими выше горизонтами.
Особенностью состава воды открытых водоемов является изменение его по сезонам года: сопровождающееся изменениями в количестве и видовом разнообразии микронаселения. Бактериальная загрязненность поверхностных источников обусловлена, главным образом, поступлением в водоемы поверхностного стока, содержащего органические, минеральные вещества и микроорганизмы, смываемые с площади водосбора, и сточных вод.
С позиций санитарной микробиологии оценка качества воды проводитсяс целью определения ее санитарно-эпидемиологической опасности илибезопасности для здоровья-человека. Вода играет важную роль в передачевозбудителей многих инфекций; главным образом кишечных. Т.к. через водуполучают распространение брюшной тиф, дизентерия, холера,инфекционный гепатит и т.д.
Прямое количественное определение возбудителей всех инфекций для контроля за качеством воды неосуществимо в связи с многообразием их видов и трудоемкостью анализа. В практической санитарной микробиологии поэтому прибегают к косвенным методам, позволяющим определить потенциальную возможность заражения воды патогенными микроорганизмами.
Санитарно-бактериологическая оценка качества воды основана на определении двух основных показателей; микробного числа и числа бактерий группы СоН.
Первый показатель даст представление об общей обсемененности воды аэробными сапрофитами, поэтому часто называется общим счетом аэробных сапрофитов или (кратко) общим счетом. Микробное число определяют методом посева на стандартную среду - мясопептонный агар (МПЛ).
Аэробные сапрофиты составляют только часть общего числа микробов в воде, но являются важным санитарным показателем качества воды, так как между степенью загрязнения ее органическими веществами и микробным числом существует прямая зависимость. Кроме того, полагают, что чем выше микробное число, тем больше вероятность присутствия в воде патогенных микроорганизмов. Микробное число водопроводной воды не должно превышать 100. В природных водах этот показатель изменяется в очень широких пределах для разных водоемов и по сезонам года для одного и того же водоема. В чистых водоемах число аэробных сапрофитов может исчисляться десятками или сотнями, а в загрязненных и грязных водоемах составлять десятки тысяч и миллионы.
По второму показателю - числу бактерий группы СоН (кишечная палочка) оценивают возможное присутствие в воде патогенных микроорганизмов.
Бактерии группы СоН относятся к семейству энтеробактерий. Это неспороносные палочки, факультативные анаэробы, сбраживающие лактозу и глюкозу при температуре 37°С с образованием кислоты и газа и не обладающие оксидазной активностью. Они являются постоянными сожителями кишечника человека и животных: постоянно и в большом числе выделяются во внешнюю среду; дольше, чем патогенные микроорганизмы, сохраняют жизнеспособность в этой среде; более устойчивы к хлору, чем возбудители большинства инфекций. Именно эти свойства бактерий группы СоИ обусловили возможность их использования в качестве санитарно-показательных микроорганизмов. Наличие коли-форм в воде говорит о ее фекальном загрязнении, а их число позволяет судить о степени этого загрязнения. Для количественного определения коли-форм применяют фуксин-сульфитный агар (среда Эндо).
Анализ водопроводной и чистой природной воды проводят после предварительного концентрирования воды на мембранных фильтрах.
Результаты выражают в виде коли-индекса - числа бактерий в 1 л воды.
Иногда делают пересчет, определяя коли-титр - наименьший объем воды (в мл), содержащий одну кишечную палочку. Коли-титр = 1000/коли-индекс.
Коли-индекс водопроводной воды должен быть не более 3. Допустимый коли-индекс воды источников водоснабжения зависит от предполагаемого способа очистки. Если намечается только хлорирование воды, то коли-индекс воды в источнике не должен превышать 1000 при полной очистке воды - 10000.
В особых условиях по санитарно-эпидемиологическим показателям прибегают к определению в воде - энтерококков, энтеровирусов сальмонелл и проводят исследования воды на патогенную микрофлору.
Поверхностные источники водоснабжения помимо санитарно-бактериологических тестов характеризуются также данными гидробиологических наблюдений. Микроскопированием пробы воды определяется число клеток фито- и зоопланктона. Эти показатели существенно изменяются по сезонам - как по количеству организмов, так и по их видовому разнообразию.
В весенне-летний период интенсивного развития водорослей (цветения водоема) содержание фитопланктона в поверхностных водах может достичь 50 тыс. клеток в 1 мл. Летом зоопланктон отличается большим разнообразием и представлен низшими ракообразными, коловратками, личинками моллюсков. В воде могут оказаться и бентосные организмы: черви, личинки насекомых. В зимний период в воде встречаются, в основном, низшие ракообразные. Число организмов зоопланктона обычно выражают числом экземпляров в 1 м3 воды. В воде источников встречаются также организмы, видимые невооруженным глазом. Их число оценивают числом экземпляров в 1 м3. Для рек средней полосы европейской части нашей страны концентрация зоопланктона составляет 100- 10000 экз. в 1 м воды. Обычно их в несколько раз меньше, чем организмов зоопланктона.
В питьевой воде планктонные организмы, так же как организмы видимые невооруженным глазом, должны отсутствовать.
ekologyprom.ru
Биотестирование сточных вод методом Daphnia
Проблемы чистой воды и охраны гидросферы становятся все более острыми по мере развития научно-технического прогресса. Уже сейчас во многих районах земного шара наблюдаются большие трудности в обеспечении водопотребления и водопользования вследствие количественного и качественного истощения водных ресурсов. В первую очередь это связано с загрязнением водоемов и забором из них больших объемов воды (зарегулирование, переброска части стока рек и др. ), ведущегося в интересах энергетики, орошения земель, навигации и в других целях.
Настоящая работа была выполнена по заданию Воронежского Областного Комитета по экологии и охране природных ресурсов. В его штате отсутствуют гидробиологи, однако результаты гидробиологического тестирования сточных вод очень важны и интересуют Комитет. Пробы для тестирования были предоставлены лабораторией Комитета, а небольшое количество дафний для разведения и дальнейшего использования в опытах – кафедрой зоологии беспозвоночных Воронежского государственного университета.
Для тестирования были взяты стоки вод в прудах-отстойниках шести сахарных заводов области.
Результаты экспериментов переданы в Областной Комитет по экологии и охране природных ресурсов.
Современное состояние проблемы загрязнения водоемов и очистки сточных вод
Загрязнение водоемов в наибольшей степени связано со сбросом в них промышленных, сельскохозяйственных и бытовых стоков, с попаданием загрязняющих веществ из атмосферы и в результате деятельности человека на самих водоемах. Во многих водоемах загрязнение настолько велико, что привело к полной деградации их экосистемы, потере их хозяйственной и ландшафтной ценности.
Под загрязнением водоемов понимается ухудшение их экономического значения и биосферных функций в результате антропогенного поступления в них вредных веществ.
Из загрязняющих веществ наибольшее значение для водных экосистем имеет нефть и продукты ее переработки, пестициды, соединения тяжелых металлов, детергенты, антисептики. Чрезвычайно опасным стало загрязнение водоемов радионуклидами. Значительную роль в загрязнении водоемов играют бытовые стоки, лесосплав, отходя деревообрабатывающих предприятий и многие другие загрязнения, не относящиеся к токсическим, но ухудшающие среду гидробионтов.
Сточные воды – это воды, использованные на бытовые, производственные и другие нужды и загрязненные различными примесями, изменившими их первоначальный химический состав и физические свойства, а также воды, стекающие с территории населенных пунктов и промышленных предприятий в результате выпадения атмосферных осадков или поливки улиц.
В зависимости от происхождения, вида и состава сточные воды подразделяются на три основные категории:
1. Бытовые (от туалетных комнат, кухонь, столовых, больниц. Они поступают от жилых и общественных зданий, а также от бытовых помещений промышленных предприятий)
2. Производственные (воды, использованные в технических процессах, не отвечающие более требованиям, предъявляемым к их качеству)
3. Атмосферные (дождевые и талые, вместе с атмосферными отводятся воды от полива улиц, от фонтанов и дренажей)
Сточные воды представляют собой сложные гетерогенные смеси, содержащие примеси органического и минерального происхождения, которые находятся в нерастворенном, коллоидном и растворенном состоянии. Степень загрязнения сточных вод оценивается концентрацией, т. е. массой примесей в единице объема (мг/л). Наиболее сложны по составу сточные воды промышленных предприятий. На формирование производственных сточных вод влияют перерабатываемое сырье, технический процесс производства, применяемые реагенты, промежуточные изделия и продукты, состав исходной воды, местные условия и др.
Эти воды могут различаться по концентрации загрязняющих веществ, по степени агрессивности и т. д.
Водоемы загрязняются в основном в результате спуска в них сточных вод от промышленных предприятий и населенных пунктов. В результате сброса сточных вод изменяются физические свойства воды (повышается температура, уменьшается прозрачность, появляются привкусы, окраска, запахи), на поверхности водоемов появляются плавающие вещества, а на дне образуются осадки, изменяется химический состав воды (увеличивается содержание органических и неорганических веществ, появляются токсические вещества, уменьшается содержание кислорода, изменяется активная реакция среды и др. ), изменяется качественные и количественные бактериальный состав, появляются болезнетворные бактерии. Загрязненные водоемы становятся непригодными для питьевого и технического водоснабжения, теряют рыбохозяйственное значение.
Первые шаги к усовершенствованию процесса очистки сточных вод связано с прямым использованием природного самоочищения и фильтрационной способности почвы. Уже в 19 столетии вокруг крупных промышленных центров были выделены специальные земельные участки, которые служили для очистки сточных вод. Они получили название полей фильтрации и полей орошения. Но длительность срока очистки и большие земельные площади делают эти способы малоэкономичными при быстро развивающемся производстве. При таком способе очистки возникают так же определенные санитарно-эпидемиологические трудности.
Следующим этапом развития способов очистки сточных вод было использование биологических прудов. Процесс очистки воды в них проходит по принципу естественного очищения обычного для водоемов и только отчасти регулируется человеком. Так очищаются стоки мясокомбинатов, молочных и сахарных заводов, кондитерских и других предприятий. Нередко такие пруды обеспечиваются принудительной аэрацией и циркуляцией воды. Отрицательным моментом работы биопрудов является длительность процесса очистки, который продолжается до 30 суток. Процесс очистки считается окончательным при следах азота аммонийного в воде.
Технический прогресс и все усиливающийся процесс индустриализации привели уже в начале 20 века к необходимости изыскать более быстрые и экономичные методы очистки сточных вод.
Методы искусственной биологической очистки, основанные на активной деятельности живых организмов, остаются в настоящее время основными экономичными и эффективными, обеспечивающие наиболее полное разложение загрязнений по сравнению со всеми иными индустриальными методами.
3. Методы анализа и тестирования сточных вод
Среди методов гидробиологического анализа поверхностных вод сапробиологический анализ занимает одно из важнейших мест. Разработанный еще в начале 20 века ботаником Кольквитцем и зоологом Марссоном сапробиологический анализ продолжает успешно применяться в повседневной практике гидробиологического контроля качества поверхностных вод.
Первоначально под сапробностью понималась способность организмов развиваться при большем или меньшем содержании в воде органических загрязнений. Затем экспериментально было доказано, что сапробность организма обусловливается как его потребностью в органическом питании, так и резистентностью по отношению к вредным продуктам распада и дефициту кислорода в загрязненных водах.
Теперь установлено, что в ряду организмов олигосапробы-мезосапробы-полисапробы возрастает не только специфическая стойкость к органическим загрязнителям и к таким их последствиям, как дефицит кислорода, но и их неспецифическая способность существовать при резко различных условиях среды. Это положение значительно расширяет возможности использования сапробиологического анализа не только в случае загрязнения вод бытовыми стоками, но и при их промышленном загрязнении.
В классической системе показательные организмы разделяются на три группы:
1. организмы сильно загрязненных вод – полисапробионты, или полисапробы;
2. организмы умеренно загрязненных вод – мезосапробионты, или мезосапробы;
3. организмы слабо загрязненных вод – олигосапробионты, или олигосапробы.
Полисапробные воды характеризуются бедностью кислорода и большим содержанием углекислоты и высокомолекулярных легко разлагающихся органических веществ – белков, углеводов. Население полисапробных вод обладает малым видовым разнообразием, но отдельные виды могут достигать большой численности. Здесь особенно распространены бесцветные жгутиконосцы и бактерии.
Мезасапробные воды характеризуются энергичным самоочищением. Большой численностью обладают грибы, бактерии и водоросли. В этих водах обитают беспозвоночные организмы, а также нетребовательные к кислороду виды рыб. Деревенские пруды, рвы и канавы на полях орошения обычно содержат мазосапробные воды.
В олигосапробных водах процессы самоочищения протекают менее интенсивно, чем в мезосапробных. В них доминируют окислительные процессы, нередко наблюдается пресыщение кислородом, преобладают такие продукты как аммонийные соединения, нитриты и нитраты. В этих водах разнообразно представлены животные и растительные организмы.
Олигосапробные воды – это практические чистые воды больших озер. Если такие воды произошли путем минерализации из загрязненных вод, то для них характерна почти полная минерализация органических веществ.
Дафния является мезосапробным организмом. С ее помощью можно определить достаточно хорошую степень очистки сточных вод. Так как она очень чувствительна к изменениям водной среды мы можем определить и недостаточную степень очистки воды. Поэтому мы проводили биотестирование сточных вод методом Дафния.
4. Биотестирование сточных вод методом Daphnia
К настоящему времени апробированы и используются на практике большое количество предельно допустимых концентраций различных веществ, успешно внедряются в практику народного хозяйства также нормы предельно допустимых стоков.
При избыточном поступлении стоков с высокими концентрациями вредных веществ нарушаются природные качества воды, и она становится непригодной для выполнения биологических функций организма. Это отрицательно сказывается на состоянии и развитии всех водных организмов и приводит к негативным состояниям стабилизированных экосистем, структура которых в большинстве случаев упрощается.
Часть ее компонентов, в первую очередь полезных человеку, частично вымирает, а ограниченное число отдельных представителей флоры и фауны может интенсивно развиваться и способствовать ухудшению природных качеств вод.
Задача настоящей работы заключается в контроле качества сточных вод, выбрасываемых сахарными заводами области. Контроль производится одним из самых допустимых биологических методов на ветвистоусом рачке Daphnia magna из отряда листоногие раки.
Для проведения данной работы требуются следующие материалы и оборудование:
Микроскоп МБС, лупы, гидробиологический сачок для отлова дафний, сачки для переноса дафний в сосуд для биотестирования, аквариум-отсадник объемом 5 л, цилиндры мерные объемом 0,5-2 л, пипетки мерные на 1,2,10 мл, стаканы химические объемом 200,100,50 мл, воронки стеклянные, чашки Петри, фильтровальная бумага
5. Характеристика тест-объектов
Род Daphniaвключает 50 видов и имеет повсеместное распространение. В пресных водоемах нашей области широко распространены 5 видов дафний.
Рачки вида Daphnia magna имеют более крупные размеры и их применение в токсикологических экспериментах предпочтительнее. Они обитают в стоячий водоемах и слабопроточных водах, особенно часто во временных пересыхающих водоемах, лужах. На территории нашей страны распространены повсеместно, кроме Заполярья и Дальнего Востока. Являются типичными мезосапробами, переносят осоление до 6%.
Короткий биологический цикл развития позволяет проследить рост и развитие дафний на всех жизненных стадиях. В течение жизни дафнии выделяют ряд стадий, сопровождающихся линьками: первые 3 следуют через 20-24-36 часов, четвертая – созревание яиц в яичнике и пятая – откладка яиц в выводковую камеру следуют с интервалами 1 -1,5 суток. Начиная с шестой стадии, каждая линька сопровождается откладыванием яиц. Растет дафния наиболее интенсивно в первые дни после рождения, после наступления половозрелости рост замедляется. Новорожденная молодь имеет размеры 0,7-0,9 мм в длину, к моменту половозрелости самки достигают 2,2 – 2,4 мм, а самцы – 2,0 – 2,1 мм. Максимальная длина тела самок может достигать 6,0 мм.
При благоприятных условиях и в лаборатории дафнии большую часть года размножаются без оплодотворения – партеногенетически, производят потомство, состоящее из самок. При недостатке пищи, перенаселении, изменении температурных условий и уменьшения светового дня в популяции дафний появляются самцы, и дафнии переходят к половому размножению, откладывая после оплодотворения «зимние яйца» (1-2) в эфиппиум, образованный из части створок раковины самок.
Период созревания рачков при оптимальной температуре 20-220С с хорошим питанием – 5 -8 дней. Длительность эмбрионального развития обычно 3-4 дня, а при повышении температуры до 25-46 часов. По истечении этого времени происходит вымет молоди. Партеногенетические поколения следуют одно за другим каждые 3-4 дня. Формирование яиц в кладке прекращается за 2-3 дня до смерти. В природе дафнии живут в среднем 20-25 дней, а в лаборатории при оптимальном режиме 3-4 месяца и более. При температурах свыше 250С продолжительность жизни дафний может сократиться до 25 дней.
Источником питания дафний в природных водоемах являются бактерии, одноклеточные водоросли, детрит, растворенные органические вещества. Интенсивность потребления корма зависит от его характера, концентрации в среде, температуры и возраста рачков. Процесс питания дафний непосредственно связан с движением грудных ножек, направляющих ток воды во внутрь раковины. Пищевые частицы, отфильтрованные на «сите», поступают в продольный желоб и передаются ко рту рачка.
Функции грудных ножек связаны с процессами дыхания. В жабрах (овальные выросты ножек) происходит газообмен. Дафния устойчива к изменению кислородного режима (от 2 мг О2/л), что связано со способностью синтезировать гемоглобин. В условиях пониженной концентрации растворенного кислорода дафнии приобретают красноватый цвет, а при благоприятных условиях – розовато-желтый цвет.
В лабораторных условиях мы использовали дрожжевой корм, который готовили следующим образом: 1 г свежих или 0,3 г воздушно-сухих дрожжей заливали 100 мл дистиллированной воды. После набухания дрожжи тщательно перемешиваются. Отстаивают 30 минут. Добавляют надосадочную жидкость в сосуды с рачками в количестве 3 мл на 1 л воды.
Подготовка дафний к биотестированию проходила по следующей схеме: 30-40 рачков с выводковыми камерами полными яиц или зародышей на 3-4 суток до тестирования пересаживают в 1-2-хлитровые емкости (стаканы) с аквариумной водой, в которую перед посадкой дафний вносят корм. После появления молоди (каждая самка может выметать от 10 до 40 молодых дафний) взрослых особей удаляют с помощью стеклянной трубки, а одно-двухдневную молодь используют для биотестирования. Необходимое для тестирование количество дафний определяется числом контрольных проб воды и их разбавлений. Так, для тестирования одной пробы с одним повтором, в трехкратной повторности, потребуется 60 дафний (в каждый сосуд для тестирования помещают по 10 рачков)
6. Тесты токсичности на Daphnia
Существуют несколько тестов-методов определения токсичности природных и сточных вод на Daphnia, разработанных разными авторами. Мы пользовались тестом Министерства мелиорации и водного хозяйства СССР 1986 года «Биотестирование сточных вод с использованием Daphnia»
При биотестировании определяют острое и хроническое токсическое воздействие вредных веществ на животных. За острое принимается действие, оказываемое сточной водой на Daphnia в течение от 10 минут до 96 часов и проявляющееся в их обездвижении или гибели. Перед биотестированием проводились подготовительные работы, включающие получение исходного материала для лабораторной культуры и ее выращивания. Для биотестирования отбирали пробу сточной воды из прудов отстойников шести сахарных заводов области. Для сравнения с фоном отбирали пробу воды вне зоны влияния сточных вод.
Пробы помещали в стеклянные емкости, которые заполняли под крышку, чтобы исключить доступ воздуха. Не допускается замораживание и консервирование отобранных проб. Биотестирование проводили сразу после отбора проб и доставки их в лабораторию. Запас воды для биотестирования хранили в холодильнике. Температура тестируемой воды +18-240С.
Биотестирование установившихся сбросов сточных вод производится для выявления и последующего осуществления контроля источников ЭВЗ (экстемально высокого загрязнения). Определяется острое действие тестируемых проб на дафний. Критерием острого токсического действия является выживаемость рачков, показатель выживаемости – количество выживших дафний за период тестирования. Тестируют сточную воду без разбавления и воду контрольную.
По 100 мл аквариумной и соответствующих проб воды наливают в сосуды для тестирования. В каждый помещают по 10 особей молоди дафний. Их вносят в сосуды для тестирования с помощью сачка диаметром 3-4 см из планктонного газа или пипеткой с резиновой грушей. Повторность трехкратная. Сосуды оставляют при рассеянном свете. Дафний в течение всего периода биотестирования не кормят. Подсчитывают количество погибших и обездвиженных дафний, последних включают в число погибших. Обездвиженным считается опустившийся на дно рачок, не поднимающийся в толщу воды через 10-30 секунд после встряхивания сосуда. Определяют количество выживших дафний. Учет проводят каждый час в течение первых 8 часов наблюдений, затем через 12 и 24 часа от начала тестирования, в последующем – в начале и конце рабочего дня.
7. Обработка и оценка результатов
Определяют среднюю арифметическую величину выживаемости дафний в тестируемой воде по сравнению с контролем и высчитывают процент отклонения от контроля. Тестируемая вода оказывает острое токсическое действие на дафний в том случае, если процент отклонения от контрольного показателя выживаемости дафний в течение 96 часов составляет менее 10. Результаты биотестирования выражают в баллах
В случае получения 0 баллов ситуация считается благополучной и не требует применения дополнительных водоохранных мер. При получении оценочного балла 1 ситуация считается неблагополучной и принимаются меры по улучшению работы имеющихся водоохранных сооружений. При оценочном балле 2 необходимо провести биотестирование соответсвующих проб воды для определения хронического токсического действия. Результаты биотестирования, выражающиеся в баллах 3,4,5 свидетельствуют о ситуации, которая может нанести существенный ущерб водному объекту и требуют принятия мер по организации дополнительных водоохранных мероприятий. Предприятия, на которых тестируемые пробы воды из контрольного створа водного объекта оценены баллом 3 и выше, включаются в перечень потенциальных источников ЭВЗ водных объектов и подлежат токсикологическому контролю
8. Выводы и предложения
В результате проведенных анализов были получены следующие результаты:
Без разбавления: Два сахарных завода (Эртильский и Грибановский) проводят сброс гипертоксических вод (5 баллов) в пруды-отстойники. Садовский сахарный завод проводит сброс высокотоксичных вод (4 балла), а три сахарных завода (Елань-Коленовский, Нижнее-Кисляйский и Перелешинский) проводят сброс среднетоксичных вод (3 балла) в пруды-отстойники.
При разбавлении 1:10: токсичность с гипертоксичной снижается до высокотоксичной.
При разбавлении 1:100: Гипертоксичность снижается, вода становится среднетоксичной.
Данные экспериментов были переданы в Областной Комитет по экологии и охране природных ресурсов. Все заводы занесены в перечень потенциальных источников ЭВЗ ввозных объектов и подлежат токсикологическому контролю.
Проведенная работа показала, что методика биотестирования проста и доступна. Ее можно рекомендовать для широкого применения в практике как специалистам гидробиологам природоохранных организаций и вузов, так и студентам вузов, техникумов и учащимся технических училищ и школ.
www.hintfox.com
Способ биотестирования по длине корней тестового растения загрязненной нефтью воды
Изобретение относится к экологии и может быть использовано для оценки опасных уровней загрязнения водных объектов нефтью. Для этого выбирают тест-растение, проводят равномерную укладку семян тест-растения на фильтровальную бумагу в контрольной и испытуемой чашке Петри диаметром 10 см. Далее в каждую контрольную и испытуемую чашку Петри наливают по 5,0 мл воды при 4-8-кратной повторности полива, при этом уровень жидкости в чашках должен быть ниже поверхности семян. При этом в контрольной чашке Петри принимается проба воды с нулевой концентрацией нефти, а в испытуемых чашках до полива подготавливают водные эмульсии испытуемой нефти с разными концентрациями. Затем приготовленными водными эмульсиями с заданной концентрацией нефти поливают семена тест-растения в чашках Петри в течение 72 часов, причем концентрацию нефти в разных водных эмульсиях увеличивают до тех пор, пока в момент измерений длины корня всхожесть семян редиса красного круглого не будет ниже 50%. Изобретение обеспечивает оценку опасных уровней загрязнения водных объектов нефтью, за счет повышения точности показателей влияния нефти различной объемной концентрации в водном растворе на рост корней растения на конкретной территории. 2 з.п. ф-лы, 12 ил., 3 табл., 1 пр.
Изобретение относится к инженерной экологии и защите окружающей природной среды. Оно может быть использовано при экологическим нормировании влияния концентрации нефти и нефтепродуктов на природную среду в виде растительности. При этом экологическое нормирование выполняется биотестированием по росту корней различных видов тестовых растений, например, при экологическом мониторинге качества воды рек и водоемов, загрязненной нефтяными сбросами.
Известен способ испытания загрязнения воды по росту корней растения в соответствии с методикой биотестирования по проращиванию семян (Приложение 10. Санитарные правила и нормы СанПиН 2.1.7.573-96 "Гигиенические требования к использованию сточных вод и их осадков для орошения и удобрения" (утв. постановлением Госкомсанэпиднадзора РФ от 31 октября 1996 г. № 46), включающий равномерную укладку семян на фильтровальную бумагу в чашке Петри диаметром 10 см, причем в каждую чашку Петри наливают по 5 мл исследуемой воды при 4-8-кратной повторности, при этом уровень жидкости в чашках должен быть ниже поверхности семян, затем чашки покрывают и помещают в термостат при температуре 20°С, а при отсутствии термостата эксперимент возможен в комнатных условиях, но тогда из-за колебаний температуры затрудняется сопоставление результатов, проводимых в различное время, эксперимент заканчивается через 72 часа, после чего измеряют длину корней.
Недостатком является то, что в сточных водах не учитывается концентрация нефти. Поэтому способ не применим для экологического нормирования. Однако достоинством является то, что на конкретных местах при биотестированпии сточных вод для орошения рекомендуется применять как тест-растения именно те культурные растения, которые произрастают и применяются в сельском хозяйстве на данном земельном участке.
Известен также способ испытания загрязнения воды по времени роста корней растения по патенту №2402765, включающий выбор тест-растения, например, в виде семян редиса красного круглого, равномерную укладку семян тест-растения на фильтровальную бумагу в контрольной и испытуемой чашке Петри диаметром 10 см, причем в каждую чашку Петри наливают по 5 мл воды при 4-8-кратной повторности полива, при этом уровень жидкости в чашках должен быть ниже поверхности семян, эксперимент заканчивают через 72 часа, после чего измеряют длину всех корней в каждой чашке Петри.
Недостатком является то, что в пробе воды рек и водоемов не измеряется до биотестирования концентрация нефти и поэтому неизвестно изменение длины корня тестируемого растения. При этом отсутствуют способы экологического нормирования до испытаний проб речной или иной воды
Технический результат - расширение функциональных возможностей биотестирования для экологического нормирования загрязнения воды нефтью и нефтепродуктами повышение точности показателей влияния нефти различной объемной концентрации в водном растворе на рост корней растения на конкретной территории, а в общем случае на рост корней общепринятого тест-растения - редиса красного круглого с белым кончиком.
Этот технический результат достигается тем, что способ биотестирования по длине корней тестового растения загрязненной нефтью воды, включающий выбор тест-растения, например, в виде семян редиса красного круглого, равномерную укладку семян тест-растения на фильтровальную бумагу в контрольной и испытуемой чашке Петри диаметром 10 см, причем в каждую чашку Петри наливают по 5,0 мл воды при 4-8-кратной повторности полива, при этом уровень жидкости в чашках должен быть ниже поверхности семян, эксперимент заканчивают через 72 часа, после чего измеряют длину всех корней в каждой чашке Петри, отличающийся тем, что общее количество испытуемых чашек Петри принимается по количеству значений объемной концентрации нефти в водном растворе, при этом в контрольной чашке Петри принимается проба воды с нулевой концентрацией нефти, следующие поливы семян в каждой чашке Петри в пределах 4-8-кратной повторности выполняют с возрастанием периода между ними, до очередного налива подготавливают водный раствор испытуемой нефти, для этого нефть заданного объема набирают и выливают в мерную колбу, после чего набирают и выливают воду в ту же мерную колбу, затем перемешивают содержимое колбы, а приготовленным раствором с заданной концентрацией нефти поливают семена тест-растения в чашке Петри в течение 72 часов, причем полив семян в первой испытуемой чашке Петри проводят при 4-8-кратной повторности одной и той же малой концентрацией нового водного раствора нефти, а в каждой последующей чашке Петри полив выполняют водным раствором нефти по возрастанию значения объемной концентрации до тех пор, пока после измерений длины корня всхожесть семян редиса красного круглого не превысит 50%, затем статистическим моделированием выявляют биотехническую закономерность изменения длины корня редиса красного круглого от объемной концентрации нефти по всей совокупности чашек Петри и каждой из них в отдельности.
До налива подготавливают водный раствор испытуемой нефти заданной концентрации для одной чашки Петри, для этого пробу нефти заданного объема в миллилитрах набирают градуированной пипеткой с помощью резиновой груши и выливают в мерную колбу, другой градуированной пипеткой набирают природную воду из близлежащего к нефтепроводу или нефтеперерабатывающему заводу и выливают в ту же мерную колбу, причем общий объем приготовленного нефтяного раствора, например, составляет 5,0 мл по таблице концентрации нефти в водном растворе:
| Объем нефти С, мл | 0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,6 | 0,8 | 1,0 |
| Объемная концентрация 100 С/5, % | 0 | 2 | 4 | 6 | 8 | 12 | 16 | 20 |
Следующие поливы семян в каждой чашке Петри в пределах четырехкратной повторности в комнатных условиях выполняют с возрастанием периода между ними за 72 часа в следующей последовательности:
| Номер полива | 1 | 2 | 3 | 4 | Измерение длины корня |
| Время с начала полива, ч | 0 | 12 | 36 | 60 | 72 |
По результатам измерений после полива семян в каждой чашке Петри водным раствором разной концентрации нефти по возрастанию ее значения с учетом контрольной чашки Петри с нулевой концентрацией нефти выполняют моделирование всхожести семян за 72 часа по формуле:
nпр=a1exp(-a2Сa3)cos(πС/(a4+a5Сa6)+a7)
где nпр - количество проросших семян редиса красного круглого, шт;
С - объемная концентрация нефти, %;
а 1…а 7 - параметры отдельных составляющих готовой статистической закономерности, принимающие конкретные значения для конкретных условий проращивания семян.
По максимальной длине корней у лидеров-проростков в каждой чашке Петри с разной объемной концентрацией нефти статистическим моделированием выявляют биотехническую закономерность:
Lmax=a1exp(-a2Сa3)
где Lmax - максимальная длина корня от лучшего по качеству семени в каждой чашке Петри, мм;
С - объемная концентрация нефти, %;
а 1…а 3 - параметры статистической модели.
Статистическим моделированием общую биотехническую закономерность изменения длины корня редиса красного круглого от объемной концентрации нефти по всей совокупности чашек Петри и по каждой в отдельности выполняют в виде обобщенного закона
L=L0exp(-a1Сa2) ,
где L0 - длина корня при поливе водным раствором с нулевой концентрацией
нефти, мм;
С - объемная концентрация нефти, %;
а1 - активность гибели естественной закономерности;
а2 - интенсивность снижения объемной концентрации нефти.
Сущность технического решения заключается в том, что экологическое нормирование устанавливает допустимое воздействие концентрации нефти и нефтепродуктов на природную среду, в том числе в случае аварийных разливов. Нормирование объемной концентрации нефти и нефтепродуктов выполняется методом тестирования по росту корней различных видов тестовых растений из общемирового списка, например, редиса красного круглого.
Сущность технического решения заключается также в том, что количество испытуемых чашек Петри принимается равным семи, то есть по количеству значений (надеемся, что они будут стандартизованы) объемной концентрации нефти в водном растворе. При этом общее количество чашек Петри в испытании равно восьми с учетом контрольной чашки Петри, за которую принимается проба воды с нулевой концентрацией нефти.
Сущность технического решения заключается также в том, что при проведении испытания устанавливается единый режим полива вне зависимости от конкретных территорий. Полив семян в каждой чашке Петри в пределах четырехкратной (для средней полосы Европейской части России, на землях юга страны пяти и даже больше кратной) повторности выполняют с возрастанием периода между ними. При этом время первого полива составляет условно (для шкалы времени полива) 0 часов, следующий полив через 12 часов, третий и четвертый полив через 36 и 60 часов соответственно от начала процесса полива, а после 72 часов (здесь мы взяли стандартизованное время по СанПиН, чтобы не путаться с предыдущим нашим изобретением) проращивания семян редиса красного круглого измеряют длину корня проростков.
Сущность технического решения заключается также в том, что метод косвенно определяет влияние заданной концентрации нефти в воде за 72 часа. Тем самым можно узнать экологический ущерб от потери растительности при аварийном разливе нефти и нефтепродуктов на местности конкретной территории, если измерить быстро объемную водную концентрацию разлива.
Положительный эффект достигается тем, что проводится косвенная оценка влияния проб воды с заданным содержанием нефти или нефтепродуктов, что позволяет определить степень возможного загрязнения нефтью и нефтепродуктами непроточных водных объектов, расположенных вблизи земель сельскохозяйственного назначения и населенных пунктов.
Новизна технического решения заключается в том, что эксперимент по проращиванию семян выполняют по изменению длины корня тест-растения при добавлении в пробу воды заранее перед поливом нефтью различной концентрации и свойств, а затем составляют таблицу влияния объемной концентрации нефти или нефтепродуктов на показатели тест-растения - максимальная длина корня и всхожесть семян.
Предлагаемое техническое решение обладает существенными признаками, новизной и значительным положительным эффектом. Материалов, порочащих новизну технического решения, нами не обнаружено.
На фиг.1 показаны 12 семян редиса красного круглого в чашке Петри при поливе водным раствором с объемной концентрации нефти равной 2%; фиг.2 - график распределения длины корня редиса красного круглого от объемной концентрации нефти по всей совокупности чашек Петри; на фиг.3 - график рангового распределения 12 семян в первой чашке Петри при объемной концентрации нефти, равной 0%; на фиг.4 - то же на фиг.3 во второй чашке Петри при объемной концентрации нефти, равной 2%; на фиг.5 - то же на фиг.3 в третьей чашке Петри при объемной концентрации нефти, равной 4%; на фиг.6 - то же на фиг.3 в четвертой чашке Петри при объемной концентрации нефти, равной 6%; на фиг.7 - то же на фиг.3 в пятой чашке Петри при объемной концентрации нефти, равной 8%; на фиг.8 - то же на фиг.3 в шестой чашке Петри при объемной концентрации нефти, равной 12 %; на фиг.9 - то же на фиг.3 в седьмой чашке Петри при объемной концентрации нефти, равной 16%; на фиг.10 - то же на фиг.3 в восьмой чашке Петри при объемной концентрации нефти, равной 20%; на фиг.11 - график распределения максимальной длины корня в каждой чашке Петри от объемной концентрации нефти; на фиг.12 - график изменения количества проросших семян растения в каждой чашке Петри в зависимости от объемной концентрации нефти.
Способ биотестирования по длине корней тестового растения искусственно загрязненной для экологического нормирования нефтью воды включает следующие основные действия.
Проводится отбор пробы природной воды на данной территории, ее консервация и подготовка. В лабораторных условиях проводится испытание биотестированием по длине корней тестового растения с добавлением в части пробы воды нефти и нефтепродуктов.
Семена тест-растения равномерно укладывают на фильтровальную бумагу в чашке Петри диаметром 10 см. В каждую чашку Петри наливают по 5,0 мл пробы воды при 4-8-кратной повторности, при этом уровень жидкости в чашках должен быть ниже поверхности семян, эксперимент заканчивают через 72 часа, после чего измеряют длину всех корней в каждой чашке Петри.
Общее количество испытуемых чашек Петри принимается по количеству значений объемной концентрации нефти в водном растворе, при этом в контрольной чашке Петри принимается проба воды с нулевой концентрацией нефти. Следующие поливы семян в каждой чашке Петри в пределах 4-8-кратной повторности выполняют с возрастанием периода между ними.
До очередного налива подготавливают водный раствор испытуемой нефти заданной концентрации для одной чашки Петри, для этого пробу нефти заданного объема в миллилитрах набирают градуированной пипеткой с помощью резиновой груши и выливают в мерную колбу, другой градуированной пипеткой набирают пробу воды и выливают в ту же мерную колбу, затем содержимое колбы перемешивают.
Приготовленным раствором с заданной концентрацией нефти поливают семена тест-растения в чашке Петри в течение 72 часов, причем полив семян в первой испытуемой чашке Петри проводят при 4-8-кратной повторности одной и той же малой концентрацией нового водного раствора нефти.
В каждой последующей чашке Петри полив выполняют водным раствором нефти по возрастанию значения объемной концентрации до тех пор, пока после измерений длины корня всхожесть семян тестируемого растения не превысит 50%. Затем статистическим моделированием выявляют биотехническую закономерность изменения длины корня растения от объемной концентрации нефти по всей совокупности чашек Петри и каждой из них в отдельности.
Способ биотестирования по длине корней редиса круглого красного загрязненной нефтью, например, проб воды с заранее заданной объемной концентрацией нефти, включает следующие действия.
Проводится отбор пробы воды, например речной воды из непроточных мест (стариц и других водоемов, пойменных лугов и др.), ее консервация и подготовка.
В лабораторных условиях проводится испытание биотестированием по длине корней тестового растения - редиса красного круглого.
Семена редиса красного круглого равномерно укладывают на фильтровальную бумагу в чашке Петри диаметром 10 см. В каждую чашку Петри наливают по 5,0 мл пробы речной воды при 4-8-кратной повторности, при этом уровень жидкости в чашках должен быть ниже поверхности семян, эксперимент заканчивают через 72 часа, после чего измеряют длину всех корней в каждой чашке Петри.
Общее количество испытуемых чашек Петри принимается по количеству значений объемной концентрации нефти в водном растворе, при этом в контрольной чашке Петри принимается проба речной воды с нулевой концентрацией нефти.
До очередного налива подготавливают водный раствор испытуемой нефти заданной концентрации для одной чашки Петри, для этого пробу нефти заданного объема в миллилитрах набирают градуированной пипеткой с помощью резиновой груши и выливают в мерную колбу, другой градуированной пипеткой набирают речную воду и выливают в ту же мерную колбу, причем общий объем приготовленного нефтяного раствора, например, составляет 5,0 мл по таблице концентрации нефти в водном растворе:
| Объем нефти С, мл | 0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,6 | 0,8 | 1,0 |
| Объемная концентрация 100С/5, % | 0 | 2 | 4 | 6 | 8 | 12 | 16 | 20 |
Приготовленным раствором с заданной концентрацией нефти поливают семена редиса красного круглого в чашке Петри в течение 72 часов, причем полив семян в первой испытуемой чашке Петри проводят при 4-8-кратной повторности одной и той же малой концентрацией нового водного раствора нефти. Следующие поливы семян в каждой чашке Петри в пределах четырехкратной повторности в комнатных условиях выполняют с возрастанием периода между ними за 72 часа в следующей последовательности:
| Номер полива | 1 | 2 | 3 | 4 | Измерение длины корня |
| Время с начала полива, ч | 0 | 12 | 36 | 60 | 72 |
В каждой последующей чашке Петри полив выполняют водным раствором нефти по возрастанию значения объемной концентрации до тех пор, пока после измерений длины корня всхожесть семян редиса красного круглого не превысит 50%.
По результатам измерений длины корня редиса красного круглого после полива семян в каждой чашке Петри водным раствором разной концентрации нефти выполняют моделирование всхожести семян за 72 часа по формуле:
nпр=a1exp(-a2Сa3)cos(πС/(a4+a5Сa6)+a7)
где nпр - количество проросших семян редиса красного круглого, шт;
С - объемная концентрация нефти, %;
а 1…а7 - параметры отдельных составляющих готовой статистической закономерности, принимающие конкретные значения для конкретных условий проращивания семян.
По максимальной длине корней у лидеров-проростков в каждой чашке Петри с разной объемной концентрацией нефти статистическим моделированием выявляют биотехническую закономерность:
Lmax=a1exp(-a2Сa3)
где Lmax - максимальная длина корня от лучшего по качеству семени в каждой чашке Петри, мм;
С - объемная концентрация нефти, %;
а 1…а 3 - параметры статистической модели.
Статистическим моделированием общую биотехническую закономерность изменения длины корня редиса красного круглого от объемной концентрации нефти по всей совокупности чашек Петри и по каждой в отдельности выполняют в виде обобщенного закона
L=L0exp(-a1Сa2) ,
где L0 - длина корня при поливе водным раствором с нулевой концентрацией нефти, мм;
С - объемная концентрация нефти, %;
а 1 - активность гибели естественной закономерности;
а 2 - интенсивность снижения объемной концентрации нефти.
Пример. Биотестирование по длине корней редиса красного круглого искусственно загрязненной нефтью воды проводили с использованием речной воды, пробу которой брали из реки Малая Кокшага.
В таблице 1 приведены данные проращивания в комнатных условиях (семена были посажены в 20 часов 13 февраля 2011 г.) независимых выборок из 12 семян редиса красного круглого с белым кончиком на восьми чашках Петри при поливе водным раствором нефти.
| Таблица 1 | ||||||||||||
| Длина корней редиса красного круглого после полива водным раствором нефти разной объемной концентрации | ||||||||||||
| Объемная концентрация нефти С, % | Длина корня 12 семян L, мм | |||||||||||
| 0 | 26 | 0 | 13 | 26 | 16 | 27 | 29 | 23 | 16 | 32 | 21 | 14 |
| 2 | 28 | 26 | 19 | 16 | 10 | 23 | 13 | 20 | 10 | 24 | 26 | 26 |
| 4 | 0 | 5 | 17 | 15 | 17 | 8 | 10 | 12 | 24 | 9 | 20 | 8 |
| 6 | 0 | 11 | 25 | 6 | 19 | 11 | 20 | 4 | 4 | 0 | 21 | 12 |
| 8 | 5 | 9 | 0 | 7 | 7 | 15 | 12 | 18 | 26 | 14 | 13 | 10 |
| 12 | 8 | 15 | 12 | 10 | 23 | 14 | 12 | 5 | 21 | 14 | 8 | 13 |
| 16 | 13 | 14 | 9 | 9 | 0 | 10 | 10 | 23 | 8 | 10 | 9 | 9 |
| 20 | 0 | 0 | 12 | 14 | 5 | 0 | 0 | 0 | 6 | 8 | 4 | 0 |
При проведении эксперимента на фильтровальную бумагу семена редиса красного круглого укладывали в чашке Петри диаметром 10 см. В каждую чашку Петри наливали по 5 мл пробы речной воды с добавлением нефти разной объемной концентрации при четырехкратной повторности.
До очередного налива подготавливали водный раствор испытуемой нефти заданной концентрации для одной чашки Петри. Для этого пробу нефти заданного объема в миллилитрах набирали градуированной пипеткой с помощью резиновой груши и выливают в мерную колбу, другой градуированной пипеткой набирали речную воду и выливали в ту же мерную колбу, содержимое колбы перемешивали.
Приготовленным раствором с заданной концентрацией нефти поливали семена редиса красного круглого в чашке Петри в течение 72 часов, причем полив семян в первой испытуемой чашке Петри проводили при 4-кратной повторности одной и той же малой концентрацией нового водного раствора нефти. Следующие поливы семян в каждой чашке Петри в пределах 4-кратной повторности в комнатных условиях выполняли с возрастанием периода между ними за 72 часа в следующей последовательности:
| Номер полива | 1 | 9 | 3 | 4 | Измерение длины корня |
| Время с начала полива, ч | 0 | 12 | 36 | 60 | 72 |
В каждой последующей чашке Петри полив выполняли водным раствором нефти по возрастанию значения объемной концентрации. Например, на фиг.1 показана испытуемая чашка Петри, в которой полив 12 семян редиса красного круглого проводили водным раствором с объемной концентрации нефти, равной 2%.
Измерение длины всех корней редиса красного круглого в каждой испытуемой чашке Петри проводили через 72 часа проращивания.
Закономерность распределения длины корня редиса красного круглого от концентрации нефти по всей совокупности получили в виде обобщенного закона гибели, то есть
L=20,64957exp(-1,09998С0,74558), (1)
где L - максимальная длина корня редиса красного круглого, мм;
С - объемная концентрация нефти, %.
На фиг.2 представлен график распределения длины корня редиса красного круглого от объемной концентрации нефти по всей совокупности чашек Петри. Из графика видно, что чем больше концентрация нефти, тем меньшие значения принимает длина корня редиса красного круглого. При снижении концентрации длина корня возрастает.
Длина корня принимает наибольшие значения при объемной концентрации нефти от 0 до 8%. При объемной концентрации 2% нефть оказывает малое влияние на рост корня редиса красного круглого.
Графики распределения длины корня редиса красного круглого от объемной концентрации нефти по каждой чашке Петри приведены на фиг.3-10.
Высокие коэффициенты корреляции уравнений убеждают в высокой адекватности полученных статистических моделей.
График распределения максимальной длины корня (табл.2) в каждой чашке Петри при поливе водным раствором разной концентрации нефти (фиг.11) также показывает снижение длины корня при увеличении концентрации и имеет закономерность в виде обобщенного закона гибели
Lmax=31,00617exp(-0,04506С0,83481), (2)
где Lmax - максимальная длина корня редиса красного круглого, мм;
С - объемная концентрация нефти, %.
| Таблица 2 | |
| Максимальная длина корня редиса красного круглого в каждой чашке Петри при разной объемной концентрации нефти | |
| Объемная концентрация нефти С, % | Максимальная длина корня L, мм |
| 0 | 32 |
| 2 | 28 |
| 4 | 24 |
| 6 | 25 |
| 8 | 26 |
| 12 | 23 |
| 16 | 23 |
| 20 | 14 |
Максимальное количество не проросших семян приходится на большую концентрацию нефти (табл.3). При объемной концентрации нефти 20% количество не проросших семян редиса красного круглого составило 50%. Поэтому дальнейшее увеличение концентрации нефти не проводилось и количество испытуемых чашек Петри с учетом контрольной при проведении биотестирования редисом красным круглым приняли равным восьми.
| Таблица 3 | ||||||||
| Концентрация нефти в водном растворе и всхожесть семян | ||||||||
| Объемная концентрация нефти С, мл | 0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,6 | 0,8 | 1,0 |
| Относительная концентрация 100С/5, % | 0 | 2 | 4 | 6 | 8 | 12 | 16 | 20 |
| Абсолютная всхожесть (из 12 шт.) nпр, шт. | 11 | 12 | 11 | 10 | 11 | 12 | 11 | 6 |
| Относительная всхожесть 100 nпр /12, % | 91,67 | 100 | 91,67 | 83,33 | 91,67 | 100 | 91,67 | 50,00 |
Идентификацией биотехнического закона была получена закономерность, представленная в виде следующей модели всхожести
nпр=10,33736exp(0,03182С)cos(πС/51,71648), (3)
где nпр - количество проросших семян редиса красного круглого, шт;
С - концентрация нефти, %.
Полученная модель (3) показывает волновое возмущение семян редиса красного круглого к содержанию нефти.
Из графика распределения проросших семян редиса красного круглого от концентрации нефти (фиг.12) также видно, что небольшие концентрации нефти не значительно влияют на всхожесть семян, но увеличение концентрации приводит их к гибели.
Проведенные испытания свидетельствуют о снижении роста корней редиса красного круглого при загрязнении речной воды нефтью. Выявлено закономерное уменьшение длины корня редиса красного круглого при увеличении концентрации нефти. Наибольшее количество не проросших семян растения отмечалось в чашке с большей концентрацией нефти.
Предлагаемый способ с высокой точностью описывает влияние нефти на распределение длины корня проростка при загрязнении речной воды.
Применение предложенного способа расширяет возможности экологического мониторинга для выявления и оценки опасных уровней загрязнения водных объектов нефтью, в том числе в результате аварийного загрязнения.
1. Способ оценки опасных уровней загрязнения водных объектов нефтью по длине корней тестового растения загрязненной нефтью воды, включающий выбор тест-растения, равномерную укладку семян тест-растения на фильтровальную бумагу в контрольной и испытуемой чашке Петри диаметром 10 см, причем в каждую контрольную и испытуемую чашку Петри наливают по 5,0 мл воды при 4-8-кратной повторности полива, при этом уровень жидкости в чашках должен быть ниже поверхности семян, эксперимент заканчивают через 72 ч, после чего измеряют длину всех корней в каждой чашке Петри, отличающийся тем, что в контрольной чашке Петри принимается проба воды с нулевой концентрацией нефти, а в испытуемых чашках до полива подготавливают водные эмульсии испытуемой нефти с разными концентрациями, затем приготовленными водными эмульсиями с заданной концентрацией нефти поливают семена тест-растения в чашках Петри в течение 72 ч, причем концентрацию нефти в разных водных эмульсиях увеличивают до тех пор, пока в момент измерений длины корня всхожесть семян редиса красного круглого не будет ниже 50%.
2. Способ оценки опасных уровней загрязнения водных объектов нефтью по длине корней тестового растения загрязненной нефтью воды по п.1, отличающийся тем, что до налива подготавливают водную эмульсию испытуемой нефти заданной концентрации для одной чашки Петри, для этого пробу нефти заданного объема в миллилитрах набирают градуированной пипеткой с помощью резиновой груши и выливают в мерную колбу, другой градуированной пипеткой набирают природную воду из близлежащего к нефтепроводу или нефтеперерабатывающему заводу водного объекта и выливают в ту же мерную колбу.
3. Способ оценки опасных уровней загрязнения водных объектов нефтью по длине корней тестового растения загрязненной нефтью воды по п.1, отличающийся тем, что следующие после первого поливы семян в каждой контрольной и испытуемой чашках Петри в комнатных условиях выполняют с возрастанием периода между поливами за 72 ч в последовательности 12, 36 и 60 ч.
www.findpatent.ru
| VII Межрегиональный интернет-конкурс для школьников «Химия настоящего и будущего» Исследовательская работа Тема: «Биотестирование природных вод ЗАТО г.Зеленогорска по проросткам различных растений-индикаторов» Автор: Дебдин Вадим, 8 класс, МБОУ ЦДОД «Перспектива», г.Зеленогорск Красноярского края Руководитель: Дебдина Маргарита Анатольевна, педагог дополнительного образования г. Томск, 2013 Оглавление Введение, цель, задачи……………………………………………………………………...3 Глава 1. Литературный обзор……………………………………………………………....4
2.1. Методика полива проростков тест-растений испытуемой водой………………….10 2.2. Метод накапывания испытуемой воды между семядолями………………………...13 Выводы……………………………………………………………………………………..18 Список источников………………………………………………………………………..19 Приложения………………………………………………………………………………..20 «Я утверждаю, что все рождающееся от земли живет за счет земной влаги, и в каком состоянии находится эта влага, в таком состоянии находится и растение» Гиппократ Ведение Эти слова, сказанные Гиппократом еще в глубокой древности, не потеряли свою актуальность и сейчас. В наше время общество осознало опасность токсического загрязнения поверхностных вод и пришло к необходимости введения в практику мониторинга совершенно новых нетрадиционных подходов, в частности биологического тестирования. Биотестирование - исследование влияния различных веществ на живые организмы. Широкое внедрение методов биотестирования в практику оценки качества вод – настоятельная необходимость времени, так как никакая даже самая современная аналитическая химия не даст полной информации о токсичности среды. К тому же анализ существующих методов оценки качества природных вод показал, что биотестирование – наиболее точный, быстрый и дешёвый способ охраны природных вод. [1] В своем исследовании с помощью данного метода мы решили выяснить, в каком же состоянии находится вода нашего города, которую мы пьем и которой поливаем растения, используемые нами в пищу. Гипотеза: с помощью методов биотестирования можно оценить степень загрязнения природных вод. Объект исследования: степень загрязнения природных вод г.Зеленогорска. Предмет исследования: однолетние растения семейства Злаковые (Gramíneae) – овёс, ячмень, пшеница, однолетние растения семейства Капустные, или Крестоцветные (Brassicaceae) - кресс-салат и редис. Цель данной работы - оценить загрязнение природных вод г.Зеленогорска по проросткам различных растений-индикаторов. Задачи:
Существуют различные физические и химические методы определения токсичности окружающей среды, но в последнее время стали широко использоваться и биологические методы позволяющие провести оценку состояния живых организмов (Приложение 1). Ведь говоря о загрязнении воды, почвы, атмосферы, об их токсичности мы имеем в виду, то насколько они благоприятны для обитания в них живых организмов, для здоровья человека. К числу наиболее радикальных приёмов относятся методы токсикологического биотестирования. Под биотестом понимается испытание в строго определённых условиях действия вещества или комплекса веществ на водные организмы посредством регистрации изменений того или иного биологического показателя исследуемого объекта по сравнению с контролем. Исследуемые организмы называются тест-объетами, а опыт биотестированием (Лысенко, 1996). Этот дешевый и универсальный метод в последние годы широко используется во всем мире для оценки качества объектов окружающей среды. В России с 1996 года начат эксперимент по внедрению методов биотестирования сточных вод, сбрасываемых в природные водоемы и подаваемых на сооружения биологической очистки.[5] С помощью биотестирования можно получить данные о токсичности конкретной пробы, загрязненной химическими веществами антропогенного или природного происхождения. Этот метод позволяет дать реальную оценку токсичности свойств какой-либо среды, обусловленной присутствием комплекса загрязняющих веществ и их метаболитов. Живые организмы всегда в той или иной степени реагируют на изменение окружающей среды, но в ряде случаев это нельзя выявить физическими или химическими методами, так как разрешающие возможности приборов или химических анализов ограничены. Чувствительные же организмы – индикаторы реагируют не только на малые дозы экологического фактора, но и дают адекватную реакцию на воздействие комплекса факторов (Груздева, 2002). [3] Биотестирование позволяет установить районы и источники загрязнения. В качестве тест-объектов используются бактерии, водоросли, высшие растения, пиявки, дафнии, моллюски, рыбы и другие организмы. В порядке возрастания толерантности к загрязнениям организмы располагаются в следующий ряд: грибы, лишайники, хвойные, травянистые растения, листопадные растения. Каждый из них имеет преимущества, но, ни один не является универсальным, самым чувствительным ко всем веществам. Для гарантированного выявления присутствия в природных водах токсического агента неизвестного химического состава нужно использовать набор тест-объектов, представляющих различные группы организмов. При выборе тест-организмов исходят из видовой токсичности возможных загрязнителей, особенностей водоема и требований водопотребителей. Для тест-организмов могут быть выделены частные интегральные тест-функции. Интегральные параметры характеризуют состояние системы наиболее обобщённо. Для организмов к интегральным относят характеристики выживаемости, роста, плодовитости. Частными для организма, например, могут быть физиологические, биохимические и гистологические параметры. [6]
В 1991г. биотестирование введено как обязательный элемент контроля качества поверхностных вод, что предусмотрено «Правилами охраны поверхностных вод» (1991). Показатели биотестирования природных вод включены в перечень показателей для выявления зон чрезвычайной экологической ситуации и зон экологического бедствия (Туманов, Постнов, 1983). [9] Методы биотестирования представляют собой характеристику степени воздействия на водные биоценозы. Так, А.М. Гродзинский Д.М. Гродзинский (1973) описывают ряд биологических проб для тестирования токсичности природных вод. [2] Согласно принятому определению, биотестирование воды – это оценка качества воды по ответным реакциям организмов, являющихся тест-объектами. Тест на прорастание семян применяется для установления воздействия различных физиологически активных веществ. В качестве индикаторов токсичности используются семена сельскохозяйственных растений. Среди сельскохозяйственных культур наиболее чувствительны салат, люцерна, злаковые, крестоцветные, а к нечувствительным видам относят кукурузу, виноград, розоцветные, подорожник (Рамад,1981). [6] Методы биотестирования должны отвечать следующим требованиям: относительная быстрота проведения, получение достаточно точных и воспроизводимых результатов, наличие, пригодных для индикации объектов в большом количестве. В настоящее время хорошо известны методы биотестирования, ориентированные на определение токсичности водной среды, обусловленной присутствием определенных групп химических соединений, в частности фосфорорганических. Наиболее апробирован на природных водах ферментативный метод В.И. Козловской. [4]
Методами биотестирования выявляется токсичность, которая является интегральным показателем загрязнения природных сред. Как и все интегральные показатели, они имеют тот недостаток, что не раскрывают индивидуальные загрязняющие вещества, присутствующие в пробе. Работ по биотестированию водной среды опубликовано множество, но они были сделаны главным образом с целью оценки токсичности вновь синтезируемых химических препаратов, препаратов, приобретаемых по импорту, а также при разработке регламентов на химические соединения. Гораздо меньше публикаций по биотестированию сточных вод и ещё меньше – по биотестированию природных вод (Никаноров, Хоружая, 2001). [1] Методы биоиндикации, позволяющие изучать влияние техногенных загрязнителей на растительные и животные организмы на неживую природу являются наиболее доступными. Биоиндикация основана на тесной взаимосвязи живых организмов с условиями среды, в которой они обитают. Изменения этих условий, например повышение солености или рН воды может привести к исчезновению определенных видов организмов, наиболее чувствительных к этим показателям и появлению других, для которых такая среда будет оптимальной. [2] Существуют разные биологические индикаторы. О наличии некоторых загрязнителей можно судить по внешним признакам растений и животных. Благодаря «памяти» этих организмов, можно узнать и о роли тех факторов, которые в настоящее время уже не действуют. Например, появление черных пятен на листьях липы рассказывает о том, что в зимнее время дворники чрезмерно увлекались посыпанием снега солью для ускорения его таяния, о выбросах сернистого газа расскажут пятна на листьях подорожника большого. По ширине годичных колец сосен в окрестностях химического предприятия можно определить, в какие годы завод особенно сильно загрязнял среду. В годы сильного загрязнения атмосферы закладываются более тонкие кольца. По высоте некоторых растений можно судить о концентрации солей в воде. Так, например, тростник может достигать высоты 4 м, но если содержание солей в воде высокое — это растение не вырастет более чем на 0,5 м. Индикаторами загрязнения атмосферы являются некоторые мхи и лишайники. Например, при анализе лишайников в Швеции было установлено появление радиоактивной пыли от Чернобыльской АЭС. Существуют специальные живые приборы — бриометры — маленькие коробочки со мхами определенных видов, по которым определяют режим задымления атмосферы. [9] Глава 2. Основная часть. Материалы и методы, порядок выполнения работы Исследования проводились по методикам, предложенным А.И. Федоровой и А.Н. Никольской в «Практикуме по экологии и охране окружающей среды», 2003, а также в учебном пособии для вузов «Экологический мониторинг» под редакцией Т.Я. Ашихминой, 2005. [7] [8] Работа по изучению метода биотестирования токсичности природных вод по проросткам растений индикаторов выполнялась в течение 2012 года. Все исследования по теме проводились в лаборатории ПУ №39 г.Зеленогорска в дневное время, при сочетании искусственного и естественного освещения в стандартных, оптимальных для тест-растений условиях. Оценить уровень загрязнения водоемов можно, используя тест на прорастание семян. Такое тестирование проводится как предварительное для выявления особенно загрязненных водоемов с целью последующего химического анализа. В качестве тест-растений были использованы проростки высших растений: пшеницы, ячменя, овса, кресс-салата, редиса. Предлагаемый метод биологической оценки токсичности природных вод по проросткам растений индикаторов проводился в двух вариантах: 1.Полив проростков тест-растений испытуемой водой. 2. Накапывание испытуемого раствора между семядолями двудольных растений. В качестве тест-растений в первом варианте применяли семена пшеницы, овса, ячменя. Во втором варианте были использованы только проростки двудольных растений: кресс-салата, редиса. Из всех используемых в исследованиях растений кресс-салат обладает повышенной чувствительностью к загрязнению воды тяжелыми металлами. Этот биоиндикатор отличается быстрым прорастанием семян и почти 100% всхожестью, которая заметно уменьшается в присутствии загрязнителей. Кроме того, побеги и корни кресс-салата под действием загрязнителей подвергаются заметным морфологическим изменениям (задержка роста и искривление побегов, уменьшение длины и массы корней) (Голубкина, 2008). [9] С целью профилактики перед проращиванием семена протравливали. Сухие семена погружали в 1%-ный раствор марганцовокислого калия на 0,5 часа, а затем промывали дистиллированной водой, используя два слоя марли, обсушивали на фильтровальной бумаге на воздухе. 2.1. Метод полива проростков тест-растений испытуемой водой (1 вариант) За 2-3 дня до опытов (сроки прорастания семян выяснялись заранее) семена тестовых объектов, пшеницы, овса, ячменя, замачивались на сутки в воде. Затем раскладывались пинцетом зародышем вверх (в одном направлении) в кювету, на дно которой был уложен слой гигроскопической ваты, а сверху – два слоя фильтровальной бумаги. Система увлажнялась водопроводной водой до полной влагоёмкости. Для этого вода наливалась под вату, а после её впитывания удалялся избыток. Кювета накрывалась плёнкой, края плёнки подгибались под кювету. Проращивание производилось при температуре +250С - +260С до размера основной массы проростков 10-15мм и появления корней, после чего ростки разделяют на фракции по длине. В стаканчики помещают одинаковое количество промытого и покалённого песка, в каждый стаканчик высаживают по 10 одинаковых проростков тест-растений. Песок поливают сверху одинаковым количеством испытуемой воды из разных водоёмов. Повторность – трёхкратная. Контроль – полив отстоянной и очищенной водопроводной водой. После достижения ростками высоты 8-10см их выкапывают, обсушивают фильтровальной бумагой, разделяют бритвой на части (стебель, корни), измеряют и взвешивают. Данные обрабатывают статистически, выражают в процентах к контролю. 2.2. Метод накапывания испытуемой воды между семядолями (2 вариант) Воду, взятую из различных источников, концентрируют упариванием в 10 раз, хранят в холодильнике. Стаканчики наполняют одинаковым количеством промытого и прокалённого песка, вставляют стеклянную трубочку до дна, через которую производят полив, отстоянной водопроводной водой. 18-20 штук всхожих семян (кресс-салат, редис) высевают на небольшую глубину. После того, как ростки взойдут и раскроются семядоли, в стаканчиках оставляют по 10 одинаковых растений, остальные выщипывают пинцетом. Все стаканчики ставят в ящичек из фанеры с бортиками, на 5см превышающими ростки в стаканчиках. У микропипеток в 1 мл вытягивают кончик, нагревая его в пламени спиртовки и используя для оттягивания пинцет. Затем затачивают кончик на тонкозернистом брусочке, чтобы образовалось отверстие, дающее небольшую каплю. Накапывают по 1 капле испытуемого вещества между семядолями, прикрывают ящичек пленкой, не сдвигая стаканчики с места. Операцию повторяют 2-3 раза через 1-2 дня (до появления третьего настоящего листа). Повторность - трёхкратная. Контроль – накапывание дистиллированной водой. Полив субстрата для выращивания производят одинаковым количеством воды через трубочку, используя воронку из фольги. Через 2-3 недели осторожно выкапывают проростки, промывают, обсушивают фильтровальной бумагой, измеряют и взвешивают отдельно надземную часть и корни. Данные обрабатывают статистически, выражают в процентах к контролю. Метод полива проростков тест-растений испытуемой водой (1 вариант) Соотношение между продуктивностью растений и токсичностью почвы определялось после измерения и взвешивания проростков тест – растений. Нами были получены данные, которые после статистической обработки выражены в процентах по отношению к контролю и приведены в таблице 1. Таблица 1 Развитие проростков тест-растений при поливе их испытуемой водой (весенний период)
Токсическое действие пробы считается доказанным, если в эксперименте зафиксирован токсический эффект торможения роста проростков, а именно их корней на 50 % (Груздева, 2002). [9] Из данных таблицы 1 видно, что наиболее благоприятной для роста и развития проростков тест-растений является проба № 2 – вода пос. Орловка. По степени роста и вегетативной мощности проростков можно сделать вывод о том, что в пробе № 1 (родник пос. Усовка) наблюдается торможение роста корней проростков больше чем на 50 % по сравнению с контролем, следовательно, токсичность пробы № 1 высокая. В пробе № 3 (родник пос. Сокаревка), наблюдается торможение роста и надземной части и корней проростков больше чем в пробе №1, поэтому токсичность пробы № 3 очень высокая. Таблица 2 Развитие проростков тест-растений при поливе их испытуемой водой (осенний период)
Из данных, представленных в таблице 2, видно, что в осенний период в большей степени наблюдается угнетение развития проростков в пробе № 3 – родник пос. Сокаревка, торможение роста корней проростков в данной пробе более чем на 60% по сравнению с контролем. В пробах № 1 – родник пос. Усовка и №2 – вода пос. Оловка также отмечается снижение в развитии вегетативных органов проростков. В ходе последующей обработки материалов, по результатам, полученным в первом варианте исследований, были построены диаграммы биотестовых испытаний. Рис. 1 Соотношение длины проростков тест-растений при поливе их испытуемой водой (весна, осень 2012г.) Рис. 2 Соотношение массы проростков тест-растений при поливе их испытуемой водой (весна, осень 2012.г.) Таким образом, из результатов, полученных в 1 варианте, можно сделать выводы:
Метод накапывания испытуемой воды между семядолями (2 вариант) Данные, полученные при выполнении исследований в этом варианте, были обработаны статистически и выражены в процентах по отношению к контролю принятому за 100%. Результаты представлены в таблице 3. Таблица 3 Развитие проростков тест-растений при накапывании испытуемой воды между семядолями (весенний период)
По изменению надземной массы в опытных пробах по сравнению с контролем можно судить о токсичности данной пробы воды. Сильное угнетение надземной части растений тест-растений, более 20% по сравнению с контролем, показывает высокую степень токсичности пробы воды (Голубкина, 2008). [9] Высокая токсичность наблюдается в пробе №3 – родник пос. Сокаревка. У проростков наблюдается торможение развития надземной части на 53-55% больше чем в контрольной пробе. Пробы №1 - родник пос. Усовка и №2 – вода пос. Орловка также токсичны, но в меньшей степени. Таблица 4 Развитие проростков тест-растений при накапывании испытуемой воды между семядолями (осенний период)
Из данных таблицы 4 видно, наиболее токсична проба №3 – родник пос. Сокаревка. Токсична проба воды №1 – родник пос. Усовка. Проба №2 – вода пос. Орловка имеет очень слабую токсичность. По результатам, полученным во 2 варианте исследований, были построены диаграммы биотестовых испытаний. Рис. 3 Соотношение длины проростков при накапывании испытуемой водой между семядолями (весна, осень 2012г.) Рис.4 Соотношение массы проростков при накапывании испытуемой водой между семядолями (весна, осень 2012 г.) Рис. 5 Зависимость длины проростков тест-растений от степени токсичности природных вод Рис. 6 Токсичность природных вод (весна, осень 2012 г.) По результатам исследований во 2 варианте можно сделать выводы:
Таким образом, гипотеза о возможности оценки с помощью методов биотестирования степени загрязнения природных вод нашла свое подтверждение. На данном этапе работы в результате проведенного эксперимента без специального дорогостоящего оборудования, приборов и реактивов были установлены уровни загрязнения воды ЗАТО г.Зеленогорск. Наша работа может иметь продолжение в следующем учебном году. Для устранения погрешностей результата, на базе лаборатории можно провести химический анализ воды и еще раз проанализировать ситуацию. Данный метод анализа природных вод можно рекомендовать садоводам-любителям и всем интересующимся данной проблемой жителям нашего города. Список источников
Приложение 1 Таблица 1 Основные характеристики методов оценки токсичности вод
Приложение 2 Таблица 2 Область применения методов биотестирования токсичности водной среды
| |||||
koledj.ru
Исследование качества воды методом биотестирования
Слайд 1
Исследование качества воды методом биотестирования. Работа выполнена: Катериненко Марией Вадимовной. Класс 8 «А». ГБОУ Школа №359. Руководитель: Набатова А.В.Слайд 2
Цель исследования: Изучить возможности применения биотестирования как способа оценки качества воды.
Слайд 3
Задачи исследования: Знать особенности инфузории туфельки как тест-объекта. Понимать механизм воздействия на тест-объект, вызывающий ответную реакцию. Уметь проводить эксперимент.
Слайд 4
Задачи исследования: Сравнивать реакцию тест-объекта в различных пробах воды. Оценивать полученные результаты. Делать выводы на основе полученных результатов.
Слайд 5
Биотестирование. Биотестирование - это определение степени опасности среды с помощью биологических объектов: водорослей, простейших и пр.
Слайд 7
Строение Инфузории туфельки: 1. большое ядро; 2. малое ядро; 3 - реснички; 4 - предротовое углубление; 5 - пищеварительные вакуоли; 6 - порошица; 7 - выделительные вакуоли с приводящими канальцами.
Слайд 8
Среда Лозина-Лозинского. Дистиллированная вода - 100 мл; 0,1 г - NaC l ; 0,01 г - КС l ; 0,01 г – СаС l 2 ; 0,01 г - MgC l 2 ; 0,02 г – NaHCO 2 .
Слайд 9
Подсчёт Инфузорий Туфелек в капле воды.
Слайд 10
Биотестирование.
Слайд 11
Итоги исследования:
Слайд 12
Вывод: Качество сырой воды дало самые низкие результаты. Кипяченая вода показала самые лучшие результаты. Бутилированная вода - средний показатель. Качество фильтрованной воды не является показательным в данном исследовании.
Слайд 13
Список литературы Бухвалов В.,Богданова Л.Экологическая экспертиза.-М.:ЛА Варяг,1995 Грин Н., Стаут У., Тейлор Д. Биология в 3-т. Под ред. Р. Сопера. – М.:Мир, 1996 Догель В.А. Зоология Беспозвоночных.-М.:Высшая школа,1981 Жизнь животных.Т.1.-М.:Просвещение,1986 Захаров И.С.,Величко А.Н. Исследование возможности применения температурных популяционных реакций инфузорий как информативных показателей вредных факторов в среде.-СПб:ИБРР,2013 Захаров И.С., Пожаров А.В. Биотехнические методы охраны окружающей среды. -СПб: Изд-во СПбГЭТУ «ЛЭТИ», 2001 Захаров И.С., Пожаров А.В., Сидоренко В.М. Экспрессные методы интегральной оценки экологического состояния объектов окружающей среды. СПб: Изд-во СПбГЭТУ «ЛЭТИ», 2007. Энциклопедия для детей Т.2.Биология.-М.:Аванта+,1999 http://chemister.ru/Database/words-description.php?dbid=1&id=49 http://www.bioind.narod.ru/Articles/guppi.htm http://ru.wikipedia.org/wiki/%D0%91%D0%B8%D0%BE%D0%B8%D0%BD%D0%B4%D0%B8%D0%BA%D0%B0%D1%86%D0%B8%D1%8F
Слайд 14
Спасибо за внимание!
nsportal.ru