Технология микроклонального размножения хризантемы в условиях in vitro. Лаборатория микроклонального размножения растений
О ЛАБОРАТОРИИ
опубликовано 29.06.2016

Микропобеги жимолости в условиях in vitro
Основным направлением деятельности лаборатории клонального микроразмножения является разработка методов получения оздоровленного высококачественного посадочного материала декоративных, нетрадиционных садовых и ягодных растений в культуре in vitro.
Клональное микроразмножение – многочисленное бесполое размножение растений в культуре тканей и клеток, при котором появляющиеся формы растений генетически идентичны исходному экземпляру. Метод заключается в способности растительной клетки проявлять свойство тотипотентности, то есть под влиянием внешних факторов давать начало целому растительному организму.
Достоинства метода заключается в том, что сокращается продолжительность селекционного процесса, ускоряется переход растений от ювенильной к репродуктивной фазе развития, создается возможность проведения работ в течении года и экономия площадей, необходимых для выращивания посадочного материала
Растения, полученные с помощью культуры ткани, имеют преимущества перед растениями, полученными путем зеленого черенкования, за счет большей скорости роста, гармоничной архитектонике куста, лучшего развития корневой системы, освобождением растений от грибной и бактериальной инфекции.
Лаборатория клонального микроразмножения оснащена новейшим оборудованием необходимым для работы: боксы абактериальной воздушной среды «Ламинар-С», автоклав MLS-3020U, воздушный стерилизатор ГП-80 МО, вытяжной шкаф В-201, а также лабораторная посуда и инструменты для работы с растительными объектами.
В лаборатории работают: лаборанты-исследователи Оксана Александровна Сироткина, Мария Игоревна Кицур и Елена Андреевна Дымовских.

Справа налево: С.А.Колесников, Д.М. Брыксин, О.А.Сироткина, М.И.Кицур.

Сотрудники лаборатории в культуральной. Справа налево: О.А. Сироткина, Д.М. Брыксин, М.И.Кицур.

Лаборант исследователь — Мария Игоревна Кицур в культуральной.

Процесс введения в культуру in vitro эксплантов сотрудниками лаборатории.

Справа налево: С.А.Колесников, Д.М. Брыксин, О.А.Сироткина, М.И.Кицур.

Процесс пересадки полученных эксплантов в стерильных условиях(М.И. Кицур)

Лаборант исследователь Оксана Александровна Сироткина.

Лаборант исследователь Оксана Александровна Сироткина.

Автоклавирование питательной среды.

М.И.Кицур, Д.М. Брыксин,С.А.Колесников, О.А.Сироткина.

Нарезка микрочеренков жимолости в стерильных условиях.

Введеный в культуру in vitro эксплант облепихи.

Процесс введения эксплантов облепихи в культуру in vitro в стерильных условиях.

Пересадка микропобегов жимолости в стерильных условиях. Лаборант-исследователь — Е.А.Дымовских.

Введение эксплантов облепихи в культуру in vitro.

Микропобеги актинидии на агаризированной питательной среде.

Микропобег аронии на этапе введения культуру in vitro.

Микропобеги аронии на агаризированной питательной среде.

Микропобеги актинидии на агаризированно питательной среде.

Резогенез жимолости.

Введенные в культуру in vitro экспланты актинидии.

Резогенез жимолости.

Введенные в культуру in vitro экспланты актинидии.

Микропобеги жимолости на этапе размножения в условиях in vitro.

Микропобеги жимолости на этапе размножения в условиях in vitro.

Микропобеги жимолости на этапе размножения в условиях in vitro.

Общий вид микрорастений под светодиодным освещением в лаборатории миклоклонального размножения.

Микропобеги аронии (черноплодной рябины) на агаризированной питательной среде.

Ризогенез жимолости в условиях in vitro.

Этапы формирования растений от введения до укоренения.
agropit.ru
ООО "Ягодная лаборатория" - In Vitro
Лаборатория In Vitro
Что мы делаем, если хотим посадить на своем участке то или иное растение? Обычно мы покупаем семена или готовую рассаду для выращивания трав и овощей, саженцы – для посадки кустарников и деревьев, рассаду или луковицы – для выращивания цветов. Часто ли мы задумываемся над тем, каким образом получена рассада? Оказывается, помимо традиционных черенкования, прививок, выращивания из семян, размножения корневищами, луковицами и т.д. в большинстве стран рассаду многих растений сегодня получают путем микроклонального размножения. Особенно широко этот способ применяется для выращивания растений, которые плохо поддаются размножению другими способами. Также этот метод незаменим, если необходимо постоянно получать в достаточно короткие сроки значительное количество качественной рассады.
С помощью микроклонального размножения (другое название метода – меристемное размножение) выращивают декоративные и плодово-ягодные растения, комнатные и срезочные цветы, картофель и прочие овощи.
Микроклональное размножение растений широко применяется в США, Голландии, Польше, Франции, Японии, Таиланде. В России также накоплен большой опыт по меристемному размножению важных для сельского хозяйства видов растений. Практически во всех российских научно-исследовательских институтах и селекционных центрах созданы лаборатории для микроклонального размножения и оздоровления селекционного материала. Относительно недавно меристемные технологии начали применяться крупными питомниками растений и сельхозпредприятиями. В России наиболее широкое применение меристемная технология пока нашла в получении здоровых семян картофеля.

О методе
Меристема (от греч. meristos — делимый) — это ткань растений, в течение всей жизни сохраняющая способность к образованию новых клеток. Именно за счет меристемы растения растут, образуют новые листья, стебли, корни, цветки.
В процессе роста меристемная ткань в определенной степени сохраняется в некоторых частях растения: в узлах побега, в почках, в кончиках корней, в основаниях черешков листьев или цветоносах и т.д.
Преимущества растений, полученных микроклональным размножением:
- Такие растения более здоровые. Они не поражаются вирусами, даже если меристемные ткани были взяты у зараженного растения, так как вирус не поражает меристемы на верхушках побегов.
- Урожайность меристемных саженцев выше. Например, с обычного кустика клубники можно собрать 200–300 г ягод, а с меристемного – до 1 кг.
- Микроклональное размножение дает возможность получения огромного количества однородных растений за время, при котором не даст того же результата не один другой метод.
- Меристемное размножение становится единственно возможным в больших промышленных масштабах, если для размножения берутся растения, которые стерильны и не дают семенного потомства.

Меристемным методом растения размножают в 4 этапа:
- Введение: меристемные ткани отделяют от нужного экземпляра растения и помещают на специальные питательные среды в пробирки. Затем меристемные растения выдерживают в специальном шкафу в течение 20-40 дней при освещении до 14 ч. в сутки.
- Размножение: через 1-1,5 месяца микрочеренки уже имеют размер горошины, у них образовались зачатки всех вегетативных органов растений. Подрощенные микрочеренки делят на пять-семь частей, а «кусочки» (вновь полученные меристемные черенки) снова проращивают в пробирках в течение 20-30 дней.
- Укоренение и адаптация: когда меристемные микрочеренки образуют достаточную корневую систему, их извлекают из пробирок и пересаживают в горшочки, заполненные легким торфом. Затем горшочки устанавливают в защищенную среду — достаточно использовать небольшую пластиковую трубку. Через 4-6 недель микрочеренки привыкают к естественным условиям выращивания.
- Подращивание: после укоренения и адаптации новые растения выращиваются при агротехнике, свойственной данной культуре, и могут быть высажены в теплицу, а затем и в открытый грунт.
berrylab.ru
Лаборатория микроразмножения
Лаборатория микроразмножения: требования к помещениям, их количеству и расположению
Работы по культивированию изолированных тканей растений и семян проводятся в асептических условиях в специально оборудованной для этого лаборатории. Лучше всего, если весь комплекс лабораторных помещений будет размещен в отдельном здании или все его комнаты сконцентрированы в одном месте с отдельным входом. В помещениях лаборатории должен соблюдаться режим стерильности и ограничиваться доступ лиц, не имеющих непосредственного отношения к данному процессу.
Лаборатория микроразмножения включает группу территориально взаимосвязанных помещений – моечную, весовую, автоклавную, ламинарную, световую, стерильный бокс, культуральную, помещение для персонала, кладовую и др. (рисунок). Для удобства в работе моечную, весовую и автоклавную необходимо соединить в единый комплекс; то же относится к ламинарной и световой комнатам. Кладовая и помещение для персонала должны находиться отдельно. Во всех помещениях полы следует выложить кафелем или устлать линолеумом, стены покрыть водоэмульсионной или масляной краской. В конце рабочей недели в комплексе лабораторных помещений обязательно проводится тщательная уборка с дезинфицирующими средствами. Помещения для ламинаров и стерильный бокс стерилизуются бактерицидными лампами (6-8 ч).
Рисунок - План-схема расположения помещений лаборатории микроразмножения НБС НАН Украины (Лаборатория биотехнологии растений)
I – культуральная; 2 – темновой отсек культуральной; 3 – ламинарная; 4 – кладовая; э – стерильный бокс; 6– коридор; 7 – лабораторное помещение; 8 – моечная; 9 – весовая; 10 – автоклавная; 11 – помещение для персонала
В моечной проводят основные подготовительные работы: мытье и первичную сушку посуды, обработку растительного материала перед введением в культуру. Эту комнату оборудуют моечными машинами, глубокими раковинами из кислотоустойчивого материала, трубопроводами холодного и горячего водоснабжения. В этом же помещении можно установить аппарат для дистиллирования воды. Для удобства в работе дистиллятор располагают на специальной подставке, прикрепленной к стене выше крана с водой. Под аппаратом устанавливают емкость для сбора дистиллированой воды.Питательные среды лучше готовить в отдельной комнате, оснащенной аналитическими и торзионными весами, рН-метром, холодильником для хранения реактивов и маточных растворов, шкафами для хранения чистой посуды и емкостей с приготовленной средой. В весовой также должен быть расположен стол с большой (2,5-3,0 м2) влагостойкой столешницей для приготовления сред.Согласно требованиям техники безопасности, автоклавную комнату лучше изолировать от всех остальных помещений. Пол в автоклавной должен быть кафельным с уклоном для стока воды в канализацию, стены обработаны водостойким покрытием. В помещении для стерилизации устанавливают автоклавы типа ГК-100 и сушильные шкафы.Для проведения работ в септических условиях (высев семян, стерилизация и вычленение эксплантов с последующим субкультивированием на питательной среде) используют комнату с ламинарными боксами или стерильный бокс. В этих комнатах на потолках и над рабочими поверхностями необходимо разместить бактерицидные аргонно-ртутные (БУВ-15, -30) или ртутнокварцевые (ПРК-7) лампы. Стерильные материалы (салфетки, вату, химические стаканы, чашки Петри, воду и др.) удобно хранить тут же, в ламинарной комнате в непосредственной близости от ламинарных боксов и использовать по мере необходимости. Возле каждого бокса должен стоять автономный передвижной столик с легко моющейся поверхностью, который используют для проведения масштабных работ или для работ по введению эксплантов в стерильную культуру.В стерильном боксе должен постоянно находиться бинокулярный микроскоп марки МБС-9; с его помощью удобно вычленять апикальные и пазушные меристемы исследуемых объектов. Здесь устанавливают столы, покрытые легко моющимся материалом, на которых размещают микроскопы и необходимый для работы инструмент. Комната должна быть хорошо освещена; перед работой ее в течение 2-3 ч стерилизуют бактерицидными лампами.Для культивирования изолированных тканей, сеянцев, растений-регенерантов и проращивания семян используют помещение, оборудованное стеллажами для размещения емкостей с растениями и искусственным освещением. Подсветку можно осуществлять люминесцентными лампами ЛБ-40, -20, ЛД-40, -20 или их современными энергосберегающими аналогами со спектром свечения, близким к естественному. В световой необходимо поддерживать постоянную температуру (22-26°С) с суточными колебаниями около 2-4°С. С этой целью помещение нужно оборудовать кондиционером. Управление освещением лучше вести из отдельного помещения – аппаратной. Влажность в культуральном помещении должна составлять 70%, фотопериод – 8-12 ч. Лампы дневного света можно размещать как вертикально, так и горизонтально – в зависимости от сортимента культивируемых растений. Для дифференциации и культивирования каллусных тканей используют темновой отсек. В этом помещении устанавливают термостаты и стеллажи для культивирования каллусов; освещение должно быть автономным и включаться только в случае проведения контроля.
Источник: Черевченко Т.М., Лаврентьева А.Н., Иванников Р.В. Биотехнология тропических и субтропических растений in vitro. – К.: Наук. думка, 2008. – 559 с.
bio-x.ru
1. Технология и техника микроклонального размножения растений
1.1 Оборудование биотехнологической лаборатории
Для организации биотехнологической лаборатории необходимы просторные изолированные помещения, а также современное оборудование и высококачественные реактивы. Для удобства проведения дезинфекции полы стены и потолок в помещениях должны иметь водостойкое и ультрофиолетоустойчивое покрытие.
Оборудование моечного помещения: должны быть глубокие раковины из кислотостойкого материала и краны с горячей и холодной водой, дистиллированная вода; дистилляторы и бидистилляторы; сушильные шкафы с режимом работы для сушки посуды до 100-130 0С, для инструментов до 170 0С, шкафы для хранения чистой посуды и инструментов, емкости для хранения моющих средств, вытяжные шкафы с эксикаторами для хромпика (h3SO4 98 % + K2CrO7).
Оборудование помещения для приготовления питательных сред: лабораторные столы, холодильники для хранения маточных растворов солей, гормонов и витаминов, аналитические и торсионные весы; иономер, магнитные мешалки, плитки, газовые горелки, набор посуды (колбы, стаканы, мерные цилиндры, мензурки, пробирки и др.), необходимый набор химических реактивов надлежащей степени чистоты (ХЧ, Ч, ЧДА).
Оборудование помещения для стерилизации: автоклавы с режимом работы – давление 1-2 атмосферы и температура 120 0С, стеллажи для штативов с питательными средами, шкафы для хранения стерильных материалов. Данное помещение должно быть оборудовано приточно-вытяжной вентиляцией и иметь канализационный слив для отвода конденсата из автоклава.
Оборудование помещения для инокуляции растительных эксплантов на питательные среды: ламинарный бокс, в который нагнетается стерильный воздух, проходящий через бактериальные фильтры. Ламинарий размещают в отдельной комнате. Если нет ламинарных боксов, то оборудуют специальную комнату-бокс - операционную. Стены такой комнаты облицовывают кафелем, пол застилают линолеумом. Двери операционной должны герметично закрываться и перед ними должен быть тамбур (передбоксник). В бокс должно поступать стерильный кондиционированный воздух. Бокс оснащают бактерицидными лампами. Нужны лабораторные столы, стеллажи, шкафы для материалов и оборудования.
Оборудование культуральных помещений: световое отделение – источники освещения со спектром близким к спектру дневного света (от 3 до 10 kLx), кондиционер для регуляции температуры (25±2 0С) и влажности воздуха (70 %), стеллажи для штативов с культивируемым материалом; темновое отделение с тем же оборудованием, исключая источники освещения. Для культивирования эксплантов на питательной среде желательно использовать термостаты или хладотермостаты, способные с высокой точностью поддерживать задаваемые режимы температуры и влажности воздуха.
Необходимый набор посуды, инструментов и материалов в биотехнологической лаборатории: мерные колбы, колбы Эрленмейера, химические стаканы, мерные цилиндры, чашки Петри, пробирки, бутылки, пипетки, стеклянные палочки, стеклянные и мембранные фильтры, ланцеты (в том числе глазные, хирургические, анатомические), ножницы, пинцеты, ножи, бритвенные лезвия, препарировальные иглы, шпатели, бумага (оберточная, пергаментная, фильтровальная), фольга алюминиевая, вата, марля, шпагат (Бирюков В.С., 2004).
studfiles.net
Республиканский лесной селекционно-семеноводческий центр - Микроклональное размножение растений
В январе–марте 2013 года на базе РЛССЦ при финансовой поддержке Министерства лесного хозяйства Республики Беларусь и методической поддержке сотрудников научно-исследовательской лаборатории клеточных технологий в растениеводстве биотехнологического факультета учреждения образования “Полесский государственный университет” (далее ПолесГУ) создана биотехнологическая лаборатория, специализирующаяся на производстве посадочного материала любых, экономически значимых видов растений в объемах до 300 тысяч адаптантов в год, с использованием метода клонального микроразмножения растений in vitro. Наряду с применением уже разработанных технологических регламентов производства посадочного материала растений в промышленных объемах, на базе биотехнологической лаборатории научно-исследовательского отдела РЛССЦ возможно проведение научно-исследовательских, опытно-конструкторских и технологических разработок (НИОКТР) новых (инновационных) технологических регламентов производства посадочного материала разных видов растений по желанию и на усмотрение заказчика.
Объемы производства (мощность) в год на базе биотехнологической лаборатории научно-исследовательского отдела РЛССЦ достигают 300 тысяч адаптантов ex vitro покрытосеменных растений в возрасте 1-8 месяцев и 50 тысяч адаптантов ex vitro хвойных (голосеменных) растений в возрасте 1-5 месяцев.
С апреля 2013 года на постоянной основе занимаемся клональным микроразмножением следующих видов растений:
Сортовая голубика высокая
(размножается в соответствии с технологическим регламентом производства посадочного материала сортовой голубики, разработанным по заказу Национального банка Республики Беларусь в 2009-2010гг. на базе научно-исследовательской лаборатории клеточных технологий в растениеводстве биотехнологического факультета ПолесГУ и переданным в рамках лицензионного договора между РЛССЦ и ПолесГУ от 05 апреля 2013 года № 867)
- Эрлиблю
- Веймут
- Дюк
- Патриот
- Спартан
- Торо
- Блюкроп
- Дениса Блю
- Кэролина блю
- Река
- Блюгольд
- Нортланд
- Нортблю
- Норткантри
- Элизабет
- Нельсон
- Чандлер
- Нуи
- Пуру
и еще 15 сортов, имеющихся в коллекции in vitro
Береза карельская (Betula pendula Roth var. Carelica)
(в соответствии с технологическим регламентом производства посадочного материала березы карельской, разработанным в 2012-2013гг. на базе Института леса НАН Беларуси по заказу Министерства лесного хозяйства Республики Беларусь)
Декоративные хвойные растения
(в соответствии с технологическим регламентом производства посадочного материала декоративных хвойных растений, разработанным в 2012-2013гг. на базе научно-исследовательской лаборатории клеточных технологий в растениеводстве биотехнологического факультета ПолесГУ по заказу Министерства лесного хозяйства Республики Беларусь)
- Туя западная (Smaragd, Teddy)
- Туя восточная (Aurea Nana)
- Кипарисовик крупноплодный (Cupressus macrocarpa)
- Кипарисовик Лавсона “Globosa”
- Кипарисовик Лавсона “Columnaris”
Хвойные лесообразующие породы
(в соответствии с технологическим регламентом производства посадочного материала растений рода Picea, разработанным в 2013-2017гг. на базе научно-исследовательской лаборатории клеточных технологий в растениеводстве биотехнологического факультета ПолесГУ по заказу Министерства лесного хозяйства Республики Беларусь)
- Ель европейская
- Ель колючая
НИО РЛССЦ оказывает следующие виды услуг:
- под заказ производим необходимое количество посадочного материала по имеющимся технологическим регламентам производства (сортовая голубика высокая, жимолость голубая, арония черноплодная, малина ремонтантная, смородина черная, хвойные растения, береза карельская), с учетом и в пределах производственных возможностей (мощности) лаборатории: стоимость услуги (посадочного материала) от 1,00÷6,40 руб./шт., в зависимости от возраста (от 1÷36 месяцев после высадки на адаптацию ex vitro).
- под заказ разрабатываем инновационные технологические регламенты производства посадочного материала любых видов растений в промышленных объемах, с использованием клеточных технологий in vitro: стоимость услуги от 10÷40 тысяч долларов США за 1 технологический регламент, в зависимости от вида растений.
- обеспечиваем полное научно-техническое сопровождение по закладке плантаций ягодных культур (голубика высокая, малина ремонтантная): стоимость услуги от 9÷14 тысяч долларов США / 1 га, в зависимости от площади плантации, при этом стоимость затрат уменьшается обратно пропорционально увеличению площади плантации.
- обеспечиваем полное научно-техническое сопровождение по закладке лесосеменных плантаций основных лесообразующих пород, хвойных и лиственных.
Телефоны научно-исследовательского отдела: +375 (17) 510-63-94 (рабочий)
GSM: +375 (29) 964-68-39 (Антон Анатольевич Волотович)
GSM: +375 (29) 380-82-07 (Оксана Александровна Кудряшова)
www.rlssc.by
Технология микроклонального размножения хризантемы в условиях in vitro
Анализ российского рынка садовых, декоративных культур свидетельствует: в последние годы интерес на новые сорта данных культур существенно вырос. В ходе процесса перехода экономики страны к импортозамещению очевидна необходимость сокращения импорта посадочного материала, становится актуальной проблема массового производства различных сортов однолетних и многолетних цветочных культур внутри России. Отстраняться от неё нельзя: наличие высокого инфекционного фона у завезённого посадочного материала сказывается не только на качестве цветения, внешнем виде и продолжительности жизни растений, но и вызывает заражение окружающей среды опасными патогенами, что оказывает отрицательное влияние на экологию регионов. Проблема может быть успешно решена с использованием при размножении ценных сортов методов биотехнологии [1].
В промышленном производстве цветочных культур во всем мире в настоящее время наиболее перспективным методом размножения растений считается метод in vitro.
Этот метод имеет существенные преимущества перед традиционными способами размножения растений:
получение генетически однородного посадочного материала;
получение безвирусных растений за счет использования меристемной культуры;
высокий коэффициент размножения;
возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
пробирочные растения легко транспортировать на любые расстояния.
Использование технологий микроклонального размножения позволяет сократить время выращивания до товарного стандарта, к примеру, для декоративно-лиственных бегоний и сенполий на 1–1,5 мес., для хризантем, лилий, гвоздик и орхидей — на 3–4 месяца. Размножая какой-либо новейший сорт, можно вырастить несколько миллионов растений за один год, и, дорастив их в течение 2–3 лет, получить качественный посадочный материал. При обычных методах размножения для этого понадобилось бы более 10 лет [2].
В мировом масштабе большая часть декоративно-цветочного ассортимента массового производства выпускается с применением технологий микроклонального размножения.
Микроразмножение растений, начавшее распространяться в 60-е годы 20 века, оформилось как мощное промышленное производство, быстро реагирующее на запросы рынка. К примеру, только за период с 1985 по 1990 годы число растений, размножаемых in vitro, возросло с 130 млн. до 513 млн. Мировыми лидерами в этой области являются Нидерланды, США, Индия, Израиль, Италия, Польша и другие страны. В США микроразмножением занимаются около 100 лабораторий, 5 из которых имеют производительность 15–20 млн. растений в год, 8–10 лабораторий — от 2–10 млн., остальные менее 1 млн. растений. Из 248 коммерческих лабораторий Западной Европы с общей годовой производительностью 212 миллионов растений только 37 производят более 1 млн.
Лидером микроразмножения растений в Западной Европе являются Нидерланды (около 70 лабораторий занимается микроразмножением). Это связано с традиционнной ориентацией на производство декоративных культур, где Нидерланды доминируют на мировом рынке (около половины мирового экспорта цветов на срезку и декоративных растений экспортируется из этой страны). Наиболее важными группами растений, размножаемых in vitro в этой стране, являются такие декоративные культуры, как горшечные растения на срезку, орхидеи и луковичные.
В России накоплен большой опыт по микроклональному размножению наиболее востребованных культур; практически во всех научно-исследовательских институтах, селекционных центрах созданы лаборатории биотехнологии, одна из главных задач которых оздоровление и микроклональное размножение ценного селекционного материала и перспективных сортов.
Сейчас технологии клонального микроразмножения invitro на лабораторном уровне разработаны в мире более чем для 2400 видов растений. Однако коммерческих лабораторий, использующих эти приёмы, относительно немного, около 200. Это объясняется отчасти тем, что не все, разработанные в сугубо лабораторных условиях методики, применимы непосредственно в производстве. Часто требуется решение отдельных узловых моментов для конкретных видов растений. Немаловажным является и вопрос экономической эффективности [3].
Среди цветочных культур большой популярностью и спросом несомненно пользуется хризантема. Хризантема сегодня входит в список наиболее популярных цветочных культур, которые распространены по всему миру. Для потребителя предлагаются как срезочные, так и горшечные, садовые и тепличные растения. По объему продаж хризантемы уступают только розам. Более чем за 2000-летнию историю культуры создано около 7000 сортов хризантем, часть из которых используют в кулинарии, в фармацевтической промышленности, а также в качестве инсектицидов. Однако наибольшую популярность хризантема снискала в цветоводстве [4].
В тоже время на территории Российской Федерации объемы производства посадочного материала современных сортов недостаточны, а имеющийся материал дорогостоящий. В связи с этим разработка современной технологии увеличения объёмов производства, равно как, и удешевления посадочного материала весьма актуальны.
В лаборатории биотехнологии сельскохозяйственных растений Самарского НИИСХ мы провели оптимизацию основных элементов технологии микроклонального размножения хризантемы корейской в условиях invitro. В качестве объекта исследования были использованы микрорастения хризантемы корейской сорта Улыбка Гагарина.
В нашем эксперименте мы использовали классическую схему микрокланального размножения основанную на активации развития уже существующих в растении меристем (апекс стебля, пазушные и спящие почки и интеркалярные зоны стебля) и индукции возникновения адвентивных почек непосредственно тканями экспланта. Рисунок 1.
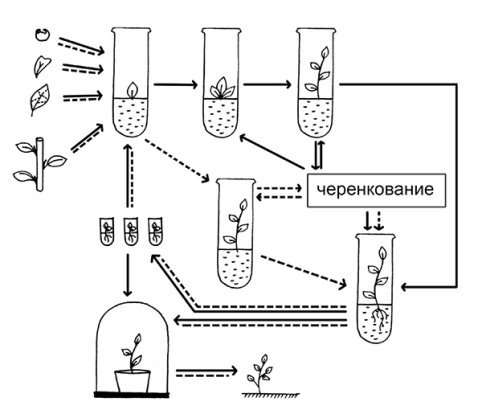
Рис. 1. Схема микроклонального размножения растений
В качестве питательной среды в эксперименте использовалась минеральная основа среды Мурасиге и Скуга с добавлением природного биологического загустителя Агар-Агара в количестве 6 г/л, а также различных концентраций фитогормонов, витаминов и органических добавок. Таблица 1.
Таблица 1
Минеральная основа среды Мурасиге и Скуга
|
Компоненты |
Содержание, мг/л |
Компоненты |
Содержание, мг/л |
|
Nh5NO3 |
1650 |
Fe2SO4 7h3O |
27,8 |
|
KNO3 |
1900 |
Na2-ЭДТА 2h3O |
37,3 |
|
CaCl2. 2h3O |
440 |
Тиамин — HCl |
0,1 |
|
MgSO4. 4h3O |
370 |
Пиридоксин — HCl |
0,5 |
|
Kh3PO4 |
170 |
Никотиновая кислота |
0,5 |
|
MnSO4. 4h3O |
22,3 |
Мезо-инозит |
100 |
|
CoCl2.6h3O |
0,025 |
Сахароза |
30.000 |
|
ZnSO4. 7h3O |
8,6 |
рН 5,6–5,8 |
|
|
CuSO4. 5h3O |
0,025 |
||
|
Na2MoO4. 2h3O |
0,25 |
||
|
Kl |
0,83 |
||
Традиционно процесс клонального микроразмножения включает в себя четыре основныхэтапа:
выбор растения-донора и получение хорошо растущей стерильной культуры;
собственно микроразмножение;
укоренение микропобегов и при необходимости их депонирование при пониженных температурах;
адаптацию пробирочных растений к почвенным условиям теплицы или открытого грунта.
В наших экспериментах в качестве эксплантов были взяты растительные побеги хризантемы длиной 2,5–3 см.
Важным этапом введение в культуру invitro является получение хорошо растущей стерильной культуры или ростков. От правильно выбранных для стерилизации растительных объектов химических реагентов зависит эффективность разработанной технологии микроклонального размножения и общий успех производства. В результате проведенных исследований было установлено, что наиболее эффективной схемой стерилизации при введении хризантемы в условия invitro является двухэтапная схема стерилизации. Первый этап стерилизация растительных эксплантов в растворе пероксида водорода (12 %) в течении 5 мин. Далее трижды промывают стерильной дистиллированной водой. Второй этап с использованием препаратов «Белизна» или «Domestos» в разведении 1:9, в течении 10 мин. Завершающим этапом стерилизации, тройная промывка растительных объектов стерильной дистиллированной водой. При данном способе стерилизации жизнеспособность эксплантов составляла более 70 %.
После выполнения этапа стерилизации у растительных эксплантов скальпелем подрезается нижняя часть стебля и далее подготовленные черенки высаживают на питательную среду Мурасиге и Скуга, дополненную сахарозой 30 г/л и регуляторами роста 1,0 мг/л кинетина и 0,5 мг/л нафтилуксусной кислоты. Дальнейшее культивирование микро растений осуществляется в факторостатной комнате при 16-часовом освещении люминесцентными фитолампами с интенсивностью около 3000 лк, при температуре 20–25°C (физические условия выращивания близки к оптимальным для культивирования эксплантов растений).
В процессе культивирования на стерильных эксплантах формируются боковые побеги, которые в последующем отделяют от маточного растения и помещают на свежую питательную среду для роста и укоренения, или используют для дальнейшего черенкования. В первом случае используют питательную среду с 50 %-ным составом макросолей с добавлением стимулятора ростовых процессов Рибав-Экстра (0,00152 г/л L-аланин + 0,00196 г/л L-глутаминновой кислоты) в количестве 0,1 мг/л. Во втором случае используется прежний состав питательной среды.
При укоренении микропобегов на агаризованной питательной среде Мурасиге-Скуга с добавлением Рибав-Экстра в течение 2 недель культивирования формируются побеги максимальной длины — 5–6 см. и 3–4 корешками длинной 1,5–2 см. В дальнейшем сформировавшиеся побеги с корнями переносят для адаптации к естественным условиям открытого грунта. Микро-растения пересаживаются в кассеты с питательным субстратом состоящим из смеси нейтрализованного торфа и перлита (вермикулит) в соотношении 1:1. Для более эффективной приживаемости микроклонов в помещении для адаптации необходимо использовать систему туманообразования фирмы «СОХРА». Данная система поддерживает в оптимальном режиме влажность воздуха и тем самым не дает листовой поверхности интенсивно терять влагу. После укоренения размноженные растения выращивают обычным способом.
Литература:
- Шевченко, С. Н. Самарская наука: ответ на зарубежные санкции // Шевченко С. Н., Милехин А. В., Рубцов С. Л. / Агроинформ, № 3 (197) // март 2015, с. 36–37.
- Бутенко Р. Г. Биология клеток высших растений in vitro и биотехнологии на их основе: Учеб. пособие — М.: ФБК-ПРЕСС, 1999.
- СассонА.Биотехнология:свершенияи надежды: Пер. с англ. / Под ред., с предисл. и допл. В. Г. Дебабова. — М.: Мир1987. — 411с.
- Гранда Харамильо Роберто Карлос. Идентификация В вируса хризантем и создание коллекций invitro оздоровленного посадочного материала. — автореферат дис…к.б.н. /МСХА имени К. А. Тимирязева. — Москва, 2009. — 19 с.
moluch.ru
Производство посадочного материала методом микроклонального размножения
Культура in vitro – выращивание клеток, тканей, органов на искусственной питательной среде в абсолютно стерильных условиях при контролируемых физических факторах (свет, температура, влажность, фотопериодичность).
Микроклональное размножение – разновидность вегетативного размножения растений в культуре in vitro. Оно освоено на явлении тотипотентности (способность нести и восстанавливать генетическую информацию растений).
Этапы микроклонального размножения
- Выбор растения-донора.
- Стерилизация эксплантов (любая часть растения, культивируемая в условиях in vitro).
- Введение в культуру in vitro. На этом этапе важно обеспечить успешное помещение экспланта на питательную среду.
- Получение хорошо растущей стерильной культуры.
- Микроразмножение. Целью этапа является получение максимального числа побегов в культуре in vitro.
- Укоренение и адаптация в нестерильных условиях. На этом этапе удлиняются побеги, повляются корни, затем осуществляется перенос в тепличные условия и адаптация к ним.
- Выращивание растений в условиях теплицы и подготовка их к реализации и посадке в открытый грунт.
Метод индукции адвентивных почек экспланта основан на способности изолированных частей растений при благоприятных условиях питательной среды, восстанавливать недостающие органы и регенерировать целые растения из разных частей (изолированного зародыша, листа стебля, семядолей, меристематических верхушек, чешуек сегментов корней и зачатков соцветий). При этом изолируют растения и выращивают их на питательной среде Мурасиге-Скуга. Через 3-4 недели культивирования меристема развивается в проросток. В основании проростка формируются адвентивные почки, которые быстро растут и дают начало новым почкам. В течение 6-8 недель образуются конгломераты почек, связанные между собой соединительной тканью и находящиеся на разной стадии развития. Появляются листья на коротких черешках, в нижней части которых формируются новые адвентивные почки. Это почки делят и затем переносят на свежую питательную среду. Таким образом, от одного материнского растения можно получать несколько миллионов растений-регенерантов в год.
Преимущества микроклонального размножения
microklon.ru








