Содержание
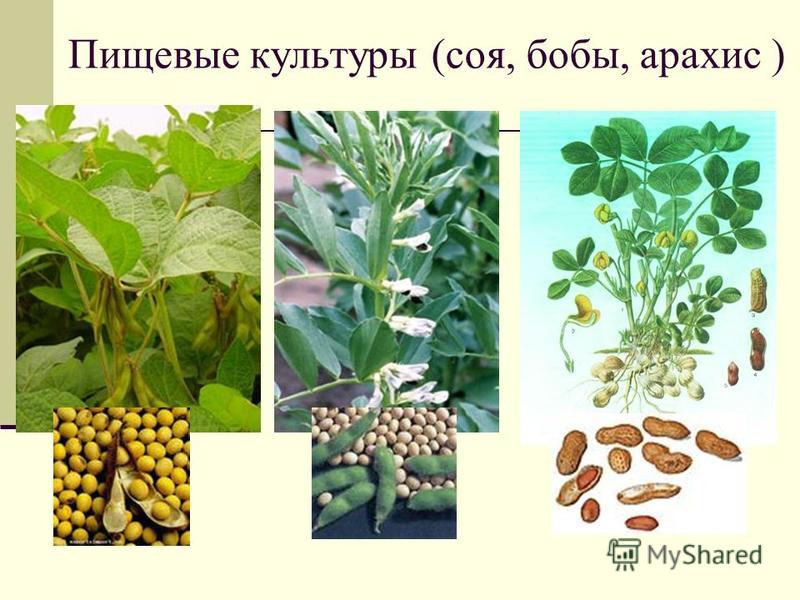
Растения, бобовые
Бобовые растения играют, по-видимому, главную роль в связывании молекулярного азота в возделываемых почвах. Однако неправильно было бы думать, что все виды бобовых растений в равной степени обогащают почву. Общее увеличение количества азота в надземной массе и пожнивных остатках при культивировании люпина составляет 150—200 кг, клевера красного — 180 кг, люцерны — 300 кг, донника — 150 кг, зерновых бобовых — 50 — 60 кг азота в год на 1 га почвы. При этом прибыль азота в почве для всех перечисленных видов, за исключением зерновых бобовых, составляет примерно 50—70 кг на 1 га.[ …]
Бобовые травы при весеннем опрыскивании, если они находятся под пологом злаковых трав и разнотравья, меньше страдают от гербицидов типа 2,4-Д. В первый год после применения гербицидов наблюдается общее изреживание травостоя (в том числе и бобовых) и известное снижение урожая. Поэтому очень важно сочетать обработку луга гербицидом с внесением удобрений (азотных, азотно-фосфорных, азотно-калийных или азотно-фосфорно-калийных) из расчета по 30—60 кг/га действующего вещества. На участках, где предполагается провести химическую прополку нежелательного разнотравья, следует удобрения вносить рано весной, а гербициды применять в сроки, указанные выше. Тогда создаются условия лучшего питания растений, остающихся в травостое, и они формируют более высокий урожаи лучшего качества.[ …]
На участках, где предполагается провести химическую прополку нежелательного разнотравья, следует удобрения вносить рано весной, а гербициды применять в сроки, указанные выше. Тогда создаются условия лучшего питания растений, остающихся в травостое, и они формируют более высокий урожаи лучшего качества.[ …]
Азот бобовым нужен так же, как и всем другим растениям, но они могут брать его из воздуха, тогда как все другие растения берут азот из почвы. Бобовые растения, черпая нужный им азот из воздуха, могут расти в почве, не имеющей азотной пищи, при этом благодаря обилию доступного только для них питания в воздухе они накопляют белка больше других.[ …]
На корнях бобовых растений естественным образом поселяются клубеньковые бактерии. Наряду с ними в почве обитают и другие азотфиксирующие микроорганизмы. Надо лишь способствовать созданию условий для их процветания. Этой цели служит афотехника, при которой в севооборотах большое место должны занимать бобовые культуры (в нашей стране площади под ними гораздо меньше научно обоснованной потребности). [ …]
[ …]
Семейство Бобовые — Fabaceae, или Мотыльковые — Papilio-пасеае. Донник лекарственный, желтый — Melilotus officinalis (L.) Desr. Двулетнее растение (см. рис. 69). Стебель прямой или восходящий, сильноветвистый, высотой 50—200 см. Листья очередные, тройчатые, листочки по краю пильчато-зубчатые, прилистники ланцетные. Цветки желтые, многочисленные, собраны в рыхлые пазушные кисти. Стержневой корень проникает в почву на глубину до 1,5 м.[ …]
Различные растения (группы растений) предъявляют неодинаковые требования к почвенным условиям. Поэтому при оценке плодородия почвы по показателям ее свойств и режимов необходимо учитывать требования конкретных растений. Так, для чайного куста благоприятна сильнокислая реакция; для бобовых культур такая реакция губительна. Показатели свойств и режимов почвы изменяются во времени и зависят от сезонных циклов почвообразования, приемов воздействия на почву и длительности ее сельскохозяйственного использования. Это обстоятельство— одна из причин, определяющих необходимость регулирования почвенного плодородия.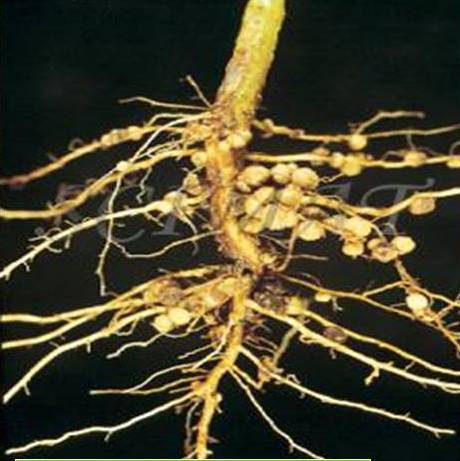 Подробнее это положение рассматривается ниже в разделе «Воспроизводство почвенного плодородия».[ …]
Подробнее это положение рассматривается ниже в разделе «Воспроизводство почвенного плодородия».[ …]
Растение серебристо-войлочное от прижатых ветвистых волосков, высотой 40— 80 см. Стебель прямостоячий, толстый, слабоветвящийся. Листья непарноперистые, с 7—12 парами продолговато-овальных листочков. Цветки бело-желтоватые, в плотных верхушечных кистевидных соцветиях. Корневая система состоит из главного корня, вертикально заглубляющегося до 6—8 м, и расходящихся горизонтальных корней, залегающих на глубине до 60 см и достигающих в длину 5—10 м. На них образуются придаточные корни, а из выводковых почек — надземные побеги.[ …]
Адаптация растений к таким экстремальным условиям в процессе длительной эволюции сформировала самые разные экологические приспособления. Это, прежде всего, господство ксерофитов, могущих экономно расходовать влагу при активной сосущей способности корней, проникающих на значительную глубину (верблюжья колючка, джузгун, черный саксаул и др.). В песчаных пустынях доминируют псаммофиты, имеющие приспособления против засыпания их песком. В пустынях широко развиты засоленные типы почв, на которых могут существовать лишь галофиты (солянки, сарсазан, солерос, лебеда, тамариск, белый саксаул и др.). Так, некоторые виды галофитов (тамариск) в Сахаре на фотосинтезирующих органах имеют специальные железы, выводящие избыток солей, у других — происходит сбрасывание соленасыщенных органов. Во всех пустынях земного шара преобладающими видами растений являются представители таких семейств, как маревые, сложноцветные, крестоцветные, бобовые, гречишные, парнолистниковые и др. Так, флора Сахары насчитывает примерно 1200 видов, песчаных пустынь Турана — 536, Кызылкумов — 533, Южного Устюрта — 259 видов и т. д.[ …]
В пустынях широко развиты засоленные типы почв, на которых могут существовать лишь галофиты (солянки, сарсазан, солерос, лебеда, тамариск, белый саксаул и др.). Так, некоторые виды галофитов (тамариск) в Сахаре на фотосинтезирующих органах имеют специальные железы, выводящие избыток солей, у других — происходит сбрасывание соленасыщенных органов. Во всех пустынях земного шара преобладающими видами растений являются представители таких семейств, как маревые, сложноцветные, крестоцветные, бобовые, гречишные, парнолистниковые и др. Так, флора Сахары насчитывает примерно 1200 видов, песчаных пустынь Турана — 536, Кызылкумов — 533, Южного Устюрта — 259 видов и т. д.[ …]
Фитоалексины растений, относящихся к разным семействам, весьма несхожи между собой, но внутри семейства они обычно принадлежат к близким структурным типам [551. У Vicia faba, кроме этого, в ответ на заражение Botrytis cinerea или В. а-Ьае вырабатываются ацетиленовые фитоалексины, например вие-ронэпоксид (223) [56]. В корнях моркови (сем.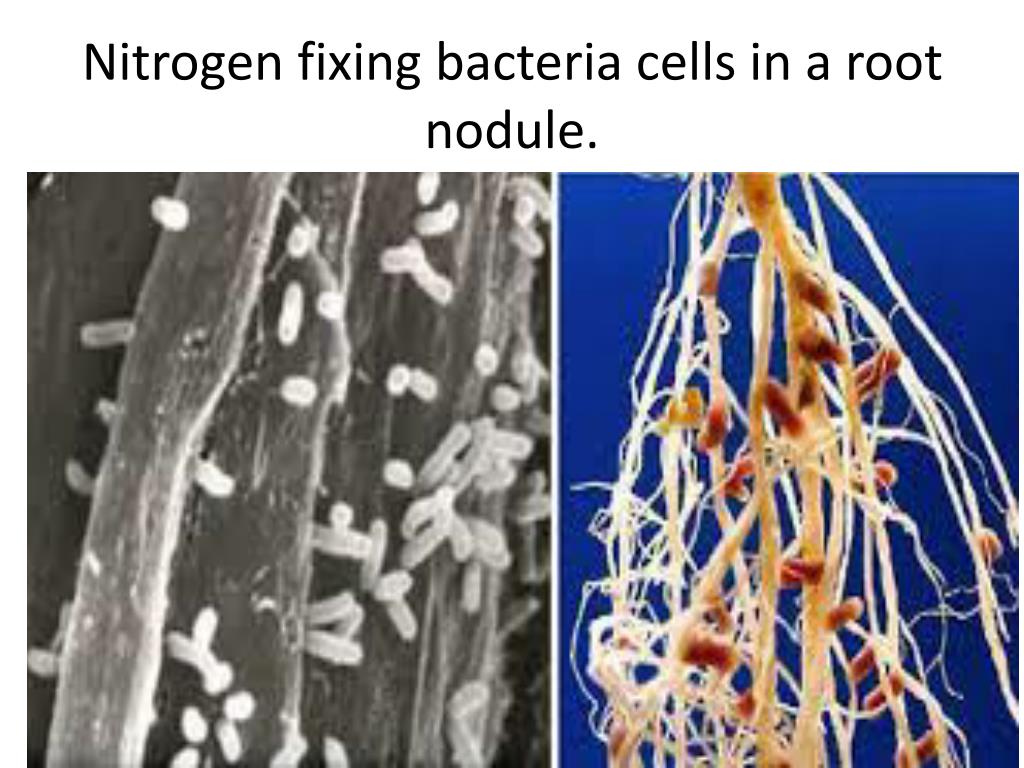 зонтичных) в ответ на микробную инфекцию вырабатывается 6-метоксимеллеин (224) [57], в клубнях орхидеи (сем. Из стеблей зараженного вилтом хлопчатника (сем. У другого представителя Solanaceae — табака — в инфецированных листьях появляется квиезон (233) — мощный ингибитор прорастания конидий у Perenospora tabacina [66, 67], а также, возможно, ряд гликозидов со структурой солаветивана [68].[ …]
зонтичных) в ответ на микробную инфекцию вырабатывается 6-метоксимеллеин (224) [57], в клубнях орхидеи (сем. Из стеблей зараженного вилтом хлопчатника (сем. У другого представителя Solanaceae — табака — в инфецированных листьях появляется квиезон (233) — мощный ингибитор прорастания конидий у Perenospora tabacina [66, 67], а также, возможно, ряд гликозидов со структурой солаветивана [68].[ …]
Инфицирование бобового растения клубеньковыми бактериями. Для обеспечения нормального процесса инфицирования корневой системы клубеньковыми бактериями необходимо наличие довольно большого количества жизнеспособных клеток бактерий в прикорневой зоне. Мнения исследователей в отношении количества клеток, необходимых для обеспечения процесса инокуляции, различны. Так, по данным американского ученого О. А л л е н а (1966), для инокуляции мелкосеменных растений требуется 500—1000 клеток, для инокуляции крупносеменных — не менее 70 000 клеток на 1 семя. По мнению австралийского исследователя Дж. Винцента (1966), в момент инокуляции на каждое семя должно приходиться по крайней мере несколько сотен жизнеспособных и активных клеток клубеньковых бактерий. Имеются данные, что в ткань корня могут внедряться и единичные клетки.[ …]
Имеются данные, что в ткань корня могут внедряться и единичные клетки.[ …]
Кормовое значение растений определяется как их питательностью, так и обилием в травостое. С учетом кормовой ценности выделяют четыре группы видов трав: злаки, бобовые, осоки и разнотравье.[ …]
У современных видов бобовых растений клубеньки обнаружены на корнях многих представителей семейства Papilionaceae.[ …]
Аэроионизированные растения тоже повышают зольность (даже при дозе 5 мин), но меньше, чем растения от аэроионизированных семян. И в этом случае у злаков зольность оказалась больше, чем у бобовых.[ …]
Из 13 000 видов (550 родов) бобовых растений наличие клубеньков выявлено пока только приблизительно у 1300 видов (243 рода). Сюда в первую очередь относятся виды растений, использующиеся в сельском хозяйстве (более 200).[ …]
Неактивный для одного растения-хозяина штамм бактерий в симбиозе с другим видом бобового растения может быть вполне эффективным. Поэтому при характеристике штамма с точки зрения его эффективности следует всегда указывать, в отношении какого вида растения-хозяина проявляется его действие. [ …]
[ …]
Однолетние растения из семейства зонтичных. Эти сорняки чаще всего произрастают по обочинам дорог, нолей и лесополос, на молодых залежах, а также среди посевов зерновых п бобовых культур. Наиболее распространен н рицепник на Северном Кавказе, в Крыму, Средней Азии. К действию гербицидов среднеустойчив. Молодые растения прицепника, имеющие высоту не более 5 см, можно уничтожить, применяя несколько повышенные дозы гербицидов: натриевая соль 2 кг, кротилин — 0,9—1 кг действующего вещества на 1 га.[ …]
Сформировав клубеньки, бобовые растения приобретают способность усваивать атмосферный азот. Однако они способны питаться и связанными формами азота — солями аммония и азотной кислоты. Лить одно растение — копеечник (Hedysarum coronarium) — ассимилирует только молекулярный азот. Поэтому без клубеньков в природе это растение не встречается.[ …]
Кроме светового питания растениям необходимо минеральное питание. Они нуждаются во многих элементах, которые либо поступают из минералов, либо становятся доступными в результате минерализации органического вещества. Все химические элементы поглощаются в форме ионов и включаются в растительную массу, накапливаясь в клеточном соке. После сжигания сухого органического материала минеральные вещества остаются в виде золы. В золе растений могут находиться все химические элементы, встречающиеся в литосфере. Жизненно необходимыми и незаменимыми являются основные элементы минерального питания, которые нужны в больших количествах: натрий, фосфор, сера, калий, кальций, магний, а также микроэлементы — железо, марганец, цинк, медь, молибден, бор и хлор. Кроме того, существуют элементы, которые требуются только для некоторых групп растений: натрий — для маревых, кобальт — для бобовых, алюминий — для папоротников и кремний — для диатомовых водорослей.[ …]
Все химические элементы поглощаются в форме ионов и включаются в растительную массу, накапливаясь в клеточном соке. После сжигания сухого органического материала минеральные вещества остаются в виде золы. В золе растений могут находиться все химические элементы, встречающиеся в литосфере. Жизненно необходимыми и незаменимыми являются основные элементы минерального питания, которые нужны в больших количествах: натрий, фосфор, сера, калий, кальций, магний, а также микроэлементы — железо, марганец, цинк, медь, молибден, бор и хлор. Кроме того, существуют элементы, которые требуются только для некоторых групп растений: натрий — для маревых, кобальт — для бобовых, алюминий — для папоротников и кремний — для диатомовых водорослей.[ …]
Много каротина в зеленых растениях бобовых трав, в л тьях кормовой капусты, в корнях красной моркови, в хо шем силосе, в хвойной и травяной муке. Надо иметь в виду что за период зимнего хранения травяной муки, сена пот! каротина в них могут составить от 40 до 100%. [ …]
[ …]
Влияние диоксида серы на растения (см. также стр. 32). Наряду с действием Б02 на человеческий организм, большое значение имеет его влияние на растения. Концентрации 502 1—2 млн-1 могут уже через несколько часов вызвать серьезное повреждение листьев в виде локализованных разрушений ткани (некрозов). У чувствительных растений хронические повреждения могут возникнуть уже начиная с концентраций 0,3 млн-1. Предельно допустимой даже для самых чувствительных растений считается концентрация 0,15 млн-1. Особенно подвержены воздействию 502, помимо вечнозеленых хвойных деревьев, бобовые, а из злаковых — ячмень [78, 190].[ …]
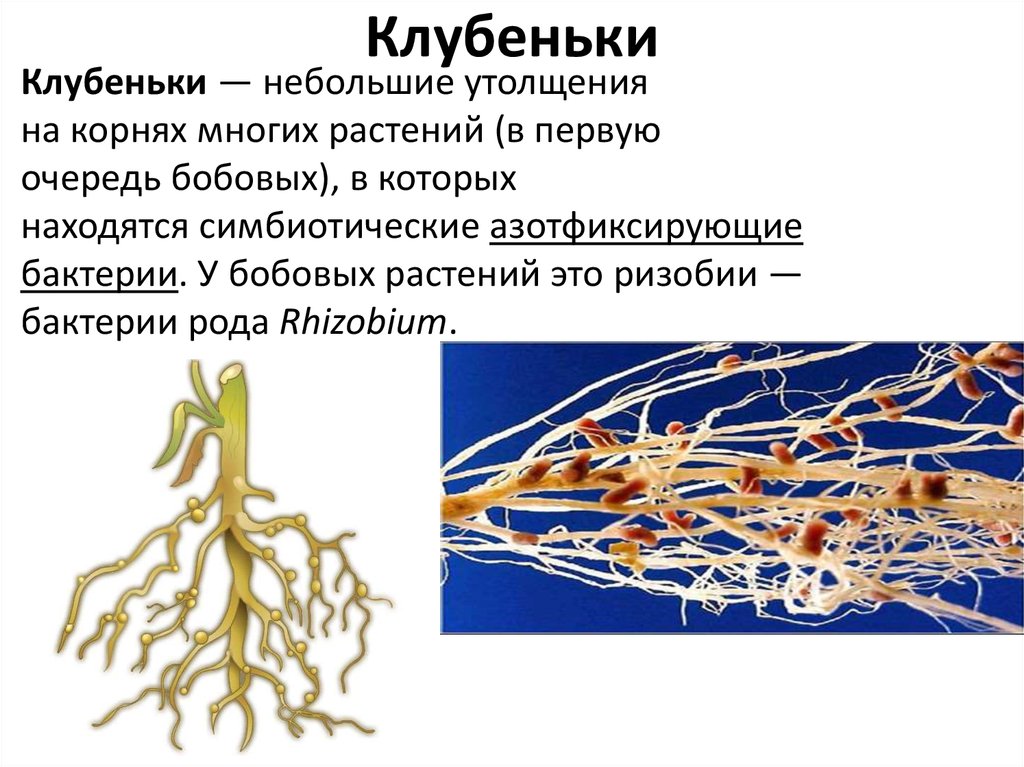
| Корневые клубеньки бобового растения. |
Молибден в воде при поливе растений даже в концентрации 0,01 мг/л накапливается в бобовых растениях до 5 мг/кг — дозе, оказывающей токси-, ческое действие на крупный рогатый скот, питающийся этими растениями.[ …]
Клубеньки на корнях бобовых растений (по Б. Небелу, 1992) Небелу, 1992) |
Клубеньковые бактерии снабжают бобовое растение азотом, который фиксируют из воздуха. Растения же, в свою очередь, поставляют бактериям продукты углеводного обмена и минеральные соли, необходимые им для роста и развития.[ …]
Установление связи между Rhizobium и бобовым растением происходит за несколько этапов взаимодействий. В свободном состоянии бактерии живут в почве (рис. 13.10) и размножаются, если к ним приближаются -корневые волооки растения-хозяина — от последнего, по-видимому, поступают некие сигналы или питательные вещества. Колония развивается на корневом волоске, тот начинает закручиваться, формируя окружающую раз множающиеся бактерии стенку и инфицирующую вить — продукт как растения, так и бактерий. Эта нить может расти в коре корня от одной клетки -к другой, которые при ее приближении начинают делиться, образуя клубенек. По мере заселения клеток бактерии меняют свою форму и превращаются в неделящиеся вздутые бактероиды. У (растения-хозяин а развивается специальная проводящая система, по которой к тканям клубенько» доставляются продукты фотосинтеза, а по другим частям растения разиосмтся фиксированный азот, в основном в виде аспарагина (рис. 13.11). Образуется специальное соединение, леггемо-глобин, придающее активно функционирующему клубеньку розовый цвет. Гем для этой молекулы, по-видимому, синтезируется бактерией, а глобин — растением-хозяином (пример биохимического мутуализма). Леггемоглобин отчасти обусловливает поддержание в клубеньке низкого парциального давления кислорода, что необходимо для фиксации молекулярного азота. Это соединение составляет до 40% массы клубенька, а сами клубеньки — до 5% общей массы -растения.[ …]
13.11). Образуется специальное соединение, леггемо-глобин, придающее активно функционирующему клубеньку розовый цвет. Гем для этой молекулы, по-видимому, синтезируется бактерией, а глобин — растением-хозяином (пример биохимического мутуализма). Леггемоглобин отчасти обусловливает поддержание в клубеньке низкого парциального давления кислорода, что необходимо для фиксации молекулярного азота. Это соединение составляет до 40% массы клубенька, а сами клубеньки — до 5% общей массы -растения.[ …]
Бактерии рода Rhizobium живут на корнях бобовых растений и фиксируют азот воздуха. Растения обеспечивают бактериям жилище и пищу, за что получают доступную форму азота, который включается в органические молекулы. По пищевым цепям азот, входящий в молекулы органических веществ, переходит к другим обитателям экосистемы. Белки и другие органические молекулы в процессе дыхания расщепляются, образуя азот в форме аммония (Nh5), который поступает в окружающую среду. Некоторые бактерии могут переводить аммоний в нитратную форму (NOj). Нитраты постепенно преобразуются другими бактериями в газообразный азот. Часть газообразного азота окисляется в воздухе во время грозовых разрядов и поступает в почву с дождевой водой. Таким способом свободного азота фиксируется в 10 раз меньше, чем это происходит с помощью бактерий. Как вы убедились, глобальная экосистема зависит от азотфиксирующих организмов, которые способны фиксировать азот воздуха.[ …]
Нитраты постепенно преобразуются другими бактериями в газообразный азот. Часть газообразного азота окисляется в воздухе во время грозовых разрядов и поступает в почву с дождевой водой. Таким способом свободного азота фиксируется в 10 раз меньше, чем это происходит с помощью бактерий. Как вы убедились, глобальная экосистема зависит от азотфиксирующих организмов, которые способны фиксировать азот воздуха.[ …]
Клубеньковые бактерии и способность бобовых питаться азотом воздуха открыты не так давно. Это открытие сделало полный переворот в земледелии. Благодаря способности бобовых растений питаться азотом воздуха, сельское хозяйство получило возможность использовать громадные запасы воздушного азота непосредственно возделыванием бобовых растений. Они добывают этот азот из воздуха не только для себя, но и обогащают им почву для других растений своими корневыми и пожнивными остатками. На этом основано применение культуры бобовых при травосеянии.[ …]
Симбиотические клубеньковые бактерии бобовых растений — Rhizobium (фиг. 36).[ …]
36).[ …]
Клевер розовый (Trifolium arvense L.) — многолетнее бобовое растение, пригодное для сенокосных травосмесей при посеве на осушенных низинных лугах и болотах. Более устойчив к избыточному увлажнению и кислотности почвы, чем красный клевер, поэтому более длительно сохраняется в травостое. По качеству дает менее поедаемое сено, чем клевер красный, так как имеет горьковатый привкус. Со злаками поедается хорошо. Урожай сена 35 ц/га.[ …]
Ксерофиты (от греч. — сухой и… фиты) — это растения, приспособленные к жизни в местообитаниях с недостаточным увлажнением (засушливые районы). К экологическим приспособлениям, уменьшающим транспирацию, относятся: узкие листья, толстая кутикула, редукция листьев, опушение и др. К ним относятся в основном растения сухих степей, полупустынь, пустынь (маревые, сложноцветные, крестоцветные, бобовые, гвоздичные, лилейные, парнолистниковые и др.). Они в свою очередь подразделяются на склерофитов и суккулентов.[ …]
Получают гуаровые смолы экстракцией семян бобового растения Оуаторэ рэогаПаё в виде белого или серого порошка. [ …]
[ …]
Можно было бы привести большой список видов растений, животных, а также болезней растений, животных и человека, в течение последних столетий появившихся исключительно «благодаря» развитию морского судоходства. Например, еще в 1876 г. из Японии в США было перевезено бобовое растение «кудзу», которое в настоящее время «захватило» поля, брошенные постройки, свалки и пр. как сорняк, из-за этого фермеры приходят в отчаяние.[ …]
ЗЕЛЕНОЕ УДОБРЕНИЕ — запашка в почву зеленых растений (часто бобовых) в целях обогащения почвы питательными веществами, улучшения ее структуры. См. также Сидерация.[ …]
Фиксация атмосферного азота. Ни одно зеленое растение не может питаться непосредственно азотом атмосферы. Так как в результате деятельности денитрифицирующих бактерий непрерывно идет уменьшение в природе запасов связанного азота и перевод его в атмосферный азот, то жизни на земле грозила бы неминуемая гибель из-за азотного голода. Однако существует группа микроорганизмов, способная связывать атмосферный азот, делая его доступным для растений. Эти микроорганизмы называются азотфиксирующими бактериями, они разделяются на клубеньковые бактерии, развивающиеся на корнях бобовых •растений, и на свободно живущие в почве.[ …]
Эти микроорганизмы называются азотфиксирующими бактериями, они разделяются на клубеньковые бактерии, развивающиеся на корнях бобовых •растений, и на свободно живущие в почве.[ …]
Правда, даже некоторые высокоорганизованные растения могут менять свое место в пространстве. Так, корневищные растения, нарастая под землей, со временем развивают надземные побеги и отходящие от них придаточные корни все в новых и новых точках, в то время как первичный побег, возникший некогда иэ семени, отмирает. Благодаря этому такие растения продолжают свое существование не на том месте, где начиналась их жизнь. Но, во-первых, эти «ростовые» движения несравнимы по скорости и эффекту с теми, которые доступны животным, а во-вторых, они наблюдаются далеко не у всех растений. Есть ограниченные движения и у других растений. Лианы, обвивающие опоры или цепляющиеся за них, иногда перекидывают свои кроны с одного места на другое. Стебель в процессе роста производит так называемые нутационные движения. Листья многих растений иэ-за неравномерного роста черешков ставят листовые пластинки в наиболее благоприятные условия освещения.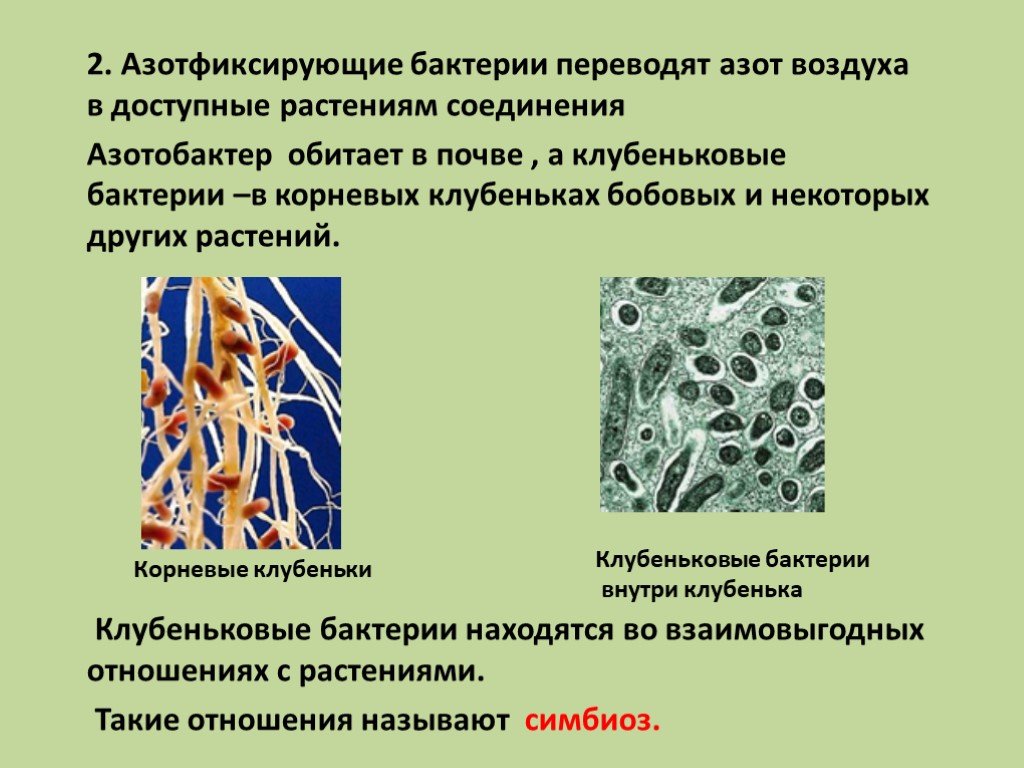 Нередки растения, закрывающие цветки на ночь, в то время как у других они закрываются на день. Листочки сложных листьев многих бобовых ежедневно с большой правильностью изменяют свое положение относительно горизонта. Тем не менее не будет ошибкой сказать, что растения в противоположность животным, как правило, «неподвижны». Некоторые долговечные (многие древесные) растения не покидают своего места сотни и даже тысячи лет (секвойи). Это свойство большинства растений — сохранять за собой одно и то же место — относительно общее и, вероятно, тесно связано со способом восприятия питания, а тем самым — с наличием клеточной оболочки.[ …]
Нередки растения, закрывающие цветки на ночь, в то время как у других они закрываются на день. Листочки сложных листьев многих бобовых ежедневно с большой правильностью изменяют свое положение относительно горизонта. Тем не менее не будет ошибкой сказать, что растения в противоположность животным, как правило, «неподвижны». Некоторые долговечные (многие древесные) растения не покидают своего места сотни и даже тысячи лет (секвойи). Это свойство большинства растений — сохранять за собой одно и то же место — относительно общее и, вероятно, тесно связано со способом восприятия питания, а тем самым — с наличием клеточной оболочки.[ …]
Уж это одно наводит на мысль о каком-то отличии бобовых растений от всех прочих. И действительно, этим клубенькам принадлежит громадная роль в жизни бобовых растений и вообще в жизни на земле. Благодаря им эта небольшая группа растений может питаться азотом прямо из воздуха, тогда как все Другие растения требуют ааотной пищи в самой почве и оез нее, как мы видели, не растут, потому что из Воздуха черпать азота не могут. [ …]
[ …]
В целом наблюдалась четко выраженная тенденция: растения со сходными потребностями в почвенных факторах (и расходующие питательные вещества одинаковым образом) в своем пространственном распределении демонстрировали отрицательную связь, а виды, произрастающие на почвах разных типов — положительную. В частности, виды всех пар типа «злак—злак» и «бобовое—бобовое» предпочитали почвы сходного типа, однако лишь в редких случаях тесно контактировали, что безусловно, свидетельствует об организующей роли конкуренции в этих ограниченных по площади растительных сообществах. Однако интерпретация полученных данных связана с определенными проблемами. Во-первых, некоторые пары нарушают эту общую тенденцию, а две из них (Trifolium pratense- -Dactylus gromerata и T. pratense- -Phleum oratense) даже демонстрируют обратную: растения живут на сходных почвах, но при этом положительно сочетаются. Во-вторых, когда результаты свидетельствуют о наличии конкуренции в парах видов, важно знать, было ли число таких пар большим, чем можно ожидать при случайном распределении. В-третьих, анализировалось лишь несколько почвенных параметров; вполне возможно, что не учтенные при этом факторы (другие измерения ниш) могли обусловить взаимоотношения, отличные от наблюдавшихся. И наконец, остается неизвестным, конкурируют ли растения за какие-либо из учтенных почвенных ресурсов в настоящее время. Таким образом, результаты позволяют лишь предполагать существование конкуренции.[ …]
В-третьих, анализировалось лишь несколько почвенных параметров; вполне возможно, что не учтенные при этом факторы (другие измерения ниш) могли обусловить взаимоотношения, отличные от наблюдавшихся. И наконец, остается неизвестным, конкурируют ли растения за какие-либо из учтенных почвенных ресурсов в настоящее время. Таким образом, результаты позволяют лишь предполагать существование конкуренции.[ …]
Содержание цинка в зерновых злаках меньше, чем в бобовых культурах. Медь в высоких концентрациях способна оказывать фитотоксическое действие, вдвое превышающее фитотоксичность цинка. Угнетение растений медью наблюдается на легких обедненных гумусом почвах. Симптомы избытка меди проявляются в виде хлороза и образования боковых корней коричневого цвета.[ …]
Другой пример симбиоза — это сожительство высших растений с бактериями, так называемая бактериотрофия. Симбиоз с клубеньковыми бактериями-азотофиксаторами широко распространен среди бобовых (93% изученных видов) и мимозовых (87%). Так, бактерии из рода ЛЫгоЫшп, живущие в клубеньках на корнях бобовых растений, обеспечиваются пищей (сахара) и местообитанием, а растения получают от них взамен доступную форму азота (рис. 6.13).[ …]
Так, бактерии из рода ЛЫгоЫшп, живущие в клубеньках на корнях бобовых растений, обеспечиваются пищей (сахара) и местообитанием, а растения получают от них взамен доступную форму азота (рис. 6.13).[ …]
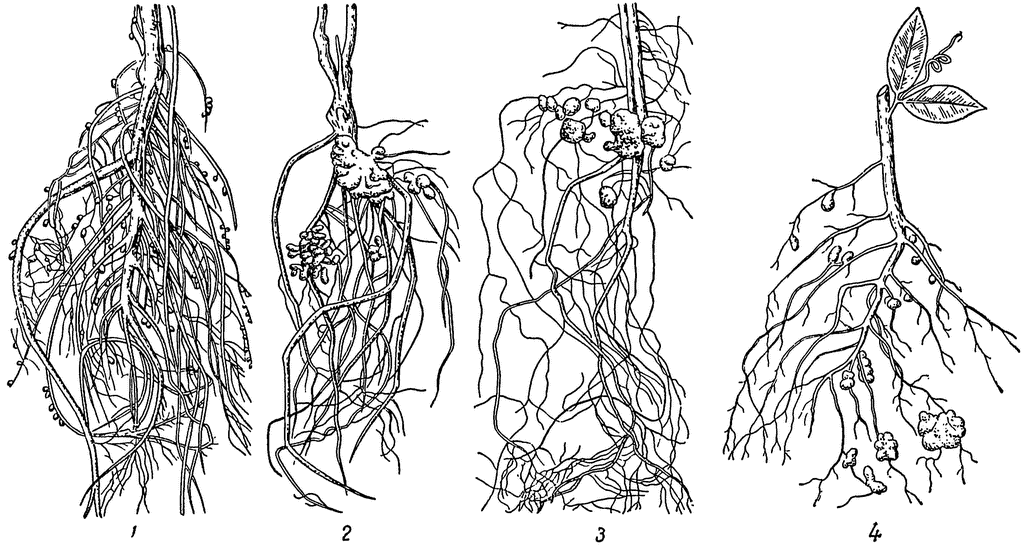
Выкопайте из земли какое-нибудь хорошо развившееся бобовое растение (горох, бобы, вику, клевер и т. п.), отмойте осторожно корни его от почвы, и вы увидите на корнях клубеньки. Клубеньки у разных растений не одинаковые: у гороха и вики — в виде горошинок, висящих на тонких корешках; у клевера в виде маленьких шариков с булавочную головку, которыми усыпаны все корни; у бобов в виде крупных желваков на главном корне (рис. 18). У других растений — небобовых — таких клубеньков нет.[ …]
РАЗНОТРАВЬЕ — совокупность двудольных травянистых растений в фитоценозе [24]. На практике в Р. включают все виды кроме злаков, бобовых и осоковых [85]. Р. широко распространено в травостоях лугов и степей.[ …]
Клевер белый, или ползучий (Trifolium reperts L.),- многолетнее бобовое растение низового типа. Типично пастбищное растение, образующее прочную дернину. Весной отрастает рано, хорошо переносит частые стравливания. К почвам не требователен, но плохо растет на кислых почвах. Влаголюбив, устойчив к временному избыточному переувлажнению почвы.[ …]
Типично пастбищное растение, образующее прочную дернину. Весной отрастает рано, хорошо переносит частые стравливания. К почвам не требователен, но плохо растет на кислых почвах. Влаголюбив, устойчив к временному избыточному переувлажнению почвы.[ …]
Люцерна синяя, или посевная (Medicago sativa L.) — многолетнее бобовое растение высотой до 170 см. По питательности люцерна превосходит клевер красный. Урожай сена достигает 100 ц/га. С весны рано отрастает, обладает отавностью. Зимостойкость выше, чем у клевера. Хороший компонент в сенокосных травосмесях, особенно с костером безостным.[ …]
Из всех этих примеров симбиоз клубеньковых бактерий с бобовыми изучен наиболее тщательно, поскольку эти растения имеют для человека огромное значение.[ …]
Люцерна малая, или крымский репей. Однолетнее невысокое растение из семейства бобовых, широко распространенное в Крыму, на Северном Кавказе, юге Украины и в Средней Азии. Люцерна малая является одним из самых злостных, имеющих очень трудноотделимые из шерсти плоды, сорняков. [ …]
[ …]
Хорошим примером симбиоза могут служить отношения между бобовыми растениями и клубеньковыми бактериями, образующими на корнях растений клубёньки и фиксирующими , атмосферный азот. Растение снабжает микробов необходимой им углеродистой пищей, а от них получает усвояемые соединения азота. В случае односторонней выгоды отношения будут называться паразитическими. Все бактерии, вызывающие заболевания растений и животных, являются паразитическими организмами.[ …]
Данные палеонтологии свидетельствуют о том, что самыми древними бобовыми культурами, имевшими клубеньки, были некоторые растения, принадлежащие к группе Eucaesal-pinioideae.[ …]
В современных условиях в круговорот азота заметно вмешивается человек. На обширных площадях он выращивает азотфиксирующие бобовые растения, связывающие природный азот. Считают, что сельское хозяйство и промышленность дают почти на 60% больше фиксированного азота, чем естественные наземные экосистемы.[ …]
Круговорот азота. Атмосферный молекулярный азот служит основным источником для перевода азота в состав сложных органических веществ.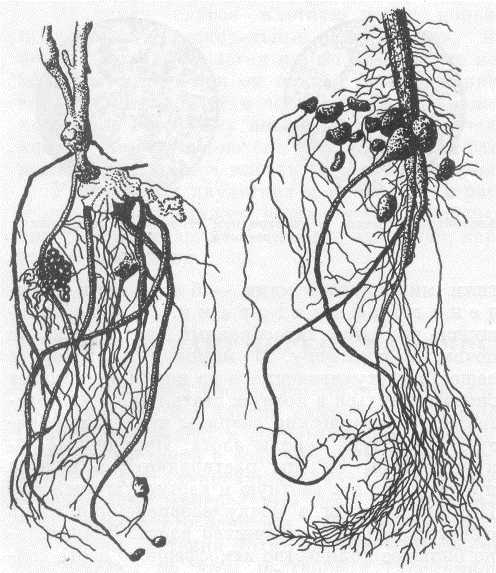 Предварительно он переходит в доступные живым организмам соединения. Это может происходить различными путями, например при фотохимической фиксации азота или при грозах с образованием смеси [ 10х оксидов азота. Последние с дождевыми водами попадают в почву в виде селитры (нитратов аммония, натрия, калия, кальция и др.) или азотной кислоты. Далее азот в результате деятельности азотфиксирующих микроорганизмов переводится в сложные органические соединения — протеиды. Они представляют собой соединения белков (протеинов) с небелковыми веществами, например с углеводами или жироподобными. Азот наиболее эффективно фиксируется бактериями, находящимися в симбиотической связи с бобовыми и другими растениями. Далее он в органической форме диффундирует в ризосферу (часть почвы, непосредственно соприкасающуюся с корнями растений) и затем включается в наземные органы растения, где и используется для синтеза протеинов. Последние являются основой азотного питания животных.[ …]
Предварительно он переходит в доступные живым организмам соединения. Это может происходить различными путями, например при фотохимической фиксации азота или при грозах с образованием смеси [ 10х оксидов азота. Последние с дождевыми водами попадают в почву в виде селитры (нитратов аммония, натрия, калия, кальция и др.) или азотной кислоты. Далее азот в результате деятельности азотфиксирующих микроорганизмов переводится в сложные органические соединения — протеиды. Они представляют собой соединения белков (протеинов) с небелковыми веществами, например с углеводами или жироподобными. Азот наиболее эффективно фиксируется бактериями, находящимися в симбиотической связи с бобовыми и другими растениями. Далее он в органической форме диффундирует в ризосферу (часть почвы, непосредственно соприкасающуюся с корнями растений) и затем включается в наземные органы растения, где и используется для синтеза протеинов. Последние являются основой азотного питания животных.[ …]
Оптимизация симбиотической деятельности бобовых культур » Строительный онлайн-ресурс
Новости 19. Промокод — это уникальная возможность приобрести ту вещь, о которой долго мечтал, по более низкой цене. Он выглядит как… 18.11.2022 Совершая покупки в интернете с умом, люди могут существенно экономить собственные деньги. Наиболее популярным способом… 18.11.2022 В каждом жилище есть смесители для ванной комнаты и кухни. В основном, они разного типа, так как в каждом из помещений… | 02.02.2014 Наиболее важным элементом белка является азот, поэтому его недостаток растениям лимитирует, прежде всего, синтез белка. Еще в конце 19 в. известный немецкий ученый Ф. Шульц писал: «Если не говорить о воде, то именно азот является самым могущественным двигателем в процессах развития, роста и творчества природы. Его уловить, им овладеть — вот в чем задача, его сберечь — вот в чем ключ к экономике; подчинить себе его источник, бьющий с неистощимой энергией, — вот в чем тайна благосостояния». Для образования, нормального роста и функционирования клубеньков требуется нейтральная или слабокислая реакция почвы. Как все биологические процессы, фиксация азота зависит от температуры. Важно отметить, что при симбиотическом азотном питании растения более требовательны к уровню фосфорного питания, нежели при питании азотом удобрений. В отличие от зернобобовых ранневесенние и поукосные подкормки азотом многолетних трав — клевера, люцерны и эспарцета меньше снижают азотфиксацию, чем допосевное применение азотных удобрений. |
Новый аспект взаимодействия растений и ризобий: биосинтез алкалоидов в Crotalaria зависит от нодуляции
1. Oldroyd GED, Downie JA. Координация морфогенеза клубеньков с ризобиальной инфекцией бобовых. Annu Rev Plant Biol. 2008; 59: 519–546. [PubMed] [Google Scholar]
Oldroyd GED, Downie JA. Координация морфогенеза клубеньков с ризобиальной инфекцией бобовых. Annu Rev Plant Biol. 2008; 59: 519–546. [PubMed] [Google Scholar]
2. Lodwig EM, et al. Аминокислотный цикл стимулирует фиксацию азота в бобово-ризобиальном симбиозе. Природа. 2003; 422 (6933): 722–726. [PubMed] [Google Scholar]
3. Oldroyd GED, Harrison MJ, Paszkowski U. Перепрограммирование растительных клеток для эндосимбиоза. Наука. 2009 г.;324(5928):753–754. [PubMed] [Google Scholar]
4. Oldroyd GED, Murray JD, Poole PS, Downie JA. Правила участия в бобово-ризобиальном симбиозе. Анну Рев Жене. 2011;45:119–144. [PubMed] [Google Scholar]
5. Benedito VA, et al. Атлас экспрессии генов модельного бобового растения Medicago truncatula . Плант Дж. 2008; 55 (3): 504–513. [PubMed] [Google Scholar]
6. Doignon-Bourcier F, et al. Генотипическая характеристика штаммов Bradyrhizobium , образующих клубеньки на небольших сенегальских бобовых, с помощью межгенных генных спейсеров 16S-23S рРНК и анализа отпечатков пальцев полиморфизма длины амплифицированного фрагмента.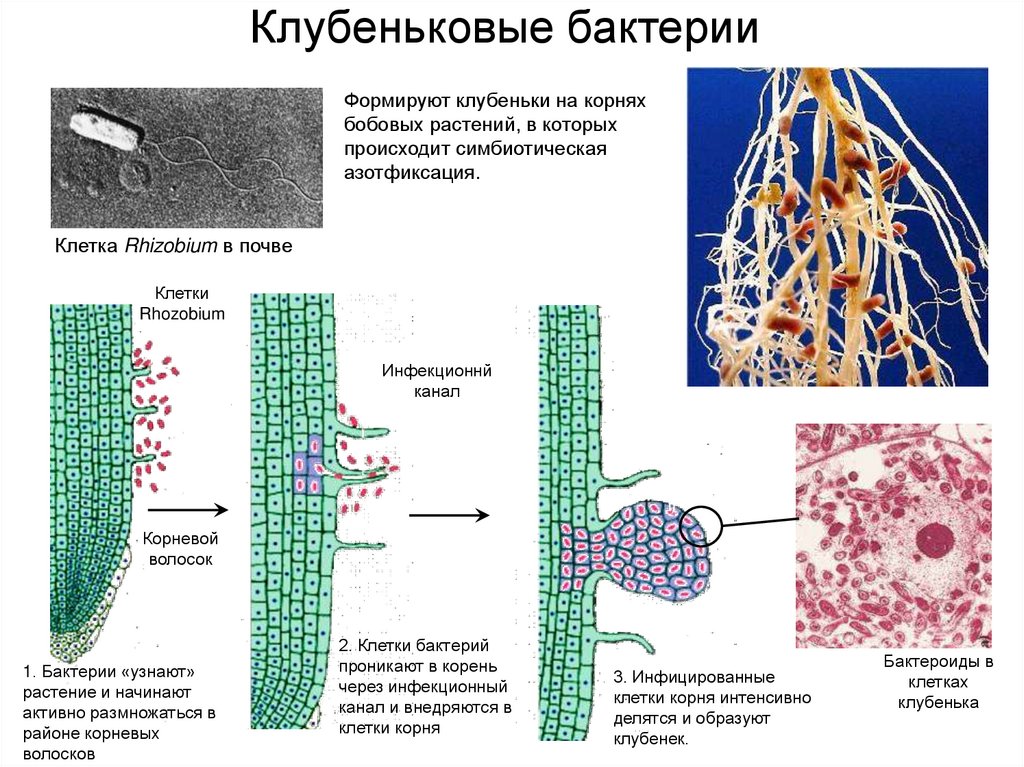 Appl Environ Microbiol. 2000;66(9): 3987–3997. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Appl Environ Microbiol. 2000;66(9): 3987–3997. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Sy A, et al. Образование клубеньков на некоторых бобовых рода Crotalaria новым видом Methylobacterium . Может J Microbiol. 2001;47(6):503–508. [PubMed] [Google Scholar]
8. Полхилл Р.М. Crotalaria в Африке и на Мадагаскаре. Университет Чикаго Пресс; Chicago: 1982. [Google Scholar]
9. Fletcher MT, McKenzie RA, Blaney BJ, Reichmann KG. Пирролизидиновые алкалоиды в Crotalaria таксонов из северной Австралии: риск для выпаса скота. J Agric Food Chem. 2009;57(1):311–319. [PubMed] [Google Scholar]
10. Thoden TC, Boppré M. Растения, производящие пирролизидиновые алкалоиды: устойчивые инструменты для борьбы с нематодами? Нематология. 2010; 12:1–24. [Google Scholar]
11. Böttcher F, Adolph RD, Hartmann T. Гомоспермидинсинтаза, первый фермент, специфичный для пути биосинтеза пирролизидиновых алкалоидов. Фитохимия. 1993;32(3):679–689. [Академия Google]
[Академия Google]
12. Обер Д., Хартманн Т. Гомоспермидинсинтаза, первый специфичный для пути фермент биосинтеза пирролизидиновых алкалоидов, произошел от дезоксигипузинсинтазы. Proc Natl Acad Sci USA. 1999;96(26):14777–14782. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Reimann A, Nurhayati N, Backenköhler A, Ober D. Повторная эволюция системы защиты, опосредованной пирролизидиновыми алкалоидами, в отдельных линиях покрытосеменных растений. Растительная клетка. 2004;16(10):2772–2784. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Kaltenegger E, Eich E, Ober D. Эволюция гомоспермидинсинтазы у Convolvulaceae: история дупликации генов, потери генов и периодов различных воздействий отбора. Растительная клетка. 2013;25(4):1213–1227. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Нурхайати Н., Гонде Д., Обер Д. Эволюция пирролизидиновых алкалоидов в орхидеях Phalaenopsis и других однодольных: идентификация дезоксигипузинсинтазы, гомоспермидинсинтазы и родственных псевдогенов. Фитохимия. 2009 г.;70(4):508–516. [PubMed] [Google Scholar]
Фитохимия. 2009 г.;70(4):508–516. [PubMed] [Google Scholar]
16. Хартманн Т., Витте Л. Химия, биология и химико-экология пирролизидиновых алкалоидов. В: Pelletier SW, редактор. Алкалоиды: химические и биологические перспективы. Том 9. Пергамон; Оксфорд: 1995. С. 155–233. [Google Scholar]
17. Нурхаяти Н., Обер Д. Рекрутирование алкалоид-специфичной гомоспермидинсинтазы (HSS) из вездесущей дезоксигипузинсинтазы: обладает ли Crotalaria функциональным HSS, который все еще обладает активностью DHS? Фитохимия. 2005;66(11):1346–1357. [PubMed] [Академия Google]
18. Гамо Т., Ито А., Савадзаки А., Мангиат И.Дж., Мендоса Д.М. Rhizobia собраны с бобовых растений на Филиппинах. Bull Natl Inst Agrobiol Resour. 1991; 6: 111–129. [Google Scholar]
19. Флорес А.С., Азеведо Тоцци AMG, Триго Дж.Р. Профили пирролизидиновых алкалоидов у видов Crotalaria из Бразилии: хемотаксономическое значение. Биохим Сист Экол. 2009;37(4):459–469. [Google Scholar]
20. Toppel G, Witte L, Hartmann T. N-окисление и деградация пирролизидиновых алкалоидов при прорастании Crotalaria scassellatii . Фитохимия. 1988;27(12):3757–3760. [Google Scholar]
Toppel G, Witte L, Hartmann T. N-окисление и деградация пирролизидиновых алкалоидов при прорастании Crotalaria scassellatii . Фитохимия. 1988;27(12):3757–3760. [Google Scholar]
21. Чанг А., Хартманн Т. Солюбилизация и характеристика сенеционин N -оксигеназы из проростков Crotalaria scassellatii . Фитохимия. 1998; 49 (7): 1859–1866. [Google Scholar]
22. Day DA, Carroll BJ, Delves AC, Gresshoff PM. Взаимосвязь между ауторегуляцией и нитратным ингибированием образования клубеньков у соевых бобов. Завод Физиол. 1989;75(1):37–42. [Академия Google]
23. Кусари С., Хертвек С., Спителлер М. Химическая экология эндофитных грибов: происхождение вторичных метаболитов. хим. биол. 2012;19(7):792–798. [PubMed] [Google Scholar]
24. Shaw FL, et al. Эволюция и разнообразный горизонтальный перенос альтернативного пути биосинтеза альтернативного полиамина sym -гомоспермидина. Дж. Биол. Хим. 2010;285(19):14711–14723. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Ober D, Kaltenegger E. Биосинтез пирролизидиновых алкалоидов, эволюция пути вторичного метаболизма растений. Фитохимия. 2009 г.;70(15-16):1687–1695. [PubMed] [Google Scholar]
Ober D, Kaltenegger E. Биосинтез пирролизидиновых алкалоидов, эволюция пути вторичного метаболизма растений. Фитохимия. 2009 г.;70(15-16):1687–1695. [PubMed] [Google Scholar]
26. Moll S, et al. Клеточно-специфическая экспрессия гомоспермидинсинтазы, входного фермента пути пирролизидиновых алкалоидов в Senecio vernalis , по сравнению с ее предком, дезоксигипузинсинтазой. Завод Физиол. 2002;130(1):47–57. [Статья бесплатно PMC] [PubMed] [Google Scholar]
27. Ober D, Harms R, Witte L, Hartmann T. Молекулярная эволюция путем изменения функции: алкалоид-специфическая гомоспермидинсинтаза сохранила все свойства дезоксигипузинсинтазы, кроме связывания с eIF5A. белок-предшественник. Дж. Биол. Хим. 2003;278(15):12805–12812. [PubMed] [Академия Google]
28. Nishimura K, et al. Независимые роли eIF5A и полиаминов в пролиферации клеток. Biochem J. 2005; 385 (Pt 3): 779–785. [Статья бесплатно PMC] [PubMed] [Google Scholar]
29. Анке С., Нимюллер Д., Молл С., Хэнш Р. , Обер Д. Полифилетическое происхождение пирролизидиновых алкалоидов в сложноцветных: данные дифференциальной тканевой экспрессии гомоспермидинсинтазы. Завод Физиол. 2004;136(4):4037–4047. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Обер Д. Полифилетическое происхождение пирролизидиновых алкалоидов в сложноцветных: данные дифференциальной тканевой экспрессии гомоспермидинсинтазы. Завод Физиол. 2004;136(4):4037–4047. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Нимюллер Д., Рейманн А., Обер Д. Отчетливая клеточно-специфическая экспрессия гомоспермидинсинтазы, участвующей в биосинтезе пирролизидиновых алкалоидов у трех видов Boraginales. Завод Физиол. 2012;159(3): 920–929. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Smith TA. Гомоспермидин в Rhizobium и корневые клубеньки бобовых. Фитохимия. 1977; 16: 278–279. [Google Scholar]
32. Fujihara S, Abe H, Minakawa Y, Akao S, Yoneyama T. Полиамины в конкрециях из различных растительно-микробных симбиотических ассоциаций. Физиология клеток растений. 1994;35(8):1127–1134. [Google Scholar]
33. Tholl D, Ober D, Martin W, Kellermann J, Hartmann T. Очистка, молекулярное клонирование и экспрессия в Escherichia coli гомоспермидинсинтазы из Rhodopseudomonas viridis . Евр Дж Биохим. 1996;240(2):373–379. [PubMed] [Google Scholar]
Евр Дж Биохим. 1996;240(2):373–379. [PubMed] [Google Scholar]
34. Ober D, Tholl D, Martin W, Hartmann T. Гомоспермидинсинтаза Rhodopseudomonas viridis : субстратная специфичность и влияние гетерологически экспрессируемого фермента на метаболизм полиаминов Escherichia coli . J Gen Appl Microbiol. 1996;42(5):411–419. [Google Scholar]
35. Обер Д., Хартманн Т. Филогенетическое происхождение вторичного пути: случай пирролизидиновых алкалоидов. Завод Мол Биол. 2000;44(4):445–450. [PubMed] [Академия Google]
36. Хартманн Т., Обер Д. Биосинтез и метаболизм пирролизидиновых алкалоидов в растениях и специализированных травоядных насекомых. В: Leeper FJ, Vederas JC, редакторы. Темы современной химии. Том 209. Спрингер; Берлин: 2000. С. 207–244. [Google Scholar]
37. Baldwin IT, Gorham D, Schmelz EA, Lewandowski CA, Lynds GY. Выделение азота для индуцируемой защиты и производства семян у Nicotiana attenuata . Экология. 1998;115(4):541–552.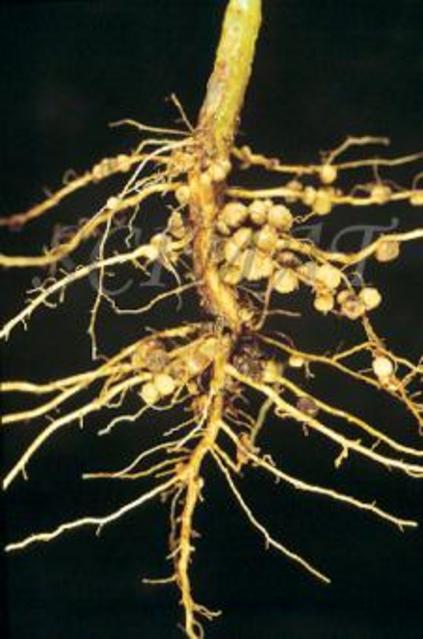 [PubMed] [Академия Google]
[PubMed] [Академия Google]
38. Эйснер Т., Мейнвальд Дж. Химия полового отбора. Proc Natl Acad Sci USA. 1995;92(1):50–55. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Науманн С., Хартманн Т., Обер Д. Эволюционное привлечение флавин-зависимой монооксигеназы для детоксикации пирролизидиновых алкалоидов, приобретенных растением-хозяином, у защищаемой алкалоидами арктоидной моли. Tyria jacobaeae . Proc Natl Acad Sci USA. 2002;99(9):6085–6090. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Sehlmeyer S, et al. Флавин-зависимые монооксигеназы как механизм детоксикации у насекомых: новые данные о арктиидах (чешуекрылых) PLoS ONE. 2010;5(5):e10435. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. McKey D. Распределение вторичных соединений в растениях. В: Розенталь Г.А., Янцен Д.Х., редакторы. Травоядные: их взаимодействие со вторичными метаболитами растений. Академический; Нью-Йорк: 1979. С. 55–133. [Google Scholar]
42. Hartmann T, Ehmke A, Eilert U, von Borstel K, Theuring C. Сайты синтеза, транслокации и накопления пирролизидинового алкалоида N -оксиды в Senecio vulgaris L. Planta. 1989;177(1):98–107. [PubMed] [Google Scholar]
Hartmann T, Ehmke A, Eilert U, von Borstel K, Theuring C. Сайты синтеза, транслокации и накопления пирролизидинового алкалоида N -оксиды в Senecio vulgaris L. Planta. 1989;177(1):98–107. [PubMed] [Google Scholar]
43. Borthakur D, Soedarjo M, Fox PM, Webb DT. Средние гены Rhizobium sp штамма TAL1145 необходимы для деградации мимозина в 3-гидрокси-4-пиридон и индуцируются мимозином. Микробиология. 2003; 149 (часть 2): 537–546. [PubMed] [Google Scholar]
44. Renier A, et al. Клубеньки Crotalaria podocarpa DC. по Methylobacterium nodulans имеет очень необычные черты. J Опытный бот. 2011;62(10):3693–3697. [PubMed] [Google Scholar]
45. Yoneyama T, Kondo M. Sesbania spp., Aeschynomene indica и Crotalaria spp. являются экспортерами амидов. Почвоведение Растениеводство. 1990;36(4):689–693. [Google Scholar]
46. Скотт П. Физиология и поведение растений. Уайли; Weinheim: 2008. [Google Scholar]
[Google Scholar]
47. Wink M. Эволюция вторичных метаболитов в бобовых (Fabaceae) S Afr J Bot. 2013;89: 164–175. [Google Scholar]
48. Pilbeam DJ, Lyon-Joyce AJ, Bell EA. Наличие пирролизидинового алкалоида монокроталина в семенах Crotalaria . J Nat Prod. 1983;46(5):601–605. [Google Scholar]
49. Williams MC, Molyneux RJ. Наличие, концентрация и токсичность пирролизидиновых алкалоидов в семенах Crotalaria . Сорняк наук. 1987; 35: 476–481. [Google Scholar]
50. Берингер Дж.Э. Перенос фактора R в Rhizobium leguminosarum . J Gen Microbiol. 1974;84(1):188–198. [PubMed] [Google Scholar]
51. Барбулова А., Чиурацци М. Процедура исследования клубеньков Lotus japonicus in vitro . В: Маркес А.Дж., редактор. Справочник по Lotus japonicus. Спрингер; Дордрехт, Нидерланды: 2005. стр. 83–86. [Google Scholar]
52. Oksman-Caldentey K-M, Kivelä O, Hiltunen R. Спонтанный органогенез побегов и регенерация растений из культур волосовидных корней Hyoscyamus muticus . Растениевод. 1991;78(1):129–136. [Академия Google]
Растениевод. 1991;78(1):129–136. [Академия Google]
53. Zörb C, et al. Молекулярная характеристика антипортеров Na + /H + ( ZmNHX ) кукурузы ( Zea mays L.) и их экспрессия в условиях солевого стресса. Дж. Физиол растений. 2005;162(1):55–66. [PubMed] [Google Scholar]
54. Фрелих С., Обер Д., Хартманн Т. Тканевое распределение, основной биосинтез и диверсификация пирролизидиновых алкалоидов ликопсаминового типа у трех видов Boraginaceae. Фитохимия. 2007;68(7):1026–1037. [PubMed] [Академия Google]
55. Ober D, Hartmann T. Дезоксигипузинсинтаза из табака: выделение кДНК, характеристика и бактериальная экспрессия фермента с расширенной субстратной специфичностью. Дж. Биол. Хим. 1999;274(45):32040–32047. [PubMed] [Google Scholar]
56. Huang SH, Hu YY, Wu CH, Holcenberg J. Простой метод прямого клонирования последовательности кДНК, которая фланкирует область известной последовательности из тотальной РНК, путем применения обратной полимеразной цепной реакции.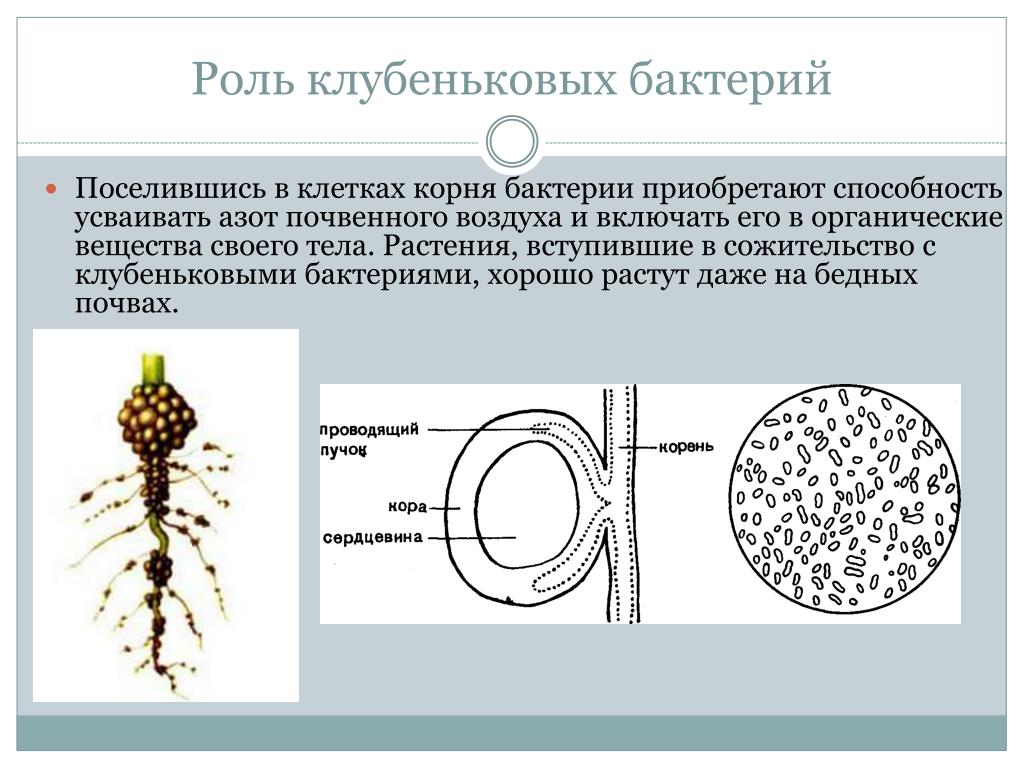 Нуклеиновые Кислоты Res. 1990;18(7):1922. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 1990;18(7):1922. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Брэдфорд ММ. Быстрый и чувствительный метод количественного определения белка в микрограммах, использующий принцип связывания белка с красителем. Анальная биохимия. 1976; 72: 248–254. [PubMed] [Google Scholar]
58. Schmittgen TD, Livak KJ. Анализ данных ПЦР в реальном времени сравнительным методом C(T). Нат Проток. 2008;3(6):1101–1108. [PubMed] [Google Scholar]
цветковых растений — Страница 2 — Ботанический сад Бристольского университета
Нектар — это сладкая награда, которую цветущие растения дают животным в обмен на их услуги в качестве опылителей. С одной стороны, это звучит невероятно просто — это похоже на вознаграждение собаки угощением после того, как она выполнила команду. Однако копните немного глубже, и вы поймете, что репродуктивный успех растения зависит от очень тонких, но сложных характеристик этого вещества, в том числе от того, когда оно производится и в каком количестве, а также от самого его состава.
Цветущие растения оптимизируют характеристики своего нектара, чтобы влиять на поведение опылителей при поиске пищи и, в конечном счете, улучшать их репродуктивную способность. Характеристики нектара определяют не только то, какие опылители привлекаются и когда они приходят, но и то, как часто они посещают и как долго остаются. Вдруг понимаешь, что за секрецией нектара стоит чрезвычайно сложная система регуляторных механизмов, которые повлияли не только на эволюцию цветковых растений, но и на самих опылителей.
Бабочка Красный адмирал ( Vanessa atalanta ) пьющая нектар. Фото: Шелби Темпл. |
Нектар состоит не только из сахара
Но прежде чем мы углубимся в эволюцию, давайте сначала рассмотрим, что такое нектар, потому что, как выясняется, дело не только в сахаре — в нектаре есть ряд вещей, которые важны для опылителей.
Однако нельзя отрицать, что углеводы – сахара, такие как глюкоза, сахароза и фруктоза – обычно являются основным компонентом нектара. Нектар будет содержать от 7 до 70 % углеводов на вес воды [1]. Другие сахара также могут присутствовать в небольших количествах, а также сахарные спирты, такие как сорбит. Именно эти сахара являются основным источником энергии для потребителей нектара.
Аминокислоты и белки являются следующими по распространенности растворенными веществами в нектаре после сахаров. Есть незаменимые и заменимые аминокислоты, которые являются строительными блоками для белков, и есть некоторые небелковые аминокислоты, которые входят в состав ферментов и консервантов. Считается, что содержание аминокислот и белков в нектаре может играть роль во вкусовых предпочтениях насекомых [1], предположительно связанных с их пищевыми потребностями.
Содержание воды в нектаре также может быть важным вознаграждением для опылителей, особенно в засушливых местообитаниях.
Нектар также содержит важные ионы, такие как калий, а также антиоксиданты, следовые количества липидов и некоторые вторичные соединения, которые, по-видимому, связаны с устойчивостью к травоядным.
| Пчела собирает нектар в Ботаническом саду. Фото: Шелби Темпл. |
Было также показано, что многие виды содержат в нектаре антимикробные соединения, которые предотвращают рост микробов в нектаре, а также подавляют болезни, передающиеся через цветы [2].
Терпиноиды, представляющие собой летучие органические соединения, придающие цветам их аромат, также накапливаются в нектаре.
Состав и консистенция нектара чрезвычайно изменчивы, поскольку он настроен на потребности нектароядных (это слово… действительно). Цветы, которые часто посещают колибри, например, обычно производят нектар в небольших количествах с высоким содержанием сахара, в то время как те, которые часто посещают воробьиные птицы, производят разбавленный нектар в больших количествах.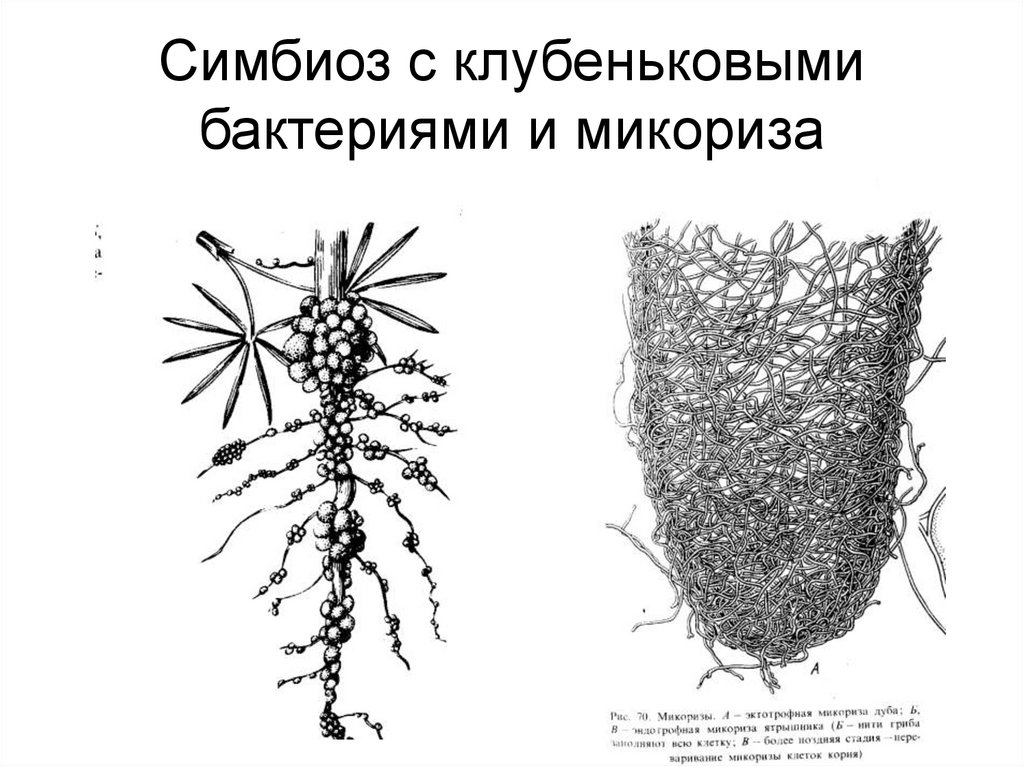 Имеются некоторые свидетельства того, что медоносные пчелы предпочитают более теплый нектар, который менее вязкий, независимо от концентрации сахара [3]. Летучие мыши также, по-видимому, предпочитают менее вязкий нектар, хотя предпочитают более разбавленный нектар, поскольку содержание воды чрезвычайно важно для их регидратации.
Имеются некоторые свидетельства того, что медоносные пчелы предпочитают более теплый нектар, который менее вязкий, независимо от концентрации сахара [3]. Летучие мыши также, по-видимому, предпочитают менее вязкий нектар, хотя предпочитают более разбавленный нектар, поскольку содержание воды чрезвычайно важно для их регидратации.
Не весь нектар вырабатывается в цветке
Нектар вырабатывается в железах, известных как нектарники. Железы обычно находятся у основания цветов, где они производят нектар в качестве награды для опылителей. Однако есть и экстрафлоральные нектарники, расположенные в другом месте растения, часто на листьях или черешке — стебле, который прикрепляет листовую пластинку к стеблю. Эти нектарники обеспечивают вознаграждение мутуалистическим животным, почти исключительно муравьям, которые приносят пользу растению. Муравьи помогают защитить определенные виды растений, избавляясь от яиц травоядных насекомых, отложившихся на листве, и взамен лакомятся богатым питательными веществами нектаром, выделяемым экстрафлоральными нектарниками.
Внефлорные нектарники могут быть особенно важны в определенные периоды жизненного цикла растения. Например, на цветоножке часто располагаются нектарники, выделяющие нектар, когда цветки находятся в бутонах. Это привлекает муравьев, которые помогают защитить уязвимые цветочные почки от травоядных насекомых и улучшают репродуктивный успех растения [4].
В отличие от нектара, вырабатываемого в цветке, нектар, вырабатываемый внецветковыми нектарниками, гораздо менее разнообразен, поскольку привлекает в основном муравьев.
Орхидея Дарвина: классический пример совместной эволюции цветковых растений и их опылителей
На производство нектара может расходоваться до 37% доступной энергии растения [5]. Это означает, что его производство сопряжено с некоторыми затратами для растения, но эти затраты явно перевешиваются преимуществами привлечения опылителей, которые гораздо более эффективны, чем полагаться на ветер или воду.
Эволюция цветковых растений и их опылителей является наиболее часто используемым примером коэволюции — физические характеристики как цветка, так и животного эволюционируют, чтобы стать более специализированными. Около 120 миллионов лет назад медоносные пчелы развили более длинные языки, чем их короткоязычные предки, чтобы получить доступ к нектару, который начали производить цветы. Их социальная структура стала более сложной, они стали более пушистыми и развили пыльцевые корзины, чтобы нести богатую белком пыльцу, но также облегчили их роль опылителей.
Около 120 миллионов лет назад медоносные пчелы развили более длинные языки, чем их короткоязычные предки, чтобы получить доступ к нектару, который начали производить цветы. Их социальная структура стала более сложной, они стали более пушистыми и развили пыльцевые корзины, чтобы нести богатую белком пыльцу, но также облегчили их роль опылителей.
| Орхидея Дарвина в цвету в Ботаническом саду в прошлом году. Фото предоставлено Энди Уинфилдом. |
Цветки также меняли форму в зависимости от предпочтений их опылителей. Самый классический из этих примеров — орхидея Дарвина ( Angraecum sesquipedale ) с высотой цветка от 20 до 35 сантиметров. Мадагаскарская орхидея была названа в честь Дарвина, потому что он предположил, основываясь только на ее форме, что она должна опыляться насекомым с хоботком неслыханной в то время длины. Сорок лет спустя мотылек-сфинкс Моргана ( Xanthopan morganii ), был обнаружен с необычно большим хоботком… и он действительно был опылителем этой орхидеи.
Также считается, что химический состав нектара возник в результате деятельности опылителей. Как упоминалось ранее, летучие мыши предпочитают нектар с низкой концентрацией сахара, и в результате опыленные летучими мышами растения из очень разных и отдаленно родственных таксономических групп выработали нектар с низкой концентрацией сахара.
Обман и грабеж
Не все цветы используют нектар — у некоторых цветы не приносят пользы. Около 30-40% видов семейства орхидей не производят полезный нектар в своих цветах [6] и вместо этого используют различные методы для привлечения опылителей. Цветы орхидеи могут выглядеть как другой вид, который дает нектар, или они могут имитировать укрытия или места расплода или даже самих опылителей, чтобы привлечь внимание людей, ищущих место для укрытия или потенциального партнера (например, у орхидей шмелей). ).
Так же, как растения нашли способы опыления без образования нектара, некоторые животные нашли способы получать нектар, но не быть опылителями. Некоторые посетители цветов, известные как грабители нектара, избегают обычного пути к нектару, обычно полностью избегая отверстия цветка, и протыкают или кусают цветок в другом месте, чтобы извлечь нектар напрямую, не вступая в контакт с какой-либо репродуктивной частью. части.
Некоторые посетители цветов, известные как грабители нектара, избегают обычного пути к нектару, обычно полностью избегая отверстия цветка, и протыкают или кусают цветок в другом месте, чтобы извлечь нектар напрямую, не вступая в контакт с какой-либо репродуктивной частью. части.
В течение многих лет считалось, что похитители нектара оказывают негативное или нейтральное воздействие на растения, но за последние пару десятилетий исследования показали, что они также могут оказывать положительное влияние на растения. Во-первых, некоторые грабители нектара в конечном итоге опыляют растения. Во-вторых, их присутствие может изменить поведение опылителей. Например, если в цветах меньше нектара (из-за того, что грабители извлекли его), то опылители будут посещать больше цветов, увеличивать диапазон кормления, перемещаться на большие расстояния и проводить меньше времени на каждом цветке — все это может улучшить перекрестное опыление и увеличить генетическое разнообразие. . Малуф и др.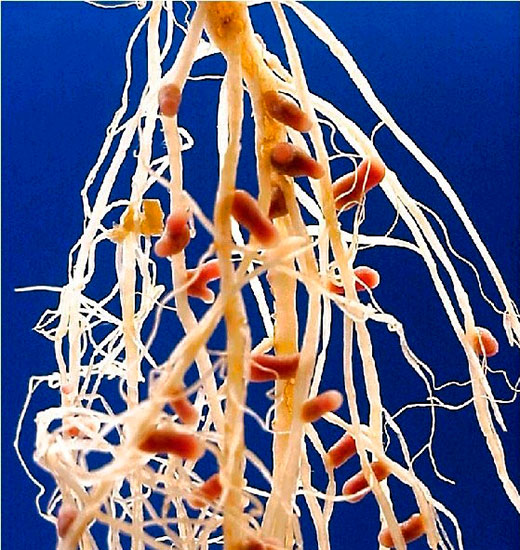 [7] дают хороший обзор по этой теме.
[7] дают хороший обзор по этой теме.
Было проведено обширное исследование характеристик нектара и его связи с опылителями. Однако более поздние исследования начинают раскрывать механизмы, с помощью которых растения производят нектар, — идентифицируя некоторые из путей, по которым сахара транспортируются внутри растения и концентрируются в их нектаре [8]. Еще многое предстоит узнать.
Источники:
[1] Пачини Э., Николсон С.В. (2007). Глава 1: Введение, В: Николсон С.В., Непи М., Пачини Э. (ред.) Нектарники и нектар. Springer: Нидерланды. ISBN: 978-1-4020-5936-0. (страницы 8-10).
[2] Сасу М.А., Уолл К.Л., Стивенсон А.Г. (2010). Противомикробный нектар ингибирует возбудителя, передающегося через цветы дикого вида Cucurbita pepo (Cucurbitaceae). Американский журнал ботаники 97 (6): 1025-1030. (ссылка)
[3] Николсон С.В., де Веер Л., Кёлер А., Пирк К.В.В. Медоносные пчелы предпочитают более теплый нектар и менее вязкий нектар, независимо от концентрации сахара (ссылка).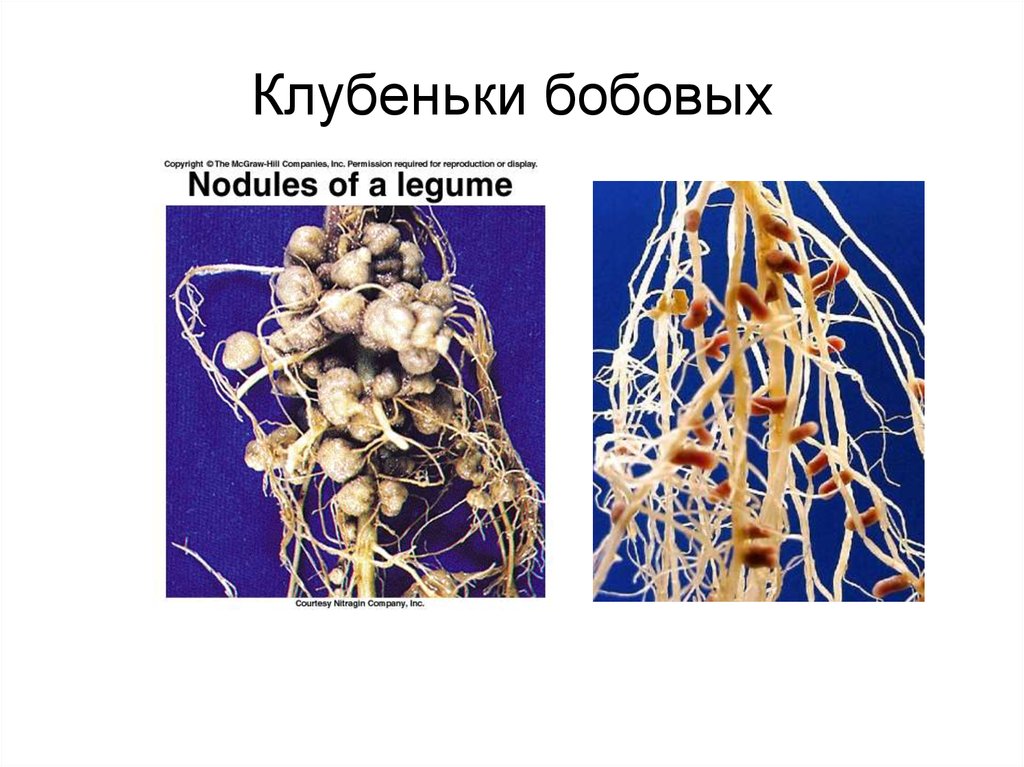

 11.2022
11.2022
 Русский микробиолог М.С. Воронин установил, что «ткань клубеньков содержит миллиарды бактерий», которые проникают в клетки корня из почвы через корневые волоски. Клубеньковые бактерии были впервые выделены в чистой культуре М. Бейеринком в 1888 г. Им установлено, что клубеньковые бактерии вызывают разрастание тканей корня округлой формы (образование клубеньков), в которых происходит усвоение молекулярного азота атмосферы. Форма и размер клубеньков зависит от вида растений. У гороха и вики они слегка продолговатые, у фасоли и сои — шаровидные, у люпина — в виде бесформенных морщинистых образований. Чистая культура Rhizobium не фиксирует газообразный азот -этот процесс протекает лишь в симбиозе с высшими растениями.
Русский микробиолог М.С. Воронин установил, что «ткань клубеньков содержит миллиарды бактерий», которые проникают в клетки корня из почвы через корневые волоски. Клубеньковые бактерии были впервые выделены в чистой культуре М. Бейеринком в 1888 г. Им установлено, что клубеньковые бактерии вызывают разрастание тканей корня округлой формы (образование клубеньков), в которых происходит усвоение молекулярного азота атмосферы. Форма и размер клубеньков зависит от вида растений. У гороха и вики они слегка продолговатые, у фасоли и сои — шаровидные, у люпина — в виде бесформенных морщинистых образований. Чистая культура Rhizobium не фиксирует газообразный азот -этот процесс протекает лишь в симбиозе с высшими растениями.
 Одни расы поселяются только на сое, другие — на горохе, вике, бобах, третьи — на люпине и т.д. При этом крупные клубеньки, расположенные на главном корне и около него на боковых скелетных корнях, обладают более высокой азотфиксирующей активностью, а рассредоточенные по периферии корневой системы мелкие клубеньки, как правило, слабее фиксируют азота или совсем не усваивают его, паразитируя на растении, что иногда приводит даже к снижению урожайности.
Одни расы поселяются только на сое, другие — на горохе, вике, бобах, третьи — на люпине и т.д. При этом крупные клубеньки, расположенные на главном корне и около него на боковых скелетных корнях, обладают более высокой азотфиксирующей активностью, а рассредоточенные по периферии корневой системы мелкие клубеньки, как правило, слабее фиксируют азота или совсем не усваивают его, паразитируя на растении, что иногда приводит даже к снижению урожайности.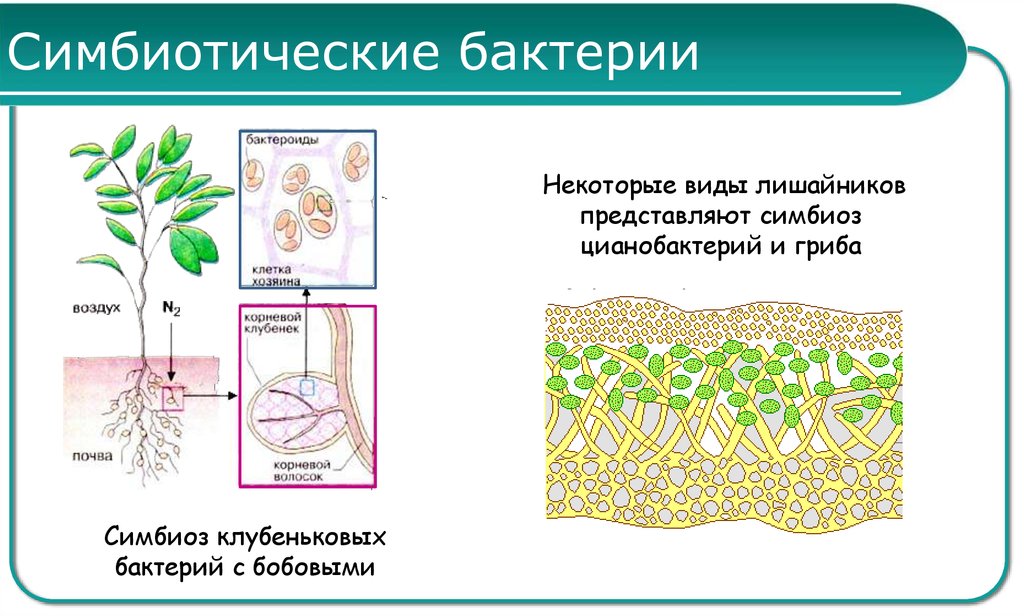 Следовательно, инокуляция очень важный прием для повышения урожайности бобовых, однако ее эффективность зависит от конкретных условий выращивания культуры.
Следовательно, инокуляция очень важный прием для повышения урожайности бобовых, однако ее эффективность зависит от конкретных условий выращивания культуры. При pH 9,0 бактерии практически всех штаммов Rhizobium сильно угнетаются и погибают. Однако оптимальное значение реакции среды пределах указанного диапазона для отдельных бобовых культур различно. По отношению к кислотности почвы, при которой бобовые способны усваивать максимальное количество азота воздуха и формировать наиболее высокий урожай, условно можно разделить на несколько групп.
При pH 9,0 бактерии практически всех штаммов Rhizobium сильно угнетаются и погибают. Однако оптимальное значение реакции среды пределах указанного диапазона для отдельных бобовых культур различно. По отношению к кислотности почвы, при которой бобовые способны усваивать максимальное количество азота воздуха и формировать наиболее высокий урожай, условно можно разделить на несколько групп.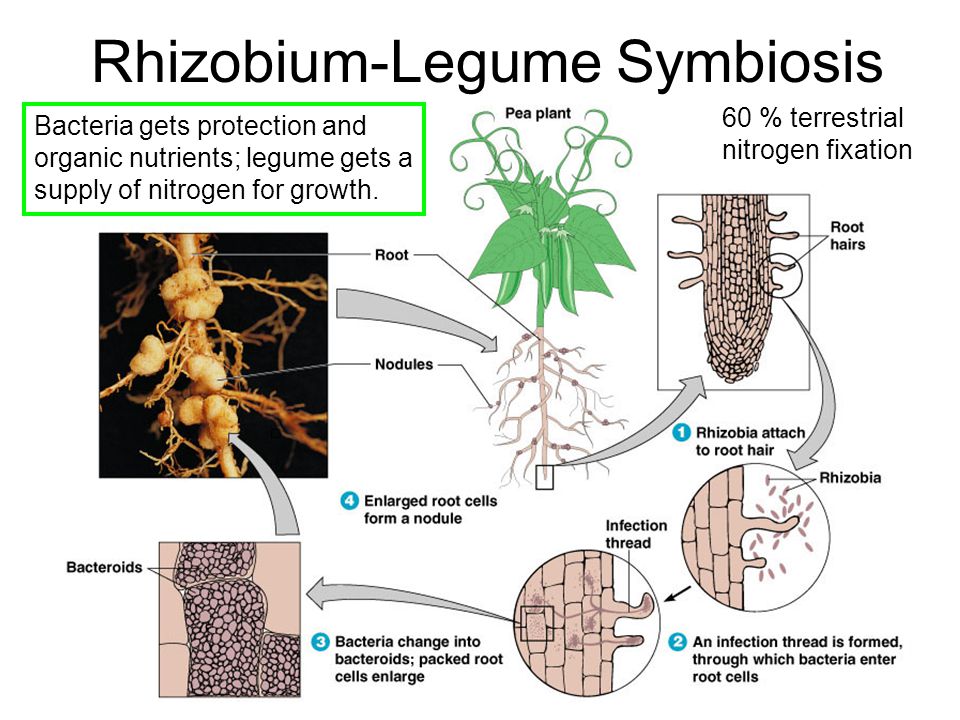
 Однако по мере использования (истощения) запасов воды капилляры разрывается и приток элементов влаги и элементов питания прекращается. В этом случае кончики корня (корешки) вынуждены за счет усиления роста «искать» другие участки с водой и пищей. Рост корней, особенно в тяжелых почвах, связан с большими материальными и энергетическими затратами на механическую работу. Поэтому при влажности почвы несколько ниже влажности разрыва капилляров (около 50% HB) значительная часть продуктов фотосинтеза расходуется на рост корней, «ищущих» воду и питательные вещества. Увеличение расхода продуктов фотосинтеза на рост корневой системы приводит к снижению интенсивности прироста надземной массы и сокращению притока (поступления) углеводов в клубеньки. Установлено, что существенное снижение интенсивности азотфиксации при низкой влажности почвы происходит не из-за дефицита воды в клубеньках (они сами не поглощают воду, а получают ее через корни), а в основном из-за недостаточного притока углеводов, поскольку фиксация атмосферного азота связана с большими энергетическими затратами.
Однако по мере использования (истощения) запасов воды капилляры разрывается и приток элементов влаги и элементов питания прекращается. В этом случае кончики корня (корешки) вынуждены за счет усиления роста «искать» другие участки с водой и пищей. Рост корней, особенно в тяжелых почвах, связан с большими материальными и энергетическими затратами на механическую работу. Поэтому при влажности почвы несколько ниже влажности разрыва капилляров (около 50% HB) значительная часть продуктов фотосинтеза расходуется на рост корней, «ищущих» воду и питательные вещества. Увеличение расхода продуктов фотосинтеза на рост корневой системы приводит к снижению интенсивности прироста надземной массы и сокращению притока (поступления) углеводов в клубеньки. Установлено, что существенное снижение интенсивности азотфиксации при низкой влажности почвы происходит не из-за дефицита воды в клубеньках (они сами не поглощают воду, а получают ее через корни), а в основном из-за недостаточного притока углеводов, поскольку фиксация атмосферного азота связана с большими энергетическими затратами.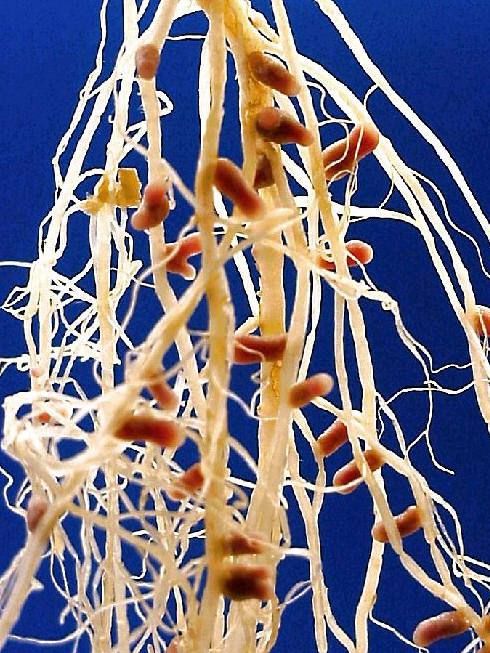 Экспериментально доказано, что на фиксацию атмосферного азота бобовые расходуют от 20 до 35% синтезированных в процессе фотосинтеза углеводов.
Экспериментально доказано, что на фиксацию атмосферного азота бобовые расходуют от 20 до 35% синтезированных в процессе фотосинтеза углеводов.

 При низком содержании фосфора в почве клубеньковые бактерии, проникая в корень, не образуют клубеньки. Поскольку фиксация атмосферного азота происходит с большой затратой энергии, поставляемой АТФ, ключевая роль в котором принадлежит фосфору, то при недостатке фосфора меньше образуется АТФ и слабее протекает азотфиксация. Для формирования 1 т зерна и соответствующего количества соломы зернобобовые потребляют 55-70 кг азота, 15-25 фосфора, 25-40 калия, 20-35 кальция (табл. 11.3).
При низком содержании фосфора в почве клубеньковые бактерии, проникая в корень, не образуют клубеньки. Поскольку фиксация атмосферного азота происходит с большой затратой энергии, поставляемой АТФ, ключевая роль в котором принадлежит фосфору, то при недостатке фосфора меньше образуется АТФ и слабее протекает азотфиксация. Для формирования 1 т зерна и соответствующего количества соломы зернобобовые потребляют 55-70 кг азота, 15-25 фосфора, 25-40 калия, 20-35 кальция (табл. 11.3).
 При этом, чем выше дозы азотных удобрений и содержание минерального азота в почве, тем продолжительнее задерживается образование клубеньков и сильнее ингибируется фиксация азота. В сельскохозяйственной практике перед посевом зернобобовых нередко вносят «стартовые» дозы азота (20-30 кг/га) удобрений, рассчитанных на питание растений до начала активной симбиотической фиксации азота.
При этом, чем выше дозы азотных удобрений и содержание минерального азота в почве, тем продолжительнее задерживается образование клубеньков и сильнее ингибируется фиксация азота. В сельскохозяйственной практике перед посевом зернобобовых нередко вносят «стартовые» дозы азота (20-30 кг/га) удобрений, рассчитанных на питание растений до начала активной симбиотической фиксации азота.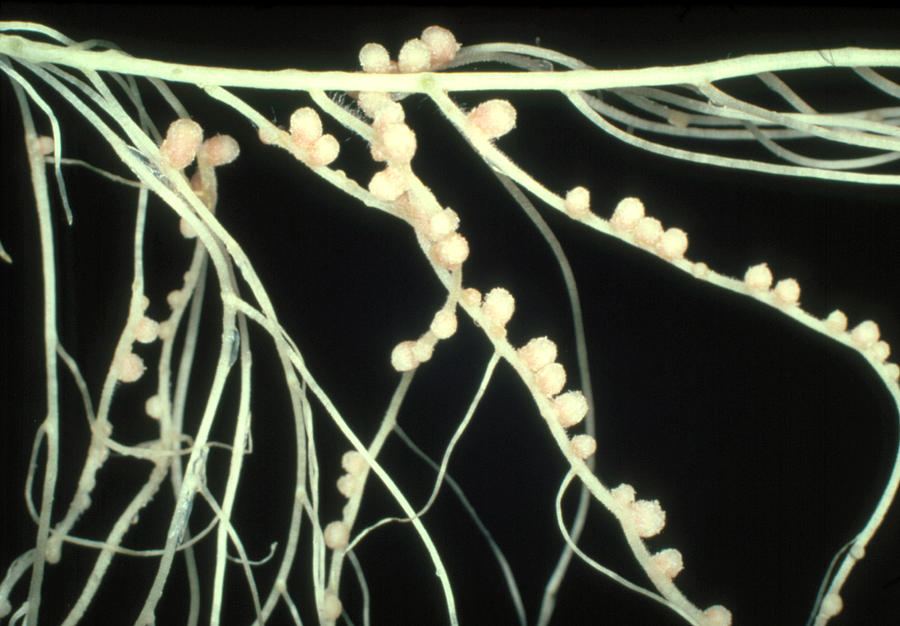 Такое его количество практически всегда содержится в корнеобитаемом слое любых почв, и растения редко испытывают азотное голодания впервые фазы развития.
Такое его количество практически всегда содержится в корнеобитаемом слое любых почв, и растения редко испытывают азотное голодания впервые фазы развития. Поэтому на средне- и хорошоокультуренных почвах азотные удобрения под зернобобовые культуры вносить не следует.
Поэтому на средне- и хорошоокультуренных почвах азотные удобрения под зернобобовые культуры вносить не следует.