Содержание
Как и почему реагируют растения на свет?
V межрайонная научно-практическая конференция учащихся
муниципальных общеобразовательных учреждений
«Школьная исследовательская инициатива»
Как и почему реагируют растения на свет?
Выполнили:
Прокопченко Елизавета Валерьевна,
Саранова Наталья Александровна,
ученицы 5 «А» класса,
МКОУ Калачеевская СОШ № 1
Руководители:
Шевырева Ольга Дмитриевна,
учитель химии,
Шевцова Светлана Тихоновна,
учитель биологии
Калач 2015
Содержание
1. Введение………………………………………………………………….3
2. Фототропизм растений…………………………………………………5
2.1. Что такое фототропизм?………………………………………..5
2.2. Методика результаты исследования…………………………….5
2.3. Общие выводы…………………………………………………..7
3. Заключение………………………………………………………………8
4. Список использованной литературы……………………………………9
Список использованной литературы……………………………………9
5. Приложение…………………………………………………………….10
1. Введение.
Природа полна загадок. Открыть для себя природную тайну – это значит необходимо провести исследование с организацией экспериментальных опытов. Что очень актуально сегодня при обучении нас пятиклассников по новым государственным стандартам.
Во внеурочное время познакомились с оборудованием школьной лаборатории «Архимед», комплектом лабораторного оборудования «Прорастание» (Приложение 1). Из всего многообразия предложенных приборов и работ больше всего понравилась работа о фототропизме. Почему? Постоянно при уходе за комнатными растениями наблюдали изменение роста самого растения или положения листьев в сторону света. Не правда, ли знакомая картина: растение, выставленное на подоконник, вскоре поворачивается лицом к улице, и, чтобы сохранить его форму, приходиться его время от времени переставлять (Приложение 1).
Но у растений нет нервной системы, тогда как они могут реагировать на свет? Чувствительны ли к свету семена растений и насколько произойдет изменение их роста? Что бы правильно ответить на поставленные вопросы решили провести опыты и убедиться в своих догадках по данному вопросу.
Цель работы: установить зависимость прорастания семян и растений от направления света.
Задача:
- работа с информационными источниками;
- эксперимент;
- наблюдение;
- сравнение;
- анализ и обобщение информации.
Гипотеза: изменения положения прорастающих семян и растений на подоконнике зависят от направления света.
Объект исследования: семена огурца сорта «Зозуля».
В своей работе использовали следующие методы: описательный, сравнительный, экспериментальный.
Время проведения исследований: ноябрь — декабрь 2014г
2. Фототропизм растений.
2.1. Что такое фототропизм?
Из научной литературы, школьного учебника по биологии, беседы с учителями предметниками узнала что:
- растения улавливают свет листовыми пластинками;
- листовые черешки способны изгибаться, поворачивая пластинку к свету;
- фототропизм – реакция органов растений на свет;
- направления лучей света вызывают одностороннее движение органов растения;
- ростовые движения регулируются химическими веществами – фитогормонами.

Таким образом, в самом деле:
1. Растение «передвигаются» совсем не так, как это делают люди и животные, — оно растет в определенном направлении. Хотя движения растений отличны от движений представителей животного царства, но они приводят к тому, же результату – изменению положения в пространстве.
2. Ростовые движения регулируются фитогормонами. Когда одна сторона растения или семени затенена, гормон роста перемещается на теневую сторону растения и заставляет ее расти быстрее. В результате стебель наклоняется и направляется к свету.
Теоретическое обоснование фототропизма растений решили подтвердить экспериментальным исследованием.
2.2. Методика и результаты исследования.
Исследование: « Оценка фототропизма растений».
Гипотеза: чем больше света, тем быстрее развивается семя.
Оборудование: 3 светонепроницаемых контейнера для проращивания семян в темноте, 3 тампона из хлопковой ваты, пипетка, водопроводная вода, стакан, семена растений огурца сорта «Зозуля».
Ход опыта.
Семена растений положили в тампоны из хлопка и расположили в дальнем углу контейнера за разделительной стенкой. Устройство для проведения эксперимента представляет собой светонепроницаемый контейнер (Приложение 2). При помощи пипетки увлажнили вату, и вдавили в нее семена (Приложение 2). Закрыли контейнеры крышками, и поставила их в теплое место. При этом солнечные лучи, и дневной свет проникали внутрь контейнера через отверстие в боковой стенке по-разному:
1. – сбоку от источника света;
2. – со сторону источника света;
3. – с противоположной стороны от источника света (Приложение 3).
В последующие дни эксперимента следили, чтобы вата с семенами не пересыхала. Об изменениях семян фиксировали в дневнике наблюдений.
Дневник наблюдений
Таблица 1
Дата | №1 | № 2 | № 3 |
28. | Закладка опыта | ||
29.11.2014г | Семена набухли | ||
01.12.2014г | Семена «наклюнулись» | ||
11.12.2014г | Появление листочков из контейнера. | ||
17.12.2014г | Появление листочков из контейнера. | ||
21.12.2014г | Появление листочков из контейнера. | ||
Вывод: развитие проростков во втором светонепроницаемом контейнере происходило быстрее, чем в других. Спустя 12 суток с момента закладки опыта росток огурца первым появился из контейнера. Несколько позже – на 5 суток появились листочки из № 3 контейнера, расположенного от источника света. Спустя 3 суток появился побег из № 1 контейнера, куда свет попадал сбоку (Приложение 3-6). Несложно было заметить и изменение внешнего вида стебля в момент выроста из-за светонепроницаемой перегородки и окраски самих листочков из-за разного содержания хлоропластов (Приложение 6).
Спустя 12 суток с момента закладки опыта росток огурца первым появился из контейнера. Несколько позже – на 5 суток появились листочки из № 3 контейнера, расположенного от источника света. Спустя 3 суток появился побег из № 1 контейнера, куда свет попадал сбоку (Приложение 3-6). Несложно было заметить и изменение внешнего вида стебля в момент выроста из-за светонепроницаемой перегородки и окраски самих листочков из-за разного содержания хлоропластов (Приложение 6).
Анализ экспериментального исследования подтвердил выдвинутую гипотезу — чем больше света попадает на стебель проростков, тем быстрее они растут и развиваются.
2.3. Общие выводы.
Из учебника биологии, беседы с учителями предметниками (Шевыревой О.Д. и Шевцовой С.Т.) выяснили, что у растений восприятие света осуществляется фотопигментами, расположенными на поверхности растения. Передача возбуждения происходят благодаря действию фитогормонов, сконцентрированных, в основном, на кончиках стеблей. Оказывается, когда одна сторона растения затенена гормон роста движется от света к теневой стороне и заставляет ее расти быстрее. А повышенная концентрация гормона роста на теневой стороне растения приводит к растяжению клеток и образования изгиба (Приложение 7). В результате стебель наклоняется по направлению света. Что и требовалось доказать.
Оказывается, когда одна сторона растения затенена гормон роста движется от света к теневой стороне и заставляет ее расти быстрее. А повышенная концентрация гормона роста на теневой стороне растения приводит к растяжению клеток и образования изгиба (Приложение 7). В результате стебель наклоняется по направлению света. Что и требовалось доказать.
3. Заключение.
Для того, чтобы растения росли и развивались упорядоченным образом и адекватно реагировали на условия среды им, так же как и животным, нужны сигналы внутренней координации. Следовательно, изгибание листовых черешков растений и стеблей к свету — это результат приспособления, таким образом, лучше поглощать солнечные лучи.
4. Список использованной литературы.
1. Корчагина В.А. Растения, бактерии, грибы. Лишайники. – М.: Просвещение, 1989, — 256с.
2. Серебрякова Т.И. Растения, бактерии, грибы. Лишайники. – М.: Просвещение, 1992. – 224с.
Приложение 1
Знакомство с лабораторным оборудованием «Прорастание». 07.11.2014
07.11.2014
Признаки недостатка света у растений
Появление ламп с цветовым спектром, оптимально подходящим для растений, произвело революцию в отрасли растениеводства, позволив людям получать урожай в искусственно созданных условиях. Однако источники света необходимо правильно расположить, для того, чтобы растение получило необходимое количество фотонов. Зачастую, не имея навыка, начинающие гроверы могут легко допустить ошибку, что чревато малым количеством или отсутствием урожая.
В данной статье рассматриваются признаки недостатка света у растений. Практически каждый хоть раз наблюдал ситуацию, когда комнатный цветок при смене места начинал осыпаться. Чтобы не допустить такого, необходимо уметь достаточно быстро определить, что растению не хватает света.
Для своевременной диагностики помните — первыми начинают желтеть и отмирать нижние листья. Пытаясь поймать максимум фотонов, растение начнёт разворачивать листья в сторону источника света. Позднее и сам стебель начнёт изгибаться в том же направлении, при этом неестественно удлиняясь.
Позднее и сам стебель начнёт изгибаться в том же направлении, при этом неестественно удлиняясь.
Растение при нехватке света начинает действовать кардинально – оно начинает усиленно вырабатывать хлорофилл, что приводит к изменению окраски листьев (в сторону потемнения) и потере яркости рисунка. Особенно хорошо это видно на растениях с пёстрыми листьями – они становятся полностью зелёными.
Не нужно забывать и о делении по фотопериодической реакции – теневыносливым растениям нужно намного меньше ресурса, чтобы выжить и отработать репродуктивный цикл. К сожалению, культуры в массе своей светолюбивы, поэтому ситуацию может спасти только подключение дополнительных ламп либо полная замена источника света.
Решение проблемы – замена источника света
Начинающие гроверы нередко допускают ошибки, связанные с недостатком света. Некоторые растениеводы используют неподходящие лампы, не понимая, что они не могут обеспечить сбалансированный спектральный состав.
На самом же деле, в световой пучок входят лучи с разной длиной волны. Для роста и развития культур важнее всего фотосинтетически активная радиация (380-710 нм, 300-800 нм). Так, больше всего растениям необходимы красные и отдаленно красные лучи.На втором месте по значимости – синие и отдаленно синие. Они не только участвуют в реакции фотосинтеза, но и способствуют образованию белков. Лучи этого спектра приближают начало цветения. Ультрафиолет не дает растениям вытягиваться и влияет на синтез необходимых витаминов. А желтые и зеленые лучи нужны насаждениям в меньшей степени, но их участие в жизни представителей флоры не стоит недооценивать. Так, зеленые лучи обладают высокой проникающей способностью и доходят до листьев нижних ярусов. Они играют значительную роль в фотосинтезе толстых стеблей и листьев.
Для того, чтобы обеспечить потребности представителей флоры, необходимо правильно подобрать искусственное освещение. Для освещения гроубокса оптимальным решением станут лампы ДНаТ, ДРИ и LED-светильники.
Популярностью у гроверов пользуются комплекты освещения ДНаТ мощностью 250-600 Вт. Для запуска ламп и бесперебойной работы лампе ДНаТ необходимо пускорегулирующее устройство (ЭмПРА или ЭПРА).
Недостатком ламп ДНаТ является излишний нагрев и повышенное энергопотребление. Данных минусов лишены диодные лампы. К примеру, LED-светильник полного спектра Светодиодный светильник Apollo 4, который оснащен 60 диодами различного спектра, при этом он практически не выделяет тепла и тратит в 4-5 раз меньше электроэнергии. Apollo может располагаться в непосредственной близости к растению.
Также следует упомянуть об освещении ЭСЛ. Такие лампы подходят для компактных растений, а также на стадии рассады. Отличным вариантом для проращивания рассады и освещения клонов является ЭСЛ лампа с цветовой температурой 6400К. Она выделяет мало тепла, служит до 3 лет, не требует пусковой аппаратуры.
Различные типы ламп обладают различной цветовой температурой. Для каждой стадии жизненного цикла растения нужна определенная цветовая температура. Например, если Вы хотите добиться максимального роста лиственной массы, тогда для вегетации лучше выбрать лампу ДРИ. Тогда как для цветения и плодоношения эффективнее использовать натриевые лампы ДНаТ на 2000-2200 К (их также часто используют для полного цикла).
Для каждой стадии жизненного цикла растения нужна определенная цветовая температура. Например, если Вы хотите добиться максимального роста лиственной массы, тогда для вегетации лучше выбрать лампу ДРИ. Тогда как для цветения и плодоношения эффективнее использовать натриевые лампы ДНаТ на 2000-2200 К (их также часто используют для полного цикла).
Согласитесь, неудобно покупать несколько ламп для разных стадий развития растений. В связи с этим лучше выбрать один многоспектральный. Как раз к таким и относится ранее упомянутый нами LED-светильник Apollo. Кстати, к нему не надо покупать дополнительные пускорегулирующие устройства, которых требуют натриевые и ртутные лампы.
Как располагать лампы?
Лампы с разной светимостью нужно располагать на определенном расстоянии от выращиваемых культур, чтобы не стать причиной ожога листьев. Лампы меньшей мощности можно располагать ближе к растению, а приближение на каждые 15 см дает удвоение интенсивности света. Если показатель интенсивности недостаточный, растения будут вытягиваться к источнику света. Ухудшится их внешний вид, следовательно, снизится урожайность.
Если показатель интенсивности недостаточный, растения будут вытягиваться к источнику света. Ухудшится их внешний вид, следовательно, снизится урожайность.
В этом гроверу пригодится измерительный прибор Medipro, который оснащается держателем, позволяющим прикрепить его к патрону лампы. На другом его конце располагается индикатор, позволяющий вовремя корректировать высоту светильника по мере роста растения.
Подводя итог
Для того чтобы растения росли, развивались, радовали глаз красивыми соцветиями и приносили хороший урожай, необходимо следить за уровнем освещенности. Каждая группа насаждений требует определенных условий. Оптимальный уровень освещенности: на стадии вегетации 18 часов света 6 часов темноты, на стадии цветения световой режим должен быть 12/12.
В принципе, бывалый растениевод вовремя увидит и исправит ошибку, однако новички могут дотянуть в таком режиме до стадии цветения. Которое может вообще не начаться в случае, если недостаток света значителен. В прочих случаях маркером станут такие признаки, как: задержка цветения, или его вялость, мелкие соцветия появляются в недостаточном количестве и при этом быстро опадают. И последнее: продиагностировав недостаток света у своих зеленых питомцев, не нужно паниковать и устраивать ему «солярий» — освещенность нужно добавлять постепенно в течение примерно недели, чтобы растение не получило ещё один стресс.
В прочих случаях маркером станут такие признаки, как: задержка цветения, или его вялость, мелкие соцветия появляются в недостаточном количестве и при этом быстро опадают. И последнее: продиагностировав недостаток света у своих зеленых питомцев, не нужно паниковать и устраивать ему «солярий» — освещенность нужно добавлять постепенно в течение примерно недели, чтобы растение не получило ещё один стресс.
Отличительные реакции растений на свет
1. Карпински С., Сечиньска-Хебда М., Витушиньска В., Бурдяк П. Световая акклиматизация, ретроградная передача сигналов, гибель клеток и иммунная защита растений. Окружающая среда растительной клетки. 2013; 36: 736–744. doi: 10.1111/pce.12018. [PubMed] [CrossRef] [Google Scholar]
2. Терашима И., Ханба Ю.Т., Тазоэ Ю., Вьяс П., Яно С. Освещенность и фенотип: сравнительное экологическое развитие солнечных и теневых листьев по отношению к фотосинтезирующему CO. 2 диффузионный. Дж. Эксп. Бот. 2006; 57: 343–354. дои: 10.1093/jxb/erj014. [PubMed] [CrossRef] [Google Scholar]
дои: 10.1093/jxb/erj014. [PubMed] [CrossRef] [Google Scholar]
3. Коно М., Терашима И. Долгосрочные и краткосрочные реакции фотосинтетического транспорта электронов на флуктуирующий свет. Дж. Фотохим. Фотобиол. Б биол. 2014; 137:89–99. doi: 10.1016/j.jphotobiol.2014.02.016. [PubMed] [CrossRef] [Google Scholar]
4. Kami C., Lorrain S., Hornitschek P., Fankhauser C. Актуальные темы биологии развития. Том 91. Academic Press Inc.; Кембридж, Массачусетс, США: 2010. Рост и развитие растений, регулируемых светом; стр. 29–66. [PubMed] [Google Scholar]
5. Higa T., Suetsugu N., Kong S.G., Wada M. Актин-зависимое движение пластидов необходимо для генерации движущей силы при направленном движении ядер у растений. проц. Натл. акад. науч. США. 2014; 111:4327–4331. doi: 10.1073/pnas.1317
1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Yamori W. Фотосинтетическая реакция на колебания окружающей среды и фотозащитные стратегии при абиотическом стрессе.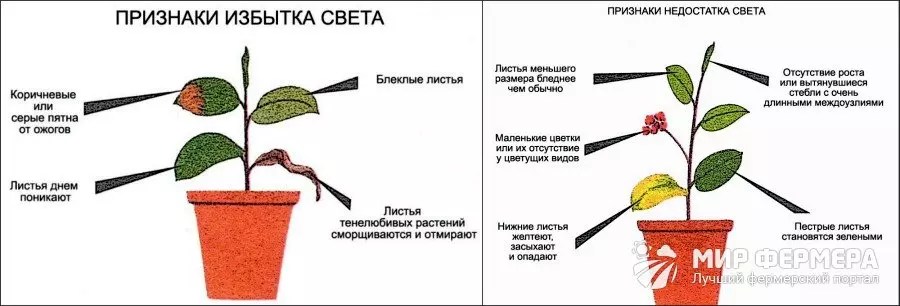 Дж. Плант. Рез. 2016; 129: 379–395. doi: 10.1007/s10265-016-0816-1. [PubMed] [CrossRef] [Академия Google]
Дж. Плант. Рез. 2016; 129: 379–395. doi: 10.1007/s10265-016-0816-1. [PubMed] [CrossRef] [Академия Google]
7. Мерчи Э.Х., Хаббарт С., Пэн С., Хортон П. Адаптация фотосинтеза к высокой освещенности у риса: экспрессия генов и взаимодействие с развитием листьев. Дж. Эксп. Бот. 2005; 56: 449–460. doi: 10.1093/jxb/eri100. [PubMed] [CrossRef] [Google Scholar]
8. Синклер Т.Р., Мухов Р.К. Эффективность использования радиации. Доп. Агрон. 1999; 65: 215–265. doi: 10.1016/S0065-2113(08)60914-1. [CrossRef] [Google Scholar]
9. Bailey-Serres J., Pierik R., Ruban A., Wingler A. Динамическое растение: захват, преобразование и управление энергией. Завод Физиол. 2018;176:961–966. doi: 10.1104/стр.18.00041. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Johnson M.P. Фотосинтез. Очерки биохим. 2016;60:255–273. doi: 10.1042/EBC20160016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Сонг Ю.Х., Ито С., Имаидзуми Т. Сходства в циркадных часах и фотопериодизме у растений. Курс. мнение Завод. биол. 2010; 13: 594–603. doi: 10.1016/j.pbi.2010.05.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Курс. мнение Завод. биол. 2010; 13: 594–603. doi: 10.1016/j.pbi.2010.05.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Хармер С.Л. Циркадная система высших растений. Анна. Преподобный завод биол. 2009 г.: 10.1146/annurev.arplant.043008.092054. [PubMed] [CrossRef] [Google Scholar]
13. Фарре Э.М., Хармер С.Л., Хармон Ф.Г., Яновский М.Дж., Кей С.А. Перекрывающиеся и разные роли PRR7 и PRR9 в циркадных часах арабидопсиса. Курс. биол. 2005; 15:47–54. doi: 10.1016/j.cub.2004.12.067. [PubMed] [CrossRef] [Google Scholar]
14. Лю Т.Л., Ньютон Л., Лю М.Дж., Шиу С.Х., Фарре Э.М. G-box-подобный мотив необходим для регуляции транскрипции с помощью циркадных регуляторов псевдоответа у арабидопсиса. Завод Физиол. 2016;170:528–539. doi: 10.1104/стр.15.01562. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Pruneda-Paz J.L., Breton G., Para A., Kay S.A. Подход функциональной геномики показывает, что CHE является компонентом циркадных часов арабидопсиса. Наука. 2009; 323:1481–1485. doi: 10.1126/science.1167206. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Наука. 2009; 323:1481–1485. doi: 10.1126/science.1167206. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Nakamichi N., Kita M., Ito S., Yamashino T., Mizuno T. РЕГУЛЯТОРЫ ПСЕВДООТВЕТА, PRR9, PRR7 и PRR5, вместе Играйте важные роли рядом с циркадными часами Arabidopsis thaliana. Физиология клеток растений. 2005; 46: 686–69.8. doi: 10.1093/pcp/pci086. [PubMed] [CrossRef] [Google Scholar]
17. Nakamichi N., Kiba T., Henriques R., Mizuno T., Chua N.H., Sakakibara H. РЕГУЛЯТОРЫ ПСЕВДООТВЕТА 9, 7 и 5 являются транскрипционными репрессорами в циркадные часы арабидопсиса. Растительная клетка. 2010; 22: 594–605. doi: 10.1105/tpc.109.072892. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Имаидзуми Т., Тран Х.Г., Шварц Т.Е., Бриггс В.Р., Кей С.А. FKF1 необходим для фотопериодической световой сигнализации у арабидопсиса. Природа. 2003; 426:302–306. дои: 10.1038/nature02090. [PubMed] [CrossRef] [Google Scholar]
19. Nakamichi N., Kita M. , Niinuma K., Ito S., Yamashino T., Mizoguchi T., Mizuno T. Псевдо-ответ, связанный с часами арабидопсиса Регуляторы PRR9, PRR7 и PRR5 координируют и позитивно регулируют время цветения через канонический CONSTANS-зависимый фотопериодический путь. Физиология клеток растений. 2007; 48 doi: 10.1093/pcp/pcm056. [PubMed] [CrossRef] [Google Scholar]
, Niinuma K., Ito S., Yamashino T., Mizoguchi T., Mizuno T. Псевдо-ответ, связанный с часами арабидопсиса Регуляторы PRR9, PRR7 и PRR5 координируют и позитивно регулируют время цветения через канонический CONSTANS-зависимый фотопериодический путь. Физиология клеток растений. 2007; 48 doi: 10.1093/pcp/pcm056. [PubMed] [CrossRef] [Google Scholar]
20. Серрано-Буэно Г., Ромеро-Камперо Ф.Дж., Лукас-Рейна Э., Ромеро Дж.М., Вальверде Ф. Эволюция восприятия фотопериода у растений и водорослей. Курс. мнение Завод. биол. 2017; 37:10–17. doi: 10.1016/j.pbi.2017.03.007. [PubMed] [CrossRef] [Академия Google]
21. Song Y.H., Estrada D.A., Johnson R.S., Kim S.K., Lee S.Y., MacCoss M.J., Imaizumi T. Различная роль белков FKF1, GIGANTEA и ZEITLUPE в регуляции стабильности констант при фотопериодическом цветении арабидопсиса. проц. Натл. акад. науч. США. 2014;111:17672–17677. doi: 10.1073/pnas.1415375111. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22. Fornara F., Panigrahi KCS, Gissot L. , Sauerbrunn N., Rühl M., Jarillo J.A., Coupland G. Arabidopsis DOF Transscription Factors Act Redundantly для уменьшения экспрессии CONSTANS и необходимы для реакции фотопериодического цветения. Дев. Клетка. 2009 г.;17:75–86. doi: 10.1016/j.devcel.2009.06.015. [PubMed] [CrossRef] [Google Scholar]
, Sauerbrunn N., Rühl M., Jarillo J.A., Coupland G. Arabidopsis DOF Transscription Factors Act Redundantly для уменьшения экспрессии CONSTANS и необходимы для реакции фотопериодического цветения. Дев. Клетка. 2009 г.;17:75–86. doi: 10.1016/j.devcel.2009.06.015. [PubMed] [CrossRef] [Google Scholar]
23. Kim J., Geng R., Gallenstein R.A., Somers D.E. Белок F-box ZEITLUPE контролирует стабильность и ядерно-цитоплазматическое разделение GIGANTEA. Разработка. 2013; 140:4060–4069. doi: 10.1242/dev.096651. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. Яновский М.Дж., Кей С.А. Молекулярные основы измерения сезонного времени у арабидопсиса. Природа. 2002; 419: 308–312. дои: 10.1038/nature00996. [PubMed] [CrossRef] [Google Scholar]
25. Chen Q., Payyavula R.S., Chen L., Zhang J., Zhang C., Turgeon R. Т-мРНК FLOWERING LOCUS синтезируется в специализированных клетках-компаньонах арабидопсиса. и прожилки табачного листа Мэрилендского мамонта. проц. Натл. акад. науч. США. 2018;115:2830–2835. doi: 10.1073/pnas.1719455115. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
науч. США. 2018;115:2830–2835. doi: 10.1073/pnas.1719455115. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Jaeger K.E., Wigge P.A. Белок FT действует как сигнал дальнего действия у арабидопсиса. Курс. биол. 2007;17:1050–1054. doi: 10.1016/j.cub.2007.05.008. [PubMed] [CrossRef] [Академия Google]
27. Corbesier L., Vincent C., Jang S., Fornara F., Fan Q., Searle I., Giakuntis A., Farrona S., Gissot L., Turnbull C., et al. Движение белка FT способствует передаче сигналов на большие расстояния при цветочной индукции арабидопсиса. Наука. 2007; 316:1030–1033. doi: 10.1126/science.1141752. [PubMed] [CrossRef] [Google Scholar]
28. Hsu C.-Y., Adams J.P., Kim H., No K., Ma C., Strauss S.H., Drnevich J., Vandervelde L., Ellis J.D., Райс Б.М. и соавт. Дублирование ЦВЕТУЩЕГО МЕСТА T координирует репродуктивный и вегетативный рост многолетнего тополя. проц. Натл. акад. науч. США. 2011;108:10756–10761. doi: 10.1073/pnas.1104713108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Тейшейра Р.Т., Шэн С., Бруннер А.М. Успехи ботанических исследований. Том 89. Academic Press Inc.; Кембридж, Массачусетс, США: 2019. Активность апикальных и камбиальных меристем побегов: координация и ответы на сигналы окружающей среды; стр. 185–199. [Google Scholar]
Тейшейра Р.Т., Шэн С., Бруннер А.М. Успехи ботанических исследований. Том 89. Academic Press Inc.; Кембридж, Массачусетс, США: 2019. Активность апикальных и камбиальных меристем побегов: координация и ответы на сигналы окружающей среды; стр. 185–199. [Google Scholar]
30. Маурья Дж. П., Бхалерао Р. П. Опосредованный фотопериодом и температурой контроль прекращения роста и покоя у деревьев: молекулярная перспектива. Анна. Бот. 2017; 120:351–360. doi: 10.1093/aob/mcx061. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Burgie E.S., Vierstra R.D. Phytochromes: атомная перспектива фотоактивации и передачи сигналов. Растительная клетка. 2014; 26: 568–4583. doi: 10.1105/tpc.114.131623. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Санчес С.Э., Руньоне М.Л., Кей С.А. Восприятие света: вопрос времени. Мол. Завод. 2020;13:363–385. doi: 10.1016/j.molp.2020.02.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Saijo Y., Sullivan J.A., Wang H., Yang J., Shen Y., Rubio V., Ma L., Hoecker U., Дэн С.В. Взаимодействие COP1-SPA1 определяет критический этап в опосредованной фитохромом А регуляции активности HY5. Гены Дев. 2003; 17: 2642–2647. doi: 10.1101/gad.1122903. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Saijo Y., Sullivan J.A., Wang H., Yang J., Shen Y., Rubio V., Ma L., Hoecker U., Дэн С.В. Взаимодействие COP1-SPA1 определяет критический этап в опосредованной фитохромом А регуляции активности HY5. Гены Дев. 2003; 17: 2642–2647. doi: 10.1101/gad.1122903. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Chen S., Lory N., Stauber J., Hoecker U. Специфичность фоторецепторов в светоиндуцированной и COP1-опосредованной быстрой деградации Репрессор фотоморфогенеза SPA2 у арабидопсиса. Генетика PLoS. 2015; 11 doi: 10.1371/journal.pgen.1005516. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
35. Podolec R., Ulm R. Опосредованная фоторецепторами регуляция убиквитинлигазы COP1/SPA E3. Курс. мнение биол. растений 2018;45:18–25. doi: 10.1016/j.pbi.2018.04.018. [PubMed] [CrossRef] [Академия Google]
36. Лау О.С., Дэн С.В. Фотоморфогенные репрессоры COP1 и DET1: 20 лет спустя. Тенденции Растениевод. 2012; 17: 584–593. doi: 10.1016/j.tplants.2012. 05.004. [PubMed] [CrossRef] [Google Scholar]
05.004. [PubMed] [CrossRef] [Google Scholar]
37. Конг С.-Г., Окадзима К. Разнообразные фоторецепторы и реакция растений на свет. Дж. Плант Рез. 2016; 129:111–114. doi: 10.1007/s10265-016-0792-5. [PubMed] [CrossRef] [Google Scholar]
38. Burgie E.S., Bussell A.N., Walker J.M., Dubiel K., Vierstra R.D. Кристаллическая структура фотосенсорного модуля из растительного фитохрома, поглощающего красный/дальний красный свет. проц. Натл. акад. науч. США. 2014;111:10179–10184. doi: 10.1073/pnas.1403096111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Кристи Дж. М., Блэквуд Л., Петерсен Дж., Салливан С. Флавопротеиновые фоторецепторы растений. Физиология клеток растений. 2015; 56 doi: 10.1093/pcp/pcu196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Paik I., Huq E. Фоторецепторы растений: многофункциональные сенсорные белки и их сигнальные сети. Семин. Сотовый Дев. биол. 2019;92:114–121. doi: 10.1016/j.semcdb.2019.03.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Лау О.С., Дэн С.В. Облегчается передача сигналов растительных гормонов: интеграторы света и гормонов. Курс. мнение биол. растений 2010; 13: 571–577. doi: 10.1016/j.pbi.2010.07.001. [PubMed] [CrossRef] [Google Scholar]
Лау О.С., Дэн С.В. Облегчается передача сигналов растительных гормонов: интеграторы света и гормонов. Курс. мнение биол. растений 2010; 13: 571–577. doi: 10.1016/j.pbi.2010.07.001. [PubMed] [CrossRef] [Google Scholar]
42. Leivar P., Quail P.H. PIF: ключевые компоненты в сотовом сигнальном концентраторе. Тенденции Растениевод. 2011;16:19–28. doi: 10.1016/j.tplants.2010.08.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Sakuraba Y., Jeong J., Kang M.Y., Kim J., Paek NC, Choi G. Факторы транскрипции, взаимодействующие с фитохромом, PIF4 и PIF5 индуцируют лист. старение арабидопсиса. Нац. коммун. 2014; 5:1–13. doi: 10.1038/ncomms5636. [PubMed] [CrossRef] [Академия Google]
44. Лейвар П., Монте Э. ФПИ: Системные интеграторы в разработке предприятий. Растительная клетка. 2014; 26:56–78. doi: 10.1105/tpc.113.120857. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Galvão VC, Fankhauser C. Восприятие световой среды у растений: фоторецепторы и ранние сигнальные шаги. Курс. мнение Нейробиол. 2015; 34:46–53. doi: 10.1016/j.conb.2015.01.013. [PubMed] [CrossRef] [Google Scholar]
Курс. мнение Нейробиол. 2015; 34:46–53. doi: 10.1016/j.conb.2015.01.013. [PubMed] [CrossRef] [Google Scholar]
46. Huang X., Ouyang X., Deng X.W. Помимо подавления фотоморфогенеза: переключение ролей COP/DET/FUS в передаче световых сигналов. Курс. мнение биол. растений 2014;21:96–103. doi: 10.1016/j.pbi.2014.07.003. [PubMed] [CrossRef] [Google Scholar]
47. Medzihradszky M., Bindics J., Ádám É., Viczián A., Klement É., Lorrain S., Gyula P., Mérai Z., Fankhauser C., Медзиградский К.Ф. и соавт. Фосфорилирование фитохрома B ингибирует индуцированную светом передачу сигналов за счет ускоренной темновой реверсии у арабидопсиса. Растительная клетка. 2013; 25: 535–544. doi: 10.1105/tpc.112.106898. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Chen M., Galvão R.M., Li M., Burger B., Bugea J., Bolado J., Chory J. Arabidopsis HEMERA/pTAC12 Initiates фотоморфогенез фитохромов. Клетка. 2010;141:1230–1240. doi: 10.1016/j.cell.2010.05.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Кайзерли Э., Палди К., О’Доннелл Л., Баталов О., Педмале Ю.В., Нусинов Д.А., Кей С.А., Чори Дж. Интеграция световой и фотопериодической сигнализации в транскрипционных ядерных очагах. Дев. Клетка. 2015;35:311–321. doi: 10.1016/j.devcel.2015.10.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Кайзерли Э., Палди К., О’Доннелл Л., Баталов О., Педмале Ю.В., Нусинов Д.А., Кей С.А., Чори Дж. Интеграция световой и фотопериодической сигнализации в транскрипционных ядерных очагах. Дев. Клетка. 2015;35:311–321. doi: 10.1016/j.devcel.2015.10.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Ван Баскирк Э.К., Декер П.В., Чен М. Фототела в световой сигнализации. Завод Физиол. 2012; 158:52–60. doi: 10.1104/стр.111.186411. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Ямагучи Р., Накамура М., Мочизуки Н., Кей С.А., Нагатани А. Светозависимая транслокация слитого белка фитохрома B-GFP в ядро трансгенного арабидопсиса. Дж. Клеточная биология. 1999; 145:437–445. doi: 10.1083/jcb.145.3.437. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Lin C., Ahmad M., Cashmore A.R. Криптохром 1 арабидопсиса представляет собой растворимый белок, опосредующий зависимую от синего света регуляцию роста и развития растений. Плант Дж. 1996; 10: 893–902. дои: 10.1046/j.1365-313X.1996.10050893.х. [PubMed] [CrossRef] [Google Scholar]
1996; 10: 893–902. дои: 10.1046/j.1365-313X.1996.10050893.х. [PubMed] [CrossRef] [Google Scholar]
53. Yu X., Klejnot J., Zhao X., Shalitin D., Maymon M., Yang H., Lee J., Liu X., Lopez J., Lina C. Arabidopsis cryptochrome 2 завершает свой посттрансляционный жизненный цикл в ядре. Растительная клетка. 2007;19:3146–3156. doi: 10.1105/tpc.107.053017. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
54. Чавес И., Покорный Р., Бырдин М., Хоанг Н., Ритц Т., Бреттель К., Эссен Л.-О., ван дер Хорст Г.Т.Дж., Батшауэр А., Ахмад М. Криптохромы: фоторецепторы синего света у растений и животных. Анну. Преподобный Завод. биол. 2011;62:335–364. doi: 10.1146/annurev-arplant-042110-103759. [PubMed] [CrossRef] [Google Scholar]
55. Zuo Z., Liu H., Liu B., Liu X., Lin C. Зависимое от синего света взаимодействие CRY2 с SPA1 регулирует активность COP1 и инициацию цветения у арабидопсиса. . Курс. биол. 2011; 21:841–847. doi: 10.1016/j.cub.2011.03.048. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Liu B., Zuo Z., Liu H., Liu X., Lin C. Cryptochrome 1 Arabidopsis взаимодействует с SPA1 для подавления активности COP1 в ответ к голубому свету. Гены Дев. 2011;25:1029–1034. doi: 10.1101/gad.2025011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Liu B., Zuo Z., Liu H., Liu X., Lin C. Cryptochrome 1 Arabidopsis взаимодействует с SPA1 для подавления активности COP1 в ответ к голубому свету. Гены Дев. 2011;25:1029–1034. doi: 10.1101/gad.2025011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Liu Y., Li X., Li K., Liu H., Lin C. Множественные белки bHLH образуют гетеродимеры для опосредования CRY2-зависимой регуляции Время цветения арабидопсиса. Генетика PLoS. 2013;9:e1003861. doi: 10.1371/journal.pgen.1003861. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Lian H.L., He S.B., Zhang Y.C., Zhu DM, Zhang J.Y., Jia K.P., Sun S.X., Li L., Yang H.Q. Зависимое от синего света взаимодействие криптохрома 1 с SPA1 определяет динамический сигнальный механизм. Гены Дев. 2011;25:1023–1028. doi: 10.1101/gad.2025111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Демарси Э., Фанхаузер С. Высшие растения используют LOV для восприятия синего света. Курс. мнение биол. растений 2009;12:69–74. doi: 10.1016/j.pbi.2008.09.002. [PubMed] [CrossRef] [Google Scholar]
растений 2009;12:69–74. doi: 10.1016/j.pbi.2008.09.002. [PubMed] [CrossRef] [Google Scholar]
60. Suetsugu N., Wada M. Эволюция трех семейств рецепторов синего света LOV в зеленых растениях и фотосинтетических страменопилах: фототропин, ZTL/FKF1/LKP2 и ауреохром. Физиология клеток растений. 2013;54:8–23. doi: 10.1093/pcp/pcs165. [PubMed] [CrossRef] [Google Scholar]
61. Иноуэ С.-И., Киношита Т., Мацумото М., Накаяма К.И., Дои М., Симадзаки К.-И. Индуцированное синим светом автофосфорилирование фототропина является первичным этапом передачи сигналов. проц. Натл. акад. науч. США. 2008; 105: 5626–5631. doi: 10.1073/pnas.0709189105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Deng Z., Oses-Prieto J.A., Kutschera U., Tseng T.S., Hao L., Burlingame A.L., Wang Z.Y., Briggs W.R. Blue индуцированные светом протеомные изменения в этиолированных проростках арабидопсиса. Дж. Протеом Рез. 2014;13:2524–2533. doi: 10.1021/pr500010z. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
63. Motchoulski A., Liscum E. Arabidopsis NPh4: белок, взаимодействующий с фоторецептором NPh2, необходимый для фототропизма. Наука. 1999;286:961–964. doi: 10.1126/science.286.5441.961. [PubMed] [CrossRef] [Google Scholar]
Motchoulski A., Liscum E. Arabidopsis NPh4: белок, взаимодействующий с фоторецептором NPh2, необходимый для фототропизма. Наука. 1999;286:961–964. doi: 10.1126/science.286.5441.961. [PubMed] [CrossRef] [Google Scholar]
64. Esmon C.A., Tinsley AG, Ljung K., Sandberg G., Hearne L.B., Liscum E. Градиент ауксина и ауксин-зависимой транскрипции предшествует ответам на тропный рост. проц. Натл. акад. науч. США. 2006; 103: 236–241. doi: 10.1073/pnas.0507127103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Ma L., Li J., Qu L., Hager J., Chen Z., Zhao H., Deng X.W. Световой контроль над развитием арабидопсиса предполагает скоординированную регуляцию экспрессии генома и клеточных путей. Растительная клетка. 2001;13:2589–2607. doi: 10.1105/tpc.010229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Инада С., Огиши М., Маяма Т., Окада К., Сакаи Т. RPT2 — преобразователь сигнала, участвующий в фототропной реакции и открытии устьиц. за счет ассоциации с фототропином 1 у Arabidopsis thaliana. Растительная клетка. 2004; 16: 887–896. doi: 10.1105/tpc.019901. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Растительная клетка. 2004; 16: 887–896. doi: 10.1105/tpc.019901. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Бодри А., Ито С., Сонг Ю.Х., Стрейт А.А., Киба Т., Лу С., Энрикес Р., Прунеда-Пас Дж.Л., Чуа Н.Х., Тобин Э.М. и соавт. Белки F-Box FKF1 и LKP2 действуют совместно с ZEITLUPE, контролируя ход часов арабидопсиса. Растительная клетка. 2010;22:606–622. doi: 10.1105/tpc.109.072843. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
68. Nelson D.C., Lasswell J., Rogg L.E., Cohen M.A., Bartel B. FKF1, управляемый часами ген, который регулирует переход к цветению у арабидопсиса. . Клетка. 2000; 101:331–340. doi: 10.1016/S0092-8674(00)80842-9. [PubMed] [CrossRef] [Google Scholar]
69. Ван Л., Фудзивара С., Сомерс Д.Е. PRR5 регулирует фосфорилирование, ядерный импорт и субнуклеарную локализацию TOC1 в циркадных часах арабидопсиса. EMBO J. 2010; 29: 1903–1915. doi: 10.1038/emboj.2010.76. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Андраде М.А., Гонсалес-Гусман М., Серрано Р., Родригес П.Л. Комбинация мотива F-box и повторов kelch определяет большое семейство белков F-box арабидопсиса. Завод Мол. биол. 2001; 46: 603–614. doi: 10.1023/A:1010650809272. [PubMed] [CrossRef] [Google Scholar]
Андраде М.А., Гонсалес-Гусман М., Серрано Р., Родригес П.Л. Комбинация мотива F-box и повторов kelch определяет большое семейство белков F-box арабидопсиса. Завод Мол. биол. 2001; 46: 603–614. doi: 10.1023/A:1010650809272. [PubMed] [CrossRef] [Google Scholar]
71. Имаидзуми Т., Шульц Т., Хармон Ф., Хо Л.А., Кей А.С. Белок FKF1 F-box опосредует циклическую деградацию репрессора CONSTANS у арабидопсиса. Наука. 2005;309: 293–297. doi: 10.1126/science.1110586. [PubMed] [CrossRef] [Google Scholar]
72. Rizzini L., Favory J.J., Cloix C., Faggionato D., O’Hara A., Kaiserli E., Baumeister R., Schäfer E., Nagy F. , Дженкинс Г.И. и соавт. Восприятие УФ-В белком арабидопсиса UVR8. Наука. 2011; 332:103–106. doi: 10.1126/science.1200660. [PubMed] [CrossRef] [Google Scholar]
73. Тосси В., Ламаттина Л., Дженкинс Г.И., Кассия Р.О. Индуцированное ультрафиолетом-В закрытие устьиц у арабидопсиса регулируется фоторецептором UV RESISTANCE LOCUS8 по механизму, зависимому от оксида азота.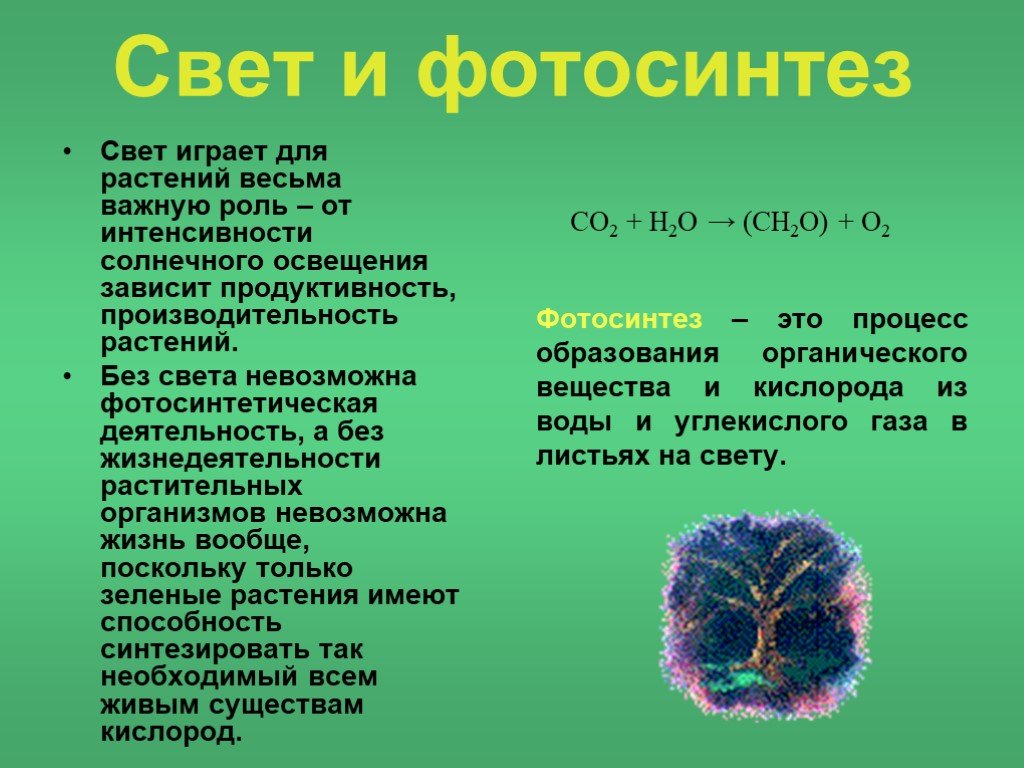 Завод Физиол. 2014;164:2220–2230. doi: 10.1104/стр.113.231753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Завод Физиол. 2014;164:2220–2230. doi: 10.1104/стр.113.231753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Фехер Б., Козма-Богнар Л., Кевей Э., Хайду А., Бинкерт М., Дэвис С.Дж., Шефер Э., Ульм Р., Надь Ф. Функциональное взаимодействие циркадианных часов и ЛОКУСА УСТОЙЧИВОСТИ к УФ-излучению 8 контролируемых сигнальных путей УФ-В у Arabidopsis thaliana. Плант Дж. 2011; 67: 37–48. doi: 10.1111/j.1365-313X.2011.04573.x. [PubMed] [CrossRef] [Google Scholar]
75. Wu D., Hu Q., Yan Z., Chen W., Yan C., Huang X., Zhang J., Yang P., Deng H., Ван Дж. и др. Структурные основы восприятия ультрафиолета-В с помощью UVR8. Природа. 2012; 484:214–219. doi: 10.1038/nature10931. [PubMed] [CrossRef] [Google Scholar]
76. Cloix C., Kaiserli E., Heilmann M., Baxter KJ, Brown B.A., O’Hara A., Smith B.O., Christie J.M., Jenkins G.I. С-концевая область фоторецептора УФ-В UVR8 инициирует передачу сигналов посредством взаимодействия с белком COP1. проц. Натл. акад. науч. США. 2012;109:16366–16370. doi: 10.1073/pnas.1210898109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
США. 2012;109:16366–16370. doi: 10.1073/pnas.1210898109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Binkert M., Kozma-Bognár L., Terecskei K., De Veylder L., Nagy F., Ulm R. UV-B-Responsive ассоциация фактора транскрипции bZIP арабидопсиса ELONGATED HYPOCOTYL5 с генами-мишенями, включая собственный промотор. Растительная клетка. 2014;26:4200–4213. doi: 10.1105/tpc.114.130716. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Хейде М., Ульм Р. Передача сигналов, опосредованная фоторецепторами УФ-В, у растений. Завод «Тренды». науч. 2012;17:230–237. doi: 10.1016/j.tplants.2012.01.007. [PubMed] [CrossRef] [Google Scholar]
79. Ulm R., Nagy F. Передача сигналов и регуляция генов в ответ на ультрафиолетовое излучение. Курс. мнение Завод. биол. 2005; 8: 477–482. doi: 10.1016/j.pbi.2005.07.004. [PubMed] [CrossRef] [Google Scholar]
80. Ballaré C.L. Световое регулирование защиты растений. Анну. Преподобный Завод. биол. 2014;65:335–363. doi: 10.1146/annurev-arplant-050213-040145. [PubMed] [CrossRef] [Академия Google]
doi: 10.1146/annurev-arplant-050213-040145. [PubMed] [CrossRef] [Академия Google]
81. Хидег Э., Янсен М.А.К., Стрид Е. Воздействие УФ-В, АФК и стресс: неразлучные спутники или слабо связанные партнеры? Тенденции Растениевод. 2013; 18:107–115. doi: 10.1016/j.tplants.2012.09.003. [PubMed] [CrossRef] [Google Scholar]
82. Jiao Y., Lau O.S., Deng X.W. Светорегулируемые транскрипционные сети у высших растений. Нац. Преподобный Жене. 2007; 8: 217–230. doi: 10.1038/nrg2049. [PubMed] [CrossRef] [Google Scholar]
83. Ni W., Xu S.L., Tepperman J.M., Stanley D.J., Maltby D.A., Gross J.D., Burlingame A.L., Wang Z.Y., Quail P.H. Взаимно гарантированный механизм разрушения ослабляет передачу световых сигналов у арабидопсиса. Наука. 2014; 344:1160–1164. doi: 10.1126/science.1250778. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Dong J., Ni W., Yu R., Deng X.W., Chen H., Wei N. Светозависимая деградация PIF3 с помощью SCFEBF1/2 способствует фотоморфогенному ответу у арабидопсиса. Курс. биол. 2017;27:2420–2430. doi: 10.1016/j.cub.2017.06.062. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Курс. биол. 2017;27:2420–2430. doi: 10.1016/j.cub.2017.06.062. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Ni W., Xu S.L., Gonzalez-Grandío E., Chalkley R.J., Huhmer A.F.R., Burlingame A.L., Wang Z.Y., Quail P.H. PPK опосредуют прямую передачу сигнала от фоторецепторов фитохрома к фактору транскрипции PIF3. Нац. коммун. 2017;8:15236. doi: 10.1038/ncomms15236. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Oh E., Kim J., Park E., Kim J.I., Kang C., Choi G. PIL5, базовый белок спираль-петля-спираль, взаимодействующий с фитохромом, является ключевым отрицательным регулятором прорастания семян у арабидопсиса. Талиана. Растительная клетка. 2004; 16:3045–3058. doi: 10.1105/tpc.104.025163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Маджи М., Кумар С., Катхаре П.К., Ву С., Джинджерич Д., Наяк Н.Р., Салаита Л., Динкинс Р., Мартин К., Гудин М. и др. Белок KELCH F-BOX положительно влияет на прорастание семян арабидопсиса, воздействуя на ФАКТОР ВЗАИМОДЕЙСТВИЯ С ФИТОХРОМОМ1. проц. Натл. акад. науч. США. 2018;115:E4120–E4129. doi: 10.1073/pnas.1711919115. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 2018;115:E4120–E4129. doi: 10.1073/pnas.1711919115. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
88. Vaistij F.E., Barros-Galvão T., Cole A.F., Gilday A.D., He Z., Li Y., Harvey D., Larson T.R., Graham Я. MOTHER-OF-FT-AND-TFL1 подавляет прорастание семян в дальнем красном свете, модулируя реакции фитогормонов у Arabidopsis thaliana. проц. Натл. акад. науч. США. 2018; 115:8442–8447. doi: 10.1073/pnas.1806460115. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. О Э., Ямагучи С., Ху Дж., Юсуке Дж., Юнг Б., Пайк И., Ли Х.С., Сун Т.П., Камия Y., Choi G. PIL5, белок bHLH, взаимодействующий с фитохромом, регулирует чувствительность к гиббереллину, связываясь непосредственно с промоторами GAI и RGA в семенах арабидопсиса. Растительная клетка. 2007;19: 1192–1208. doi: 10.1105/tpc.107.050153. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Донг Х.К., Ямагучи С., Лим С., О Э., Пак Дж., Ханада А. , Камия Ю., Чой Г. СОМНУС , белок цинковых пальцев CCCH-типа у Arabidopsis, отрицательно регулирует светозависимое прорастание семян после PIL5. Растительная клетка. 2008;20:1260–1277. doi: 10.1105/tpc.108.058859. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Камия Ю., Чой Г. СОМНУС , белок цинковых пальцев CCCH-типа у Arabidopsis, отрицательно регулирует светозависимое прорастание семян после PIL5. Растительная клетка. 2008;20:1260–1277. doi: 10.1105/tpc.108.058859. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Парси Ф. Цветение: время для интеграции. Междунар. Дж. Дев. биол. 2005;49: 585–593. doi: 10.1387/ijdb.041930fp. [PubMed] [CrossRef] [Google Scholar]
92. Шим Дж. С., Имаидзуми Т. Суточные часы и фотопериодическая реакция арабидопсиса: от сезонного цветения до окислительно-восстановительного гомеостаза. Биохимия. 2015;54:157–170. doi: 10.1021/bi500922q. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Сава М., Нусинов Д.А., Кей С.А., Имаидзуми Т. Для измерения длины дня у арабидопсиса необходимо образование комплекса FKF1 и GIGANTEA. Наука. 2007; 318: 261–265. doi: 10.1126/science.1146994. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
94. Song Y.H., Smith R. W., To BJ, Millar A.J., Imaizumi T. FKF1 передает временную информацию для стабилизации CONSTANS при фотопериодическом цветении. Наука. 2012; 336:1045–1049. doi: 10.1126/science.1219644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
W., To BJ, Millar A.J., Imaizumi T. FKF1 передает временную информацию для стабилизации CONSTANS при фотопериодическом цветении. Наука. 2012; 336:1045–1049. doi: 10.1126/science.1219644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
95. Nomoto Y., Kubozono S., Yamashino T., Nakamichi N., Mizuno T. Рост растений, контролируемый циркадными часами и PIF4: совпадение Механизм напрямую интегрирует сигнальную сеть гормонов в фотопериодический контроль архитектуры растений у Arabidopsis thaliana. Физиология клеток растений. 2012;53:1950–1964. doi: 10.1093/pcp/pcs137. [PubMed] [CrossRef] [Google Scholar]
96. Шим Дж. С., Кубота А., Имаидзуми Т. Суточные часы и фотопериодическое цветение арабидопсиса: CONSTANS — это центр интеграции сигналов. Завод Физиол. 2017; 173:5–15. doi: 10.1104/стр.16.01327. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
97. Ito S., Song YH, Josephson-Day AR, Miller RJ, Breton G., Olmstead R.G., Imaizumi T. FLOWERING Активаторы транскрипции BHLH контролируют экспрессию фотопериодического регулятора цветения CONSTANS арабидопсиса. проц. Натл. акад. США. 2012;109: 3582–3587. doi: 10.1073/pnas.1118876109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. США. 2012;109: 3582–3587. doi: 10.1073/pnas.1118876109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
98. Jang S., Marchal V., Panigrahi KCS, Wenkel S., Soppe W., Deng X.W., Valverde F., Coupland G. Arabidopsis COP1 формирует временной паттерн накопления CO, вызывая фотопериодическую реакцию цветения. EMBO J. 2008; 27: 1277–1288. doi: 10.1038/emboj.2008.68. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
99. Ласаро А., Вальверде Ф., Пинь М., Харилло Дж.А. Убиквитинлигаза HOS1 Arabidopsis E3 отрицательно регулирует количество CONSTANS в фотопериодическом контроле цветущих W. растительных клеток. 2012;24:982–999. doi: 10.1105/tpc.110.081885. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
100. Вальверде Ф., Мурадов А., Соппе В., Равенскрофт Д., Самах А., Коупленд Г. Регуляция фоторецептором белка CONSTANS при фотопериодическом цветении . Наука. 2004; 303:1003–1006. doi: 10.1126/science.1091761. [PubMed] [CrossRef] [Google Scholar]
101. Liu H., Wang Q., Liu Y., Zhao X., Imaizumi T., Somers D.E., Tobin EM., Lin C. Arabidopsis CRY2 и ZTL опосредуют сине- легкая регуляция фактора транскрипции CIB1 с помощью различных механизмов. проц. Натл. акад. науч. США. 2013;110:17582–17587. doi: 10.1073/pnas.1308987110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Liu H., Wang Q., Liu Y., Zhao X., Imaizumi T., Somers D.E., Tobin EM., Lin C. Arabidopsis CRY2 и ZTL опосредуют сине- легкая регуляция фактора транскрипции CIB1 с помощью различных механизмов. проц. Натл. акад. науч. США. 2013;110:17582–17587. doi: 10.1073/pnas.1308987110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
102. Li D., Liu C., Shen L., Wu Y., Chen H., Robertson M., Helliwell C.A., Ito T ., Мейеровиц Э., Ю. Х. Репрессорный комплекс управляет интеграцией сигналов цветения у арабидопсиса. Дев. Клетка. 2008; 15:110–120. doi: 10.1016/j.devcel.2008.05.002. [PubMed] [CrossRef] [Google Scholar]
103. Gu X., Le C., Wang Y., Li Z., Jiang D., Wang Y., He Y. Члены клады FLC Arabidopsis образуют комплексы цветение-репрессор. координация реакций на эндогенные сигналы и сигналы окружающей среды. Нац. коммун. 2013; 4:1–10. doi: 10.1038/ncomms2947. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
104. Castillejo C., Pelaz S. Баланс между активностью CONSTANS и TEMPRANILLO определяет экспрессию FT для запуска цветения. Курс. биол. 2008;18:1338–1343. doi: 10.1016/j.cub.2008.07.075. [PubMed] [CrossRef] [Google Scholar]
Курс. биол. 2008;18:1338–1343. doi: 10.1016/j.cub.2008.07.075. [PubMed] [CrossRef] [Google Scholar]
105. Матье Дж., Янт Л.Дж., Мюрдтер Ф., Кюттнер Ф., Шмид М. Подавление цветения с помощью миР172-мишени SMZ. PLoS биол. 2009; 7 doi: 10.1371/journal.pbio.1000148. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
106. Liu H., Yu X., Li K., Klejnot J., Yang H., Lisiero D., Lin C. Фотовозбужденный CRY2 взаимодействует с CIB1, чтобы регулировать транскрипцию и инициацию цветения у Arabidopsis. Наука. 2008; 322:1535–1539. doi: 10.1126/science.1163927. [PubMed] [CrossRef] [Google Scholar]
Как растения растут к свету? Ученые объясняют механизм фототропизма — ScienceDaily
Растения разработали ряд стратегий, позволяющих улавливать максимальное количество солнечного света через свои листья. Как мы знаем, глядя на растения на подоконнике, они растут к солнечному свету, чтобы иметь возможность генерировать энергию путем фотосинтеза. Теперь международная группа ученых предоставила окончательное представление о движущей силе этого движения — растительном гормоне ауксине.
Рост растений к свету особенно важен в начале их жизненного цикла. Многие семена прорастают в почве и получают питание в темноте за счет ограниченных запасов крахмала и липидов. Достигая поверхности, проростки быстро растут вверх против гравитационного притяжения, что дает первоначальный ключ к ориентации. С помощью высокочувствительных светочувствительных белков они находят кратчайший путь к солнечному свету и даже способны наклоняться в направлении источника света.
«Даже зрелые растения склоняются к самому сильному свету. Они делают это, удлиняя клетки стебля на стороне, наиболее удаленной от света. Такой тип ориентированного на свет роста называется фототропизмом», — объясняет профессор Клаус Швеххаймер из кафедрой системной биологии растений Мюнхенского технического университета (TUM).
Транспортеры перемещают растительный гормон к целевому участку
Веществом, отвечающим за удлинение клеток, является ауксин. Этот фитогормон образуется в клетках на верхушке побега и затем передается от клетки к клетке. Таким образом, гормон проходит через многие клетки растения, прежде чем достигнет своего конечного пункта назначения. «Экспортные и импортные белки выталкивают ауксин из одной клетки в межклеточное пространство, а затем в следующую клетку и так далее, пока ауксин в конечном итоге не достигнет своего целевого участка», — отмечает Швеххаймер.
Таким образом, гормон проходит через многие клетки растения, прежде чем достигнет своего конечного пункта назначения. «Экспортные и импортные белки выталкивают ауксин из одной клетки в межклеточное пространство, а затем в следующую клетку и так далее, пока ауксин в конечном итоге не достигнет своего целевого участка», — отмечает Швеххаймер.
Наиболее важными белками в этом процессе являются экспортные белки, известные как «PIN», которые регулируют направление потока ауксина. Как удалось продемонстрировать группе Швеххаймера, эти PIN-коды не функционируют сами по себе: «Они требуют сигнала протеинкиназы D6PK», — продолжает Швеххаймер. «Фермент киназа модифицирует PIN-коды путем переноса фосфатных групп, активируя их, таким образом, как переносчики ауксина».
Какова роль ауксина?
Движение растений было впервые всесторонне описано Чарльзом Дарвином в 1880 году в его основополагающей работе «Сила движения растений». Теория о том, что растительный гормон ауксин может играть роль в наклонах растений к источнику света, была впервые предложена в 1937 году голландским исследователем Фрицем Вентом в модели Холодного-Вента.
Несмотря на то, что многие последующие наблюдения подтвердили эту модель, до сих пор не было определенного доказательства того, что ауксин действительно участвует в этом процессе. Профессор Кристиан Фанкхаузер из UNIL (Университет Лозанны) в Швейцарии объясняет, почему: «До сих пор все растения с известным дефектом транспорта ауксина демонстрировали нормальный фототропизм. Как же тогда транспорт ауксина может быть важен для этого процесса?»
Модель регулирования ауксина подтверждена
Команда TUM в сотрудничестве со своими коллегами из UNIL нашли ответ на этот вопрос. Швейцарским исследователям удалось одновременно инактивировать несколько транспортеров PIN в растении. Со своей стороны, ученым ТУМ удалось продемонстрировать функцию протеинкиназы D6PK.
Было обнаружено, что при отсутствии нескольких компонентов PIN и киназы рост растений полностью не реагировал на световые сигналы, запускающие фототропизм. Механизм транспорта ауксина у этих мутантных растений был сильно нарушен: растения росли вверх, вдали от гравитационного притяжения, независимо от источника света.


 11.2014г
11.2014г