16.03.2022
Типы посуды для работы с растениямиЧашки для культуры растительной ткани
Контейнеры для инкубации Incu
Бутылки (емкости) для культивирования растенийБутылки (емкости) для культивирования растений I типа
Бутылки (емкости) для выращивания растений II типа
Емкости для культивирования растений Phytohealth
Система для культивирования растений AraHarvest
Информация для заказа:Чашки для культуры растительной тканиКонтейнеры для инкубации IncuСистема AraHarvestНаборы и реактивы для растений
Добавьте артикул товара имеющегося на складе и оплатите его по выгодному курсу Укажите артикул, наименование/фасовку и производителя той продукции, которая вам необходима: Я согласен на обработку персональных данных, а также с правилами сайта. |
Микроклонирование
Технология клонального микроразмножения позволяет в короткие сроки получить рассаду:
- Редких растений;
- Дорогих сортов;
- Саженцев с ценными сортовыми свойствами.
Помощь в создании лаборатории «под ключ».
Размножение in vitro (микроклонирование) – вегетативное размножение растений из клеток материнского организма, базируется на явлении тотипотентности (способности из одной клетки создать целый новый организм).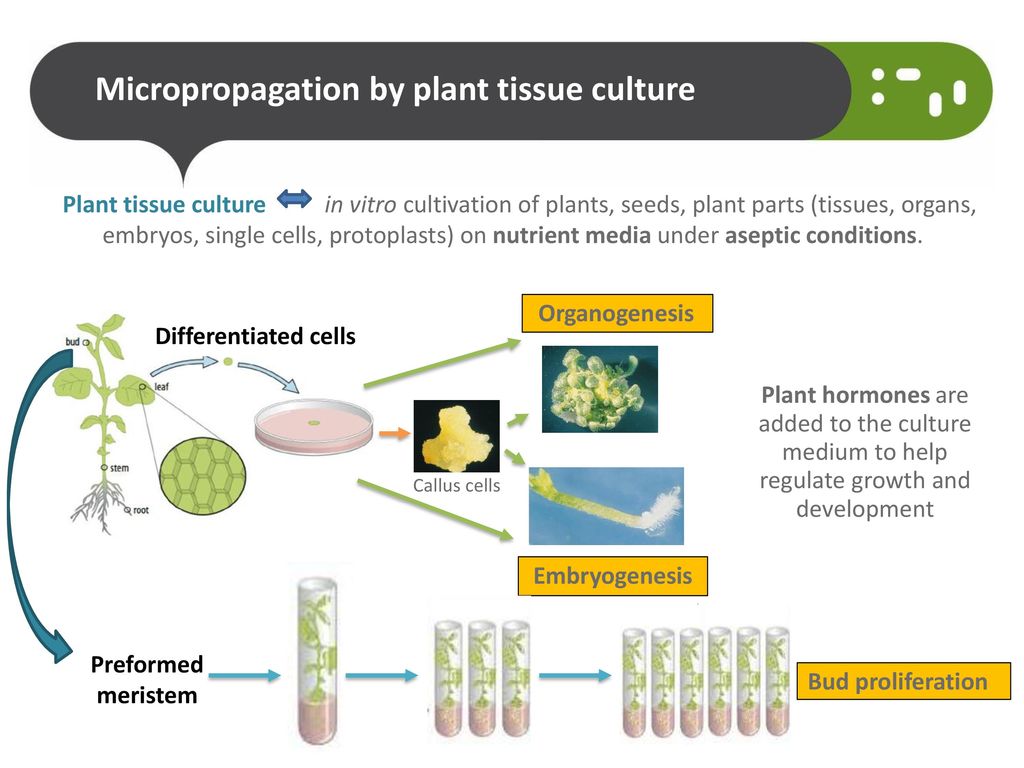
Преимущества получения растений in vitro:
- Полученная рассада абсолютно здорова и очищена от любой инфекции (бактерии, грибки, вирусы, простейшие и др).
- Отличная приживаемость при высадке в поле.
- Высокие темпы роста в сравнении с обычной рассадой.
- Полная генетическая идентичность полученной рассады и сохранение всех ценных сортовых качеств.
- Высокая урожайность, хорошая транспортабельность плодов.
- Получение рассады в любое время года.
Наша лаборатория готова предоставить следующие коллекции уже готовых промышленно ценных культур, выращенных in vitro:
| Ягодные | Цветочные | Эфиромасличные |
| Земляника | Гардения | Сортовая мята |
| Малина | Хризантема | Родиола перистонадрезная |
| Виноград | Мирт | Душица |
| Инжир | Жасмин | Лаванда |
| Ежевика | Роза | Чабрец |
| Актинидия | Орхидея «Фаленопсис» | Роза эфиромасличная |
| Жимолость | Орхидея «Ванда», «Дендробиум» |
А также, древесные культуры фундук, грецкий орех и павловния.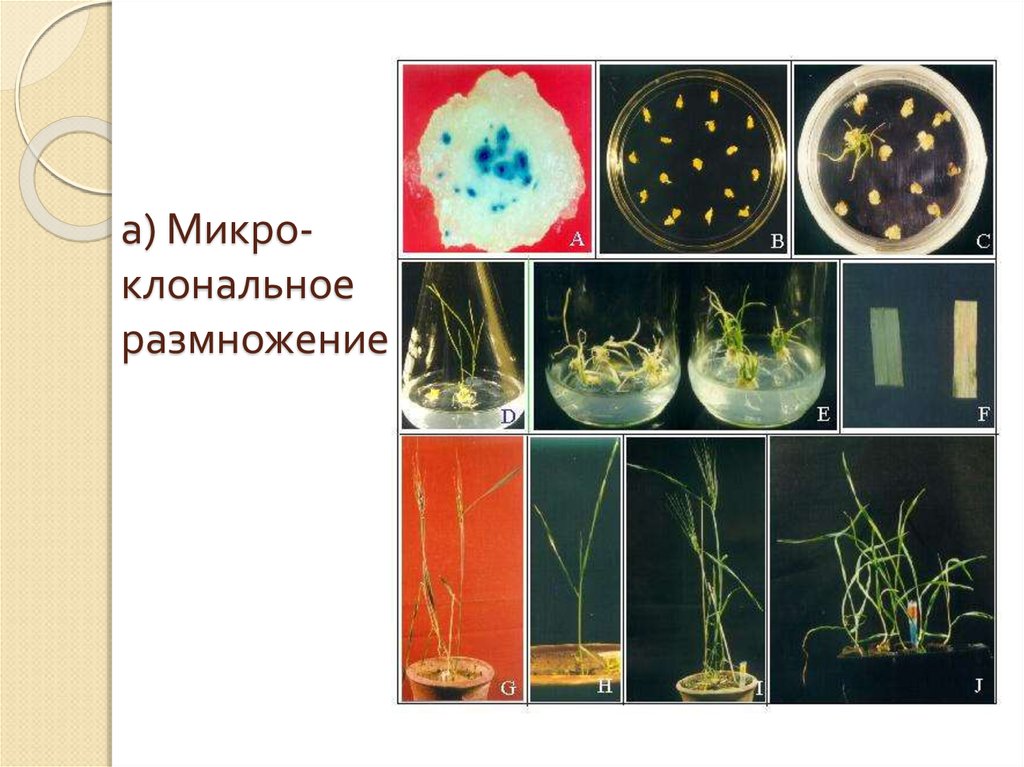
Микроклонирование растений заказчика и образцов из банка лаборатории
Получить рассаду растений, приведенных в таблице выше можно в относительно короткие сроки. Компания «Комплексный АгроСервис» предлагает услугу размножения своего образца растения (предоставленного заказчиком), полный цикл воспроизводства в этом случае может занять больше времени.
Краткое описание ягодных культур имеющихся в банке лаборатории клонального микроразмножения
Ремонтантный сорт малины «Брусвяна»
Данный сорт, размноженный по технологии культуры меристем, начинает плодоношение с июня — это его первый урожай, который формируется на побегах второго года. Тем временем, набирают силу побеги первого года, которые уже с августа формируют второй урожай, которые длится до самых заморозков.
Плоды у этого сорта одни из самых крупных, вес отдельных ягод 15 грамм, отличаются высокой плотностью и насыщенным вкусом. Ожидаемая отдача 5-8 кг урожая с куста.
Ожидаемая отдача 5-8 кг урожая с куста.
Ремонтантный сорт малины «Геракл»
Ягоды размером 8-9 гр, плотные, хорошо подходят для заморозки. С куста можно ожидать более 3 кг урожая, который будет один и довольно поздний, что обеспечивает его защиту от вредителей. Сорт устойчив к серой гнили, грибкам, морозам.
Ремонтантный сорт Геракл, рассада которого получена in vitro, нуждается в зимней обрезке, укрывании. Выгодно отличается слабым образованием побегов их медленным ростом, благодаря чему его не нужно часто прореживать.
Ремонтантный сорт красной малины «Полка»
Сорт, ставший эталоном в Европе, размножается исключительно по технологии клонального микроразмножения. Ягоды довольно крупные, размером от 3 до 6 грамм, с сильно выраженным ароматом малины и насыщенным вкусом, дегустационной оценки 4,5 баллов.
Плодоношение происходит с конца июля по начало заморозков. Что выгодно отличает данный сорт, это плодоношение на однолетних побегах. Средняя урожайность 9 тонн с гектара.
Средняя урожайность 9 тонн с гектара.
- Во время жары этот сорт нуждается в затенении, иначе не спасет даже активный полив — ягоды пекутся.
- Не очень высока устойчивость к гнили, другим заболеваниям.
- Некорректное внесение удобрений может спровоцировать активный рост ростков, блокируя урожай. Вообще, данный сорт малины активно кустится, поэтому нуждается в регулярной нормировке. Оптимально оставлять до 9 побегов на куст.
- Еще одна сложность это значительная длина побегов, которые без прищепывания верхушек достигают 1,8 м. Сами ветки гибкие, поэтому будет нуждаться в подвязке, опоре.
На зиму следует укрывать, так как заморозки могут навредить.
Малина «Гордость России»
Средние сроки созревания — первый урожай можно ожидать в первой декаде июля, с куста можно ожидать до 6 кг выхода. Интересный плюс этого сорта — созревшие ягоды не опадают на землю, долго остаются на ветках не загнивая. Косточки в ягодах почти не ощущаются.
Косточки в ягодах почти не ощущаются.
Кусты компактны, высота отдельных побегов достигают 1,8 м. Прекрасно переносит морозы, не нужно укрывать до цифр минус 30 гр.Цельс. Весьма устойчива к заболеваниям, практически не поражается гнилью корневой шейки, вирусными заболеваниями.
Безколючковая ежевика «Торнфри»
Сорт выведен в 1966 году с США. Превышает малину в 3 раза по урожайности и по содержанию ряда биологически активных веществ. Ягоды крупные, до 5 гр, диаметром до 3 см, хорошо траспортабельны, что важно для торговли. Вкус кисло-сладкий. Саженцы должны быть размещены на расстоянии 2,5х1,5м или 3 тысячи саженцев на гектар. Окупается такой ягодник обычно на второй год промышленного урожая.
Период плодоношения растянут с июля по октябрь. Созревание происходит с августа до морозов. Ветви длинные, поэтому их следует подвязывать, для чего натягивают по 5 проволок через каждые 50см. Чтобы ягода была крупнее, нужна обрезка боковых веточек побега. Зеленая обрезка требует оставлять 8-10 побегов на погонный метр. Устойчива к стеблевому раку, ржавчине.
Зеленая обрезка требует оставлять 8-10 побегов на погонный метр. Устойчива к стеблевому раку, ржавчине.
Помощь в создании лаборатории клонального микроразмножения растений
Предлагаем услуги по созданию лаборатории клонального микроразмножения растений. Консультации, разработка проекта, оснащение оборудованием, обучение персонала на нашей базе. Консультации по подготовке питательных растворов, стерилизации оборудования, выезд наших специалистов к заказчику. Звоните +380504200351.
Пролиферация побегов in vitro и образование корней in vitro и ex vitro Pyrus elaeagrifolia Pallas
Введение
Хлороз железа в грушах является широко распространенной проблемой, особенно в регионах с известковыми почвами (Dolcet-Sanjuan et al., 2004). Pyrus elaeagrifolia Pallas является одним из источников генов, используемых для повышения устойчивости подвоев к засухе и хлорозу (Lombard and Westwood, 1987). Таким образом, Claveria et al. (2010) использовали межвидовые скрещивания, включая Pyrus amygdaliformis, P. amygdaliformis подвид. persica, P. elaeagrifolia и P. communis ssp. cordata в создании подвоев, устойчивых к железистому хлорозу. По данным Lombard and Westwood (1987), засухоустойчивость и поглощение азота, фосфора, железа, бора и цинка из почвы привоя груши сорта P. elaeagrifolia находятся на высоком уровне. Кроме того, этот вид устойчив к черной пятнистости, усыханию груши и мохнатой грушевой тле. В Турции саженцев P. elaeagrifolia используются в качестве подвоя в течение 9 лет.0005 P. communis (Lombard and Westwood, 1987; Bell et al., 1996). Как правило, более старые дикорастущие деревья этого вида прививают привоями груши (Коксал и др., 2002). Таким образом, здоровые деревья груши можно выращивать на засушливых почвах с рН 7,5–8. Однако сеянцы этого вида демонстрируют высокую генетическую изменчивость. По этим причинам методы вегетативного клонального размножения могут использоваться для выбранных генотипов P.
Таким образом, Claveria et al. (2010) использовали межвидовые скрещивания, включая Pyrus amygdaliformis, P. amygdaliformis подвид. persica, P. elaeagrifolia и P. communis ssp. cordata в создании подвоев, устойчивых к железистому хлорозу. По данным Lombard and Westwood (1987), засухоустойчивость и поглощение азота, фосфора, железа, бора и цинка из почвы привоя груши сорта P. elaeagrifolia находятся на высоком уровне. Кроме того, этот вид устойчив к черной пятнистости, усыханию груши и мохнатой грушевой тле. В Турции саженцев P. elaeagrifolia используются в качестве подвоя в течение 9 лет.0005 P. communis (Lombard and Westwood, 1987; Bell et al., 1996). Как правило, более старые дикорастущие деревья этого вида прививают привоями груши (Коксал и др., 2002). Таким образом, здоровые деревья груши можно выращивать на засушливых почвах с рН 7,5–8. Однако сеянцы этого вида демонстрируют высокую генетическую изменчивость. По этим причинам методы вегетативного клонального размножения могут использоваться для выбранных генотипов P. elaeagrifolia в качестве подвоев.
elaeagrifolia в качестве подвоев.
Pyrus elaeagrifolia происходит из Турции, России и Юго-Восточной Европы (Ломбард и Вествуд, 1987; Белл и др., 1996). Есть много видов этого вида в Анатолийском регионе Турции. Большое значение в селекции груши имеет подбор из этих карликовых или полукарликовых генотипов клоновых подвоев, устойчивых к хлорозу и засухе, устойчивых к болезням и вредителям. Подобно большинству фруктовых деревьев и видов орехов, воспроизводство однородных копий исходного родительского растения P. elaeagrifolia возможно черенкованием, отводками и микроразмножением. Среди этих методов у этого вида изучено только размножение черенкованием. Два типа P. elaeagrifolia размножали черенками хвойных пород: процент укореняемости был определен как 11,4 и 43,8% (Dumanoglu et al., 1999). Микроразмножение позволяет садоводам быстро размножать новый подвой за короткое время (Webster, 1995; Hartmann et al., 1997). Размножение пазушными почками является широко используемым средством массового размножения растений, генотипически и фенотипически идентичных исходному растению, из которого они были получены (Evans, 1990). Результаты по микроразмножению P. communis (Cheng, 1979; Shen and Mullins, 1984; Rodriguez et al., 1991; Al-Maarri et al., 1994; Iglesias et al., 2004), P. calleryana (Berardi et al. , 1993), P. calleryana , P. betulaefolia (Yeo and Reed, 1995) и P. syriaca (Shibli et al., 1997), о которых сообщалось несколькими исследователями (Chevreau and Bell, 2005). . Однако микроразмножение P. elaeagrifolia не изучалось. В этом исследовании мы сообщаем о in vitro пролиферация побегов и in vitro и ex vitro корнеобразование P. elaeagrifolia .
Результаты по микроразмножению P. communis (Cheng, 1979; Shen and Mullins, 1984; Rodriguez et al., 1991; Al-Maarri et al., 1994; Iglesias et al., 2004), P. calleryana (Berardi et al. , 1993), P. calleryana , P. betulaefolia (Yeo and Reed, 1995) и P. syriaca (Shibli et al., 1997), о которых сообщалось несколькими исследователями (Chevreau and Bell, 2005). . Однако микроразмножение P. elaeagrifolia не изучалось. В этом исследовании мы сообщаем о in vitro пролиферация побегов и in vitro и ex vitro корнеобразование P. elaeagrifolia .
Материалы и методы
Растительный материал
В настоящем исследовании дикое взрослое дерево, полученное из семян P. elaeagrifolia Pallas, использовалось в качестве растительного материала, а in vitro верхушечных культур были получены из активно растущие побеги.
Создание эксплантатов и эксперименты по размножению побегов
Murashige and Skoog (1962) Во всех экспериментах использовали базовую среду, содержащую 3% (вес/объем) сахарозы и 0,7% (вес/объем) агара Difco Bacto. В базовую среду MS добавляли 0,3 мкМ гибберелловой кислоты (GA 3 ). Для начальных экспериментов по культивированию и размножению использовали бензиладенин (БА; 0,0, 4,5 и 9,0 мкМ) в сочетании с индол-3-масляной кислотой (ИМК; 0,0, 0,5 и 2,5 мкМ) и индол-3-уксусной кислотой ( ИУК; 0,0, 0,5 и 2,5 мкМ). Все регуляторы роста добавляли в среду перед автоклавированием при 121°С в течение 20 мин. pH доводили до 5,7 перед добавлением агара и автоклавированием. Все культуры хранили при 24 ± 1°C в условиях 16-часового фотопериода холодного белого флуоресцентного света (35 мкмоль⋅м -2 ⋅с -1 ).
В базовую среду MS добавляли 0,3 мкМ гибберелловой кислоты (GA 3 ). Для начальных экспериментов по культивированию и размножению использовали бензиладенин (БА; 0,0, 4,5 и 9,0 мкМ) в сочетании с индол-3-масляной кислотой (ИМК; 0,0, 0,5 и 2,5 мкМ) и индол-3-уксусной кислотой ( ИУК; 0,0, 0,5 и 2,5 мкМ). Все регуляторы роста добавляли в среду перед автоклавированием при 121°С в течение 20 мин. pH доводили до 5,7 перед добавлением агара и автоклавированием. Все культуры хранили при 24 ± 1°C в условиях 16-часового фотопериода холодного белого флуоресцентного света (35 мкмоль⋅м -2 ⋅с -1 ).
Для получения эксплантатов кончики побегов длиной 2 см промывали проточной водопроводной водой в течение 5 мин и стерилизовали поверхность в растворе гипохлорита натрия (3% активного хлора) с 0,1% (об./об.) Tween 20 в течение 15 мин и трижды ополаскивают стерильной дистиллированной водой. Экспланты верхушек побегов (≈1 см) культивировали в стеклянных пробирках (12 см × 2,5 см), содержащих 10 мл среды МС с добавлением комбинаций БК ИМК и ИУК. После 4 недель культивирования регистрировали процент эксплантов, образующих побеги, и количество побегов длиной более 1 см.
После 4 недель культивирования регистрировали процент эксплантов, образующих побеги, и количество побегов длиной более 1 см.
Побеги in vitro , которые будут использоваться в качестве эксплантатов для экспериментов по размножению, должны быть в достаточном количестве. По этой причине побеги (>1 см) исходных культур пересевают на среду МС с добавлением 9,0 мкМ БК в течение 4 нед. Затем побеги, пролиферировавшие на этой среде, пересевают в стеклянные колбы (250 мл), содержащие 50 мл среды МС с добавлением комбинаций БК и ИМК или ИУК, с интервалом в 4 недели, три раза. Каждый раз побеги пересевают на свежую среду того же состава, что и предыдущая пересев. Процент размножения побегов и количество побегов (>1 см) на пролиферирующий побег регистрировали только в конце второй и третьей пересевов на среду МС с добавлением различных комбинаций БК × ауксин. Данные первой пересева не оценивали, так как экспланты, использованные в этой пересевке, были взяты из культур на среде МС с добавлением 90,0 мкМ ВА.
Эксперименты с тремя факторами (концентрация БК, концентрация ауксина и тип ауксина) были организованы как полностью рандомизированный план с факторными комбинациями БК (0,0, 4,5 и 9,0 мкМ) и ИМК (0,0, 0,5 и 2,5 мкМ). ) или ИУК (0,0, 0,5 и 2,5 мкМ). Каждая обработка в исходной культуре включала 12 повторов (пробирки). Эксперимент по размножению побегов состоял из трех повторностей (колбочек) по пять побегов в каждой обработке.
Эксперименты по укоренению
Эксперименты по укоренению проводились в условиях in vitro и ex vitro с микроразмноженными побегами длиной примерно 1–2 см, полученными из пятой субкультуры. В эксперименте по укоренению in vitro использовали базальную среду MS, содержащую макроэлементы половинной концентрации с добавлением 3% (масса/объем) сахарозы и 0,7% (масса/объем) агара Difco Bacto. Эффекты различных обработок ауксином, которые представляли собой базовую среду без регуляторов роста (контроль), нафталинуксусную кислоту (НУК; 5 и 10 мкМ) и ИМК (5 и 10 мкМ) в базовой среде, 10 – второе погружение в ИМК (10 и 20 мМ) и растворенные в 50% этаноле, тестировали на свету или в темноте в течение 10 дней, а затем на свету.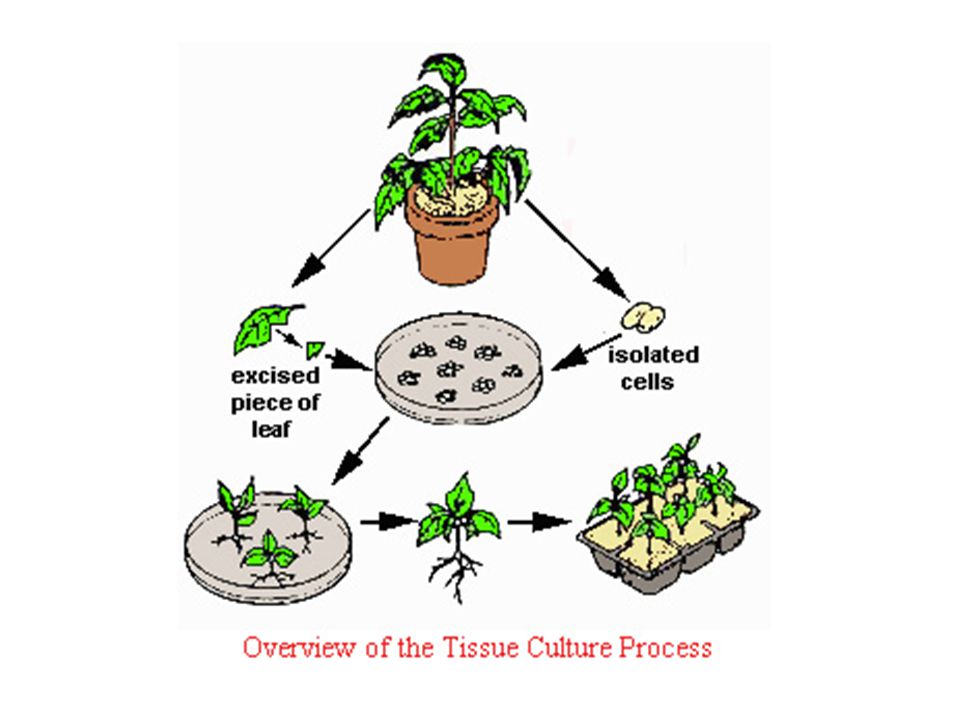 Двухфакторный эксперимент (ауксин × темнота) был организован как полностью рандомизированный план с факторными комбинациями обработок ауксином и темнотой. Каждая обработка включала 24 повторения (пробирки).
Двухфакторный эксперимент (ауксин × темнота) был организован как полностью рандомизированный план с факторными комбинациями обработок ауксином и темнотой. Каждая обработка включала 24 повторения (пробирки).
Для экспериментов по укоренению ex vitro микрочеренки быстро погружали в растворы 0, 10, 20, 30 или 40 мМ IBA в 50% этаноле. Эти черенки помещали в пластиковые ящики (10 см × 8 см × 5 см), содержащие перлит. Коробка была запечатана полиэтиленовой пленкой, чтобы предотвратить высыхание. Влажность в ящиках постепенно снижали, открывая пломбы. Эксперимент был однофакторным (обработки ауксином) полностью рандомизированным дизайном, состоял из четырех повторностей (боксов) по пять микровырезов в каждой обработке. Культуры выращивали при 24 ± 1°С при 16-часовом фотопериоде с концентрацией 35 мкмоль⋅м -2 ⋅s -1 поставляется с флуоресцентными лампами холодного белого цвета для лечения in vitro и ex vitro .
Данные были собраны через 45 дней для in vitro и 75 дней для ex vitro эксперимента. Определяли процент укоренившихся побегов, количество корней и среднюю длину корней на один укоренившийся побег. Мозоли оценивали по шкале от 0 до 4 (0 = нет мозолей, 1 = очень маленькие, 2 = маленькие, 3 = средние, 4 = большие) на каждый побег.
Определяли процент укоренившихся побегов, количество корней и среднюю длину корней на один укоренившийся побег. Мозоли оценивали по шкале от 0 до 4 (0 = нет мозолей, 1 = очень маленькие, 2 = маленькие, 3 = средние, 4 = большие) на каждый побег.
Всходы пересаживали в горшки, содержащие автоклавированную смесь торфа (70%), перлита (12%), песка (12%) и садовой земли (6%), и горшки накрывали пластиковой пленкой. Пластиковая пленка была особенно открыта через 3 недели в комнате для выращивания.
Статистический анализ
Многофакторный дисперсионный анализ (ANOVA) был выполнен для данных с помощью программного обеспечения Minitab (MINITAB Inc.). Средние значения сравнивали с помощью критерия множественного диапазона Дункана ( P <0,05). Перед анализом для процентных данных использовались преобразования Arcsin.
Результаты
Пролиферация побегов
В исходной культуре влияние взаимодействия БК × концентрация ауксина и типа ауксина × концентрация ауксина на скорость пролиферации побегов было значительным (таблица 1). Практически при всех концентрациях ауксина 4,5 и 9,0 мкМ БК давали самые высокие скорости пролиферации побегов. С другой стороны, пролиферация побегов увеличивалась при концентрациях ИУК 0,0 и 0,5 мкМ и концентрации ИМК 2,5 мкМ. В исходной культуре самые высокие проценты (>80%) пролиферации побегов были получены на среде с добавлением 90,0 мкМ БК и 0,5 мкМ ИУК (Таблица 1) Во второй и третьей субкультурах на скорость размножения побегов значительно влияли концентрации БК, причем самые высокие были получены при концентрациях БК от 4,5 до 9,0 мкМ. Коэффициенты размножения побегов колебались от 91,1 ± 2,4 до 96,4 ± 2,0 % и от 76,7 ± 7,8 до 89,4 ± 3,3 % во второй и третьей пересевах соответственно.
Практически при всех концентрациях ауксина 4,5 и 9,0 мкМ БК давали самые высокие скорости пролиферации побегов. С другой стороны, пролиферация побегов увеличивалась при концентрациях ИУК 0,0 и 0,5 мкМ и концентрации ИМК 2,5 мкМ. В исходной культуре самые высокие проценты (>80%) пролиферации побегов были получены на среде с добавлением 90,0 мкМ БК и 0,5 мкМ ИУК (Таблица 1) Во второй и третьей субкультурах на скорость размножения побегов значительно влияли концентрации БК, причем самые высокие были получены при концентрациях БК от 4,5 до 9,0 мкМ. Коэффициенты размножения побегов колебались от 91,1 ± 2,4 до 96,4 ± 2,0 % и от 76,7 ± 7,8 до 89,4 ± 3,3 % во второй и третьей пересевах соответственно.
ТАБЛИЦА 1. Влияние бензиладенина (БК), индол-3-масляной кислоты (ИМК) и индол-3-уксусной кислоты (ИУК) на процент пролиферации побегов у Pyrus elaeagrifolia Pallas.
Влияние взаимодействия концентрация бензиладенина × тип ауксина × концентрация ауксина на количество побегов на эксплант было значительным в исходной культуре (таблица 2). Наибольшая пролиферация побегов (1,7 ± 0,2) была получена на среде, содержащей от 4,5 мкМ БК до 2,5 мкМ ИМК. Средняя пролиферация побегов эксплантатов на этой стадии была невысокой, тогда как во второй субкультуре она резко возрастала (табл. 2). Взаимодействие БК × концентрация ауксина было значительным, и побеги, выращенные на 90,0 мкМ БК без ауксина вызывали наилучшую пролиферацию побегов (10,6 ± 1,6). Наибольшее количество побегов зафиксировано при 9,0 мкМ БК в третьей субкультуре (рис. 1). На размножение значительно влияли концентрации БА в этой субкультуре.
Наибольшая пролиферация побегов (1,7 ± 0,2) была получена на среде, содержащей от 4,5 мкМ БК до 2,5 мкМ ИМК. Средняя пролиферация побегов эксплантатов на этой стадии была невысокой, тогда как во второй субкультуре она резко возрастала (табл. 2). Взаимодействие БК × концентрация ауксина было значительным, и побеги, выращенные на 90,0 мкМ БК без ауксина вызывали наилучшую пролиферацию побегов (10,6 ± 1,6). Наибольшее количество побегов зафиксировано при 9,0 мкМ БК в третьей субкультуре (рис. 1). На размножение значительно влияли концентрации БА в этой субкультуре.
ТАБЛИЦА 2. Влияние бензиладенина (БК), индол-3-масляной кислоты (ИМК) и индол-3-уксусной кислоты (ИУК) на пути пролиферации побегов у Pyrus elaeagrifolia Pallas.
РИСУНОК 1. Пролиферация побегов в Pyrus elaeagrifolia на среде MS с добавлением 4,5 мкМ бензиладенина (ВА) и 0,3 мкМ гибберелловой кислоты (GA 3 ).
Укоренение
Самый высокий процент укоренения был получен как 54,2 ± 10,4 и 55 ± 9,6% в экспериментах in vitro и ex vitro соответственно. Как в условиях in vitro , так и в условиях ex vitro образование корней не наблюдалось в контрольных средах без регуляторов роста. Взаимодействие ауксина и темноты было значимым для in vitro экспериментов по укоренению (табл. 3). Наибольшая укореняемость (54,2 ± 10,4%) и длина корня (10,5 ± 2,4 мм) были получены при 10-дневной темновой обработке на среде с 5 мкМ ИМК. Однако количество корней на укоренившийся побег на среде с 5 мкМ IBA было статистически одинаковым как при световой (2,4 ± 0,9), так и при темной (2,5 ± 0,6) обработках. NAA не способствовала образованию корней in vitro . Как правило, побеги, культивированные на среде с высоким содержанием IBA (10 мкМ) или быстро погруженные в 10 или 20 мМ растворы IBA как в темноте, так и на свету, продуцировали более крупный каллюс, чем другие среды. Степень мозоли (0–4) из in vitro микросрезов колебались от 0,0 до 3,8 ± 0,1 (табл. 3).
Как в условиях in vitro , так и в условиях ex vitro образование корней не наблюдалось в контрольных средах без регуляторов роста. Взаимодействие ауксина и темноты было значимым для in vitro экспериментов по укоренению (табл. 3). Наибольшая укореняемость (54,2 ± 10,4%) и длина корня (10,5 ± 2,4 мм) были получены при 10-дневной темновой обработке на среде с 5 мкМ ИМК. Однако количество корней на укоренившийся побег на среде с 5 мкМ IBA было статистически одинаковым как при световой (2,4 ± 0,9), так и при темной (2,5 ± 0,6) обработках. NAA не способствовала образованию корней in vitro . Как правило, побеги, культивированные на среде с высоким содержанием IBA (10 мкМ) или быстро погруженные в 10 или 20 мМ растворы IBA как в темноте, так и на свету, продуцировали более крупный каллюс, чем другие среды. Степень мозоли (0–4) из in vitro микросрезов колебались от 0,0 до 3,8 ± 0,1 (табл. 3).
ТАБЛИЦА 3. Влияние ауксина и темноты на укоренение побегов in vitro у Pyrus elaeagrifolia Pallas.
В экспериментах по укоренению ex vitro на укоренение побегов значительно повлияла концентрация IBA 10 мМ в методе быстрого погружения (таблица 4). Самый высокий процент укоренения (55 ± 9,6%) и количество корней на укоренившийся побег (1,8 ± 0,3) были получены при этой концентрации в конце 75 дней. Быстрое погружение в обработку IBA не оказало существенного влияния на длину корня и степень мозоли. Средняя длина корня, измеренная между 17,6 ± 10,4 и 28,9± 7,0 мм, был выше, чем полученный из экспериментов in vitro . Одной из причин более длинных корней на микрочеренках была продолжительность пребывания в перлите (75 дней). Несмотря на высокую концентрацию ИМК, равную 40 мМ, каллусная степень микровырезов колебалась от 0,0 до 0,1 ± 0,03 (табл. 4).
ТАБЛИЦА 4. Влияние обработки быстрым погружением в растворы индол-3-масляной кислоты (ИМК) на укоренение ex vitro побегов Pyrus elaeagrifolia Pallas.
Обсуждение
В настоящем исследовании культура верхушек побегов взрослого дерева P. elaeagrifolia была успешно установлена на среде MS с добавлением некоторых регуляторов роста. Во время исходных культур и пересевов не наблюдалось загрязнения тканей и потемнения. In vitro На пролиферацию побегов P. elaeagrifolia влияли концентрации БА (4,5 и 9,0 мкМ) как в исходных культурах, так и в субкультурах. Сообщалось, что концентрации БА от 3,3 до 20 мкМ приводили к успешному размножению P. communis (Singha, 1982; Shen and Mullins, 1984; Baviera et al., 1989; Dolcet-Sanjuan et al., 1990; Moretti et al., 1991; Rodriguez et al., 1991; Yeo and Reed, 1995; Iglesias et al., 2004), P. calleryana (Dolcet-Sanjuan et al., 1990; Rossi et al., 1991; Berardi et al., 1993; Yeo and Reed, 1995), P. amygdaliformis (Dolcet-Sanjuan et al., 1990), P. betulifolia (Dolcet-Sanjuan et al., 1990; Yeo and Reed, 1995) и P. syrica (Shibli et al., 19).97). Как правило, исследователи использовали только BA для микроразмножения видов Pyrus , и имеется очень мало информации о влиянии ауксинов на размножение этого рода.
elaeagrifolia была успешно установлена на среде MS с добавлением некоторых регуляторов роста. Во время исходных культур и пересевов не наблюдалось загрязнения тканей и потемнения. In vitro На пролиферацию побегов P. elaeagrifolia влияли концентрации БА (4,5 и 9,0 мкМ) как в исходных культурах, так и в субкультурах. Сообщалось, что концентрации БА от 3,3 до 20 мкМ приводили к успешному размножению P. communis (Singha, 1982; Shen and Mullins, 1984; Baviera et al., 1989; Dolcet-Sanjuan et al., 1990; Moretti et al., 1991; Rodriguez et al., 1991; Yeo and Reed, 1995; Iglesias et al., 2004), P. calleryana (Dolcet-Sanjuan et al., 1990; Rossi et al., 1991; Berardi et al., 1993; Yeo and Reed, 1995), P. amygdaliformis (Dolcet-Sanjuan et al., 1990), P. betulifolia (Dolcet-Sanjuan et al., 1990; Yeo and Reed, 1995) и P. syrica (Shibli et al., 19).97). Как правило, исследователи использовали только BA для микроразмножения видов Pyrus , и имеется очень мало информации о влиянии ауксинов на размножение этого рода.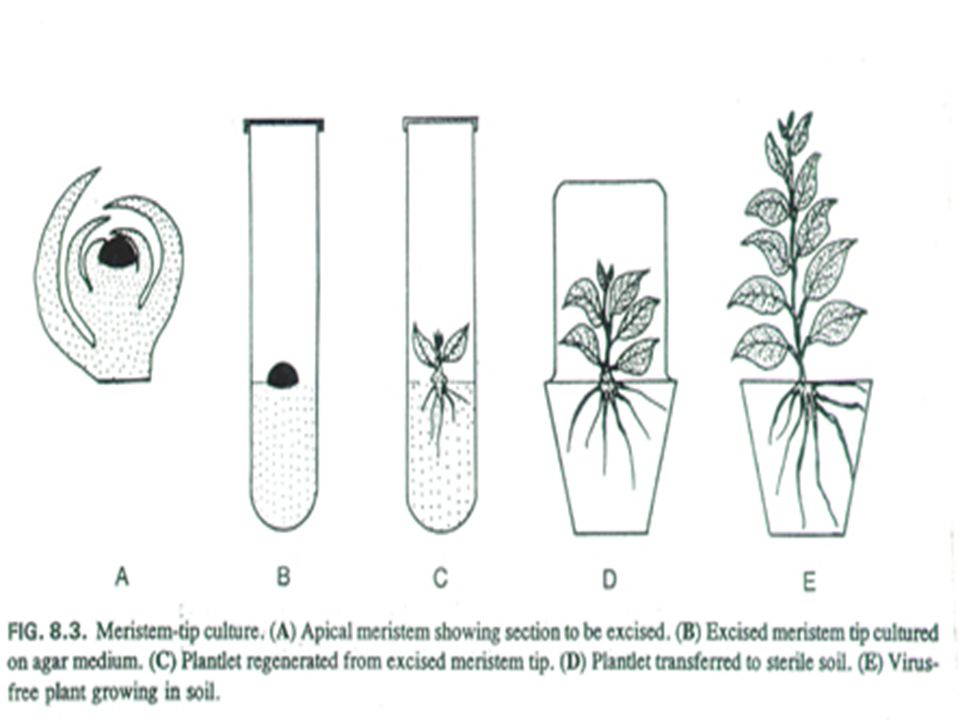 Yeo и Reed (1995) исследовали комбинации BA с IBA и NAA при размножении трех вариантов подвоя P. calleryana , P. betulifolia и P. communis . Результаты показали, что концентрации IBA и NAA >0,5 или 1 мкМ подавляли размножение побегов у всех трех генотипов. Бходжвани и др. (1984) сообщили, что побеги P. pyrifolia размножали на среде MS с добавлением 6,7 мкМ БК и 0,1 мкМ НУК. Наши результаты по IBA согласуются с результатами Yeo and Reed (1995). В настоящем исследовании комбинация высоких концентраций БК (9,0 мкМ) и ауксина (2,5 мкМ) ингибировала пролиферацию побегов P. elaeagrifolia в исходной культуре. Кроме того, при >9,0 мкМ ВА и >2,5 мкМ IAA или IBA (данные не показаны) возникали сильные мозоли на базальном конце и гипергидратация побегов in vitro . Нет информации о влиянии ИУК на Pyrus видов. Наше исследование показало, что ИУК в концентрации 0,5 мкМ вызывала самый высокий процент пролиферации побегов в исходной культуре. Согласно этому результату, ИУК важна для пролиферации побегов у P.
Yeo и Reed (1995) исследовали комбинации BA с IBA и NAA при размножении трех вариантов подвоя P. calleryana , P. betulifolia и P. communis . Результаты показали, что концентрации IBA и NAA >0,5 или 1 мкМ подавляли размножение побегов у всех трех генотипов. Бходжвани и др. (1984) сообщили, что побеги P. pyrifolia размножали на среде MS с добавлением 6,7 мкМ БК и 0,1 мкМ НУК. Наши результаты по IBA согласуются с результатами Yeo and Reed (1995). В настоящем исследовании комбинация высоких концентраций БК (9,0 мкМ) и ауксина (2,5 мкМ) ингибировала пролиферацию побегов P. elaeagrifolia в исходной культуре. Кроме того, при >9,0 мкМ ВА и >2,5 мкМ IAA или IBA (данные не показаны) возникали сильные мозоли на базальном конце и гипергидратация побегов in vitro . Нет информации о влиянии ИУК на Pyrus видов. Наше исследование показало, что ИУК в концентрации 0,5 мкМ вызывала самый высокий процент пролиферации побегов в исходной культуре. Согласно этому результату, ИУК важна для пролиферации побегов у P. elaeagrifolia .
elaeagrifolia .
Как in vitro , так и ex vitro укоренение микроразмноженных побегов P. elaeagrifolia осуществлялось только с помощью обработки ауксином. Такие результаты были обнаружены у некоторых других видов Pyrus и древесных растений (Bhojwani et al., 19).84; Шен и Маллинз, 1984 г.; Бавьера и др., 1989; Макклелланд и др., 1990; Берарди и др., 1991, 1993; Дольсет-Санджуан и др., 1991; Моретти и др., 1991; Родригес и др., 1991; Росси и др., 1991; Аль-Маарри и др., 1994; Рид, 1995; Йео и Рид, 1995; Шибли и др., 1997; Иглесиас и др., 2004; Баррос и др., 2005). В текущем исследовании IBA в низкой концентрации (5 мкМ) при обработке в темноте (10 дней) стимулировал образование корней in vitro в микрочеренках P. elaeagrifolia . Этот результат согласуется с тем, что разбавленная минеральная среда с 0,1–10 мкМ ИМК и НУК и начальный период инкубации в темноте в течение 7–10 дней улучшает укоренение груши 9.0005 in vitro побегов (Chevreau and Bell, 2005). Мы также использовали базовую среду MS с половинной концентрацией макроэлементов в эксперименте по укоренению, но корнеобразование не было получено на среде с добавлением NAA. Однако Аль-Маарри и соавт. (1994) сообщили, что лучшим экзогенным ауксином для укоренения in vitro сеянцев груши сортов Passe Crassane и Williams был NAA в концентрации 1 мкМ. Сообщалось, что корнеобразование видов Pyrus ( P. betulaefolia, P. communis, P. calleryana и P. amygdaliformis ) стимулировали воздействием на побеги высоких уровней (10 или 32 мкМ) IBA в течение 7 дней с последующим пассированием на среде без ауксина (Dolcet-Sanjuan et al., 1990). Наш результат показал, что IBA является эффективным ауксиновым типом для укоренения микрочеренков P. elaeagrifolia . Точно так же, особенно для рекальцитрантных генотипов Pyrus , было предложено лечение 10 мкМ IBA в течение 1 или 3 недель в темноте (Reed, 1995; Yeo and Reed, 1995), но концентрации IBA ниже 10 мкМ в исследованиях не тестировались.
Мы также использовали базовую среду MS с половинной концентрацией макроэлементов в эксперименте по укоренению, но корнеобразование не было получено на среде с добавлением NAA. Однако Аль-Маарри и соавт. (1994) сообщили, что лучшим экзогенным ауксином для укоренения in vitro сеянцев груши сортов Passe Crassane и Williams был NAA в концентрации 1 мкМ. Сообщалось, что корнеобразование видов Pyrus ( P. betulaefolia, P. communis, P. calleryana и P. amygdaliformis ) стимулировали воздействием на побеги высоких уровней (10 или 32 мкМ) IBA в течение 7 дней с последующим пассированием на среде без ауксина (Dolcet-Sanjuan et al., 1990). Наш результат показал, что IBA является эффективным ауксиновым типом для укоренения микрочеренков P. elaeagrifolia . Точно так же, особенно для рекальцитрантных генотипов Pyrus , было предложено лечение 10 мкМ IBA в течение 1 или 3 недель в темноте (Reed, 1995; Yeo and Reed, 1995), но концентрации IBA ниже 10 мкМ в исследованиях не тестировались. Берарди и др. (1993) обнаружили, что укоренение in vitro в P. calleryana стимулировалось ауксинами, в основном NAA (2,7 мкМ). Шибли и др. (1997) сообщили, что IBA, IAA и NAA индуцировали in vitro укоренение P. syrica , и максимальное укоренение 72% было достигнуто при 17 мкМ IAA. Для in vitro укоренения сорта груши Конференция было обнаружено, что ИУК в концентрации 2,7 мкМ наиболее подходит (Baviera et al., 1989). Но Аль-Маарри и др. (1994) сообщили, что ИУК неблагоприятна для укоренения побегов груши.
Берарди и др. (1993) обнаружили, что укоренение in vitro в P. calleryana стимулировалось ауксинами, в основном NAA (2,7 мкМ). Шибли и др. (1997) сообщили, что IBA, IAA и NAA индуцировали in vitro укоренение P. syrica , и максимальное укоренение 72% было достигнуто при 17 мкМ IAA. Для in vitro укоренения сорта груши Конференция было обнаружено, что ИУК в концентрации 2,7 мкМ наиболее подходит (Baviera et al., 1989). Но Аль-Маарри и др. (1994) сообщили, что ИУК неблагоприятна для укоренения побегов груши.
В качестве другой обработки Reed (1995) рекомендовал использовать обработку погружением IBA или NAA для укоренения генотипов груши с неизвестным потенциалом укоренения. Но влияние процедур погружения 10 и 20 мМ IBA на укоренение in vitro в P. elaeagrifolia было не таким сильным, как влияние среды с добавлением 5 мкМ IBA в темноте. Однако Родригес и соавт. (1991) сообщили, что укоренение in vitro без образования мозолей у P. communis было достигнуто путем погружения базального конца в 5 мкМ раствор IBA на 1 мин.
communis было достигнуто путем погружения базального конца в 5 мкМ раствор IBA на 1 мин.
Успешное укоренение ex vitro может сэкономить время и снизить затраты (Йео и Рид, 1995). В нашем исследовании обработка 10 мМ IBA быстрым погружением в условиях ex vitro стимулировала укоренение, но более высокие концентрации IBA препятствовали образованию корней у микрочеренков. Однако Йео и Рид (1995) сообщили, что ни укоренение, ни выживание не произошло после обработки ex vitro у любых подвоев Pyrus . Кроме того, укоренение ex vitro оказалось безуспешным в течение P. syrica при обработке микросрезов 0–100 мкМ ИМК, ИУК или НУК в течение 1 ч (Shibli et al., 1997). Аль-Маарри и др. (1994) сообщили, что укоренение ex vitro было вызвано предварительной обработкой при хранении в течение 1 месяца с последующим погружением на 1 час в растворы NAA (0,05–0,5 мМ).
Заключение
Здесь мы сообщаем об эффективном протоколе клонального размножения с помощью культуры верхушек побегов дикого взрослого дерева P. elaeagrifolia . Комбинация 9,0 мкМ БК и 0,5 мкМ ИУК и 4,5 или 90,0 мкМ БК без ауксина рекомендуется для исходных культур и пересевов соответственно. Укоренение микрочеренков было хорошим на среде MS, модифицированной макроэлементами половинной концентрации с 5 мкМ IBA и 10-дневной темновой обработкой in vitro или 10 мМ IBA быстрым погружением для ex vitro . Акклиматизацию проростков проводили в камере выращивания в течение 3 недель. В настоящее время мы успешно используем этот протокол для других исследований in vitro на P. elaeagrifolia .
elaeagrifolia . Комбинация 9,0 мкМ БК и 0,5 мкМ ИУК и 4,5 или 90,0 мкМ БК без ауксина рекомендуется для исходных культур и пересевов соответственно. Укоренение микрочеренков было хорошим на среде MS, модифицированной макроэлементами половинной концентрации с 5 мкМ IBA и 10-дневной темновой обработкой in vitro или 10 мМ IBA быстрым погружением для ex vitro . Акклиматизацию проростков проводили в камере выращивания в течение 3 недель. В настоящее время мы успешно используем этот протокол для других исследований in vitro на P. elaeagrifolia .
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Al-Maarri, K., Arnaud, Y., and Miginiac, E. (1994). Микроразмножение сеянцев Pyrus communis сорта «Passe Crassane» и сорта «Williams»: факторы, влияющие на корнеобразование in vitro и ex vitro. науч. Хортик. 58, 207–214. doi: 10.1016/0304-4238(94)-X
науч. Хортик. 58, 207–214. doi: 10.1016/0304-4238(94)-X
CrossRef Full Text | Google Scholar
Баррос, М.Т.Ф., Иполито, К.И., и Баптиста, К.Г.М. (2005). Укоренение in vitro сортов груши португальской ( Pyrus communis ) в ответ на изменения индукции ауксина и обработки в темный период. Акта Хортик . 671, 631–636.
Google Scholar
Бавьера Дж. А., Гарсия Дж. Л. и Ибарра М. (1989). Коммерческое микроразмножение in vitro сорта груши. конференция. Акта Хортик . 256, 63–68.
Google Scholar
Белл, Р. Л., Куамм, Х. А., Лейн, Р. Э. К., и Скирвин, Р. М. (1996). «Груши», в Fruit Breeding, Tree and Tropical Fruits , eds J. Janick and JN Moore (Нью-Йорк, штат Нью-Йорк: John Wiley and Sons, Inc.), 441–514.
Google Scholar
Берарди Г., Инфанте Р. и Нери Д. (1993). Микроразмножение Pyrus calleryana Dcn. из рассады. науч. Хортик. 53, 157–165. дои: 10.1016/0304-4238(93)-H
Полнотекстовая перекрестная ссылка | Google Scholar
Берарди Г. , Нери Д., Мажорино А. и Аверси Р. (1991). Укоренение in vitro Pyrus calleryana . Акта Хортик. 300, 181–188.
, Нери Д., Мажорино А. и Аверси Р. (1991). Укоренение in vitro Pyrus calleryana . Акта Хортик. 300, 181–188.
Google Scholar
Бходжвани С.С., Маллинз К. и Коэн Д. (1984). Размножение in vitro Pyrus pyrifolia . науч. Хортик. 23, 247–254. doi: 10.1016/0304-4238(84)-2
CrossRef Full Text | Академия Google
Ченг, Т.Ю. (1979). Микроразмножение клоновых подвоев плодовых деревьев. Компактные фруктовые деревья 12, 127–137.
Реферат PubMed | Полный текст | Google Scholar
Шевро Э. и Белл Р. (2005). « Pyrus spp. груша и Cydonia spp. айва», в Биотехнология плодовых и орехоплодных культур , изд. RE Litz (Trowbridge: CABI Publishing), 543–565. doi: 10.1079/9780851996622.0543
CrossRef Full Text | Google Scholar
Claveria, E., Asin, L., Iglesias, I., Vilardell, P., Bonany, J., Simard, M. H., et al. (2010). Скрининг in vitro на устойчивость к железному хлорозу как надежный инструмент селекции в программе селекции подвоев. Акта Хортик . 935, 199–206.
Акта Хортик . 935, 199–206.
Google Scholar
Дольсет-Санджуан Р., Клаверия Э., Бонани Дж., Иглесиас И., Асин Л. и Симард М. Х. (2004). Селекция новых подвоев груши: скрининг in vitro и полевая оценка устойчивости к железному хлорозу. Акта Хортик . 658, 463–468.
Google Scholar
Dolcet-Sanjuan, R., Mok, D.W.S., and Mok, M.C. (1990). Микроразмножение Pyrus и Cydonia и их реакции на условия, ограничивающие содержание Fe. Культ органов растительных клеток. 21, 191–199. doi: 10.1007/BF00047611
CrossRef Полный текст | Google Scholar
Dolcet-Sanjuan, R., Mok, DWS, and Mok, M.C. (1991). Манипуляции in vitro с видами Pyrus и Cydonia oblonga . Акта Хортик . 300, 45–50.
Google Scholar
Думаноглу Х., Айгун А., Алай А., Гюнес Н. Т. и Озкая М. Т. (1999). Влияние сроков, IBA и путресцина на укоренение и стрелкование в Pyrus elaegrifolia pall. обрезки хвойных пород. тюрк. Дж. Агрик. За. 23, 559–565.
тюрк. Дж. Агрик. За. 23, 559–565.
Google Scholar
Evans, NE (1990). «Микроразмножение» в Methods in Molecular Biology. Plant Cell and Tissue Culture , eds JW Pollard and JM Walker (Нью-Джерси: Humana Press), 93–103. doi: 10.1385/0-89603-161-6:93
CrossRef Full Text | Google Scholar
Хартманн Х.Т., Кестер Д.Е., Дэвис Ф.Т. и Женева Р.Л. (1997). Размножение растений: принципы и практика , 6-е изд. Нью-Джерси: Prentice-Hall, Inc.
Google Scholar
Иглесиас И., Виларделл П., Бонани Дж., Клаверия Э. и Дольсет-Санджуан Р. (2004). Микроразмножение и полевая оценка груши ( Pyrus communis L.) « IGE 2002», новой селекции сорта Dr. Jules Guyot. Дж. Ам. соц. Хорт. наука . 129, 389–393.
Google Scholar
Коксал А.И., Думаноглу Х. и Гюнеш Н. (2002). Анкара » Сорт груши . Анкара: Аджанс-Тюрк Пресс.
Google Scholar
Ломбард, П. Б., и Вествуд, М. Н. (1987). «Подвои груши», в Rootstocks for Fruit Crops , eds RC Rom and RF Carlson (Нью-Йорк, штат Нью-Йорк: John Wiley and Sons, Inc. ), 145–183.
), 145–183.
Google Scholar
Макклелланд, М.Т., Смит, М.А.Л., и Карозерс, З.Б. (1990). Влияние инициации корней in vitro и ex vitro на последующее качество корней микрорезки у трех древесных растений. Культ органов растительных клеток. 23, 115–123. doi: 10.1007/BF00035831
Полный текст CrossRef | Google Scholar
Моретти К., Скоццоли А., Пазини Д. и Паганелли Ф. (1991). Размножение сортов груши in vitro. Акта Хортик . 300, 115–117.
Google Scholar
Мурасиге Т. и Скуг Ф. (1962). Пересмотренная среда для быстрого роста и биоанализа с культурами тканей табака. Физиол. Растение. 15, 473–497. дои: 10.1111/j.1399-3054.1962.tb08052.x
Полнотекстовая перекрестная ссылка | Google Scholar
Рид, Б. М. (1995). Скрининг зародышевой плазмы Pyrus на реакцию укоренения in vitro. HortScience 30, 1292–1294.
Google Scholar
Родригес Р., Сала К.Д., Куоццо Л. и Анкора Г. (1991). Размножение груши in vitro с использованием двухфазной системы культивирования. HortScience 26, 62–64.
HortScience 26, 62–64.
Google Scholar
Росси В., Паоли Г. Д. и Поццо Ф. Д. (1991). Размножение Pyrus calleryana sel. D6 культурой in vitro. Акта Хорт . 300, 145–148.
Google Scholar
Shen, X.S., и Mullins, M.G. (1984). Размножение in vitro груши Pyrus communis L., сортов William’s Bon Chretien, Packham’s Triumph и Beurre Bosc. науч. Хортик. 23, 51–57. doi: 10.1016/0304-4238(84)-X
CrossRef Full Text | Google Scholar
Шибли Р. А., Аджлуни М. М., Джарадат А., Альджанаби С. и Шатнави М. (1997). Микроразмножение дикой груши ( Pyrus syrica). науч. Хортик. 68, 237–242. doi: 10.1016/S0304-4238(96)00972-7
CrossRef Full Text | Google Scholar
Сингха, С. (1982). Влияние концентрации агара на пролиферацию побегов in vitro Malus sp. «Almey» и Pyrus communis «Seckel». Дж. Ам. соц. Хорт. науч. 107, 657–660.
Google Scholar
Webster, AD (1995). Размножение подвоя плодовых деревьев умеренного пояса. NZ J. Crop Hortic. наука . 23, 355–372. doi: 10.1080/01140671.1995.9513912
Размножение подвоя плодовых деревьев умеренного пояса. NZ J. Crop Hortic. наука . 23, 355–372. doi: 10.1080/01140671.1995.9513912
PubMed Abstract | Полный текст | Полный текст перекрестной ссылки | Google Scholar
Йео, Д.Ю., и Рид, Б.М. (1995). Микроразмножение трех подвоев Pyrus . HortScience 30, 620–623.
Реферат PubMed | Полный текст | Google Scholar
Культура растительных тканей in vitro как пятое поколение биоэнергетики
Термогравиметрический анализ (ТГА). Терморазложение образцов исследовали с помощью ТГА, как показано на рис. 2. Этот метод измерял количество и скорость изменения вес различных доступных фракций в образцах в зависимости от температуры. На рис. 2 можно выделить четыре стадии при ГТЛ образцов: ниже 160 °С, 160–540 °С, 540–800 °С и выше 800 °С. Первые три области были зарегистрированы в атмосфере азота для имитации реакций пиролиза. В последней области газ-носитель переключился с азота на кислород, на реакции горения 20 . Потеря массы образцов при температуре ниже 160 °C была связана с потерей слабосвязанной воды, что соответствует содержанию влаги 21,22 . Точные значения влажности приведены в таблице 1. Лист, стебель и корень, полученные из выращенных in vitro саженцев Cannabis sativa , имели среднее содержание влаги 15,45, 18,87 и 20,78 мас.% соответственно. Различные каллусы показали более низкое содержание влаги. Влажность CL, CS и CR составила 10,63, 10,52 и 10,36 мас.% соответственно.
Потеря массы образцов при температуре ниже 160 °C была связана с потерей слабосвязанной воды, что соответствует содержанию влаги 21,22 . Точные значения влажности приведены в таблице 1. Лист, стебель и корень, полученные из выращенных in vitro саженцев Cannabis sativa , имели среднее содержание влаги 15,45, 18,87 и 20,78 мас.% соответственно. Различные каллусы показали более низкое содержание влаги. Влажность CL, CS и CR составила 10,63, 10,52 и 10,36 мас.% соответственно.
Рисунок 2
Термогравиметрический анализ образцов, полученных из посевной и каллусной культуры.
Изображение полного размера
Таблица 1 Элементный и экспресс-анализ образцов, полученных из посевной и каллусной культуры.
Полноразмерная таблица
Между 160 и 800 °C есть две области массы, соответствующие летучим веществам и связанному углероду. Вторая область показывает, что разлагаемые органические фракции (целлюлоза и гемицеллюлоза) разлагаются при 160 °C. Эту область можно считать зоной активного разложения, в которой имеет место наибольшая скорость деполимеризации 23 . Как показано на рис. 2, образцы на основе каллуса имели более высокие значения летучих веществ, чем образцы на основе семян. CL представляет собой самое высокое зарегистрированное значение, 61,34 мас.%. При температуре выше 800 °C в атмосфере азота дальнейших потерь массы обнаружено не было. Поэтому в этот момент газ-носитель был переключен с азота на кислород для горения. Третья и четвертая области показывают доли фиксированного углерода и золы соответственно. В процессе горения горючий остаток улетучивается после отгонки летучих, и эта потеря массы соответствует фиксированному содержанию углерода. В сущности, связанный углерод содержит углерод, а также небольшие количества водорода, кислорода и азота 9.0065 24 . Эта часть находится в третьей области ТГА и измеряется путем вычитания суммы содержания влаги, летучих веществ и золы в образце. Весовой процент связанного углерода в образцах находится в порядке PR (23,74 мас.
Эту область можно считать зоной активного разложения, в которой имеет место наибольшая скорость деполимеризации 23 . Как показано на рис. 2, образцы на основе каллуса имели более высокие значения летучих веществ, чем образцы на основе семян. CL представляет собой самое высокое зарегистрированное значение, 61,34 мас.%. При температуре выше 800 °C в атмосфере азота дальнейших потерь массы обнаружено не было. Поэтому в этот момент газ-носитель был переключен с азота на кислород для горения. Третья и четвертая области показывают доли фиксированного углерода и золы соответственно. В процессе горения горючий остаток улетучивается после отгонки летучих, и эта потеря массы соответствует фиксированному содержанию углерода. В сущности, связанный углерод содержит углерод, а также небольшие количества водорода, кислорода и азота 9.0065 24 . Эта часть находится в третьей области ТГА и измеряется путем вычитания суммы содержания влаги, летучих веществ и золы в образце. Весовой процент связанного углерода в образцах находится в порядке PR (23,74 мас. %) > PS (21,1 мас.%) > PL (16,56 мас.%) > CL (15,8 мас.%) > CR (15,51 мас.%) > CR (15,51 мас.%) %) > CS (15,51 мас.%), что указывает на то, что образцы на основе проростков имели более высокое значение связанного углерода.
%) > PS (21,1 мас.%) > PL (16,56 мас.%) > CL (15,8 мас.%) > CR (15,51 мас.%) > CR (15,51 мас.%) %) > CS (15,51 мас.%), что указывает на то, что образцы на основе проростков имели более высокое значение связанного углерода.
Масса, оставшаяся после 800 °C, связана с неорганическими материалами или золой. Эти вещества не разлагаются в этом интервале температур. Зольность образцов находилась в порядке PL (17,2 мас.%) > PR (15,9 мас.%).мас.%) > CR (15,66 мас.%) > CS (15,51 мас.%) > PS (14,16 мас.%) > CL (12,23 мас.%).
Для всех образцов целлюлоза и гемицеллюлозы являются первичными биополимерами, подвергающимися термическому разложению в диапазоне температур 160–540 °С. Разложение во всех образцах начинается с гемицеллюлозы при 160°С, постепенно переходя к целлюлозе, и достигает минимальной скорости разложения при 540°С. Различия в структуре и химической природе этих шести образцов обусловлены сомаклональными вариациями. Это явление обычно происходит во время цикла каллогенеза растения и приводит к изменениям в метаболическом пути и даже к продукции новых метаболитов.
Элементный анализ (CHNS-O): Результаты анализа CHNS-O представлены в Таблице 1. Как видно, результаты согласуются с литературными данными по элементному анализу естественно выращенной конопли 3 . Производство Cannabis sativa s in vitro показало лишь незначительные изменения в элементном составе. По сравнению с естественно выращенной коноплей образцы, полученные in vitro, содержали меньше кислорода. По этой причине значения высокой теплоты сгорания (HHV) для образцов были выше, чем типичные для естественно выращенной конопли. Еще одно примечательное наблюдение связано с разницей в содержании углерода между семенами и образцами на основе каллуса. Содержание углерода в образцах на основе каллуса было выше, чем в образцах на основе семян, а кислорода в них было больше. Элементный анализ, представленный в таблице 1, во всех случаях показывает, что процентное содержание углерода, полученное из образцов органов, было ниже, чем в соответствующих образцах каллюса. И наоборот, во всех случаях из образцов органов были получены более высокие проценты кислорода по сравнению с их аналогами. Атомные отношения H/C и O/C графически представлены на диаграмме Ван Кревелена на рис. 3 для исследования потенциала образцов с точки зрения декарбоксилирования, деметанирования, дегидратации и HHV для процесса HTL. На рисунке 3 показано, что PL, PS и PR более склонны к обезвоживанию, чем их аналоги в каллусной культуре (CL, CS и CR). Это подтвердил анализ ТГА, показавший наличие большего количества влаги в образцах на основе семян, чем в образцах на основе каллюса. Диаграмма Ван Кревелена также показывает, что PL, PS и PR более склонны к реакциям декарбоксилирования по сравнению с CL, CS и CR. Это можно считать причиной более высокого содержания карбоксильных функциональных групп в биомасле, полученном из образцов на основе проростков, чем в образцах на основе каллюса 25 . Более высокое отношение H/C и более низкое отношение O/C указывает на более высокую HHV.
И наоборот, во всех случаях из образцов органов были получены более высокие проценты кислорода по сравнению с их аналогами. Атомные отношения H/C и O/C графически представлены на диаграмме Ван Кревелена на рис. 3 для исследования потенциала образцов с точки зрения декарбоксилирования, деметанирования, дегидратации и HHV для процесса HTL. На рисунке 3 показано, что PL, PS и PR более склонны к обезвоживанию, чем их аналоги в каллусной культуре (CL, CS и CR). Это подтвердил анализ ТГА, показавший наличие большего количества влаги в образцах на основе семян, чем в образцах на основе каллюса. Диаграмма Ван Кревелена также показывает, что PL, PS и PR более склонны к реакциям декарбоксилирования по сравнению с CL, CS и CR. Это можно считать причиной более высокого содержания карбоксильных функциональных групп в биомасле, полученном из образцов на основе проростков, чем в образцах на основе каллюса 25 . Более высокое отношение H/C и более низкое отношение O/C указывает на более высокую HHV. Значения HHV в образцах находятся в порядке CS > CR > CL > PR > PS > PL, что указывает на более высокое количество HHV для образцов, полученных с помощью культуры каллуса, чем для проростков, выращенных in vitro 26,27 . Для сравнения, Mahmud Parvez et al., 2021, сравнили промышленную коноплю с несколькими материалами из биомассы. Они обнаружили, что средняя ВТС конопли составляет 18–19 МДж/кг, что аналогично среднему значению ВТС, полученному для злаков и мискантуса. Они обнаружили, что HHV конопли немного ниже, чем у древесной биомассы, такой как еловая древесина (19–20 МДж/кг) и коры ели (20–23 МДж/кг). Однако изученные здесь образцы имели не только более высокую ВТС, чем у естественно выращенной технической конопли, но и их значения ВТС были сопоставимы с древесной биомассой. HHV для CS, CR, CL, PS, PR и PL составлял 21,88, 21,3, 20,91, 19,54, 19,22 и 19,01 соответственно.
Значения HHV в образцах находятся в порядке CS > CR > CL > PR > PS > PL, что указывает на более высокое количество HHV для образцов, полученных с помощью культуры каллуса, чем для проростков, выращенных in vitro 26,27 . Для сравнения, Mahmud Parvez et al., 2021, сравнили промышленную коноплю с несколькими материалами из биомассы. Они обнаружили, что средняя ВТС конопли составляет 18–19 МДж/кг, что аналогично среднему значению ВТС, полученному для злаков и мискантуса. Они обнаружили, что HHV конопли немного ниже, чем у древесной биомассы, такой как еловая древесина (19–20 МДж/кг) и коры ели (20–23 МДж/кг). Однако изученные здесь образцы имели не только более высокую ВТС, чем у естественно выращенной технической конопли, но и их значения ВТС были сопоставимы с древесной биомассой. HHV для CS, CR, CL, PS, PR и PL составлял 21,88, 21,3, 20,91, 19,54, 19,22 и 19,01 соответственно.
Рисунок 3
Диаграмма Ван Кревелена с образцами, полученными из посевных и каллусных культур.
Увеличить
Результаты, представленные в таблице 1, поднимают интересный вопрос об изменении химического и элементного состава образцов. Эти изменения могут быть связаны с сомаклональной изменчивостью, возникающей при культивировании каллуса. Это явление может привести к изменениям метаболических путей из-за интерференции РНК, модификации гистонов, ремоделирования хроматина, метилирования ДНК и спонтанных мутаций 13 . Недавно Адамек и соавт. (2021) с помощью полногеномного секвенирования показали, что соматические мутации каннабиса могут изменить метаболический путь биосинтеза каннабиноидов 28 . Мы считаем, что энергетические культуры 5-го поколения можно еще улучшить за счет сомаклональной изменчивости и/или генетических манипуляций, чтобы получить образец с наименьшим количеством лигнина. Поскольку сгруппированные короткие палиндромные повторы с регулярными интервалами (CRISPR) опосредованное редактирование генома и Agrobacterium -опосредованная генная трансформация была разработана в каннабисе, генетические манипуляции с каллюсом можно считать многообещающим инструментом для изменения путей лигнина с целью производства большего количества биоэнергии 29,30,31 . Это исследование предлагает новый подход к будущим исследовательским проектам, использующим генетически модифицированные культуры для производства биотоплива.
Это исследование предлагает новый подход к будущим исследовательским проектам, использующим генетически модифицированные культуры для производства биотоплива.
План экспериментов: Для исследования влияния температуры на биосырую нефть, водную фазу, газ и углеводороды в HTL образцов было разработано двадцать три эксперимента с использованием I-оптимальной матрицы Design Expert 11. Эксперименты HTL проводились в автоклавный инженерный реактор Parker при трех различных температурах: 250, 300 и 350 °C со временем удерживания 20 мин. Выходы биопродуктов, полученных из HTL шести выращенных in vitro образцов, приведены в таблице 2. Весовые проценты продуктов варьировались от образца к образцу. Это произошло из-за вариаций химического состава, которые произошли за счет сомаклональных вариаций.
Таблица 2 I-оптимальная схема конструкции и экспериментальные результаты.
Полноразмерная таблица
Наибольший выход биосырья был получен при гидролизе ФЛ при температуре 300°С. Выход биосырья для PL сначала увеличился с 19,02 мас. % до 28,2 мас. %, за счет повышения температуры с 250 до 300°С, а затем снизилась до 23,73 мас. % при 350 °С. Однако выход биосырья в КС в выбранном диапазоне температур увеличился с 21,01 до 22,39 мас. %. Наименьшее количество биосырья было получено из HTL PR и CR, которые составили 12,64 и 13,9.вес. %, соответственно. Выход гидроугля образцов колебался в пределах от 28,13 до 49,64 мас.% и варьировался пропорционально содержанию связанного углерода и зольности в исходных образцах. Как первый, так и второй максимальные выходы углеводородов наблюдались в ГТС ПР при 250 и 300 °С, которые составили 49,64 и 46,6 мас.% соответственно. Во всех образцах количество гидроугля снижалось с повышением температуры от 250 до 350 °С. Эти тенденции аналогичны многим другим отчетам.
Выход биосырья для PL сначала увеличился с 19,02 мас. % до 28,2 мас. %, за счет повышения температуры с 250 до 300°С, а затем снизилась до 23,73 мас. % при 350 °С. Однако выход биосырья в КС в выбранном диапазоне температур увеличился с 21,01 до 22,39 мас. %. Наименьшее количество биосырья было получено из HTL PR и CR, которые составили 12,64 и 13,9.вес. %, соответственно. Выход гидроугля образцов колебался в пределах от 28,13 до 49,64 мас.% и варьировался пропорционально содержанию связанного углерода и зольности в исходных образцах. Как первый, так и второй максимальные выходы углеводородов наблюдались в ГТС ПР при 250 и 300 °С, которые составили 49,64 и 46,6 мас.% соответственно. Во всех образцах количество гидроугля снижалось с повышением температуры от 250 до 350 °С. Эти тенденции аналогичны многим другим отчетам.
В дополнение к поиску вариантов продуктов, Эксперт по дизайну 11 позволил авторам найти оптимальные решения для различных сценариев. Ограничения, применяемые к программному обеспечению, приведены в таблице S1. В этом исследовании авторы стремились найти оптимальные рабочие условия, при которых биосырье было бы максимальным, а гидроуголь минимальным. Программное обеспечение предложило шесть различных решений. Как показано в Таблице S2, температура должна быть установлена на уровне 350 °C во всех шести растворах. Наибольшая желательность соответствовала КС, где выходы газа, биосырья, воды и гидроугля составили 38,4, 22,61, 10,552 и 28,48 мас. %, соответственно. Желательность находится в порядке CL > PL > CS > PS > CR > PR, что предполагает большой потенциал листовых сегментов в процессе HTL.
В этом исследовании авторы стремились найти оптимальные рабочие условия, при которых биосырье было бы максимальным, а гидроуголь минимальным. Программное обеспечение предложило шесть различных решений. Как показано в Таблице S2, температура должна быть установлена на уровне 350 °C во всех шести растворах. Наибольшая желательность соответствовала КС, где выходы газа, биосырья, воды и гидроугля составили 38,4, 22,61, 10,552 и 28,48 мас. %, соответственно. Желательность находится в порядке CL > PL > CS > PS > CR > PR, что предполагает большой потенциал листовых сегментов в процессе HTL.
На рисунке 4 сравнивается процентное содержание биопродуктов, полученных из HTL шести образцов in vitro при 350 °C. Сегменты корней показали наименьшую желательность из-за большего количества гидроугля в них. Как упоминалось ранее, более высокое количество связанного углерода и золы в сегментах корней делает их склонными к образованию большего количества гидроугля, чем другие сегменты. Что касается гидроугля, то в листе содержится меньше гидроугля, чем в двух других сегментах. Выход обугливания в обеих группах образцов находится в порядке лист > стебель > корень. Сегменты листьев, полученные как из проростков, так и из каллусных культур, показали наибольшую желательность. Например, 22,6 мас.% КЛ было превращено в жидкую часть, в то время как содержание гидроугля оставалось на самом низком пределе. Выход газа в образцах находится в порядке CS > CL > CR > PL > PS > PR, что указывает на более высокую склонность сегментов на основе каллуса к реакциям газификации, чем образцы на основе проростков.
Выход обугливания в обеих группах образцов находится в порядке лист > стебель > корень. Сегменты листьев, полученные как из проростков, так и из каллусных культур, показали наибольшую желательность. Например, 22,6 мас.% КЛ было превращено в жидкую часть, в то время как содержание гидроугля оставалось на самом низком пределе. Выход газа в образцах находится в порядке CS > CL > CR > PL > PS > PR, что указывает на более высокую склонность сегментов на основе каллуса к реакциям газификации, чем образцы на основе проростков.
Рисунок 4
( a ) Газ, ( b ) Биосырая нефть, ( c ) Водный раствор и ( d ) Углеводород Выходы получены из оптимального раствора (350 ° C и 30 мин).
Изображение в натуральную величину
Хроматограммы ГХ-МС биосырья: на рис. 5 сравниваются хроматограммы ГХ-МС фракции биосырья из ГТС PL, PS, PR, CL, CS и CR. Библиотека F-поиска обнаружила более шестидесяти химических веществ, о чем сообщается в таблице S3.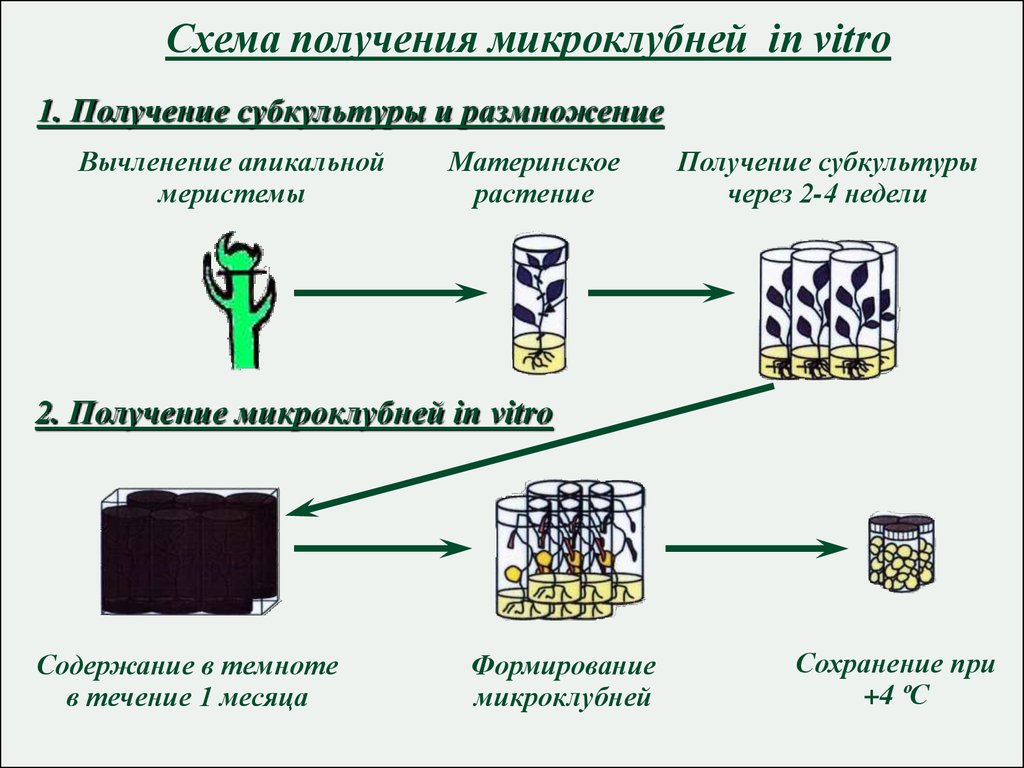 Для лучшей интерпретации обнаруженные химические вещества были разделены на восемь групп в зависимости от их функциональных групп: кислоты, углеводороды, альдегиды, кетоны, фураны, ароматические соединения, соединения азота и спирты 32 . Результаты проиллюстрированы в виде круговой диаграммы на рис. 6.
Для лучшей интерпретации обнаруженные химические вещества были разделены на восемь групп в зависимости от их функциональных групп: кислоты, углеводороды, альдегиды, кетоны, фураны, ароматические соединения, соединения азота и спирты 32 . Результаты проиллюстрированы в виде круговой диаграммы на рис. 6.
Рисунок 5
Спектры ГХ-МС для биомасел, полученных из PL, PS, PR, CL, CS и CR.
Увеличенное изображение
Рис. 6
Химический состав биосырья гидротермального сжижения.
Полноразмерное изображение
Как видно на рис. 5, хроматограмму образцов можно разделить на четыре основные области в зависимости от времени удерживания (ВУ): менее 5,5 мин (I), от 5,5 до 10,5 мин (II), от 10,5 до 20 мин (III) и свыше 20 мин (IV). В области I углекислый газ, низкомолекулярные кислоты, кетоны и фураны являются основными компонентами, образующимися при гидролизе природных биополимеров и начальной фрагментации их производных (сахаров С6, таких как фруктоза и глюкоза). Наиболее интенсивный пик в этой области соответствует углекислому газу , , что составляет 19,83, 28,25, 35,07, 34,48, 18,39 и 17,91% для PL, PS, PR, CL, CS и CR соответственно. Углекислый газ в основном получают из ацетата целлюлозы (AC) и гидроксибутилметилцеллюлозы. В отличие от других биосырых лигноцеллюлозных биомасс, которые производят уксусную кислоту с высокой селективностью, для PL, PS, PR, CL и CS это химическое вещество не проявлялось. Среди этих шести образцов уксусная кислота была обнаружена только для CR (4,72%). Для сегментов корней были зарегистрированы только фураны, которые находятся только в форме 2-фурфурола. Это химическое вещество производится из двух разных источников: гидроксиэтилцеллюлозы (ГЭЦ) и целлюлозы соответственно. Вторая область (II) в основном богата ароматическими соединениями, такими как толуол, фенол, п-крезо, 2-этилфенол, 4-этилфенол, 2-метокси-4-винилфенол, винилсирингол и дифенол. Этот тип функциональной группы в основном возникает либо из-за дегидратации кетонов, либо из состава лигнина.
Наиболее интенсивный пик в этой области соответствует углекислому газу , , что составляет 19,83, 28,25, 35,07, 34,48, 18,39 и 17,91% для PL, PS, PR, CL, CS и CR соответственно. Углекислый газ в основном получают из ацетата целлюлозы (AC) и гидроксибутилметилцеллюлозы. В отличие от других биосырых лигноцеллюлозных биомасс, которые производят уксусную кислоту с высокой селективностью, для PL, PS, PR, CL и CS это химическое вещество не проявлялось. Среди этих шести образцов уксусная кислота была обнаружена только для CR (4,72%). Для сегментов корней были зарегистрированы только фураны, которые находятся только в форме 2-фурфурола. Это химическое вещество производится из двух разных источников: гидроксиэтилцеллюлозы (ГЭЦ) и целлюлозы соответственно. Вторая область (II) в основном богата ароматическими соединениями, такими как толуол, фенол, п-крезо, 2-этилфенол, 4-этилфенол, 2-метокси-4-винилфенол, винилсирингол и дифенол. Этот тип функциональной группы в основном возникает либо из-за дегидратации кетонов, либо из состава лигнина. В этой области также появляется левоглюкозан, который считается наиболее распространенным сахаром в HTL целлюлозы 9.0065 33 . Это соединение было получено только при ГТЛ КР с высокой селективностью 6,74%. Известно, что третья область (III) хроматограммы содержит углеводороды (в основном алкены). В этой области алкены, такие как 1-додецен, 1,15-гексадекадиен, C16h36 (тетрамер), 1,7-октадиен, 1-тридецен, C12h28 (тример), C16h36 (тетрамер) и 5-гексен-1,3 ,5-триилтрибензол были обнаружены. В последней области (IV) у нас в основном были хиноны. В этом исследовании во всех образцах был обнаружен 2,5-ди-трет-бутилгидрохинон. Эти соединения получают из ароматических соединений путем превращения четного числа групп –CH= в группы –C(=O)– с любой необходимой перегруппировкой двойных связей 34 .
В этой области также появляется левоглюкозан, который считается наиболее распространенным сахаром в HTL целлюлозы 9.0065 33 . Это соединение было получено только при ГТЛ КР с высокой селективностью 6,74%. Известно, что третья область (III) хроматограммы содержит углеводороды (в основном алкены). В этой области алкены, такие как 1-додецен, 1,15-гексадекадиен, C16h36 (тетрамер), 1,7-октадиен, 1-тридецен, C12h28 (тример), C16h36 (тетрамер) и 5-гексен-1,3 ,5-триилтрибензол были обнаружены. В последней области (IV) у нас в основном были хиноны. В этом исследовании во всех образцах был обнаружен 2,5-ди-трет-бутилгидрохинон. Эти соединения получают из ароматических соединений путем превращения четного числа групп –CH= в группы –C(=O)– с любой необходимой перегруппировкой двойных связей 34 .
Химический состав биосырья гидротермального сжижения: Суммарные площади пиков кислот, соединений азота, кетонов, альдегидов, фуранов, ароматических соединений, спирта и углеводородов показаны на рис. 6. Поскольку выход биосырца в HTL всех образцов был относительно схожий, % площади можно использовать для сравнения содержания целевой функциональной группы в биосырье 35 . Во всех образцах преобладали кислоты и ароматические соединения. Селективность кислот в образцах находится в порядке PR (33,14%) > PS (290,12%) > PL (24,23%) > CL (19,55%) > CS (20%) > CR (12,2%), что указывает на то, что биосырье, полученное из образцов на основе рассады, богаче кислотами, чем образцы на основе каллюса. Еще одно существенное различие между этими двумя группами образцов было связано с углеводородами. Образцы на основе каллуса показали более высокую селективность в отношении углеводородов. Селективность этой функциональной группы в отношении ХС, КР и ХЛ составила 18,33, 16,99 и 15,44%; в то время как PL, PS и PR показали более низкую селективность 14,09, 9,07 и 7,51% соответственно. О балансе между кислотами и углеводородами уже сообщалось в литературе 36 . Алифатические кислоты могут быть преобразованы в углеводороды путем конденсации, разложения и деоксигенации.
6. Поскольку выход биосырца в HTL всех образцов был относительно схожий, % площади можно использовать для сравнения содержания целевой функциональной группы в биосырье 35 . Во всех образцах преобладали кислоты и ароматические соединения. Селективность кислот в образцах находится в порядке PR (33,14%) > PS (290,12%) > PL (24,23%) > CL (19,55%) > CS (20%) > CR (12,2%), что указывает на то, что биосырье, полученное из образцов на основе рассады, богаче кислотами, чем образцы на основе каллюса. Еще одно существенное различие между этими двумя группами образцов было связано с углеводородами. Образцы на основе каллуса показали более высокую селективность в отношении углеводородов. Селективность этой функциональной группы в отношении ХС, КР и ХЛ составила 18,33, 16,99 и 15,44%; в то время как PL, PS и PR показали более низкую селективность 14,09, 9,07 и 7,51% соответственно. О балансе между кислотами и углеводородами уже сообщалось в литературе 36 . Алифатические кислоты могут быть преобразованы в углеводороды путем конденсации, разложения и деоксигенации.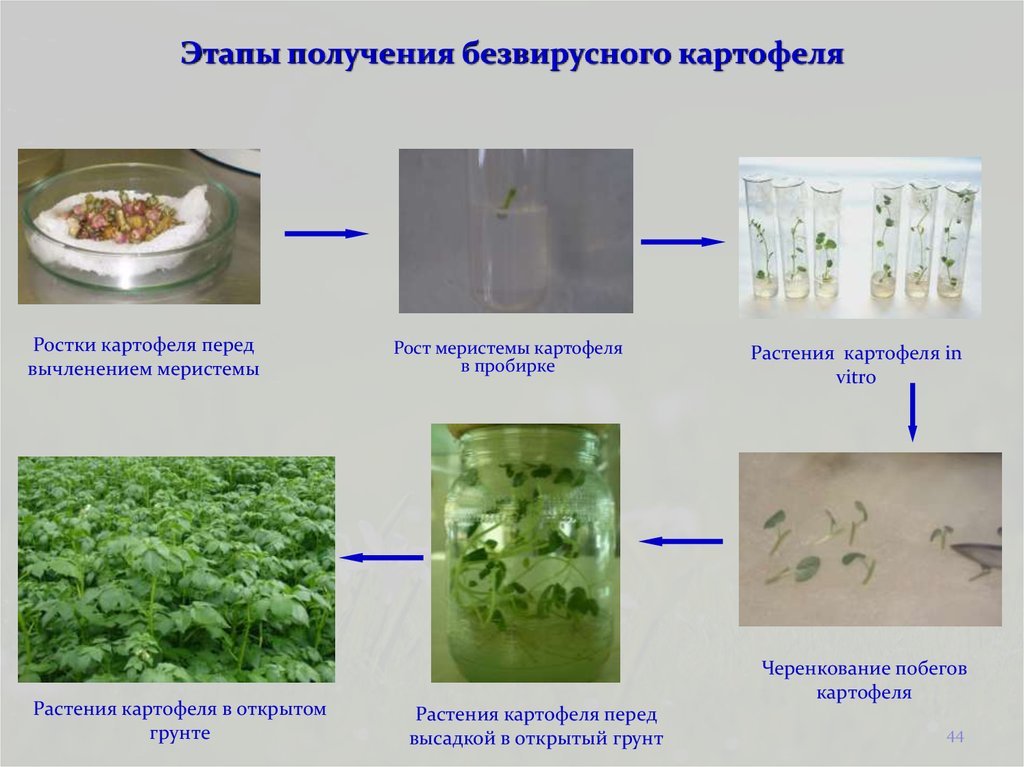 Таким образом, необходимы дальнейшие методы модернизации для снижения коррозионной природы образцов и одновременного увеличения содержания углеводородов.
Таким образом, необходимы дальнейшие методы модернизации для снижения коррозионной природы образцов и одновременного увеличения содержания углеводородов.
Альдегиды и кетоны получают путем дегидратации сахаров С6, включая глюкозу и фруктозу. Суммарная селективность этих двух функциональных групп в образцах на основе каллуса была выше, чем в образцах на основе семян. Среди образцов биотопливо CL и CS показало лучшее качество. Полученная биосырья для ХЛ состояла из 190,55% кислот, 0,42% соединений N, 15,44% кетонов, 16,03% альдегидов, 2,21% фуранов, 20,01% ароматических соединений, 5,2% спиртов и 19,88% углеводородов.
Что касается азотсодержащих соединений, то PL, PS и PR показали более высокую селективность в отношении соединений N, таких как м-фенилендиамин, фенилацетонитрил, глутаминовая кислота, N,N-диметилгексадециламин и анилин. Выбросы NOx тесно связаны с этими соединениями, поэтому желательно более низкое содержание азота в биосырье.
Углеводородные фракции на полунефтяной основе: основной целью процесса HTL является повышение качества биосырой нефти до максимального выхода углеводородных фракций на полунефтяной основе. В этом разделе химические вещества были разделены на основе их углеродного числа на три группы: легкий бензин, тяжелый бензин и биодизель (рис. 7). Эти три фракции углеводородов основаны на трех последовательных реакциях: кетонизации кислот, альдольной конденсации кетонов и олигомеризации алкенов. Кетонизация — это реакция, посредством которой две карбоновые кислоты могут быть превращены в кетон, углекислый газ и воду 9.0065 32 . Затем кетоны подвергаются альдольной конденсации с последующей олигомеризацией, в результате чего образуются диапазоны размеров молекул топлива. Селективность легкого бензина (С5-С6) в модернизированном бионефти находится в порядке PR > CR > CS > PS > PL > CL. Хотя для PR была получена более высокая селективность углеводородов С5-С6, следует отметить, что они находятся в основном в форме карбоновых кислот. Что касается углеводородов C7-C12, CL продемонстрировал большой потенциал для углеводородов тяжелого бензинового ряда. Высочайшая селективность по углеводородам (190,88%), а самая низкая селективность спиртов (5,2%) в этом сырье делает его прекрасной альтернативой традиционному сырью.
В этом разделе химические вещества были разделены на основе их углеродного числа на три группы: легкий бензин, тяжелый бензин и биодизель (рис. 7). Эти три фракции углеводородов основаны на трех последовательных реакциях: кетонизации кислот, альдольной конденсации кетонов и олигомеризации алкенов. Кетонизация — это реакция, посредством которой две карбоновые кислоты могут быть превращены в кетон, углекислый газ и воду 9.0065 32 . Затем кетоны подвергаются альдольной конденсации с последующей олигомеризацией, в результате чего образуются диапазоны размеров молекул топлива. Селективность легкого бензина (С5-С6) в модернизированном бионефти находится в порядке PR > CR > CS > PS > PL > CL. Хотя для PR была получена более высокая селективность углеводородов С5-С6, следует отметить, что они находятся в основном в форме карбоновых кислот. Что касается углеводородов C7-C12, CL продемонстрировал большой потенциал для углеводородов тяжелого бензинового ряда. Высочайшая селективность по углеводородам (190,88%), а самая низкая селективность спиртов (5,2%) в этом сырье делает его прекрасной альтернативой традиционному сырью. Селективность по тяжелому бензину находится в порядке CL > CS > PS > PR > CR > PL.
Селективность по тяжелому бензину находится в порядке CL > CS > PS > PR > CR > PL.
Рисунок 7
Углеводородные фракции на основе Semi-Petro.
Увеличенное изображение
Большинство алкенов появилось в третьей области (III) хроматограммы, и они были в основном в диапазоне C8-C21. Вот почему этой фракции углеводорода (биодизеля), производимой эксплантами HTL Industrial Hemp, следует уделить больше внимания. Среди трех различных сегментов, оцениваемых здесь, HTL листа и стебля производили больше биодизельного топлива, чем HTL корня. Селективность биодизеля в отношении PL, PS, PR, CL, CS и CR составила 39.0,03%, 29,91%, 8,77%, 31,82%, 18,04% и 5,99% соответственно.
Экспериментальная часть
Все эксперименты, проводимые на растениях, проводятся в соответствии с соответствующими институциональными, национальными и международными директивами и законодательством. Культура клеток конопли in vitro: семена промышленной конопли ( Cannabis sativa сорта «Finola»; семена, сертифицированные CSGA № 1, № лота: 1908–18,637-17-KKF-01) использовались для получения проростков, выращенных in vitro. на основе протокола Hesami et al., (2021) 15 . Вкратце, после погружения семян в 70%-й этанол на 60 с с последующим 12%-ным (об./об.) коммерческим отбеливателем на 12 минут и трехкратной промывкой стерилизованной деионизированной водой по 5 минут каждый, обеззараженные семена (2 семена в коробке) инокулировали в среду mMS с концентрацией 0,43 (среда Мурасиге и Скуга, модификация Ван дер Сальма (Van der Salm et al., 1994)) (Phytotech Labs, Канзас, США) с добавлением 2,3% сахарозы 16 . В текущем исследовании сегменты листьев, корней и стеблей выращенных in vitro проростков сорта Finola были отобраны для изучения каллогенеза на основе протокола Hesami and Jones (2021) 9.0065 17 . Базальной средой в эксперименте по каллогенезу служила среда MS (Murashige, Skoog, 1962) соляная смесь (Phytotechnology Laboratories) с B 5 (Gamborg et al., 1968) витаминная среда (Phytotechnology Laboratories), дополненная 3% сахарозы, 0,78 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D, Fisher Scientific) и 1,32 мг/л кинетина (Fisher Scientific) 17,18 .
на основе протокола Hesami et al., (2021) 15 . Вкратце, после погружения семян в 70%-й этанол на 60 с с последующим 12%-ным (об./об.) коммерческим отбеливателем на 12 минут и трехкратной промывкой стерилизованной деионизированной водой по 5 минут каждый, обеззараженные семена (2 семена в коробке) инокулировали в среду mMS с концентрацией 0,43 (среда Мурасиге и Скуга, модификация Ван дер Сальма (Van der Salm et al., 1994)) (Phytotech Labs, Канзас, США) с добавлением 2,3% сахарозы 16 . В текущем исследовании сегменты листьев, корней и стеблей выращенных in vitro проростков сорта Finola были отобраны для изучения каллогенеза на основе протокола Hesami and Jones (2021) 9.0065 17 . Базальной средой в эксперименте по каллогенезу служила среда MS (Murashige, Skoog, 1962) соляная смесь (Phytotechnology Laboratories) с B 5 (Gamborg et al., 1968) витаминная среда (Phytotechnology Laboratories), дополненная 3% сахарозы, 0,78 мг/л 2,4-дихлорфеноксиуксусной кислоты (2,4-D, Fisher Scientific) и 1,32 мг/л кинетина (Fisher Scientific) 17,18 . Как для прорастания семян in vitro, так и для каллогенеза все среды содержали 0,6% агара (Thermo-Fisher Scientific, Waltham, MA), а pH среды доводили до 5,8 перед автоклавированием в течение 20 минут при 120 ◦C. Тридцать мл среды заливали в коробку Magenta GA7 (Fisher Scientific, Нью-Джерси, США). Все ящики с культурами помещали в ростовую камеру при 25 ± 2°C при 16-часовом фотопериоде с 40 ± 5 мкмоль м −2 с −1 интенсивность света. Для дальнейших экспериментов использовали различные части проростков, выращенных in vitro (лист, корень и стебель) и разные каллусы (каллюс, полученный из листа, каллюс, полученный из корня, и каллюс, полученный из стебля) (рис. 8).
Как для прорастания семян in vitro, так и для каллогенеза все среды содержали 0,6% агара (Thermo-Fisher Scientific, Waltham, MA), а pH среды доводили до 5,8 перед автоклавированием в течение 20 минут при 120 ◦C. Тридцать мл среды заливали в коробку Magenta GA7 (Fisher Scientific, Нью-Джерси, США). Все ящики с культурами помещали в ростовую камеру при 25 ± 2°C при 16-часовом фотопериоде с 40 ± 5 мкмоль м −2 с −1 интенсивность света. Для дальнейших экспериментов использовали различные части проростков, выращенных in vitro (лист, корень и стебель) и разные каллусы (каллюс, полученный из листа, каллюс, полученный из корня, и каллюс, полученный из стебля) (рис. 8).
Рисунок 8
Каллусы, полученные из различных частей (листьев, стеблей и корней) проростков каннабиса, выращенных in vitro.
Изображение с полным размером
Эксперименты по гидротермальному сжижению: Эксперименты по гидротермальному сжижению проводились с использованием реактора высокого давления (300 мл), изготовленного Parker Hastelloy. Реактор был оборудован очень точным регулятором температуры и магнитной мешалкой (с регулируемой скоростью). Схему реактора можно найти в предыдущем исследовании авторов 19 .
Реактор был оборудован очень точным регулятором температуры и магнитной мешалкой (с регулируемой скоростью). Схему реактора можно найти в предыдущем исследовании авторов 19 .
Характеристика образцов, полученных из посевной и каллусной культуры: Приблизительные характеристики образцов были получены с использованием аппарата ТГА (SDT-Q600, TA tools-Waters LLC, Нью-Касл, США) при скорости нагрева 10 °С/мин, а максимальная температура 1000 °C и скорость потока азота 50 мл/мин. Элементный состав образцов определяли с помощью анализатора элементов Flash 2000 (Thermo Fisher Scientific, Уолтем, Массачусетс, США). Анализ проводили на сухой основе, а содержание кислорода в данных образцах рассчитывали по разности: %O = 100 – (%C + %H + %N + %S + % золы).
Характеристика биопродуктов. Биосырую смесь из HTL образцов анализировали на пиролизере Frontier LAB, соединенном с ГХ Agilent 7890B и масс-спектрометром с ионной ловушкой Agilent 240 (Agilent Technologies, США). Образцы весом 200–400 мкг взвешивали в U-образной кварцевой трубке и помещали в держатель образцов.

 По мере роста высоту контейнера можно увеличить в два раза за счет второго контейнера, скрепленного с первым дополнительной рамкой (доступно только для кат. № 310070 и 310071). Крышка контейнера имеет расширение по краям крышки для более легкого открывания. Контейнер (кат. № 310070) можно использовать с крышкой для разведения насекомых.
По мере роста высоту контейнера можно увеличить в два раза за счет второго контейнера, скрепленного с первым дополнительной рамкой (доступно только для кат. № 310070 и 310071). Крышка контейнера имеет расширение по краям крышки для более легкого открывания. Контейнер (кат. № 310070) можно использовать с крышкой для разведения насекомых.
 Данные емкости разработаны для предотвращения загрязнения (контаминации), имеют винтовую крышку и функцию штабелирования для экономии места в лаборатории.
Данные емкости разработаны для предотвращения загрязнения (контаминации), имеют винтовую крышку и функцию штабелирования для экономии места в лаборатории.



 Обзор
Обзор