Содержание
Genomia: Тестирование кошек: GSD IV
Стандартный срок исследования: 7 рабочих дней
Цена за 1 тест:
45.00 $
без НДС
CZK / EUR / USD
Описание:
Гликогеноз (Glycogen Storage Disease, GSD) – группа аутосомно-рецессивных заболеваний, возникающих вследствие нарушения метаболизма гликогена.
Основным и наиболее универсальным источником энергии для человека, животных и растений является глюкоза. В организме животных глюкоза хранится в форме гликогена, который откладывается в виде гранул в цитоплазме клеток, преимущественно в клетках печени и мышц. При недостатке глюкозы гликоген расщепляется, и глюкоза попадает в кровь. Превращение гликогена в глюкозу – многоступенчатый процесс, протекающий под воздействием ряда ферментов, нарушение работы которых приводит к избыточному накоплению гликогена в виде аномальных гранул и нарушению гомеостаза глюкозы.
Больные котята погибают от гипогликемии вскоре после рождения. В некоторых случаях животное живет до полугода, страдая при этом от прогрессирующей мышечной дегенерации.
Наследственность:
Мутация передается
аутосомно-рецессивным наследованием.
Заболевание проявляется у особей,
которые получили мутированный ген от
обоих родителей. Данные особи обозначаются
как P/P (мутированный гомозигот). Носители
мутированного гена, обозначаемые как
N/P (гетерозигот), получили мутированный
ген лишь от одного из родителей,
клинические признаки заболевания у них
отсутствуют; однако носители передают
заболевание своим потомкам. Теоретически
в результате спаривания двух гетерозигот
(N/P) 25% потомства будут здоровыми, 50%
будут носителями, а 25 % потомства
унаследуют от своих родителей мутированные
гены и будут страдать данным генетическим
заболеванием.
Тестируемая мутация: p.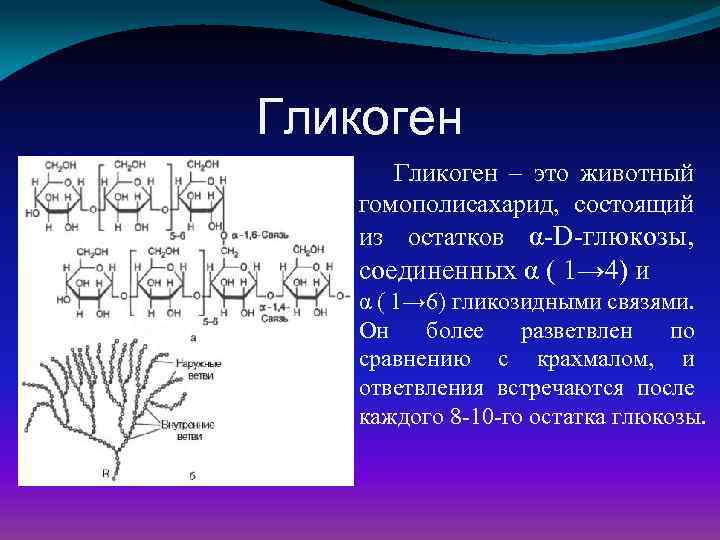 Y34X в гене GBE1
Y34X в гене GBE1
Образец:
кровь в EDTA (1,0 мл) или мазок из ротовой
полости. Подробная информация об отборе
образцов приведена здесь
Общая информация о генетическом
тесте:
Генетический тест позволяет
обнаружить больную особ или носителя
мутации. Тест может быть выполнен в
любом возрасте и действителен на
протяжении всей жизни. Генетический
тест методом полимеразной цепной реакции
(PCR) является очень точным, результаты
анализа позволяют определить больных
животных, здоровых носителей мутации
и здоровых животных.
С учетом наличия мутаций
собаки делятся на три группы:
-
P/P = позитивный / позитивный
= больной, особь унаследовала мутацию
от обоих родителей „affected“ -
N/P = негативный / позитивный
= особь унаследовала мутацию от одного
родителя, является носителем мутации
„Carrier“, болезнь у него не проявится -
N/N = негативный / негативный
= особь без мутаций, болезнь у особи не
проявится = нормальный генотип „wildtype“
Результаты спаривания
особей с различными генотипами:
|
|
Affected (P/P)
| ||
|
Wild type (N/N)
|
аллель
|
P
|
P
|
|
N
|
N/P (carrier)
|
N/P (carrier)
| |
|
N
|
N/P (carrier)
|
N/P (carrier)
| |
Все
потомки являются носителями мутации
.
|
|
Carrier (N/P)
| ||
|
Wild type (N/N)
|
аллель
|
N
|
P
|
|
N
|
N/N (здоровый)
|
N/P (carrier)
| |
|
N
|
N/N (здоровый)
|
N/P (carrier)
| |
Статистически
50 % потомков будут носителями, а 50 % будут здоровыми.
.
|
|
Carrier (N/P)
| ||
|
Carrier (N/P)
|
аллель
|
N
|
P
|
|
N
|
N/N (здоровый)
|
N/P (carrier)
| |
|
P
|
N/P (carrier)
|
P/P (больной)
| |
Статистически
25 % потомства будут здоровы, 25 % больны, а 50 % будут носителями.
.
Литература:
John C. Fyfe, Rebeccah L. Kurzhals, Michelle G. Hawkins, Ping Wang,
Naoya Yuhki, Urs Giger, Thomas J. Van Winkle, Mark E. Haskins, Donald F.
Patterson, Paula S. Henthorn: A complex rearrangement in GBE1 causes
both perinatal hypoglycemic collapse and late-juvenile-onset
neuromuscular degeneration in glycogen storage disease type IV of
Norwegian forest cats, Molecular Genetics and Metabolism 90 (2007)
383-392
- Норвежская лесная
Стандартный срок исследования: 7 рабочих дней
Цена за 1 тест:
45.00 $
без НДС
CZK / EUR / USD
КАТАБОЛИЗМ И БИОСИНТЕЗ ГЛИКОГЕНА — TDMUV
КАТАБОЛИЗМ
И БИОСИНТЕЗ ГЛИКОГЕНА. РЕГУЛЯЦИЯ ОБМЕНА ГЛИКОГЕНА.
БИОСИНТЕЗ
ГЛЮКОЗЫ — ГЛЮКОНЕОГЕНЕЗ. МЕХАНИЗМЫ ГОРМОНАЛЬНОЙ РЕГУЛЯЦИИ И ПАТОЛОГИЯ ОБМЕНА УГЛЕВОДОВ.
Гликоген –
главная форма запасания углеводов
у животных и человека. Накапливается гликоген главным образом в
печени (до 6% от массы печени) и в скелетных мышцах, где его содержание редко
превышает 1%. Запасы гликогена
в скелетных мышцах ввиду значительно большей массы последних превышают его
запасы в печени. Гликоген присутствует в
цитозоле в форме гранул диаметром от 10 до 40 нм. На электронных микрофотографиях
гликогеновые гранулы выглядят плотными. Установлено, что эти гранулы, кроме гликогена, содержат ферменты, катализирующие
синтез и распад гликогена.
Однако гликогеновые гранулы отличаются от мульти-ферментных комплексов
(например, от пируватдегидрогеназного комплекса). Степень структурной
организации гликогеновых гранул ниже, чем в мультиферментных комплексах.
Следует подчеркнуть, что синтез и распад гликогена в клетке осуществляются
разными метаболическими путями. В частности, считалось, что гликогенфосфорилаза
(фосфорилаза а) катализирует как распад гликогена, так и его
синтез, потому что в опытах in vitro было показано, что гликогенфосфорилазная реакция
обратима.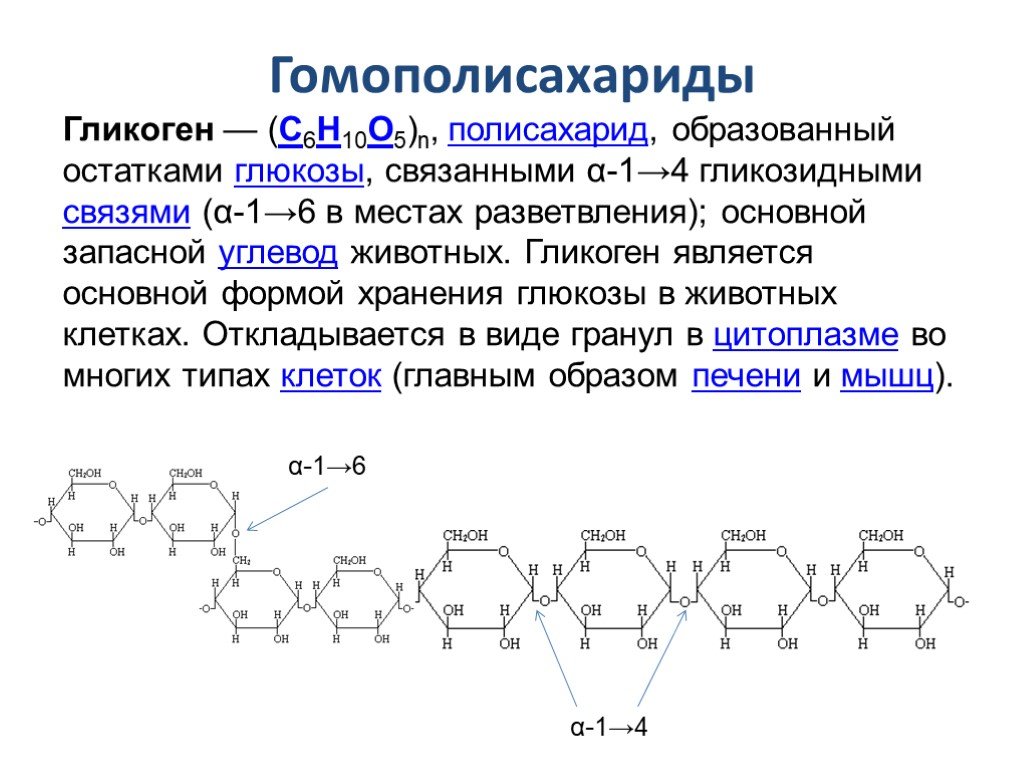 Однако в дальнейшем было установлено, что в клетке (in vivo) фосфорилаза а катализирует только распад гликогена, синтез гликогена осуществляется
Однако в дальнейшем было установлено, что в клетке (in vivo) фосфорилаза а катализирует только распад гликогена, синтез гликогена осуществляется
при участии совершенно другого фермента. Оба эти процесса
(синтез и распад гликогена) регулируют содержание глюкозы в крови и создают
резерв глюкозы
для интенсивной мышечной работы.
Депонирование и распад гликогена
Гликоген — основная форма депонирования
глюкозы в клетках животных. У растений эту же функцию выполняет крахмал. В
структурном отношении гликоген, как и крахмал, представляет собой разветвленный
полимер из глюкозы: Однако гликоген более разветвлен и компактен. Ветвление
обеспечивает быстрое освобождение при распаде гликогена большого количества
концевых мономеров. Синтез и распад гликогена не являются обращением друг в
друга, эти процессы происходят разными путями: Гликоген синтезируется в
период пищеварения (в течение 1-2 часов после приема углеводной пищи).
Гликогенез особенно интенсивно протекает в печени и скелетных мышцах. В
начальных реакциях образуется UDF-глюкоза (реакция 3), которая является
активированной формой глюкозы, непосредственно включающейся в реакцию
полимеризации (реакция 4). Эта последняя реакция катализируется гликогенсинтазой,
которая присоединяет глюкозу к олигосахариду или к уже имеющейся в клетке
молекуле гликогена, наращивая цепь новыми мономерами. Для подготовки и
включения в растущую полисахаридную цепь требуется энергия 1 моль АТР и 1 моль
UTP. Ветвление полисахаридной цепи происходит при участии
фермента амило- a -1,4— a -1,6-гликозил-трансферазы путем
разрыва одной a -1,4-связи и переноса олигосахаридного остатка от конца
растущей цепи к ее середине с образованием в этом месте a -1,6-гликозидной
связи . Молекула гликогена содержит до 1 млн. остатков
глюкозы, следовательно, на синтез расходуется значительное количество энергии.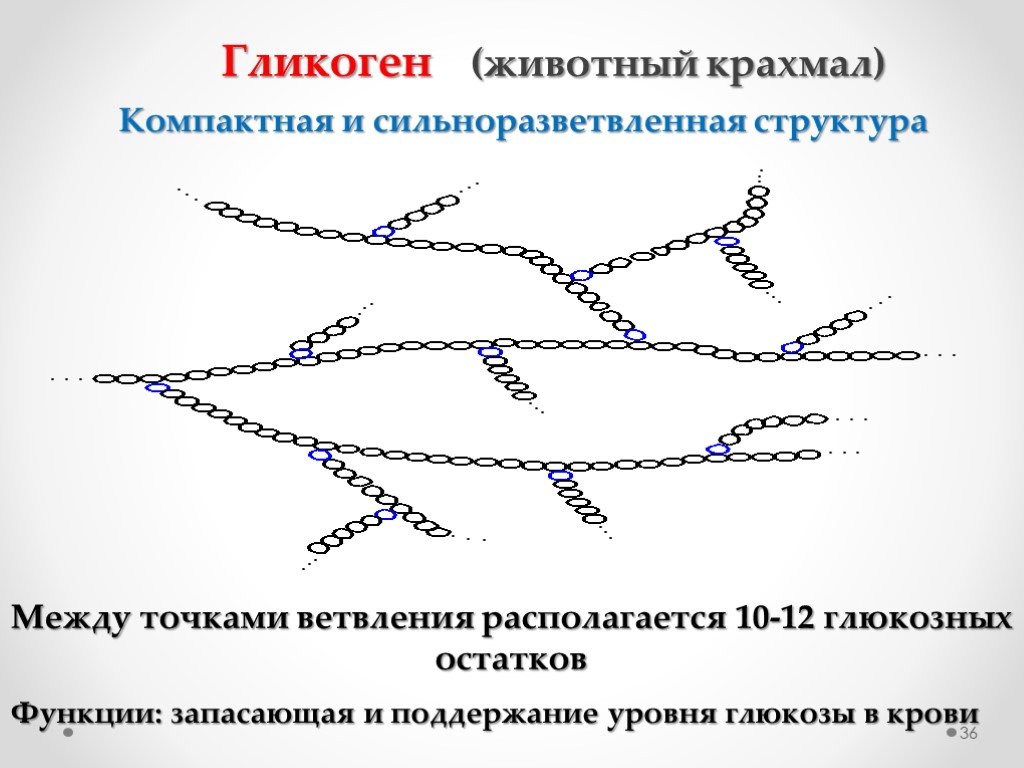
Необходимость превращения глюкозы в гликоген связана с тем, что накопление
значительного количества глюкозы в клетке привело бы к повышению осмотического
давления, так как глюкоза хорошо растворимое вещество. Напротив, гликоген
содержится в клетке в виде гранул, и мало растворим. Распад
гликогена — гликогенолиз — происходит в период между приемами пищи.
Освобождение глюкозы в виде глюкозо-1-фосфата ( реакция 5 ) происходит в
результате фосфоролиза, катализируемого фосфорилазой. Фермент отщепляет
концевые остатки один за другим, укорачивая цепи гликогена. Однако этот фермент
расщепляет только a -1,4 гликозидные связи. Связи в точке ветвления
гидролизуются ферментом амило- a
-1,6-гликозидазой , который отщепляет мономер глюкозы в
свободном виде.
Особенности метаболизма гликогена в печени и мышцах
Включение глюкозы в метаболизм начинается с образования
фосфоэфира — глюкозо-6-фосфата. В клетках мышц и других органах
В клетках мышц и других органах
эту реакцию катализирует фермент гексокиназа, его Км менее 0,1 ммоль/л. В клетках печени эту же
реакцию катализирует глюкокиназа, значение Км которой примерно 10
ммоль/л. Это значит, что насыщение глюкокиназы происходит только при высокой
концентрации глюкозы. Различия в свойствах ферментов объясняют, почему в период
пищеварения глюкоза задерживается в основном в печени. Глюкокиназа при высокой
концентрации глюкозы в этот период максимально активна.
Напротив, гексокиназа, обладая большим сродством к глюкозе, способна
выхватывать ее из общего кровотока, где концентрация глюкозы ниже. Физиологическое
значение гликогенолиза в печени и в мышцах различно. Мышечный гликоген
является источником глюкозы для самой клетки. Гликоген печени используется
главным образом для поддержания физиологической концентрации глюкозы в крови.
Различия обусловлены тем, что в клетке печени присутствует фермент глюкозо-6-фосфатаза,
катализирующая отщепление фосфатной группы и образование свободной глюкозы,
после чего глюкоза поступает в кровоток. В клетках мышц нет этого
В клетках мышц нет этого
фермента, и распад гликогена идет только до образования
глюкозо-6-фосфата, который затем используется в клетке.
Биосинтез глюкозы — глюконеогенез
Глюконеогенез — это синтез глюкозы из неуглеводных
предшественников. У млекопитающих эту функцию выполняет
в основном печень, в меньшей мере — почки и клетки
слизистой кишечника. Запасов гликогена в организме
достаточно для удовлетворения потребностей в глюкозе в период между приемами
пищи. При углеводном или полном голодании, а также в условиях длительной физической
работы концентрация глюкозы в крови поддерживается за счет глюконеогенеза. В
этот процесс могут быть вовлечены вещества, которые способны превратиться в
пируват или любой другой метаболит глюконеогенеза. Причем, использование
первичных субстратов в глюконеогенезе происходит в различных физиологических
состояниях. Так, в условиях голодания часть тканевых белков распадается до
Так, в условиях голодания часть тканевых белков распадается до
аминокислот, которые затем используются в глюконеогенезе. При распаде жиров
образуется глицерин, который через диоксиацетонфосфат включается в
глюконеогенез. Лактат, образующийся при интенсивной
физической работе в мышцах, затем в печени превращается в глюкозу.
Следовательно, физиологическая роль глюконеогенеза из лактата и из аминокислот
и глицерина различна. Синтез глюкозы из пирувата протекает, как и при
гликолизе, но в обратном направлении: Семь реакций гликолиза легко обратимы и
используются в глюконеогенезе. Но три киназные реакции необратимы и должны
шунтироваться. Так, фруктозо-1,6-дифосфат и глюкозо-6-фосфат дефосфорилируются
специфическими фосфатазами, а пируват фосфорилируется до образования
фосфоенолпирувата посредством двух промежуточных стадий через оксалоацетат.
Образование оксалоацетата катализируется пируваткарбоксилазой. Этот фермент
содержит в качестве кофермента биотин. Оксалоацетат образуется в митохондриях,
Оксалоацетат образуется в митохондриях,
транспортируется в цитозоль и включается в глюконеогенез. Следует обратить
внимание на то, что каждая из необратимых реакций гликолиза вместе с
соответствующей ей необратимой реакцией глюконеогенеза составляют цикл,
называемый субстратным: Таких циклов существует три — соответственно трем
необратимым реакциям. Результатом одновременного протекания реакций субстратных
циклов будет расходование энергии. Субстратные циклы могут протекать в условиях
нормального обмена веществ в печени и имеют вполне определенное биологическое
значение. Кроме того, эти циклы служат точками приложения регуляторных
механизмов, в результате чего изменяется поток метаболитов либо по пути
распада глюкозы, либо по пути ее синтеза. Суммарное уравнение глюконеогенеза из
пирувата:
2 пируват + 4 ATP + 2 GTP + 2(NADH) + 4 Н2О ®
Глюкоза + 4 ADP + 2 GDP + 2 NAD+ + 6 Н3РО4
За сутки в организме человека может синтезироваться до 80 г глюкозы. На синтез 1 моль
На синтез 1 моль
глюкозы из пирувата расходуется 6 макроэргических связей (4 ATP и 2 GTP).
Глюкозо-лактатный цикл (цикл Кори)
Начинается с образования лактата в мышцах в результате
анаэробного гликолиза (особенно в белых мышечных волокнах, которые бедны
митохондриями по сравнению с красными). Лактат переносится кровью в печень, где
в процессе глюконеогенеза превращается в глюкозу, которая затем с током крови
может возвращаться в работающую мышцу. Итак печень
снабжает мышцу глюкозой и, следовательно, энергией для сокращений. В печени
часть лактата может окисляться до СО2 и Н2О,
превращаясь в пируват и — далее в общих путях катаболизма.
Пентозофосфатный путь в метаболизме глюкозы
Это путь превращения глюкозы в пентозы. В
пентозофосфатном пути превращения глюкозы можно выделить две части: А -
окислительный путь и Б -
неокислительный путь синтеза пентоз. Коферментом дегидрогеназ является
Коферментом дегидрогеназ является
NADP+, который восстанавливается в NADPH и используется клетками в
реакции восстановления и гидроксилирования. Кроме того,
пентозофосфатный путь (окислительный и неокислительный) поставляет клетке пентозофосфаты,
необходимые для синтеза нуклеиновых кислот и
коферментов (NAD, FAD, СоА). Все реакции пентозофосфатного пути
проходят в цитозоле клетки. Реакции неокислительного этапа пентозофосфатного
пути являются обратимыми, поэтому становится возможным синтез гексоз из пентоз.
Некоторые метаболиты неокислительного пути являются также и метаболитами
гликолиза. Из этого следует, что оба процесса тесно связаны и в зависимости от
потребностей клетки возможны переключения с одного пути на другой. При
сбалансированной потребности в NADPH и пентозах в клетке происходит
окислительный путь синтеза пентоз. Если потребности в пентозах превышают
потребности в NADPH, то окислительный путь шунтируется за счет использования
метаболитов гликолиза: фруктозо-6-фосфат и глицероальдегидфосфат в реакциях
неокислительного пути превращаются в пентозы. Если же NADPH необходим
Если же NADPH необходим
в большей степени, чем пентозы, то возможны два варианта:
При высоком
энергетическом статусе клетки излишки пентоз путем обратных реакций
неокислительного пути превращаются в фруктозо-6-фосфат и глицероальдегидфосфат,
из которых в процессе глюконеогенеза образуется глюкоза;
При
низком энергетическом статусе клетки из пентоз также образуются
глицероальдегидфосфат и фруктозо-6-фосфат, которые затем включаются в гликолиз
Регуляция метаболизма углеводов (некоторые аспекты)
Регуляция метаболизма глюкозы в печени, связанная с
ритмом питания. Направление метаболизма глюкозы меняется при смене
периода пищеварения на постабсорбтивное состояние. При пищеварении глюкоза
задерживается в печени и депонируется в виде гликогена. Кроме того, глюкоза
используется для синтеза жиров. Причем, исходные субстраты для синтеза жира — a
-глицерофосфат и ацетил-СоА образуются из глюкозы в процессе гликолиза. Следовательно,
Следовательно,
гликолиз в печени имеет особое значение. В постабсорбтивном периоде направление
процессов меняется на распад гликогена и глюконеогенез. Координация процессов
осуществляется путем аллостерической регуляции и ковалентной модификацией
ферментов (фосфорилирование и дефосфорилирование). Регуляторные
влияния направлены на реакции субстратных циклов. Активность ферментов
субстратного цикла фруктозо-6-фосфат « фруктозо-1,6-бисфосфат (цикл II) зависит
от концентрации фруктозо-2,6-бисфосфата, образующегося из фруктозо-6-фосфата в
дополнительной реакции. Синтез и распад этого регуляторного метаболита
происходят в реакциях, составляющих еще один субстратный цикл, оба направления
которого катализируются одним — бифункциональным ферментом (БИФ).
Киназная или фосфатазная активность
бифункционального фермента зависит от фосфорилированного или
дефосфорилированного состояния этого фермента. Концентрация
Концентрация
фруктозо-2,6-бисфосфата при пищеварении повышается, так как БИФ в этом случае
дефосфорилирован и проявляет киназную активность. Фруктозо-2,6-бисфосфат
является аллостерическим активатором гликолитического фермента и ингибитором
фермента глюконеогенеза. Следовательно, при пищеварении ускоряется
гликолитическое направление цикла и тормозится направление глюконеогенеза.
Фруктозо-1,6-дифосфат служит аллостерическим активатором пируваткиназы
(гликолитический фермент III цикла). В период пищеварения фруктозо-2,6-дифосфат
активирует фосфофруктокиназу и концентрация фруктозо-1,6-дифосфата
увеличивается, что приводит к активации пируваткиназы. Так достигается
согласованность в регуляции двух субстратных циклов. Регуляция I субстратного
цикла достигается следующим образом: при пищеварении концентрация глюкозы
повышается до 10-20 мкмоль/л. Активность глюкокиназы в этих условиях
максимальна, и глюкозо-6-фосфат направляется на синтез гликогена и жиров. Кроме
Кроме
того, глюкоза при такой концентрации участвует в активации гликогенсинтазы.
Активность пируватдегидрогеназного комплекса в период пищеварения
также повышается, потому что он в этих условиях дефосфорилирован. В результате
ускоряется образование Ацетил-СоА и использование его для синтеза жирных
кислот. Переход ферментов из дефосфорилированного состояния в фосфорилированное
находится под контролем гормонов, в случае регуляции метаболизма глюкозы в
печени основными являются глюкагон и инсулин. Регуляция метаболизма глюкозы в
мышцах, связанная с режимом мышечной работы. При переходе от состояния покоя к
мышечной работе возрастает потребность клеток в энергии, которая восполняется
за счет ускорения процессов распада гликогена и гликолиза. Координация
интенсивности гликолиза обеспечивается аллостерической регуляцией ферментов
необратимых стадий энергетическим статусом клетки. Так, ингибитором
фосфофруктокиназы служит ATP, если в ходе гликолиза синтез ATP превышает
потребности клетки.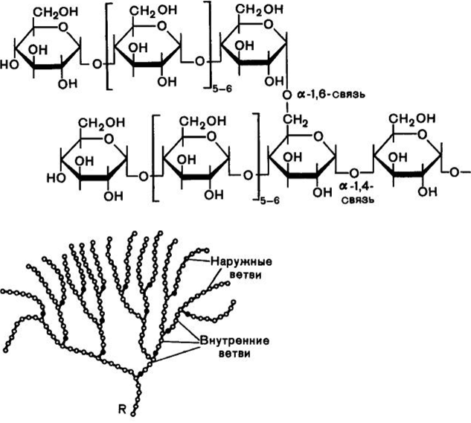 В основе регуляции обмена гликогена лежит изменение
В основе регуляции обмена гликогена лежит изменение
активности ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы. Регуляция
активности этих ферментов осуществляется путем фосфорилирования –
дефосфорилирования. Соотношение процессов синтеза гликогена, распада гликогена
и гликолиза в мышцах контролируют инсулин и адреналин.
Пути регуляции метаболизма углеводов крайне
разнообразны. На любых уровнях организации живого организма обмен углеводов регулируется
факторами, влияющими на активность
ферментов, участвующих в
реакциях углеводного обмена. К этим факторам относятся концентрация субстратов, содержание
продуктов (метаболитов) отдельных реакций, кислородный режим, температура, проницаемость
биологических мембран, концентрация коферментов, необходимых
для отдельных реакций, и т.д. (см. главу 4). В данной главе было
показано влияние перечисленных факторов на активность ферментных
систем углеводного обмена. И тем не менее некоторые
аспекты регуляции метаболизма
углеводов напомним. Гликолиз – это
Гликолиз – это
совокупность реакций превращения глюкозы в пируват. У
аэробных организмов
гликолиз служит как бы
прелюдией к циклу
трикарбоновых кислот (циклу Кребса). Десять реакций гликолиза протекают в
цитозоле. Гликолитический путь играет двоякую роль: приводит к генерированию АТФ в результате распада глюкозы, и он же
поставляет строительные блоки для синтеза клеточных компонентов. Реакции
гликолитического пути в физиологических условиях легкообратимы, кроме реакций,
катализируемых гексокиназой,
фосфофруктокиназой и пируват-киназой. Фосфофруктокиназа – наиболее важный
регуляторный элемент (фермент) в процессе гликолиза, ингибируется
высокими концентрациями
АТФ и цитрата и активируется АМФ. Цикл трикарбоновых кислот
(цикл Кребса) представляет собой конечный общий путь для окисления «топливных» молекул. Большинство
«топливных» молекул
вступает в цикл в виде ацетил-КоА. Окислительное декарбоксилирование
пирувата, приводящее к образованию ацетил-КоА, является связующим звеном между гликолизом и циклом трикарбоновых кислот.
Заметим, что последний служит также источником строительных блоков для
процессов биосинтеза.
Все реакции цикла протекают в митохондриях. Скорость цикла трикарбоновых кислот
зависит от потребности в АТФ.
Высокий энергетический заряд клетки понижает активность цитратсинтазы,
изоцитратдегидрогеназы и α-кетоглутаратдегидрогеназы.
Еще один важный регуляторный момент – необратимое образование ацетил-КоА из
пи-рувата. В результате пентозофосфатного пути происходит генерирование НАДФН и
рибозо-5-фосфата в цитозоле. НАДФН участвует в
восстановительных биосинтезах,
а рибозо-5-фосфат используется в синтезах РНК, ДНК и нуклеотидных коферментов. Взаимодействие гликолитического и
пентозофосфатного путей обеспечивает возможность постоянного приспособления концентраций НАДФН, АТФ и строительных блоков,
например рибозо-5-фосфата и пирувата, для удовлетворения потребностей клеток. Наконец, глюконеогенез и гликолиз регулируются
реципрокно, так что, если активность
одного из путей относительно понижается, то активность другого пути
повышается.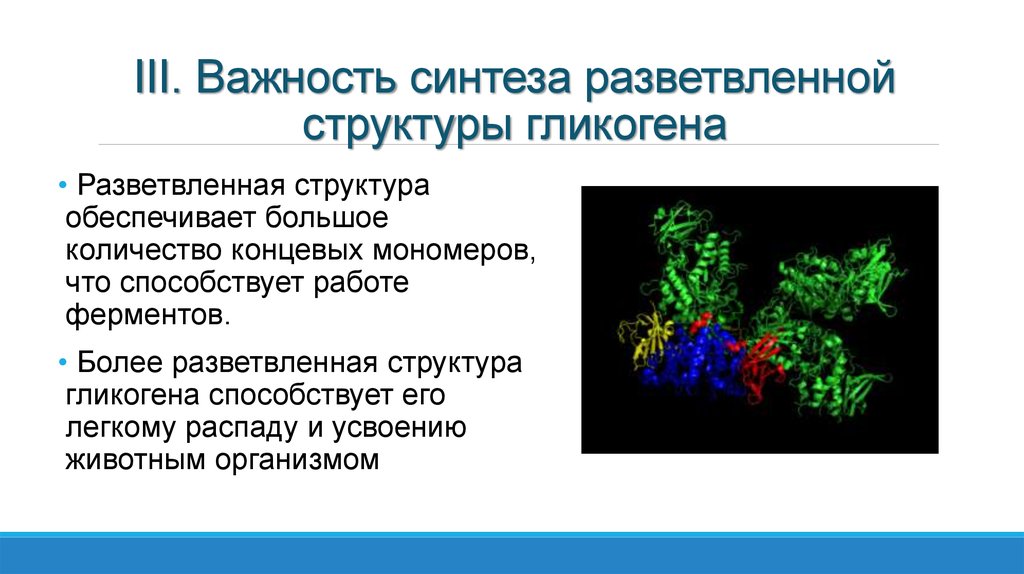 У человека и животных на всех стадиях синтеза и распада углеводов регуляция
У человека и животных на всех стадиях синтеза и распада углеводов регуляция
углеводного обмена осуществляется при участии ЦНС и гормонов. Например,
установлено, что концентрация
глюкозы в крови ниже
3,3–3,4 ммоль/л (60–70 мг/100 мл) приводит к рефлекторному возбуждению высших
метаболических центров, расположенных в гипоталамусе. В регуляции углеводного
обмена особая роль принадлежит высшему отделу ЦНС – коре большого мозга. Наряду
с ЦНС важное влияние на содержание глюкозы оказывают
гормональные факторы, т.е. регуляции уровня глюкозы в крови осуществляется
ЦНС через ряд эндокринных желез
(см. главу 8).
Биохимия, гликоген — PubMed
Book
Salah A. Daghlas
1
, Шамим С. Мохиуддин
2
Источник: StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2022 янв.
.
Принадлежности
Принадлежности
- 1 Университет Миссури, Колумбия
- 2 Университет имама Абдулрахмана бин Фейсала, Даммам
PMID:
30969624
Идентификатор книжной полки:
НБК539802
Бесплатные книги и документы
Book
Salah A. Daghlas et al.
Бесплатные книги и документы
Источник: StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2022 янв.
.
Авторы
Салах А. Даглас
1
, Шамим С. Мохиуддин
2
Принадлежности
- 1 Университет Миссури, Колумбия
- 2 Университет имама Абдулрахмана бин Фейсала, Даммам
PMID:
30969624
Идентификатор книжной полки:
НБК539802
Выдержка
Гликоген представляет собой сильно разветвленный полимер глюкозы, который животные используют в качестве резерва энергии. Это животный аналог крахмала. Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких количествах в других тканях, таких как почки, сердце и мозг. Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения. Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться. Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут оказывать значительное неблагоприятное воздействие на организм.
Гликогена в растительных тканях нет. Он высоко сконцентрирован в печени, хотя скелетные мышцы содержат больше всего гликогена по массе. Он также присутствует в более низких количествах в других тканях, таких как почки, сердце и мозг. Остатки глюкозы в гликогене соединяются двумя основными связями, альфа-1,4 и альфа-1,6 гликозидными связями в линейных цепях и в точках соединения. Ветвление является важным аспектом гликогена, поскольку оно увеличивает его растворимость и позволяет ему быстрее метаболизироваться. Важно отметить, что гликоген служит для поддержания гомеостаза глюкозы в организме животного. Из-за этого его метаболизм регулируется в первую очередь инсулином и глюкагоном, а также молекулами в их нижестоящих сигнальных путях. Инсулин и глюкагон способствуют синтезу и расщеплению гликогена соответственно. Патологии, нацеленные на ферменты, участвующие в синтезе, деградации и/или регуляции гликогена, могут оказывать значительное неблагоприятное воздействие на организм.
Авторское право © 2022, StatPearls Publishing LLC.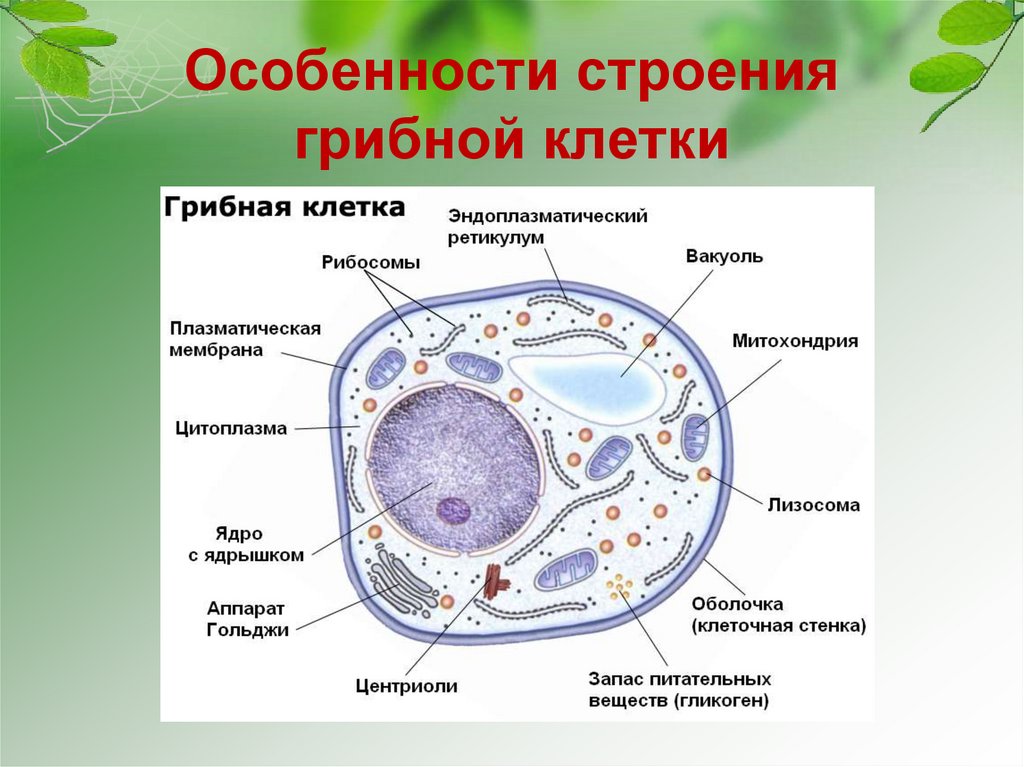
Разделы
Вступление
Основы
Сотовая связь
молекулярный
Клиническое значение
Обзорные вопросы
использованная литература
Похожие статьи
Метаболизм гликогена у человека.
Адева-Андани М.М., Гонсалес-Лукан М., Донапетри-Гарсия С., Фернандес-Фернандес С., Аменейрос-Родригес Э.
Адева-Андани М.М. и соавт.
Клиника ББА. 2016 27 фев; 5:85-100. doi: 10.1016/j.bbacli.2016.02.001. электронная коллекция 2016 июнь.
Клиника ББА. 2016.PMID: 27051594
Бесплатная статья ЧВК.
Рассмотрение.
Полисахарид Dendrobium officinale улучшает метаболизм глюкозы в печени диабетиков через сигнальные пути, опосредованные глюкагоном, и модифицируя структуру гликогена печени.
Лю Ю, Ян Л, Чжан Ю, Лю Х, Ву З, Гилберт Р.Г., Дэн Б., Ван К.
Лю Ю и др.
J Этнофармакол. 2020 10 фев; 248:112308. doi: 10.1016/j.jep.2019.112308. Epub 2019 14 октября.
J Этнофармакол. 2020.PMID: 31622745
Биохимическое измерение гликогена: метод исследования взаимосвязи AMPK-гликоген.
Поссик Э, Пауза А.
Поссик Э. и др.
Методы Мол Биол. 2018;1732:57-67. doi: 10.1007/978-1-4939-7598-3_4.
Методы Мол Биол. 2018.PMID: 29480468
Филогеномный анализ ферментативного дуэта разветвления и разветвления гликогена.

Змасек С.М., Годзик А.
Змасек С.М. и соавт.
БМС Эвол Биол. 2014 23 авг; 14:183. doi: 10.1186/s12862-014-0183-2.
БМС Эвол Биол. 2014.PMID: 25148856
Бесплатная статья ЧВК.Пространственная структура молекул гликогена в клетках.
Безбородкина Н.Н., Честнова А.Ю., Воробьев М.Л., Кудрявцев Б.Н.
Безбородкина Н.Н., и соавт.
Биохимия (Москва). 2018 май;83(5):467-482. дои: 10.1134/S0006297918050012.
Биохимия (Москва). 2018.PMID: 29738682
Рассмотрение.
Посмотреть все похожие статьи
использованная литература
Роуч П.Дж., Депаоли-Роуч А.А., Херли Т.Д., Тальябраччи В.С. Гликоген и его метаболизм: некоторые новые разработки и старые темы. Biochem J.
 2012 Feb 01;441(3):763-87.
2012 Feb 01;441(3):763-87.—
ЧВК
—
пабмед
Дженсен Дж., Рустад П.И., Колнес А.Дж., Лай Ю.К. Роль распада гликогена скелетных мышц в регуляции чувствительности к инсулину при физических нагрузках. Фронт Физиол. 2011;2:112.
—
ЧВК
—
пабмед
Эллингвуд С.
 С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141.
С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141.—
ЧВК
—
пабмед
Адева-Андани М.М., Гонсалес-Лукан М., Донапетри-Гарсия С., Фернандес-Фернандес С., Аменейрос-Родригес Э. Метаболизм гликогена у людей. Клиника ББА. 2016 июнь; 5:85-100.
—
ЧВК
—
пабмед
Петерсен М.
 С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587.
С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587.—
ЧВК
—
пабмед
Типы публикаций
Гликоген — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 395
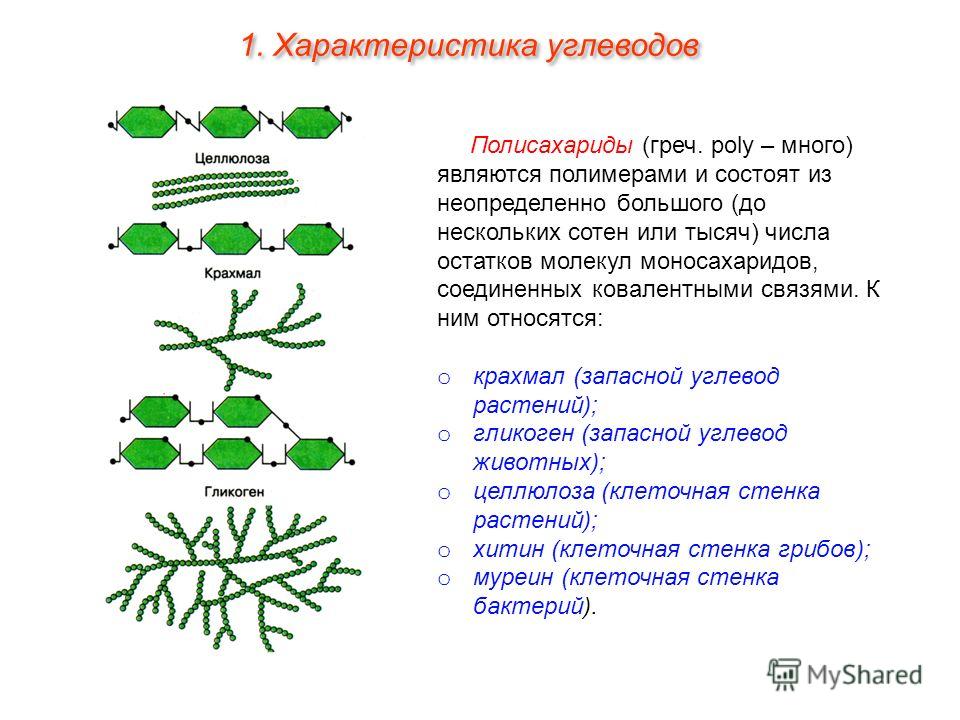
Полисахариды представляют собой углеводные полимеры, состоящие из десятков, сотен и нескольких тысяч моносахаридных звеньев. Все распространенные полисахариды содержат глюкозу в качестве моносахаридной единицы. Полисахариды синтезируются растениями, животными и людьми для хранения в пищу, структурной поддержки или метаболизма для получения энергии.
Все распространенные полисахариды содержат глюкозу в качестве моносахаридной единицы. Полисахариды синтезируются растениями, животными и людьми для хранения в пищу, структурной поддержки или метаболизма для получения энергии.
Введение
Гликоген представляет собой запасную форму глюкозы у животных и людей, которая аналогична крахмалу в растениях. Гликоген синтезируется и запасается в основном в печени и мышцах. Структурно гликоген очень похож на амилопектин с альфа-ацетальными связями, однако он имеет еще большее разветвление и присутствует больше глюкозных звеньев, чем в амилопектине. Различные образцы гликогена были измерены при 1700-600000 единиц глюкозы.
Структура гликогена состоит из длинных полимерных цепей единиц глюкозы, соединенных связью альфа-ацеталя . На графике слева показана очень маленькая часть цепи гликогена. Все мономерные звенья представляют собой альфа-D-глюкозу, а все альфа-ацетальные звенья соединяют C#1 одной глюкозы с C#4 следующей глюкозы.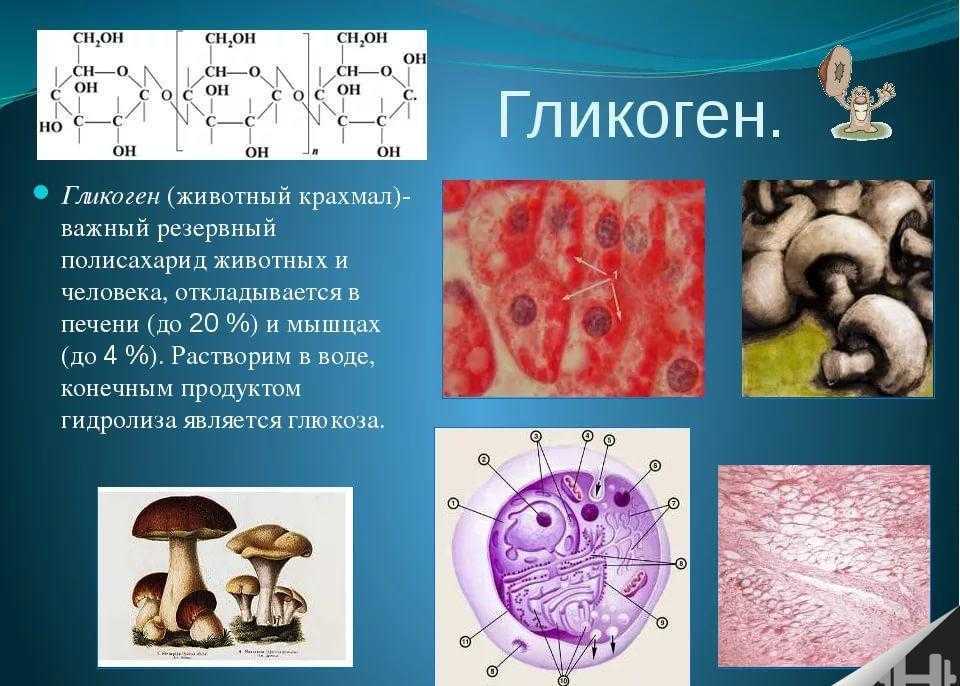
Ответвления образованы путем соединения C # 1 с C # 6 через ацетальные связи. В гликогене ответвления располагаются с интервалом в 8-10 глюкозных единиц, а в амилопектине ветви разделены 12-20 глюкозными единицами.
Ацетальная функциональная группа
Углерод № 1 называется аномерным углеродом и является центром ацетальной функциональной группы. Углерод, к которому присоединены два атома кислорода эфира, является ацеталем. Альфа-положение определяется как эфирный кислород, находящийся на противоположной стороне кольца по отношению к C # 6. В структуре кресла это приводит к проекции вниз . Это то же определение, что и -ОН в полуацетале.
Крахмал в сравнении с гликогеном
Растения производят крахмал и целлюлозу в процессе фотосинтеза. Животные и человек, в свою очередь, питаются растительными материалами и продуктами. Пищеварение — это процесс гидролиза, при котором крахмал в конечном итоге расщепляется на различные моносахариды.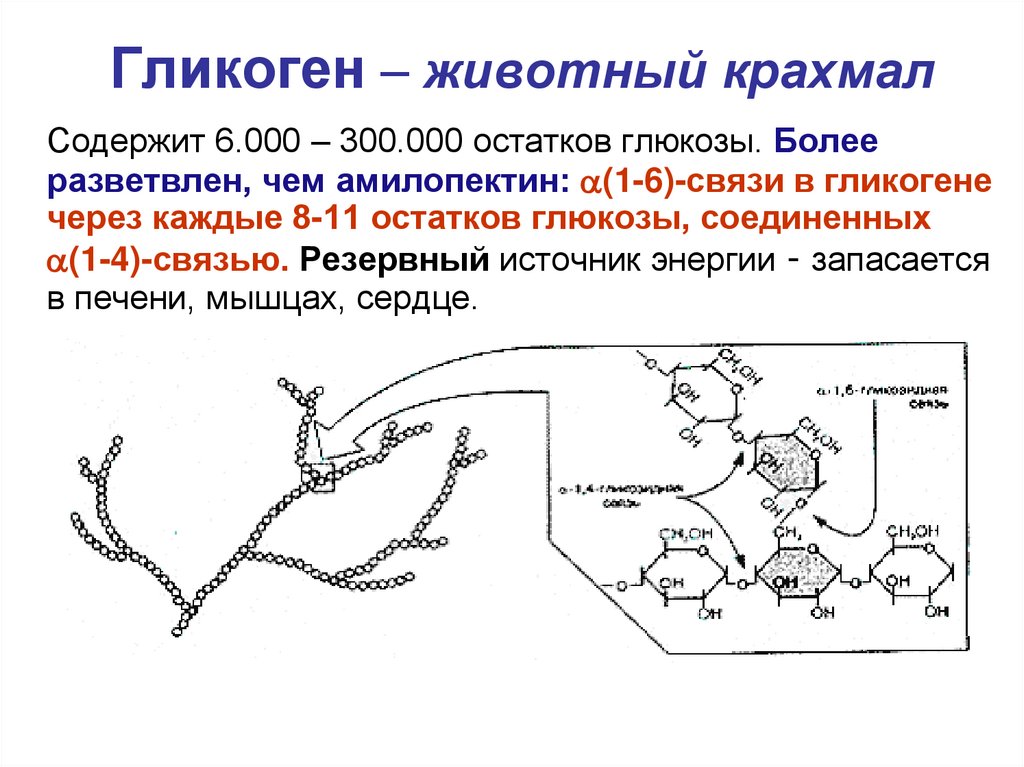


 2012 Feb 01;441(3):763-87.
2012 Feb 01;441(3):763-87.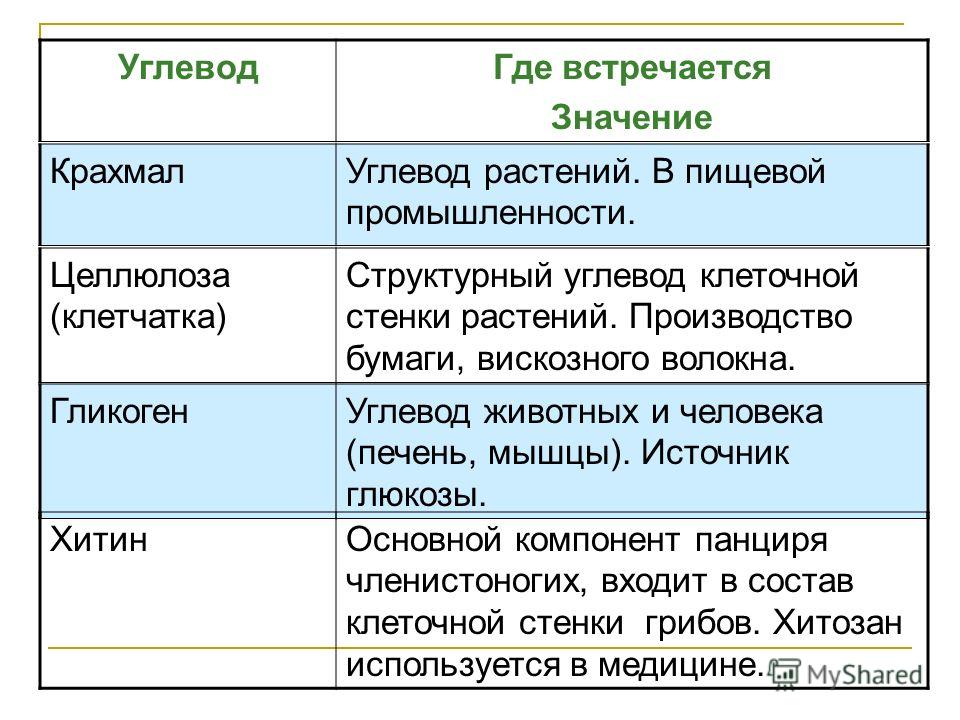 С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141.
С., Ченг А. Биохимические и клинические аспекты болезней накопления гликогена. J Эндокринол. 2018 сен; 238(3):R131-R141.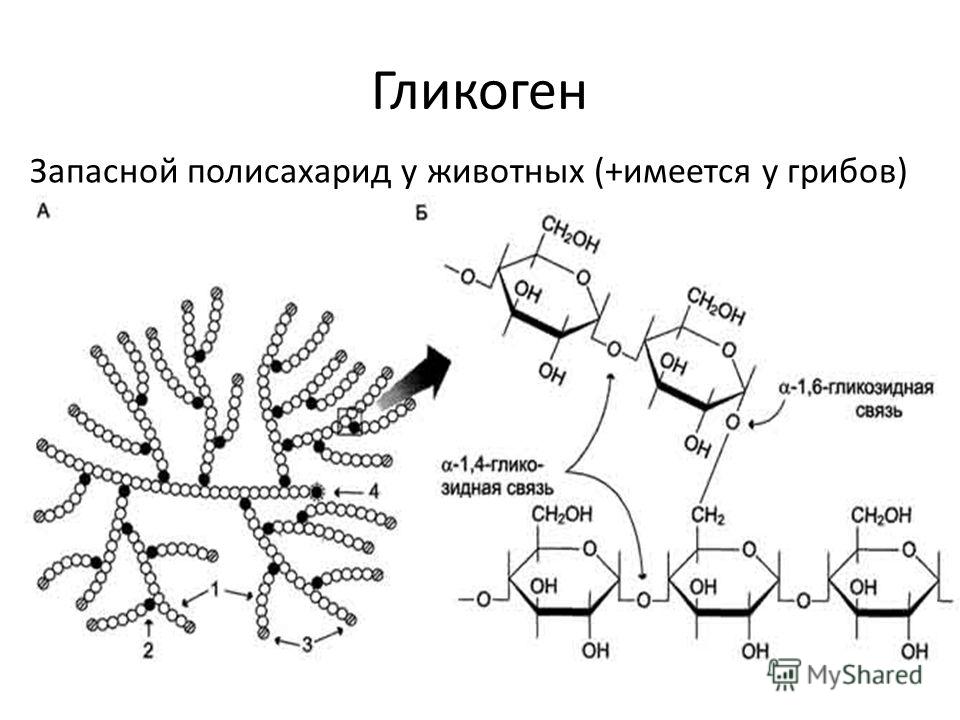 С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587.
С., Ватнер Д.Ф., Шульман Г.И. Регуляция метаболизма глюкозы в печени в норме и при патологии. Нат Рев Эндокринол. 2017 Октябрь; 13 (10): 572-587.