Содержание
российские ученые определили связь между засухами и содержанием CO₂ в атмосфере
28 сентября, 2022 12:16
Источник:
Russia Today
Российские ученые подвели итоги эксперимента, который длился 24 года в лесах Подмосковья. На протяжении этого времени биологи замеряли интенсивность так называемого дыхания почв (газообмена между атмосферой и землей) в части выделяемого почвенной биотой и корнями растений углекислого газа. Выяснилось, что, хотя при повышении температуры активность микроорганизмов обычно растет, в условиях засухи выделение CO₂ снижается, поскольку биота также нуждается во влаге. При этом в разных типах почвы этот процесс идет неодинаково. По словам ученых, полученные выводы помогут лучше понять, как будет меняться баланс между поглощением и выделением лесами углекислого газа в условиях засух, которых в последние годы становится всё больше на фоне глобального потепления.
Поделиться
Ученые из Института физико-химических и биологических проблем почвоведения РАН (Пущино) обобщили результаты уникального полевого эксперимента, который продолжался 24 года. Его целью было оценить общее дыхание почв (процесса газообмена между атмосферой и землей) в различные сезоны года и определить, насколько оно чувствительно к повышению температуры. О результатах исследования, опубликованных в журнале Forests, RT сообщили в пресс-службе Российского научного фонда.
По словам специалистов, наземные экосистемы оказывают решающее влияние на природные потоки углекислого газа и его концентрацию в атмосфере. Относительная стабильность последней обеспечивается балансом между поглощением углекислого газа растениями в ходе фотосинтеза и его выделением при разложении органического вещества почвенными микроорганизмами.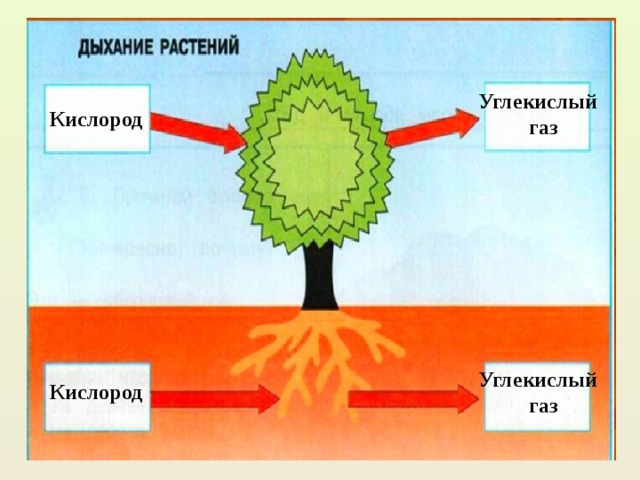
«И если все мы слышали выражение, что леса — легкие нашей планеты, то об этих крошечных, невидимых глазу существах, населяющих почву, мы часто забываем. А ведь они активно дышат, выделяя в процессе своей жизнедеятельности в атмосферу углекислый газ, и тем самым напрямую участвуют в круговороте углерода», — рассказала в беседе с RT руководитель проекта, главный научный сотрудник лаборатории почвенных циклов азота и углерода Института физико-химических и биологических проблем почвоведения РАН Ирина Курганова. — Так, в результате дыхания почвы в атмосферу выделяется почти на порядок больше углерода, чем при сжигании ископаемого топлива».
Исследование проводилось в двух экосистемах на юге Подмосковья: в широколиственном и смешанном лесах. С декабря 1997 по ноябрь 2021 года учёные еженедельно и непрерывно измеряли на одних и тех же участках количество углекислого газа, выделяемого почвенными микроорганизмами и корнями растений.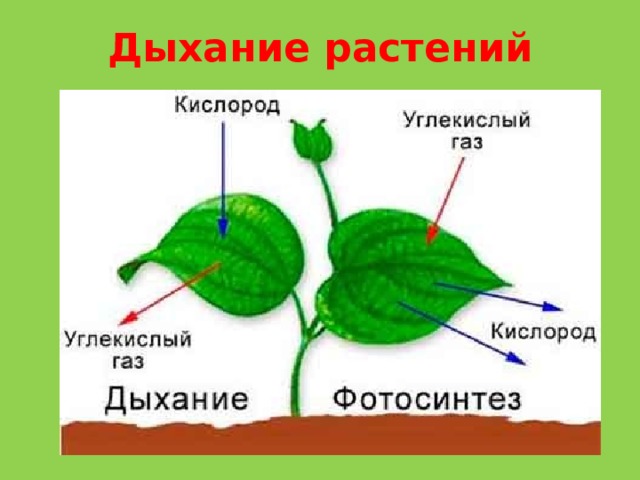 Для этого были установлены герметично закрытые камеры, в которых накапливался CO₂. Из них ученые отбирали газовые пробы, которые затем анализировали в лаборатории. По изменению концентрации углекислого газа в пробах авторы работы рассчитывали интенсивность дыхания почвы.
Для этого были установлены герметично закрытые камеры, в которых накапливался CO₂. Из них ученые отбирали газовые пробы, которые затем анализировали в лаборатории. По изменению концентрации углекислого газа в пробах авторы работы рассчитывали интенсивность дыхания почвы.
Камеры-накопители. Источник: Ирина Курганова
Выделение углекислого газа происходит в процессе жизнедеятельности почвенных микроорганизмов и дыхания корней растений, и с ростом температуры эти процессы протекают более активно. Однако ученые установили, что чувствительность дыхания почвы к повышению температуры зависит от уровня влажности во время вегетации растений.
В засушливые годы выделение углекислого газа снижалось по сравнению с годами, когда уровень увлажненности был нормальным или повышенным, поскольку количество влаги и доступность питательных веществ в почве для микроорганизмов заметно уменьшались. В результате процессы их жизнедеятельности замедлялись, и они выделяли в атмосферу меньше CO₂.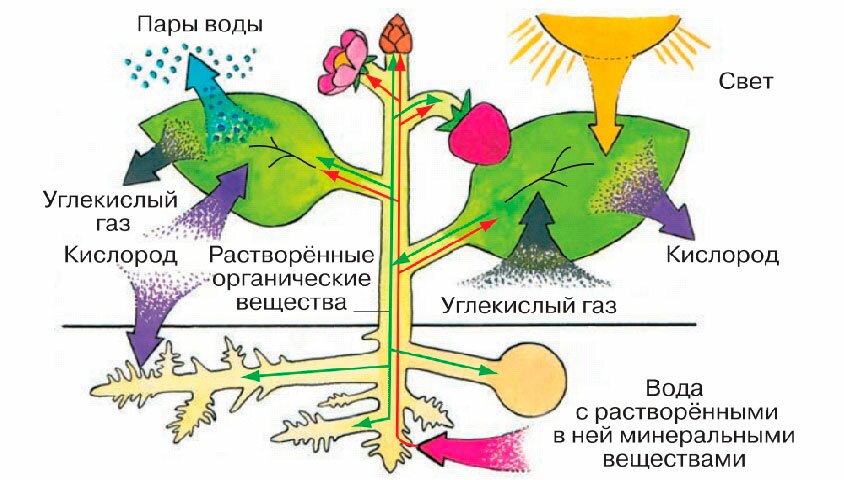
При этом степень отклика микробиоты на недостаток влаги в почве во время засух неодинакова. Ученые выяснили, что живущие в супесчаных почвах микроорганизмы в засушливые годы значительно снижают активность и переходят в экономный режим. Это связано с тем, что такой грунт обладает низкой водоудерживающей способностью и быстро теряет влагу. Поэтому в супесчаных почвах повышение температуры в условиях засухи не приводит к росту почвенного дыхания.
Несколько иная ситуация наблюдается в суглинистых почвах. Они тоже сокращают выделение углерода в условиях засухи, однако далеко не так сильно, как супеси. Дело в том, что эти почвы способны даже в самые засушливые годы сохранять запасы влаги, необходимой для жизнедеятельности микроорганизмов.
В целом отклик дыхания почв на рост температуры в засушливые годы снижается во всех случаях, отмечают авторы работы. И потепление климата в условиях усиления его засушливости может привести к уменьшению концентрации углекислого газа в атмосфере, поскольку его выделение почвой будет меньше, чем поглощение растениями.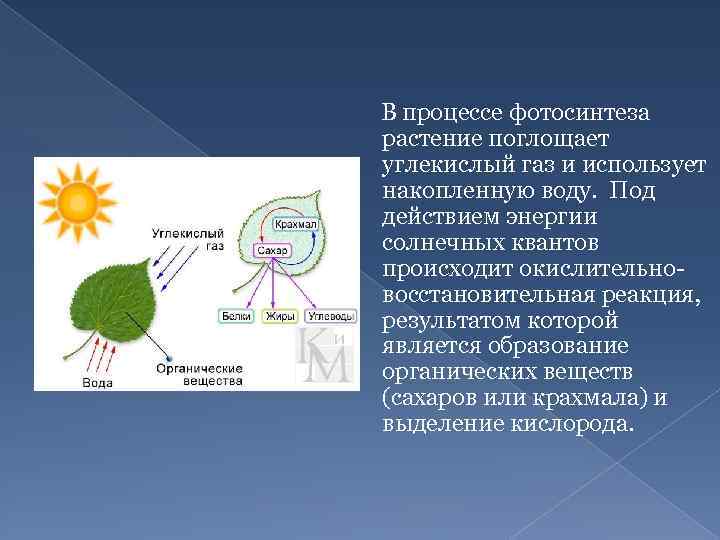
«Таким образом, мы показали, что именно влагообеспеченность почв в вегетационный период является основным фактором, контролирующим температурную чувствительность почвенного дыхания в лесных экосистемах. При современной тенденции усиления засушливости климата во многих регионах России и мира можно прогнозировать снижение потока углекислого газа из почв в атмосферу. Эта тенденция будет распространяться на лесные экосистемы таежной зоны, к которым принадлежат и леса Подмосковья, где проводились исследования», — отметила Ирина Курганова.
По словам специалистов, опубликованная работа дает новые знания о глобальном цикле углерода, который напрямую связан с климатическими изменениями, наблюдаемыми сегодня на Земле.
Исследование поддержано грантом Российского научного фонда.
Если вы хотите стать героем публикации и рассказать о своем исследовании, заполните форму на сайте РНФ.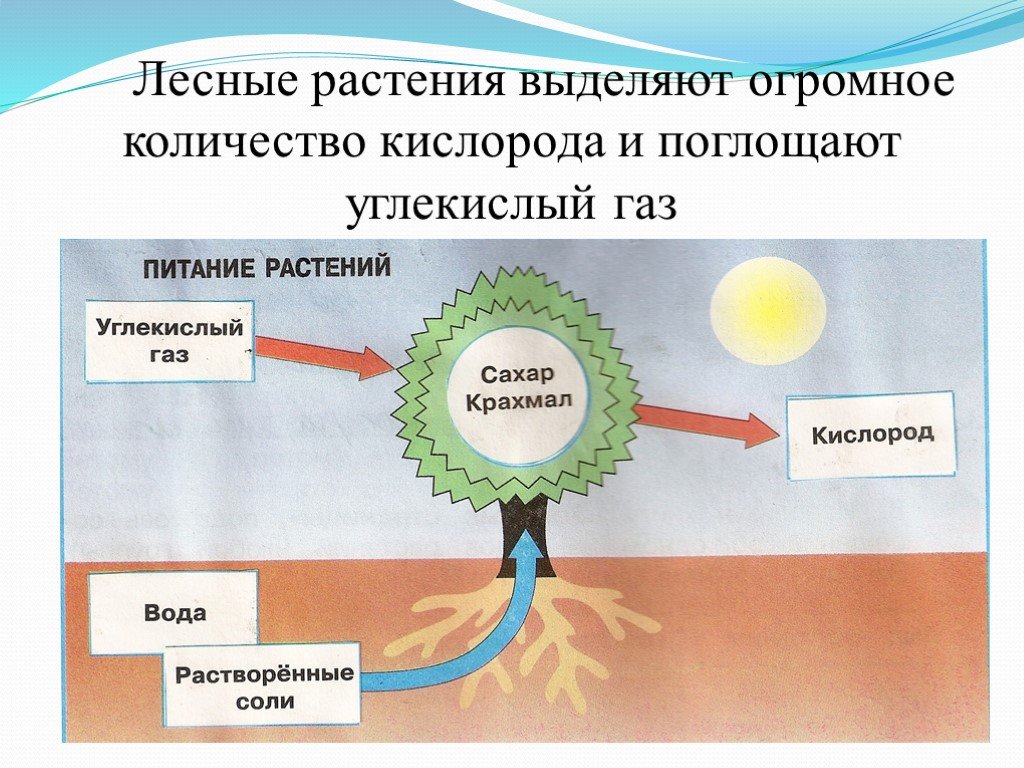
Теги
Биология, Спецпроект
Лаборатория дыхания растений и механизмов его регуляции
Заведующий лабораторией – Шугаев Александр Григорьевич, ведущий научный сотрудник, д.б.н.
Тел.: (499) 678-53-40, E-mail: [email protected]
Краткая история подразделения, основные научные достижения
Лаборатория была создана в конце 2003 году на базе лаборатории транспорта метаболитов, которой на протяжении многих лет руководил академик А.Л. Курсанов. С момента создания лаборатории в поиске движущих сил дальнего транспорта ассимилятов А.Л. Курсанов уделял значительное внимание изучению дыхательного метаболизма проводящих тканей. Впоследствии под руководством Э.И. Выскребенцевой и при участии А.Г. Шугаева было начато исследование энергетического метаболизма сахаронакапливающего органа – корнеплода сахарной свеклы. В ходе этих исследований были получены новые важные сведения относительно специфики энергетики запасающих органов и механизмов ее регуляции.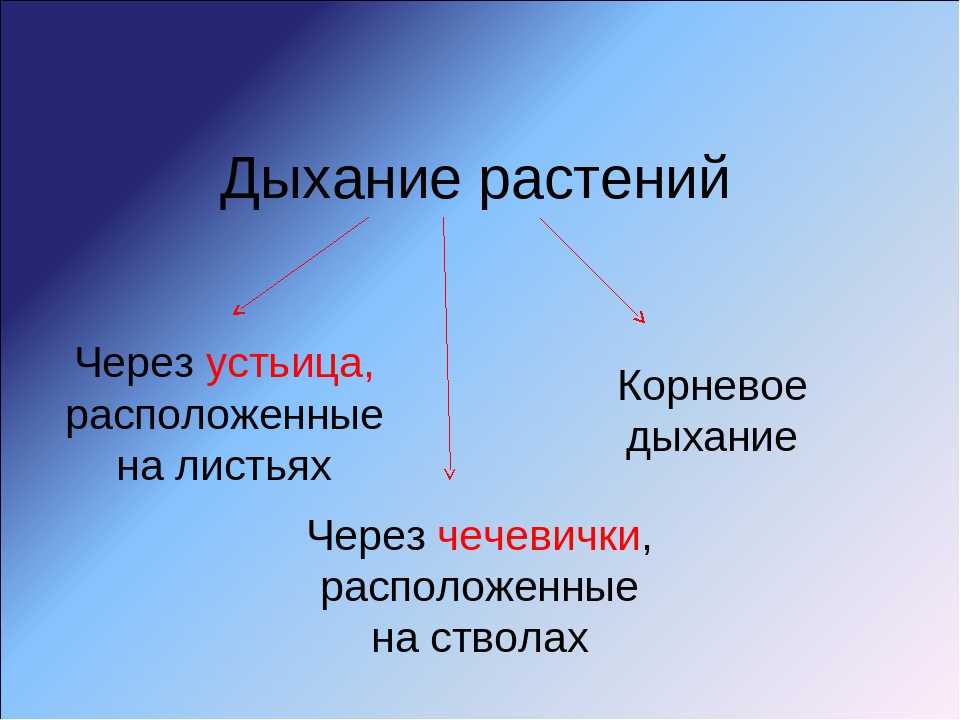 Созданная лаборатория продолжает и существенно развивает эти исследования.
Созданная лаборатория продолжает и существенно развивает эти исследования.
Основные направления исследований сотрудников лаборатории
В настоящее время основными направлениями исследований, проводимых сотрудниками лаборатории, являются:
Исследование роли митохондрий в формировании устойчивости растений к абиотическому стрессу. С этой целью в экспериментах in vivo и in vitro проводится изучение структурно-функциональных изменений митохондрий растений в ответ на раздельное и совместное действие неблагоприятных факторов окружающей среды (водного дефицита, экстремальных температур, гипоксии).
Изучение функциональных аспектов гормональной регуляции дыхания. Продолжено изучение влияния стрессовых фитогормонов (салициловой кислоты и мелатонина) на метаболизм митохондрий, включая: процесс окислительного фосфорилирования, генерацию активных форм кислорода (АФК) и индукцию повышенной проницаемости внутренней мембраны, вследствие открытия поры.
Изучение природы альтернативных путей митохондриального дыхания, механизмов их регуляции и роли при неблагоприятных воздействиях окружающей среды.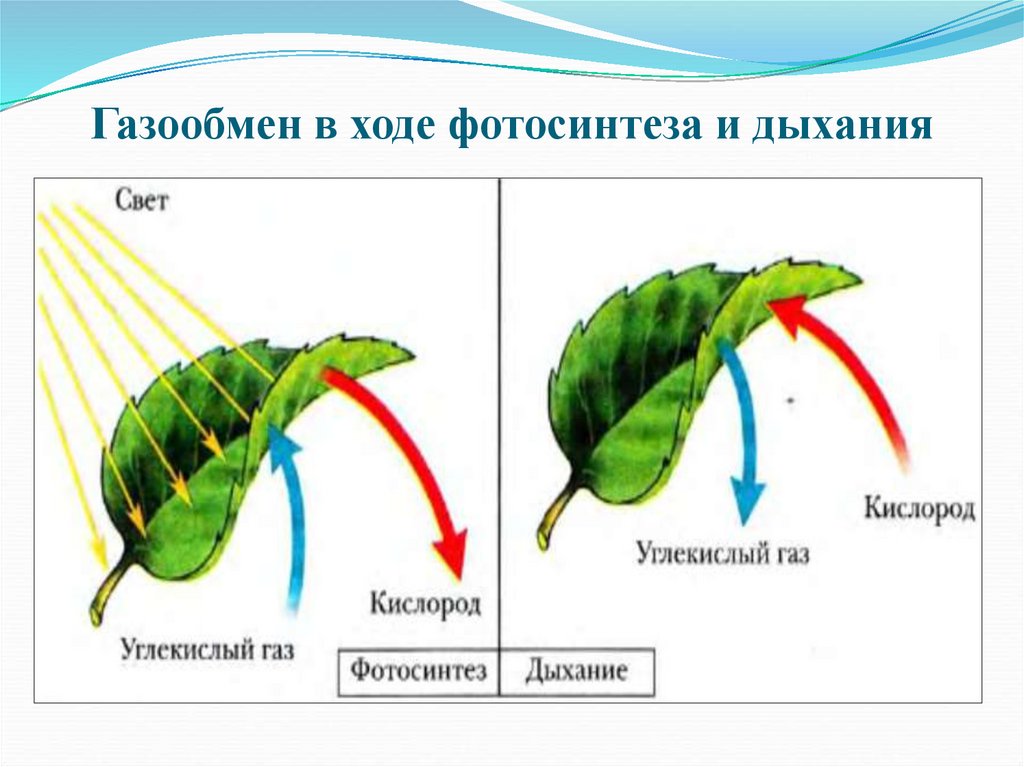
Совместно с сотрудниками Института биохимической физики им. Н.М. Эмануэля РАН, изучается влияние некоторых биологически активных веществ, например, антиоксидантов (ресвератрола), доноров оксида азота (железо-серанитрозильного комплекса с тиосульфатом — ТНКЖтио), мелафена и др., на рост проростков гороха и люпина в условиях засухи, дыхание митохондрий и перекисное окисление мембранных липидов (ПОЛ), с целью выявления их возможного протекторного действия на растения.
Среди результатов, полученных за последние 6 лет можно отметить следующие:
- Впервые показано, что характер регуляторного действия салициловой кислоты (СК) на метаболизм митохондрий (разобщение и/или ингибирование дыхания) зависел не только от ее концентрации, но и от продолжительности инкубации органелл в ее присутствии, а также от физиологического состояния ткани, из которой они были выделены.
- Показано, что при окислении сукцината в митохондриях семядолей люпина СК индуцировала повышенную проницаемость внутренней мембраны для протонов и одновалентных катионов (ионов К+), по-видимому, вследствие открытия в ней специального канала или поры.
 При этом, необходимым условием такой пермеаблизации мембраны являлось существенное увеличение под влиянием фитогормона генерации АФК дыхательной цепью и возникновение окислительного стресса.
При этом, необходимым условием такой пермеаблизации мембраны являлось существенное увеличение под влиянием фитогормона генерации АФК дыхательной цепью и возникновение окислительного стресса. - Установлено, что геном люпина кодирует как минимум две изоформы альтернативной оксидазы (АО) − LuАох1 и LuАох2 с приблизительной мол. м. 35 кД., экспрессия которых резко возрастала после обработки проростков СК, за счет увеличения содержания мРНК. СК-индуцируемая экспрессия Аох- генов коррелировала с активацией цианид-резистентного дыхания (ЦРД) и увеличением максимальной активности АО, как в семядолях люпина, так и в выделенных из них митохондриях.
- Впервые получены данные, свидетельствующие о наличии тесной взаимосвязи между изменениями в составе липидов мембран митохондрий, в частности, изменением в составе ненасыщенных жирных кислот с очень длинной цепью, с 18 и 20 углеродными атомами, и нарушением окисления НАД-зависимых субстратов, катализируемого комплексом I ЭТЦ митохондрий проростков гороха в условиях водного дефицита.

- Кроме того, было показано, что после совместного действия засухи и пониженной температуры, в отличие от их раздельного применения, проростки гороха скорее возобновляли рост, а митохондрии быстрее восстанавливали активность основного, цитохромного пути окисления в ЭТЦ, сопряженного с синтезом АТФ. При этом, окисление малата, катализируемое комплексом I, оказалось более чувствительно к неблагоприятным факторам (НФ) и требовало более длительного времени восстановления, чем окисление сукцината, катализируемое комплексом II.
- На митохондриях растений (семядолей люпина, эпикотилей гороха) впервые показано, что мелатонин существенно снижал генерацию АФК (перекиси водорода) при окислении дыхательных субстратов. На модельной системе изолированных митохондрий показано, что антиоксидант ресвератрол в диапазоне концентрации (10-5-10-12) предотвращал ПОЛ в мембранах митохондрий проростков гороха.
- Показано, что обработка семян и проростков гороха донором оксида азота (ТНКЖтио) предотвращала торможение роста корней и побегов в условиях дефицита воды.
 Высказывается предположение, что защитные свойства препарата ТНКЖтио обусловлены его способностью предотвращать ПОЛ.
Высказывается предположение, что защитные свойства препарата ТНКЖтио обусловлены его способностью предотвращать ПОЛ.
Список сотрудников лаборатории
Шугаев Александр Григорьевич — заведующий лабораторией, ведущий научный сотрудник, д.б.н.
Тел.: (499) 678-53-40, внутренний: 3-40, e-mail: [email protected]
Генерозова Инна Павловна — старший научный сотрудник, к.б.н.
Тел.: (499) 678-53-40, внутренний: 3-40
Буцанец Павел Андреевич — научный сотрудник, к.б.н.
Тел.: (499) 678-53-40, внутренний: 3-40
Шугаева Наталия Александровна — н.с.
Тел.: (499) 678-53-40, внутренний: 3-40
Васильев Сергей Викторович, инженер;
Тел.: (499) 678-53-40, внутренний: 3-40
В 2019 году сотрудниками были успешно защищены в ИФРе кандидатские диссертации
- Буцанец П.А. «Влияние салициловой кислоты на метаболическую активность митохондрий растений и экспрессию генов альтернативной оксидазы», по специальности 03.01.05 — физиология и биохимия растений
- Баик А.
 С. «Характеристика пролин-специфичной аминопептидазы из одноклеточной водоросли Sinechocyctis sp. PCC 6803», также по специальности 03.01.05 — физиология и биохимия растений
С. «Характеристика пролин-специфичной аминопептидазы из одноклеточной водоросли Sinechocyctis sp. PCC 6803», также по специальности 03.01.05 — физиология и биохимия растений
Список основных публикаций сотрудников
Публикации сотрудников лаборатории дыхания растений в 2022 году
(статьи в рецензируемых журналах индексируемых в базах данных WoS, Scopus, РИНЦ и в списке ВАК)
Бычков И.А., Кудрякова Н.В., Шугаев А.Г., Кузнецов Вл.В., Кузнецов В.В. Рецептор мелатонина CAND2/PMTR1 участвует в регуляции экспрессии митохондриальных генов при фотоокислительном стрессе // Доклады РАН. Науки о жизни. 2022. Т. 502. С. 21–27. DOI: https://doi.org/10.31857/S2686738922010061
Жигачева И.В., Бинюков В.И., Генерозова И.П., Миль Е.М., Крикунова Н.И., Расулов M.М. Натрий µ2-дитиосульфато-тетранитрозилдиферрат тетрагидрат предотвращает обусловленную тепловым шоком дисфункцию митохондрий // Физиология растений. 2022. Т. 69. № 1. С. DOI: https://doi. org/10.31857/S0015330322010225
org/10.31857/S0015330322010225
Шугаев А.Г., Буцанец П.А., Шугаева Н.А. Влияние повышенной температуры на окисление НАД-зависимых субстратов и активность альтернативной оксидазы в митохондриях семядолей люпина // Физиология растений. 2022. Т. 69. № 4. С. 373 — 385. DOI: https://doi.org/10.31857/S0015330322040157
Генерозова И.П., Васильев С.В., Буцанец П.А., Шугаев А.Г. Совместное действие мелатонина и водного дефицита на рост, уровень МДА и дыхание митохондрий гипокотилей и корней люпина // Физиология растений. 2022. Т. 69. № 5. C. 501 — 510. DOI: https://doi.org/10.31857/S0015330322050074
Zhigacheva I.V., Krikunova N. I., Generozova I.P., Butsanets P.A., Gerasimov N. Yu., Vasiliev S.V., Goloshchapov A.N. Sodium μ2-dithiosulfate-tetranitrosyl diferrate tetrahydrate increases the efficiency of respiratory chain activity in mitochondria of pea seedlings// Biophysics. 2022. V. 67. No. 4., P. 534 — 540. DOI: https://doi.org/10.1134/S0006350922040236
Буцанец П. А., Шугаева Н.А., Шугаев А.Г. Идентификация генов альтернативной оксидазы митохондрий Lupinus luteus и влияние на их экспрессию салициловой кислоты // Известия РАН. Серия биологическая. 2022. № 6. С. 606 — 613. DOI: https://doi.org/10.31857/S102634702206004X
А., Шугаева Н.А., Шугаев А.Г. Идентификация генов альтернативной оксидазы митохондрий Lupinus luteus и влияние на их экспрессию салициловой кислоты // Известия РАН. Серия биологическая. 2022. № 6. С. 606 — 613. DOI: https://doi.org/10.31857/S102634702206004X
Zhigacheva I. V., Krikunova N.I., Mil E.3, Generozova I. P , Butsanets P.A.
Functional state of mitochondria in various pea seedling cultivars differing in resistance to water deficiency and influence of iron tetranitrosyl complex with thiosulfate ligands on it // Journal of Agriculture and Environment. 2022. V. 4. N 24. P. 1 — 8. DOI: https://doi.org/10.23649/jae.2022.4.24.07
Публикации сотрудников за 2021г.
Буцанец П.А., Шугаев А.Г. Салициловая кислота повышает устойчивость проростков люпина к гипертермии // Международный научно-исследовательский журнал. 2021. № 12 (2). С. 63 — 66. DOI: https://doi.org/10.23670/IRJ.2021.114.12.043
Gerasimov N. Y., Nevrova O.V., Zhigacheva I. V., Generozova I. P., Goloshchapov A. N. In vitro effects of different resveratrol concentrations on the structural state of mitochondrial membranes isolated from pea leaves // BIOPHYSICS. 2021. V. 66. P. 415–419. DOI: https://doi.org/10.1134/S0006350921030052.4.
Y., Nevrova O.V., Zhigacheva I. V., Generozova I. P., Goloshchapov A. N. In vitro effects of different resveratrol concentrations on the structural state of mitochondrial membranes isolated from pea leaves // BIOPHYSICS. 2021. V. 66. P. 415–419. DOI: https://doi.org/10.1134/S0006350921030052.4.
Буцанец П.А., Шугаева Н.А., Шугаев А.Г. Влияние мелатонина и салициловой кислоты на генерацию активных форм кислорода в митохондриях семядолей люпина // Физиология растений. 2021. Т. 68. № 4. С. 421 — 429. DOI: https://doi.org/10.1134/S1021443721040038
Публикации сотрудников за 2020г.
Binyukov V. I., Zhigacheva I. V., Mil E. M., Albantova A. A., Generozova I. P. The action of resveratrol on mitochondria of pea seedlings under stress conditions. Data of Atomic Force Microscopy and Fluorometry // Cell Tiss. Biol. 2020. V. 14. P. 74 — 81. DOI: https://doi.org/10.1134/S1990519X20010034
Zhigacheva I.V., Krikunova N.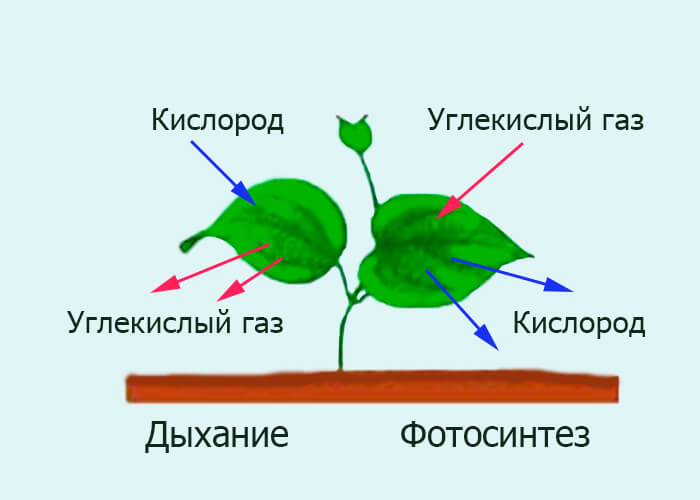 I., Generozova I.P., Rasulov M.M. 2020. Temperature dependence of the fatty-acids composition of mitochondrial membranes of pea seedlings been treating with nitrogen oxide donor under water deficiency // Journal of Agriculture and Environment. 2020. V. 2. P. 13-21. DOI : https://doi.org/10.23649/jae.2020.2.14.3
I., Generozova I.P., Rasulov M.M. 2020. Temperature dependence of the fatty-acids composition of mitochondrial membranes of pea seedlings been treating with nitrogen oxide donor under water deficiency // Journal of Agriculture and Environment. 2020. V. 2. P. 13-21. DOI : https://doi.org/10.23649/jae.2020.2.14.3
Zhigacheva I., Binykov V., Krikunova N., Generozova I., Rasulov M. Iron-sulfur-nitrosyl complex increases the resistance of pea seedlings to water deficiency // Current Chemical Biology. 2020. V. 14. P. 203-215. DOI: https://doi.org/10.2174/2212796814999200907162619
Буцанец П.А., Баик А.С., Шугаева Н.А., Шугаев А.Г. Влияние салициловой кислоты на дыхание и генерацию активных форм кислорода в митохондриях растений // Евразийский союз ученых. 2020. Т. 10. С. 9-15. DOI: https://doi.org/10.31618/ESU.2413-9335.2020.2.79.1043
Жигачева И.В., Васильева С.В., Генерозова И.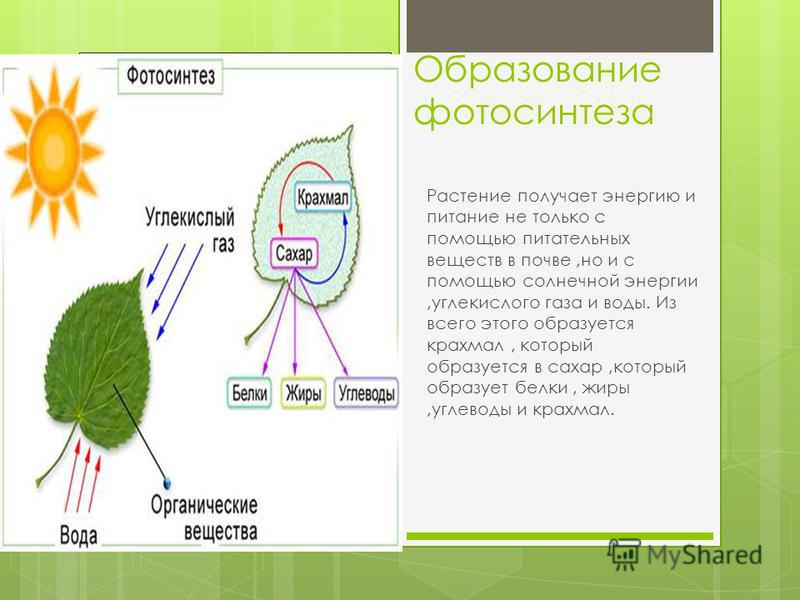 П., Расулов М.М. Тетранитрозильный биядерный комплекс железа повышает устойчивость проростков гороха и клеток Е. coli к стрессовым воздействиям // Биологические мембраны. 2020. Т. 37. № 2. С. 149-155. DOI: https://doi.org/10.31857/S0233475520020139
П., Расулов М.М. Тетранитрозильный биядерный комплекс железа повышает устойчивость проростков гороха и клеток Е. coli к стрессовым воздействиям // Биологические мембраны. 2020. Т. 37. № 2. С. 149-155. DOI: https://doi.org/10.31857/S0233475520020139
Жигачева И.B., Бинюков В.И., Русина И.Ф., Миль И.М., Генерозова И.П. Антиоксидантные и антирадикальные свойства реcвератрола и его антистрессовая активность // Химическая физика. 2020. Т. 39. С. 41-48. DOI: https://doi.org/10.31857/S0207401X20070122
Публикации сотрудников за 2019г.
Бинюков В. И., Жигачева И. В., Миль Е. М., Албантова А. А., Генерозова И. П. Действие ресвератрола на митохондрии проростков гороха в стрессовых условиях. Данные атомно-силовой микроскопии и флуорометрии. Цитология. 2019. Т. 61. N 10. C. 845 — 852 . DOI: https://doi.org/10.1134/S004137711910002X
Буцанец П.А., Баик А.С., Шугаев А.Г., Кузнецов В.В.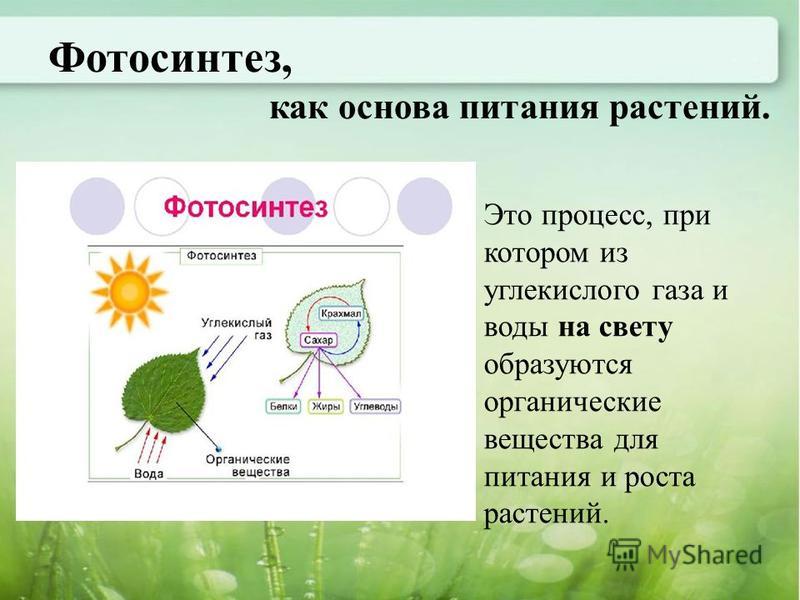 Мелатонин ингибирует продукцию перекиси водорода митохондриями растений // Доклады академии наук.. 2019. Т. 487. № 6. С. 94–97. DOI: https://doi.org/10.1134/S1607672919060036
Мелатонин ингибирует продукцию перекиси водорода митохондриями растений // Доклады академии наук.. 2019. Т. 487. № 6. С. 94–97. DOI: https://doi.org/10.1134/S1607672919060036
Generozova I.P., Butsanets P.A., Shugaev A.G. Mitochondrial respiration after combined action of dehydration and low temperature in pea seedlings // Biologia Plantarum. 2019. V. 63. Issue 1. P. 11-19. DOI: https://doi.org/1032615/bp.2019.002
Публикации сотрудников за 2018г.
Баик А.С., Миронов К.С., Архипов Д.В., Пиотровский М.С., Пожидаева Е.С. Характеристика аминопептидазы Р одноклеточной цианобактерии Sinechocystis sp. PCC6803. Доклады академии наук. 2018. Т. 478. № 4. С. 478-482. DOI : https://doi.org/10.31857/S086956520001207-0
Жигачева И.В., Генерозова, И.П., Вепринцев Т.Л. Антирадикальные и антистрессовые свойства N-ацетилцис-теинат 2-этил-6-метил-3-гидроксипиридина. Химическая физика. 2018. Т. 2018, Т. 37, № 11, С. 58-62. DOI: https://doi.org/10.1134/S0207401X18100126
Химическая физика. 2018. Т. 2018, Т. 37, № 11, С. 58-62. DOI: https://doi.org/10.1134/S0207401X18100126
Генерозова И.П., Буцанец П.А., Шугаев А.Г. Окислительный стресс у проростков гороха в период восстановления после действия неблагоприятных факторов. Годичное собрание ОФР. Всероссийская научная конференция «Механизмы устойчивости растений и микроорганизмов к неблагоприятным условиям среды». 10-15 июля 2018г. Иркутск. 2018. С. 221-225. DOI: https://doi.org/10.31255/978-5-94797-319-8-221-225
Список основных публикаций сотрудников лаборатории за 2003-2016 годы
Шугаев А.Г., Буцанец П.А., Шугаева Н.А. (2016) Салициловая кислота индуцирует протонную проницаемость внутренней мембраны митохондрий семядолей люпина. Физиология растений, 63, 765-776.
Абдрахимова Й.Р., Андреев И.М., Шугаев А.Г. (2015) Определение скорости генерации АФК в митохондриях растений in vitro с помощью флуоресцентных индикаторов: неспецифические эффекты ингибиторов терминальных оксидаз.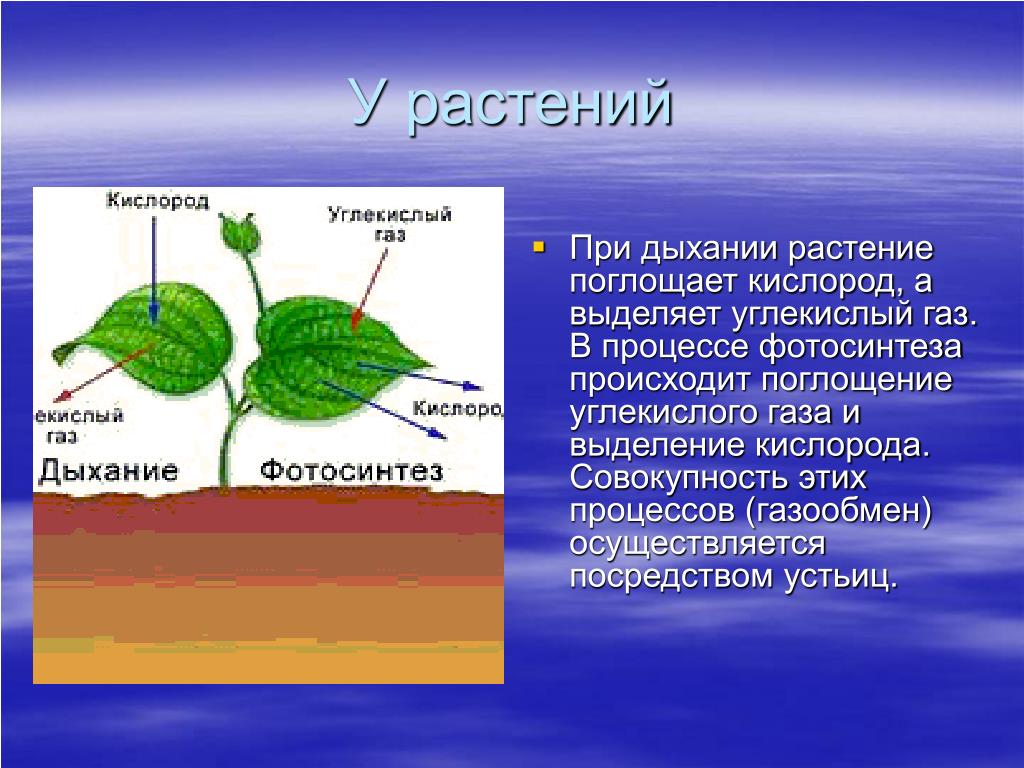 Физиология растений, 62, 146-152.
Физиология растений, 62, 146-152.
Zhigacheva I., Generozova I., Shugaev A., Misharina T., Terenina M. and Krikunova N. (2015) Organophosphorus plant growth regulators provides high activity Complex I mitochondrial respiratory chain Pisum sativum L seedlings in conditions of insufficient moisture. Annual Research & Review in Biology, 5, 85-96.
Белозерова Н.С., Баик А.С., Буцанец П.А., Кузнецов В.В., Шугаев А.Г., Пожидаева Е.С. (2014) Влияние салициловой кислоты на альтернативный путь дыхания люпина желтого. Физиология растений, 61, 43-52.
Zhigacheva I., Burlakova E., Misharina T., Terenina M., Krikunova N., Generozova I., Shugaev A. (2014) Fatty acid composition and activity of the mitochondrial respiratory chain complex I of pea seedlings under water deficit. Biologia, 59, 241-249.
Шугаев А.Г., Буцанец П.А., Андреев И.М., Шугаева Н.А. (2014) Влияние салициловой кислоты на метаболическую активность митохондрий растений.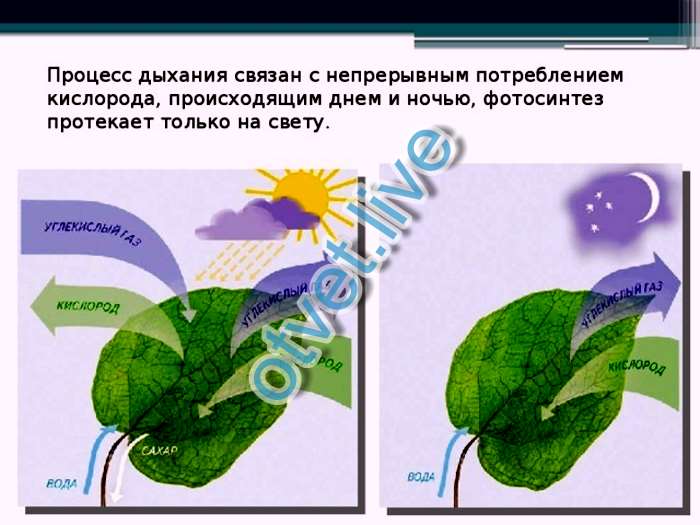 Физиология растений, 61, 555-564.
Физиология растений, 61, 555-564.
Zhigacheva I., Mil1 E., Binukov V., Generozova I., Shugaev A., Fatkullinа L. (2014) Combined effect of insufficient watering, moderate cooling, and organophosphorous plant growth regulator on the morphology and functional properties of pea seedling mitochondria. Annual Research & Review in Biology, 4, 3007-3025.
Binyukov V.I., Mill E.M., Zhigacheva I.V., Albantova A.A., Generozova I.P., Shugaev A.G. (2013) Effect Melaphen on a mitochondria of sprouth of peas under stressful influences by the AFM method. Chapter 18. In: Quantitative chemistry, biochemistry and biology. Steps ahead. Eds.: G.E. Zaikov, O.V. Stoyanov, W. Tyszkiewicz and Z. Weztejuk, Nova Science Publishers. New York, p. 195-204.
Zaikov G.E., Zhigacheva I.V., Burlakova E.B., Misharina T.A., Terenina M.B., Krikunova N.I., Generozova I.P., Shugaev A.G., Fattachov S.G. (2013) Effect of unsufficient watering and melamin salt of bis-(oxymetyl)-phosphonic acid (melaphen) on the fatty acid composition. Chapter 19. In: Progress in polymer materials science, Ed. G.E. Zaikov, O.V. Stoganov, E.I. Kulish, CRC Press. Toronto, New Gersey. USA, p. 187-199.
Chapter 19. In: Progress in polymer materials science, Ed. G.E. Zaikov, O.V. Stoganov, E.I. Kulish, CRC Press. Toronto, New Gersey. USA, p. 187-199.
Zhigacheva I.V., Burlakova E.B., Zaikov, Misharina T.A., Terenina M.B., Krikunova N.I., Generozova I.P., Shugaev A.G., Fattahov S.G. (2013) Content of Unsaturated Fatty Acids Containing 18 and 20 Carbon Atoms in the Total Lipid Moiety of Mitochondrial Membranes Determines the Activity Complex I of Respiration Chain. Polymers Research J. , 7(1) , 139-149.
Жигачева И.В., Бурлакова Е.Б., Мишарина Т.А., Теренина М.Б., Крикунова Н.И., Генерозова И.П., Шугаев А.Г., Фаттахов С.Г. (2013) Жирнокислотный состав липидов мембран и энергетика митохонджрий проростков гороха в условиях дефицита воды. Физиология растений, 60, 205-213.
Бинюков И.Н., Миль Е.М., Жигачёва И.В., Албантова А.А., Генерозова И.П., Шугаев А.Г., Фаттахов С.Г., Коновалов А.И. (2012) Недостаточное увлажнение и мелафен изменяют морфологию митохондрий проростков гороха. Доклады Академии наук, 446, 222-225.
Доклады Академии наук, 446, 222-225.
Брыков В.А., Генерозова И.П., Шугаев А.Г. (2012) Структурно–функциональная организация митохондрий корня гороха в условиях моделированной микрогравитации. Цитология и генетика (Украина) , 46, 20-26.
Генерозова И.П., Шугаев А.Г. (2012) Дыхательный метаболизм митохондрий проростков гороха разного возраста в условиях недостатка влаги и реоводнения. Физиология растений, 59(2) , 262-273.
Брыков В.О., Генерозова И.П., Шугаев А.Г., Кордюм Е.Л. (2011) Дыхательная активность митохондрий in vitro корней гороха выращенных в условиях моделированной микрогравитации. Доклады Национальной Академии Наук Украины, Сер. Биол., 9, 142-147.
Белозерова Н.С., Пожидаева Е.С., Шугаев А.Г., Кузнецов В.В. (2011) Салициловая кислота дифференциально регулирует интенсивность транскрипции митохондриальных генов Lupinus luteus L. Доклады Академии наук, 440, 266-269.
Абдрахимова Й.Р., Андреев И.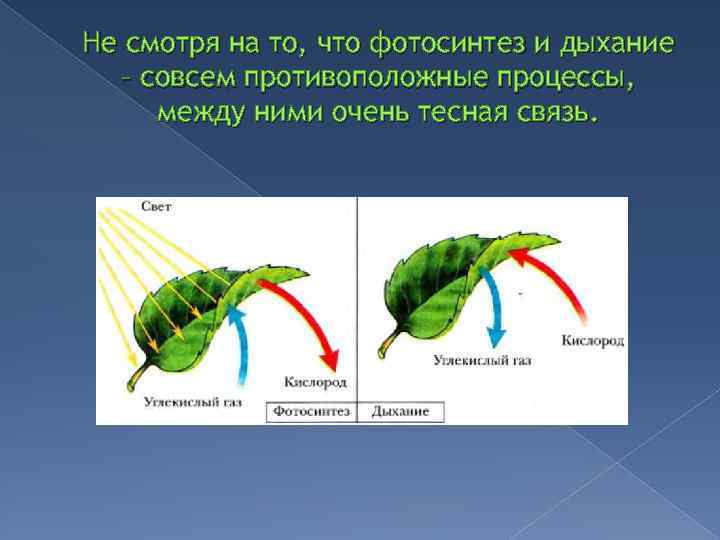 М., Шугаев А.Г. (2011) Участие диссипативных систем в контроле энергетической эффективности дыхания в митохондриях этиолированных проростков озимой пшеницы. Физиология растений, 58, 509-517.
М., Шугаев А.Г. (2011) Участие диссипативных систем в контроле энергетической эффективности дыхания в митохондриях этиолированных проростков озимой пшеницы. Физиология растений, 58, 509-517.
Жигачева И.В., Бурлакова Е.Б., Генерозова И.П., Шугаев А.Г., Фаттахов С.Г., Коновалов А.И. (2011) Регуляторы роста растений мелафен и пирафен предотвращают вызванную временным водным дефицитом дисфункцию митохондрий. Доклады Академии наук, 441, 111-116.
Шугаев А.Г., Лаштабега Д.А, Шугаева Н.А., Выскребенцева Э.И. (2011) Активность антиоксидантных ферментов в митохондриях растущих и покоящихся корнеплодов сахарной свеклы. Физиология растений, 58, 323-329.
Белозерова Н.С., Пожидаева Е.С., Шугаев А.Г., Кузнецов В.В. (2011) Метод run-on транскрипции для изучения регуляции экспрессии митохондриального генома. Физиология растений, 58, 133-138.
Zhigacheva I.V., Burlakova E.B., Generozova I.P., Shugaev A.G., Fattahov S.G. (2010) Ultra-low doses of melafen affect the energy of mitochondria.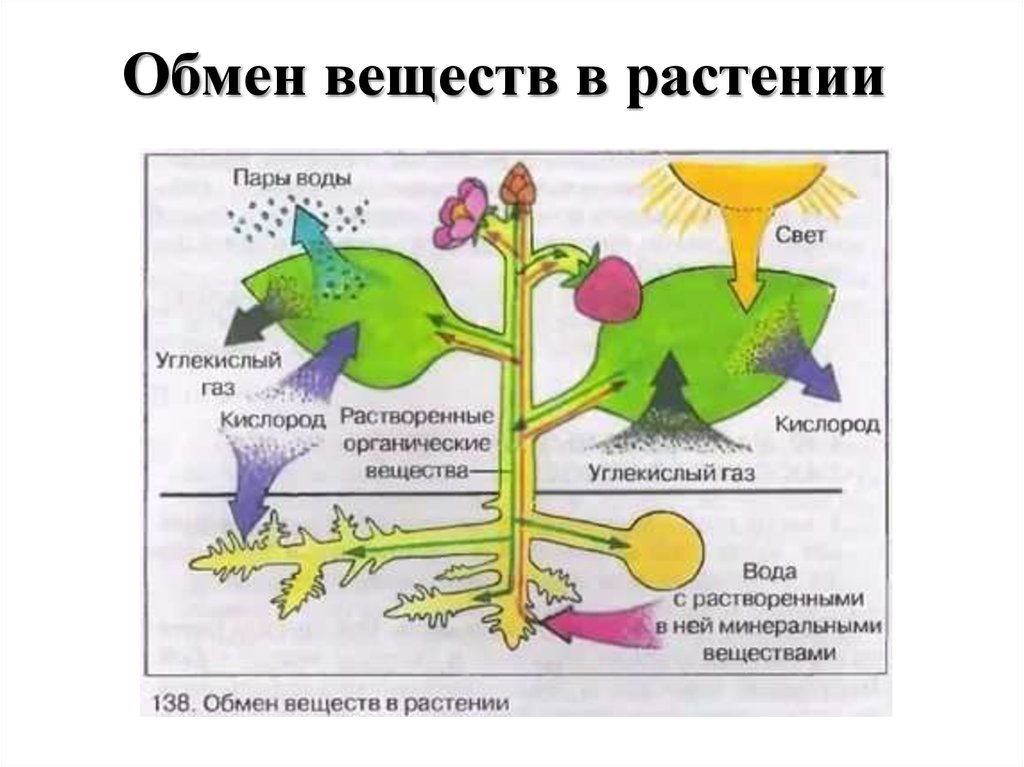 J. Biophys. Struct. Biol., 2, 1-8.
J. Biophys. Struct. Biol., 2, 1-8.
Шугаев А.Г., Шугаева Н.А., Лаштабега Д.А., Выскребенцева Э.И. (2010) Влияние КСl-среды на окисление сукцината и генерацию перекиси водорода в митохондриях корнеплода сахарной свеклы. Физиология растений, 57, 200-208.
Генерозова И.П., Маевская С.Н., Шугаев А.Г. (2009) Ингибирование метаболической активности митохондрий этиолированных проростов гороха, подвергнутых водному стрессу. Физиология растений, 56, 45-52.
Шугаев А.Г., Генерозова И.П, Шугаева Н.А, Выскребенцева Э.И. (2008) Метаболическая активность митохондрий растений в гипертонических растворах сахарозы. Физиология растений, 55, 374-380.
Жигачева И.В., Бурлакова Е.Б, Шугаев А.Г., Генерозова И.П., Фаттахов С.Г., Коновалов А.И. (2008) Фосфорорганический регулятор роста растений: устойчивость клеток растений и животных к стрессовым воздействиям. Биологические мембраны, 25, 183-189.
Жигачева И.В., Фаткуллина Л.Д., Бурлакова Е.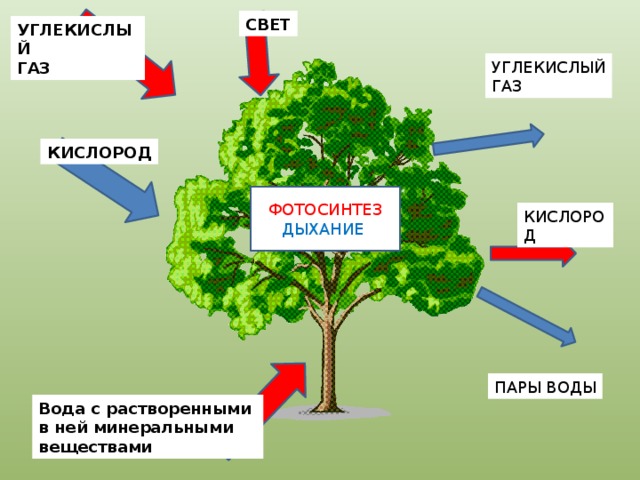 Б, Шугаев А.Г., Генерозова И.П., Фаттахов С.Г., Коновалов А.И. (2008) Влияние фосфорорганического регулятора роста растений на структурнее характеристики мембран растительного и животного происхождения. Биологические мембраны, 25, 150-156.
Б, Шугаев А.Г., Генерозова И.П., Фаттахов С.Г., Коновалов А.И. (2008) Влияние фосфорорганического регулятора роста растений на структурнее характеристики мембран растительного и животного происхождения. Биологические мембраны, 25, 150-156.
Шугаева Н.А., Выскребенцева Э.И., Орехова С.О., Шугаев А.Г. (2007) Влияние водного дефицита на дыхание проводящих пучков листового черешка сахарной свеклы. Физиология растений, 54, 373-380.
Егорова Е.А., Бухов Н.Г., Шугаев А.Г., Лось Д.А. (2006) Влияние экзогенной глюкозы на поток электронов к фотосистеме I и дыхание у клеток цианобактерий. Физиология растений, 53, 336-342.
Шугаев А.Г., Шугаева Н.А., Выскребенцева Э.И. (2006) Цианид- и ротенон-резистентное дыхание митохондрий корнеплода сахарной свеклы в ходе онтогенеза. Физиология растений, 53, 503-510.
Шугаев А.Г., Шугаева Н.А., Выскребенцева Э.И. (2005) Влияние KCl–среды на окисление малата митохондриями корнеплода сахарной свеклы. Физиология растений, 52, 694-700.
Шугаев А.Г., Андреев И.М., Выскребенцева Э.И. (2005) Функциональная идентификация АТФ-чувствительного К+-унипортера в митохондриях корнеплода сахарной свеклы. Физиология растений, 52, 209-215.
Комарова Э.Н., Выскребенцева Э.И., Трунова Т.И. (2003) Активность лектиноподобных белков клеточных стенок и внешних мембран органелл и их связь с эндогенными лигандами в проростках озимой пшеницы. Физиология растений, 50, 511-516.
Vartapetian B.B., Andreeva I.N., Generozova I.P., Polyakova L.I., Maslova I.P., Dolgikh Yu.I., Stepanova A.Yu. (2003) Functional electron microscopy in studies of plant response and adaptation to anaerobic stress. Ann. Bot., 91, 155-172.
Болычевцева Ю.В., Мажoрова Л.Е., Терехова И.В., Егорова Е.А., Шугаев А.Г., Рахимбердиева М.Г., Карапетян Н.В. (2003) Новый тип адаптации цианобактерий Spirulina platensis к условиям освещения. Прикладная биохимия и микробиология, 39, 571-576.
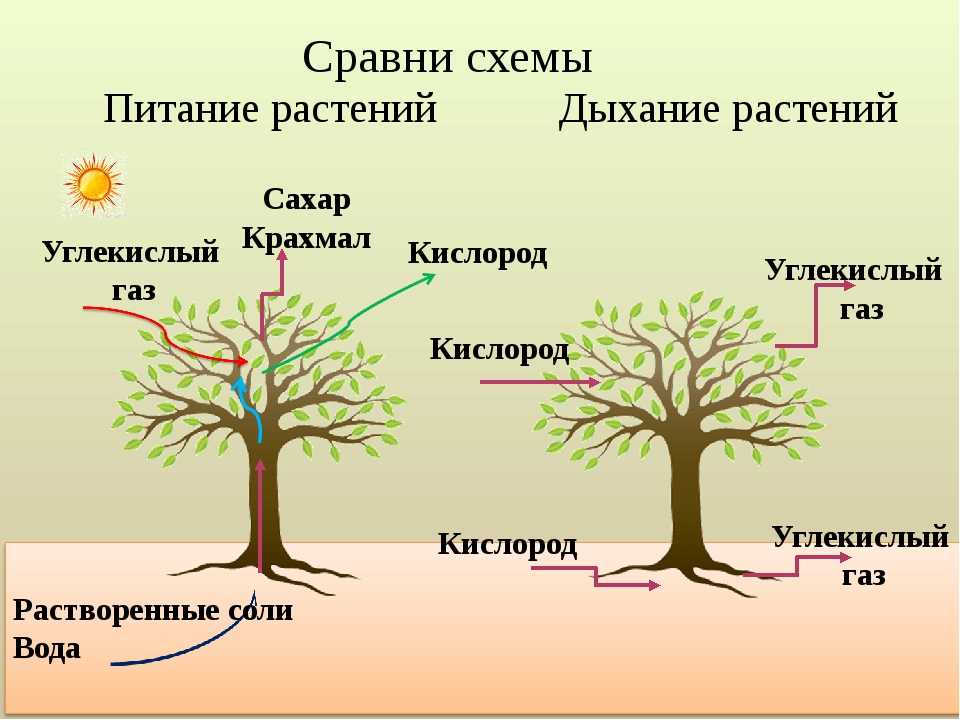
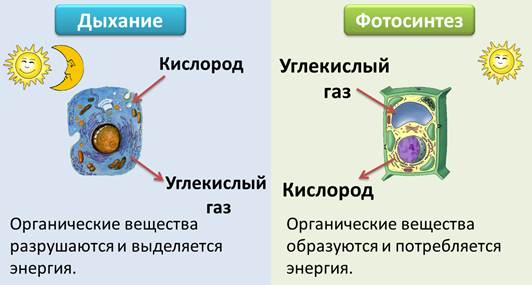
Как растения используют аэробное и анаэробное дыхание?
Кислород является одной из основных потребностей жизни, но вы когда-нибудь задумывались, какова роль кислорода в нашем организме? Почему так важно потреблять кислород? Вот почему мы посвятили этот конкретный ресурс тому, чтобы научить вас, как растения используют кислород и что произойдет, если у них не будет кислорода?
Что такое аэробное дыхание?
Начнем с самых простых. Термин «Аэробное дыхание» относится к набору реакций, происходящих благодаря кислороду. Благодаря кислороду химическая энергия будет преобразована в АТФ ( Аденозинтрифосфат ). Назначение АТФ — перенос энергии в клетку. В некоторых книгах его также называют энергетической валютой для клетки. Без АТФ клетка погибнет, поэтому растения используют аэробное дыхание, чтобы убедиться, что их клетки полны энергии для других целей. Все живые существа осуществляют аэробное дыхание, чтобы жить. Мы подробно поговорим об этом в следующем разделе, как он преобразует химическую энергию в АТФ.
Термин «Аэробное дыхание» относится к набору реакций, происходящих благодаря кислороду. Благодаря кислороду химическая энергия будет преобразована в АТФ ( Аденозинтрифосфат ). Назначение АТФ — перенос энергии в клетку. В некоторых книгах его также называют энергетической валютой для клетки. Без АТФ клетка погибнет, поэтому растения используют аэробное дыхание, чтобы убедиться, что их клетки полны энергии для других целей. Все живые существа осуществляют аэробное дыхание, чтобы жить. Мы подробно поговорим об этом в следующем разделе, как он преобразует химическую энергию в АТФ.
Что такое анаэробное дыхание?
Противоположно аэробному дыханию. Слово «анаэробный» означает отсутствие кислорода. Простыми словами, ряд метаболических реакций протекает без утилизации кислорода. Означает ли это, что клетка не будет генерировать никакой энергии? Нет, он по-прежнему будет давать энергию, но в очень меньшем количестве.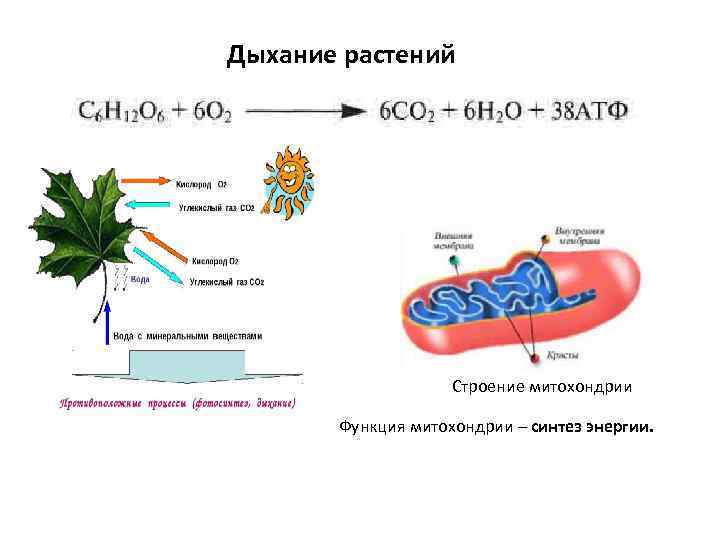 Растения также подвержены анаэробному дыханию. Честно говоря, при анаэробном дыхании не так много реакций, но они дают очень быструю энергию клетке в больших количествах. Растения и микроорганизмы являются лучшими примерами анаэробного дыхания. Многие микроорганизмы содержат сульфат в транспортной цепи (на своем конце), однако некоторые из них используют нитраты.
Растения также подвержены анаэробному дыханию. Честно говоря, при анаэробном дыхании не так много реакций, но они дают очень быструю энергию клетке в больших количествах. Растения и микроорганизмы являются лучшими примерами анаэробного дыхания. Многие микроорганизмы содержат сульфат в транспортной цепи (на своем конце), однако некоторые из них используют нитраты.
Процесс аэробного и анаэробного дыхания
Процесс обоих видов дыхания начинается, когда хлоропласт производит глюкозу с использованием солнечной энергии. Этот процесс известен как фотосинтез . Молекула глюкозы содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Химическая формула глюкозы. Глюкоза является пищей для растений. Эта молекула претерпевает ряд реакций, которые превращают глюкозу в 38 АТФ. Хотя образуется примерно 40 АТФ, в процессе дыхания расходуется 2 собственных АТФ, поэтому образуется 38 АТФ. Глюкоза вступает в реакцию, называемую 9.0007 «Гликолиз» , который превращает молекулы глюкозы в пировиноградную кислоту .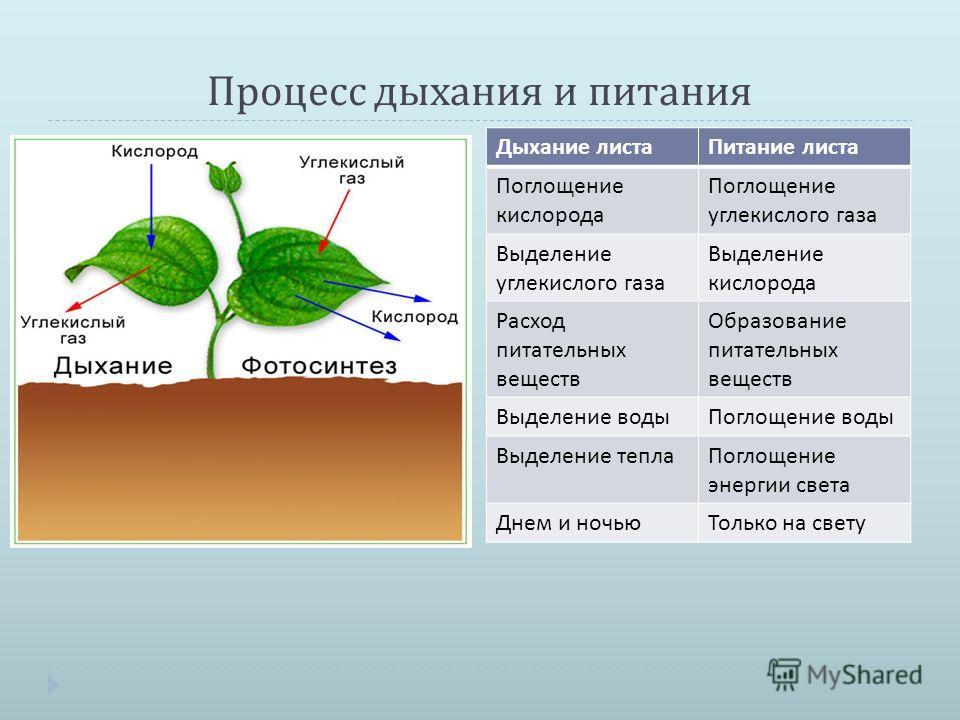 Из одной молекулы глюкозы образуется 2 молекулы пировиноградной кислоты. Это первая фаза как аэробного, так и анаэробного дыхания. Эта реакция также высвобождает еще две вещи: 2 АТФ и . Давайте проследим за АТФ, и поскольку они очень важны, гликолиз производит пировиноградную кислоту с 2 АТФ и . В этой фазе аэробное дыхание отделяется от анаэробного. Обратите внимание, что процесс гликолиза потребляет 2 АТФ.
Из одной молекулы глюкозы образуется 2 молекулы пировиноградной кислоты. Это первая фаза как аэробного, так и анаэробного дыхания. Эта реакция также высвобождает еще две вещи: 2 АТФ и . Давайте проследим за АТФ, и поскольку они очень важны, гликолиз производит пировиноградную кислоту с 2 АТФ и . В этой фазе аэробное дыхание отделяется от анаэробного. Обратите внимание, что процесс гликолиза потребляет 2 АТФ.
Для аэробного дыхания
Для аэробного дыхания есть два условия, и оба должны быть выполнены. Если один из них не выполняется, то аэробного дыхания не будет. Первое условие довольно простое, должен быть кислород для аэробного дыхания. Второе условие – потребность митохондрий. На приведенном выше рисунке показаны митохондрии. Как только пировиноградная кислота попадает в перимитохондриальное пространство (межмембранное пространство), она превращается в ацетил-коэнзим А (ацетил-Ко-А) . Эта реакция происходит только в этой области, потому что фермент, который превращает пировиноградную кислоту в ацетил-Ко-А, доступен только в этой области.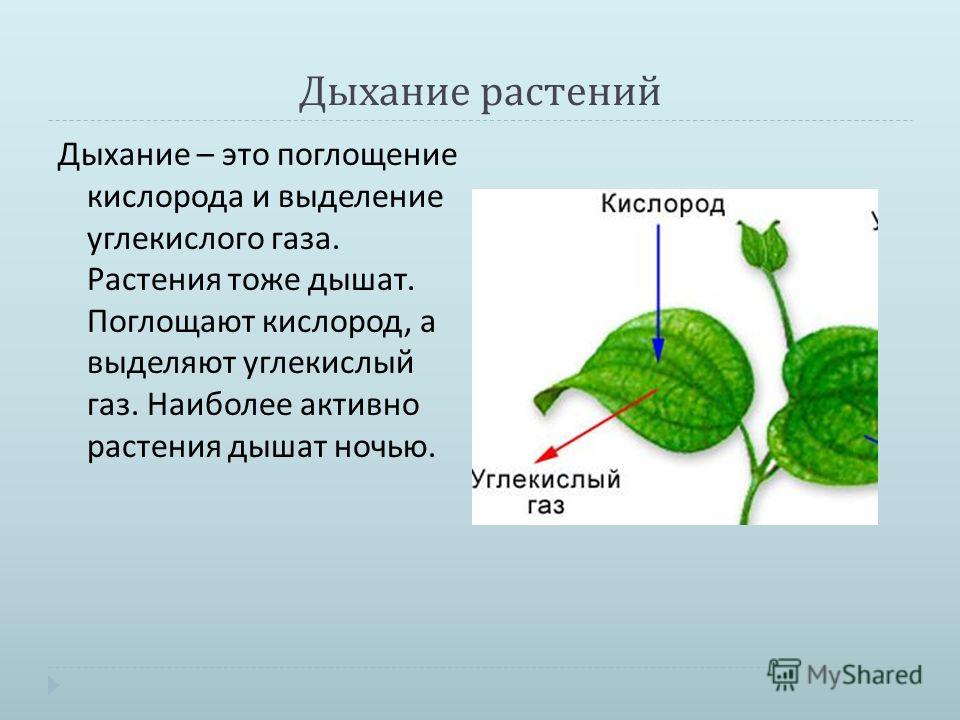 Эта реакция выпустит еще 2 . До сих пор у нас есть 2 ATP и . Теперь ацетил-Ко-А будет перенесен в матрикс митохондрий, где происходит наиболее важная реакция, известная как цикл Кребса . Цикл Кребса высвободит и 2 GTP ( Гуанозин-5′-трифосфат ). GTP играет очень важную роль в синтезе РНК в процессе транскрипции. Он используется в качестве источника энергии, который связывает амино-связанную тРНК с А-сайтом рибосомы. Поскольку он также является источником энергии, мы можем сказать, что в данном случае ГТФ равен АТФ, что означает образование цикла Кребса и 2 АТФ. Это вторая фаза аэробного дыхания. После цикла Кребса у нас остается 4 АТФ и , и , вопрос в том, что этот процесс высвобождает 38 АТФ, где остальные 34 АТФ? Ответ с помощью кристы . Следующим шагом является преобразование и в АТФ, и именно здесь начинается роль крист. Процесс преобразования и в АТФ называется Электронно-транспортная система (ETS) . В ходе этого процесса производится 3 АТФ и производится 2 АТФ.
Эта реакция выпустит еще 2 . До сих пор у нас есть 2 ATP и . Теперь ацетил-Ко-А будет перенесен в матрикс митохондрий, где происходит наиболее важная реакция, известная как цикл Кребса . Цикл Кребса высвободит и 2 GTP ( Гуанозин-5′-трифосфат ). GTP играет очень важную роль в синтезе РНК в процессе транскрипции. Он используется в качестве источника энергии, который связывает амино-связанную тРНК с А-сайтом рибосомы. Поскольку он также является источником энергии, мы можем сказать, что в данном случае ГТФ равен АТФ, что означает образование цикла Кребса и 2 АТФ. Это вторая фаза аэробного дыхания. После цикла Кребса у нас остается 4 АТФ и , и , вопрос в том, что этот процесс высвобождает 38 АТФ, где остальные 34 АТФ? Ответ с помощью кристы . Следующим шагом является преобразование и в АТФ, и именно здесь начинается роль крист. Процесс преобразования и в АТФ называется Электронно-транспортная система (ETS) . В ходе этого процесса производится 3 АТФ и производится 2 АТФ.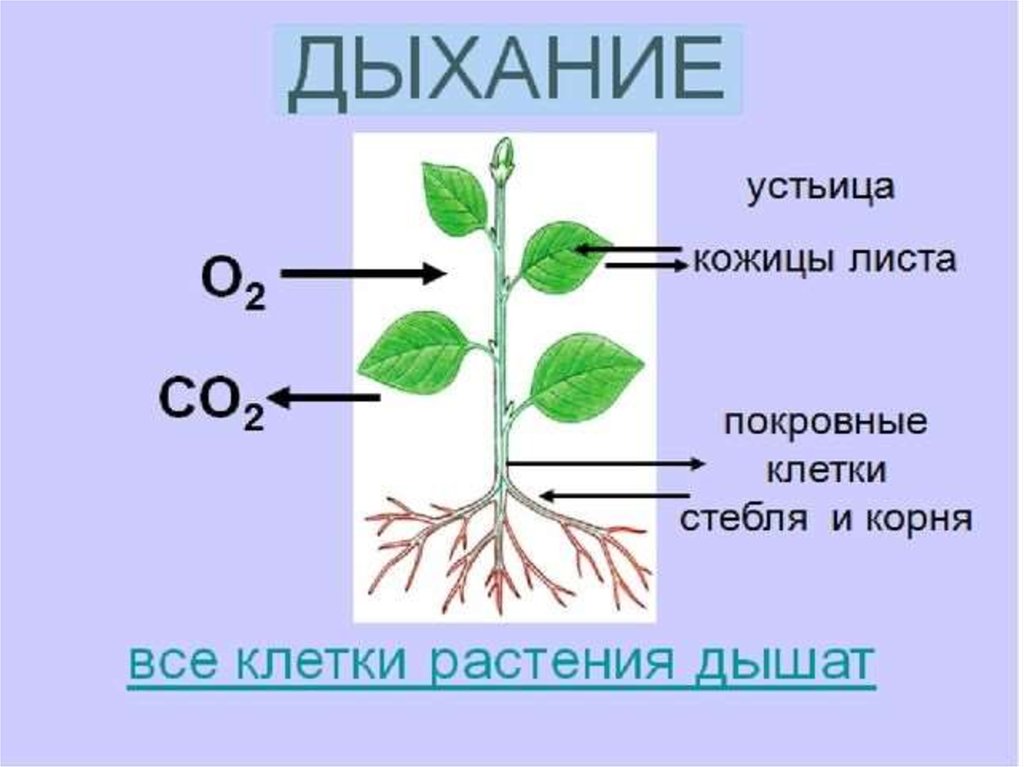 Весь процесс высвобождается и, посчитаем, насколько они эквивалентны АТФ. означает 30 АТФ и означает 4 АТФ, всего вместе у нас есть 34 АТФ. Рассчитаем общее количество АТФ, образующихся при аэробном дыхании. 2 АТФ образовались в ходе гликолиза, 2 АТФ образовались в результате цикла Кребса и 34 АТФ образовались путем превращения и в АТФ в кристах. Если суммировать все АТФ, то получится 38 АТФ, и именно так происходит аэробное дыхание.
Весь процесс высвобождается и, посчитаем, насколько они эквивалентны АТФ. означает 30 АТФ и означает 4 АТФ, всего вместе у нас есть 34 АТФ. Рассчитаем общее количество АТФ, образующихся при аэробном дыхании. 2 АТФ образовались в ходе гликолиза, 2 АТФ образовались в результате цикла Кребса и 34 АТФ образовались путем превращения и в АТФ в кристах. Если суммировать все АТФ, то получится 38 АТФ, и именно так происходит аэробное дыхание.
Для анаэробного дыхания
После реакции гликолиза мы получили пировиноградную кислоту. Поскольку нет ни митохондрий, ни кислорода, ни даже того и другого, продукты будут разными, и будет производиться разное количество АТФ. Пировиноградная кислота превратится в этанол и углекислый газ при использовании . В случае животной клетки она будет производить молочную кислоту. Гликолиз распадается на пировиноградную кислоту и не требует кислорода. Это уже часть анаэробной, поэтому первая фаза пройдет без проблем. Подсчитаем АТФ, образующиеся при этом дыхании.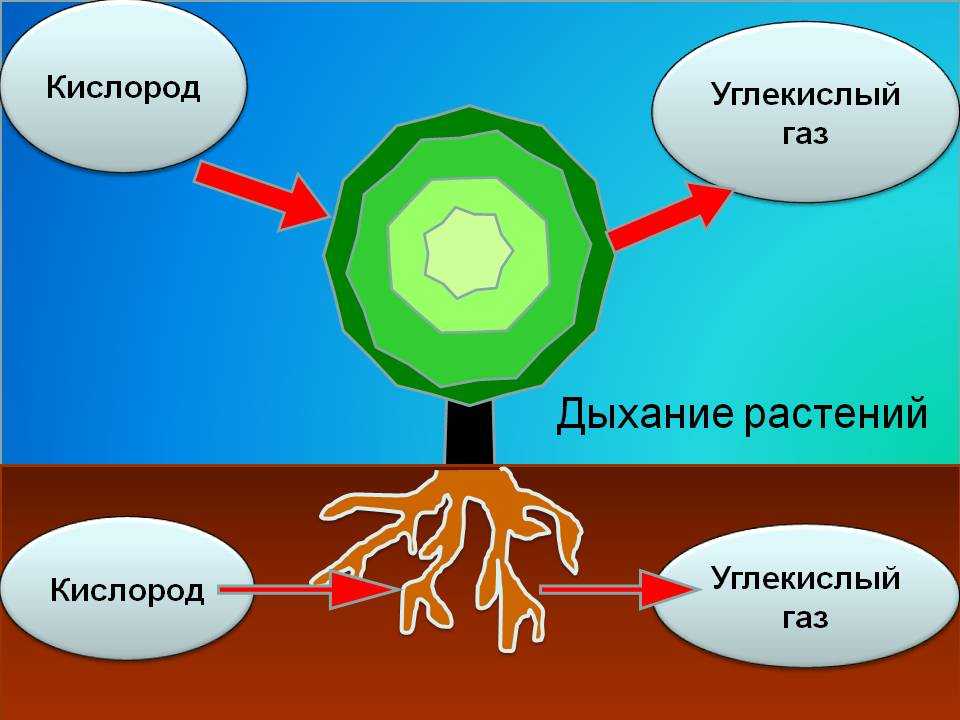 Гликолиз производит 2 АТФ, а превращение пировиноградной кислоты в этанол и углекислый газ не высвобождает АТФ, поэтому у нас остается только 2 АТФ. Короче говоря, анаэробное дыхание производит только 2 АТФ. Если присутствуют и митохондрии, и кислород, то предпочтение будет отдаваться аэробному дыханию, однако при отсутствии любого из них предпочтение отдается анаэробному дыханию.
Гликолиз производит 2 АТФ, а превращение пировиноградной кислоты в этанол и углекислый газ не высвобождает АТФ, поэтому у нас остается только 2 АТФ. Короче говоря, анаэробное дыхание производит только 2 АТФ. Если присутствуют и митохондрии, и кислород, то предпочтение будет отдаваться аэробному дыханию, однако при отсутствии любого из них предпочтение отдается анаэробному дыханию.
Уравнение слова для аэробного/анаэробного дыхания?
В обоих процессах используются одни и те же реагенты, но разные продукты из-за разных условий. При аэробном дыхании глюкоза расщепляется на углекислый газ и воду.
Это общее уравнение клеточного дыхания. Это означает, что после реакции в цитопласте, митохондриях и ЭТС это продукты. После балансировки уравнения оно показывает, что шесть молей глюкозы реагируют с шестью молями кислорода с выделением шести молей углекислого газа и шести молей воды с тридцатью восемью АТФ. Ниже приведено уравнение анаэробного дыхания.
Это может показаться простым, но это не так. Аэробное дыхание проходит через ряд метаболических реакций, о которых следует рассказать подробнее. Каждый шаг в аэробной реакции содержит множество реакций, которые будут слишком сложны для данного ресурса, давайте просто упростим этот.
Аэробное дыхание проходит через ряд метаболических реакций, о которых следует рассказать подробнее. Каждый шаг в аэробной реакции содержит множество реакций, которые будут слишком сложны для данного ресурса, давайте просто упростим этот.
Разница между аэробным и анаэробным дыханием
Реакции с кислородом и без кислорода — не единственное различие в обоих процессах дыхания, это еще несколько различий. Ниже приведена таблица, в которой показаны различия.
| База сравнения | Аэробное дыхание | Анаэробное дыхание |
|---|---|---|
| Продукты общей реакции | Потребляет шесть молей глюкозы и кислорода для выделения шести молей углекислого газа и воды | Потребляет один моль глюкозы и НАДН для производства двух молей этанола и двух молей углекислого газа |
| Потребность в кислороде | Для этого процесса требуется кислород | Этот процесс не требует кислорода |
| Произведенная энергия | 38 Энергия, эквивалентная АТФ, производится | 2 Энергия на сумму АТФ производится |
| Замена газа | Поглощение кислорода и выделение углекислого газа | Газ не поглощается, однако некоторые газы выделяются в зависимости от микроорганизма |
| Место реакции | Все метаболические реакции протекают в цитоплазме и митохондриях | Все реакции происходят в цитоплазме клетки |
| Окисление | Происходит полный процесс окисления с превращением углеводов в энергию | Из-за отсутствия кислорода происходит неполный процесс окисления.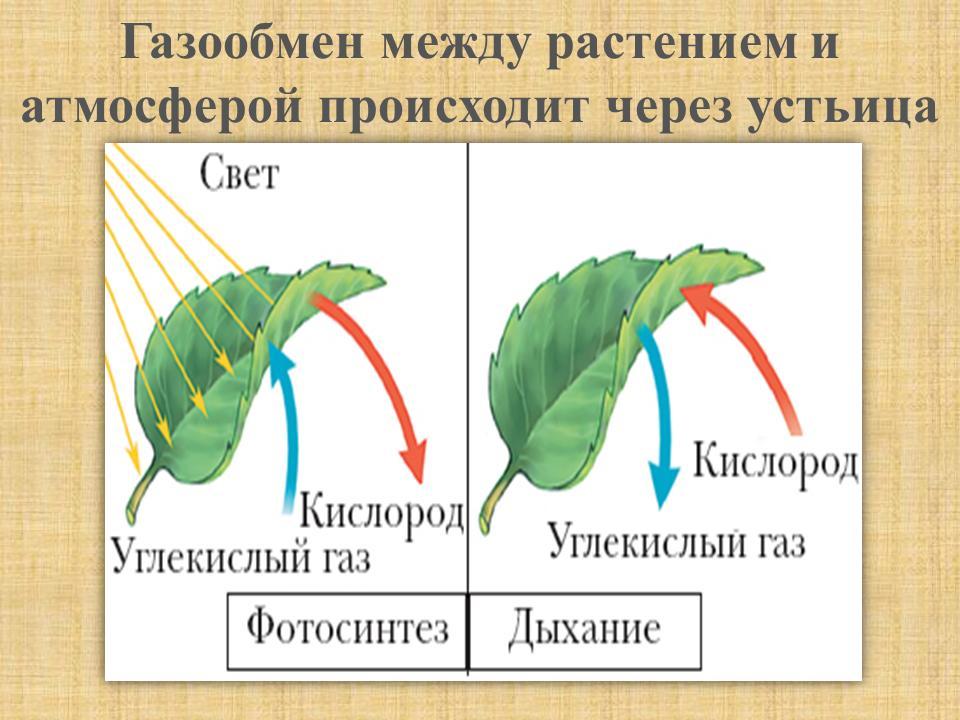 |
| Время реакции | Поскольку происходит много реакций и производится большое количество энергии, это требует много времени | Быстрые реакции |
| Происходит | Этот процесс встречается у всех высших живых организмов | В основном встречается у примитивных прокариот. Однако млекопитающие также подвергаются этому процессу во время экстремальных движений 90–080. |
Заключение
Приведенное выше описание процесса представляет собой краткое изложение аэробного и аэробного дыхания. Аэробное и анаэробное дыхание — очень сложные процессы дыхания. На самом деле, существует огромная блок-схема их обоих с их промежуточными продуктами, для понимания которой требуется много времени. Аэробное дыхание очень распространено и встречается у многих живых существ, однако анаэробное дыхание используется на промышленном уровне для производства этанола и молочной кислоты. Эта область называется биохимической инженерией, и давайте поговорим о ней в следующий раз.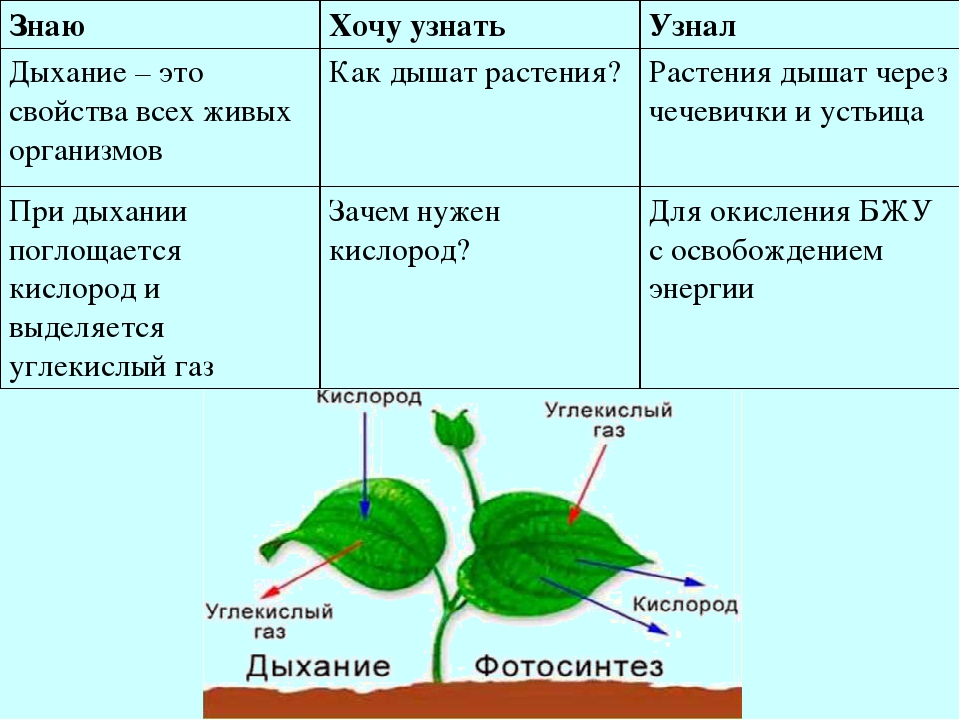
Когда дышат растения
Это основной вопрос при рассмотрении дыхания растений. Поскольку у растений нет специализированных органов, таких как легкие, мы можем заключить, что они не дышат, а скорее дышат. Растения дышат чечевицами и устьицами (на стеблях и листьях имеются отдельные чечевицы и устьица), выполняющими функцию газообмена.
Типы дыхания
Существует два типа дыхания, которые мы классифицируем в зависимости от наличия или отсутствия кислорода:
Аэробная дыхательная система
Аэробное дыхание относится к дыханию, которое происходит в присутствии кислорода, поскольку «воздух» содержит кислород. Аэробное дыхание — это процесс, посредством которого кислород используется для разрыва химических связей в глюкозе, высвобождая большое количество энергии. Это основной источник энергии для растений. Аэробы – это животные и растения, которые дышат кислородом. Большинство существ дышат аэробно.
C6h22O6+6O2 ⟶ 6CO2 + 6h3O + Энергия
Без кислорода не может существовать ни один организм, получающий энергию посредством аэробного дыхания. Это потому, что в этом районе нет кислорода; они не могут получать энергию из потребляемой пищи. Аэробное дыхание требует больше энергии, так как включает полное расщепление глюкозы с использованием кислорода.
Это потому, что в этом районе нет кислорода; они не могут получать энергию из потребляемой пищи. Аэробное дыхание требует больше энергии, так как включает полное расщепление глюкозы с использованием кислорода.
Система анаэробного дыхания
Анаэробное дыхание — это процесс дыхания, происходящий в отсутствие кислорода. Углекислый газ CO2 и спирт используются для создания неполного окисления пищевых компонентов в этом методе (ОН). Кроме того, образуются другие органические соединения, такие как лимонная кислота, щавелевая кислота и молочная кислота.
Это также называется внутримолекулярным дыханием. У таких видов, как дрожжи, некоторые бактерии и паразитические черви, происходит анаэробное дыхание. Анаэробные животные и растения — это те, которые могут выживать и производить энергию в отсутствие кислорода.
Глюкоза ⟶ Спирт + CO2 + (Энергия)
Дрожжи — это одноклеточный грибок. Одна клетка представляет весь организм у дрожжей. Этот метод производит незначительное количество энергии. Дрожжи дышат анаэробно, и в ходе этого процесса глюкоза превращается в спирт. В результате он используется для производства вина, хлеба и других продуктов.
Дрожжи дышат анаэробно, и в ходе этого процесса глюкоза превращается в спирт. В результате он используется для производства вина, хлеба и других продуктов.
При анаэробном дыхании выделяется значительно меньше энергии, чем при аэробном дыхании, поскольку анаэробное дыхание является единственным типом дыхания, происходящим в отсутствие кислорода. Все организмы, получающие энергию за счет анаэробного дыхания, способны выжить в отсутствие кислорода.
Например, дрожжи — это существа, которые могут выжить без кислорода из воздуха, потому что получают энергию за счет анаэробного дыхания. Дрожжи могут выжить без кислорода.
Значение температуры воздуха
Дыхание растений происходит 24 часа в сутки, но более выражено ночью, когда фотосинтез приостанавливается. Ночью температура должна быть ниже, чем днем, так как растения могут переносить стресс. Рассмотрим бегуна, соревнующегося в марафоне. Бегун дышит быстрее, чем человек, стоящий на месте; в результате у бегуна учащается дыхание и повышается температура его тела. Аналогичная концепция применима к растениям; при повышении температуры в ночное время увеличивается частота дыхания и, следовательно, повышается температура. Это действие может привести к повреждению цветков и задержке роста растений.
Аналогичная концепция применима к растениям; при повышении температуры в ночное время увеличивается частота дыхания и, следовательно, повышается температура. Это действие может привести к повреждению цветков и задержке роста растений.
Корневое дыхание
Дыхание растений происходит с помощью корней. В почве насыщенный кислородом воздух уже существует в щелях между частицами. Этот кислород впоследствии попадает в корни через корневые волоски. Корневые волоски находятся в непосредственном контакте с ними. Действительно, корневой волосок представляет собой трубчатое расширение наружных эпидермальных клеток корня. Внутри частиц почвы кислород диффундирует в корневые волоски. Кислород распределяется по всем участкам корней через корневые волоски для дыхания. В процессе дыхания кислород превращается в углекислый газ, который выбрасывается из корней теми же корневыми волосками, которые инициируют процесс.
Если растение в горшке чрезмерно поливать в течение длительного времени, оно в конце концов погибнет.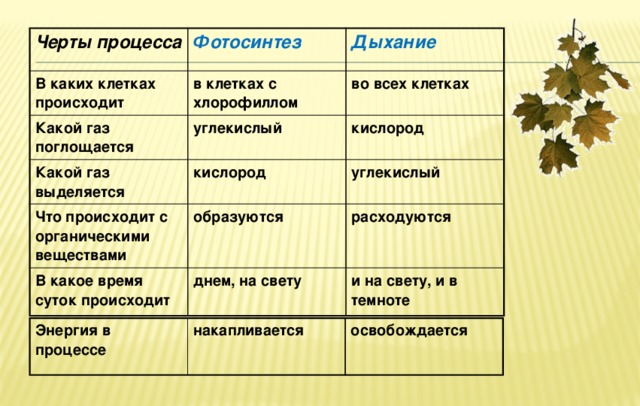 Это связано с тем, что чрезмерное количество воды изгоняет весь воздух, находящийся между частицами почвы. В результате кислород не доступен для корней для аэробного дыхания. В таких ситуациях корни растений дышат анаэробно, производя спирт. Это может быть фатальным для растения. На ранних стадиях прорастания семена дышат анаэробно, потому что они имеют семенную оболочку, препятствующую проникновению кислорода.
Это связано с тем, что чрезмерное количество воды изгоняет весь воздух, находящийся между частицами почвы. В результате кислород не доступен для корней для аэробного дыхания. В таких ситуациях корни растений дышат анаэробно, производя спирт. Это может быть фатальным для растения. На ранних стадиях прорастания семена дышат анаэробно, потому что они имеют семенную оболочку, препятствующую проникновению кислорода.
Растения дышат днем и ночью, выделяя при этом углекислый газ. Хотя общее количество углекислого газа CO2, выделяемого в течение дня, ничтожно мало по сравнению с количеством кислорода, образующегося при фотосинтезе. В результате следует избегать ночного сна под деревом.
Дыхание стволовых клеток
У растений со стеблями трав газообмен происходит через устьица, а образующийся при этом углекислый газ CO2 диффундирует в воздух исключительно через устьица. В то время как у растений с жесткими и одеревеневшими стеблями газообмен происходит через чечевички.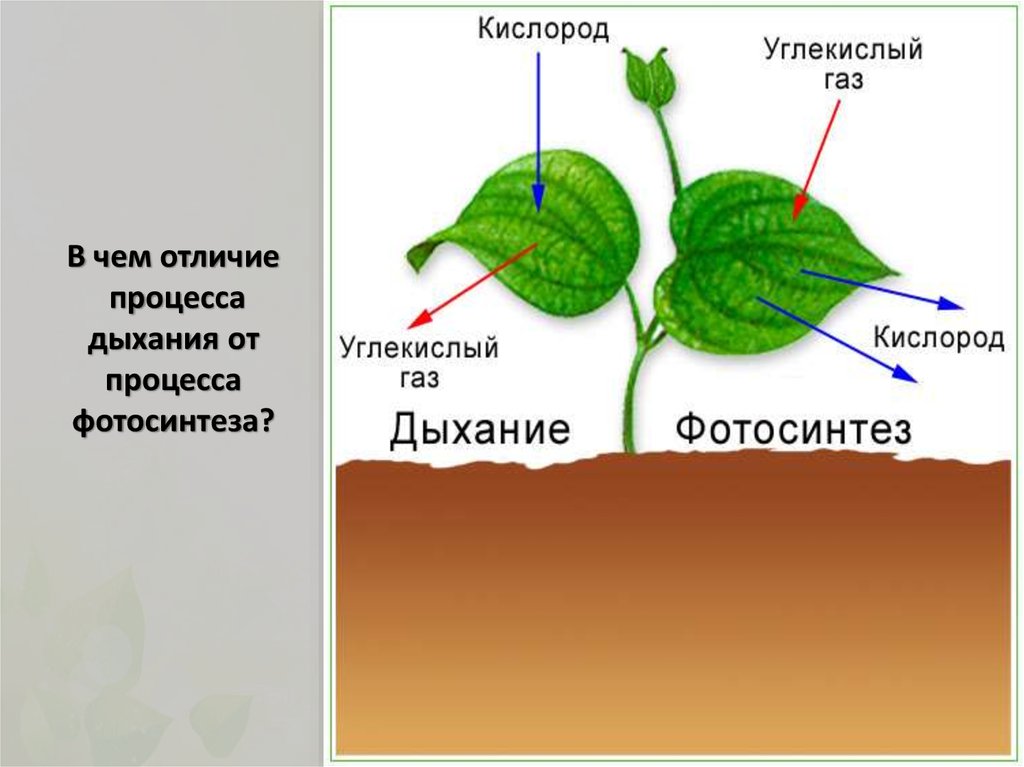 Чечевицы часто представляют собой рыхлые мертвые клетки, которые можно найти в коре древесных растений в виде небольших отверстий. Они позволяют кислороду диффундировать в межклеточные щели тканей, а углекислому газу (СО2) выходить в атмосферу, завершая процесс дыхания в стеблях.
Чечевицы часто представляют собой рыхлые мертвые клетки, которые можно найти в коре древесных растений в виде небольших отверстий. Они позволяют кислороду диффундировать в межклеточные щели тканей, а углекислому газу (СО2) выходить в атмосферу, завершая процесс дыхания в стеблях.
Дыхание листьев
В листьях дыхательные газы обмениваются через очень маленькие поры, называемые устьицами. На нижних листьях растения много устьиц. Каждая стома содержит небольшую пору в центре, которая окружена и регулируется двумя почковидными клетками, называемыми замыкающими клетками. Когда устьица открываются, газы обмениваются между атмосферой и внутренней частью листа посредством диффузии, завершая процесс дыхания в листьях.
Заключение
Дыхание корней особенно важно в органическом производстве, поскольку корневая зона густо заселена природными бактериями, которые превращают органические питательные вещества в полезные ионы. Поскольку этим микроорганизмам для функционирования и дыхания требуется кислород, субстрат должен поддерживать достаточный запас кислорода как для корней, так и для микроорганизмов.

 При этом, необходимым условием такой пермеаблизации мембраны являлось существенное увеличение под влиянием фитогормона генерации АФК дыхательной цепью и возникновение окислительного стресса.
При этом, необходимым условием такой пермеаблизации мембраны являлось существенное увеличение под влиянием фитогормона генерации АФК дыхательной цепью и возникновение окислительного стресса.
 Высказывается предположение, что защитные свойства препарата ТНКЖтио обусловлены его способностью предотвращать ПОЛ.
Высказывается предположение, что защитные свойства препарата ТНКЖтио обусловлены его способностью предотвращать ПОЛ.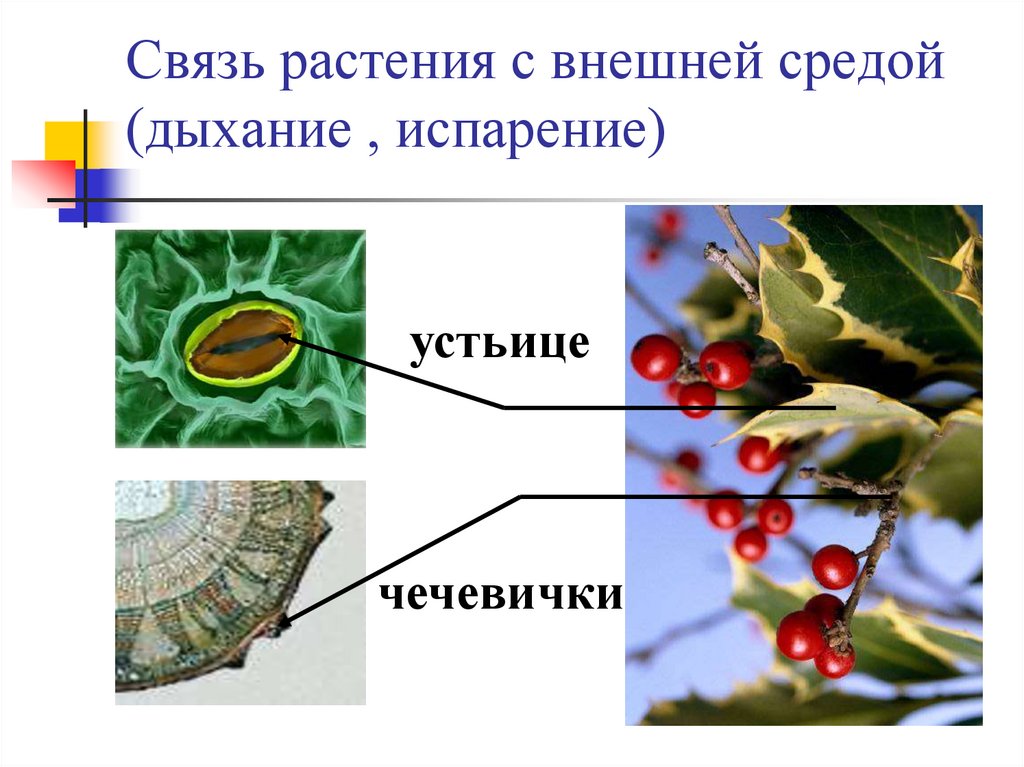 С. «Характеристика пролин-специфичной аминопептидазы из одноклеточной водоросли Sinechocyctis sp. PCC 6803», также по специальности 03.01.05 — физиология и биохимия растений
С. «Характеристика пролин-специфичной аминопептидазы из одноклеточной водоросли Sinechocyctis sp. PCC 6803», также по специальности 03.01.05 — физиология и биохимия растений