Синтез АТФ в клетке. Где синтезируется атф у растений
Синтез АТФ в клетке
Аденозинтрифосфорная кислота-АТФ - обязательный энергетический компонент любой живой клетки. АТФ также нуклеотид, состоящий из азотистого основания аденина, сахара рибозы и трех остатков молекулы фосфорной кислоты. Это неустойчивая структура. В обменных процессах от нее последовательно отщепляются остатки фосфорной кислоты путем разрыва богатой энергией, но непрочной связи между вторым и третьим остатками фосфорной кислоты. Отрыв одной молекулы фосфорной кислоты сопровождается выделением около 40 кДж энергии. В этом случае АТФ переходит в аденозиндифосфорную кислоту (АДФ), а при дальнейшем отщеплении остатка фосфорной кислоты от АДФ образуется аденозинмонофосфорная кислота (АМФ).
Схема строения АТФ и превращения ее в АДФ (Т.А. Козлова, В.С. Кучменко. Биология в таблицах. М.,2000)
АДФ Следовательно, АТФ - своеобразный аккумулятор энергии в клетке, который "разряжается" при ее расщеплении. Распад АТФ происходит в процессе реакций синтеза белков, жиров, углеводов и любых других жизненных функций клеток. Эти реакции идут с поглощением энергии, которая извлекается в ходе расщепления веществ.
АТФ синтезируется в митохондриях в несколько этапов. Первый из них - подготовительный - протекает ступенчато, с вовлечением на каждой ступени специфических ферментов. При этом сложные органические соединения расщепляются до мономеров: белки - до аминокислот, углеводы - до глюкозы, нуклеиновые кислоты - до нуклеотидов и т. д. Разрыв связей в этих веществах сопровождается выделением небольшого количества энергии. Образовавшиеся мономеры под действием других ферментов могут претерпеть дальнейший распад с образованием более простых веществ вплоть до диоксида углерода и воды.
Схема Синтез АТФ в мвтохондрии клетки
ПОЯСНЕНИЯ К СХЕМЕ ПРЕВРАЩЕНИЕ ВЕЩЕСТВ И ЭНЕРГИИ В ПРОЦЕССЕ ДИССИМИЛЯЦИИ
I этап - подготовительный: сложные органические вещества под действием пищеварительных ферментов распадаются на простые, при этом выделяется только тепловая энергия. Белки ->аминокислоты Жиры-> глицерин и жирные кислоты Крахмал ->глюкоза
II этап-гликолиз (бескислородный): осуществляется в гиалоплазме, с мембранами не связан; в нем участвуют ферменты; расщеплению подвергается глюкоза: У дрожжевых грибов молекула глюкозы без участия кислорода превращается в этиловый спирт и диоксид углерода (спиртовое брожение): У других микроорганизмов гликолиз может завершаться образованием ацетона, уксусной кислоты и т, д. Во всех случаях распад одной молекулы глюкозы сопровождается образованием двух молекул АТФ. В ходе бескислородного расщепления глюкозы в виде химической связи в молекуле АТФ сохраняется 40% анергии, а остальная рассеивается в виде теплоты.
III этап-гидролиз (кислородный): осуществляется в митохондриях, связан с матриксом митохондрий и внутренней мембраной, в нем участвуют ферменты, расщеплению подвергается молочная кислота: СзН6Оз+ЗН20 -->3СО2+ 12Н. С02 (диоксид углерода) выделяется из митохондрий в окружающую среду. Атом водорода включается в цепь реакций, конечный результат которых - синтез АТФ. Эти реакции идут в такой последовательности:
1. Атом водорода Н с помощью ферментов-переносчиков поступает во внутреннюю мембрану митохондрий, образующую кристы, где он окисляется: Н-е-->H+ 2. Протон водорода H+ (катион) выносится переносчиками на наружную поверхность мембраны крист. Для протонов эта мембрана непроницаема, поэтому они накапливаются в межмембранном пространстве, образуя протонный резервуар.
3. Электроны водорода e переносятся на внутреннюю поверхность мембраны крист и тут же присоединяются к кислороду с помощью фермента оксидазы, образуя отрицательно заряженный активный кислород (анион): O2 + е-->O2-
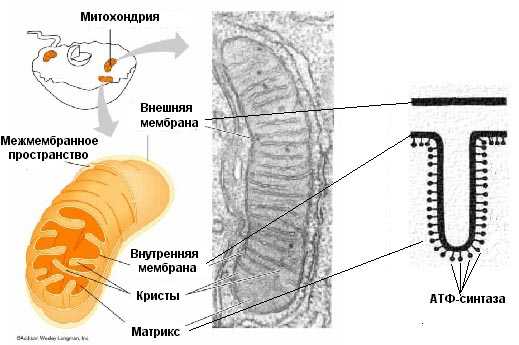
4. Катионы и анионы по обе стороны мембраны создают разноименно заряженное электрическое поле, и когда разность потенциалов достигнет 200 мВ, начинает действовать протонный канал. Он возникает в молекулах ферментов АТФ-синтетаз, которые встроены во внутреннюю мембрану, образующую кристы.
5. Через протонный канал протоны водорода H+ устремляются внутрь митохондрий, создавая высокий уровень энергии, большая часть которой идет на синтез АТФ из АДФ и Ф (АДФ+Ф-->АТФ), а протоны H+ взаимодействуют с активным кислородом, образуя воду и молекулярный 02:( 4Н++202- -->2Н20+02)
Таким образом, О2, поступающий в митохондрии в процессе дыхания организма, необходим для присоединения протонов водорода Н. При его отсутствии весь процесс в митохондриях прекращается, так как электронно-транспортная цепь перестает функционировать. Общая реакция III этапа: (2СзНбОз + 6Oз + 36АДФ + 36Ф ---> 6С02 + 36АТФ + +42Н20)
В результате расщепления одной молекулы глюкозы образуются 38 молекул АТФ: на II этапе - 2 АТФ и на III этапе - 36 АТФ. Образовавшиеся молекулы АТФ выходят за пределы митохондрии и участвуют во всех процессах клетки, где необходима энергия. Расщепляясь, АТФ отдает энергию (одна фосфатная связь заключает 40 кДж) и в виде АДФ и Ф (фосфата) возвращается в митохондрии.
www.examen.ru
АТФ-синтез | Учеба-Легко.РФ - крупнейший портал по учебе
Сегодня мы рассмотрим некоторые молекулярные машины. Первая из них называется АТФ-синтаза. Она занимается в митохондриях синтезом аденозинтрифосфорной кислоты (АТФ). Напомню, что АТФ – это молекула, которая обеспечивает клетку энергией (рис. 5).
Для нас сейчас важно, зато молекула аденозинтрифосфорной кислоты содержит так называемую макроэргическую связь. Реакция синтеза представлена на схеме.
АДФ+Ф ==> АТФ +h3O
Из аденозиндифосфата и фосфата получается АТФ, при этом образуется так называемая макроэргическая связь, и на ее образование затрачивается 30,6 кДж/моль (7,3 ккал/моль). АТФ обеспечивает энергией большинство происходящих в клетке процессов, так как при гидролизе макроэргической связи запасенная в ней энергия освобождается.
Как же синтезируется эта молекула, то есть, как образуется макроэргическая связь между фосфатами? Это было одно время загадкой. Существовало предположение о том, что есть какое-то вещество Х, химический посредник, осуществляет связь между процессами, дающими энергию, то есть окислением питательных веществ до СО2 и Н2О, и каким –то образом энергия окисления (в своем роде медленное "горение" внутри организма) переходит в энергию макроэргической связи в молекуле АТФ. Это предположение о наличии химического посредника, которого никто найти не мог, называлось гипотезой химического сопряжения (рис. 6).
Но в 1961 г. английский ученый Питер Митчелл предложил другое объяснение – хемиосмотическую гипотезу (подробнее мы о ней будем говорить позже), которая заключается в том, что вода, которая образуется в процессе окисления, образуется не в виде молекулы воды, а виде протона H+ и иона гидроксила OH–. Энергия, получаемая при окислении, идет на то, чтобы продукты реакции – протон и гидроксил – разделить в пространстве. Протон выбрасывается из митохондрий через внутреннюю мембрану в межмембранное пространство (сам по себе протон не может проникнуть через мембрану митохондрии, эта мембрана непроницаема для заряженных частиц), и гидроксогруппы, которая остается внутри митохондрии.

В результате возникает разница концентраций ионов водорода (∆рН – то есть кислотности среды) и разница потенциала: положительные заряды снаружи митохондриальной мембраны, а отрицательный внутри. Напомним, что у митохондрий 2 мембраны, причем внешняя в энергетических процессах такой важной роли, как внутренняя, не играет. То есть энергия, полученная при окислении, запасена в виде электрохимической энергии. Электрический потенциал на мембране митохондрий достигает 200 милливольт, а толщина мембраны не превышает 10 нм.
Питер Митчелл первый высказал предположение о том, что химические реакции в клетке пространственно упорядочены, и продукты реакции распределяются асимметрично: протон в одну сторону, гидроксил в другую. За счет этого появляется электрохимический потенциал на мембране (обозначается Δμн). Он состоит из химической (∆рН – разница в концентрации протонов) и электрической (Δφ – разница в величине заряда) компоненты Δμн=∆рН + Δφ. Электрохимический потенциал на мембране митохондрий – универсальная форма запасания энергии клеткой.
Протоны могут перекачиваться через мембрану и при фотосинтезе в хлоропластах или в клетках фотосинтезирующих бактерий (Рис. 8).
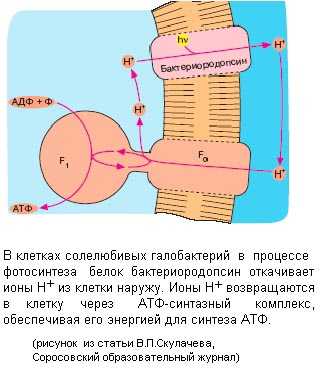
На рисунке представлена довольно простая система бактериального фотосинтеза, сопряженного с синтезом АТФ на примере галобактерий. Галобактерии живут в Мертвом море. Море настолько соленое, что соль выпадает в осадок, но в таких экстремальных условиях галобактерии прекрасно себя чувствуют. Галобактерии используют фотосинтез для получения энергии. Белок бактериородопсин под действием света выкачивает протоны изнутри бактериальной клетки наружу, и на мембране снаружи избыток протонов, и, соответственно, образуется положительный заряд. То есть в данном случае электрохимический потенциал на мембране бактерии возникает не за счет окисления веществ в процессе дыхания, а за счет работы, связанной со световой энергией.
Если протон "падает" сквозь мембрану внутрь митохондрии, при этом его потенциальная энергия уменьшается, так как он "падает" в электрическом поле от положительного заряда к отрицательному, и вдобавок по градиенту концентрации. Эта энергия используется для синтеза АТФ. И далее пойдет речь о том, как это происходит.
Синтезом АТФ занимается молекулярная машина, которая называется АТФ-синтаза. Она состоит из двух частей. Первая погружена в мембрану называется F0 (см. рисунок). Она представляет собой протонный канал, то есть это дыра в мембране, по которой протон может попасть внутрь митохондрии, но попадает он внутрь с потерей энергии, которую улавливает вторая часть молекулярной машины, которая называется F1. Эта часть АТФ-синтазы торчит внутрь митохондрии и использует энергию "падающих" через F0 протонов для того, чтобы аденозиндифосфат соединился с фосфатом посредством макроэргической связи и образовал молекулу АТФ.
Рассмотрим, как АТФ-синтаза синтезирует АТФ. Оказывается, что прежде всего совершается работа механическая, так как для осуществления синтеза АТФ в АТФ-синтазе крутится белковая структура. Как устроена АТФ-синтаза?
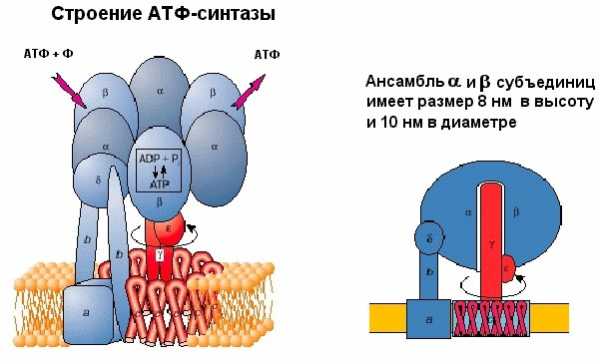
Она состоит из двух частей – статора (на рисунке 9 помечено синим цветом), и ротора (обозначен красным). Статор состоит из трех альфа субъединиц и трех бета субъединиц – они занимаются химической частью работы: синтезом АТФ из АДФ и фосфата. В собранном состоянии все вместе эти субъединицы по форме напоминают слега приплюснутый шар 8 нм в высоту и 10 нм в диаметре.
К ним примыкает дельта субъединица, и все вместе эта система образует F1 субъединицу молекулярной машины. Здесь же есть опора, которая «якорит» всю систему в мембране. Как известно, мембрана сделана из фосфолипидов (на рисунке показаны желтым). Гидрофильные "головки" фосфолипидов обращены в водную поверхность, а гидрофобные "хвосты" погружены внутрь мембраны, и именно они препятствуют перемещению заряженных частиц через мембрану. Вращающаяся часть машины, ротор, состоит из гамма и эпсилон субъединиц. Эта конструкция погружена в структуру, сделанную из одинаковых белков, они обозначаются буквой с. Статор держится в мембране, а ротор крутится. И энергия протона используется на то, чтобы прокрутить ротор этой машины.
Молекулярная машина работает в обе стороны (так же как и катализаторы, которые проводят реакцию как в прямую, так и в обратную стороны). Если течет протонный ток с наружной мембраны внутрь, то синтезируется АТФ; если же протонного потенциала нет, но подать с внутренней стороны АТФ, то машина начнет «выкачивать» протоны, создавая протонный потенциал. При этом ротор также вращается.
Для того, чтобы доказать, что в АТФ синтазе вращается часть машины, F1 фрагмент перевернули, «пришили» к неподвижной подложке, а к гамма-субъединице навесили искусственным образом нить актина (длинный белок, который можно было увидеть в микроскоп, так как он был мечен флуоресцентной меткой). Затем подали к этой системе энергию в виде АТФ, и оказалось, что при наличии АТФ гамма субъединица начала крутиться. Все это сняли на пленку. Было видно, как крутится флуоресцентная метка на актиновом хвостике, и было показано, что действительно происходит вращение во время работы этой молекулярной машины (рис. 10).
Теперь разберем, как же крутится этот ротор; как работает электромотор в мембране клеток, как у бактерий, так и у митохондрий высших организмов. Если вы вспомните временную ось возникновения жизни, то увидите, что возникнуть этот мотор должен был более трех миллиардов лет назад.
Как же используется протонный ток, чтобы крутить мотор? Оказалось, что в статоре имеется протонный канал, т.е. такой белок, который образует проход для протона. Но этот канал не сплошной. Если бы был канал, который пронизывал всю мембрану насквозь, то из-за разницы потенциалов все протоны потекли бы внутрь митохондрии, и произошла бы деэнергетизация мембраны, т.е. она бы разрядилась. Но канал устроен очень хитро. Он состоит из двух половинок (полу-каналов), которые, к тому же, смещены одна относительно другой (рис. 1).
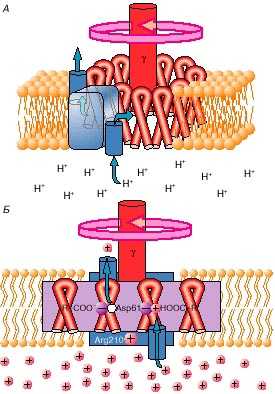
Структура этой машины такова, что протон проваливается через полуканал с наружной стороны митохондриальной мембраны, но попасть внутрь митохондрии он не может. Сваливается протон на подставленную ему аминокислоту ротора и эту аминокислоту протонирует, то есть на аминокислоте появляется дополнительный положительный заряд. Затем, когда протонированная аминокислота на вращающемся роторе доедет до следующей половинки канала, ведущей уже внутрь митохондрии (а внутри протонов мало и, кроме того, там протон поджидают отрицательно заряженные ионы), то протон наконец "падает" внутрь и аминокислота освобождается от положительного заряда. Заряды в роторе и статоре расположены таким образом, что протонирование – депротонирование приводит к повороту машины. Таким образом, протон в два приема проваливается внутрь митохондрии, и за счет этого мотор проворачивается.
За объяснение ферментативного механизма, лежащего в основе синтеза АТФ, два исследователя получили Нобелевскую премию: Пол Д. Бойер, США и Джон Э. Уолкер, Великобритания (Нобелевская премия 1997 года).
Было рассказано, как мотор крутится, но не было объяснено, почему синтезируется АТФ. Сейчас подробно мы на этом останавливаться не будем, но вкратце, объяснить это можно следующим образом. Представим АТФ в таком виде: АТФ=АДФ~Ф. Собственно, почему при разрыве этой связи выделяется большое количество энергии? При разрыве образуется отрицательно заряженный фосфат, который гидратируется (покрывается «шубой» из молекул воды). Как вы помните, вода – это диполь (кислород имеет частично отрицательный заряд, а два водорода - положительный). И за счет гидратирования эта энергия и получается. Но если синтез АТФ идет в той среде, где воды нет, т.е. в гидрофобной среде, то макроэргической эта реакция не является. Показано, что когда происходит образование ковалентной связи между фосфатными группами молекул АДФ и Ф, ферменту практически не требуется энергии. Реакции синтеза и гидролиза ATP в каталитическом центре фермента активно идут при отсутствии внешнего источника энергии. Условия, в которых находятся молекулы АДФ и Ф в каталитическом центре, существенно отличаются от условий протекания реакции в водной среде, благодаря чему образование молекулы АТФ в активном центре фермента может происходить энергетически "бесплатно". Энергия "падающих" протонов тратится потом на то, чтобы «выпихнуть» вон АТФ, отцепить его от каталитической субъединицы.
Таким образом, за счет электрохимического потенциала на внутренней мембране митохондрий внутри клетки или митохондрий совершается механическая работа, сопряженная с химическим синтезом.
На рисунке виден срез митохондрии (рис. 12). Внутри содержится матрикс и выросты (складки) – кристы, на которых и расположена АТФ-синтаза. Зачем нужны складки? Чтобы увеличить площадь поверхности. Количество складок внутри митохондрий зависит от того, насколько интенсивно ей приходится работать, сколько энергии нужно клетке. Митохондрии в клетках печени имеют гораздо меньше крист, чем, например, в клетках сердца.
В хлоропластах происходит точно такой же процесс синтеза АТФ, также работает АТФ-синтаза, как и в митохондриях, но источником протонного потенциала является уловленная энергия света. Там тоже есть складки, они называются тилакоидами. Только в хлоропластах все как бы вывернуто наизнанку. То есть протоны за счет энергии света накапливаются снаружи этих образований.
uclg.ru
10. Митохондрии. Атф.
Митохондрии - микроскопические двумембранные полуавтономные органоиды общего назначения, обеспечивающие клетку энергией, получаемой благодаря процессам окисления и запасаемой в виде фосфатных связей АТФ. Митохондрии также участвуют в биосинтезе стероидов, окислении жирных кислот и синтезе нуклеиновых кислот. Присутствуют во всех эукариотических клетках. В прокариотических клетках митохондрий нет, их функцию выполняют мезосомы - впячивания наружной цитоплазматической мембраны внутрь клетки.
Митохондрии могут иметь эллиптическую, сферическую, палочковидную, нитевидную и др. формы, которые могут изменяться в течение определенного времени. Количество митохондрий в клетках, выполняющих различные функции, варьирует в широких пределах - от 50 и достигая в наиболее активных клетках 500-5000. Их больше там, где интенсивны синтетические процессы (печень) или велики затраты энергии (мышечные клетки). В клетках печени (гепатоцитах) их число составляет 800. а занимаемый ими объем равен примерно 20% объема цитоплазмы. Размеры митохондрий составляют от 0,2 до 1-2 мкм в диаметре и от 2 до 5-7 (10) мкм в длину. На светооптическом уровне митохондрии выявляются в цитоплазме специальными методами и имеют вид мелких зерен и нитей (что обусловило их название - от греч. mitos - нить и chondros - зерно).
В цитоплазме митохондрии могут располагаться диффузно, однако обычно они сосредоточены в участках максимального потребления энергии, например, вблизи ионных насосов, сократимых элементов (миофибрилл) органелл движения (аксонем спермия, ресничек), компонентов синтетического аппарата (цистерн ЭПС). Согласно одной из гипотез, все митохондрии клетки связаны друг с другом и образуют трехмерную сеть.
Митохондрия окружена двумя мембранами - наружной и внутренней, разделенных межмембранным пространством, и содержат митохондриальный матрикс, в который обращены складки внутренней мембраны - кристы.
Наружная митохондриальная мембрана гладкая, по химическому составу сходна с наружной цитоплазматической мембраной и обладает высокой проницаемостью для молекул массой до 10 килодальтон, проникающих из цитозоля в межмембранное пространство. По своему составу она похожа на плазмалемму, 25% составляют белки, 75% липиды. Среди липидов присутствует холестерол. Наружная мембранаа содержит много молекул специализированных транспортных белков (например, поринов), которые формируют широкие гидрофильные каналы и обеспечивают ее высокую проницаемость, а также небольшое количество ферментных систем. На ней находятся рецепторы, распознающие белки, которые переносятся через обе митохондриальные мембраны в особых точках их контакта - зонах слипания.
Внутренняя мембрана имеет выросты внутрь - гребни или кристы, делящие матрикс митохондрии на отсеки. Кристы увеличивают площадь поверхности внутренней мембраны. Таким образом, внутреняя митохондриальная мембрана по площади превосходит наружную. Кристы расположены перпендикулярно или продольно длине митохондрии. Кристы по форме могут быть везикулярные, тубулярные или ламеллярные.
Химический состав внутренней мембраны митохондрий сходен с мембранами прокариот (например, в ней присутствует особый липид - кардиодипин и отсутствует холестерол). Во внутренней митохондриальной мембране преобладают белки, составляющие 75%. Во внутреннюю мембрану встроены белки трех типов (а) белки электрон-транспортной цепи (дыхательной цепи) - НАД'Н-дегидрогеназа и ФАД'Н дегидрогеназа - и другие транспортные белки, (б) грибовидные тельца АТФ-синтетазы (головки которых обращены в сторону матрикса) и (в) часть ферментов цикла Кребса (сукцинатдегидрогеназа). Внутренняя митохондриальная мембрана отличается чрезвычайно низкой проницаемостью, транспорт веществ осуществляется через контактные сайты. Низкая проницаемость внутренней мембраны для мелких ионов из-за высокого содержания фосфолипида
Митохондрии - полуавтономные органоиды клетки, т.к. содержат собственную ДНК, полуавтономную систему репликации, транскрипции и собственный белоксинтезируюший аппарат - полуавтономную систему трансляции (рибосомы 70S типа и т-РНК). Благодаря этому митохондрии синтезируют часть собственных белков. Митохондрии могут делиться независимо от деления клетки. Если из клетки удалить все митохондрии, то новые в ней не появятся. Согласно теории эндосимбиоза митохондрии произошли от аэробных прокариотических клеток, которые попали в клетку хозяина, но не переварились, вступили на путь глубокого симбиоза и постепенно, утратив автономность, превратились в митохондрии.
Митохондрии - полуавтономные органоиды, что выражается следующими признаками:
1) наличие собственного генетического материала (нити ДНК), что позволяет осуществлять синтез белка, а также позволяет самостоятельно делиться независимо от клетки;
2) наличие двойной мембраны;
3) пластиды и митохондрии способны синтезировать АТФ (для хлоропластов источник энергии - свет, в митохондриях АТФ образуется в результате окисления органических веществ).
Функции митохондрий:
1) Энергетическая - синтез АТФ (отсюда эти органоиды и получили название «энергетических станций клетки»):
При аэробном дыхание на кристах происходит окислительное фосфорилирование (образование АТФ из АДФ и неорганического фосфата за счет энергии, освободившейся при окислении органических веществ) и перенос электронов по электрон-транспортной цепи. На внутренней мембране митохондрии расположены ферменты, участвующие в клеточном дыхании;
2) участие в биосинтезе многих соединений (в митохондриях синтезируются некоторые аминокислоты, стероиды (стероидогенез), синтезируется часть собственных белков), а также накопление ионов (Са2+), гликопротеидов, белков, липидов;
3) окисление жирных кислот;
4) генетическая - синтез нуклеиновых кислот (идут процессы репликации и транскрипции). Митохондриальная ДНК обеспечивает цитоплазматическую наследственность.
АТФ
АТФ была открыта в 1929 году немецким химиком Ломанном. В 1935 году Владимир Энгельгардт обратил внимание на то, что мышечные сокращения невозможны без наличия АТФ. В период с 1939 под 1941 г. лауреат Нобелевской премии Фриц Липман доказал, что основным источником энергии для метаболической реакции является АТФ, и ввел в обращение термин "энергетически богатые фосфатные связи". Кардинальные изменения в изучении действия АТФ на организм произошли в середине 70-х годов, когда было обнаружено наличие специфических рецепторов на наружной поверхности клеточных мембран, чувствительных к молекуле АТФ. С тех пор интенсивно изучается триггерное (регуляторное) действие АТФ на различные функции организма
Аденозинтрифосфорная кислота (АТФ, аденинтрифосфорная кислота) — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание — аденин — соединяется β-N-гликозидной сзязью с 5'-углеродом рибозы, к которой последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: α, β и γ.
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз фосфоэфирных связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
АТФ + h3O → AДФ + h4PO4 + энергия
АТФ + h3O → AМФ + h5P2O7 + энергия
Высвобождённая энергия используется в разнообразных процессах, протекающих с затратой энергии
функции
1)Главная - энергетическая. АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов.
2) синтез нуклеиновых кислот.
3) регуляция множества биохимических процессов. АТФ, присоединяясь к регуляторным центрам ферментов, усиливает или подавляет их активность.
непосредственный предшественник синтеза циклоаденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
медиатор в синапсах
пути синтеза:
В организме АТФ синтезируется из АДФ, используя энергию окисляющихся веществ:
АДФ + h4PO4 + энергия → AТФ + h3O.
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование. Основная масса АТФ образуется на мембранах в митохондриях путём окислительного фосфорилирования ферментом H-зависимой АТФ-синтетазой. Субстратное фосфорилирование АДФ не требует участия мембран, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В организме АТФ является одним из самых часто обновляемых веществ. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
studfiles.net
синтаза - это... Что такое АТФ-синтаза?
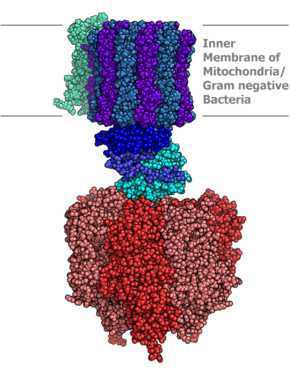 Молекулярная модель АТФ-синтазы
Молекулярная модель АТФ-синтазы Аденозинтрифосфатсинта́за (АТФ-синта́за) — класс ферментов, синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганических фосфатов. Энергию для синтеза АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например из просвета хлоропласта в его строму, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова:
АДФ + Фн → АТФ + h3OАТФ-синтазы очень важны для жизнедеятельности почти всех организмов, так как АТФ относится к так называемым макроэргическим соединениям, при гидролизе которых происходит освобождение значительного количества энергии.
Антибиотик олигомицин подавляет активность FO-компонента АТФ-синтазы.
Структура и номенклатура
Имеющаяся в митохондриях АТФ-синтаза F1FO очень хорошо исследована.
- компонент FO — трасмембранный домен,
- компонент F1 находится вне мембраны, в матриксе.
АТФ-синтазный комплекс FOF1 по форме напоминает плодовое тело гриба, у которого компонент F1 — это шляпка, ножка — это γ-субъединица компонента F1, а «корни» гриба — компонент FO, заякоренный в мембране.
В структурно-функциональном плане АТФ-синтетаза состоит из двух крупных фрагментов, обозначаемых символами F1 и FO. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтетазы, называемая фактором сопряжения FO, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода (ядер протия). Всего в состав комплекса FO входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону FO субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Номенклатура фермента имеет традиционное происхождение, поэтому довольно непоследовательна.
Обозначение компонента F1 является сокращением от «Fraction 1» (часть 1), а символом FO (в индексе записана буква O, а не ноль) обозначался участок связывания олигомицина.
Некоторые субъединицы фермента имеют также буквенные обозначения:
- Греческие: α, β, γ, δ, ε
- Латинские: a, b, c, d, e, f, g, h
Другие — более сложные обозначения:
- F6 (от «Fraction 6»)
- OSCP — белок, чувствительный к олигомицину (от англ. the oligomycin sensitivity conferral protein), ATP5O
- A6L (названный так по названию гена, кодирующего его в митохондриальном геноме)
- IF1 (фактор ингибирования 1), ATPIF1
Компонент F1 достаточно велик (диаметр его составляет 9 нм), чтобы быть видимым в трансмиссионный электронный микроскоп при негативном окрашивании[1].
Частичками F1 усеяна внутренняя митохондриальная мембрана. Изначально считалось, что они содержат весь дыхательный аппарат митохондрии. Однако после долгих экспериментов группа Эфраима Рекера (впервые выделившая компонент F1 в 1961) показала, что эти частички связаны с АТФазной активностью в том числе и в разделённых митохондриях, и в субмитохондриальных частицах, формирующихся при ультразвуковом воздействии на митохондрии. Множество дальнейших исследований в разных лабораториях подтвердили эту АТФазную активность.
Модель синтеза АТФ: механический катализ
В 60—70 годах XX века Пол Бойер предположил, что синтез АТФ связан с изменениями конфигурации АТФ-синтазы, вызываемыми вращением γ-субъединицы, так называемый механизм изменения участка связывания («перевёртыш», англ. flip-flop). Исследовательской группе под руководством Джона Э. Уокера, относившейся тогда к Лаборатории молекулярной биологии в Кембридже, удалось выделить АТФ-синтазный каталитический комплекс F1 в кристаллической форме. На тот момент это была самая крупная из известных науке асимметричная белковая структура. Ее исследования показали, что модель вращающегося катализа, предложенная Бойером, соответствует действительности. За это открытие Бойер и Уокер получили половину Нобелевской премии по химии в 1997 году. Вторую половину получил Йенс Кристиан Скоу «за первое открытие фермента, осуществляющего транспорт ионов — Na+,K+-аденозинтрифосфатазы».
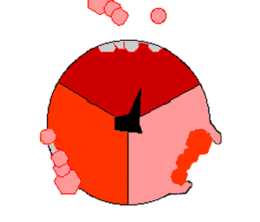 Механизм действия АТФ-синтазы. АТФ показан красным, АДФ и фосфат — розовым, вращающаяся субъединица γ — черным.
Механизм действия АТФ-синтазы. АТФ показан красным, АДФ и фосфат — розовым, вращающаяся субъединица γ — черным. Кристалл F1 состоит из перемежающихся α- и β-субъединиц (по 3 каждого вида), расположенных как дольки апельсина вокруг асимметричной γ-субъединицы. В соответствии с принятой моделью синтеза АТФ (также называемой моделью непостоянного катализа), градиент электрического поля, направленный поперёк внутренней митохондриальной мембраны и обусловленный электронной транспортной цепочкой, заставляет протоны проходить сквозь мембрану через АТФ-синтазный компонент FO. Часть компонента FO (кольцо из c-субъединиц) вращается, когда протоны проходят через мембрану. Это c-кольцо жёстко связано с асимметричной центральной ножкой (состоящей в основном из γ-субъединицы), которая в свою очередь вращается внутри α3β3-участка компонента F1. Это приводит к тому, что три участка катализа, связывающиеся с нуклеотидами, претерпевают изменения в конфигурации, приводящие к синтезу АТФ.
Основные субъединицы (α3β3) компонента F1 соединены дополнительной боковой ножкой с неподвижным участком FO, что предотвращает их вращение вместе с γ-субъединицей. Структура неповрёжденной АТФ-синтазы с низкой точностью выявлена при помощи электронной криомикроскопии (ЭКМ). Показано, что боковая ножка — это гибкая перемычка, похожая на канат, наматывающаяся на комплекс во время его работы.
При каждом обороте γ-субъединицы на 3600 синтезируются три молекулы АТФ, При этом, видимо, у разных организмов из межмембранного пространства в матрикс проходит от 10 до 14 протонов — по числу с-субъединиц[2].
В определённых условиях каталитическая реакция может протекать в обратном направлении, при этом гидролиз АТФ вызывает прокачку протонов через мембрану.
В механизме изменения участка связывания задействован активный участок β-субъединицы, последовательно проходящий через три состояния[3].
В «открытом» состоянии АДФ и фосфат подходят к активному участку. Затем белок охватывает эти молекулы и свободно связывается с ними («свободное» состояние). Следующее изменение формы белка прижимает молекулы друг к другу («тесное» состояние), что приводит к формированию АТФ. Наконец, активный участок снова переходит в «открытое» состояние, освобождает АТФ и связывает следующую молекулу АДФ и фосфата, после чего цикл производства АТФ повторяется.
Физиологическое значение
Как и у многих других ферментов, действие АТФ-синтазы F1FO обратимо. Большие концентрации АТФ заставляют её расщеплять АТФ и создавать трансмембранный протонный градиент. Такое использование АТФ-синтазы отмечено у анаэробных бактерий, не имеющих электронной транспортной цепочки. Эти бактерии применяют гидролиз АТФ для создания протонного градиента, который задействован в движении жгутиков и клеточном питании.
У аэробных бактерий в нормальных условиях АТФ-синтаза, как правило, работает в обратном направлении, производя АТФ за счёт энергии электрохимического потенциала, создаваемого электронной транспортной цепочкой. В целом данный процесс называется окислительным фосфорилированием. Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1 находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
КПД АТФ-синтазы близок к 100%[4].
АТФ-синтаза у разных организмов
АТФ-синтаза растений
У растений АТФ-синтаза CF1FO присутствует в хлоропластах. Она встроена в мембрану тилакоида, причём компонент CF1 выступает в строму, где протекают реакции тёмного фотосинтеза (также называемые светонезависимыми реакциями Кальвиновского цикла). Структура и механизм катализа АТФ-синтазы хлоропластов почти такая же, как и в митохондриях. Однако электрохимический потенциал у хлоропластов формируется не дыхательной электротранспортной цепочкой, а фотосинтетическими белками.
АТФ-синтаза E. coli
АТФ-синтаза кишечной палочки — самая простая из всех известных АТФ-синтаз. Она состоит всего из 8 видов субъединиц.
АТФ-синтаза дрожжей
Напротив, АТФ-синтаза дрожжей — самая сложная из известных. Она состоит из 20 различных видов субъединиц.
Эволюция АТФ-синтазы
Эволюция АТФ-синтазы считается примером модульной эволюции, при которой две субъединицы, каждая обладающая своими функциями, соединились и получили новые функции.
Гексамер α3β3, входящий в состав компонента F1 проявляет существенное сходство с гексамерной ДНК-геликазой. Оба типа ферментов образуют кольцо с вращательной симметрией 3 порядка, обладающее центральной пóрой. Действие каждого из них также зависит от относительного вращения макромолекулы внутри поры: геликазы используют спиральную форму ДНК для движения вдоль неё и для обнаружения суперскручивания, тогда как α3β3-гексамер использует изменения своей конфигурации из-за вращения γ-субъединицы для осуществления каталитической реакции.
Протонный мотор компонента FO проявляет большое функциональное сходство с протонными моторами жгутиков. И там, и там присутствует кольцо из множества небольших богатых α-спиралями белков, вращающихся относительно соседних неподвижных белков за счёт энергии протонного градиента. Это, конечно, очень зыбкое сходство, так как структура жгутиковых моторов гораздо сложнее, чем FO, а вращающееся белковое кольцо гораздо крупнее и состоит из 30 субъединиц против 10, 11 или 14, входящих в состав компонента FO.
Теория молекулярной эволюции предполагает, что две субъединицы с независимыми функциями — ДНК-геликаза с дополнительным АТФ-азным действием и протонный мотор — смогли соединяться, причём вращение мотора вызывало проявление АТФ-азной активности геликазы. Или же, наоборот, в первичной связке ДНК-геликазы и протонного мотора гидролиз АТФ на геликазе заставлял работать протонный мотор. Это соединение затем постепенно оптимизировалось, получило возможность катализировать обратную реакцию и через какое-то время превратилось в сложную АТФ-синтазу, существующую в настоящее время. Однако, до сих пор неясен механизм происхождения протонного мотора, который без геликазы или других комплексов не представляет никакой пользы.
См. также
Примечания
- ↑ Fernandez-Moran et al., Journal of Molecular Biology, Vol 22, p 63, 1962
- ↑ Протонный градиент АТФ-синтетазы (англ.)
- ↑ Gresser MJ, Myers JA, Boyer PD (1982). «Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model». J. Biol. Chem. 257 (20): 12030–8. PMID 6214554.
- ↑ K. Kinosita, Jr. R. Yasuda, H. Noji, K. Adachi. А rotary molecular motor that can work at near 100% efficiency. Philos Trans R Soc Lond B Biol Sci. 2000 April 29; 355(1396): 473—489.
Литература
Ссылки
dic.academic.ru
АТФ-синтаза | Virtual Laboratory Wiki
Аденозинтрифосфатсинта́за (АТФ-синта́за) — класс ферментов, синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганических фосфатов с затратами энергии. Эту энергию АТФ-синтаза часто получает от протонов, проходящих через электрохимический градиент, например из просвета хлоропласта в его строму, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова:
АДФ + Фн → АТФАТФ-синтазы очень важны для жизнедеятельности почти всех организмов, так как АТФ — основная внутриклеточная «энергетическая валюта».
Антибиотик олигомицин подавляет активность FO-компонента АТФ-синтазы.
Структура и номенклатура Править
Файл:ATPsynthase labelled.pngИмеющаяся в митохондриях АТФ-синтаза F1FO очень хорошо исследована.
- компонент FO — трасмембранный домен,
- компонент F1 находится над мембраной.
АТФ-синтазный комплекс FOF1 визуально напоминает плодовое тело гриба, у которого компонент F1 — это шляпка, ножка — это γ-субъединица компонента F1, а «корни» гриба — компонент FO, углубленный в мембрану.
Номенклатура фермента имеет традиционное происхождение, поэтому довольно непоследовательна.
Обозначение компонента F1 является сокращением от «Fraction 1» (часть 1), а символом FO (в индексе записана буква O, а не ноль) обозначался участок связывания олигомицина.
Некоторые субъединицы фермента имеют также буквенные обозначения:
- Греческие: α, β, γ, δ, ε
- Латинские: a, b, c, d, e, f, g, h
Другие — более сложные обозначения:
- F6 (от «Fraction 6»)
- OSCP — белок, чувствительный к олигомицину (от англ. the oligomycin sensitivity conferral protein), ATP5O
Компонент F1 достаточно велик (диаметр его составляет 9 нм), чтобы быть видимым в трансмиссионный электронный микроскоп при негативном окрашивании[1].
Частичками F1 усеяна внутренняя митохондриальная мембрана. Изначально считалось, что они содержат весь дыхательный аппарат митохондрии. Однако после долгих экспериментов группа Эфраима Рекера (впервые выделившая компонент F1 в 1961) показала, что эти частички связаны с АТФазной активностью в том числе и в разделенных митохондриях, и в субмитохондриальных частицах, формирующихся при ультразвуковом воздействии на митохондрии. Множество дальнейших исследований в разных лабораториях подтвердили эту АТФазную активность.
Механизм изменения участка связывания Править
В 60-70 годах XX века Пол Бойер предположил, что синтез АТФ связан с изменениями конфигурации АТФ-синтазы, вызываемыми вращением γ-субъединицы, так называемый механизм изменения участка связывания («перевертыш», англ. flip-flop). Исследовательской группе под руководством Джона Э. Уокера, относившейся тогда к Лаборатории молекулярной биологии в Кембридже удалось выделить АТФ-синтазный каталитический комплекс F1 в кристаллической форме. На тот момент это была самая крупная из известных науке асимметричная белковая структура. Ее исследования показали, что модель вращающегося катализатора, предложенная Бойером, соответствует действительности. За это открытие Бойер и Уокер получили половину Нобелевской премии по химии в 1997 году. Вторую половину получил Йенс Кристиан Скоу «за первое открытие фермента, осуществляющего транспорт ионов — Na+,K±аденозинтрифосфатазы».
Файл:ATPsyn.gifКристалл F1 состоит из перемежающихся α- и β-субъединиц (по 3 каждого вида), расположенных как дольки апельсина вокруг асимметричной γ-субъединицы. В соответствии с принятой моделью синтеза АТФ (также называемой моделью непостоянного катализа), градиент электрического поля, направленный поперек внутренней митохондриальной мембраны и обусловленный электронной транспортной цепочкой, заставляет протоны проходить сквозь мембрану через АТФ-синтазный компонент FO. Часть компонента FO (кольцо из c-субъединиц) вращается, когда протоны проходят через мембрану. Это c-кольцо жестко связано с асимметричной центральной ножкой (состоящей в основном из γ-субъединицы), которая в свою очередь вращается внутри α3β3-участка компонента F1. Это приводит к тому, что три участка катализа, связывающиеся с нуклеотидами, претерпевают изменения в конфигурации, приводящие к синтезу АТФ.
Основные субъединицы (α3β3) компонента F1 соединены дополнительной боковой ножкой с неподвижным участком FO, что предотвращает их вращение вместе с γ-субъединицей. Структура неповрежденной АТФ-синтазы с низкой точностью выявлена при помощи электронной криомикроскопии (ЭКМ). Показано, что боковая ножка — это гибкая перемычка, похожая на канат, наматывающаяся на комплекс во время его работы.
В определенных условиях каталитическая реакция может протекать в обратном направлении, при этом гидролиз АТФ вызывает прокачку протонов через мембрану.
В механизме изменения участка связывания задействован активный участок β-субъединицы, последовательно проходящий через три состояния[2].
В «открытом» состоянии АДФ и фосфат подходят к активному участку. Затем белок охватывает эти молекулы и свободно связывается с ними («свободное» состояние). Следующее изменение формы белка прижимает молекулы друг к другу («тесное» состояние), что приводит к формированию АТФ. Наконец, активный участок снова переходит в «открытое» состояние, освобождает АТФ и связывает следующую молекулу АДФ и фосфата, после чего цикл производства АТФ повторяется.
Физиологическое значение Править
Как и у многих других ферментов, действие АТФ-синтазы F1FO обратимо. Большие концентрации АТФ заставляют ее создавать трансмембранный протонный градиент. Такое использование АТФ-синтазы отмечено у анаэробных бактерий, не имеющих электронной транспортной цепочки. Эти бактерии применяют гидролиз АТФ для создания протонного градиента, который задействован в движении жгутиков и клеточном питании.
У аэробных бактерий в нормальных условиях АТФ-синтаза, как правило, работает в обратном направлении, производя АТФ за счет энергии электрохимического потенциала, создаваемого электронной транспортной цепочкой. В целом данный процесс называется окислительным фосфорилированием. Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1 находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
АТФ-синтаза у разных организмов Править
АТФ-синтаза растений Править
У растений АТФ-синтаза CF1FO присутствует в хлоропластах. Она встроена в мембрану тилакоида, причем компонент CF1 выступает в строму, где протекают реакции темного фотосинтеза (также называемые светонезависимыми реакциями Кальвиновского цикла). Структура и механизм катализа АТФ-синтазы хлоропластов почти такая же, как и в митохондриях. Однако электрохимический потенциал у хлоропластов формируется не дыхательной электротранспортной цепочкой, а фотосинтетическими белками.
АТФ-синтаза E. coli Править
АТФ-синтаза кишечной палочки — самая простая из всех известных АТФ-синтаз. Она состоит всего из 8 видов субъединиц.
АТФ-синтаза дрожжей Править
Напротив, АТФ-синтаза дрожжей — самая сложная из известных. Она состоит из 20 различных видов субъединиц.
Эволюция АТФ-синтазы Править
Эволюция АТФ-синтазы считается примером модульной эволюции, при которой две субъединицы, каждая обладающая своими функциями, соединились и получили новые функции.
Гексамер α3β3, входящий в состав компонента F1 проявляет существенное сходство с гексамерной ДНК-геликазой. Оба типа ферментов образуют кольцо с вращательной симметрией 3 порядка, обладающее центральной пóрой. Действие каждого из них также зависит от относительного вращения макромолекулы внутри поры: геликазы используют спиральную форму ДНК для движения вдоль нее и для обнаружения суперскручивания, тогда как α3β3-гексамер использует изменения своей конфигурации из-за вращения γ-субъединицы для осуществления каталитической реакции.
Протонный мотор компонента FO проявляет большое функциональное сходство с протонными моторами жгутиков. И там, и там присутствует кольцо из множества небольших богатых α-спиралями белков, вращающихся относительно соседних неподвижных белков за счет энергии протонного градиента. Это, конечно, очень зыбкое сходство, так как структура жгутиковых моторов гораздо сложнее, чем FO, а вращающееся белковое кольцо гораздо крупнее и состоит из 30 субъединиц против 10, 11 или 14, входящих в состав компонента FO.
Теория молекулярной эволюции предполагает, что две субъединицы с независимыми функциями — ДНК-геликаза с дополнительным АТФ-азным действием и протонный мотор — смогли соединяться, причем вращение мотора вызывало проявление АТФ-азной активности геликазы. Или же, наоборот, в первичной связке ДНК-геликазы и протонного мотора гидролиз АТФ на геликазе заставлял работать протонный мотор. Это соединение затем постепенно оптимизировалось, получило возможность катализировать обратную реакцию и через какое-то время превратилось в сложную АТФ-синтазу, существующую в настоящее время. Однако, до сих пор неясен механизм происхождения протонного мотора, который без геликазы или других комплексов не представляет никакой пользы.
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: АТФ-синтаза. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
ru.vlab.wikia.com
Где и как образуется АТФ?. Рассказы о биоэнергетике
Где и как образуется АТФ?
Первой системой, для которой выяснили механизм образования АТФ, оказался гликолиз — вспомогательный тип энергообеспечения, включающийся в условиях нехватки кислорода. При гликолизе молекула глюкозы расщепляется пополам и полученные обломки окисляются до молочной кислоты.
Такое окисление сопряжено с присоединением фосфорной кислоты к каждому из фрагментов молекулы глюкозы, то есть с их фосфорилированием. Последующий перенос фосфатных остатков с фрагментов глюкзы на АДФ дает АТФ.
Механизм образования АТФ при внутриклеточном дыхании и фотосинтезе долгое время оставался совершенно неясным. Было известно только, что ферменты, катализирующие эти процессы, встроены в биологические мембраны — тончайшие пленки (толщиной около одной миллионной доли сантиметра), состоящие из белков и фосфорилированных жироподобных веществ — фосфолипидов.
Мембраны — важнейший структурный компонент любой живой клетки. Внешняя мембрана клетки отделяет протоплазму от окружающей клетку среды. Клеточное ядро окружено двумя мембранами, которые образуют ядерную оболочку — преграду между внутренним содержимым ядра (нуклеоплазмой) и остальной частью клетки (цитоплазмой). Кроме ядра, в клетках животных и растений находят еще несколько структур, окруженных мембранами. Это эндоплазматическая сеть — система мельчайших трубочек и плоских цистерн, стенки которых образованы мембранами. Это, наконец, митохондрии — шарообразные или вытянутые пузырьки размером мельче ядра, но крупнее компонентов эндоплазматической сети. Диаметр митохондрии обычно около микрона, хотя иногда митохондрии образуют ветвящиеся и сетчатые структуры протяженностью в десятки микрон.
В клетках зеленых растений, помимо ядра, эндоплазматической сети и митохондрий, находят еще и хлоропласты — мембранные пузырьки более крупные, чем митохондрии.
Каждая из этих структур выполняет свою, специфическую биологическую функцию. Так, ядро — вместилище ДНК. Здесь происходят процессы, лежащие в основе генетической функции клетки, и начинается сложная цепь процессов, приводящая в конечном итоге к синтезу белка. Этот синтез завершается в мельчайших гранулах — рибосомах, большая часть которых связана с эндоплазматической сетью. В митохондриях происходят окислительные реакции, совокупность которых называется внутриклеточным дыханием. Хлоропласты отвечают за фотосинтез.
Клетки бактерий устроены проще. Обычно они имеют только две мембраны — внешнюю и внутреннюю. Бактерия — это как бы мешок в мешке, а точнее, очень мелкий пузырек с двойной стенкой. Здесь нет ни ядра, ни митохондрий, ни хлоропластов.
Существует гипотеза, что митохондрии и хлоропласты произошли из бактерий, захваченных клеткой более крупного и высокоорганизованного существа. Действительно, биохимия митохондрий и хлоропластов во многом напоминает бактериальную. Морфологически митохондрии и хлоропласты тоже в известном смысле подобны бактериям: они окружены двумя мембранами. Во всех трех случаях: в бактериях, митохондриях и хлоропластах — синтез АТФ происходит во внутренней мембране.
Долгое время считалось, что образование АТФ при дыхании и фотосинтезе протекает аналогично уже известному превращению энергии при гликолизе (фосфорилирование расщепляемого вещества, его окисление и перенос остатка фосфорной кислоты на АДФ). Однако все попытки экспериментально доказать эту схему оканчивались неудачей.
Поделитесь на страничкеСледующая глава >
bio.wikireading.ru
Ответы@Mail.Ru: Содержание АТФ (где содержится)
АТФ и ее роль в клетке В цитоплазме каждой клетки, а также в митохондриях, хлоро-пластах и ядрах содержится аденозинтрифосфорная кислота (Л ТФ) . Она поставляет энергию для большинства реакций, происходящих в клетке. С помощью АТФ клетка синтезирует новые молекулы белков, углеводов, жиров, избавляется от отходов, осуществляет активный транспорт веществ, биение жгутиков и ресничек и т. д. Молекула АТФ представляет собой нуклеотид, образованный азотистым основанием аденином, пятиуглеродным сахаром рибо-зой и тремя остатками фосфорной кислоты. Фосфатные группы в молекуле АТф соединены между собой высокоэнергетическими (макроэргическими) связями (в формуле обозначены символом ~): Связи между фосфатными группами не очень прочные, и при их разрыве выделяется большое количество энергии. В результате гидролитического отщепления от АТФ фосфатной группы образуется аденозиндифосфорная кислота (АДФ) н высвобождается порция энергии: АДФ также может подвергаться дальнейшему гидролизу с отщеплением еще одной фосфатной группы и выделением второй порции энергии; при этом АДФ преобразуется в аденозин-монофосфат (АМФ) , который далее не гидролизуется: АТФ образуется из АДФ и неорганического фосфата за счет энергии, освобождающейся при окислении органических веществ и в процессе фотосинтеза. Этот процесс называется фосфорили-рованием. При этом должно быть затрачено не менее 40 кДж/моль энергии, которая аккумулируется в макроэргических связях: Следовательно, основное значение процессов дыхания и фотосинтеза определяется тем, что они поставляют энергию для синтеза АТФ, с участием которой в клетке выполняется большая часть работы. Таким образом, АТФ — это главный универсальный поставщик энергии в клетках всех живых организмов. АТФ чрезвычайно быстро обновляется. У человека, например, каждая молекула АТФ расщепляется и вновь восстанавливается 2 400 раз в сутки, так что ее средняя продолжительность жизни менее 1 мин. Синтез АТФ осуществляется главным образом в митохондриях и хлоропластах (частично в цитоплазме) . Образовавшаяся здесь АТФ направляется в те участки клетки, где возникает потребность в энергии. Источник : Н. А. Лемеза Л. В. Камлюк Н. Д. Лисов "Пособие по биологии для поступающих в ВУЗы"
аденозинтрифосфорная кислота (АТФ) содержится в цитоплазме всех клеток, а также в митохондриях, хлоропластах и ядре.
солнце, ветер, вода, тепловая энергия, световая энергия, электоэнергия
touch.otvet.mail.ru