Содержание
Как тяжёлые металлы влияют на растения?
4 October 2022 /
38 просмотров
Невозможно представить мир без растений: кормящих, одевающих, лечащих нас, да и просто красивых деревьев, кустарников, цветов и трав. На качество растений, употребляемый человеком, напрямую влияет содержание в воде и почве тяжёлых металлов. Какие элементы относятся к этой категории и как их присутствие сказывается на растениях, расскажем ниже.
Что такое «тяжёлые металлы»?
Общепринятого определения термина, предложенного более двухсот лет назад, нет. Чаще всего химические элементы относят к категории тяжёлых металлов по одному из следующих признаков:
- Атомный вес превышает 50. В этом случае к тяжёлым относятся, в частности, хром, железо, цинк, олово — и все прочие металлы, стоящие в Периодической таблице после ванадия.
- Плотность превышает средний показатель железа, то есть 8 г/см3. В соответствии с этим критерием из списка тяжёлых металлов должно быть исключено, например, олово.

- «Качество» металла. Разные классификации могут рассматривать в роли тяжёлых только цветные (без марганца и железа), неблагородные (без золота и серебра), редкие (без молибдена и вольфрама) металлы.
На практике к тяжёлым металлам, оказывающим воздействие на рост и развитие растений, относят встречающиеся в воде и почве в виде солей медь, свинец, кобальт, цинк, ртуть. Их избыток приносит вред — вместе с тем иногда опасен и недостаток.
Влияние тяжёлых металлов на растения
Рассмотрим действие на рост и развитие растений некоторых элементов:
- Свинец. В небольших количествах способствует ускорению роста растений, повышению содержания крахмала. Загрязнение почвы и воды свинцом подавляет фотосинтетические процессы, что в итоге отрицательно сказывается на урожайности.
- Медь. Стимулирует процессы фотосинтеза и образования ферментов на основе железа, в том числе пероксидазы. Избыток меди приводит к непропорциональному развитию, подавлению роста побегов, быстрому увяданию растений.

- Кобальт. В качестве микроудобрения ускоряет созревание и повышает урожайность сельскохозяйственных культур, в частности, сахарной свёклы. В избытке приводит к отмиранию перенасыщенных элементом частей растения, чаще всего — листьев.
- Цинк. Присутствие в почве микроэлемента необходимо для здорового развития растения: при недостатке цинка приостанавливается выработка гормона роста ауксина, снижается жизнестойкость. Избыток металла приводит, напротив, к замедлению роста, отмиранию новых побегов, снижению усвояемости меди.
- Ртуть. Активно накапливается в хвойных деревьях и размножающихся спорами растениях. В больших концентрациях приводит к замедлению обмена веществ, замедлению клеточного дыхания и выработки жизненно важных ферментов.
Контроль содержания тяжёлых металлов
Обеспечить здоровый рост, долговечность, высокую урожайность позволит контроль содержания в воде и почве тяжёлых металлов. Исчерпывающие исследования можно заказать в лаборатории «УкрХимАнализ».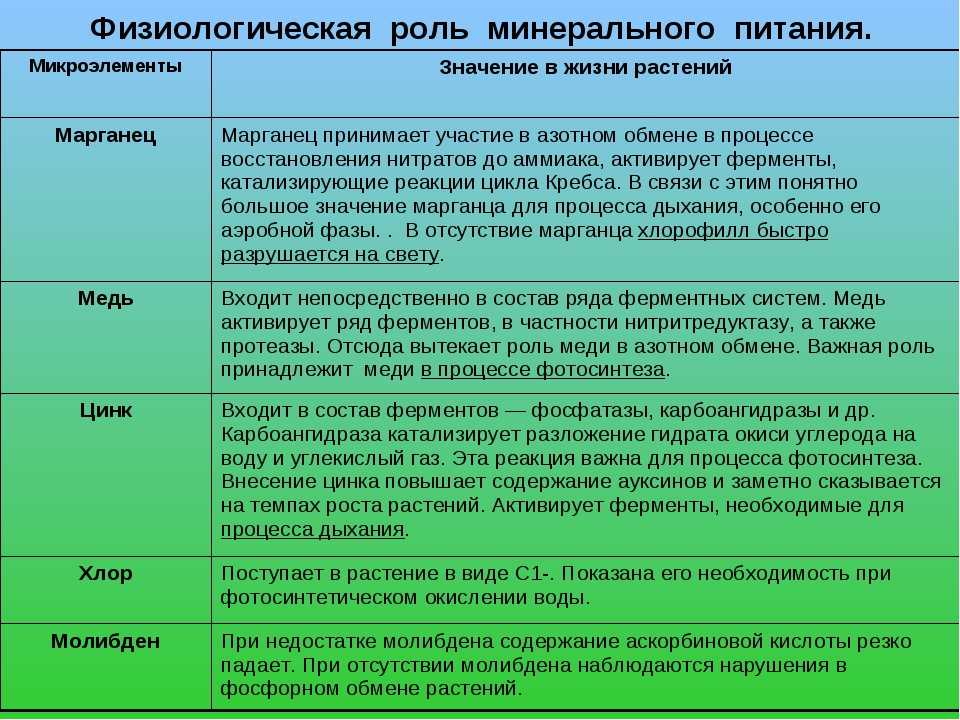 Компания работает в Киеве и по всей Украине, выполняет лабораторные исследования в соответствии с ISO 10012:2005, предоставляет заключения, оформленные в соответствии с государственными стандартами. А вы убедились, что выращиваете растения в безопасной среде?
Компания работает в Киеве и по всей Украине, выполняет лабораторные исследования в соответствии с ISO 10012:2005, предоставляет заключения, оформленные в соответствии с государственными стандартами. А вы убедились, что выращиваете растения в безопасной среде?
У Вас есть вопросы или Вам нужна консультация?
Заполните форму и получите бесплатную консультацию!
Читайте похожие статьи:
Исследование влияния тяжелых металлов на механизм фитоэкстракции растений — статья
- Авторы:
Авдеенкова Т.С.,
Макарова А.С.,
Матасов А.В.,
Челноков В.В.
- Журнал:
Актуальная биотехнология - Том:
3 - Номер:
34 - Год издания:
2020 - Первая страница:
482 - Последняя страница:
483 - Аннотация:
Антропогенное загрязнение воды тяжелыми металлами является одной из основных проблем в
современном мире, и необходимо отметить постоянный рост степени загрязнения водных объектов,
который, в свою очередь, является вызвано ежегодным увеличением производства [1–3]. Источниками
Источниками
тяжелых металлов в окружающей среде в результате деятельности человека являются выбросы от
промышленности, транспортных средств и мусоросжигательных заводов. К отраслям, загрязняющим
окружающую среду тяжелыми металлами, относятся черная и цветная металлургия, производство
топлива, горнодобывающие комплексы, стекло, керамика, электротехника и т. д. [4].
Тяжелые металлы, попадающие в водоемы, приводят к изменениям физических свойств воды, в
частности к изменению органолептических и химических показателей воды [5]. Поступающие в
водоемы металлы препятствуют естественным процессам самоочищения воды. Загрязненные водоемы
становятся непригодными для питьевого, промышленного водоснабжения, а также теряют ценность
для рыбопромысла. Кроме того, загрязненная вода может вызывать нарушения в росте и развитии
растений и организмов, являющихся частью водной биоты [6]. Одним из эффективных способов
очистки водоемов является механизм фиторемидиации. Благодаря данному способу тяжелые металлы
Благодаря данному способу тяжелые металлы
извлекаются из воды, что делает ее пригодной для потребления и использования [7]. Целью этой
работы было определение наиболее эффективных элементов в инженерных сооружениях,
обеспечивающих механизм фитоэкстракции для удаления тяжёлых металлов из водоёмов - Добавил в систему:
Авдеенкова Татьяна Сергеевна
Прикрепленные файлы
| № | Имя | Описание | Имя файла | Размер | Добавлен |
|---|
Влияние тяжелых металлов на прорастание семян
1. Саху С.К., Прадхан К.С., Саранги Загрязнение почвы в Ориссе. Обзор Ориссы. Сентябрь 2004 г.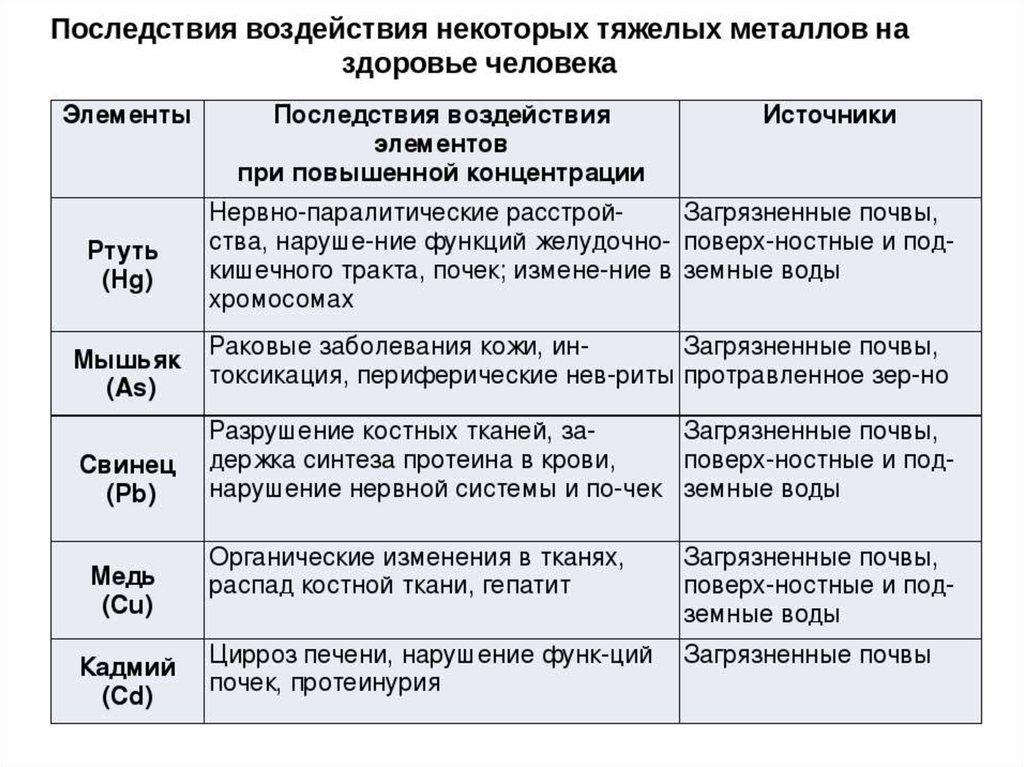 [Google Scholar]
[Google Scholar]
2. Ван В., Винокур Б., Альтман А. Реакция растений на засуху, соленость и экстремальные температуры: на пути к генной инженерии для устойчивости к стрессу. Планта. 2003; 218:1–14. [PubMed] [Google Scholar]
3. Ахмад М.С., Ашраф М. Основные роли и вредное воздействие никеля на растения. Rev Environ Contam Toxicol. 2011; 214:125–67. [PubMed] [Академия Google]
4. Пуррут Б., Шахид М., Думат С., Винтертон П., Пинелли Э. Поглощение свинца, токсичность и детоксикация в растениях. Rev Environ Contam Toxicol. 2011; 213:113–36. [PubMed] [Google Scholar]
5. Li W, Mao R, Liu X. Влияние продолжительности стресса и нетоксичных ионов на токсичность тяжелых металлов для прорастания семян Arabidopsis и роста проростков. Ин Юн Шэн Тай Сюэ Бао. 2005; 16:1943–7. [PubMed] [Google Scholar]
6. Ашраф М.Ю., Садик Р., Хуссейн М., Ашраф М., Ахмад М.С. Токсическое действие никеля (Ni) на рост и метаболизм прорастающих семян подсолнечника (Helianthus annuus L.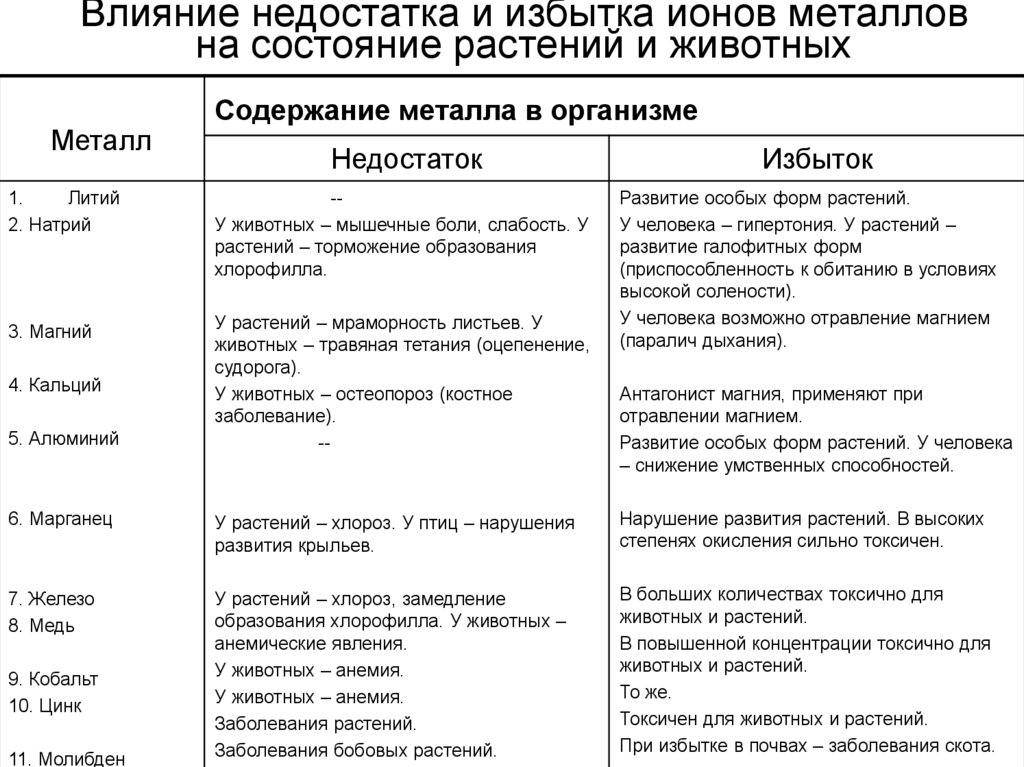 ) Biol Trace Elem Res. 2011;143:1695–703. [PubMed] [Google Scholar]
) Biol Trace Elem Res. 2011;143:1695–703. [PubMed] [Google Scholar]
7. Сиддики М.Х., Аль-Вайби М.Х., Басала, Миссури. Интерактивное влияние кальция и гиббереллина на толерантность к никелю по отношению к антиоксидантным системам Triticum aestivum L. Protoplasma. 2011; 248:503–11. [PubMed] [Google Scholar]
8. Ахмад М.С., Хуссейн М., Саддик Р., Алви А.К. Mungbean: индикатор никеля, аккумулятор или исключение? Bull Environ Contam Toxicol. 2007; 78: 319–24. [PubMed] [Google Scholar]
9. Юсуф М., Фаридуддин К., Варшни П., Ахмад А. Салициловая кислота минимизирует токсичность никеля и/или солености в индийской горчице (Brassica juncea) за счет улучшенной антиоксидантной системы. Environ Sci Pollut Res Int. 2012;19: 8–18. [PubMed] [Google Scholar]
10. Сингх Х.П., Каур Г., Батиш Д.Р., Кохли Р.К. Ингибированное свинцом (Pb) появление корней у Brassica campestris связано с изменениями в ферментах, метаболизирующих крахмал. Биол Трейс Элем Рез. 2011; 144:1295–301. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
11. Мохамед HI. Молекулярно-биохимические исследования влияния гамма-лучей на токсичность свинца растений вигны (Vigna sinensis). Биол Трейс Элем Рез. 2011; 144:1205–18. [PubMed] [Google Scholar]
12. Wang C, Tian Y, Wang X, Geng J, Jiang J, Yu H, et al. Загрязненная свинцом почва вызывает окислительный стресс, защитную реакцию и ее показательные биомаркеры в корнях 9 растений.Саженцы 0011 Vicia faba . Экотоксикология. 2010;19:1130–9. [PubMed] [Google Scholar]
13. Pena LB, Azpilicueta CE, Gallego SM. Семядоли подсолнечника справляются с медным стрессом, индуцируя субъединицы каталазы, менее чувствительные к окислению. J Трейс Элем Мед Биол. 2011;25:125–9. [PubMed] [Google Scholar]
14. Sfaxi-Bousbih A, Chaoui A, El Ferjani E. Медь влияет на углеводный статус семядолей во время прорастания семян фасоли. Биол Трейс Элем Рез. 2010; 137:110–6. [PubMed] [Академия Google]
15. Сингх Д., Натх К., Шарма Ю.К. Реакция прорастания семян пшеницы и роста проростков на медный стресс. Дж. Энвайрон Биол. 2007; 28: 409–14. [PubMed] [Google Scholar]
Дж. Энвайрон Биол. 2007; 28: 409–14. [PubMed] [Google Scholar]
16. Ahsan N, Lee DG, Lee SH, Kang KY, Lee JJ, Kim PJ, Yoon HS, Kim JS, Lee BH. Избыток меди вызывал физиологические и протеомные изменения в прорастающих семенах риса. Хемосфера. 2007; 67: 1182–93. [PubMed] [Google Scholar]
17. Zhang H, Lian C, Shen Z. Протеомная идентификация небольших белков, реагирующих на медь, в прорастающих эмбрионах Oryza sativa. Энн Бот. 2009 г.;103:923–30. [Статья бесплатно PMC] [PubMed] [Google Scholar]
18. Rahoui S, Chaoui A, El Ferjani E. J. Повреждение мембран и утечка растворенных веществ из прорастающих семян гороха в условиях кадмиевого стресса. Опасный мэтр. 2010; 178:1128–31. [PubMed] [Google Scholar]
19. Sfaxi-Bousbih A, Chaoui A, El Ferjani E. Кадмий ухудшает мобилизацию минералов и углеводов во время прорастания семян фасоли. Экотоксикол Environ Saf. 2010;73:1123–9. [PubMed] [Google Scholar]
20. Ahsan N, Lee SH, Lee DG, Lee H, Lee SW, Bahk JD, et al. Изменение физиологического и белкового профилей прорастающих проростков риса, подвергшихся острой токсичности кадмия. C R Биол. 2007; 330:735–46. [PubMed] [Академия Google]
Изменение физиологического и белкового профилей прорастающих проростков риса, подвергшихся острой токсичности кадмия. C R Биол. 2007; 330:735–46. [PubMed] [Академия Google]
21. Smiri M, Chaoui A, Rouhier N, Gelhaye E, Jacquot JP, El Ferjani E. Кадмий влияет на систему глутатион/глутаредоксин при прорастании семян гороха. Биол Трейс Элем Рез. 2011; 142:93–105. [PubMed] [Google Scholar]
22. Rancelis V, Cesniene T, Kleizaite V, Zvingila D, Balciuniene L. Влияние поглощения кобальта семенами Vicia faba на индукцию морфоза хлорофилла, полиморфизм SOD и метилирование ДНК. Окружающая среда Токсикол. 2012; 27:32–41. [PubMed] [Академия Google]
23. Шарма И., Пати П.К., Бхардвадж Р. Влияние 28-гомобрассинолида на систему антиоксидантной защиты у Raphanus sativus L. при отравлении хромом. Экотоксикология. 2011;20:862–74. [PubMed] [Google Scholar]
24. Мустафиз А., Сингх А.К., Парик А., Сопори С.К., Сингла-Парик С.Л. Полногеномный анализ риса и Arabidopsis выявил два гена глиоксалазы, которые сильно экспрессируются при абиотических стрессах. Функц Интегр Геномикс. 2011; 11: 293–305. [PubMed] [Академия Google]
Функц Интегр Геномикс. 2011; 11: 293–305. [PubMed] [Академия Google]
25. Wang Y, Zong K, Jiang L, Sun J, Ren Y, Sun Z и другие. Характеристика устойчивого к кадмию мутанта Arabidopsis cdr3-1D выявила связь между устойчивостью к тяжелым металлам, а также развитием семян и цветением. Планта. 2011; 233:697–706. [PubMed] [Google Scholar]
26. Xiao S, Gao W, Chen QF, Ramalingam S, Chye ML. Сверхэкспрессия связанного с мембраной ацил-КоА-связывающего белка ACBP1 повышает толерантность к свинцу у арабидопсиса . Плант Дж. 2008; 54: 141–51. [PubMed] [Академия Google]
27. Чжан Дж., Шу В.С. Механизмы толерантности растений к кадмию тяжелых металлов. Чжи Ву Шэн Ли Ю Фен Цзы Шэн Ву Сюэ Сюэ Бао. 2006; 32:1–8. [PubMed] [Google Scholar]
28. DalCorso G, Farinati S, Furini A. Регуляторные сети кадмиевого стресса в растениях. Поведение сигналов растений. 2010;5:663–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Влияние тяжелых металлов на метаболизм азота в растениях
- Вход в панель авторов
Что такое открытый доступ?
Открытый доступ — это инициатива, направленная на то, чтобы сделать научные исследования бесплатными для всех. На сегодняшний день наше сообщество сделало более 100 миллионов загрузок. Он основан на принципах сотрудничества, беспрепятственного открытия и, самое главное, научного прогресса. Будучи аспирантами, нам было трудно получить доступ к нужным нам исследованиям, поэтому мы решили создать новое издательство с открытым доступом, которое уравняет правила игры для ученых со всего мира. Как? Упрощая доступ к исследованиям и ставя академические потребности исследователей выше деловых интересов издателей.
На сегодняшний день наше сообщество сделало более 100 миллионов загрузок. Он основан на принципах сотрудничества, беспрепятственного открытия и, самое главное, научного прогресса. Будучи аспирантами, нам было трудно получить доступ к нужным нам исследованиям, поэтому мы решили создать новое издательство с открытым доступом, которое уравняет правила игры для ученых со всего мира. Как? Упрощая доступ к исследованиям и ставя академические потребности исследователей выше деловых интересов издателей.
Наши авторы и редакторы
Мы являемся сообществом из более чем 103 000 авторов и редакторов из 3 291 учреждения в 160 странах мира, включая лауреатов Нобелевской премии и самых цитируемых исследователей мира. Публикация на IntechOpen позволяет авторам получать цитирование и находить новых соавторов, а это означает, что больше людей увидят вашу работу не только из вашей собственной области исследования, но и из других смежных областей.
Оповещения о содержимом
Краткое введение в этот раздел, посвященный открытому доступу, особенно с точки зрения IntechOpen
Как это работаетУправление предпочтениями
Контакты
Хотите связаться? Свяжитесь с нашим головным офисом в Лондоне или командой по работе со СМИ здесь:
Карьера:
Наша команда постоянно растет, поэтому мы всегда ищем умных людей, которые хотят помочь нам изменить мир научных публикаций.
Рецензируемая глава в открытом доступе
Автор:
Vitor Nascimento, Glauco Nogueira, Gabriel Monteiro, Waldemar Junior, Joze Melissa Nunes de Freitas и Cândido Neto
Представлено: 21 сентября 2020 года. Рассмотрено: 16 апреля 2021 года. Детали Заказ Распечатать
Обзор показателей главы
343 Глава Загрузки
Просмотреть полные показатели
СКАЧАТЬ БЕСПЛАТНО
Рекламное объявление
Abstract
В качестве основного элемента азот необходим в больших количествах, поскольку он является важным компонентом клеточных компонентов и метаболизма растений, а его недостаток является одним из наиболее распространенных ограничений развития растений. Изучение токсического действия металлов на растения включает в себя сложную систему реакций, которые можно лучше определить, если обратить большое внимание на различные предпосылки возникновения, чтобы определить, как действовать. Цель этого обзора состоит в том, чтобы дополнить научные знания, обращаясь к основным функциям и характеристикам связи тяжелых металлов и метаболизма азота в растении. Растущая индустриализация и урбанизация привели к антропогенному вкладу тяжелых металлов в биосферу и к наибольшей доступности в экосистемах. Эта токсичность для растений зависит от вида растений, конкретного металла, концентрации, состава почвы, поскольку считается, что многие тяжелые металлы необходимы для роста растений. Приведены данные и обзоры о влиянии тяжелых металлов на азотистый обмен растений и реакции растений на взаимовлияние тяжелых металлов и различных стрессорных факторов. Понятно, чтобы понять связь между количеством металлов и пользой или вредом, причиняемым растениям, определяя затем, какой механизм должен быть активирован для защиты вашей физиологической системы.
Изучение токсического действия металлов на растения включает в себя сложную систему реакций, которые можно лучше определить, если обратить большое внимание на различные предпосылки возникновения, чтобы определить, как действовать. Цель этого обзора состоит в том, чтобы дополнить научные знания, обращаясь к основным функциям и характеристикам связи тяжелых металлов и метаболизма азота в растении. Растущая индустриализация и урбанизация привели к антропогенному вкладу тяжелых металлов в биосферу и к наибольшей доступности в экосистемах. Эта токсичность для растений зависит от вида растений, конкретного металла, концентрации, состава почвы, поскольку считается, что многие тяжелые металлы необходимы для роста растений. Приведены данные и обзоры о влиянии тяжелых металлов на азотистый обмен растений и реакции растений на взаимовлияние тяжелых металлов и различных стрессорных факторов. Понятно, чтобы понять связь между количеством металлов и пользой или вредом, причиняемым растениям, определяя затем, какой механизм должен быть активирован для защиты вашей физиологической системы.
Ключевые слова
- Физиология растений
- Деятельность человека
- Индустриализация
- Стресс растений
- Токсичность
и наземные экосистемы. Этот элемент необходим в больших количествах, так как он является важным компонентом белков, нуклеиновых кислот и других клеточных составляющих. Одни только белки составляют 60% и более N растений и микробных клеток [1]. Он также является важным элементом метаболизма растений, а его дефицит является одним из наиболее распространенных ограничений развития растений [2]. Предпочтение растений в отношении источника N может варьироваться в зависимости от давления отбора и последующей физиологической адаптации [3].
Наиболее распространенными и доступными в почве формами являются нитратная (NO 3 − ) и аммиачная (NH 4 + ) формы, причем первая более многочисленна и лучше усваивается растениями [4], в результате процесса нитрификации бактериями.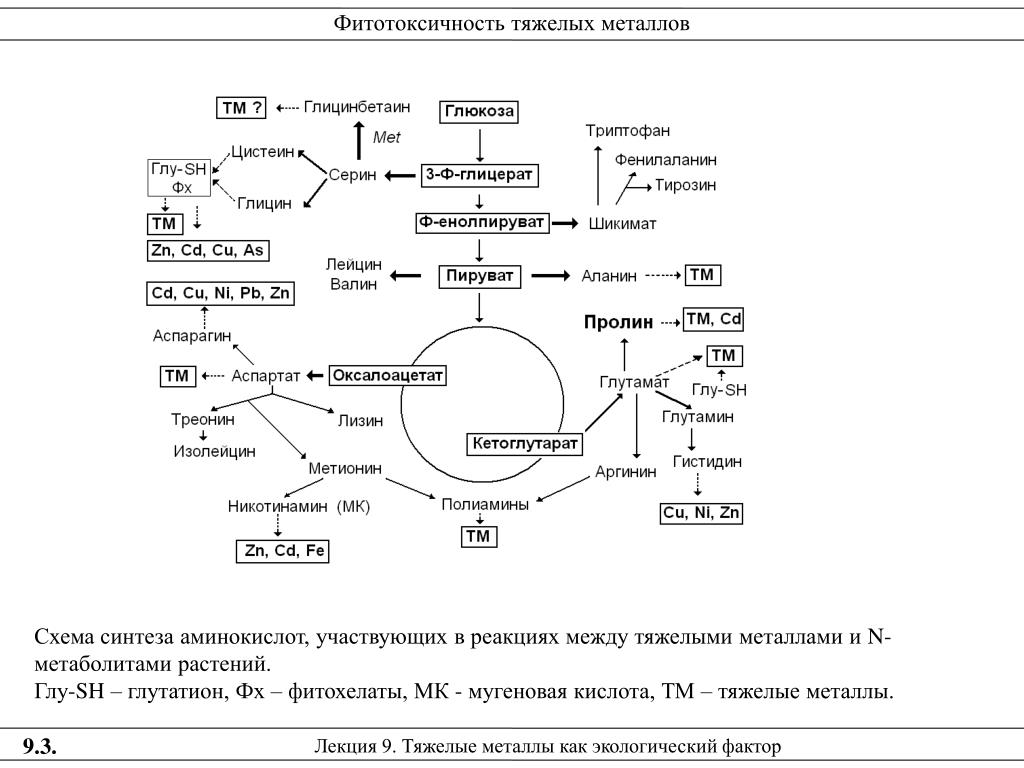 Однако в зависимости от почвенных условий аммиачная форма может быть наиболее распространенной из-за угнетения этих организмов [5]. Известно, что попадая в листья, разные источники азота могут по-разному влиять на метаболизм растений. Накопление NH 4 + может приводить к снижению фотосинтеза [6], а избыток NO 3 − может приводить к образованию реактивных форм, вызывающих окислительный стресс [7].
Однако в зависимости от почвенных условий аммиачная форма может быть наиболее распространенной из-за угнетения этих организмов [5]. Известно, что попадая в листья, разные источники азота могут по-разному влиять на метаболизм растений. Накопление NH 4 + может приводить к снижению фотосинтеза [6], а избыток NO 3 − может приводить к образованию реактивных форм, вызывающих окислительный стресс [7].
Метаболизм азота также тесно связан с метаболизмом углерода (C), и процесс фотодыхания является одной из точек связи между ними, помимо того, что он является метаболическим путем, который естественным образом производит активные формы кислорода (рис. 1). .
Рис. 1.
Обмен азота в растениях. Источник: Заметки экспертов по биологии.
Изучение токсического воздействия металлов на растения включает в себя сложную систему реакций, которые можно лучше определить, уделив большое внимание различным фоновым условиям и регионам присутствия, чтобы определить, как действовать дальше. Таким образом, цель этого обзора состоит в том, чтобы дополнить научные знания, обращаясь к основным функциям и характеристикам связи тяжелых металлов и метаболизма азота в растении.
Таким образом, цель этого обзора состоит в том, чтобы дополнить научные знания, обращаясь к основным функциям и характеристикам связи тяжелых металлов и метаболизма азота в растении.
Реклама
2. Тяжелые металлы
По данным Lenntech [8], тяжелые металлы были значительными загрязнителями окружающей среды, поскольку их токсичность представляет собой проблему, приобретающую все большее значение по экологическим, эволюционным, экологическим и пищевым причинам. Включая медь (Cu), марганец (Mn), свинец (Pb), кадмий (Cd), никель (Ni), кобальт (Co), железо (Fe) и другие, они представляют собой группу металлов и металлоидов с атомной плотностью более 4 г/см 3 , или в 5 и более раз больше, чем у воды [9]. С точки зрения окружающей среды это определяется как совокупность обстоятельств, окружающих организм или группу организмов, особенно сочетание внешних физических условий, которые влияют и влияют на рост, выживание и развитие организмов [10].
Тяжелые металлы чаще всего встречаются в горных породах с рассеянной формой. Усиливающаяся индустриализация и урбанизация привели к антропогенному вкладу тяжелых металлов в биосферу и их наибольшая доступность в почве и водных экосистемах и относительно меньшая часть в атмосфере в виде паров или твердых частиц. Эта токсичность для растений зависит от вида растений, конкретного металла, концентрации, химической формы, pH и состава почвы, поскольку считается, что многие тяжелые металлы необходимы для роста растений. Согласно Милдвану [11], некоторые из этих тяжелых металлов, такие как Cu и Zn, могли служить активаторами ферментативных реакций и кофакторов, проявляя металлические свойства, такие как пластичность, ковкость, катионная стабильность, проводимость и лигандная специфичность, характеризовались относительно высокой плотностью и высокой относительный атомный вес с атомным номером больше 20, как сказал Raskin et al. [12].
В Бразилии референтные уровни для исследования содержания тяжелых металлов и других химических веществ в почвах и подземных водах определены в Резолюции CONAMA № 420 [13], что облегчает оценку загрязнения и создание индикаторов, контролирующих и принимающих уход за участками, контактирующими с металлами и живущими в них существами. Все формы жизни могут быть затронуты присутствием тяжелых металлов в зависимости от дозы и химического состава [14]. Еще одним ключевым фактором, который следует учитывать, является степень воздействия, которая напрямую связана с величиной биодоступности в окружающей среде, поскольку свободные ионы металла могут связываться с органическим веществом, снижая биодоступность [15].
Все формы жизни могут быть затронуты присутствием тяжелых металлов в зависимости от дозы и химического состава [14]. Еще одним ключевым фактором, который следует учитывать, является степень воздействия, которая напрямую связана с величиной биодоступности в окружающей среде, поскольку свободные ионы металла могут связываться с органическим веществом, снижая биодоступность [15].
Реклама
3. Тяжелые металлы в растениях
Согласно Becher et al. [16], ответы растений на стрессы окружающей среды включают как защитные, так и стресс-индуцируемые реакции. Стимуляция важных путей толерантности, таких как усиление активности антиоксидантных ферментов, накопление осмолитов, индукция локализованных в мембране переносчиков. Поэтому у растений выработаны механизмы гомеостаза ионов, позволяющие им справляться с некоторым ограниченным избытком тяжелых металлов. Растения в ходе эволюции демонстрируют толерантность или даже приспособление к различным биотическим и абиотическим стрессовым факторам.
Согласно Холлу и Уильямсу [17] в процессе эволюции появились шапероны, хелаторы и специфические трансмембранные переносчики. У неадаптированных к данным условиям среды растений, испытывающих избыток ионов, может происходить усиленный биосинтез комплексообразующих веществ, таких как металлотионеины, фитохелатины и/или органические кислоты (рис. 2) [18, 19].
Рис. 2.
Морфофизиологические реакции растений на токсичность металлов в почве.
Усвоение азота является важным метаболическим процессом растений, который не только контролирует рост растений, но и играет важную роль в их выживании в стрессовых условиях. Как сказали Бургер и Джексон [20], № 3 − и NH 4 + являются основными источниками азота и необходимы для различных метаболических процессов. Нитрат превращается в NH 4 + посредством процесса, состоящего из двух стадий; на первой стадии NO 3 − превращается в нитрит под действием фермента нитратредуктазы, а на второй стадии нитрит под действием нитритредуктазы превращается в NH 4 + .
Перес-Тиенда и др. [21] сообщили, что нитратредуктаза находится в цитоплазме, тогда как нитритредуктаза находится в хлоропластах и использует энергию и некоторые восстановители, такие как НАДН или НАДФН, из процесса дыхания или фотосинтеза, чтобы осуществить такие NO 3 — до NH 4 + реакция превращения. Первая стадия этой реакции происходит в цитозоле, а вторая — в пластиде. После производства NH 4 + он должен быть включен в углеродный скелет, и этот процесс происходит в основном через цикл GOGAT.
Кроме того, как сообщают Mevel и Prieur [22], можно визуализировать две изоформы GS, GOGAT, и их локализация была обнаружена тканеспецифическим образом, например, в корнях, GS1 и NADHGOGAT в первую очередь участвуют в ассимиляции азота, в листьях в ассимиляции азота принимают участие преимущественно GSII и GOGAT.
Токсичность металлов значительно снижает процесс усвоения азота. Однако уровень снижения зависит от чувствительности и локализации ферментов к токсичности тяжелых металлов. Кроме того, концентрация, подвижность и продолжительность пребывания ионов тяжелых металлов в питательной среде еще больше усугубляют изменения в процессе усвоения азота.
Кроме того, концентрация, подвижность и продолжительность пребывания ионов тяжелых металлов в питательной среде еще больше усугубляют изменения в процессе усвоения азота.
Воздействие металлов в более высоких концентрациях может привести к серьезному повреждению различных метаболических процессов, что, в свою очередь, приведет к гибели растений. Воздействие избыточных количеств металлов на растения угнетает физиологически активные ферменты [23], инактивирует фотосистемы [24] и, возможно, может нарушать минеральный обмен. Джанас и др. [25] проанализировали влияние Cu на перекисное окисление липидов, рост, локализацию в проростках чечевицы и накопление фенольных соединений. Согласно Се и соавт. [26] и Chen [27] в предыдущих экспериментах сообщали, что растворенные органические вещества почвы оказывают значительное влияние на трансформацию тяжелых металлов за счет увеличения растворимости металла, поглощения растениями и роста корней.
Реклама
4.
 Воздействие некоторых тяжелых металлов на растения
Воздействие некоторых тяжелых металлов на растения
4.1 Cu
Согласно Burkhead et al . [28], из-за способности переключаться между восстановленным состоянием Cu и окисленным состоянием Cu он участвует в биологических процессах, таких как фотосинтез, дыхание, удаление супероксида кислорода, восприятие этилена, лигнификация и метаболизм клеточной стенки. Как эссенциальный элемент Cu также может быть высокотоксичным [29]. Cu в свободной форме катализирует реакции, в результате которых образуются гидроксильные радикалы, вызывающие повреждение липидов, белков и ДНК [30]. По Берналу и др. [31], медь также препятствует гомеостазу железа. Резкое снижение биомассы растений, ингибирование роста корней, хлороз и некроз являются наиболее часто сообщаемыми симптомами избытка od Cu из-за увеличения производства активных форм кислорода и вредных взаимодействий на клеточном уровне.
4.2 Zn
Роль цинка в клеточных процессах является хорошим примером разнообразной биологической полезности ионов металлов. Zn участвует в белковом, липидном обмене, углеводном и нуклеиновом обмене. Более того, Zn имеет решающее значение для контроля биологических процессов, регулируемых белками, содержащими ДНК-связывающие мотивы Zn-finger и транскрипцию генов [32]. Точная причина токсичности Zn неизвестна, но металл может связываться с неподходящими внутриклеточными лигандами или конкурировать с другими ионами металлов за транспортные белки или активные сайты ферментов. Чтобы играть эти разнообразные роли в клетках, а также поскольку он не может пассивно диффундировать через клеточные мембраны, Zn должен транспортироваться во внутриклеточные компартменты клетки, где он необходим для этих Zn-зависимых процессов.
Zn участвует в белковом, липидном обмене, углеводном и нуклеиновом обмене. Более того, Zn имеет решающее значение для контроля биологических процессов, регулируемых белками, содержащими ДНК-связывающие мотивы Zn-finger и транскрипцию генов [32]. Точная причина токсичности Zn неизвестна, но металл может связываться с неподходящими внутриклеточными лигандами или конкурировать с другими ионами металлов за транспортные белки или активные сайты ферментов. Чтобы играть эти разнообразные роли в клетках, а также поскольку он не может пассивно диффундировать через клеточные мембраны, Zn должен транспортироваться во внутриклеточные компартменты клетки, где он необходим для этих Zn-зависимых процессов.
4.3 Ni
Ni играет важную роль в некоторых метаболических явлениях и чрезвычайно токсичен для растений, если присутствует в чрезмерных количествах в питательных растворах или в почве, на которую воздействуют растения. Согласно Рахману и соавт. [33], общие признаки, связанные с токсичностью Ni для растений, включают: снижение роста побегов и корней, слабое развитие системы ветвления [34], деформацию различных частей растения [35], аномальную форму цветка [36, 37], снижение производства биомассы [33], пятнистость листьев [38], митотические нарушения кончиков корней [36], ингибирование прорастания [39], дефицит железа, приводящий к хлорозу [40, 41], и некрозу листьев [42].
4.4 Cd
Согласно Chen et al. [43], считается, что среди всех тяжелых металлов кадмий (Cd) обладает высокой токсичностью для человека и всех других живых организмов, поскольку не имеет известных биологических функций в водных или наземных организмах. Благодаря своему влиянию на различные биохимические и физиологические процессы в растениях Cd может ингибировать рост растений и вызывать гибель клеток выше критических уровней [44, 45]. Исследования Hassan et al. [46] сообщили, что вызванное кадмием снижение роста можно объяснить ингибированием фиксации углерода из-за снижения скорости фотосинтеза и содержания хлорофилла.
Реклама
5. Заключение
В представленной главе мы представили данные и обзоры о влиянии тяжелых металлов на азотный обмен растений и реакции растений, а также о взаимовлиянии тяжелых металлов и различных факторов стресса. Кроме того, ясно понять связь между количеством металлов и пользой или вредом, причиняемым растениям, определяя затем, какой механизм должен быть активирован для защиты вашей физиологической системы. Кроме того, мы кратко покажем физиологически, как происходит этот процесс.
Кроме того, мы кратко покажем физиологически, как происходит этот процесс.
Ссылки
- 1. ВИЕЙРА, Р.С. Ciclo do Nitrogenio em sistemas agrícolas. Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA), Бразилиа, Бразилия. Доступно в: 2017LV04.pdf (embrapa.br). 2017
- 2. ПАЛЛАРДИС, С. Г. Глава 9 – Азотистый обмен. В: Pallardys, SG (Ed.). Физиология древесных растений. 3 изд. Сан-Диего: Академическая пресса. с.233-254. Доступно на: http://dx.doi.org/10.1016/B978-012088765-1.50010-5. 2008
- 3. ТЕРС-ЛАФОРГ, Т.; ГИЗЕЛА, М .; ХИРЕЛЬ, Б. Новое понимание функции глутаматдегидрогеназы, выявленное во время перехода от источника к приемнику растений табака (Nicotiana tabacum L.), выращиваемых при различных режимах азота. Physiologia Plantarum, т. 120, № 2, стр. 220-228. 2004
- 4. ЛЕА, П.Дж., АЗЕВЕДО, Р.А. Эффективность использования азота.
 1. Поглощение азота из почвы. Анналы прикладной биологии, т. 149, № 3, стр. 243-247. Доступно на: http://dx.doi.org/10.1111/j.1744-7348.2006.00101.x. 2006
1. Поглощение азота из почвы. Анналы прикладной биологии, т. 149, № 3, стр. 243-247. Доступно на: http://dx.doi.org/10.1111/j.1744-7348.2006.00101.x. 2006 - 5. МИЛЛЕР, А.Дж., КРАМЕР, М.Д. Получение и усвоение корневого азота. Растительная почва, т.274, н.1-2, стр.1-36. Доступно на: http://dx.doi.org/10.1007/s11104-004-0965-1. 2004
- 6. БЛЭКВЕЛЛ, Р. Д.; МЮРРЕЙ, AJS; ЛЕА, П.Дж. Ингибирование фотосинтеза у ячменя со сниженным уровнем активности хлоропластной глутаминсинтетазы. Журнал экспериментальной ботаники, т. 38, № 11, с. 1799-1809. 1987
- 7. Л. И., С. X.; ВАНГ, ZH; СТЮАР, Б. А. Реакция сельскохозяйственных культур на аммоний и нитрат N. Достижения в области агрономии, Сан-Диего, т. 118, с. 205-397. 2013
- 8. Водоподготовка и очистка воздуха Lenntech. Очистка воды. Lenntech, Rotterdamseweg, Нидерланды Доступно на: http://www.excelwater.com/thp/filters/Water-Purification.htm.
 2004
2004 - 9. ХОУКС Дж.С. Тяжелые металлы. Дж. Чем Эду 74:1369-1374. 1997
- 10. Farlex Incorporated (2005) Определение: окружающая среда, бесплатный словарь, Farlex Inc. Publishing, США. Доступно на: http://www.thefreedictionary.com/
- 11. МИЛДВАН, А.С. Металл в катализе ферментов. В: Boyer DD (ed) Ферменты, том 11. Academic Press, Лондон, стр. 445-536. 1970
- 12. РАСКИН И.; КУМАР, П.Б.А.М.; ДУШЕНКОВ С.; СОЛТ, Д.Э. «Биоконцентрация тяжелых металлов растениями», Current Opinion in Biotechnology, vol. 5, нет. 3, стр. 285-290. 1994
- 13. Бразилия (2009 г.) Resolução № 420 от 28 декабря 2009 г. Diário Oficial da União 249: 81-84. 2009
- 14. ОЛИВЕЙРА, Д.Л.; РОЧА, К.; МОРЕЙРА, ПК; МОРЕЙРА, С.О.Л. Plantas nativas do Cerrado: uma alternativa para fitorremediação. Эстудос 36: 1141-1159. 2009
- 15. МЮНИЗ, Д.
 Х.Ф.; OLIVEIRA-FILHO EC. Университеты: Ciências da Saúde 4: 83–100. 2006
Х.Ф.; OLIVEIRA-FILHO EC. Университеты: Ciências da Saúde 4: 83–100. 2006 - 16. БЕХЕР, М.; РАЗГОВОР, И. Н.; КРАЛЛ, Л.; KRÄMER, U. Межвидовое профилирование транскриптов микрочипов выявляет высокую конститутивную экспрессию генов гомеостаза металлов в побегах арабидопсиса галлера, гипераккумулятора цинка. Завод Ж. 37, 251-268. 2004
- 17. ХОЛЛ, Дж.Л.; УИЛЬЯМС, Л.Э. Транспортеры переходных металлов в растениях. Дж. Эксп. Бот. 54, 2601-2613. 2003
- 18. ШАТ, Х.; ВАН ХУФ, НАЛМ; ТЕРВАХАУТА, А. и др. Эволюционные реакции на стресс цинка и меди у Bladder Campion, Silene vulgaris (Moench) Garcke. В книге «Толерантность растений к абиотическим стрессам: роль генной инженерии»; Kluwer Academic Publishers: Дордрехт, Нидерланды, стр. 343–360. 2000
- 19. ЖАО, Ф.Дж.; Ванг, младший; БАРКЕР, Дж. Х. А.; ШАТ, Х .; БЛИКЕР, PM; МАКГРАТ, С.П. Роль фитохелатинов в толерантности к мышьяку у гипераккумулятора Pteris vittata.
 Новый Фитол. 159, 403-410. 2003
Новый Фитол. 159, 403-410. 2003 - 20. БУРГЕР, М.; ДЖЕКСОН Л.Э. Микробная иммобилизация аммония и нитратов в зависимости от скорости аммонификации и нитрификации в органических и традиционных системах земледелия. Soil Biol Biochem 35(1):29-36. 2003
- 21. ПЕРЕС-ТИЕНДА, Дж.; КОРРЕА, А.; AZCÓN-AGUILAR, C. et al. Транскрипционная регуляция переносчиков NH 4 + хозяина и пути GS/GOGAT в корнях арбускулярной микоризы риса. Растение Физиол Биохим 75:1-8. 2014
- 22. МЕВЕЛЬ, Г.; PRIEUR, D. Гетеротрофная нитрификация термофильными видами Bacillus под влиянием различных условий культивирования. Can J Microbiol 46(5):465-473. 2000
- 23. ГАДД, Г.М. Геомикология: биогеохимические преобразования горных пород, минералов, металлов и радионуклидов грибами, биовыветривание и биоремедиация. Микол Рез 111: 3-49. 2007
- 24. САНДМАНН, Г.; БЕГЕР, П.
 Опосредованные медью процессы перекисного окисления липидов в фотосинтетических мембранах. Завод Физиол 66: 797-800. 1980
Опосредованные медью процессы перекисного окисления липидов в фотосинтетических мембранах. Завод Физиол 66: 797-800. 1980 - 25. ЯНАС, К.М.; ЗИЛИ, А .; СКА-ТОМАШЕВСКА, Ю.; РЫБАЧЕК, Д.; МАШЕВСКИЙ, Дж.; ПОСМИК М.М. и др. Влияние ионов меди на рост, перекисное окисление липидов, накопление и локализацию фенольных соединений в проростках чечевицы (Lens culinaris Medic.). J Plant Physiol 167: 270-276. 2010
- 26. СИЕ, З.; ВУ, Л.; ЧЕНЬ, Н.; ЛИУ, К.; ЧЖЕН, Ю. и др. Фитоэкстракция почвы, загрязненной Pb и Cu, с кукурузой и микрокапсулированной ЭДТА. Int J Phytoremediation 14: 727-740. 2012
- 27. ЧЕНЬ, X.; ВАН Дж.; ШИ Ю.; ЧЖАО М.К.; ЧИ, Г.Ю. Влияние кадмия на рост и фотосинтетическую активность пакхои и горчицы. Ботанические исследования 52: 41-46. 2011
- 28. БЕРКХЕД, Дж.Л.; ГОГОЛИН РЕЙНОЛДС, К.А.; АБДЕЛЬ-ГАНИ, SE; COHU, C.M.; ПИЛОН, М. Гомеостаз меди. Новый фитолог 182: 799-816. 2009
- 29.
 ФЕРНАНДЕС Х.К., ЭНРИКЕС Ф.С. 1991. Биохимические, физиологические и структурные эффекты избытка меди в растениях. Ботаническое обозрение 57: 246-273
ФЕРНАНДЕС Х.К., ЭНРИКЕС Ф.С. 1991. Биохимические, физиологические и структурные эффекты избытка меди в растениях. Ботаническое обозрение 57: 246-273 - 30. COHU CM, PILON M. 2010. Клеточная биология меди. В: Hell R, Mendel RR, ред. Клеточная биология металлов и питательных веществ. Монографии о растительных клетках, том. 17. Берлин, Германия: Springer, 55-74
- 31. БЕРНАЛ, М.; КАСЕРО, Д.; СИНГХ, В.; УИЛСОН, Г.Т. и другие. Секвенирование транскриптома идентифицирует регулируемые SPL7 гены приобретения меди FRO4/FRO5 и зависимость гомеостаза железа от меди у арабидопсиса. Клетка растений 24: 738-761. 2012
- 32. РОДЕС Д., КЛУГ А. Цинковые пальцы. наук Ам. 268:56-65. 1993
- 33. RAHMAN H, SABREEN S, ALAM S, KAWAI S. Влияние никеля на рост и состав металлических микроэлементов в растениях ячменя, выращенных в питательном растворе. J Plant Nutr 28: 393-404. 2005
- 34.
 REEVES RD, BAKER AJM, BGRHIDI A, BERAZAÍN R. Никельаккумулирующие растения из древних змеевидных почв Кубы. Новый фитол 133:217-224. 1996
REEVES RD, BAKER AJM, BGRHIDI A, BERAZAÍN R. Никельаккумулирующие растения из древних змеевидных почв Кубы. Новый фитол 133:217-224. 1996 - 35. РАЙТ Д.А., ВЕЛБОРН П. (2002) Экологическая токсикология. Издательство Кембриджского университета. 2002
- 36. McIlveen WD, Negusanti JJ. Никель в земной среде. Наука Всего Окружающая среда 148:109-138. 1994
- 37. МИШРА Д, КАР М. Никель в росте и метаболизме растений. Бот Откр. 40:395-452. 1974
- 38. GAJEWSKA E, SKŁODOWSKA M, SŁABA M, Mazur J (2006) Влияние никеля на активность антиоксидантных ферментов, содержание пролина и хлорофилла в побегах пшеницы. Biol Plant 50(4):653-659
- 39. NEDHI A, SINGH LJ, SINGH SI. Влияние кадмия и никеля на всхожесть, ранний рост проростков и фотосинтез пшеницы и голубиного гороха. Инд Дж Троп Агри 8:141-147. 1990
- 40. EWAIS EA (1997) Влияние кадмия, никеля и свинца на рост, содержание хлорофилла и белки сорняков.
 Biol Plant 39:403-410
Biol Plant 39:403-410 - 41. KIRKBY EA, RÖMHELD V. Микроэлементы в физиологии растений: функции, усвоение и подвижность. Труды № 543, Международное общество производителей удобрений, Йорк, Великобритания. 1-51. 2004
- 42. KUKKOLA E, RAUTIO P, HUTTUNEN S. Признаки стресса у сеянцев сосны обыкновенной, подвергшихся воздействию меди и никеля. Бот Environ Exp 43: 197-210. 2000
- 43. CHEN F, DONG J, WANG F, WU F, ZHANG G, LI G и др. Идентификация генотипов ячменя с низким накоплением Cd в зерне и его взаимодействие с четырьмя микроэлементами. Хемосфера 67: 2082-2088. 2007
- 44. ПОПОВА Л.П., МАСЛЕНКОВА Л.Т., ЙОРДАНОВА Р.Ю., ИВАНОВА А.П., КРАНТЕВ А.П., САЛАЙ Г. Экзогенная обработка салициловой кислотой снижает токсичность кадмия у проростков гороха. Растение Физиол Биохим 47:224-231. 2009
- 45. XU J, YIN HX и LI X, Защитные эффекты пролина от токсичности кадмия в гипераккумуляторах, выращиваемых микроразмножением, Solanum nigrum L.
 Plant Cell Rep 28:325-333. 2009
Plant Cell Rep 28:325-333. 2009 - 46. HASSAN MJ, WANG F, ALI S и ZHANG G, Токсическое воздействие кадмия на рис при воздействии азотных удобрений. Растительная почва 277: 359-365 (2005)
Секции
Информация о авторе
- 1. Введение
- 2. Heavy Metals
- 3. Гиви металлов в растениях
- 4. Влияние некоторых тяжелых металлов на растениях
- 4.concluse
1
- .
. Контроль
1
Список литературы
Реклама
Написано
Vitor Nascimento, Glauco Nogueira, Gabriel Monteiro, Waldemar Júnior, Joze Melissa Nunes de Freitas и Cândo Neto
903.



 Источниками
Источниками
 Благодаря данному способу тяжелые металлы
Благодаря данному способу тяжелые металлы
 1. Поглощение азота из почвы. Анналы прикладной биологии, т. 149, № 3, стр. 243-247. Доступно на: http://dx.doi.org/10.1111/j.1744-7348.2006.00101.x. 2006
1. Поглощение азота из почвы. Анналы прикладной биологии, т. 149, № 3, стр. 243-247. Доступно на: http://dx.doi.org/10.1111/j.1744-7348.2006.00101.x. 2006 2004
2004 Х.Ф.; OLIVEIRA-FILHO EC. Университеты: Ciências da Saúde 4: 83–100. 2006
Х.Ф.; OLIVEIRA-FILHO EC. Университеты: Ciências da Saúde 4: 83–100. 2006 Новый Фитол. 159, 403-410. 2003
Новый Фитол. 159, 403-410. 2003 Опосредованные медью процессы перекисного окисления липидов в фотосинтетических мембранах. Завод Физиол 66: 797-800. 1980
Опосредованные медью процессы перекисного окисления липидов в фотосинтетических мембранах. Завод Физиол 66: 797-800. 1980 ФЕРНАНДЕС Х.К., ЭНРИКЕС Ф.С. 1991. Биохимические, физиологические и структурные эффекты избытка меди в растениях. Ботаническое обозрение 57: 246-273
ФЕРНАНДЕС Х.К., ЭНРИКЕС Ф.С. 1991. Биохимические, физиологические и структурные эффекты избытка меди в растениях. Ботаническое обозрение 57: 246-273 REEVES RD, BAKER AJM, BGRHIDI A, BERAZAÍN R. Никельаккумулирующие растения из древних змеевидных почв Кубы. Новый фитол 133:217-224. 1996
REEVES RD, BAKER AJM, BGRHIDI A, BERAZAÍN R. Никельаккумулирующие растения из древних змеевидных почв Кубы. Новый фитол 133:217-224. 1996 Biol Plant 39:403-410
Biol Plant 39:403-410 Plant Cell Rep 28:325-333. 2009
Plant Cell Rep 28:325-333. 2009