Содержание
Зоны корня – онлайн-тренажер для подготовки к ЕНТ, итоговой аттестации и ВОУД
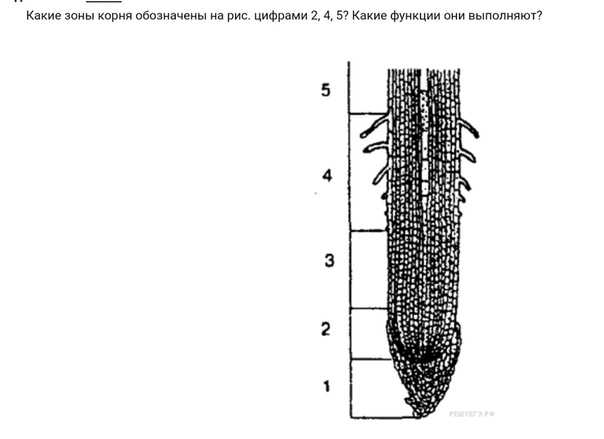
На продольном разрезе кончика корня можно выделить несколько зон: деления, роста, всасывания и проведения.
Корневой чехлик не относится к зонам корня. Он покрывает снаружи и защищает верхушку корня, его точку роста, состоящую из образовательной ткани. Клетки корневого чехлика живые. Наружные клетки корневого чехлика при слущивании выделяют слизь, защищающую нежные молодые клетки кончика корня от повреждений и облегчающую продвижение корня в почве.
1. Зона деления, или конус нарастания, находится под корневым чехликом и представлена клетками верхушечной образовательной ткани. Здесь клетки постоянно делятся и тем самым способствуют росту корня в длину и развитию других зон. Длина зоны деления около 1 мм.
2. Зона растяжения, или зона роста, состоит из образовательной ткани. Ее клетки имеют крупные ядра, тонкие стенки и густую зернистую цитоплазму без вакуолей. Здесь клетки интенсивно растут, вытягиваются вдоль корня и начинают дифференцироваться. Деление клеток почти отсутствует. Протяженность ее – несколько миллиметров.
Здесь клетки интенсивно растут, вытягиваются вдоль корня и начинают дифференцироваться. Деление клеток почти отсутствует. Протяженность ее – несколько миллиметров.
3. Зона всасывания или поглощения, или зона корневых волосков, длинной до несколько сантиметров, начинается над зоной растяжения. Здесь отдельные клетки кожицы корня вытягиваются, образуя наружные выросты длинной от 1–2 до 20 мм – корневые волоски, которые по мере роста вытягиваются, покрываются слизью. Тонкие наружные оболочки корневых волосков тесно соприкасаются с частицами почвы, что способствует всасывающей функции, т. е. поглощению растворов минеральных веществ.
4. Проводящая зона покрыта пробковой тканью находится над всасывающей зоной и расположена в центре корня. Она включает первичную флоэму (луб) и первичную ксилему (древесину).
Проводящая система обеспечивает восходящий по древесине ток воды и минеральных веществ из корня в стебель, и нисходящий ток – передвижение органических веществ по лубу из стебля в корень.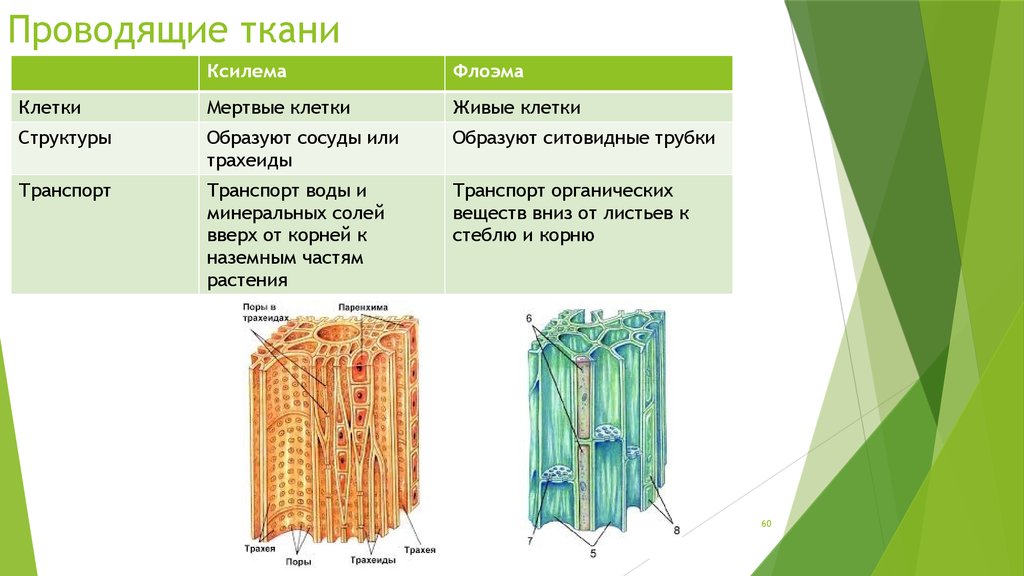 Состоит она из сосудисто-волокнистых пучков. Основные проводящие элементы флоэмы – ситовидные трубки, ксилемы – трахеи (сосуды) и трахеиды. В этой зоне отсутствуют волоски, но много боковых корней.
Состоит она из сосудисто-волокнистых пучков. Основные проводящие элементы флоэмы – ситовидные трубки, ксилемы – трахеи (сосуды) и трахеиды. В этой зоне отсутствуют волоски, но много боковых корней.
У однодольных растений такое строение сохраняется в течение всей жизни, у двудольных – только на первых этапах развития. Но уже в течение первого года жизни у некоторых двудольных наблюдаются вторичные изменения в корне, связанные с появлением образовательной ткани – камбия.
Камбий закладывается между ксилемой и флоэмой, замыкая первичную ксилему в центре и отодвигая первичную флоэму к периферии. За счет деления клеток камбия корень двудольных растений растет в толщину.
Зоны корня
|
Зоны корня
|
Преобладающая
ткань
|
Особенности строения клеток
|
Функции
|
|---|---|---|---|
|
Корневой чехлик
(не является зоной корня)
|
Покровная
(перидерма)
|
Клетки мелкие с толстой оболочкой
|
Защита от повреждения
|
|
Зона деления
|
Образовательная
(меристема)
|
Клетки мелкие с тонкой оболочкой
|
Рост корня
|
|
Зона растяжения
|
Образовательная
(меристема)
|
Вытянутые клетки с тонкой оболочкой
|
Рост корня
|
|
Зона всасывания
|
Всасывающая
(ризодерма)
|
Корневой волосок
|
Всасывание растворенных веществ
|
|
Зона проведения
|
Проводящая
(флоэма и ксилема)
|
Клетки вытянутые (сосуды, ситовидные трубки)
|
Перемещение веществ
|
|
Все зоны
|
Механическая
(колленхима, склеренхима)
|
Вытянутые вдоль корня клетки с толстой оболочкой.
Они рано теряют содержимое и заполнены воздухом.
|
Опора органа
|
Авторизация
Размер:
AAA
Цвет:
C
C
C
Изображения
Вкл.
Выкл.
Обычная версия сайта
Сведения об образовательной организации
Контакты
Старая версия сайта
Версия для слабовидящих
Версия для слабовидящих
Южно-Уральский государственный медицинский университет
- Университет
- События
- Новости
- ЮУГМУ сегодня
- Историческая справка
- Руководство
- Выборы ректора
- Лицензия, аккредитация и сертификаты
- Организационная структура
- Противодействие коррупции
- Первичная профсоюзная организация ЮУГМУ Профсоюза работников здравоохранения РФ
- Абитуриенту
- Новости для абитуриентов
- Центр довузовской подготовки
- Поступающим на специалитет
- Поступающим в ординатуру
- Поступающим в аспирантуру
- Поступающим в медицинский колледж
- Документы на право ведения образовательной деятельности
- Положения о приемной, экзаменационной и апелляционной комиссиях
- Информация об общежитиях
- Часто задаваемые вопросы
- Результаты приема студентов
- Информация для инвалидов
- Обучающемуся
- Факультеты
- Кафедры
- Медицинский колледж
- Ординатура
- Аспирантура
- Научная библиотека
- Образовательный портал
- Расписания
- Совет обучающихся ЮУГМУ
- Этический кодекс студентов медицинских вузов
- Совет студентов Минздрава России
- О допуске студентов к работе в медицинских организациях
- Иностранным обучающимся
- Медицинское обслуживание
- Информация об общежитиях
- Стипендиальное обеспечение
- Порядок перехода обучающихся с платного на бесплатное обучение
- Часто задаваемые вопросы
- Анкетирование
- Студенческие отряды
- Противодействие терроризму и экстремизму
- Специалисту
- Институт дополнительного профессионального образования
- Аккредитация специалистов
- Пациенту
- Клиника ФГБОУ ВО ЮУГМУ Минздрава России
- Профилактика новой коронавирусной инфекции, гриппа, ОРВИ, вакцинация
- Здоровый образ жизни
- Нет наркотикам!
- Научная работа
- Управление по научной и инновационной работе
- Экспериментально-биологическая клиника (виварий)
- Отдел международных связей
- НИИ иммунологии
- Центральная научно-исследовательская лаборатория
- НОЦ «Проблемы фундаментальной медицины»
- НОЦ «Клиническая фармакология»
- Конференции и другие мероприятия
- Диссертационные советы
- Журнал «Непрерывное медицинское образование и наука»
- Студенческое научное общество
- Совет молодых ученых и специалистов
Построение различий: случай формирования паттерна основных тканей у растений
1. Гомпель Н., Прюдом Б., Виткопп П.Дж., Касснер В.А., Кэрролл С.Б.
Гомпель Н., Прюдом Б., Виткопп П.Дж., Касснер В.А., Кэрролл С.Б.
2005.
Шанс пойман на лету: цис-регуляторная эволюция и происхождение пигментных узоров у дрозофилы . Природа
433, 481–487. ( 10.1038/nature03235) [PubMed] [CrossRef] [Google Scholar]
2. Wittkopp PJ, Stewart EE, Arnold LL, Neidert AH, Haerum BK, Thompson EM, Ahras S, Smith-Winberry G, Shefner L.
2009.
Внутривидовой полиморфизм к межвидовой дивергенции: генетика пигментации у Дрозофила . Наука
326, 540–544. ( 10.1126/science.1176980) [PubMed] [CrossRef] [Google Scholar]
3. Николов Л.А., Циантис М.
2017.
Использование геномов горчицы для изучения генетической основы эволюционных изменений. Курс. мнение биол. растений
36, 119–128. ( 10.1016/j.pbi.2017.02.005) [PubMed] [CrossRef] [Google Scholar]
4. Долан Л., Джанмаат К., Виллемсен В., Линстед П., Поэтиг С., Робертс К., Шерес Б.
1993.
Клеточная организация корня Arabidopsis thaliana . Разработка
119, 71–84. [PubMed] [Google Scholar]
5. Шерес Б.
Шерес Б.
2000.
Нелинейная сигнализация для формирования паттерна?
Курс. Опин биол. растений.
3, 412–417. ( 10.1016/S1369-5266(00)00105-9) [PubMed] [CrossRef] [Google Scholar]
6. Weigel D, Jurgens G.
2002.
Стволовые клетки, образующие стебли. Природа
415, 751–754. (10.1038/415751a) [PubMed] [CrossRef] [Google Scholar]
7. Steeves TA, Sussex IM.
1989.
Закономерности развития растений, 2-е изд.
Кембридж, Великобритания: Издательство Кембриджского университета. [Академия Google]
8. Шерес Б.
2007.
Ниши стволовых клеток: детские стишки в разных королевствах. Нац. Преподобный Мол. Клеточная биол.
8, 345–354. ( 10.1038/nrm2164) [PubMed] [CrossRef] [Google Scholar]
9. Фан А.
1990.
Анатомия растений, 4-е изд.
Оксфорд, Великобритания: Пергамон. [Google Scholar]
10. Timmers AC, Auriac MC, Truchet G.
1999.
Уточненный анализ ранних симбиотических стадий взаимодействия Rhizobium–Medicago в связи с перестройками микротрубочек цитоскелета. Разработка
126, 3617–3628. [PubMed] [Академия Google]
[PubMed] [Академия Google]
11. Сяо Т.Т., Шильдеринк С., Молинг С., Дейнум Э.Е., Кондороси Э., Франссен Х., Куликова О., Нибель А., Бисселинг Т.
2014.
Карта судьбы корневых узелков Medicago truncatula . Разработка
141, 3517–3528. (10.1242/dev.110775) [PubMed] [CrossRef] [Google Scholar]
12. Paungfoo-Lonhienne C, et al.
2008.
Растения могут использовать белок в качестве источника азота без помощи других организмов. проц. Натл акад. науч. США
105, 4524–4529. ( 10.1073/pnas.0712078105) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Хеймш С., Сиго Дж. Л. мл.
2008.
Организация апикальной меристемы корня у покрытосеменных растений. Являюсь. Дж. Бот.
95, 1–21. ( 10.3732/ajb.95.1.1) [PubMed] [CrossRef] [Google Scholar]
14. Clowes FAL.
1994.
Происхождение эпидермиса в меристемах корней. Новый Фитол.
127, 335–347. ( 10.1111/j.1469-8137.1994.tb04284.x) [CrossRef] [Google Scholar]
15. Pauluzzi G, Divol F, Puig J, Guiderdoni E, Dievart A, Perin C.
2012.
Сёрфинг по сети генов корневой наземной ткани. Дев. биол.
365, 14–22. ( 10.1016/j.ydbio.2012.02.007) [PubMed] [CrossRef] [Google Scholar]
16. Киршнер Г.К., Шталь Ю., Фон Корф М., Саймон Р.
2017.
Уникальные и сохранившиеся особенности меристемы корня ячменя. Фронт. Растениевод.
8, 1240 ( 10.3389/fpls.2017.01240) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Баум С.Ф., Дубровский Ю.Г., Рост Т.Л.
2002.
Апикальная организация и созревание коры и сосудистого цилиндра у корней Arabidopsis thaliana (Brassicaceae). Являюсь. Дж. Бот.
89, 908–920. ( 10.3732/ajb.89.6.908) [PubMed] [CrossRef] [Google Scholar]
18. Пакетт А.Дж., Бенфей П.Н.
2005.
Созревание основной ткани корня регулируется гиббереллином и ЧУЧЕЛОМ и требует SHORT-ROOT. Завод Физиол.
138, 636–640. ( 10.1104/pp.104.058362) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Clark LH, Harris WH.
1981.
Наблюдения за анатомией корня риса ( Oryza sativa L. ). Являюсь. Дж. Ботаника
). Являюсь. Дж. Ботаника
68, 154–161. ( 10.2307/2442846) [CrossRef] [Google Scholar]
20. Генри С., Дивол Ф., Беттембург М., Бюро С., Гидердони Э., Перин С., Диварт А.
2015.
Иммунопрофилирование коры корня риса выявляет два корковых субдомена. Фронт. Растениевод.
6, 1139( 10.3389/fpls.2015.01139) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Popham RA.
1966 год.
Лабораторное пособие по анатомии растений. Анн-Арбор, Мичиган: CV Mosby, Мичиганский университет. [Google Scholar]
22. Di Laurenzio L, Wysocka-Diller J, Malamy JE, Pysh L, Helariutta Y, Freshour G, Hahn MG, Feldmann KA, Benfey PN.
1996.
Ген SCARECROW регулирует асимметричное клеточное деление, необходимое для создания радиальной организации корня Arabidopsis . Клетка
86, 423–433. ( 10.1016/S0092-8674(00)80115-4) [PubMed] [CrossRef] [Google Scholar]
23. van den Berg C, Willemsen V, Hage W, Weisbeek P, Scheres B.
1995.
Судьба клеток в корневой меристеме Arabidopsis определяется направленной передачей сигналов. Природа
Природа
378, 62–65. ( 10.1038/378062a0) [PubMed] [CrossRef] [Google Scholar]
24. Helariutta Y, Fukaki H, Wysocka-Diller J, Nakajima K, Jung J, Sena G, Hauser MT, Benfey PN.
2000.
Ген SHORT-ROOT контролирует формирование радиального паттерна Arabidopsis 9.0004 корень через радиальную сигнализацию. Клетка
101, 555–567. ( 10.1016/S0092-8674(00)80865-X) [PubMed] [CrossRef] [Google Scholar]
25. Nakajima K, Sena G, Nawy T, Benfey PN.
2001.
Межклеточное перемещение предполагаемого фактора транскрипции SHR при формировании корневого паттерна. Природа
413, 307–311. ( 10.1038/35095061) [PubMed] [CrossRef] [Google Scholar]
26. Sena G, Jung JW, Benfey PN.
2004.
Широкая способность реагировать на SHORT ROOT выявляется тканеспецифической эктопической экспрессией. Разработка
131, 2817–2826. ( 10.1242/dev.01144) [PubMed] [CrossRef] [Google Scholar]
27. Ватен А. и др.
2011.
Биосинтез каллозы регулирует симпластический транспорт во время развития корня. Дев. Клетка
21, 1144–1155. (10.1016/j.devcel.2011.10.006) [PubMed] [CrossRef] [Google Scholar]
(10.1016/j.devcel.2011.10.006) [PubMed] [CrossRef] [Google Scholar]
28. Cui H, et al.
2007.
Эволюционно консервативный механизм, ограничивающий движение SHR, определяет один слой энтодермы у растений. Наука
316, 421–425. ( 10.1126/science.1139531) [PubMed] [CrossRef] [Google Scholar]
29. Sozzani R, et al.
2010.
Пространственно-временная регуляция генов клеточного цикла с помощью SHORTROOT связывает формирование паттерна и рост. Природа
466, 128–132. ( 10.1038/природа09143) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Long Y, et al.
2017.
In vivo FRET-FLIM выявляет взаимодействия белков, специфичных для клеточного типа, в корнях Arabidopsis . Природа
548, 97–102. ( 10.1038/nature23317) [PubMed] [CrossRef] [Google Scholar]
31. Clark NM, Hinde E, Winter CM, Fisher AP, Crosti G, Blilou I, Gratton E, Benfey PN, Sozzani R.
2016.
Отслеживание подвижности и взаимодействия факторов транскрипции в корнях Arabidopsis с помощью флуоресцентной корреляционной спектроскопии. электронная жизнь
электронная жизнь
5, e14770 ( 10.7554/eLife.14770) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Уэлч Д., Хассан Х., Блилоу И., Имминк Р., Хейдстра Р., Шерес Б.
2007.
Белки цинковых пальцев Arabidopsis JACKDAW и MAGPIE ограничивают асимметричное деление клеток и стабилизируют границы тканей, ограничивая действие SHORT-ROOT. Гены Дев.
21, 2196–2204. ( 10.1101/gad.440307) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Heidstra R, Welch D, Scheres B.
2004.
Мозаичный анализ с использованием клонов с отмеченной активацией и делецией выделяет действие Arabidopsis SCARECROW в асимметричном клеточном делении. Гены Дев.
18, 1964–1969. ( 10.1101/gad.305504) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Ferrell JE., Jr.
2002.
Самовоспроизводящиеся состояния при передаче сигнала: положительная обратная связь, двойная отрицательная обратная связь и бистабильность. Курс. Мнение Cell Biol.
14, 140–148. (10.1016/S0955-0674(02)00314-9) [PubMed] [CrossRef] [Google Scholar]
35. Di Mambro R, et al.
Di Mambro R, et al.
2017.
Минимум ауксина запускает в развитии переключение с клеточного деления на клеточную дифференцировку у Arabidopsis 9.0004 корень. проц. Натл акад. науч. США
114, Е7641–Е7649. ( 10.1073/pnas.1705833114) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Li P, et al.
2018.
Построение функциональной полоски каспария в неэндодермальных клонах организовано двумя параллельными сигнальными системами у Arabidopsis thaliana . Курс. биол.
28, 2777–2786. ( 10.1016/j.cub.2018.07.028) [PubMed] [CrossRef] [Google Scholar]
37. Moller BK, Ten Hove CA, Xiang D, Williams N, Lopez LG, Yoshida S, Smit M, Datla R, Вейерс Д.
2017.
Клетки ответа на ауксин автономно контролируют инициацию основной ткани в начале Эмбрион арабидопсиса . проц. Натл акад. науч. США
114, Е2533–Е2539. ( 10.1073/pnas.1616493114) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Милона П., Линстед П., Мартиенссен Р., Долан Л.
2002.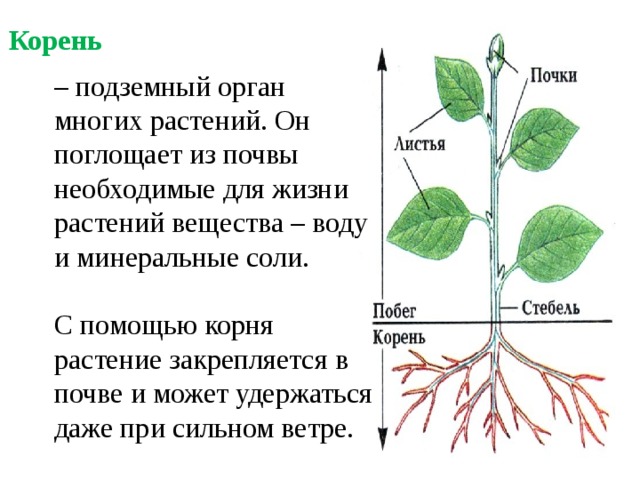
SCHIZORIZA контролирует асимметричное деление клеток и ограничивает эпидермальную идентичность в корне Arabidopsis . Разработка
129, 4327–4334. [PubMed] [Google Scholar]
39. ten Hove CA, Willemsen V, de Vries WJ, van Dijken A, Scheres B, Heidstra R.
2010.
SCHIZORIZA кодирует ядерный фактор, регулирующий асимметрию деления стволовых клеток в Корень арабидопсиса . Курс. биол.
20, 452–457. (10.1016/j.cub.2010.01.018) [PubMed] [CrossRef] [Google Scholar]
40. Carlsbecker A, et al.
2010.
Передача сигналов клетками с помощью микроРНК165/6 направляет зависящую от дозы гена судьбу клеток корня. Природа
465, 316–321. ( 10.1038/nature08977) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Miyashima S, Koi S, Hashimoto T, Nakajima K.
2011.
Неклеточно-автономная микроРНК165 действует дозозависимым образом, регулируя статус множественной дифференцировки в Корень арабидопсиса . Разработка
138, 2303–2313. ( 10.1242/dev.060491) [PubMed] [CrossRef] [Google Scholar]
42. Мияшима С., Хонда М., Хашимото К., Татемацу К., Хашимото Т., Сато-Нара К., Окада К., Накадзима К.
Мияшима С., Хонда М., Хашимото К., Татемацу К., Хашимото Т., Сато-Нара К., Окада К., Накадзима К.
2013.
Всесторонний анализ экспрессии семейства генов Arabidopsis MICRORNA165/6 во время эмбриогенеза показывает консервативную роль в спецификации меристемы и неклеточно-автономную функцию. Физиология клеток растений.
54, 375–384. ( 10.1093/pcp/pcs188) [PubMed] [CrossRef] [Google Scholar]
43. Ди Руокко Г., Бертолотти Г., Пасифичи Э., Полверари Л., Циантис М., Сабатини С., Костантино П., Делло Иойо Р.
2018.
Дифференциальное пространственное распределение miR165/6 определяет изменчивость анатомии корней растений. Разработка
145, 153858 (10.1242/dev.153858) [PubMed] [CrossRef] [Google Scholar]
44. Ван Г., Фирс М.
2010.
Передача сигналов пептида CLE во время развития растений. протоплазма
240, 33–43. ( 10.1007/s00709-009-0095-y) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Фиерс М., Големец Э., Сюй Дж., Ван дер Гест Л., Хейдстра Р., Стикема В. , Лю К.М.
, Лю К.М.
2005.
Пептиды CLV3, CLE19 и CLE40, состоящие из 14 аминокислот, запускают потребление корневой меристемы у Arabidopsis посредством CLAVATA2-зависимого пути. Растительная клетка
17, 2542–2553. ( 10.1105/tpc.105.034009) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Kinoshita A, et al.
2015.
Растительный белок U-box, PUB4, регулирует асимметричное клеточное деление и пролиферацию клеток в корневой меристеме. Разработка
142, 444–453. ( 10.1242/dev.113167) [PubMed] [CrossRef] [Google Scholar]
47. Коидзуми К., Хаяши Т., Ву С., Галлахер К.Л.
2012.
Белок SHORT-ROOT действует как мобильный дозозависимый сигнал при формировании паттерна основной ткани. проц. Натл акад. науч. США
109, 13 010–13 015. ( 10.1073/pnas.1205579109) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Wysocka-Diller JW, Helariutta Y, Fukaki H, Malamy JE, Benfey PN .
2000.
Молекулярный анализ функции ПУЧЕЛА выявляет радиальный механизм формирования паттерна, общий для корня и побега. Разработка
Разработка
127, 595–603. [PubMed] [Google Scholar]
49. Cui H, Benfey PN.
2009.
Взаимодействие между SCARECROW, GA и LIKE HETEROCHROMATIN PROTEIN 1 в формировании рисунка основной ткани в корне Arabidopsis . Плант Дж.
58, 1016–1027. ( 10.1111/j.1365-313X.2009.03839.x) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Rizzardi K, Landberg K, Nilsson L, Ljung K, Sundas-Larsson A.
2011.
TFL2/LHP1 участвует в биосинтезе ауксинов посредством позитивной регуляции генов YUCCA. Плант Дж.
65, 897–906. ( 10.1111/j.1365-313X.2010.04470.x) [PubMed] [CrossRef] [Google Scholar]
51. Chen W, Drapek C, Li D, Xu Z, Benfey P, Bai S.
2018.
Деацетилаза гистонов HDA19 влияет на судьбу клеток коры, взаимодействуя с ЧУЧЕЛОМ в корне Arabidopsis . bioRxiv. ( 10.1101/313791) [CrossRef] [Google Scholar]
52. Хо Джо, Чанг К.С., Ким И.А., Ли М.Х., Ли С.А., Сон С.К., Ли М.М., Лим Дж.
2011.
Направление передачи сигналов гиббереллина регулятором транскрипции GRAS, подобным чучелу 3 в Корень арабидопсиса .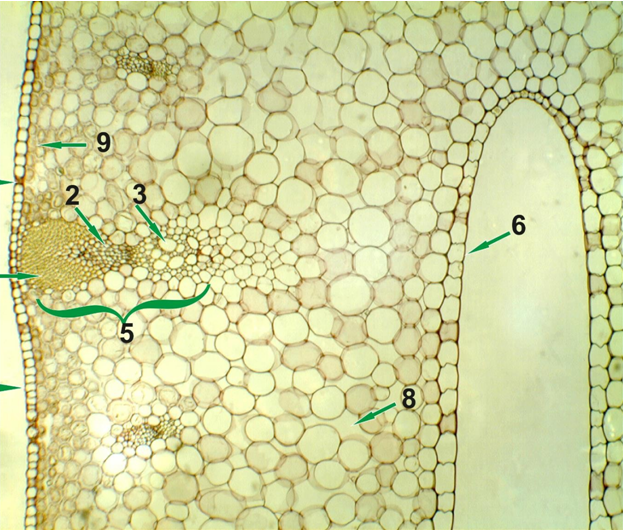 проц. Натл акад. науч. США
проц. Натл акад. науч. США
108, 2166–2171. ( 10.1073/pnas.1012215108) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Koizumi K, Gallagher KL.
2013.
Идентификация SHRUBBY, взаимодействующего белка SHORT-ROOT и SCARECROW, который контролирует рост корней и формирование радиального рисунка. Разработка
140, 1292–1300. ( 10.1242/dev.090761) [PubMed] [CrossRef] [Google Scholar]
54. Cui H, Kong D, Wei P, Hao Y, Torii KU, Lee JS, Li J.
2014.
SPINDLY, ERECTA и его лиганд STOMAGEN играют роль в редокс-опосредованной пролиферации коры головного мозга.0003 Корень арабидопсиса . Мол. Завод
7, 1727–1739. ( 10.1093/mp/ssu106) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Jeong JS, Kim YS, Baek KH, Jung H, Ha SH, Do Choi Y, Kim M, Reuzeau C , Ким Дж.К.
2010.
Специфичная для корней экспрессия OsNAC10 улучшает устойчивость к засухе и урожайность зерна риса в условиях полевой засухи. Завод Физиол.
153, 185–197. ( 10.1104/pp.110.154773) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Smith S, De Smet I.
Smith S, De Smet I.
2012.
Архитектура корневой системы: выводы из Arabidopsis и зерновые культуры. проц. Р. Соц. Б.
367, 1441–1452. ( 10.1098/rstb.2011.0234) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Qin F, Kodaira KS, Maruyama K, Mizoi J, Tran LS, Fujita Y, Morimoto K, Shinozaki K, Ямагути-Шинозаки К.
2011.
SPINDLY, негативный регулятор передачи сигналов гибберелловой кислоты, участвует в реакции растений на абиотический стресс. Завод Физиол.
157, 1900–1913 гг. ( 10.1104/pp.111.187302) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Цуй Х.
2015.
Пролиферация коры корня является защитным механизмом против абиотического стресса. Сигнал завода. Поведение
10, e1011949 (10.1080/15592324.2015.1011949) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Coudert Y, Perin C, Courtois B, Khong NG, Gantet P.
2010.
Генетический контроль развития корней у риса, модельного злака. Тенденции Растениевод.
15, 219–226. ( 10.1016/j.tplants.2010.01.008) [PubMed] [CrossRef] [Google Scholar]
( 10.1016/j.tplants.2010.01.008) [PubMed] [CrossRef] [Google Scholar]
60. Камия Н., Ито Дж., Мориками А., Нагато Ю., Мацуока М.
2003.
Роль гена ПУЧЕЛО в асимметричных клеточных делениях растений риса. Плант Дж.
36, 45–54. ( 10.1046/j.1365-313X.2003.01856.x) [PubMed] [CrossRef] [Google Scholar]
61. Ву С., Ли К.М., Хаяши Т., Прайс С., Дивол Ф., Генри С., Паулуцци Г., Перин С., Галлахер К.Л.
2014.
Вероятный механизм, основанный на движении коротких корней, для регулирования количества слоев клеток коры в корнях. проц. Натл акад. науч. США
111, 16 184–16 189. ( 10.1073/pnas.1407371111) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Henry S, Dievart A, Divol F, Pauluzzi G, Meynard D, Swarup Р, Ву С, Галлахер К.Л., Перин С.
2017.
Сверхэкспрессия SHR индуцирует образование дополнительных клеточных слоев с идентичностью клеток коры у риса. Дев. биол.
425, 1–7. ( 10.1016/j.ydbio.2017.03.001) [PubMed] [CrossRef] [Google Scholar]
63. Штерн Д.Л.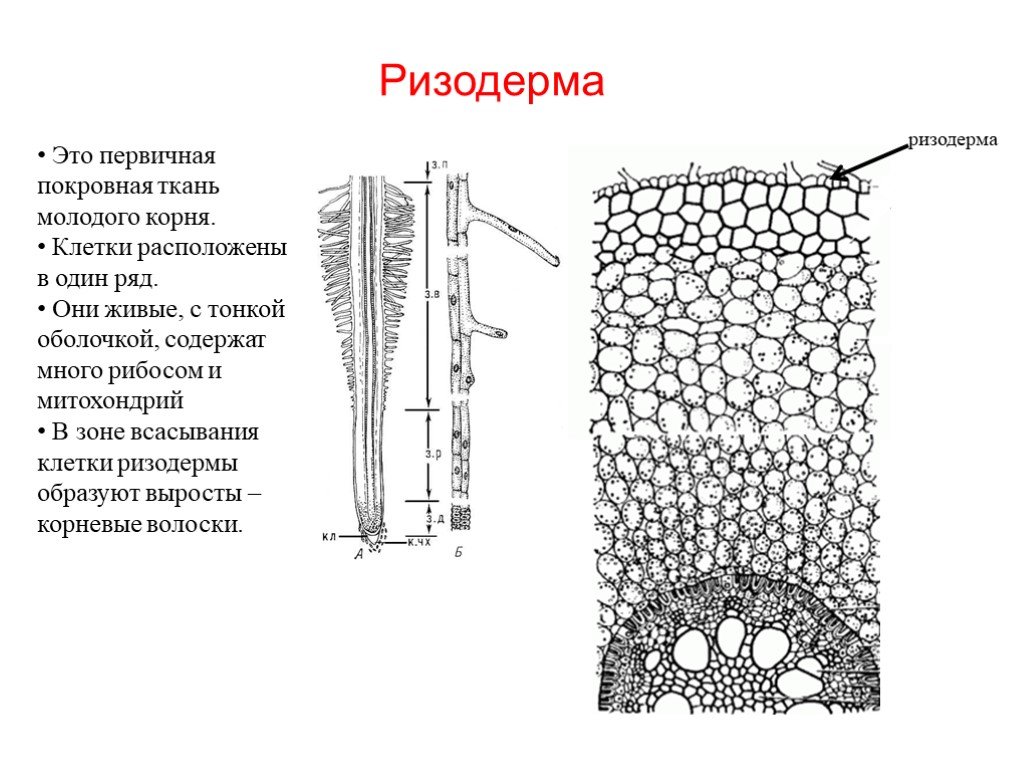 , Оргогозо В.
, Оргогозо В.
2009.
Предсказуема ли генетическая эволюция?
Наука
323, 746–751. ( 10.1126/science.1158997) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Romero IG, Ruvinsky I, Gilad Y.
2012.
Сравнительные исследования экспрессии генов и эволюции регуляции генов. Нац. Преподобный Жене.
13, 505–516. ( 10.1038/nrg3229) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Ментинк Р.А., Циантис М.
2015.
От конечностей к листьям: общие темы эволюционного разнообразия форм органов. Фронт. Жене.
6, 284 ( 10,3389/fgene.2015.00284) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Hay A, Barkoulas M, Tsiantis M.
2006.
Активности ASYMMETRIC LEAVES1 и ауксина конвергентны, чтобы подавить экспрессию BREVIPEDICELLUS и способствовать развитию листьев у Arabidopsis . Разработка
133, 3955–3961. ( 10.1242/dev.02545) [PubMed] [CrossRef] [Google Scholar]
67. Баркулас М., Хей А., Кугумуци Э., Циатис М.
2008.
Основа развития для формирования рассеченных листьев в Arabidopsis родственник Cardamine hirsuta . Нац. Жене.
Нац. Жене.
40, 1136–1141. (10.1038/ng.189) [PubMed] [CrossRef] [Google Scholar]
68. Vlad D, et al.
2014.
Эволюция формы листа за счет дупликации, регуляторной диверсификации и потери гена гомеобокса. Наука
343, 780–783. ( 10.1126/science.1248384) [PubMed] [CrossRef] [Google Scholar]
69. Пипер Б., Моннио М., Хей А.
2016.
Генетическая архитектура числа лепестков Cardamine hirsuta . Новый Фитол.
209, 395–406. ( 10.1111/nph.13586) [PubMed] [CrossRef] [Google Scholar]
70. Kougioumoutzi E, et al.
2013.
SIMPLE LEAF3 кодирует связанный с рибосомой белок, необходимый для развития листочка в Cardamine hirsuta . Плант Дж.
73, 533–545. (10.1111/tpj.12072) [PubMed] [CrossRef] [Google Scholar]
71. Раст-Сомссич М.И., и соавт.
2015.
Альтернативная проводка генетической сети KNOXI лежит в основе различий в развитии листьев A. thaliana и C. hirsuta . Гены Дев.
29, 2391–2404. ( 10.1101/gad.269050.115) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Hofhuis H, et al.
Hofhuis H, et al.
2016.
Морфомеханические инновации способствуют взрывному рассеиванию семян. Клетка
166, 222–233. ( 10.1016/j.cell.2016.05.002) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Вуоло Ф., Ментинк Р.А., Хайхейдари М., Бейли К.Д., Филатов Д.А., Циантис М.
2017.
Исправление: комбинированная эволюция энхансера и кодирующей последовательности разнообразия листьев в форме гена гомеобокса. Гены Дев.
31, 2199 (10.1101/gad.309179.117) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Hay AS, et al.
2014.
Cardamine hirsuta : универсальная генетическая система для сравнительных исследований. Плант Дж.
78, 1–15. (10.1111/tpj.12447) [PubMed] [CrossRef] [Google Scholar]
75. Gan X, et al.
2016.
Геном Cardamine hirsuta дает представление об эволюции морфологического разнообразия. Нац. Растения
2, 16167 ( 10.1038/nplants.2016.167) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вегетативные части растений
Растения имеют внешние структуры, такие как листья, стебли, корни, цветы, плоды и семена. Эти структуры известны как органы растений . Каждый орган представляет собой организованную группу тканей, которые работают вместе для выполнения определенной функции. Структуры можно разделить на две группы: половые репродуктивные и вегетативные .
Эти структуры известны как органы растений . Каждый орган представляет собой организованную группу тканей, которые работают вместе для выполнения определенной функции. Структуры можно разделить на две группы: половые репродуктивные и вегетативные .
Вегетативные части (рис. 1) включают корни, стебли, побеги и листья. Они не принимают непосредственного участия в половом размножении. Вегетативные части часто используются при бесполых формах размножения. Примеры включают черенкование, окулировку или прививку.
Корни
Функции корней — поглощать питательные вещества и влагу, закреплять растение в почве, поддерживать стебель и запасать пищу.
Корни часто упускают из виду, вероятно, потому, что они менее заметны, чем остальная часть растения. Однако важно понимать корневую систему растений. Они оказывают заметное влияние на размер и силу растения, способ размножения, адаптацию к типам почвы и реакцию на агротехнику и орошение.
Корни обычно происходят из нижней части растения или черенка. У них есть корневой чехлик, но нет узлов, и они никогда не несут непосредственно листья или цветы.
Их основные функции — поглощать питательные вещества и влагу, закреплять растение в почве, поддерживать стебель и запасать пищу. У некоторых растений их можно использовать для размножения.
Структура
Внутри корень состоит из трех основных частей (рис. 2).
- Меристема находится на кончике и производит новые клетки. Это зона деления и роста клеток.
- За меристемой находится зона удлинения . В этой области клетки увеличиваются в размерах за счет поглощения пищи и воды. По мере роста они проталкивают корень сквозь почву.
- Зона созревания находится непосредственно под стеблем. Здесь клетки становятся специфическими тканями, такими как эпидермис, кора или сосудистая ткань.
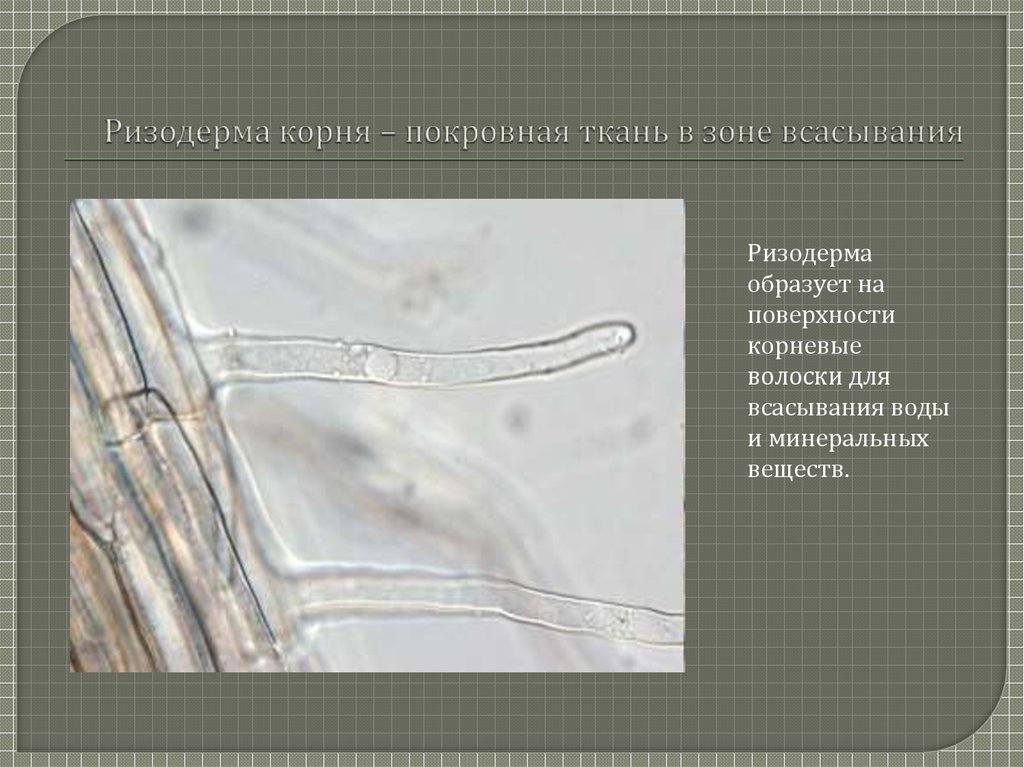
Корень эпидермис является его наружным слоем клеток (рис. 3). Эти клетки отвечают за поглощение воды и минералов, растворенных в воде.
3). Эти клетки отвечают за поглощение воды и минералов, растворенных в воде.
Клетки коры участвуют в перемещении воды из эпидермиса в сосудистую ткань (ксилема и флоэма) и в хранении пищи. Сосудистая ткань расположена в центре корня и проводит питание и воду.
Внешне важны две области: корневой чехлик и корневые волоски (рис. 2). Корневой чехлик — это самый внешний кончик корня. Он состоит из клеток, которые отслаиваются по мере того, как корень прорастает через почву. Его функция заключается в защите корневой меристемы.
Корневые волоски представляют собой тонкие удлиненные клетки эпидермиса. Они возникают в небольшой зоне сразу за растущей верхушкой корня. Обычно они кажутся прекрасными невооруженным глазом. Их функция заключается в увеличении площади поверхности корня и всасывающей способности.
Корневые волоски обычно живут один или два дня. При пересадке растения они легко отрываются или могут засохнуть на солнце.
Многие корни имеют естественные симбиотические (взаимовыгодные) отношения с некоторыми грибами. Эта взаимосвязь улучшает способность растения поглощать воду и питательные вещества. Эта полезная ассоциация называется микоризой (гриб + корень).
Типы корней
Существует два основных типа корней: основной и боковой.
- Первичный корень берет начало на нижнем конце зародыша проростка. Некоторые первичные корни продолжают удлиняться вниз, становятся центральным элементом корневой системы и имеют ограниченное вторичное ветвление. Эти корни называются стержневыми корнями (рис. 4). Деревья гикори и пекан, а также морковь имеют стержневые корни.
- Боковой или вторичный корень — это боковой или ветвящийся корень, отходящий от другого корня. Если первичный корень перестает удлиняться и развиваются многочисленные боковые корни, формируется мочковатая корневая система.
 Эти боковые корни многократно ветвятся. Они образуют сеть питающих корней, характерную для большинства растений.
Эти боковые корни многократно ветвятся. Они образуют сеть питающих корней, характерную для большинства растений.
Некоторые растения, такие как травы, естественным образом образуют мочковатую корневую систему. В других случаях отсечение основного корня растения путем его подрезания может побудить растение образовать мочковатую корневую систему. Питомники используют эту технику с деревьями, у которых естественным образом образуется стержневой корень. Деревья с компактной мочковатой корневой системой пересаживаются успешнее.
Как растут корни
На раннем этапе развития росток поглощает питательные вещества и влагу из почвы вокруг прорастающего семени. Полоска удобрений на несколько дюймов с каждой стороны и чуть ниже недавно посаженных семян способствует раннему росту большинства пропашных культур.
По мере того, как растение хорошо приживается, количество и расположение его корней сильно влияют на его способность поглощать влагу и питательные вещества.
У большинства растений большая часть поглощающих (питающих) корней расположена в верхних 12 дюймах почвы. Почвенная среда в этом регионе обычно лучше всего подходит для роста корней. Почва в этой зоне имеет хороший баланс плодородия, влаги и воздушных пространств.
Для роста корней важны следующие факторы:
- Корни в водонасыщенной почве плохо растут. В конечном итоге они могут погибнуть из-за нехватки кислорода.
- Корни проникают гораздо глубже в рыхлую, хорошо дренированную почву, чем в тяжелую, плохо дренированную почву.
- Плотный уплотненный слой почвы может ограничивать или прекращать рост корней.
- Контейнерные растения имеют ограниченную зону для роста корней. Они также восприимчивы к холодным повреждениям, потому что ограниченное количество почвы вокруг их корней не может обеспечить достаточную изоляцию.
- Корни растут не только вниз, но и в стороны. На самом деле, они часто выходят далеко за пределы капельной линии растения.
 Помните об этой обширной корневой системе, когда тревожите почву вокруг существующих деревьев и кустарников.
Помните об этой обширной корневой системе, когда тревожите почву вокруг существующих деревьев и кустарников.
Корни в пищу
Увеличенный корень является съедобной частью некоторых овощных культур. Батат представляет собой вздутый клубневидный корень. Морковь, пастернак, козлобородник и редис имеют удлиненные стержневые корни.
Стебли
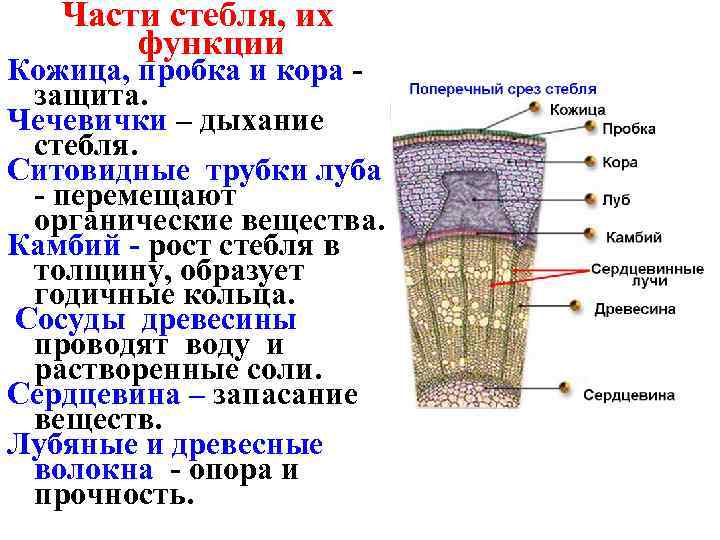
Стебли поддерживают почки и листья и переносят воду, минеральные вещества и питательные вещества (фотосинтез).
Стебли поддерживают почки и листья и переносят воду, минералы и пищу (фотосинтез). Сосудистая система внутри стебля образует непрерывный путь от корня через стебель и, наконец, к листьям. Именно по этой системе движется вода и пищевые продукты.
Терминология стебля
- Побег : Молодой стебель (возрастом до года) с листьями.
- Веточка : Молодой стебель (возрастом до года), находящийся в зимней стадии покоя (без листьев).
- Ветвь : Стебель старше одного года, обычно с отходящими от него боковыми стеблями.

- Ствол : Главный стебель древесного растения.
Структура
Сосудистая система
Эта система состоит из ксилемы , флоэмы и сосудистого камбия . Его можно рассматривать как водопровод завода. Трубки Xylem проводят воду и растворенные минералы. Phloem пробирки содержат пищевые продукты, такие как сахар.
Камбий представляет собой слой меристематической ткани, разделяющий ксилему и флоэму. Он постоянно производит новые клетки ксилемы и флоэмы. Эта новая ткань отвечает за увеличение стебля в обхвате.
Сосудистый камбий важен для садоводов. Например, ткани на привитых привоях и подвоях должны совпадать. Кроме того, неосторожная обрезка сорняков может содрать с дерева кору. Это может повредить камбий и привести к гибели дерева.
Сосудистые системы однодольных и двудольных растений различаются (рис. 5). Оба содержат ксилему и флоэму, но эти структуры устроены по-разному.
5). Оба содержат ксилему и флоэму, но эти структуры устроены по-разному.
- У однодольных растений ксилема и флоэма образуют пучки. Эти пучки рассеяны по всему стеблю.
- У двудольных растений сосудистая система называется непрерывной, поскольку внутри стебля она образует кольца. Кольцо флоэмы находится рядом с корой и со временем становится частью коры у зрелых одревесневших стеблей. Ксилема образует внутреннее кольцо. У древесных растений его называют заболонью и сердцевиной.
Различие сосудистых систем однодольных и двудольных растений представляет практический интерес для садоводов. Некоторые гербициды действуют только на одну группу. Например, 2,4-Д убивает только растения с непрерывной сосудистой системой (двудольные). С другой стороны, неселективные гербициды (например, глифосат) убивают растения независимо от типа их сосудистой системы.
Узлы
Узлы — это область на стебле, где расположены почки (рис.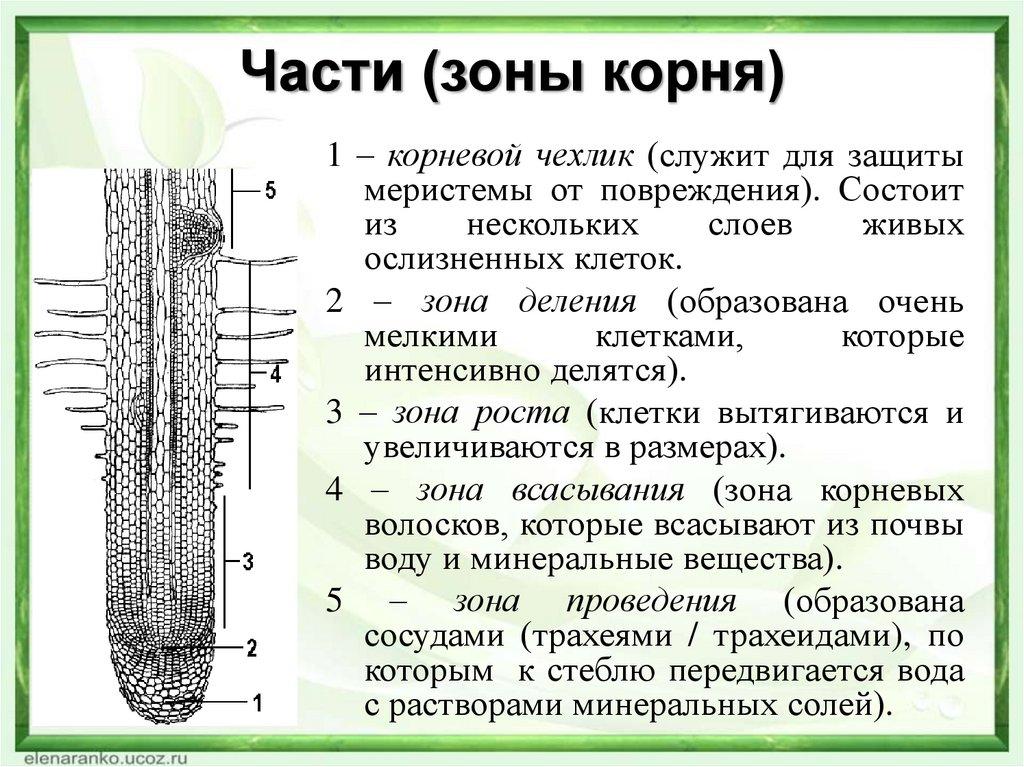 6). Это место большой клеточной активности и роста. Именно здесь маленькие почки развиваются в листья, стебли или цветы.
6). Это место большой клеточной активности и роста. Именно здесь маленькие почки развиваются в листья, стебли или цветы.
При обрезке важно определить местонахождение узлов растения. Как правило, вы хотите сделать обрезку чуть выше, но не слишком близко к узлу. Такая обрезка побуждает почки в этом узле начать развитие. В конечном итоге он сформирует новые стебли или листья.
Область между двумя узлами называется межузлом . Его длина зависит от многих факторов, в том числе от генетики. Несколько других факторов также могут влиять на длину междоузлий:
- Снижение плодородия почвы уменьшает длину междоузлий. Напротив, применение удобрений с высоким содержанием азота может значительно увеличить его.
- Недостаток света увеличивает длину междоузлий и вызывает вытянутый стебель. Эта ситуация известна как растяжение, или этиоляция . Часто возникает у рассады, выращенной в помещении, и у комнатных растений, которые не получают достаточного количества солнечного света.

- Длина междоузлия также зависит от сезона. Ранний рост имеет длинные междоузлия. В. Напротив, прирост в конце сезона обычно имеет гораздо более короткие междоузлия.
- Энергию стебля можно разделить между тремя или четырьмя боковыми стеблями или направить на рост и развитие плода. В этом случае укорачивается длина междоузлия.
- Вещества, регулирующие рост растений, и гербициды также могут влиять на длину междоузлий.
Типы стеблей
Стебли могут быть длинными, с большими расстояниями между листьями и почками. Примеры включают ветки деревьев и побеги клубники. Другие стебли сжаты, с короткими расстояниями между почками или листьями. Примеры включают кроны растений клубники, плодовые шпоры и африканские фиалки.
Стебли обычно растут над землей. Однако иногда они растут под землей в виде корневищ, клубней, клубнелуковиц или луковиц. Все стебли должны иметь почки или листья, чтобы их можно было классифицировать как ткань стебля.
Специализированные надземные стебли
Некоторые растения имеют специализированные надземные стебли, известные как короны , шпоры или столоны (рис. 7).
7).
- Коронки (на землянике, одуванчиках и африканских фиалках) представляют собой сжатые стебли. У них листья и цветки на коротких междоузлиях.
- Шпоры — это короткие коренастые боковые стебли, отходящие от основного стебля. Это плодоносящие стебли груши, яблони и вишни. Если провести сильную обрезку рядом с плодоносящими побегами, они могут превратиться в бесплодные стебли. Это устранит потенциальный годовой урожай фруктов.
- Столоны мясистые или полудеревянистые, удлиненные, горизонтальные стебли. Они часто лежат вдоль поверхности почвы. Клубничные побеги представляют собой столоны с небольшими листьями в узлах. Из этих узлов развиваются корни, и формируется дочернее растение. Этот тип вегетативного размножения — простой способ увеличить размер грядки клубники. Паукообразные растения также производят столоны, которые в конечном итоге могут стать совершенно новыми растениями.
Специализированные подземные стволы
Клубни картофеля, корневища ирисов и луковицы тюльпанов представляют собой подземные стебли, в которых хранится питание для растения (рис.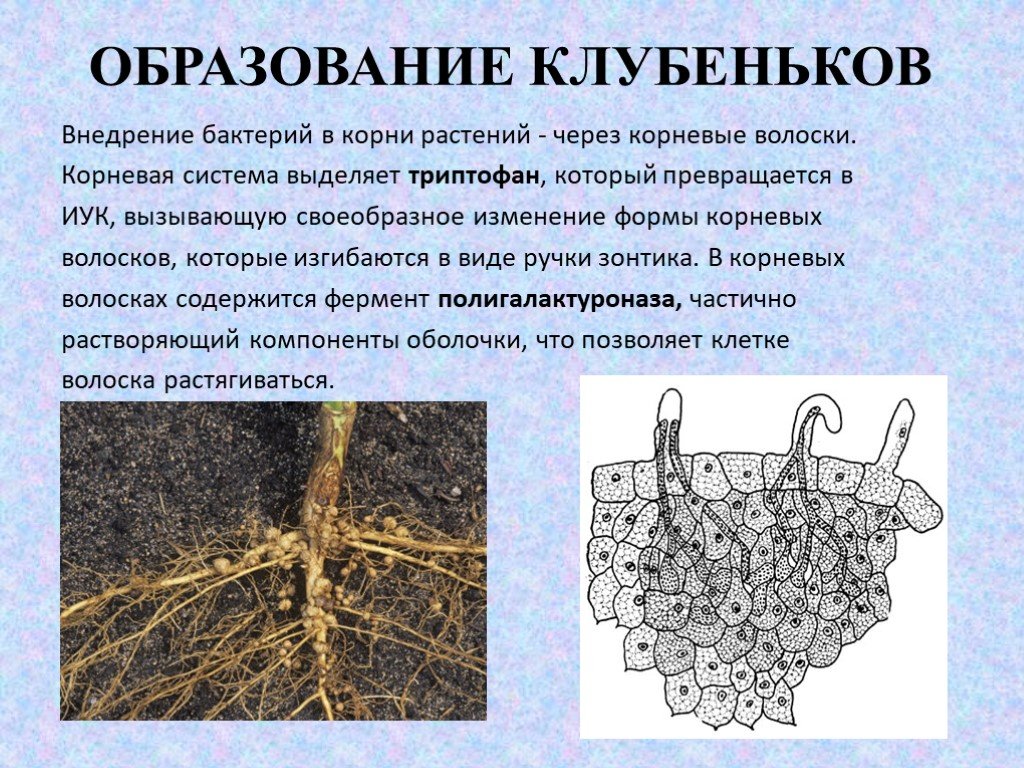 8). Иногда трудно отличить корни от стеблей, но один из верных способов — искать узлы. Стебли имеют узлов ; корни нет.
8). Иногда трудно отличить корни от стеблей, но один из верных способов — искать узлы. Стебли имеют узлов ; корни нет.
Например, у картофеля клубней «глазки» на самом деле являются узлами стебля. Каждый глаз содержит группу почек. При выращивании картофеля из кусочков семян важно, чтобы каждый кусочек имел хотя бы один глазок и был размером с мяч для гольфа. Это обеспечит достаточно энергии для раннего роста побегов и корней.
Корневища напоминают столоны, потому что они растут горизонтально от растения к растению. Некоторые корневища сжатые и мясистые (например, ирис). Другие тонкие и имеют удлиненные междоузлия (например, полевица). Джонсонграсс является коварным сорняком, главным образом из-за способности его корневища разрастаться.
Из луковиц тюльпанов, лилий, нарциссов и лука получают луковиц . Это укороченные, сжатые подземные стебли, окруженные мясистыми чешуйками (листьями), которые охватывают центральную почку на кончике стебля.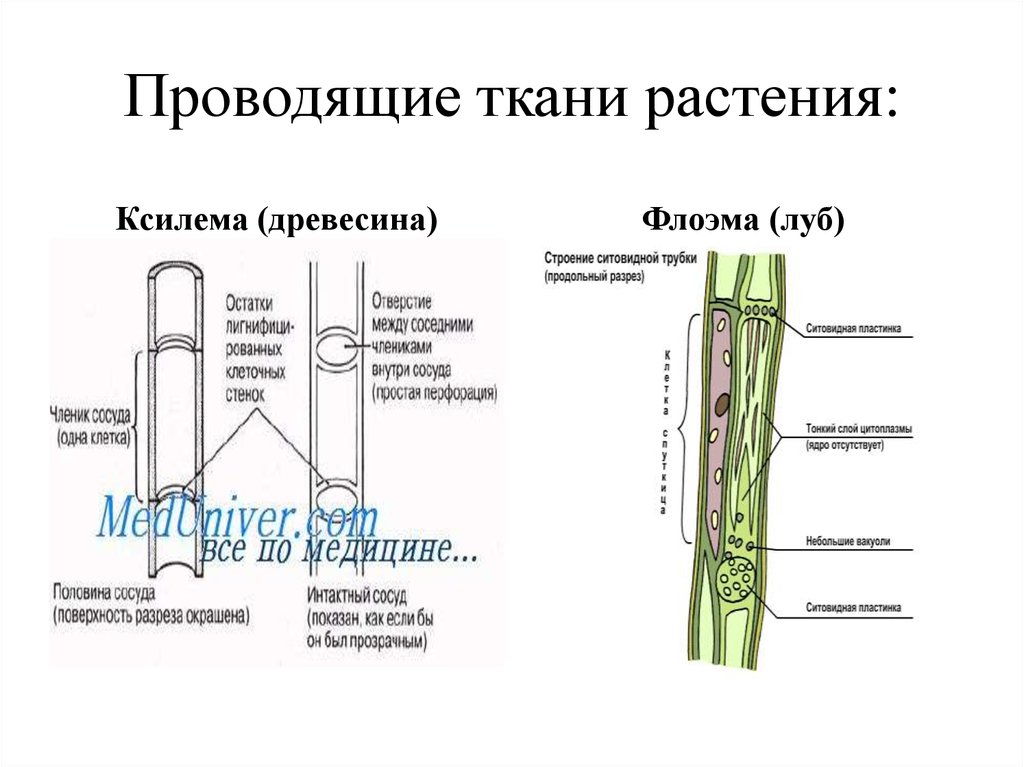 В ноябре вы можете разрезать луковицу тюльпана или нарцисса пополам и увидеть все части цветка в миниатюре.
В ноябре вы можете разрезать луковицу тюльпана или нарцисса пополам и увидеть все части цветка в миниатюре.
После цветения луковичного растения его флоэма переносит запасы пищи из листьев в чешуйки луковицы. Когда весной луковица начинает расти, она использует запасы пищи.
По этой причине важно не удалять листья с нарциссов, тюльпанов и других луковичных растений до тех пор, пока они не пожелтеют и не завянут. В это время они закончили производство пищи, которая будет использована для цветения в следующем году.
Есть два типа лампочек: оболочниковый и необолочечный (фиг.8).
- Tunicate Луковицы (например, нарциссов, тюльпанов и лука) имеют тонкое бумажное покрытие. Это покрытие на самом деле является модифицированным листом. Это помогает защитить луковицу от повреждения во время выкапывания и от высыхания после извлечения из почвы.
- Необолочечные луковицы (например, лилии) не имеют этого бумажного покрытия.
 Они очень подвержены повреждениям и высыханию, поэтому обращайтесь с ними очень осторожно.
Они очень подвержены повреждениям и высыханию, поэтому обращайтесь с ними очень осторожно.
Клубнелуковицы — еще один вид подземных стеблей. Хотя и луковицы, и клубнелуковицы состоят из стеблевой ткани, они не одинаковы. Клубнелуковицы имеют форму луковиц, но не содержат мясистых чешуек. Клубнелуковица представляет собой твердый вздутый стебель с сухими чешуйчатыми листьями. Гладиолусы и крокусы образуют клубнелуковицы.
Некоторые растения (например, клубневые бегонии и цикламены) образуют модифицированный подземный стебель, называемый клубневым стеблем . Эти стебли короткие, плоские и увеличенные. Сверху (крона) возникают почки и побеги, а снизу отрастают мочковатые корни.
Другие растения (например, георгины и сладкий картофель) производят подземные запасающие органы, называемые клубневыми корнями . Эти органы часто путают с луковицами и клубнями. Однако они состоят из ткани корня, а не из ткани стебля, и у них нет ни узлов, ни междоузлий.
Стебли и размножение
Стебли часто используются для вегетативного размножения растений. Использование участков надземных стеблей, содержащих узлы и междоузлия, является эффективным способом размножения многих декоративных растений. Эти стеблевые черенки дают корни и, в конечном итоге, новые растения.
Подземные стебли также являются хорошими тканями для размножения. Вы можете разделить корневища на части или удалить маленькие луковицы или корневища от их родителя. Клубни можно разрезать на кусочки, содержащие глазки и узлы. Все эти ткани будут производить новые растения.
Виды растений и их стебли
Деревья обычно имеют один, но иногда несколько основных стволов. Стволы деревьев обычно достигают более 12 футов в высоту в зрелом возрасте. Напротив, кустарники обычно имеют несколько основных стеблей, и в зрелом возрасте они обычно не превышают 12 футов в высоту.
Стволы большинства плодовых, декоративных деревьев и кустарников одревесневают.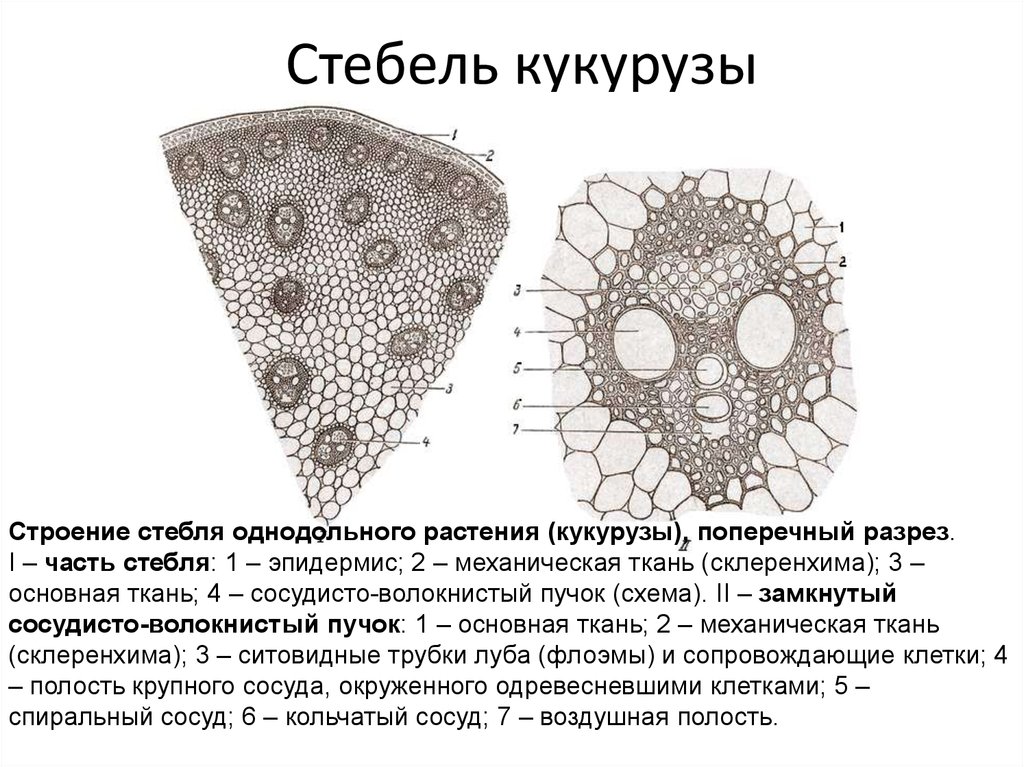 Эти стебли содержат большое количество затвердевшей ткани ксилемы в центральной части (сердцевина или заболонь).
Эти стебли содержат большое количество затвердевшей ткани ксилемы в центральной части (сердцевина или заболонь).
Стебли травянистых или суккулентных растений содержат лишь небольшое количество ткани ксилемы. Обычно они живут только один вегетационный период. У многолетних растений каждый год из кроны (между корнем и стеблем) развиваются новые травянистые стебли.
Побеги (рис. 9а) представляют собой стебли с относительно большой сердцевиной (центральной силовой тканью). Обычно они живут всего один или два года. Примеры растений с тростями включают розы, виноград, ежевику и малину. Для выращивания фруктов важно знать, какие побеги нужно обрезать, как их обрезать и когда их обрезать.
Лиана (рис. 9b) представляет собой растение с длинными висячими стеблями. Некоторые лианы растут вдоль земли. Другие должны поддерживаться другим заводом или сооружением.
Вьющиеся лозы окружают структуру для поддержки. Некоторые кружат по часовой стрелке (например, хмель и жимолость). Другие вращаются против часовой стрелки (например, фасоль и трубочная лоза голландца).
Некоторые кружат по часовой стрелке (например, хмель и жимолость). Другие вращаются против часовой стрелки (например, фасоль и трубочная лоза голландца).
Некоторые вьющиеся лианы поддерживаются воздушными корнями (например, плющ английский и ядовитый плющ). Другие поддерживаются тонкими усиками, которые окружают поддерживающий объект (например, огурцы, тыквы, виноград и страстоцветы). Наконец, у некоторых лиан есть усики с клейкими кончиками (например, лиана вирджиния и японская).
Стебли в пищу
Съедобная часть некоторых культурных растений представляет собой увеличенный сочный стебель. Примеры включают спаржу и кольраби. Съедобные части брокколи состоят из ткани стебля, цветочных почек и нескольких маленьких листьев. Съедобный клубень картофеля представляет собой мясистый подземный стебель. И хотя название говорит об обратном, съедобная часть цветной капусты на самом деле представляет собой разросшуюся ткань стебля.
Почки
Почка – это неразвитый побег, из которого вырастают листья или части цветка.
Почка – это неразвитый побег, из которого вырастают листья или части цветка. Почки деревьев и кустарников умеренной зоны обычно имеют защитный внешний слой из мелких кожистых чешуек. Однолетние растения и травянистые многолетники имеют голые почки с зелеными, несколько сочными внешними листьями.
Почкам многих растений требуется выдержка в течение определенного количества дней при температуре ниже критической, прежде чем весной возобновится рост. Этот период, часто называемый отдыхом, у разных растений различен. Forsythia, например, требует относительно короткого периода покоя. Таким образом, он растет при первых признаках теплой погоды. С другой стороны, многим сортам персика требуется от 700 до 1000 часов при температуре ниже 45°F.
В состоянии покоя спящие почки могут выдерживать очень низкие температуры. После того, как период покоя удовлетворен, они более восприимчивы к холодным температурам или морозу.
Листовая почка состоит из короткого стебля с зачаточными листьями.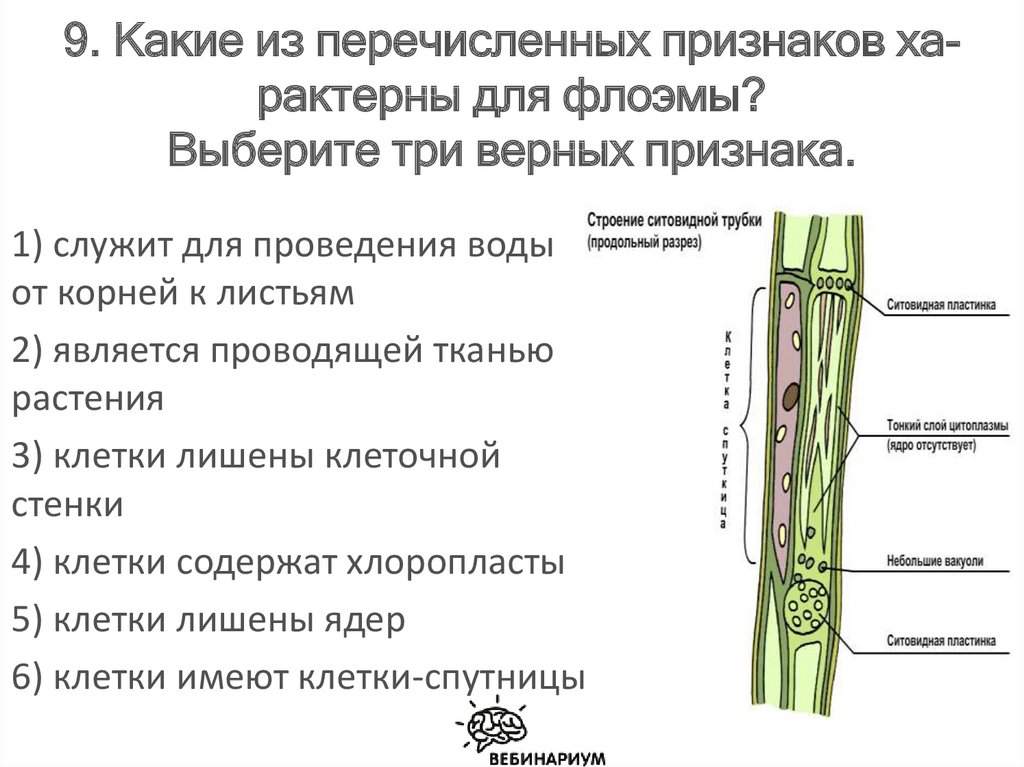 Листовые почки часто менее пухлые и более заостренные, чем цветочные (рис. 10а).
Листовые почки часто менее пухлые и более заостренные, чем цветочные (рис. 10а).
Бутон цветка состоит из короткого стебля с зачаточными частями цветка. В случае плодовых культур цветочные почки иногда называют плодовыми почками. Однако эта терминология неверна. Хотя цветы могут превратиться в плоды, они могут этого не сделать из-за неблагоприятных погодных условий, отсутствия опыления или других неблагоприятных обстоятельств.
Расположение
Почки названы в честь их расположения на стебле (рис. 10b). Верхушечные почки расположены на верхушке (кончике) стебля. Боковые ( пазушные ) почки расположены по бокам стебля. Обычно они возникают там, где лист встречается со стеблем (пазуха ). В некоторых случаях пазуха содержит более одной почки.
Придаточные почки возникают в местах, отличных от верхушечного или пазушного положения. Они могут развиваться из корней, стебля междоузлие , край листовой пластинки или мозоли на срезанном конце стебля или корня. Придаточные почки позволяют черенкам стебля, листьев и корней развиваться в совершенно новые растения.
Придаточные почки позволяют черенкам стебля, листьев и корней развиваться в совершенно новые растения.
Почки в пищу
Увеличенные почки или части почек составляют съедобную часть некоторых садовых культур. Капуста и кочанный салат являются примерами необычно больших верхушечных бутонов. Сочные пазушные почки – съедобная часть брюссельской капусты. В случае шаровидного артишока едят мясистую базальную часть прицветников цветочного бутона вместе с его твердым стеблем. Брокколи — самое важное садовое растение со съедобными цветочными почками. В этом случае в пищу поедаются части стебля, а также мелкие листья, связанные с цветочными почками.
Листья
Функция и строение
Основная функция листьев — поглощать солнечный свет для производства растительных сахаров.
Основной функцией листьев является поглощение солнечного света для производства растительных сахаров. Этот процесс называется фотосинтезом . Поверхность листа сглажена, чтобы обеспечить большую площадь для эффективного поглощения света. Лезвие представляет собой расширенную тонкую структуру по обе стороны от средней жилки. Обычно это самая крупная и заметная часть листа (рис. 11).
Лезвие представляет собой расширенную тонкую структуру по обе стороны от средней жилки. Обычно это самая крупная и заметная часть листа (рис. 11).
Лист отделен от стебля стеблевидным придатком, называемым черешком . Основание черешка прикреплено к стеблю в узле . Черешки различаются по длине или могут полностью отсутствовать. При отсутствии черешка листовая пластинка описывается как сидячая или бесстебельная.
Узел, где черешок встречается со стеблем, называется пазухой листа . Пазуха содержит одиночные почки или группы почек, называемые пазушными почками. Они могут быть как активными, так и спящими. При правильных условиях они разовьются в стебли или листья.
Листовая пластинка состоит из нескольких слоев (рис. 12а и 12б). Сверху и снизу находится слой толстых жестких клеток, называемый эпидермисом . Его основная функция заключается в защите других слоев ткани листа.
Расположение клеток эпидермиса определяет текстуру поверхности листа.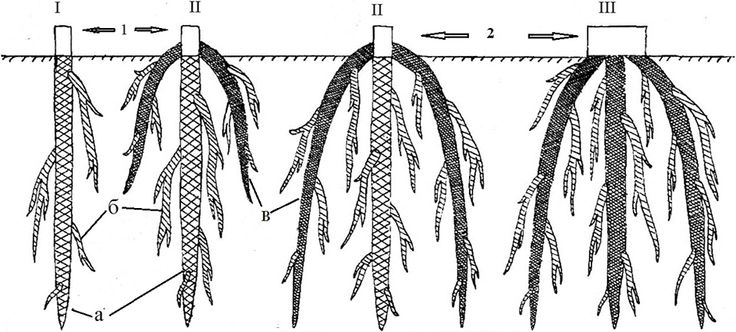 Некоторые листья, например у фиалки африканской, имеют волоски ( опушение ). Эти волоски являются продолжением клеток эпидермиса, и они делают листья бархатными.
Некоторые листья, например у фиалки африканской, имеют волоски ( опушение ). Эти волоски являются продолжением клеток эпидермиса, и они делают листья бархатными.
Кутикула является частью эпидермиса. Он образует восковой слой под названием кутин , который защищает лист от обезвоживания и болезней.
Количество кутина на листе увеличивается с увеличением интенсивности света. По этой причине, перемещая растения из тени на солнечный свет, делайте это постепенно в течение нескольких недель. Это постепенное воздействие солнечного света позволяет наращивать слой кутина. Более толстый срезанный слой защитит листья от быстрой потери влаги или солнечных ожогов.
Восковидный кутин также отталкивает воду. По этой причине многие пестициды содержат аэрозольную добавку, помогающую продукту прилипать к кутиновому слою или проникать в него.
Специальные эпидермальные клетки, называемые замыкающими клетками , открываются и закрываются в ответ на внешние раздражители, такие как изменения погоды и света. Они регулируют поступление воды, кислорода и углекислого газа в лист и из него через крошечные отверстия, называемые устьицами . У большинства видов большая часть устьиц расположена на нижней стороне листьев.
Они регулируют поступление воды, кислорода и углекислого газа в лист и из него через крошечные отверстия, называемые устьицами . У большинства видов большая часть устьиц расположена на нижней стороне листьев.
Условия, при которых растения теряют много воды (высокая температура, низкая влажность), стимулируют закрытие замыкающих клеток. В мягкую погоду они остаются открытыми. Охранные клетки также закрываются при отсутствии света.
Между верхним и нижним эпидермисом расположен мезофилл . Он делится на плотный верхний слой (палисадный мезофилл) и нижний слой, содержащий много воздушного пространства (губчатый мезофилл). В клетках мезофилла расположены хлоропластов , в которых происходит фотосинтез.
Типы листьев
Существует множество видов листьев растений. Наиболее распространенные и бросающиеся в глаза листья называются листвой. Они являются основным местом фотосинтеза. Однако существует множество других видов видоизмененных листьев.
- Листья чешуи (катафиллы) находятся на корневищах и почках, которые они окружают и защищают.
- Семенные листья ( семядоли ) встречаются на эмбриональных растениях. В них хранится питание для развивающегося саженца.
- Колючки и усики , например, имеющиеся на растениях барбариса и гороха, защищают растение или помогают поддерживать его стебли.
- Листья для хранения , например, на луковичных растениях и суккулентах, для хранения пищевых продуктов.
- Прицветники часто ярко окрашены. Например, эффектные структуры на кизилах и пуансеттиях — это прицветники, а не лепестки.
Жилкование
Проводящие пучки ксилемы и флоэмы отходят от стебля через черешок и в листовую пластинку в виде жилок. Срок жилкование относится к тому, как жилки распределены в лезвии. Существует два основных типа жилкования: с параллельными жилками и с сетчатыми жилками (рис. 13).
13).
В листьях с параллельными жилками многочисленные жилки проходят практически параллельно друг другу. Сбоку они соединены мелкими прямыми прожилками. Листья с параллельным жилкованием чаще всего встречаются у однодольных растений.
Наиболее распространенный тип параллельных жилок встречается у растений семейства злаковых. Жилки этих растений проходят от основания листа к его вершине. Другой тип параллельного жилкования встречается у таких растений, как банан, калла и кипрей. У этих растений жилки отходят латерально от средней жилки.
В листьях с сетчатыми жилками (также называемых с сетчатыми жилками ) жилки ответвляются от основного ребра или ребер и подразделяются на более мелкие жилки. Затем эти прожилки объединяются в сложную сеть. Эта система переплетенных жилок делает лист более устойчивым к разрыву, чем структура с параллельными жилками. Листья с сетчатым жилкованием встречаются у двудольных растений.
Сетчатое жилкование может быть перистым или пальчатым. У перистого жилкования жилки отходят латерально от средней жилки к краю. Примеры включают яблоки, вишни и персики. В пальчатое жилкование, главные жилки отходят наружу, как ребра веера, от основания листовой пластинки. Примеры включают виноград и клены.
Листья как идентификаторы растений
Листья используются для идентификации растений. Жилкование листа (рис. 13), форма лезвия и края (рис. 14 и 15), а также формы вершины и основания (рис. 16) могут быть важными отличительными характеристиками.
Тип листа (рис. 17) также важен для идентификации. Есть два типа листьев: простой и составной . У простых листьев листовая пластинка представляет собой единый непрерывный узел. Сложные листья состоят из нескольких отдельных листочков, отходящих от одного и того же черешка. Некоторые листья двоякосложные. Тип листа может сбивать с толку, потому что простой лист с глубокими лопастями может выглядеть как сложный лист.
Тип листа может сбивать с толку, потому что простой лист с глубокими лопастями может выглядеть как сложный лист.
Расположение листьев вдоль стебля также используется для идентификации растений (рис. 18). Существует четыре типа расположения створок:
- Противоположные листья расположены поперек стебля друг от друга. В каждом узле есть два листа.
- Чередующиеся (спиральные) листья расположены чередующимися шагами вдоль стебля. Каждый узел имеет только один лист.
- Листья мутовчатые расположены по кругу вдоль стебля.
- Розоватые листья расположены в розетке вокруг стебля. У них очень короткие узлы.
Листья в пищу
Листовая пластинка является основной съедобной частью некоторых садовых культур. Примеры включают зеленый лук, листовую капусту, одуванчики, цикорий, листовой салат, горчицу, петрушку, шпинат, мангольд и другую зелень. Съедобная часть лука-порея, лука и флорентийского фенхеля представляет собой скопление мясистых оснований листьев.

 Эти боковые корни многократно ветвятся. Они образуют сеть питающих корней, характерную для большинства растений.
Эти боковые корни многократно ветвятся. Они образуют сеть питающих корней, характерную для большинства растений.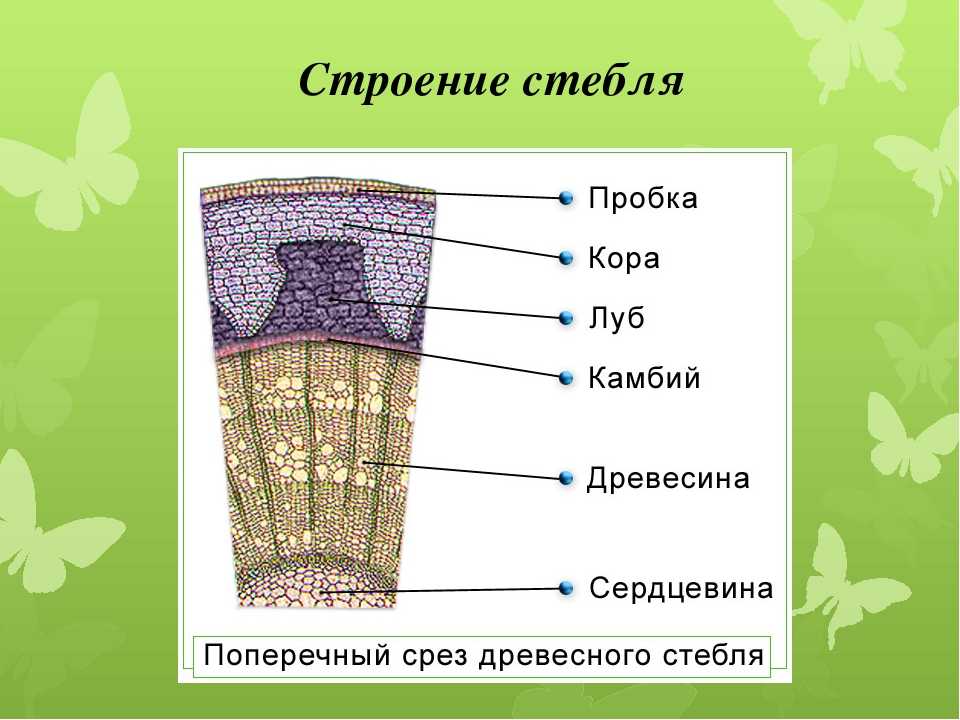 Помните об этой обширной корневой системе, когда тревожите почву вокруг существующих деревьев и кустарников.
Помните об этой обширной корневой системе, когда тревожите почву вокруг существующих деревьев и кустарников.