Содержание
Реферат По Биологии 6 Класс Ткани Растений – Telegraph
➡➡➡ ПОДРОБНЕЕ ЖМИТЕ ЗДЕСЬ!
Реферат По Биологии 6 Класс Ткани Растений
В биологии тканью называют группу клеток, имеющих сходное строение и происхождение, а также выполняющих одинаковые функции . У растений наиболее разнообразные и сложно устроенные ткани развились в процессе эволюции у покрытосеменных (цветковых). Органы растений обычно образованы несколькими тканями. Можно выделить шесть типов тканей растений: образовательную, основную, проводящую, механическую, покровную, секреторную. Каждая ткань включает подтипы. Между тканями, а также внутри них бывают межклетники — промежутки между клетками.
Благодаря делению клеток образовательной ткани растение увеличивается в длину и толщину. При этом часть клеток образовательной ткани дифференцируется в клетки других тканей.
Клетки образовательной ткани достаточно мелкие, плотно прилегают друг к другу, имеют крупное ядро и тонкую оболочку.
Образовательная ткань в растениях находится в конусах нарастания корня (кончик корня) и стебля (верхушка стебля), бывает в основаниях междоузлий, также образовательная ткань составляет камбий (который обеспечивает рост стебля в толщину).
К паренхиме относят несколько разновидностей тканей. Различают ассимиляционную (фотосинтезирующую), запасающую, водоносную и воздухоносную основную ткань.
Фотосинтезирующая ткань состоит из клеток, содержащих хлорофилл, т. е. зеленых клеток. Эти клетки имеют тонкие стенки, содержат большое количество хлоропластов. Основная их функция — фотосинтез. Ассимиляционная ткань составляет мякоть листьев, входит в состав коры молодых стеблей деревьев и стебли трав.
В клетках запасающей ткани накапливаются запасы питательных веществ. Эта ткань составляет эндосперм семян, входит в состав клубней, луковиц и др. Сердцевина стебля, внутренние клетки коры стебля и корня, сочный околоплодник также обычно состоят из запасающей паренхимы.
Водоносная паренхима свойственна лишь ряду растений, обычно засушливых мест обитания.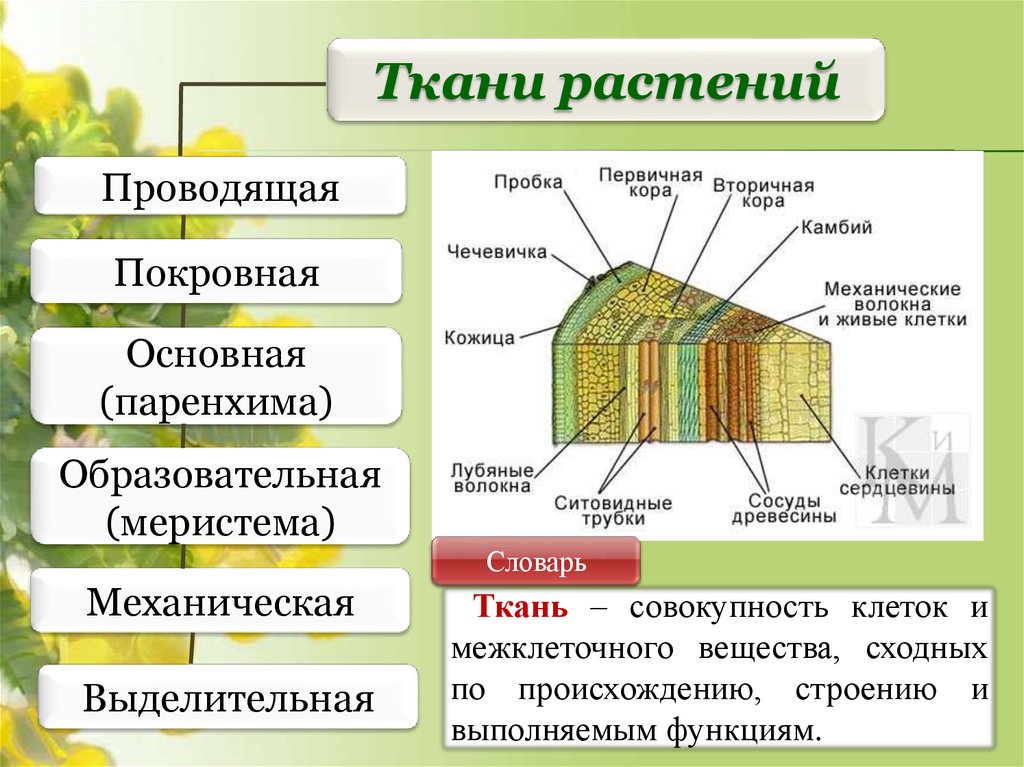 В клетках этой ткани накапливается вода. Водоносная ткань может быть как в листьях (алоэ), так и в стебле (кактусы).
В клетках этой ткани накапливается вода. Водоносная ткань может быть как в листьях (алоэ), так и в стебле (кактусы).
Воздухоносная ткань свойственна водным и болотным растениям. Ее особенностью является наличие большого количества межклетников, содержащих воздух. Это облегчает газообмен растению, когда он затруднен.
Общей функцией различных проводящих тканей является проведение веществ от одних органов растения к другим. В стволах древесных растений клетки проводящей ткани расположены в древесине и лубе. Причем в древесине расположены сосуды (трахеи) и трахеиды , по которым перемещается водный раствор от корней, а в лубе — ситовидные трубки , по которым перемещаются органические вещества от фотосинтезирующих листьев.
Сосуды и трахеиды — это мертвые клетки. По сосудам водный раствор поднимается быстрее, чем по трахеидам.
Ситовидные трубки являются живыми, но безъядерными клетками.
К покровной ткани относится кожица (эпидермис), пробка, корка. Кожица покрывает листья и зеленые стебли, это живые клетки. Пробка состоит из мертвых клеток, пропитанных жироподобным веществом, не пропускающим воду и воздух.
Пробка состоит из мертвых клеток, пропитанных жироподобным веществом, не пропускающим воду и воздух.
Главные функции любой покровной ткани — это защита внутренних клеток растения от механического повреждения, высыхания, проникновения микроорганизмов, перепадов температуры.
Пробка является вторичной покровной тканью, так как возникает на месте кожицы у стеблей и корней многолетних растений.
Корка состоит из пробки и отмерших слоев основной ткани.
Для клеток механической ткани характерны сильно утолщенные одревесневшие оболочки. Функции механической ткани — это придание телу и органам растений прочности и упругости.
В стеблях покрытосеменных растений механическая ткань может располагаться одним целостным слоем или же отдельными тяжами, отстоящими друг от друга.
В листьях волокна механической ткани обычно располагаются рядом с волокнами проводящей ткани. Вместе они образуют жилки листа.
Клетки секреторной ткани выделяют различные вещества, и поэтому функции у этой ткани разные. Выделительные клетки у растений выстилают смоляные и эфиромасличные ходы, образуют своеобразные железы и железистые волоски. К секреторной ткани принадлежат нектарники цветков.
Выделительные клетки у растений выстилают смоляные и эфиромасличные ходы, образуют своеобразные железы и железистые волоски. К секреторной ткани принадлежат нектарники цветков.
Смолы выполняют защитную функцию при повреждении стебля растения.
Нектар привлекает насекомых-опылителей.
Бывают секреторные клетки, выводящие продукты обмена, например, соли щавелевой кислоты.
plustilino © 2019. All Rights Reserved
Ткани растений
Доклад на тему ткани растений и животных 6 класс
Реферат «Представление о растительной ткани .
Конспект по биологии » Растительная ткань » — УчительPRO
Ткани растений — Биология
Фипи Структура Сочинения
Сочинение Рассуждение По Тексту В 9 Классе
Сочинение Повествование Один День Из Жизни
Сочинение От Лица Вельможи 5 Класс
Дипломная Работа Высшее Образование
|
Ткани растений – это группы клеток, которые в определенном порядке располагаются в теле растения и предназначены для выполнения различных функций в жизнедеятельности растения.
Процесс образования тканей
В отличие от тканей животных, у растений процесс образования тканей из первичных клеток можно наблюдать не на зародыше, а в растущих частях тела растения. Первичные клетки растения однородны, имеют примерно равные размеры и пропорции, состоят из протоплазмы и ядра. Из этих клеток формируется первоначальная меристема. Она в свою очередь позднее делится на составляющие: первый внешний слой (протодерм), из которого образуется кожица; срединный слой (прокамбий), являющийся предшественником сосудисто-волокнистых пучков; слой основной меристемы, который находится между протодермом и прокамбием и называется основной паренхимой или основной тканью растений, из нее появляется сердцевина, часть проводящей паренхимы. Это образовательная ткань растений.
О том, как проходит сосудисто-волокнистый пучок, можно судить по нервации листьев.
Если изучать строение этой системы, можно увидеть, что образуется сплошной скелет во всем теле растения. Он состоит из правильно связанных друг с другом пучков, хотя они соединены по-разному у разных растений. Скелет растения из проводящих волокон, по которым перемещаются питательные вещества от листьев к корню и наоборот, представляет собой механическую ткань растения.
У растений формируется практически замкнутое кольцо сосудисто-волокнистых структур, а парехима центральной части ствола тесно связана с паренхимой коры через маленькие «окна» в сосудисто-волокнистом кольце, в которых находятся паренхиматические клетки. В процессе длительного преобразования клеток камбия образуется ряд слоев сосудисто-волокнистых образований. У многих деревьев это внутренний слой (наиболее древний) – первичная древесина, камбий и вторичная кора (паренхима, включающая луб).
Классификация тканей растений
Классификация разработана по генетическим и морфологическим признакам. Характеристика тканей растений определяется расположением ткани и выполняемым ею функциям. К системам защиты относися покровная ткань (кожица, корка, пробка) и механическая ткань или система скелета (толстостенный луб, склеренхима, колленхима, либриформ). Система питания включает всасывающую систему (ризоиды, кожица корня, корневые волоски), усвояющую (ассимиляционную) систему (губчатая ткань, хлорофиллоносная паренхима), проводящую ткань (сосудистые пучки, проводящая паренхима, млечные сосуды), накапливающую систему (водоносная ткань, ткань с запасами питательных веществ) и выделительную ткань (железки, хранилища слизей, смол, масла).
Функции тканей растений
Функции разнообразны в зависимости от типа ткани растения. Покровная ткань выполняет защитную функцию. Благодаря проводящей ткани, обеспечивается передвижение воды и растворенных в ней питательных веществ внутри растения. Функция механической ткани – обеспечение прочности органов растения. Элементы ткани этого вида формируют каркас для поддержания всех составных частей растения и противодействия любым механическим повреждениям. Как заметно из названия «основная ткань», именно она представляет собой основу органов растения. Основная ткань выполняет множество различных функций. Поэтому выделяют ее подтипы — ассимиляционная, запасающая, воздухоносная и водоносная паренхима. Клетки ассимиляционной ткани ответственны за фотосинтез, в клетках запасающей паренхимы содержатся запасы белков, жиров, углеводов, других веществ. Водоносная паренхима обеспечивает накопление воды. А воздухоносная ткань (аэропаренхима), имеющаяся у водных растений, обеспечивает доставку воздуха к тем частям растения, куда его доступ затруднен.
Похожие материалы:
2. Корень растения
|
Подготовка среды для культуры тканей растений – обучение генетическим ресурсам растений: криоконсервация клональных пропагул
Реми Боннарт, Национальная лаборатория по сохранению генетических ресурсов Министерства сельского хозяйства США, 1111 S. Mason St., Fort Collins, Colorado 80521.
Кэтрин Чен, факультет почвоведения и растениеводства, Университет штата Колорадо, Форт-Коллинз, Колорадо 80521.
Gayle M. Volk, Национальная лаборатория по сохранению генетических ресурсов USDA-ARS, 1111 S. Mason St., Fort Collins, Colorado 80521. [email protected]
Целью этого тренинга является демонстрация процесса приготовления питательной среды для тканей растений, что необходимо для размножения, предварительной обработки и восстановления верхушек побегов во многих методах криоконсервации.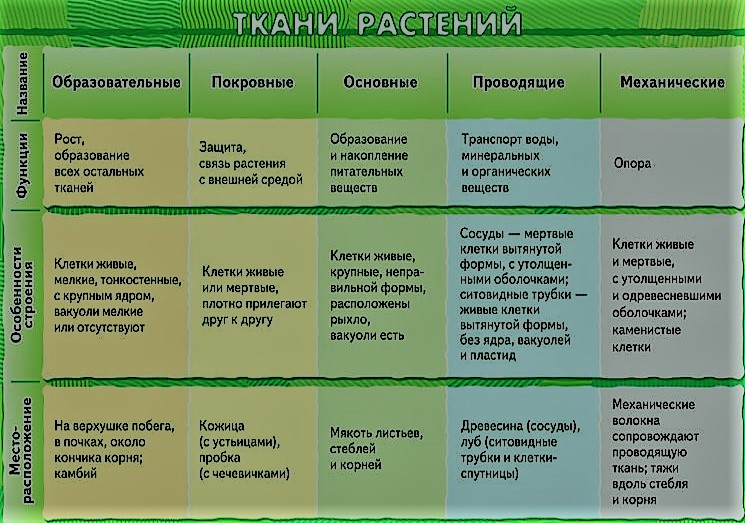 Этот тренинг предназначен для ученых и технического персонала, интересующихся вопросами микроразмножения и криоконсервации растений.
Этот тренинг предназначен для ученых и технического персонала, интересующихся вопросами микроразмножения и криоконсервации растений.
- Фон
- Компоненты питательной среды для тканей растений
- Подготовка среды
- Вариации
- Ссылки
- Благодарности
Микроразмножение растений является важным и часто необходимым методом криоконсервации растений, размножающихся вегетативно. Культура растительных тканей — это быстрый и эффективный способ размножения растительных тканей и клеток для получения желаемого продукта. Культуры побегов являются жизненно важным источником эксплантатов для многих методов криоконсервации кончиков побегов, и кончики побегов чаще всего предварительно обрабатывают и восстанавливают с использованием искусственной питательной среды. Составление и приготовление среды для культивирования тканей растений несложно, но требует некоторого планирования и специального оборудования.
При планировании приготовления питательной среды для культивирования тканей растений необходимо учитывать цель культивирования тканей, виды культивируемых растений и ожидаемые результаты.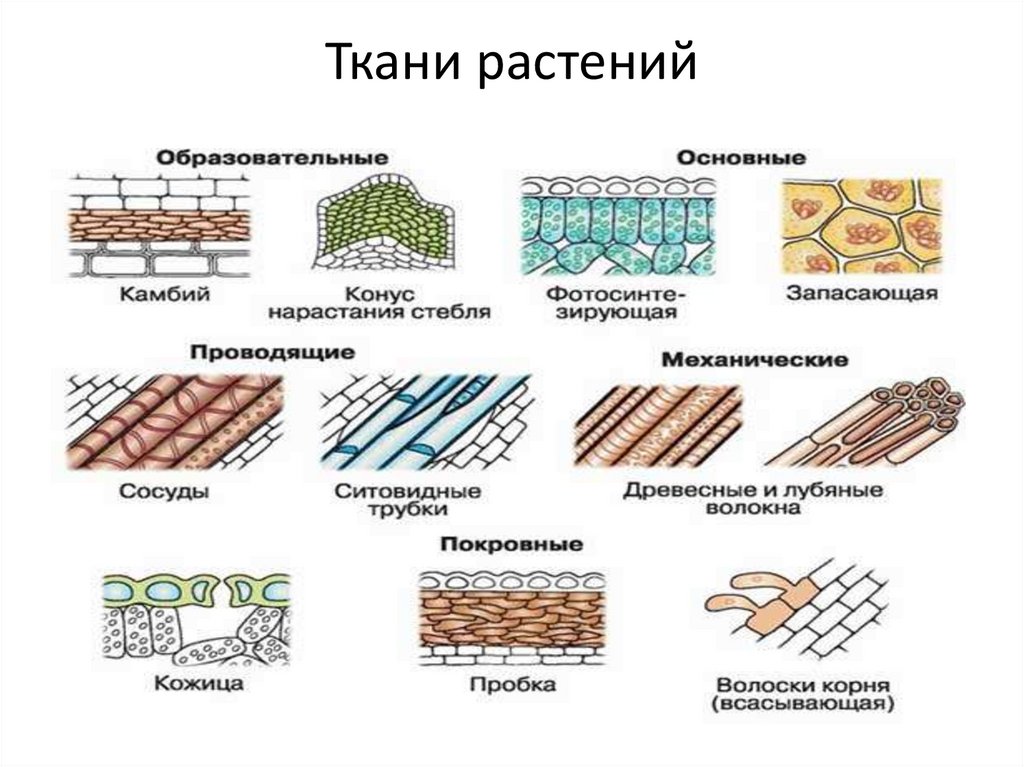 Стадии культуры растительных тканей: селекция/подготовка (этап 0), инициация/приживаемость (этап 1), размножение (этап 2), укоренение (этап 3) и акклиматизация/закаливание (этап 4). Состав питательной среды выбирается в зависимости от того, на какой стадии находится или будет находиться растение. Как правило, лучше всего провести поиск в литературе, например, в книгах или статьях в научных журналах, чтобы узнать, есть ли доступная информация об интересующем целевом растении, предлагаемых средах для этого растения и полученных результатах.
Стадии культуры растительных тканей: селекция/подготовка (этап 0), инициация/приживаемость (этап 1), размножение (этап 2), укоренение (этап 3) и акклиматизация/закаливание (этап 4). Состав питательной среды выбирается в зависимости от того, на какой стадии находится или будет находиться растение. Как правило, лучше всего провести поиск в литературе, например, в книгах или статьях в научных журналах, чтобы узнать, есть ли доступная информация об интересующем целевом растении, предлагаемых средах для этого растения и полученных результатах.
Некоторые справочники, имеющие отношение к культурам тканей растений: «Размножение растений с помощью культуры тканей» Эдвина Ф. Джорджа, Майкла А. Холла и Герта-Яна Де Клерка; Культура тканей растений: методы и эксперименты Пака Сунгуна; Культура тканей растений: вводный текст Сант Саран Бходжвани и Прем Кумар Данту; и «Растения из пробирок: введение в микроразмножение» Лидианы Кайт, Джона Клейна, Холли Скоггинс и Марка Бриджена.
Состав среды для культивирования тканей растений
может оказывать сильное влияние на рост и развитие растений. Существует множество различных составов, которые были разработаны на протяжении многих лет для множества видов растений, но некоторые из них чаще используются для большей части работ по культивированию тканей растений. Формула Мурасиге и Скуга (1962) на сегодняшний день является наиболее распространенной базовой средой, но часто используются и другие эффективные среды. К ним относятся сообщения, описанные Уайтом (1963), «Б-5 Гамборга» Гамборга и др. др. (1968), Шенк и Хильдебрандт (1972), Нич и Нич (1969) и «Среда для древесных растений» Ллойда и Маккауна (1980). Эти составы сред могут быть либо изготовлены из жидких исходных растворов солей и витаминов, либо приобретены в виде предварительно смешанных пакетов в виде порошка.
Существует множество различных составов, которые были разработаны на протяжении многих лет для множества видов растений, но некоторые из них чаще используются для большей части работ по культивированию тканей растений. Формула Мурасиге и Скуга (1962) на сегодняшний день является наиболее распространенной базовой средой, но часто используются и другие эффективные среды. К ним относятся сообщения, описанные Уайтом (1963), «Б-5 Гамборга» Гамборга и др. др. (1968), Шенк и Хильдебрандт (1972), Нич и Нич (1969) и «Среда для древесных растений» Ллойда и Маккауна (1980). Эти составы сред могут быть либо изготовлены из жидких исходных растворов солей и витаминов, либо приобретены в виде предварительно смешанных пакетов в виде порошка.
Существует множество компонентов и добавок, которые можно использовать в средах для микроразмножения растений, но большинство из них можно разделить на восемь категорий: вода, питательные соли (микро- и макроэлементы), витамины, аминокислоты, углеводы, желирующие агенты, регуляторы роста (гормоны). и другие органические добавки. Ниже приводится сводка по каждой категории компонентов:
и другие органические добавки. Ниже приводится сводка по каждой категории компонентов:
♦ Вода- Питательные среды для растений изготавливаются на водной основе и обычно содержат более 90% всех компонентов. Важно использовать сверхчистую воду, чтобы никакие минералы или другие примеси не влияли на рост растений. Это достигается либо дистилляцией, либо обратным осмосом.
♦ Питательные соли- Питательные соли обеспечивают «макро» и «микро» элементы, необходимые для роста растений. Макронутриенты требуются в больших количествах (1-60 мМ) и включают азот, фосфор, калий, кальций, магний и серу. Микроэлементы необходимы в меньших количествах (0,1-100 мкМ) и включают железо, марганец, цинк, бор, медь, молибден, кобальт и йод. В некоторые среды также добавляют натрий и хлор, но они не считаются необходимыми для роста растений. Макро- и микроэлементы обычно добавляют в среду в виде солей в форме, более доступной для использования растениями.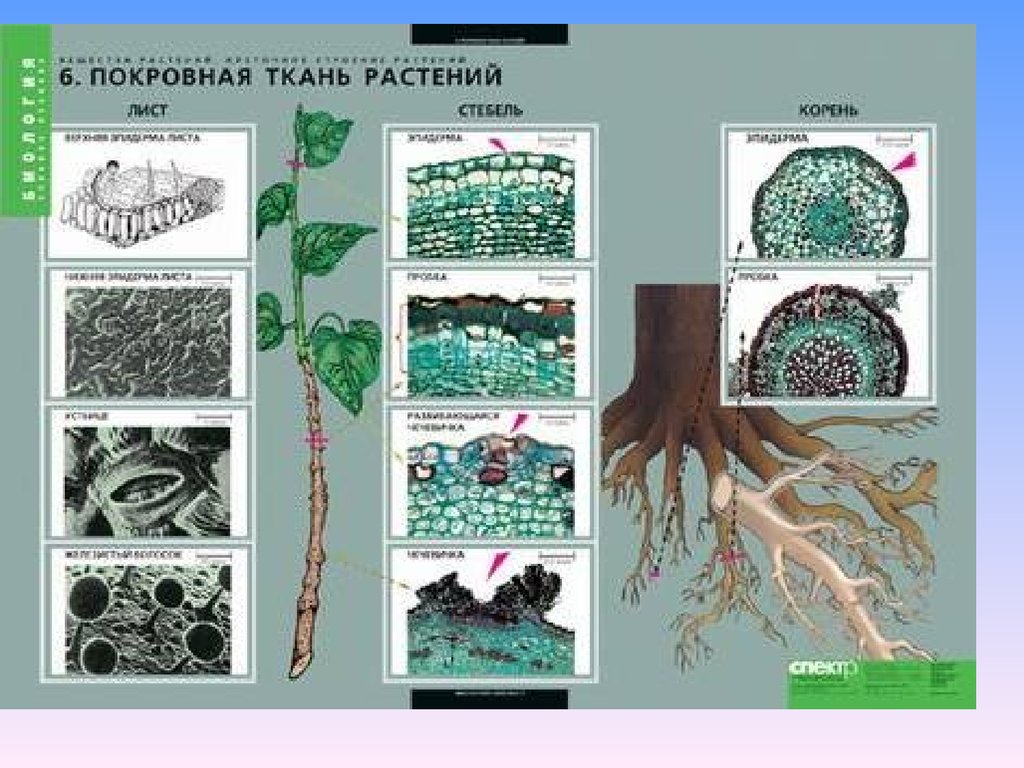 Примеры питательных солей включают нитрат кальция, хлорид калия и сульфат магния. Железо и цинк иногда добавляют в хелатной форме, чтобы облегчить доступность и избежать осаждения этих элементов. Обычные хелатирующие агенты включают EDTA или EDDHA.
Примеры питательных солей включают нитрат кальция, хлорид калия и сульфат магния. Железо и цинк иногда добавляют в хелатной форме, чтобы облегчить доступность и избежать осаждения этих элементов. Обычные хелатирующие агенты включают EDTA или EDDHA.
♦ Витамины- Растения, выращенные in vitro, часто лишены способности синтезировать витамины, в отличие от растений, выращенных в почве или других субстратах. Различные витамины добавляют в качестве добавок к средам для культивирования тканей растений, чтобы обеспечить соединения, которые стимулируют определенные метаболические функции. Витаминные добавки обычно используются в дозах 0,1-10 мг/л и включают тиамин, никотиновую кислоту, пиридоксин и мио-инозитол.
♦ Аминокислоты- Некоторые аминокислоты добавляются в среды для культивирования тканей растений и могут быть полезны для роста клеток растений, поскольку они являются легкодоступным источником азота, который иногда легче усваивается растениями, чем из неорганических источников. Смеси аминокислот, такие как гидролизат казеина, или отдельные аминокислоты, такие как глицин, глутамин или аденин, могут быть добавлены в среду с различной скоростью в диапазоне от 2 до 1000 мг/л.
Смеси аминокислот, такие как гидролизат казеина, или отдельные аминокислоты, такие как глицин, глутамин или аденин, могут быть добавлены в среду с различной скоростью в диапазоне от 2 до 1000 мг/л.
♦ Углеводы- Большинство растений in vitro не способны производить собственные углеводы из света, воды и углекислого газа, как в естественном мире. Источник углеводов должен поставляться в среду для роста растений. Наиболее часто используемым источником углеводов является сахароза, но также используются глюкоза, фруктоза и мальтоза в количестве 20-30 г/л. Влияние источника углеводов и количества, используемого в среде, варьируется у разных видов растений.
♦ Желирующие агенты- Среды для культивирования тканей растений обычно дополняют желирующим агентом или смесью нескольких агентов. Целью гелеобразователей является оказание физической поддержки культивируемому растению. Агар (полученный из красной водоросли Gracilaria) часто является желирующим агентом, но геллановая камедь (полученная из бактерии Sphingomonas ) также используется отдельно или в сочетании с агаром. Агароза (полученная из некоторых видов красных водорослей) используется в меньшей степени, особенно для культуры пыльцы. Различные виды растений могут иметь лучший рост при использовании определенного гелеобразователя или смеси нескольких, поэтому рекомендуется провести тестирование. В некоторых случаях реакция растений может варьироваться в зависимости от производителя или чистоты гелеобразователя. Если гелеобразующий агент не используется, например, для суспензионных клеточных культур, можно либо постоянно встряхивать культуру на шейкерном столе, либо, в случае побегов, использовать систему поддержки какого-либо типа (например, бумажный «плот»). необходимый.
Агароза (полученная из некоторых видов красных водорослей) используется в меньшей степени, особенно для культуры пыльцы. Различные виды растений могут иметь лучший рост при использовании определенного гелеобразователя или смеси нескольких, поэтому рекомендуется провести тестирование. В некоторых случаях реакция растений может варьироваться в зависимости от производителя или чистоты гелеобразователя. Если гелеобразующий агент не используется, например, для суспензионных клеточных культур, можно либо постоянно встряхивать культуру на шейкерном столе, либо, в случае побегов, использовать систему поддержки какого-либо типа (например, бумажный «плот»). необходимый.
♦ Регуляторы роста – Среды для культивирования тканей растений обычно дополняют регуляторами роста растений (РГР) для достижения желаемых характеристик роста целевых видов/сортов растений. Существует четыре основные группы PGR: ауксины, цитокинины, гиббереллины и абсцизовая кислота. Ауксины и цитокинины являются наиболее используемыми и часто применяются в сочетании друг с другом. Ауксины, как правило, стимулируют образование и рост корней и каллюсов, тогда как цитокинины, как правило, способствуют формированию и росту пазушных и адвентивных побегов. Гибберелловая кислота используется для стимуляции удлинения побегов, а абсцизовая кислота может способствовать повышению общего качества соматических зародышей.
Ауксины, как правило, стимулируют образование и рост корней и каллюсов, тогда как цитокинины, как правило, способствуют формированию и росту пазушных и адвентивных побегов. Гибберелловая кислота используется для стимуляции удлинения побегов, а абсцизовая кислота может способствовать повышению общего качества соматических зародышей.
Наиболее распространенные ауксины, используемые в средах для культивирования тканей растений, включают индолуксусную кислоту (IAA), индолмасляную кислоту (IBA), нафталинуксусную кислоту (NAA) и 2,4-дихлорфеноксиуксусную кислоту (2,4-D). 0,01-10 мг/л. Обычно используемые цитокинины включают бензиладенин (БА), кинетин и зеатин, используемые в диапазоне 0,1-10 мг/л. Большинство PGR можно автоклавировать вместе с другими компонентами среды, однако, если требуется критическая концентрация, рекомендуется стерилизация фильтрованием и добавление после автоклавирования.
Поскольку микроколичества PGR используются в питательных средах, исходные растворы (обычно с определенной концентрацией X мг/мл) используются для удобного и точного измерения желаемого количества.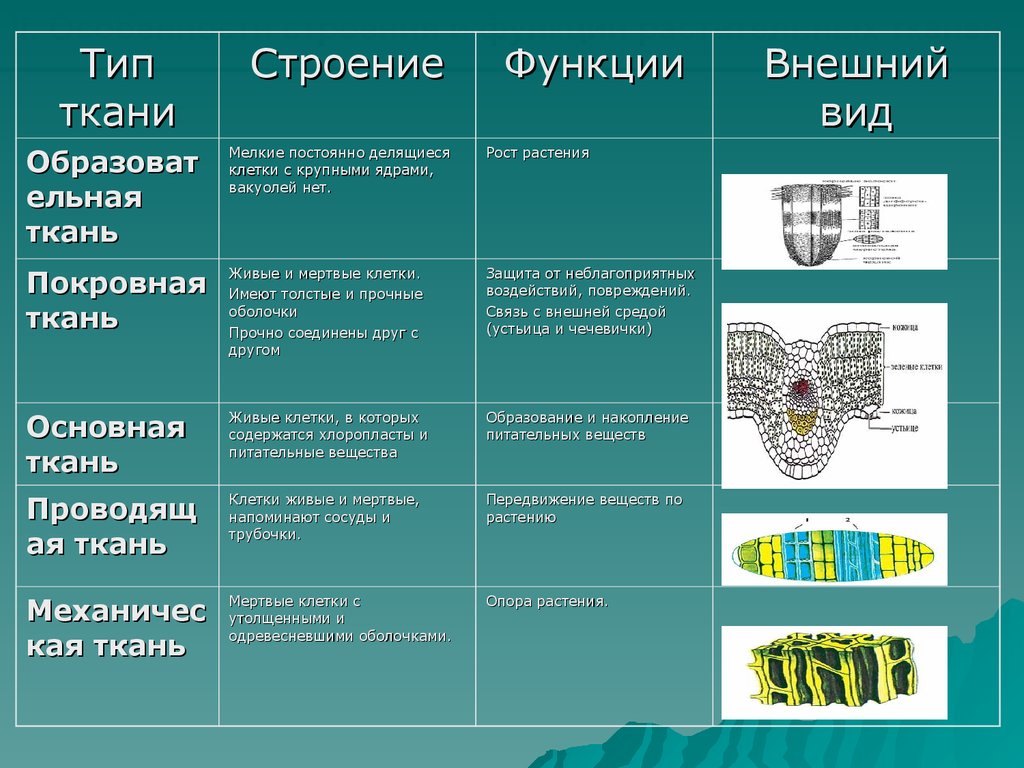 Большинство PGR следует растворять в подходящем растворителе (таком как этанол, ДМСО, гидроксид натрия, соляная кислота и т. д.) перед разбавлением до конечной концентрации маточного раствора. Исходные растворы следует хранить в холодильнике или в замороженном виде.
Большинство PGR следует растворять в подходящем растворителе (таком как этанол, ДМСО, гидроксид натрия, соляная кислота и т. д.) перед разбавлением до конечной концентрации маточного раствора. Исходные растворы следует хранить в холодильнике или в замороженном виде.
♦ Прочие органические добавки и антиоксиданты- Существует множество других органических соединений, которые могут способствовать росту растений в культурах тканей. Они могут включать кокосовое молоко, гидролизаты белков, экстракт солода и активированный уголь (AC). Активированный уголь иногда добавляют к культурам растений, где растительные ткани производят окисленные фенольные соединения или другие примеси, которые со временем могут стать токсичными. Добавление AC в среду в количестве 0,5-5 г/л может способствовать адсорбции токсичных соединений, которые в противном случае оказали бы негативное влияние на рост.
Антиоксиданты и соединения, подобные антиоксидантам, иногда добавляют в качестве добавок к средам для культивирования тканей растений, чтобы предотвратить или свести к минимуму активные формы кислорода (АФК), которые могут вызывать окислительное повреждение тканей растений. Было показано, что аскорбиновая кислота, лимонная кислота, глутатион (восстановленная форма), липоевая кислота, глицин-бетаин, D-токоферол (витамин Е), салициловая кислота и поливинилпирролидон (ПВП) обладают потенциалом ингибировать образование АФК, но их эффекты различаются. широко между различными видами растений. В Национальной лаборатории сохранения генетических ресурсов, Форт-Коллинз, Колорадо, 9.0059 Vitis одноузловые микрочеренки и верхушки побегов обрабатывали смесью 1 мМ аскорбиновой кислоты, 1 мМ глутатиона (восстановленная форма) и 0,1 мМ салициловой кислоты в средах для предварительной обработки и предварительного культивирования соответственно (Bettoni et al. 2019). Было показано, что эта обработка значительно улучшает отрастание побегов после процесса криоконсервации, вероятно, из-за его антиоксидантного действия. Точно так же Uchendu и соавт. (2010) обнаружили, что добавление глутатиона (восстановленного), липоевой кислоты или глицина-бетаина на различных этапах процесса криоконсервации значительно увеличивало отрастание кончиков криоконсервированных побегов.
Было показано, что аскорбиновая кислота, лимонная кислота, глутатион (восстановленная форма), липоевая кислота, глицин-бетаин, D-токоферол (витамин Е), салициловая кислота и поливинилпирролидон (ПВП) обладают потенциалом ингибировать образование АФК, но их эффекты различаются. широко между различными видами растений. В Национальной лаборатории сохранения генетических ресурсов, Форт-Коллинз, Колорадо, 9.0059 Vitis одноузловые микрочеренки и верхушки побегов обрабатывали смесью 1 мМ аскорбиновой кислоты, 1 мМ глутатиона (восстановленная форма) и 0,1 мМ салициловой кислоты в средах для предварительной обработки и предварительного культивирования соответственно (Bettoni et al. 2019). Было показано, что эта обработка значительно улучшает отрастание побегов после процесса криоконсервации, вероятно, из-за его антиоксидантного действия. Точно так же Uchendu и соавт. (2010) обнаружили, что добавление глутатиона (восстановленного), липоевой кислоты или глицина-бетаина на различных этапах процесса криоконсервации значительно увеличивало отрастание кончиков криоконсервированных побегов.
Существует несколько основных этапов приготовления питательной среды для тканей растений. Ниже приводится общая схема процесса:
- В колбе Эрленмейера или химическом стакане добавить сверхчистую воду лабораторного качества до ~80 % конечного объема, подлежащего приготовлению, который по крайней мере в два раза превышает объем приготавливаемой среды
- Добавьте в воду мешалку подходящего размера и поставьте колбу или химический стакан на мешалку; включите мешалку для умеренного перемешивания
- При перемешивании медленно добавить компоненты среды по одному (кроме гелеобразующего агента) и дать раствориться
- Выньте мешалку из колбы/химического стакана (для этого лучше всего подходит магнитный съемник мешалки) и вылейте содержимое в градуированный цилиндр подходящего размера; добавить лабораторную воду, чтобы достичь конечного объема
- Осторожно перелейте содержимое обратно в колбу/химический стакан, добавьте мешалку и поместите на мешалку рядом с рН-метром; добавить желирующий агент (например, агар, геллановую камедь, агарозу и т.
 д.) и дать перемешаться при перемешивании
д.) и дать перемешаться при перемешивании - Откалибруйте pH-метр с помощью соответствующих калибровочных буферов (обычно pH 4 и 7 достаточно), затем поместите наконечник зонда в среду при перемешивании
- Добавьте по каплям соответствующий раствор кислоты или основания (обычно 0,1–1 М соляной кислоты или гидроксида калия) в среду для доведения до желаемого pH*
- Поместите колбу/стакан на мешалку/горячую плиту и включите сильный огонь, умеренно помешивая
- Внимательно наблюдая и надев соответствующие средства индивидуальной защиты, доведите раствор до кипения, затем сразу же выключите нагрев, чтобы избежать кипения
- Во время перемешивания используйте перистальтический насос или подобное устройство для равномерного распределения среды по нужным сосудам**, затем закройте пробками
- Поместите наполненные сосуды в контейнеры, пригодные для автоклавирования, и стерилизуйте в соответствии с рекомендуемым временем для объема каждого сосуда
- Осторожно достаньте стерилизованную среду из автоклава, надев надлежащее защитное снаряжение, и дайте остыть в чистой среде
* Рецепты сред обычно включают заданный уровень pH, который позволит гелеобразователю затвердеть и будет способствовать максимальному росту видов в культуре. рН среды, вероятно, изменится (обычно в сторону уменьшения) после автоклавирования, особенно в присутствии источника углеводов, такого как сахароза. Изменение рН будет варьироваться в зависимости от приготавливаемой среды, различных моделей автоклавов, времени стерилизации и т. д., поэтому рекомендуется проверять рН среды как до, так и после автоклавирования, чтобы определить, насколько сильно произошло изменение. В следующий раз при приготовлении среды pH среды корректируется перед автоклавированием, чтобы компенсировать изменение, которое наблюдалось ранее.
рН среды, вероятно, изменится (обычно в сторону уменьшения) после автоклавирования, особенно в присутствии источника углеводов, такого как сахароза. Изменение рН будет варьироваться в зависимости от приготавливаемой среды, различных моделей автоклавов, времени стерилизации и т. д., поэтому рекомендуется проверять рН среды как до, так и после автоклавирования, чтобы определить, насколько сильно произошло изменение. В следующий раз при приготовлении среды pH среды корректируется перед автоклавированием, чтобы компенсировать изменение, которое наблюдалось ранее.
** Обычно используемые сосуды для культур тканей растений включают пробирки, чашки Петри, сосуды Magenta GA7, стеклянные банки и пакеты Star*Pac. Тип контейнера и объем среды должны отражать пространство, необходимое для роста растительного материала до его повторного размножения. Пробирки особенно полезны для индукции культуры, поскольку их небольшой объем подходит для разделения эксплантатов, что снижает потери от загрязнения. Поскольку чашки Петри неглубокие, широкие и с ними легко работать, они являются идеальными сосудами для кратковременного использования небольших тканей, например, для предварительного кондиционирования узлов или кончиков побегов перед криоконсервацией. И пробирки, и чашки Петри бывают разных размеров; независимо от этого среда обычно должна занимать менее половины максимального объема сосуда. Имейте в виду, что чашки Петри из полистирола НЕ автоклавируются, поэтому их необходимо заполнять после стерилизации среды в ламинарном боксе. Пурпурные сосуды и стеклянные банки идеально подходят для размножения культур, которые хорошо растут при более высокой плотности; они обычно заполнены менее чем на 15% (например, 80 мл среды в сосуде Magenta GA7 объемом 575 мл), чтобы оставить достаточно места для роста. Пакеты Star*Pac можно использовать для экономии места в условиях медленного роста.
Поскольку чашки Петри неглубокие, широкие и с ними легко работать, они являются идеальными сосудами для кратковременного использования небольших тканей, например, для предварительного кондиционирования узлов или кончиков побегов перед криоконсервацией. И пробирки, и чашки Петри бывают разных размеров; независимо от этого среда обычно должна занимать менее половины максимального объема сосуда. Имейте в виду, что чашки Петри из полистирола НЕ автоклавируются, поэтому их необходимо заполнять после стерилизации среды в ламинарном боксе. Пурпурные сосуды и стеклянные банки идеально подходят для размножения культур, которые хорошо растут при более высокой плотности; они обычно заполнены менее чем на 15% (например, 80 мл среды в сосуде Magenta GA7 объемом 575 мл), чтобы оставить достаточно места для роста. Пакеты Star*Pac можно использовать для экономии места в условиях медленного роста.
Предлагаемые объемы сред для различных сосудов для культивирования тканей растений:
- Пробирка (150×25 мм): 20–25 мл
- Пробирка (150×20 мм): 15–20 мл
- Чашка Петри (100×25 мм): 50–80 мл
- Чашка Петри (100×15 мм): 25–35 мл
- Чашка Петри (60×15 мм): 12 мл
- Чашка Петри (35×10 мм): 5 мл
- Пурпурный куб GA7 (575 мл): 50–80 мл
- Стеклянные банки (946 мл): 150-180 мл
- Пакеты Star*Pac: 10 мл
youtube.com/embed/G6rRWnyZhmU?feature=oembed&rel=0″ frameborder=»0″ allowfullscreen=»allowfullscreen»>
Видео 1. Техник Реми Боннар готовит 2 л среды для пролиферации побегов хлебного дерева.
Существует множество вариантов культуральных сред для тканей растений, основанных на желаемом росте и потребности в питательных веществах целевого растения, а также на том, как будут использоваться растительные продукты. Существуют твердые, полутвердые и жидкие версии питательных сред в зависимости от типа культуры и вида растений. Многие культуры побегов выращивают на отвержденных средах, чтобы поддерживать структуры растений по мере их развития в фазе роста. Другие культуры, такие как корень или суспензия, можно культивировать в жидкой среде и встряхивать, чтобы обеспечить надлежащую аэрацию ткани или клеток.
При криоконсервации большинство сред, которые используются для выращивания растений перед процессом криоконсервации и во время последующего восстановления, находятся в отвержденной или полутвердой форме, чтобы обеспечить поддержку побегам или верхушкам побегов.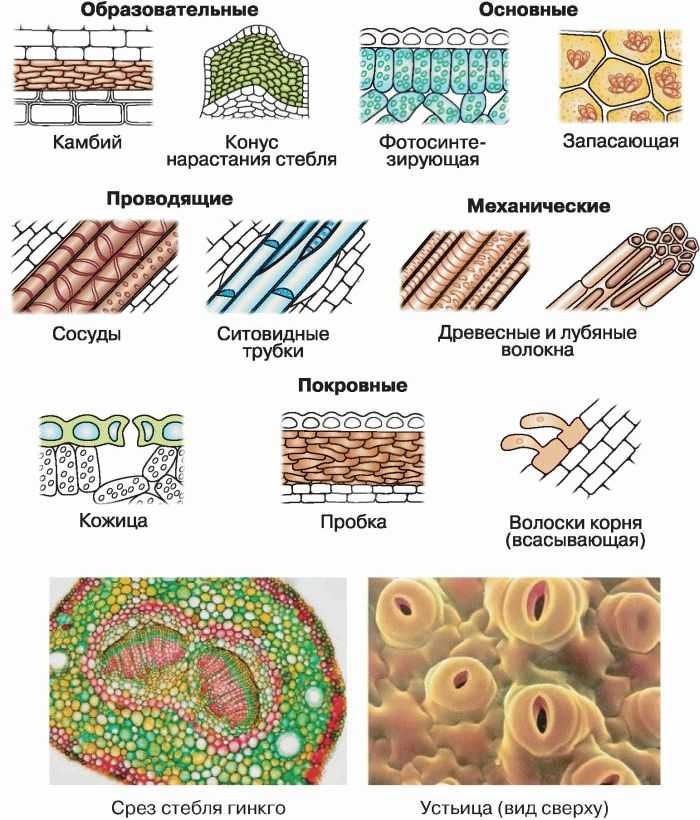 С другой стороны, большинство реальных сред/реагентов для криоконсервации (таких как криопротекторы «PVS2» и «PVS3») находятся в жидкой форме для улучшения обмена воды и других соединений в тканях и из них для оптимизации защитных эффектов.
С другой стороны, большинство реальных сред/реагентов для криоконсервации (таких как криопротекторы «PVS2» и «PVS3») находятся в жидкой форме для улучшения обмена воды и других соединений в тканях и из них для оптимизации защитных эффектов.
Bettoni JC, Kretzschmar AA, Bonnart R, Shepherd A, Volk GM. 2019. Криоконсервация 12 видов Vitis с использованием верхушечных побегов, полученных из растений, выращенных In Vitro. HortScience 54:976-981.
Бходжвани С.С. и Данту П.К. 2013. Культура тканей растений: вводный текст. Спрингер, Индия.
Gamborg OL, Miller RA, Ojima K. 1968. Требования к питательным веществам суспензионных культур клеток корней сои. Экспериментальные исследования клеток 50:151-158.
Джордж Э.Ф., Холл М.А. и Де Клерк Г.Дж. 2008. Размножение растений тканевой культурой, 3-е издание. Спрингер, Дордрехт.
https://phytotechlab.com/
https://www.plantcelltechnology.com/
Кайт Л., Клейн Дж.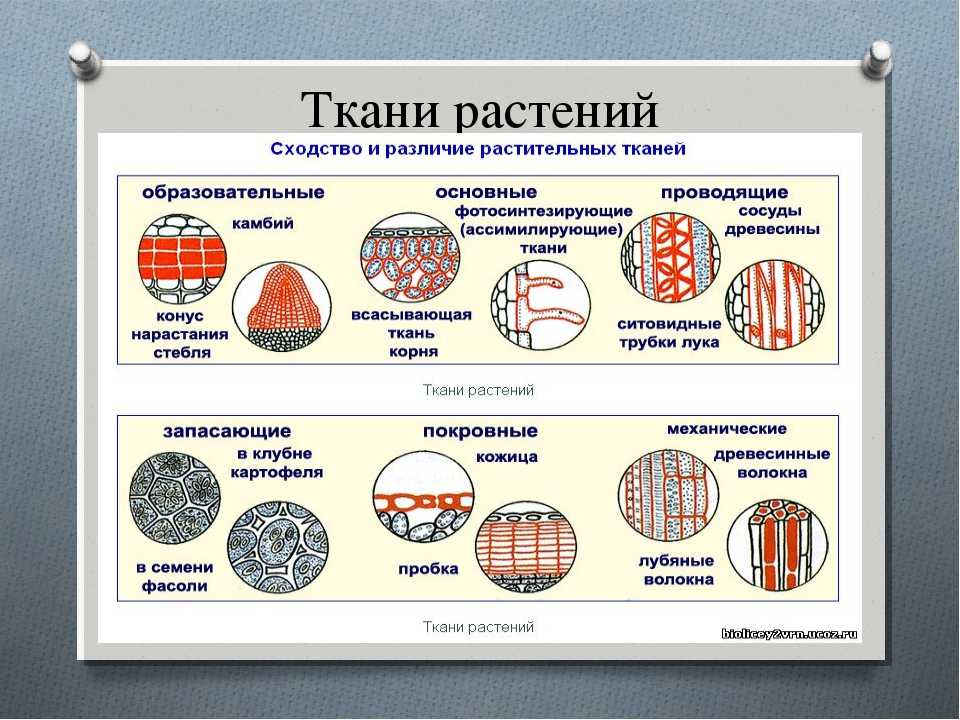 , Скоггинс Х. и Бриджен М. 2013. Растения из пробирок: введение в микроразмножение, 4-е издание. Timber Press, Портленд, Орегон.
, Скоггинс Х. и Бриджен М. 2013. Растения из пробирок: введение в микроразмножение, 4-е издание. Timber Press, Портленд, Орегон.
Lloyd G, McCown B. 1980. Коммерчески осуществимое микроразмножение горного лавра, Kalmia latifolia , с использованием культуры верхушек побегов. Объединенные материалы Международного общества производителей растений 30:421-427.
Murashige T, Skoog F. 1962. Переработанная среда для быстрого роста и биоанализа культур тканей табака. Physiologia Plantarum 15:473-497.
Nitsch JP, Nitsch C. 1969. Гаплоидные растения из пыльцевых зерен. Наука 163:85-87.
Park S. 2021. Методы и эксперименты по культивированию тканей растений, 4-е издание. Academic Press, Кембридж, Массачусетс.
Шенк РУ, Хильдебрандт АС. 1972. Среда и методы индукции и роста культур клеток однодольных и двудольных растений. Канадский журнал ботаники 50:199-204.
Скирвин Р.М., Чу М.С., Манн М.Л., Янг Х., Салливан Дж., Ферманиам Т. 1986. Стабильность pH среды для тканевых культур в зависимости от автоклавирования, времени и культивируемого растительного материала.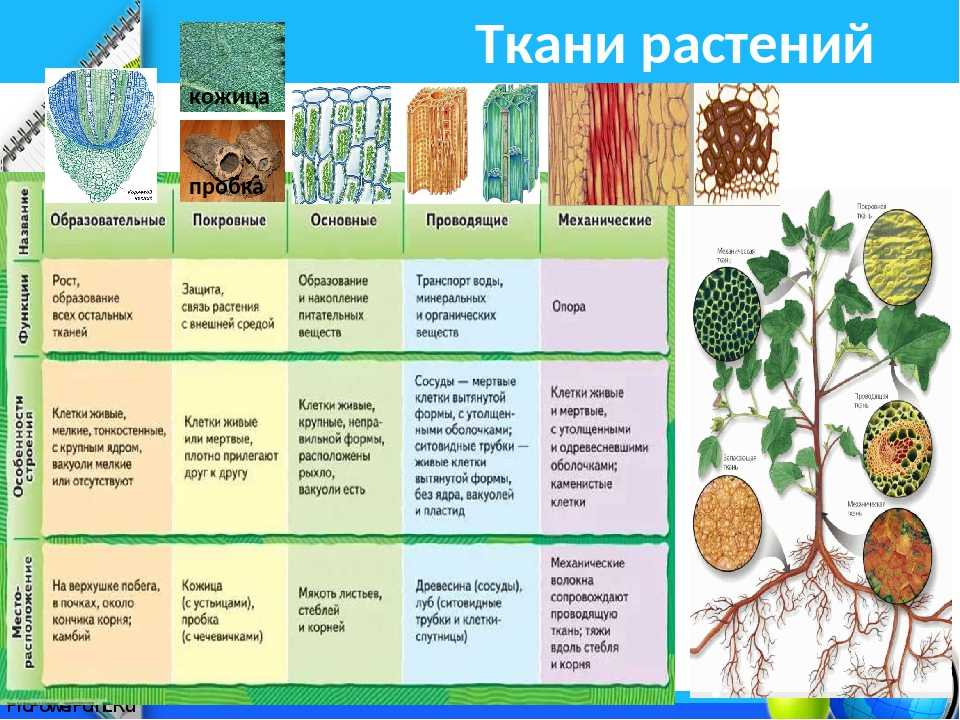 Отчеты о растительных клетках 5:292-294.
Отчеты о растительных клетках 5:292-294.
Ученду Э.Е., Муминова М., Гупта С., Рид Б.М. 2010. Антиоксидантные и антистрессовые соединения улучшают отрастание криоконсервированных кончиков побегов Rubus . Клеточная биология и биология развития in vitro — Plant 46: 386-393.
Белый пр. 1963. Культивирование животных и растительных клеток, 2-е изд. Компания Рональда Пресса, Нью-Йорк, штат Нью-Йорк.
Образец цитирования: Боннар Р.М., Чен К.Ю., Волк Г.М. 2022. Подготовка среды для культуры тканей растений. В: Volk GM (Eds.) Обучение генетическим ресурсам растений: криоконсервация клональных пропагул. Форт-Коллинз, Колорадо: Университет штата Колорадо. Дата обращения. Доступно по адресу https://colostate.pressbooks.pub/clonalcryopreservation/chapter/media/
.
Этот учебный модуль стал возможен благодаря:
Редакторы: Кэтрин Чен, Гейл Волк
Поставщики контента: Реми Боннар, Гейл Волк
Видеооператор: Эмма Балунек
Этот проект финансировался USDA-ARS и грантом USDA-NIFA Higher Education Challenge Program 2020-70003-30930.
USDA является поставщиком равных возможностей и работодателем. Упоминание торговых наименований или коммерческих продуктов в этой статье предназначено исключительно для предоставления конкретной информации и не подразумевает рекомендацию или одобрение Министерства сельского хозяйства США.
Культура растительных клеток: потенциальный источник химических веществ (Технический отчет)
Культура растительных клеток: потенциальный источник химических веществ (Технический отчет) | ОСТИ.GOV
перейти к основному содержанию
- Полная запись
- Другие родственные исследования
Высшие растения производят много промышленно важных продуктов. Среди них лекарства и медицинские химикаты, эфирные масла и ароматизаторы, растительные масла и жиры, тонкие и специальные химикаты и даже некоторые товарные химикаты.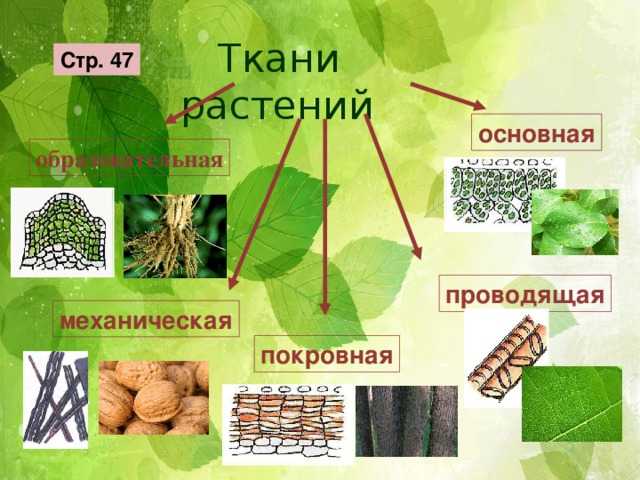 Хотя в настоящее время экстракция целых растений является основным способом сбора этих материалов, появление культуры тканей растительных клеток может стать гораздо более эффективным методом производства многих типов фитохимических веществ. Использование иммобилизованных растительных клеток в усовершенствованной конфигурации биореактора с выделением продукта в среду реактора может представлять собой наиболее простой способ коммерциализации таких методов для менее ценных химических веществ. Важные возможности исследований и разработок в этой области включают скрининг культур растений на наличие немедицинских малоценных химических веществ; понимание и контроль физиологии и биохимии растительных клеток; оптимизация эффективных методов иммобилизации; разработка более эффективных концепций биореакторов; и совершенствование методов экстракции и очистки продукта. 62 ссылки, 2 рис.
Хотя в настоящее время экстракция целых растений является основным способом сбора этих материалов, появление культуры тканей растительных клеток может стать гораздо более эффективным методом производства многих типов фитохимических веществ. Использование иммобилизованных растительных клеток в усовершенствованной конфигурации биореактора с выделением продукта в среду реактора может представлять собой наиболее простой способ коммерциализации таких методов для менее ценных химических веществ. Важные возможности исследований и разработок в этой области включают скрининг культур растений на наличие немедицинских малоценных химических веществ; понимание и контроль физиологии и биохимии растительных клеток; оптимизация эффективных методов иммобилизации; разработка более эффективных концепций биореакторов; и совершенствование методов экстракции и очистки продукта. 62 ссылки, 2 рис.
- Авторов:
Скотт, CD;
Дугалл, Д.
 К.
К.
- Дата публикации:
- Исследовательская организация:
- Окриджская национальная лаборатория, Теннесси (США)
- Идентификатор ОСТИ:
- 5938126
- Номер(а) отчета:
- ОРНЛ/ТМ-10521
ВКЛ.: DE88000036
- Номер контракта Министерства энергетики:
- АК05-84ОР21400
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Прочая информация: Части этого документа неразборчивы на микрофишах.
 Оригинал доступен до исчерпания запасов
Оригинал доступен до исчерпания запасов
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 09 ТОПЛИВО НА БИОМАССЕ; ХИМИЧЕСКОЕ СЫРЬЕ; БИОСИНТЕЗ; ТКАНЕВЫЕ КУЛЬТУРЫ; БИОКОНВЕРСИЯ; БИОРЕАКТОРЫ; КЛЕТОЧНЫЕ КУЛЬТУРЫ; ТОПЛИВО; ЛАТЕКС; ЛИПИДЫ; ОПТИМИЗАЦИЯ; ОРГАНИЧЕСКИЕ КИСЛОТЫ; РАСТИТЕЛЬНЫЕ КЛЕТКИ; ПОДВЕСКИ; ТЕРПЕНЫ; ДИСПЕРСИИ; ЭЛАСТОМЕРЫ; ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ; ОРГАНИЧЕСКИЕ ПОЛИМЕРЫ; ПОЛИМЕРЫ; РЕЗИНЫ; СИНТЕЗ; 140504 * — Преобразование солнечной энергии — Производство и преобразование биомассы — (-1989)
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Скотт, К. Д., и Дугалл, Д.К. Культура растительных клеток: потенциальный источник химических веществ . США: Н. П., 1987.
Д., и Дугалл, Д.К. Культура растительных клеток: потенциальный источник химических веществ . США: Н. П., 1987.
Веб. дои: 10.2172/5938126.
Копировать в буфер обмена
Скотт, К. Д., и Дугалл, Д. К. Культура растительных клеток: потенциальный источник химических веществ . Соединенные Штаты. https://doi.org/10.2172/5938126
Копировать в буфер обмена
Скотт, К.Д., и Дугалл, Д.К., 1987.
«Культура растительных клеток: потенциальный источник химических веществ». Соединенные Штаты. https://doi.org/10.2172/5938126. https://www.osti.gov/servlets/purl/5938126.
Копировать в буфер обмена
@статья{osti_5938126,
title = {Культура растительных клеток: потенциальный источник химических веществ},
автор = {Скотт, К.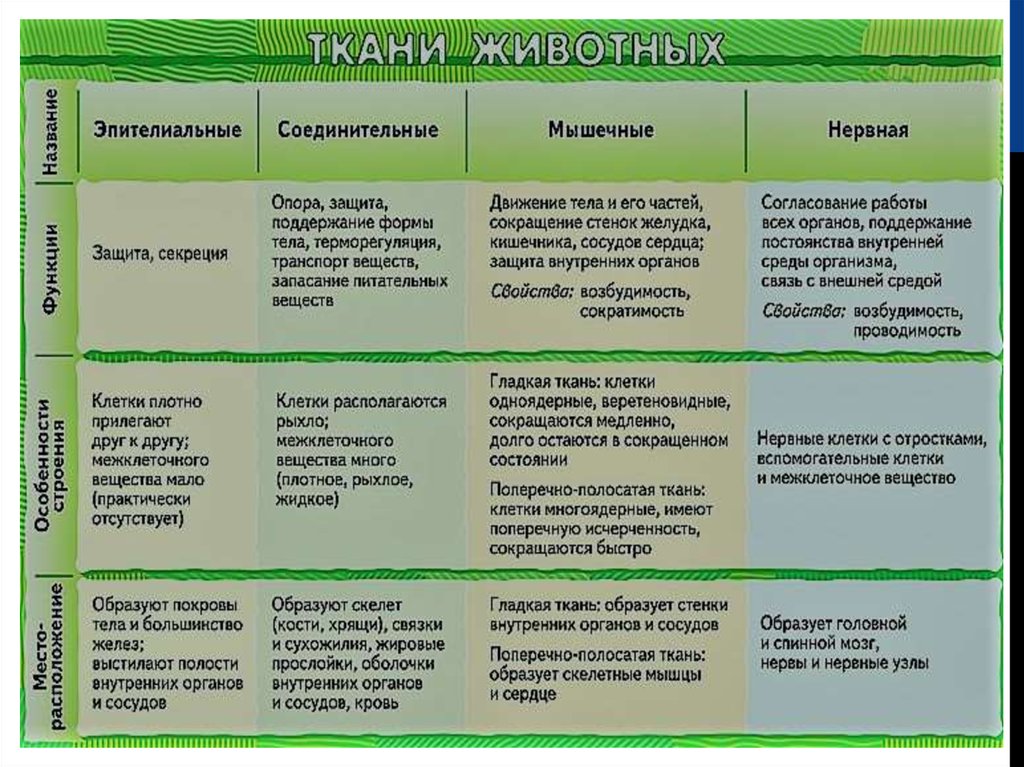 Д. и Дугалл, Д.К.},
Д. и Дугалл, Д.К.},
abstractNote = {Высшие растения производят много промышленно важных продуктов. Среди них лекарства и медицинские химикаты, эфирные масла и ароматизаторы, растительные масла и жиры, тонкие и специальные химикаты и даже некоторые товарные химикаты. Хотя в настоящее время экстракция целых растений является основным способом сбора этих материалов, появление культуры тканей растительных клеток может стать гораздо более эффективным методом производства многих типов фитохимических веществ. Использование иммобилизованных растительных клеток в усовершенствованной конфигурации биореактора с выделением продукта в среду реактора может представлять собой наиболее простой способ коммерциализации таких методов для менее ценных химических веществ. Важные возможности исследований и разработок в этой области включают скрининг культур растений на наличие немедицинских малоценных химических веществ; понимание и контроль физиологии и биохимии растительных клеток; оптимизация эффективных методов иммобилизации; разработка более эффективных концепций биореакторов; и совершенствование методов экстракции и очистки продукта.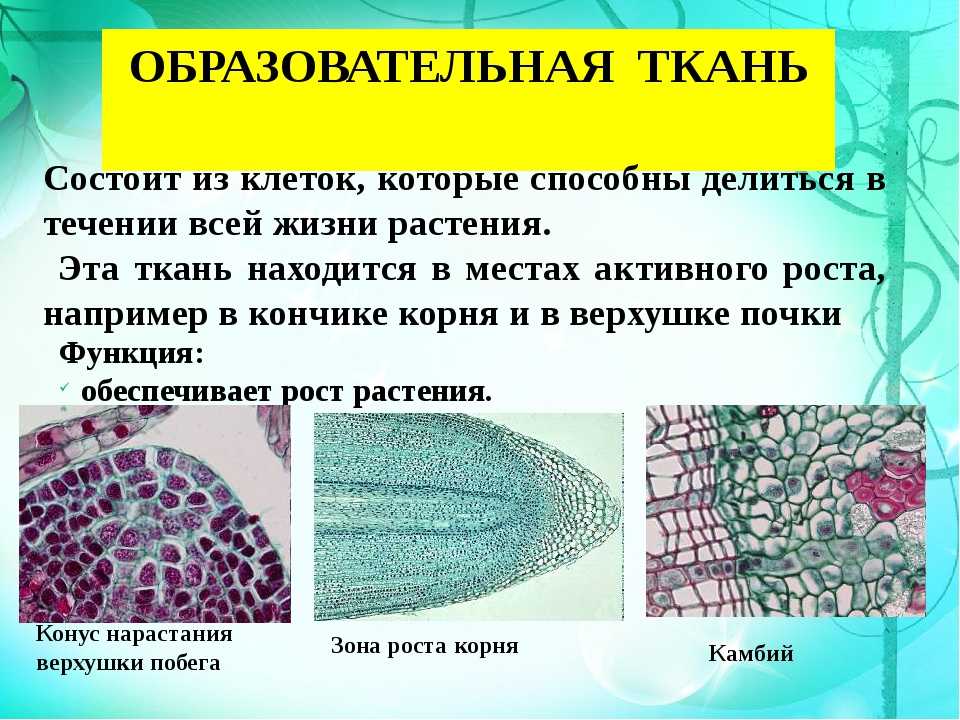

 Все многоклеточные организмы имеют клетки различной структуры, совокупности которых являются тканями. Степень дифференцировки клеток тканей растений возрастает от низших растений к высшим.
Все многоклеточные организмы имеют клетки различной структуры, совокупности которых являются тканями. Степень дифференцировки клеток тканей растений возрастает от низших растений к высшим. Образуется характерная сеть, причем пучки листьев соединены с пучками стеблей, которые формируют разветвленную систему, переходящую в корень.Это проводящая ткань растения.
Образуется характерная сеть, причем пучки листьев соединены с пучками стеблей, которые формируют разветвленную систему, переходящую в корень.Это проводящая ткань растения.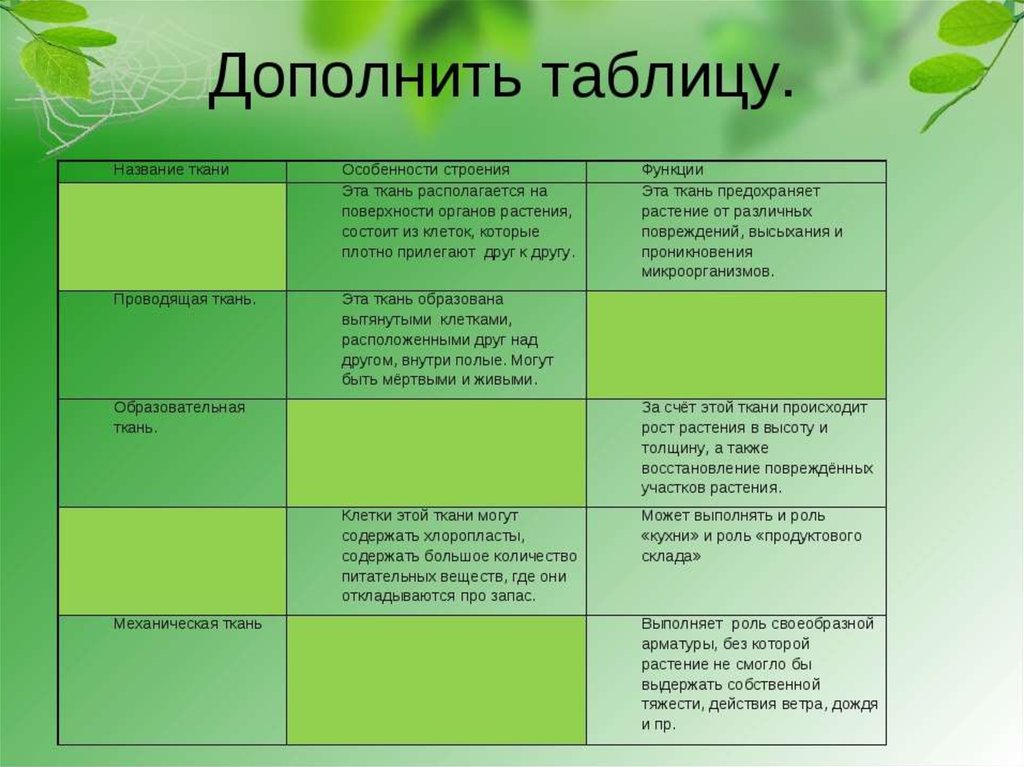 Под кожицей формируется пробковая ткань растения, основная функция которой – защитная так же, как и кожицы. Таким образом, кожица и пробковая ткань являются покровными тканями растений. Функции покровной ткани растения – предохранение органов растения от высыхания, влияния высоких и низких температур, повреждений и других неблагоприятных факторов внешней среды.
Под кожицей формируется пробковая ткань растения, основная функция которой – защитная так же, как и кожицы. Таким образом, кожица и пробковая ткань являются покровными тканями растений. Функции покровной ткани растения – предохранение органов растения от высыхания, влияния высоких и низких температур, повреждений и других неблагоприятных факторов внешней среды.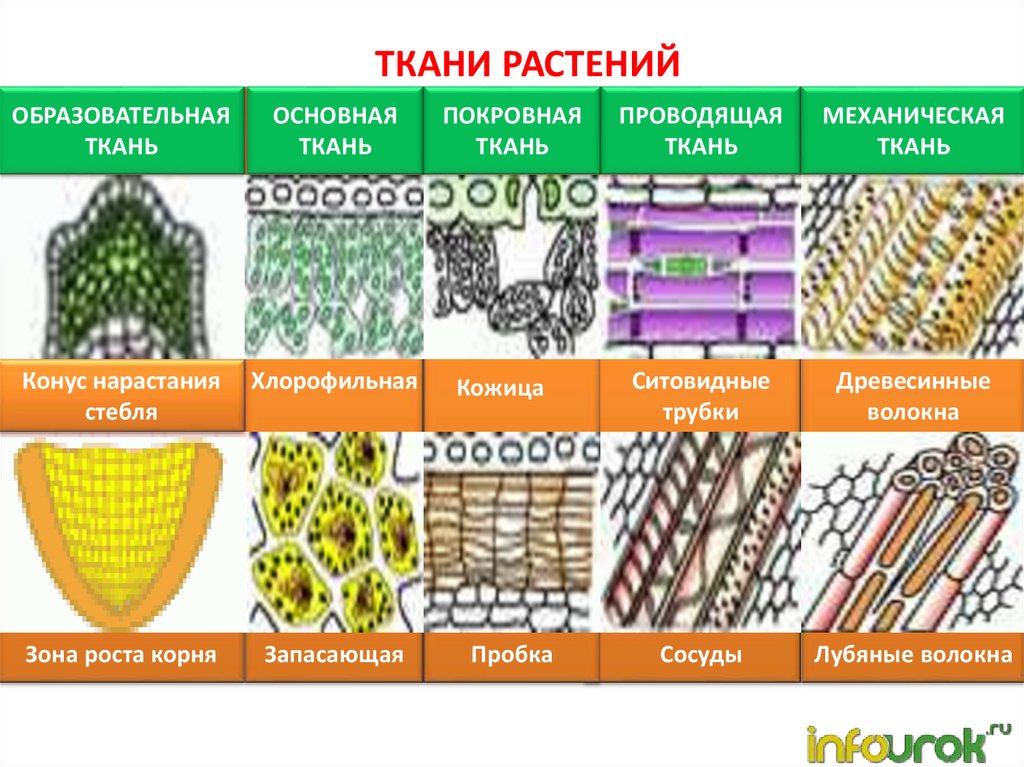

 д.) и дать перемешаться при перемешивании
д.) и дать перемешаться при перемешивании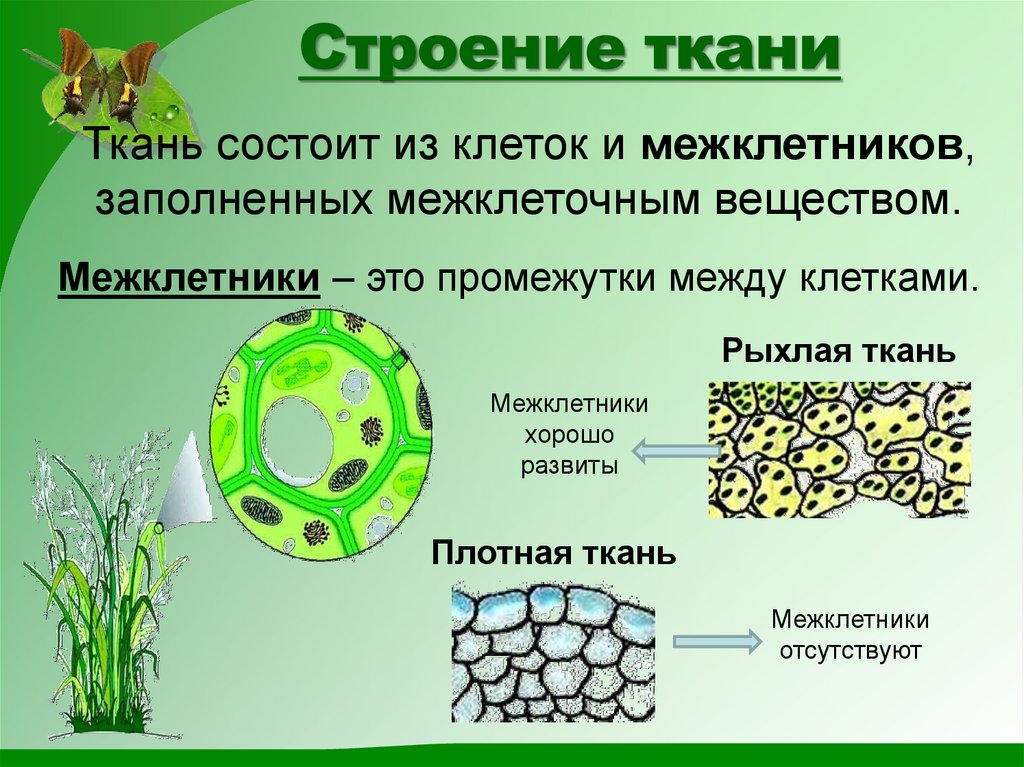 К.
К. Оригинал доступен до исчерпания запасов
Оригинал доступен до исчерпания запасов