|
|
|
|
Идентификационные коды автора: Web of Science ResearcherID, Scopus Author ID, РИНЦ, ORCID iD, Google Scholar Ученая степень, ученое звание: Должность: Электронная почта: Направления исследований:
Ключевые слова: Образование и опыт работы: 1984 – окончила Ленинградский государственный университет. Дипломную работу выполняла на кафедре физиологии и биохимии растений. 1987-1989 – младший научный сотрудник Всероссийский института растениеводства им. В.И. Вавилова. Научные проекты: Руководитель:
Исполнитель:
Прочие проекты: Проекты и программы фундаментальных исследований Президиума РАН, руководитель:
В ходе выполнения проектов проводилось комплексное изучение биологии орхидных, с использованием традиционных и современных методов систематики, эмбриологии и генетики. Объектами исследования являлись растения нескольких видов, внесенных в Красную книгу Российской Федерации (2008) из родов Orchis, Cypripedium, Dactylorhiza, Gymnadenia, Ophrys, Liparis. Были впервые изучены полиморфизм и генетическая структура популяций некоторых редких видов орхидных, описана генетическая структура межвидовых интрогрессивно гибридных комплексов с участием редких таксонов. Установлены ранее неизвестные факты наличия внутригеномного полиморфизма участка ITS1 ДНК у Cypripedium calceolus, у C. Shanxiense и у C. × ventricosum и существования двух разных генетических линий C. Научные мероприятия: Организация мероприятий:
Экспедиции:
Избранные публикации: Shirokov A. Andronova E.V., Kovaleva A. A., Evdokimova E. E, Nazarov V. V., Semeonov A. V. Fruitаge and seed viability of Orchis purpurea (Orchidaceae) at the northeast limit of distribution. The International Journal of Plant Reproductive Biology. 2020. 12(1): 56-66. Butuzova O.G., Torshilova A.A., Andronova E.V. Seed dormancy in Cardiocrinum cordatum var. Glenii (Liliaceae) and ways of its overcoming. The International Journal of Plant Reproductive biology. 2019. 11(1): 51-57. Andronova E.V., Butuzova O.G., Torshilova A.A. Mechanisms of seed dormancy in Cardiocrinum cordatum var. Glenii (Liliaceae). Botanica Pacifica: a Journal of Plant Science and Conservation. Андронова Е.В., Ковалева А.А., Евдокимова Е.Е., Назаров В.В. Причины низкой жизнеспособности семян Orchis purpurea (Orchidaceae) в Крыму. Ботанический журнал. 2018. 103(8): 992–1002. Андронова Е.В., Филиппов Е.Г. Генетический полиморфизм Orchis militaris L. и O. simia Lam. (Orchidaceae) на Кавказе и в Крыму. Экосистемы. 2018. 16(46): 63-73. Филиппов Е.Г., Андронова Е.В. Генетическая структура популяций и естественная гибридизация Dactylorhiza salina и D. incarnata (Orchidaceae). Генетика. 2017. 53(3): 310–323. Филиппов Е.Г., Андронова Е.В., Козлова О.Н. Генетическая структура популяций Dactylorhiza ochroleuca и D. incarnata (Orchidaceae) в зоне их совместного произрастания в России и Беларуси. Генетика. 2017. 53(6): 675–686. Андронова Е.В., Мачс Э.М., Филиппов Е. Андронова Е.В., Евдокимова Е.Е., Семенов А.В. Причины формирования нежизнеспособных диаспор у Orchis purpurea subsp. caucasica (Orchidaceae). Наука Кубани. 2016. 3: 13-20. Андронова Е.В., Мачс Э.М., Филиппов Е.Г. Генетический полиморфизм Cypripedium calceolus, C. macranthon, C. shanxiense, C. × ventricosum (Orchidaceae) по данным пиросеквенирования. Проблемы ботаники Южной Сибири и Монголии. 2016. 15: 95-100. Андронова Е.В., Евдокимова Е.Е., Семенов А.В. Плодоношение, гетероспермия и качество семян у Orchis purpurea (Orchidaceae). Ботанический журнал. 2015. 100(4): 359-372. Poluboyarova T.V., Novikova T.I., Vinogradova G.Yu., Andronova E. Андронова Е.В. Гетерогенность семян и семенного потомства у некоторых видов орхидных в экспериментах in vitro и в природных условиях. В кн. Фундаментальные и прикладные аспекты современной орхидологии. Киев. 2014. 1: 9–19. Полубоярова Т.В., Андронова Е.В., Новикова Т.И., Виноградова Г.Ю. Регенерация побегов из тканей цветка Allium altissimum (Alliaceae) в культуре in vitro. Растительные ресурсы. 2011. 3: 33–42. Андронова Е.В., Ивасенко Ж.В., Вахрамеева М.Г., Варлыгина Т.И. Опыт пересадки Dactylorhiza maculata s.l., полученной в культуре in vitro, в природные условия. Труды Звенигородской биостанции МГУ. (Ред. Н.Г. Уланова, В.М. Гаврилов). М.: Изд-во Московского университета. 2011. Андронова Е.В. Летальные аномалии строения и развития зародыша у Dactylorhiza fuchsii (Druce) Soó (Orchidaceae). Ботанический журнал. 2011. 96(7): 858-863. Филиппов Е.Г., Андронова Е.В. Генетическая дифференциация представителей рода Сypripedium по данным изоферментного анализа. Генетика. 2011. 47(5): 615–623. Андронова Е.В., Ивасенко Ж.В. Жизнеспособность семенного потомства разных растений Dactylorhiza maculata s.l. (Orchidaceae) после посадки из культуры in vitro в природные условия. Ботанический журнал. 2007. 92 (10): 64-74. Андронова Е.В., Ивасенко Ж.В., Вахрамеева М.Г. Выживаемость растений Dactylorhiza maculata s.l. (Orchidaceae) после пересадки из культуры in vitro в природные условия(Московская обл.). Растительные ресурсы. 2007. 43(1): 57-61. Андронова Е.В., Ивасенко Ж.В. Выживаемость растений Dactylorhiza maculata s. Андронова Е.В., Ивасенко Ж.В., Федорова Н.А. Жизнеспособность и темпы развития сеянцев Dactylorhiza maculata s.l. (Orchidaceae) в культуре in vitro. Ботанический журнал. 2007. 92 (7): 1035-1048. Андронова Е.В. О биологическом разнообразии, семенном размножении in vitro и репатриации орхидных. Вестник ТвГУ, Серия Биология и Экология. 2007. 7(35): 8-11. Андронова Е.В., Филиппов Е.Г. Морфологические особенности цветков у самоопыляющихся растений Cypripedium calceolus и C.shanxiense. Ботанический журнал. 2007. 92(3): 360-364. Андронова Е.В., Филиппов Е.Г., Мельникова А.Б., Аверьянов Л.В. Морфологический анализ и соотношение типичных и уклоняющихся форм в популяциях Cypripedium calceolus на юге Хабаровского и Приморского краев. Иванова А.Н., Андронова Е.В., Шаварда А.Л., Муравник Л.Е. Ультраструктура секреторных клеток железистых волосков Drosera rotundifolia (Droseraceae) в культуре in vitro. Ботанический журнал. 2005. 90(6): 878–883. Андронова Е.В. Новые аспекты изучения семенного размножения северных видов орхидных. Биологический вестник. 2003. 7(1-2): 67-69. Андронова Е.В. Особенности развития проростков некоторых видов рода Dactylorhiza (Orchidaceae) после их пересадки из культуры in vitro в природу. Ботанический журнал. 2003. 88(9): 105-109. Андронова Е.В. Прорастение семян Dactylorhiza maculata s.l. (Orchidaceae) in situ. Ботанический журнал. 2003. 88(5): 63-71. Vinogradova T., Andronova E.V. Development of orchid seed and seedlings. In: Orchids Biology: Reviews and Perspectives, Vol. Андронова Е.В., Батыгина Т.Б., Васильева В.Е. Протокорм. В кн. Эмбриология цветковых растений. Терминология и концепции, Т. 3. Системы репродукции. (Ред. Т.Б. Батыгина). СПб: Мир и семья. 2000: 329–334. Андронова Е.В., Куликов П.В., Филиппов Е.Г., Васильева В.Е., Батыгина Т.Б. Проблемы и перспективы семенного размножения in vitro орхидных умеренной зоны. В кн. Эмбриология цветковых растений. Терминология и концепции, Т. 3. Системы репродукции. (Ред. Т.Б. Батыгина). СПб: Мир и семья. 2000: 513–524. Batygina T.B., Andronova E.V. The Orchid protocorm: an opinion. In: Glimpses in Botany (Ed.: Mukerji K.G., Chamola B.P., Sharma A.K.). A.P.H. Pub.Corp., New Delhi, India. 2000: 60-74. Андронова Е.В., Батыгина Т.Б., Васильева В.Е. Протокорм. В кн. Эмбриология цветковых растений. Андронова Е.В., Куликов П.В., Филиппов Е.Г., Васильева В.Е., Батыгина Т.Б. Проблемы и перспективы семенного размножения in vitro орхидных умеренной зоны. В кн. Эмбриология цветковых растений. Терминология и концепции, Т.3. Системы репродукции. (ред. Т.Б. Батыгина). СПб, 2000: Мир и семья. 513-524. Аndronova E.V. Polaric protodermal cell growth during embryo and seedling organogenesis. Biologia, Vilnius. 1999. 1: 45-49. Андронова Е.В. Эмбриогенез орхидных. В кн. Эмбриология цветковых растений. Терминология и концепции, Т.2. Семя. (ред. Т.Б.Батыгина). СПб, Мир и семья. 1997: 524-537. Batygina T.B., Andronova E.A. Is there a cotyledon in the Orchidaceae?: an opinion. In: Recent Advances in Plant Biology (Eds. Malik C.P., Abrol Y.P.). India, Delhi, APN Publ. |
Половое размножение и развитие растений : Farmf
Глава 1. Развитие от клетки до организма
Ключевые вопросы
- Как происходят процессы митоза и мейоза при чередовании половой и бесполой фаз размножения растений?
- Чем отличаются спорофитное и гаметофигное поколения водоросли Ulva (морской салат)?
- К какому поколению — спорофитному или гаметофитному — относится лесной папоротник? Каким образом у него развивается следующее поколение?
- Какие мужские и женские половые органы имеются в цветке?
- Какие формы мужских и женских гаметофитных поколений существуют у цветковых растений?
- Чем отличаются опыление и оплодотворение?
- Каковы основные части зародыша цветковых растений?
- Как изменяются питательные потребности у зародышей растений в процессе их развития?
- Какую пользу растениям приносит способность их семян находиться в покоящемся состоянии?
- Какие факторы способствуют их прорастанию?
- Что такое меристемы? Где располагаются меристемные ткани у развивающихся растений?
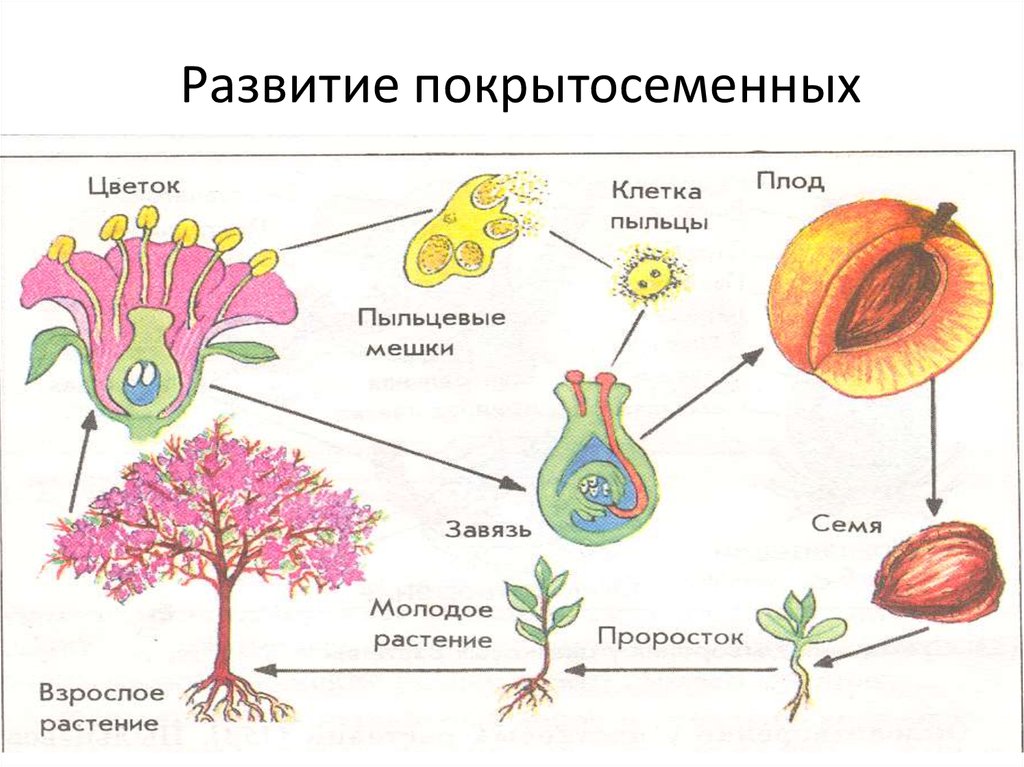
Преимущества полового размножения так же существенны для растений, как и для животных, но, поскольку высшие растения стационарны, у них выработались иные способы объединения двух гамет для формирования нового организма.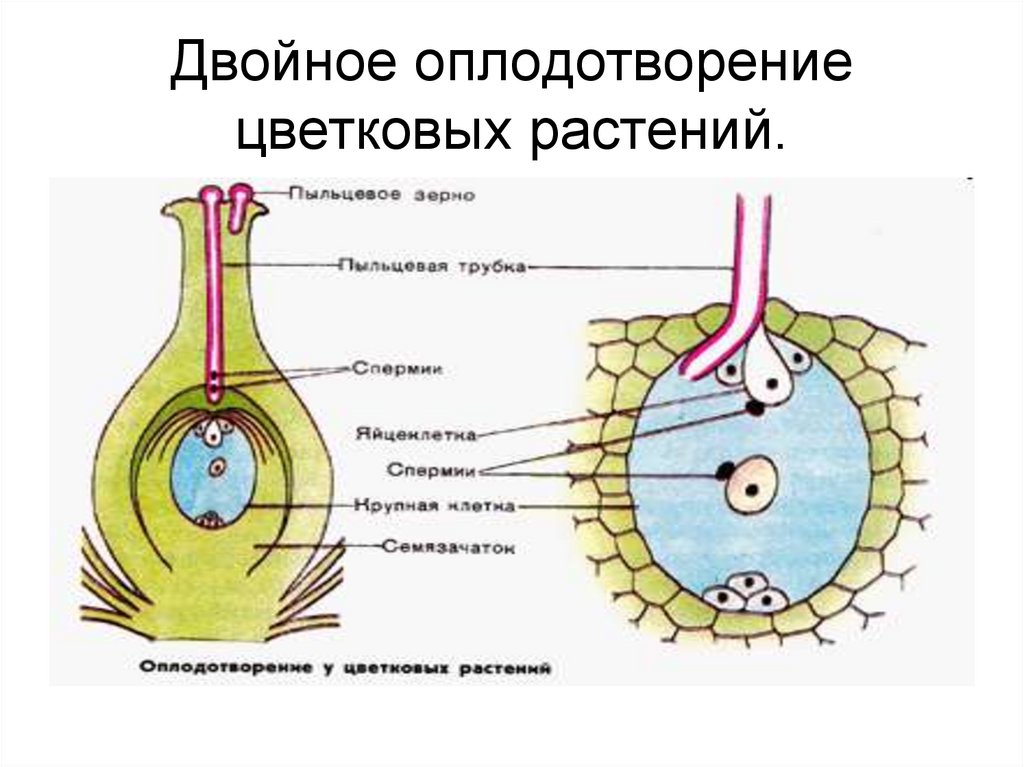
После оплодотворения начинается развитие зародыша растения.
В течение очень короткого времени оплодотворенная яйцеклетка развиваестся в полностью сформированное растение.
3.1. У большинства растений половое и бесполое размножение попеременно сменяют друг друга
Цикл размножения почти всех видов растений включает половую и бесполую фазы. Обычно объединение двух гамет приводит к формированию диплоидной клетки — зиготы, которая развивается в диплоидное растение бесполого спорофитного поколения. Спорофитным растение называют потому, что в результате мейотического деления оно образует гаплоидные споры. В свою очередь, из каждой споры развивается гаплоидное растение полового гаметофитного поколения, которое образует гаплоидные гаметы. Цикл размножения повторяется снова после соединения двух гамет, образования зиготы и восстановления диплоидного набора хромосом. Споры никогда не объединяются друг с другом, каждая спора независимо делится митотически и развивается в целое растение.
Относительно простым примером чередования поколений является широко распространенная водоросль Ulva, или морской салат. (Водоросли включают в себя ряд простейших форм растений. Их размеры колеблются от единичных микроскопических клеток до многоклеточных образований со стеблями длиной около 75 футов, или 23 м.) Ulva растет в мелководных участках моря и имеет тонкие, почти прозрачные, зеленые листья.
Некоторые из этих растений являются диплоидными спорофитами, другие — гаплоидными гаметофитами.
В определенное время года некоторые клетки диплоидных спорофитов делятся и проходят мейоз внутри старых клеточных оболочек. Образовавшиеся гаплоидные споры разрывают окружающую их оболочку и распространяются в воде с помощью имеющихся у них четырех жгутиков (рис. 3-1). Подвижные споры выглядят одинаковыми и не проявляют тенденции к слиянию друг с другом.
Рис. 3-1. Цикл развития Ulva (морского салата)
Если спора, опускаясь на дно, попадает на благоприятную почву, из нее развивается водоросль гаметофитного поколения, идентичная исходному спорофиту.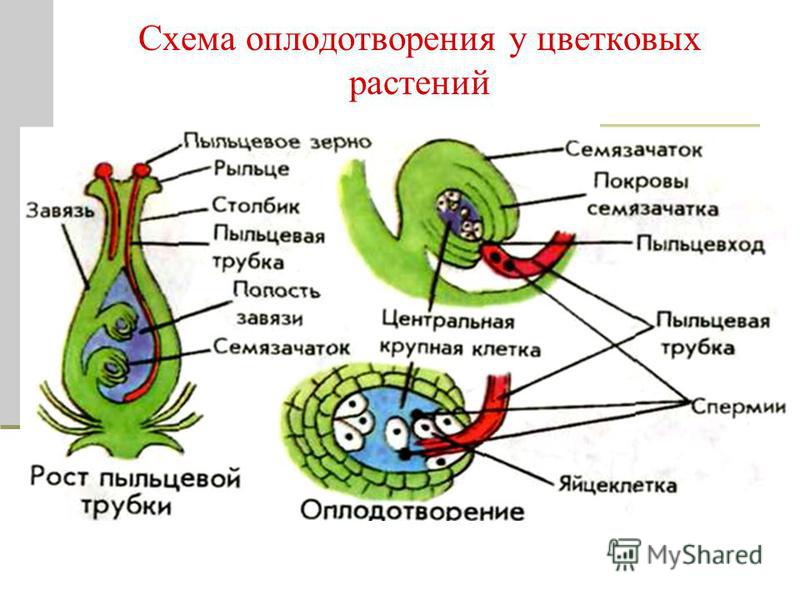 Однако в ядрах клеток этого нового растения содержится гаплоидный набор хромосом. Со временем гаплоидные растения образуют изогаметы, каждая из которых имеет только два жгутика.
Однако в ядрах клеток этого нового растения содержится гаплоидный набор хромосом. Со временем гаплоидные растения образуют изогаметы, каждая из которых имеет только два жгутика.
Если изогаметы двух разных растений объединяются, формируется зигота, которая может развиться в диплоидный спорофит.
3.2. У наземных растений чередование поколений более сложное, так как перемещение спор и гамет в воздухе более затруднено, чем в воде
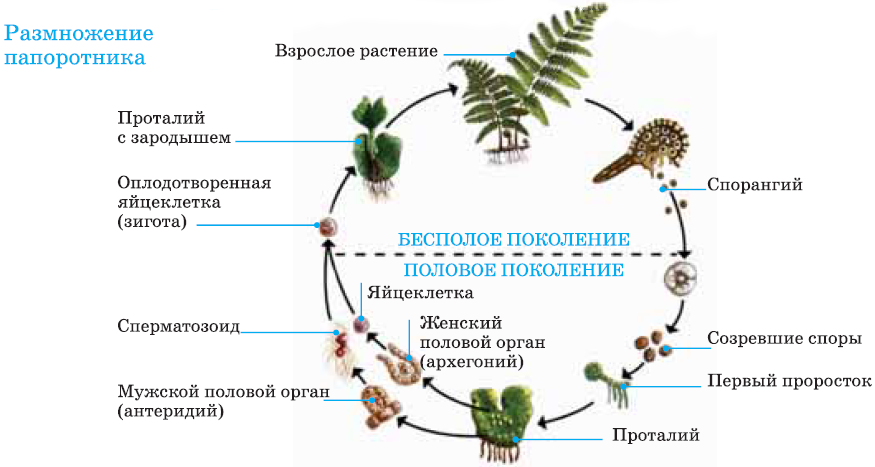
Нецветущие растения, например лесные папоротники, являются диплоидными спорофитами. Споры образуются в результате мейоза в коричневых спорангиях на внутренних сторонах листьев папоротника. После того как созревшие споры падают на землю, они развиваются в маленькие, плоские, серцевидные гаметофиты (рис. 3-2). Гаметы образуются в специализированных структурах на нижней поверхности этих миниатюрных растений. Один тип гамет представляет собой маленькие подвижные микрогаметы (сперматозоиды). Другой — крупные неподвижные макрогаметы (яйцеклетки).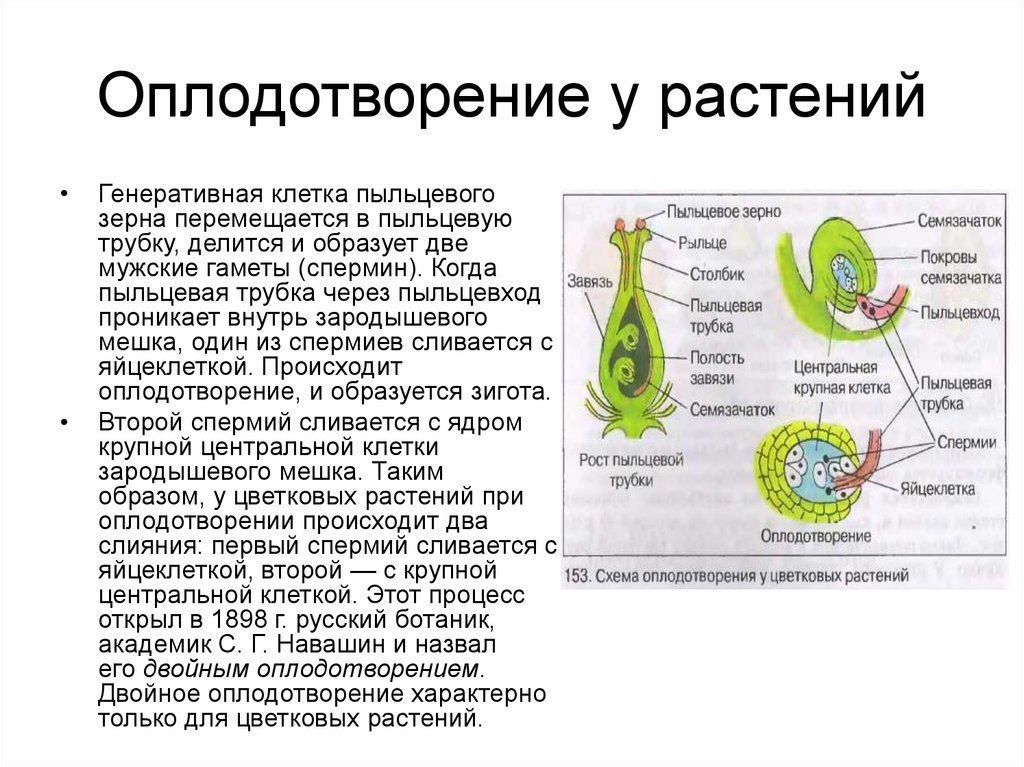 У папоротников яйцеклетки и сперматозоиды образуются в одних и тех же гаметофитах.
У папоротников яйцеклетки и сперматозоиды образуются в одних и тех же гаметофитах.
Рис. 3-2. Цикл развития папоротника
Когда происходит высвобождение сперматозоидов (во время дождливого периода), они передвигаются в воде, окружающей гаметофит. В свою очередь яйцеклетки образуют специфическое вещество, которое способствует передвижению сперматозоида к яйцеклетке и их слиянию. Образовавшиеся зиготы растут и разрушают гаметофит. Вновь сформированное растение является спорофитом.
3.3. У высших растений органы размножения находятся в цветках
Наземные растения часто подвержены воздействиям жары, холода, дождей, засухи, и, хотя взросльщ растения могут адаптироваться к таким условиям, большинство зигот не способно выжить. Поэтому у многих растений зиготы содержатся в тканях взрослого растения, которое их защищает. В этих условиях образуется меньшее количество гамет и зигот, однако каждая из них имеет больше шансов выжить.
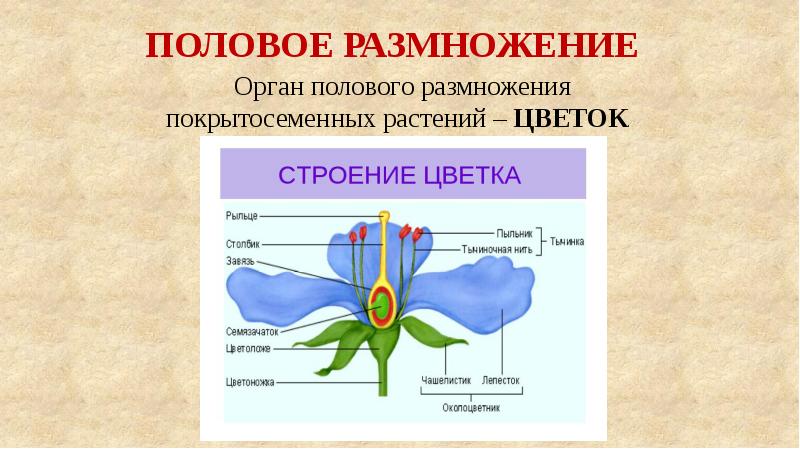
Такими специализированными структурами, которые обеспечивают сохранность зародышей, являются цветки.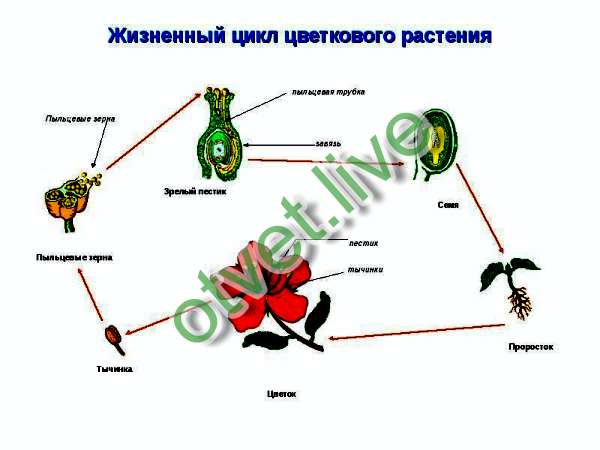 Типичный цветок содержит все необходимые компоненты для полового размножения (рис. 3-3).
Типичный цветок содержит все необходимые компоненты для полового размножения (рис. 3-3).
Рис. 3-3. Продольный разрез цветка нарцисса
Дополнительными частями цветка являются чашелистики, защищающие бутон во время его формирования, и лепестки, которые придают цветку особую привлекательность. Основными структурами размножения в цветке являются мужские тычинки, состоящие из тычиночных нитей, на концах которых расположены пыльники, и женский пестик, имеющий рыльце, столбики завязь.
Развитие микрогамет происходит в пыльниках. Макрогаметы формируются в завязи, где происходит оплодотворение и развитие зиготы.
У одних растений происходит самоопыление, т. е. микрогаметы из пыльника могут оплодотворять макрогаметы в завязи того же цветка. У других самоопылению препятствуют определенные физиологические барьеры. Властности, формирование микро- и макрогамет в период цветения происходит в различное время. У большой группы растений самоопыление невозможно, поскольку мужские b женские цветки образуются на разных растениях.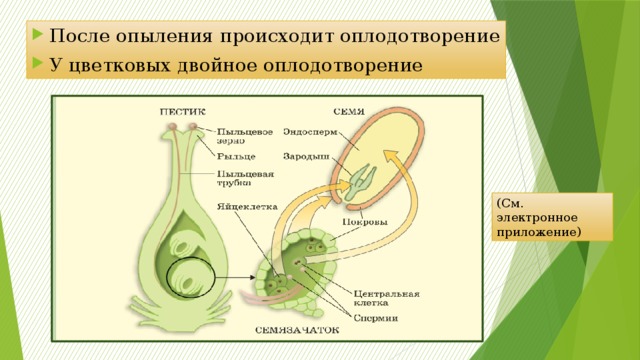 У некоторых растений, размножающихся только вегетативно, развиваются стерильные цветы.
У некоторых растений, размножающихся только вегетативно, развиваются стерильные цветы.
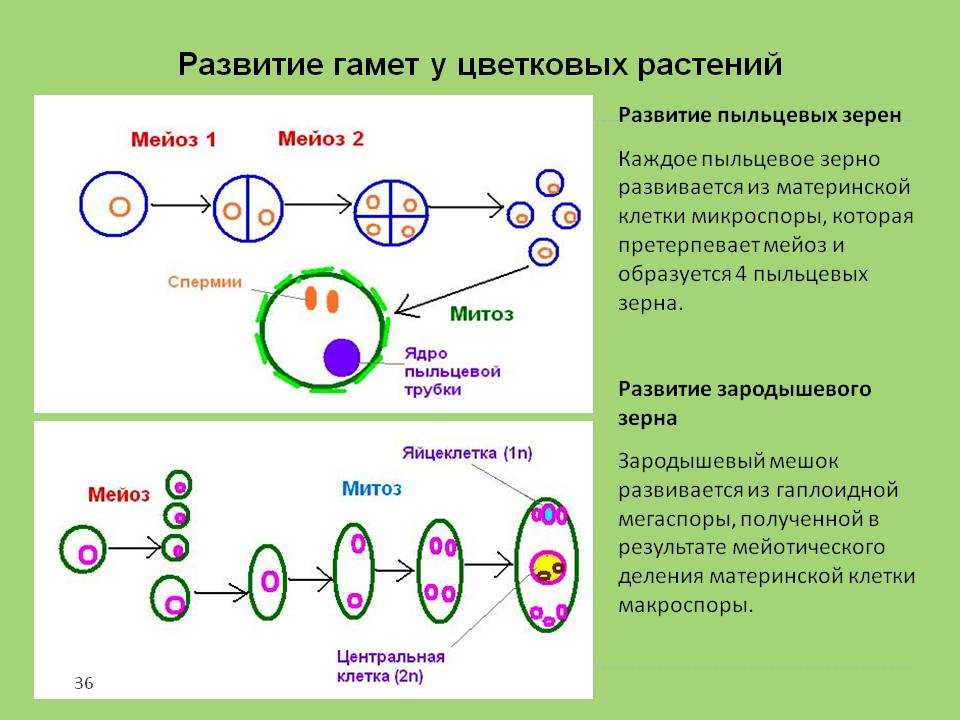
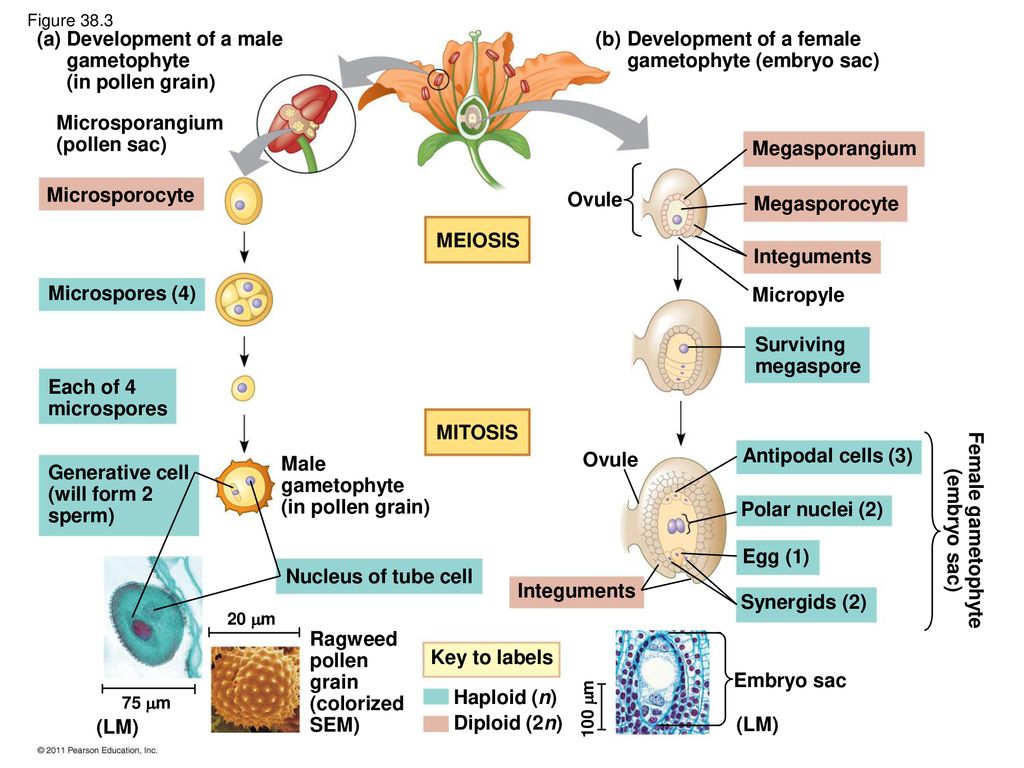
Независимо от того, происходит самоопыление или нет, гаметофитное поколение у цветущих растений представляет собой не отдельное растение, а часть цветка. Действительно, мужской гаметофит является пыльцевым зерном, а женский гаметофит — зародышевым мешком. Внутри пыльника каждая диплоидная пыльцевая материнская клетка, делясь мейотически, образует четыре гаплоидные пыльцевые клетки, или микроспоры. Таким образом формируется мужское гаметофитное поколение. Стенки пыльцевых клеток становятся тоньше, а митотически делящееся ядро образует зрелое пыльцевое семя с двумя ядрами. Когда пыльник созревает и открывается, происходит высвобождение семян, которые переносятся на другие цветки ветром, насекомыми или другим способом.
Женский гаметофит развивается в завязи растения и полностью обособлен от окружающей среды. В завязи обычно имеется несколько центров роста, где развиваются семяпочки.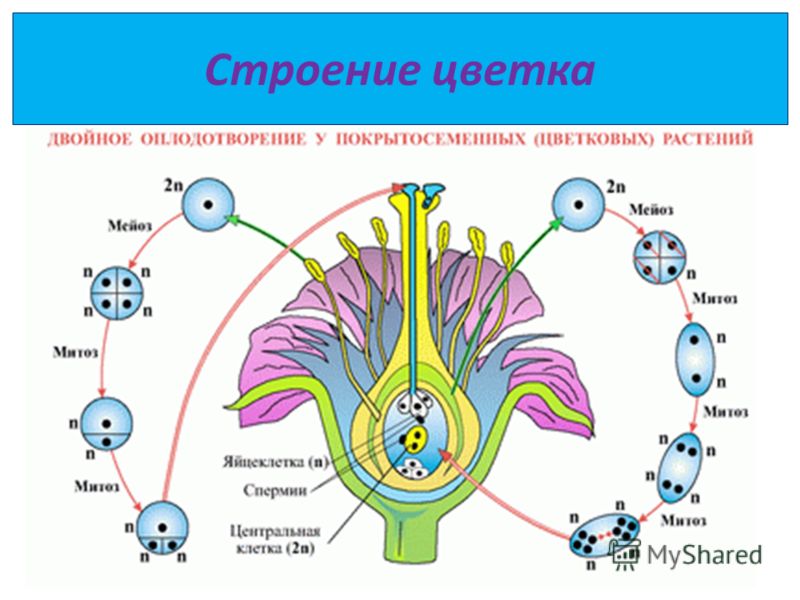 В дальнейшем в этих структурах произойдет образование ткани женского гаметофита. В центре семяпочки материнская клетка — макроспора — делится мейотически и образует четыре гаплоидных макроспоры. Выживает только одна из четырех макроспор, которая делится митозом и образует зародышевый мешок с восемью ядрами (рис. 3-4, Б). Цитоплазма зародышевого мешка распределяется между шестью ядрами, образуя структуры, подобные клеткам. Одна из этих новых клеток становится яйцеклеткой, которая располагается у одного из полюсов зародышевого мешка, вблизи отверстия в семяпочке, называемого микропиле. Клетки семяпочки, окружающие зародышевый мешок, формируют защитные оболочки, или интегументы. В отличие от мужских пыльцевых зерен зародышевый мешок неподвижен.
В дальнейшем в этих структурах произойдет образование ткани женского гаметофита. В центре семяпочки материнская клетка — макроспора — делится мейотически и образует четыре гаплоидных макроспоры. Выживает только одна из четырех макроспор, которая делится митозом и образует зародышевый мешок с восемью ядрами (рис. 3-4, Б). Цитоплазма зародышевого мешка распределяется между шестью ядрами, образуя структуры, подобные клеткам. Одна из этих новых клеток становится яйцеклеткой, которая располагается у одного из полюсов зародышевого мешка, вблизи отверстия в семяпочке, называемого микропиле. Клетки семяпочки, окружающие зародышевый мешок, формируют защитные оболочки, или интегументы. В отличие от мужских пыльцевых зерен зародышевый мешок неподвижен.
Рис. 3-4. Оплодотворение и раннее развитие цветковых растений. А. Проросшее пыльцевое зерно. Б. Пыльцевая трубка продвигается к завязи цветка, проходит микропиле и оплодотворяет семяпочку. В. — Ж. Стадии раннего развития зародыша растений. Показаны подвесок, котиледон и апикальная меристема. Все данные стадии развития проходят внутри семяпочки. Ж. Зрелый зародыш изогнут и повторяет форму семяпочки. 3. Зрелый зародыш внутри семяпочки
Показаны подвесок, котиледон и апикальная меристема. Все данные стадии развития проходят внутри семяпочки. Ж. Зрелый зародыш изогнут и повторяет форму семяпочки. 3. Зрелый зародыш внутри семяпочки
3.4. Опыление, перенос пыльцевых зерен от пыльника на рыльце пестика предшествует оплодотворению, в результате которого происходит объединение ядер яйцеклетки и сперматозоида
Вскоре после того, как пыльцевое зерно попадает на рыльце пестика, одно из двух ядер в пыльце делится и образует два ядра мужской половой клетки.
У пыльцевого зерна формируется труйса, которая растет внутрь пестика по направлению к семяпочке. Два ядра мужской половой клетки продвигаются по мере роста трубки. Этот процесс занимает от нескольких часов до нескольких дней, хотя у некоторых растений длится несколько месяцев (рис. 3-4, А).
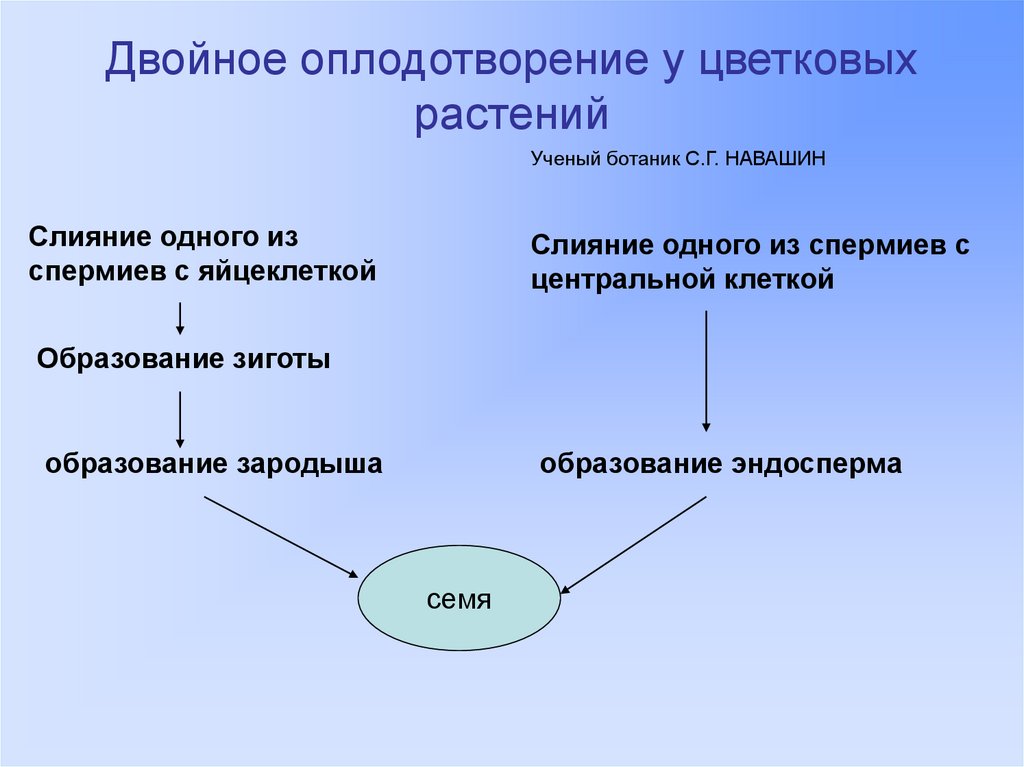
Пыльцевая трубка входит в зародышевый мешок через микропиле семяпочки. При этом конец трубки разрывается и оба ядра мужской половой клетки попадают внутрь.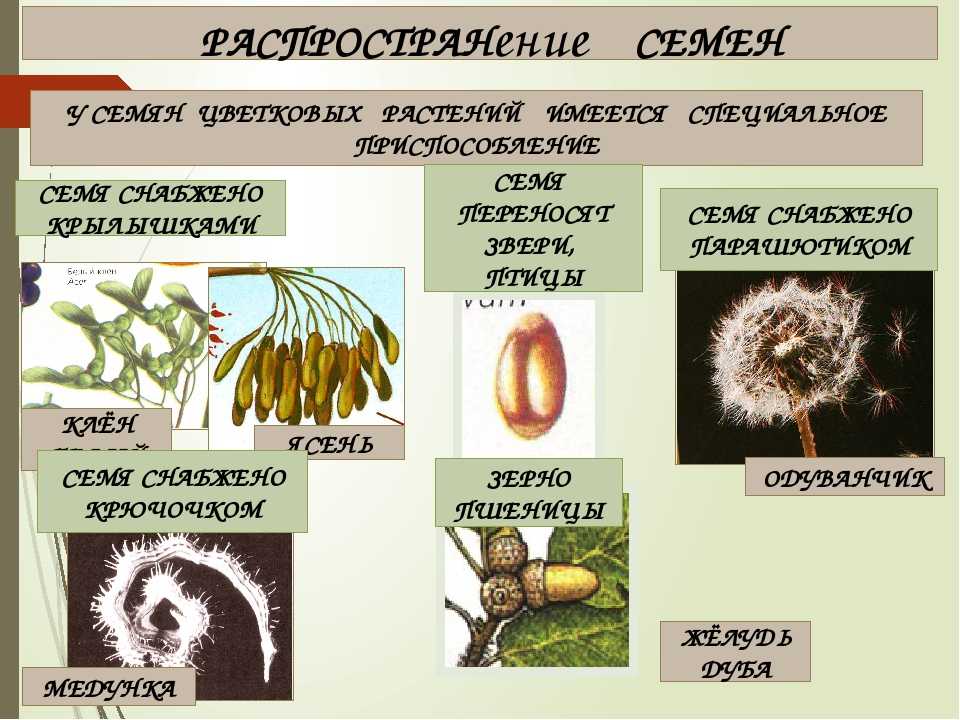 Одно ядро сперматозоида сливается с поЯйрными ядрами семяпочки и формирует эндосперм, т.е. ткань, обеспечивающую питание зародыша. Эта ткань образуется в результате слияния трех ядер и поэтому содержит в три раза и более увеличенный гаплоидный набор хромосом. Другое ядро сперматозоида проникает в яйцеклетку и, объединяясь с ее ядром, образует диплоидную зиготу.
Одно ядро сперматозоида сливается с поЯйрными ядрами семяпочки и формирует эндосперм, т.е. ткань, обеспечивающую питание зародыша. Эта ткань образуется в результате слияния трех ядер и поэтому содержит в три раза и более увеличенный гаплоидный набор хромосом. Другое ядро сперматозоида проникает в яйцеклетку и, объединяясь с ее ядром, образует диплоидную зиготу.
3.5. После оплодотворения начинается рост зародыша растения
Одно из отличительных свойств растений — их способность развиваться без помощи активно подвижных клеток. Увеличение массы клеток и морфогенез (становление формы растения) происходит исключительно за счет деления клеток. Становление же формы эмбрионального растения обусловлено неодинаковой скоростью деления клеток в отдельных участках зародыша и различиями в плоскости делений, которые по-разному ориентируют клетки относительно поверхности растения. (Рост зрелых растений также зависит от клеточных делений, которые в основном происходят в недифференцированных тканях, называемых меристемами. Поэтому они обычно считаются зонами, где происходит развитие эмбрионов.)
Поэтому они обычно считаются зонами, где происходит развитие эмбрионов.)
Сразу после оплодотворения ядра эндосперма начинают быстро делиться и образуют большое количество ядер внутри зародышевого мешка. Затем между ними возникают клеточные мембраны. Сформированные таким путем клетки эндосперма содержат большую часть цитоплазмы зародышевого мешка. Эндосперм является тканью, обеспечивающей питание эмбриона. Часто она представляет собой жидкость, например молоко кокосового ореха. После того как формирование эндосперма завершено, начинает делиться зигота. Образуются две структуры — собственно эмбрион (рис, 3-4, В-3) и подвесок (рис. 3-4, Д), который продвигает зародыш в эндосперм. Зародыш быстро развивается, и вскоре образуются клетки, которые в дальнейшем формируют главный стебель, или ось нового растения. На одном конце этой будущей оси находится зародышевый росток, или эпикотиль, на другом — зародышевый корень, первичный корешок. Первые эмбриональные листки, или семядоли (рис.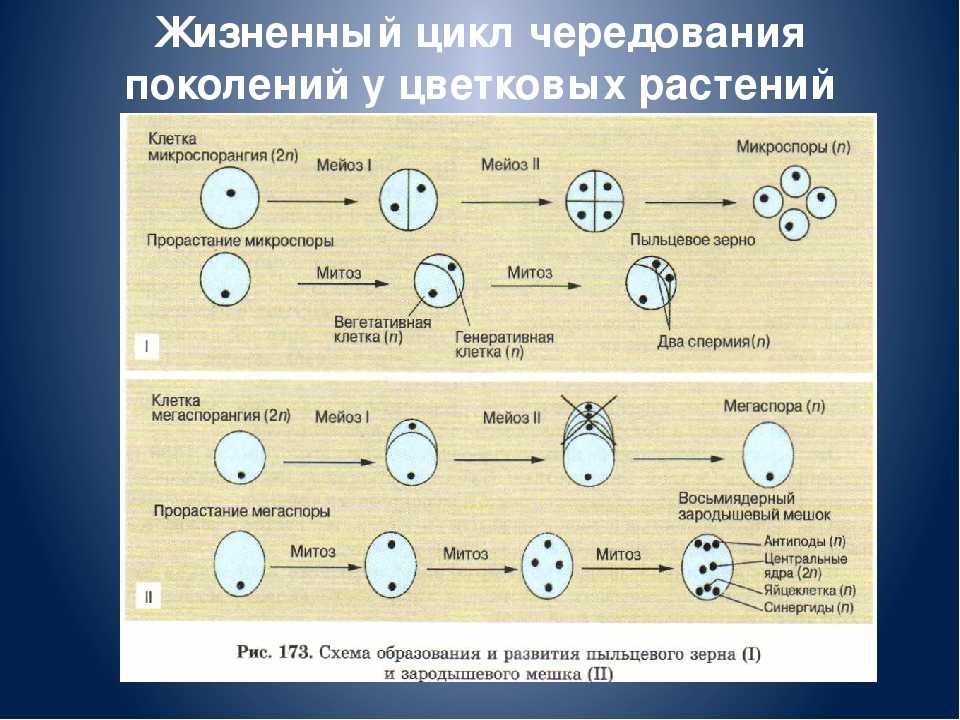 3-4, E), будут поглощать питательные вещества эндосперма и передавать их непосредственно в зародыш. Тем временем изменяются состав и строение наружных оболочек семяпочки. Она уплотняется и сохраняет зародыш до тех пор, пока он не прорастет и не образует молодое растение, или побег.
3-4, E), будут поглощать питательные вещества эндосперма и передавать их непосредственно в зародыш. Тем временем изменяются состав и строение наружных оболочек семяпочки. Она уплотняется и сохраняет зародыш до тех пор, пока он не прорастет и не образует молодое растение, или побег.
3.6. По мере развития эмбрионов растений их питательные потребности уменьшаются
Когда-то удавалось выращивать только относительно зрелые зародыши растений, поскольку культивирование ранних зародышей требует более сложной питательной среды. Позднее было обнаружено, что растворы, содержащие кокосовое молоко, способствуют развитию ранних зародышей, поскольку кокосовое молоко представляет собой жидкий эндосперм, в котором присутствуют растительные гормоны и органические вещества, необходимые зародышам. После того как эти гормоны были определены и очищены, появилась возможность выращивать очень ранние зародыши на полностью искусственных средах.
Эти эксперименты показывают, что способность к синтезу у ранних эмбрионов растений крайне ограничена и поэтому они зависят от наличия в окружающей среде как сложных, так и простых веществ. По мере развития зародышей увеличивается их способность синтезировать различные вещества, и в конечном счете они могут полностью удовлетворять свои потребности в сложных веществах, синтезируя их из простых.
По мере развития зародышей увеличивается их способность синтезировать различные вещества, и в конечном счете они могут полностью удовлетворять свои потребности в сложных веществах, синтезируя их из простых.
3.7. Семена со зрелыми зародышами часто находятся в состоянии покоя
Зародыш, находящийся внутри семени, обычно способен выживать в таких условиях, в которых родительское растение погибает. Поэтому многие растения используют семена не только для размножения, но и для преодоления неблагоприятных условий окружающей среды. Некоторые семена могут находиться в состоянии покоя многие годы и сохранять способность к прорастанию. Так когда были высажены семена лотоса, имеющие возраст около 1000 лет, они проросли и развились в зрелые растения.
Состояние покоя предотвращает прорастание растений в неблагоприятное время. В зоне умеренного климата семена, созревшие в конце лета, падают на землю рядом с родительским растением и сохраняются в состоянии покоя. Они не прорастают до тех пор, пока не пройдет холодный период.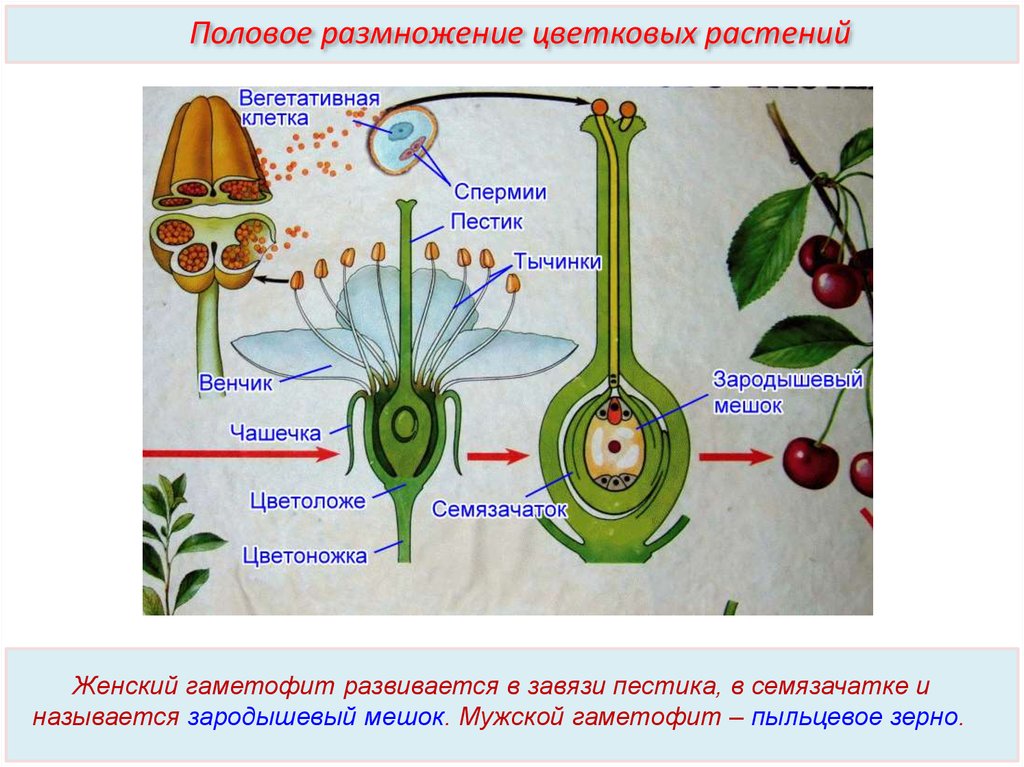 Таким образом исключается прорастение семян осенью или во время короткой оттепели, которая, сменившись морозом, может погубить их.
Таким образом исключается прорастение семян осенью или во время короткой оттепели, которая, сменившись морозом, может погубить их.
Некоторые растения пустынь имеют очень короткий жизненный цикл и буйно растут только во время дождливого сезона. Семена этих растений не прорастают до тех пор, пока не наступит сезон дождей и не выпадет определенное количество осадков. После того как в почве накопится достаточное количество влаги, новое растение созревает и образует семена следующего поколения. Потребность семян во влаге регулируется растворимым веществом (ингибитором), от которого зависят сроки их прорастания. Только после того, как выпадет достаточное количество осадков, которые растворят и смоют этот ингибитор, может начаться прорастание.
3.8. После периода покоя семена прорастают, и у зародыша растения начинает развиваться корень
Прорастание семян включает в себя развитие корня, стебля (или ствола) и листьев. Однажды начавшись, развитие этих частей продолжается в течение всей жизни растения и может прерываться только на время сезонных периодов покоя. Каждый сезон у растения появляются новые стебли, листья и корни. У древесных пород растений увеличивается диаметр ствола. Вероятно, такой постоянный рост и развитие часто включают в себя те же процессы, которые происходят в зародыше.
Каждый сезон у растения появляются новые стебли, листья и корни. У древесных пород растений увеличивается диаметр ствола. Вероятно, такой постоянный рост и развитие часто включают в себя те же процессы, которые происходят в зародыше.
Корни развиваются первыми. Для нормального развития молодого растения необходимо, чтобы корень пророс в почву, откуда он может извлекать воду и минеральные вещества. На кончике корня находятся молодые клетки, а ближе к основанию располагаются более старые (рис. 3-5). Корневой чехлик, расположенный на самом кончике корня, защищает более организованный и чувствительный участок корня от действия частиц почвы. Выше чехлика находится зона клеточного деления, корневая меристема, где формируются практически все новые клетки растущего корня. Хотя она является единственной зоной высокой митотической активности, наиболее заметный рост корня осуществляется не здесь. Сразу после деления клетки корневой меристемы приобретают кубическую форму, и, только когда последующие деления отодвинут их от кончика корня, начинается элонгация клеток, которая приводит к его удлинению. Элонгация клеток и поглощение воды обеспечивают продвижение корня в почве.
Элонгация клеток и поглощение воды обеспечивают продвижение корня в почве.
Рис. 3-5. Схема продольного разреза ростка и корня цветкового растения
Над зоной элонгации находится зона созревания, где клетки дифференцируются (рис. 3-5). Здесь проявляется дифференциальная активность генов, т. е. в процессе дифференцировки клетки используют только часть своей генетической информации. После того как клетки дифференцируются, они сохраняют свою специфичность в нормальных условиях в течение всей жизни растения.
Хотя корень взрослого растения состоит из дифференцированных клеток, меристема на кончике корня (апикальная меристема) сохраняет такой же эмбриональный характер, как и в прорастающем семени. Некоторые кольцевые слои клеток внутри зрелого корня также сохраняют меристематическую активность. Такой кольцевой слой называют камбием. Обычно существует пробковый камбий, образующий корневую кору, и сосудистый камбий, который постоянно увеличивает количество клеток в проводящей ткани.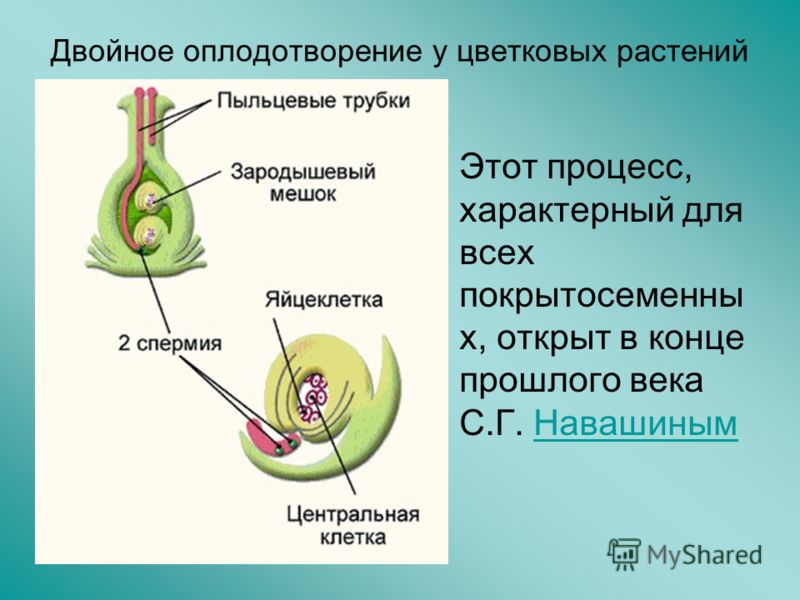 Таким образом корень может постоянно расти в длину и утолщаться.
Таким образом корень может постоянно расти в длину и утолщаться.
3.9. Развитие проростка, как и развитие корня, происходит в апикальной меристеме
По мере роста верхней части развивающегося проростка формируются ткани стебля и листьев (рис. 3-5). Эту зону принято считать организующим центром растения. Основная организующая активная зона развивающегося проростка
находится в куполообразном выступе на самой верхушке и называется промеристемой. Типы клеток, составляющие промеристему, отличаются у разных групп растений.
Так же, как и у корней, в проростке различают ряд других зон роста, называемых камбиальными (рис. 3-6). В стволе деревьев и кустарников непосредственно под корой располагается пробковый камбий, из которого образуется кора. Глубже находится второй меристематический цилиндр, или сосудистый камбий. Обычно плоскость делений этих камбиальных клеток параллельна наружной поверхности ствола. Дочерние клетки, лежащие внутри кольца сосудистого камбия, образуют ткани ксилемы, по которым вода от корней перемещается вверх. Ежегодные приросты тканей ксилемы имеют кольцевую форму и увеличивают толщину ствола дерева. В зонах с умеренным климатом, где температура и количество осадков подвержены сезонным изменениям, годичные периоды роста отличаются друг от друга. На поперечном срезе ствола дерева ткани ксилемы располагаются в виде годичных колец. Дочерние клетки, лежащие снаружи сосудистого камбия, формируют ткань флоэмы, по которой перемещаются жидкости, в основном сок. Скорость клеточных делений в камбии зависит от температуры и влажности.
Ежегодные приросты тканей ксилемы имеют кольцевую форму и увеличивают толщину ствола дерева. В зонах с умеренным климатом, где температура и количество осадков подвержены сезонным изменениям, годичные периоды роста отличаются друг от друга. На поперечном срезе ствола дерева ткани ксилемы располагаются в виде годичных колец. Дочерние клетки, лежащие снаружи сосудистого камбия, формируют ткань флоэмы, по которой перемещаются жидкости, в основном сок. Скорость клеточных делений в камбии зависит от температуры и влажности.
Рис. 3-6. Схема поперечного и радиального разрезов древесного ствола. Показаны слои меристемы, проводящие и опорные элементы, необходимые для роста растений
32.1: Репродуктивное развитие и структура растений — Репродуктивное развитие и структура растений
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 13800
- Безграничный
- Безбрежный
Цели обучения
- Различать способы размножения растений
Введение
Растения выработали различные репродуктивные стратегии для продолжения своего вида.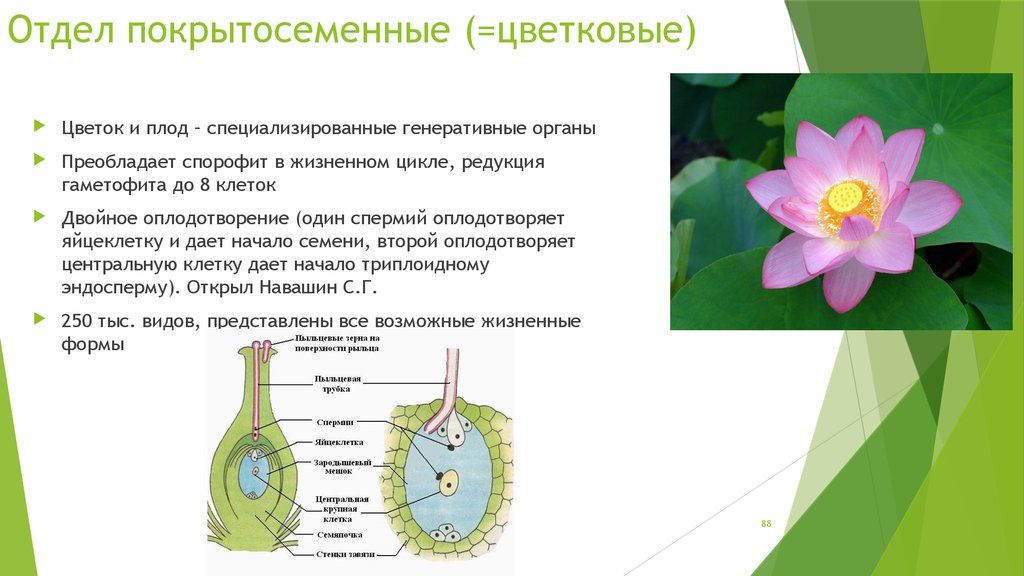 Некоторые растения размножаются половым путем, тогда как другие размножаются бесполым путем, в отличие от видов животных, которые полагаются почти исключительно на половое размножение. Половое размножение растений обычно зависит от агентов-опылителей, тогда как бесполое размножение не зависит от этих агентов. Цветы часто являются самой эффектной или наиболее ароматной частью растений. Своими яркими цветами, ароматами и интересными формами и размерами цветы привлекают насекомых, птиц и животных для удовлетворения своих потребностей в опылении. Другие растения опыляются ветром или водой; третьи самоопыляются.
Некоторые растения размножаются половым путем, тогда как другие размножаются бесполым путем, в отличие от видов животных, которые полагаются почти исключительно на половое размножение. Половое размножение растений обычно зависит от агентов-опылителей, тогда как бесполое размножение не зависит от этих агентов. Цветы часто являются самой эффектной или наиболее ароматной частью растений. Своими яркими цветами, ароматами и интересными формами и размерами цветы привлекают насекомых, птиц и животных для удовлетворения своих потребностей в опылении. Другие растения опыляются ветром или водой; третьи самоопыляются.
Бесполое размножение
Вегетативное размножение является одним из видов бесполого размножения. Другими применимыми терминами являются вегетативное размножение, клональный рост или вегетативное размножение. Вегетативный рост — это увеличение отдельного растения, в то время как вегетативное размножение — это любой процесс, который приводит к появлению новых «особей» растений без производства семян или спор.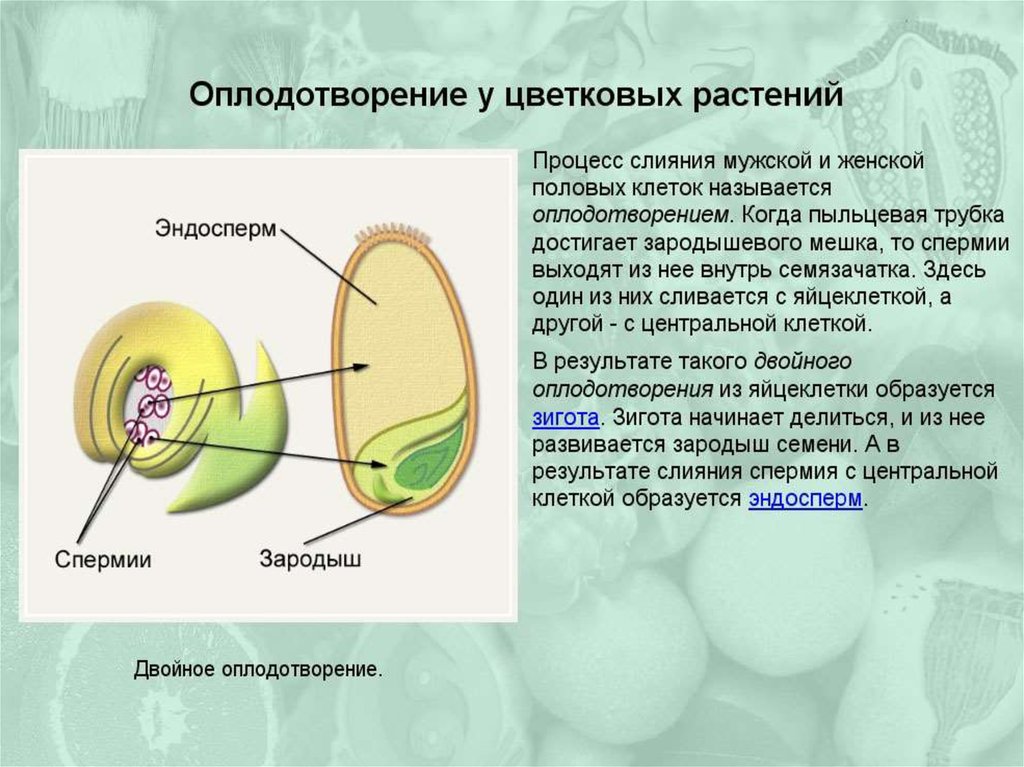 Это естественный процесс для многих и многих видов, а также процесс, используемый или поощряемый садоводами и фермерами для получения большого количества экономически ценных растений. В этом отношении это форма клонирования, которая осуществляется человечеством на протяжении тысячелетий, а растениями — на протяжении сотен миллионов лет.
Это естественный процесс для многих и многих видов, а также процесс, используемый или поощряемый садоводами и фермерами для получения большого количества экономически ценных растений. В этом отношении это форма клонирования, которая осуществляется человечеством на протяжении тысячелетий, а растениями — на протяжении сотен миллионов лет.
Половое размножение и цветок
Цветок — репродуктивный орган растений, относящихся к покрытосеменным. Все растения имеют средства и соответствующие структуры для полового размножения. Основная функция цветка – производить семена путем полового размножения. Семена — это следующее поколение, которое у большинства растений служит основным способом распространения особей этого вида по ландшафту. Фактическое распространение у большинства видов является функцией плода (структурной части, которая обычно окружает семя).
Рисунок \(\PageIndex{1}\): Растения и половое размножение. Растения, размножающиеся половым путем, часто достигают оплодотворения с помощью опылителей, таких как (а) пчелы, (б) птицы и (в) бабочки.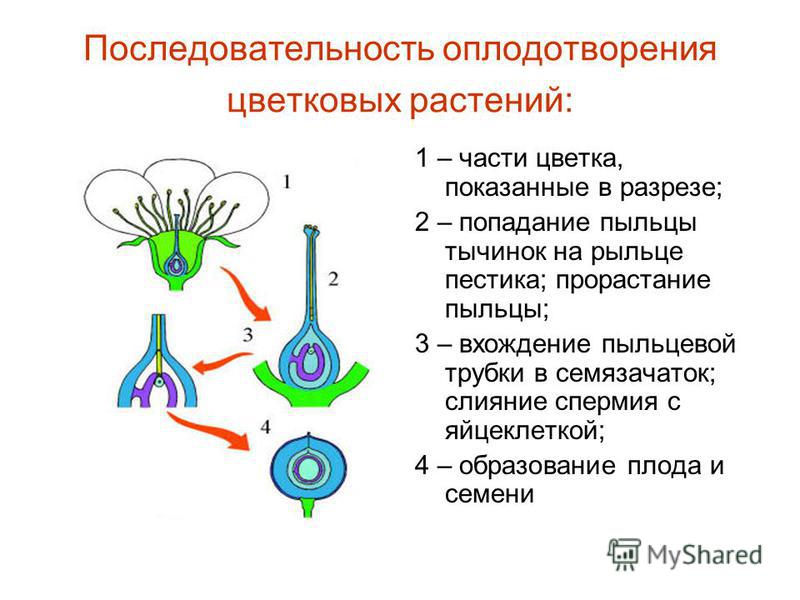
Key Points
- Вегетативное размножение — это тип бесполого размножения, в результате которого появляются новые особи растений без образования семян или спор.
- Вегетативное размножение также используется садоводами для производства большого количества ценных растений.
- Растения имеют цветки, дающие семена путем полового размножения; семена рассеиваются, чтобы увеличить распространение следующего поколения.
- Семена часто рассеиваются животными при проглатывании плодов, которые окружают семена, способствуя их распространению.
Ключевые термины
- вегетативное размножение : форма бесполого размножения у растений
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Безграничный
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги

Репродукция растений: Короче говоря
- Джон Р Паннелл,
- Гийом Коссар,
- Университет Лозанны, Швейцария;
Подавляющее большинство цветковых растений являются гермафродитами, в каждом цветке которых есть как мужские, так и женские части (Renner, 2014). Эта стратегия явно успешна и имеет несколько преимуществ, в том числе то, что, производя как пыльцу, так и семяпочки, каждый цветок имеет больше возможностей передать гены следующему поколению (Charnov et al., 19).76). Хотя гермафродиты также могут извлечь выгоду из возможности самооплодотворения (и многие из них делают это), большинство гермафродитов делают все возможное, чтобы избежать «самоопыления», потому что это часто наносит ущерб приспособленности растения (Charlesworth and Willis, 2009; Barrett, 2002).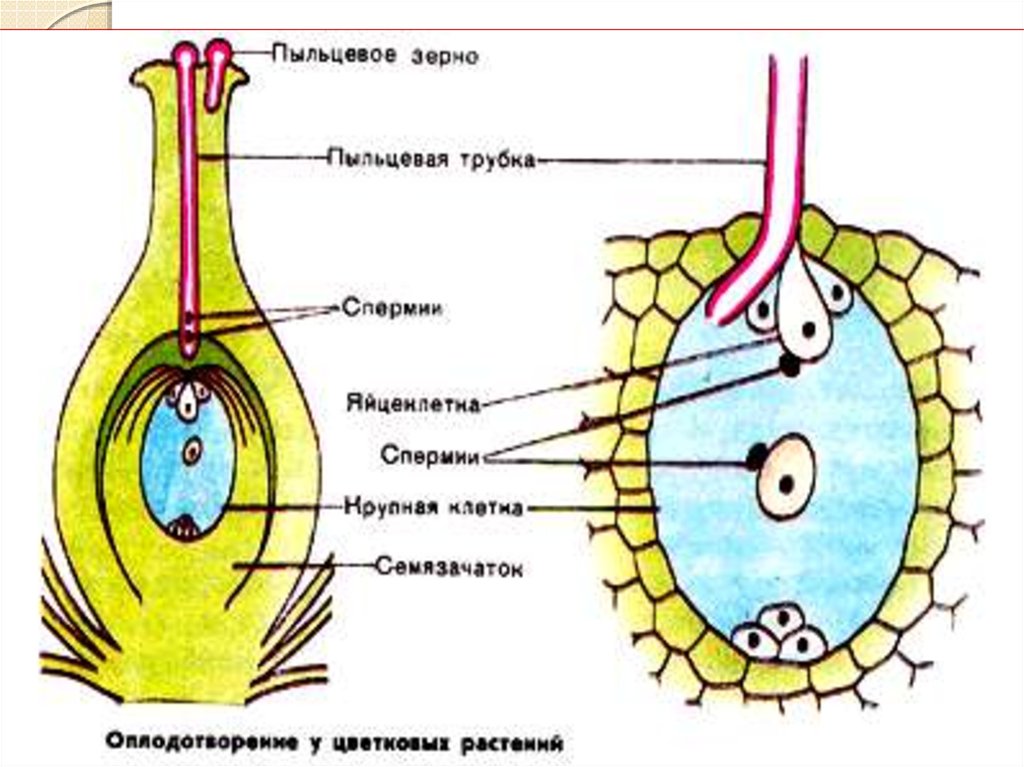 Таким образом, у гермафродитных растений развился замечательный набор механизмов, которые помогают им способствовать ауткроссингу.
Таким образом, у гермафродитных растений развился замечательный набор механизмов, которые помогают им способствовать ауткроссингу.
Один из этих механизмов, известный как гетеростилия, заключается в том, что мужские и женские части цветка (тычинки и рыльца) находятся в разных местах в разных цветках. Рыльце находится на конце стебля, называемого стилем. Некоторые цветы имеют длинные столбики и держат свои тычинки, производящие пыльцу, глубоко в цветочной трубке, в то время как другие имеют короткие столбики и держат свои тычинки намного выше в цветочной трубке (рис. 1А). Это означает, что пыльца растения с длинным столбиком с большей вероятностью опылит цветок с коротким столбиком, и наоборот. Растения с длинным и коротким столбиком также могут различаться по размеру и цвету их пыльцевых зерен и текстуре их рыльца, а ауткроссинг возможен только между разными морфами (Barrett, 2002). Примечательно, что, несмотря на свою сложность, гетеростилия неоднократно развивалась у цветковых растений и обнаружена по крайней мере в 30 семействах, включая первоцветы (род 9).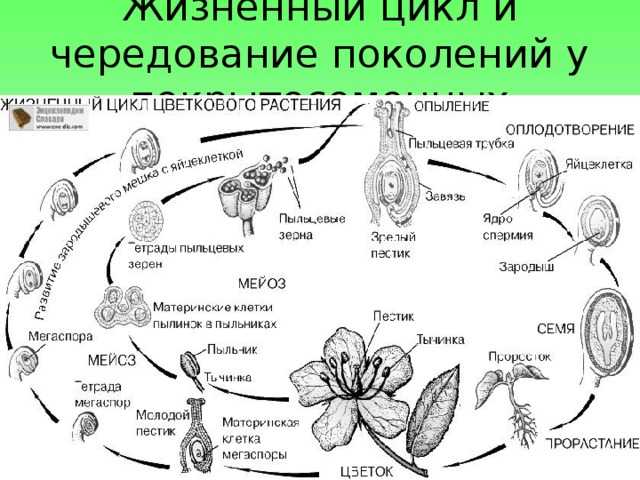 0155 Примула ).
0155 Примула ).
Гетеростилия у первоцветов.
( A ) Схематические изображения длинностолбчатого (слева) и короткостолбчатого цветка (справа) двуцветных видов, таких как Primula vulgaris . Когда насекомое проникает в цветок с длинным столбиком, оно собирает пыльцу в основном на головке. Если это насекомое затем посетит цветок с коротким столбиком, рыльце соберет пыльцу с головы насекомого. Между тем, высокие тычинки осаждали свежую пыльцу на брюшке насекомого для эффективного переноса на рыльца цветков с длинным столбиком. ( B ) Huu et al. идентифицировали CYP730A50 как дуплицированный ген, который изменяет длину столбика у цветков Primula . Цветки без CYP730A50 (слева) вырабатывают брассиностероиды, которые заставляют клетки столбика удлиняться и образовывать длинный столбик. С другой стороны, цветы с этим геном (справа) в S-локусе подавляют выработку брассиностероидов, что приводит к короткому столбику.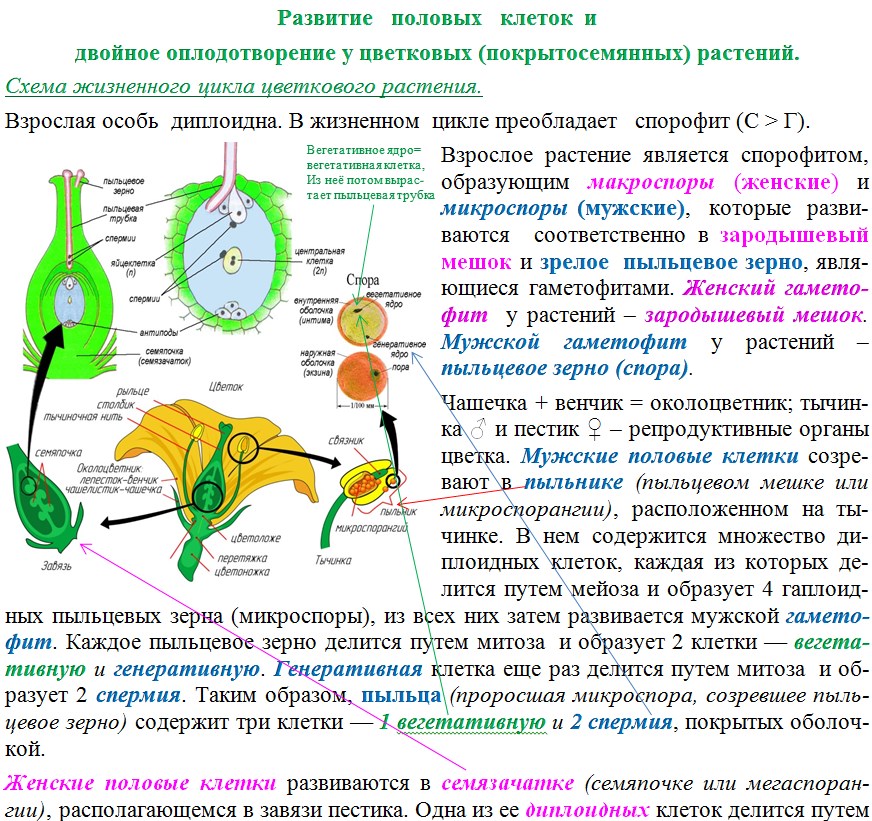
Чарльз Дарвин был очарован гетеростилией (Darwin, 1877), и теперь мы знаем, что она вызывается экспрессией нескольких генов, которые наследуются вместе как единая генетическая единица (локус). Однако выяснение того, как эти гены влияют на развитие цветов, было чем-то вроде святого Грааля в этой области. Теперь в eLife Майкл Ленхард из Потсдамского университета и его коллеги, в том числе Куонг Нгуен Хуу в качестве первого автора, идентифицировали ген, отвечающий за различную длину столбиков у первоцветов, и показали, как он работает (Huu et al., 2016).
Хуу и др. обнаружили, что ген, названный CYP734A50, присутствует только в цветках с коротким столбиком у нескольких видов примулы, и оценки охвата считывания транскриптов предполагают, что в этих цветках присутствует только одна копия гена. CYP734A50 кодирует фермент, расщепляющий растительные гормоны, называемые брассиностероидами, которые, как известно, способствуют удлинению клеток (Ohnishi et al.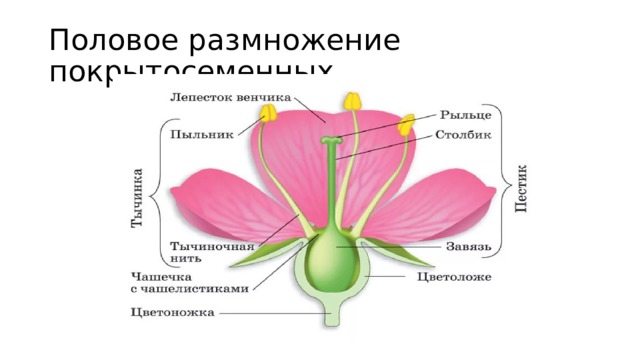 , 2006). Хуу и др. обнаружили, что определенный брассиностероид, кастастерон, присутствует в более высоких уровнях в длинных стилях, чем в коротких, и что лечение коротких стилей другим брассиностероидом увеличивает длину стиля (рис. 1B). Более того, индуцированное вирусом молчание CYP734A50 у молодых растений с короткими стеблями приводило к образованию цветков с более длинными стеблями.
, 2006). Хуу и др. обнаружили, что определенный брассиностероид, кастастерон, присутствует в более высоких уровнях в длинных стилях, чем в коротких, и что лечение коротких стилей другим брассиностероидом увеличивает длину стиля (рис. 1B). Более того, индуцированное вирусом молчание CYP734A50 у молодых растений с короткими стеблями приводило к образованию цветков с более длинными стеблями.
Долгое время считалось, основываясь на теоретических рассуждениях и сравнительном анализе, что первой мутацией в эволюции гетеростилии была мутация, уменьшающая длину стиля, и что экспрессия этого мутировавшего гена должна доминировать над экспрессией его гомологичного гена в локусе длины стиля (Lloyd and Webb, 1992a; 1992b). Результаты Huu et al. согласуются с идеей о том, что экспрессия гена CYP734A50 у короткошерстных особей является генетически доминирующей. Но как возникло это превосходство?
Хуу и др. показывают, что CYP734A50 является результатом дупликации гена, который более широко расщепляет брассиностероиды.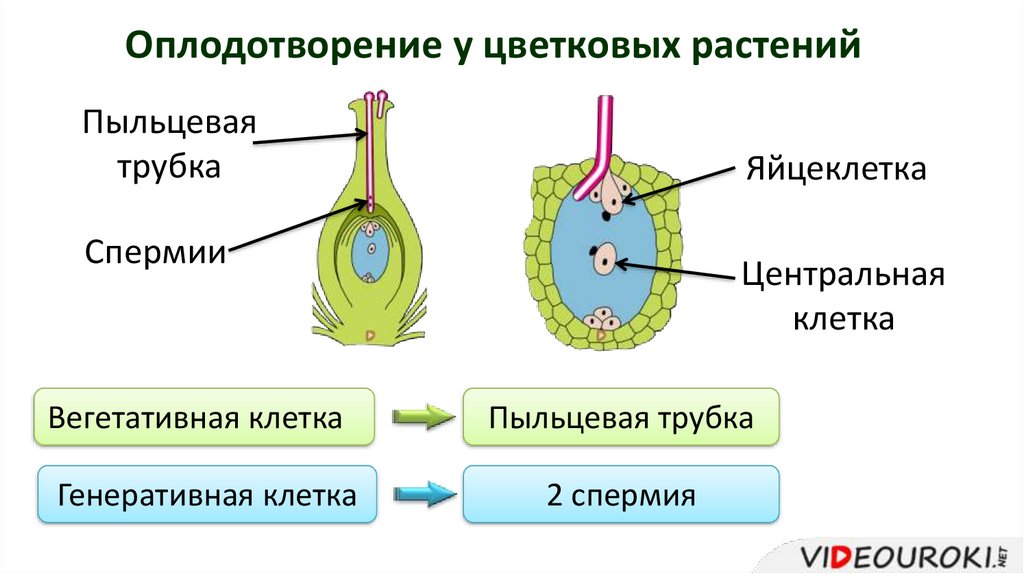 Событие дублирования произошло в начале эволюции рода Primula , и затем дублированная копия эволюционировала, чтобы выражаться только в стилях. Наличие или отсутствие дупликации поддерживается в этом роде с помощью процесса, называемого отрицательным частотно-зависимым отбором, при котором приспособленность признака (например, короткие стили) увеличивается, если он становится редким, что предотвращает его потерю.
Событие дублирования произошло в начале эволюции рода Primula , и затем дублированная копия эволюционировала, чтобы выражаться только в стилях. Наличие или отсутствие дупликации поддерживается в этом роде с помощью процесса, называемого отрицательным частотно-зависимым отбором, при котором приспособленность признака (например, короткие стили) увеличивается, если он становится редким, что предотвращает его потерю.
В своей краткой автобиографии Дарвин отразил, что «я не думаю, что что-либо в моей научной жизни доставляло мне столько удовольствия, как выяснение значения строения разноцветных цветков». Как и большая часть его работ, выдвинутая им гипотеза выдержала испытание временем и остается предпочтительным объяснением того, как и почему развилась гетеростилия (Barrett, 2002). Идентифицировав ген, контролирующий длину стиля, работа Huu et al. является важным шагом на пути к пониманию механизмов, лежащих в основе гетеростилии. Будущая задача состоит в том, чтобы понять эволюционную историю других генов, участвующих в гетеростилии, и выяснить, какую роль они играют в развитии цветка.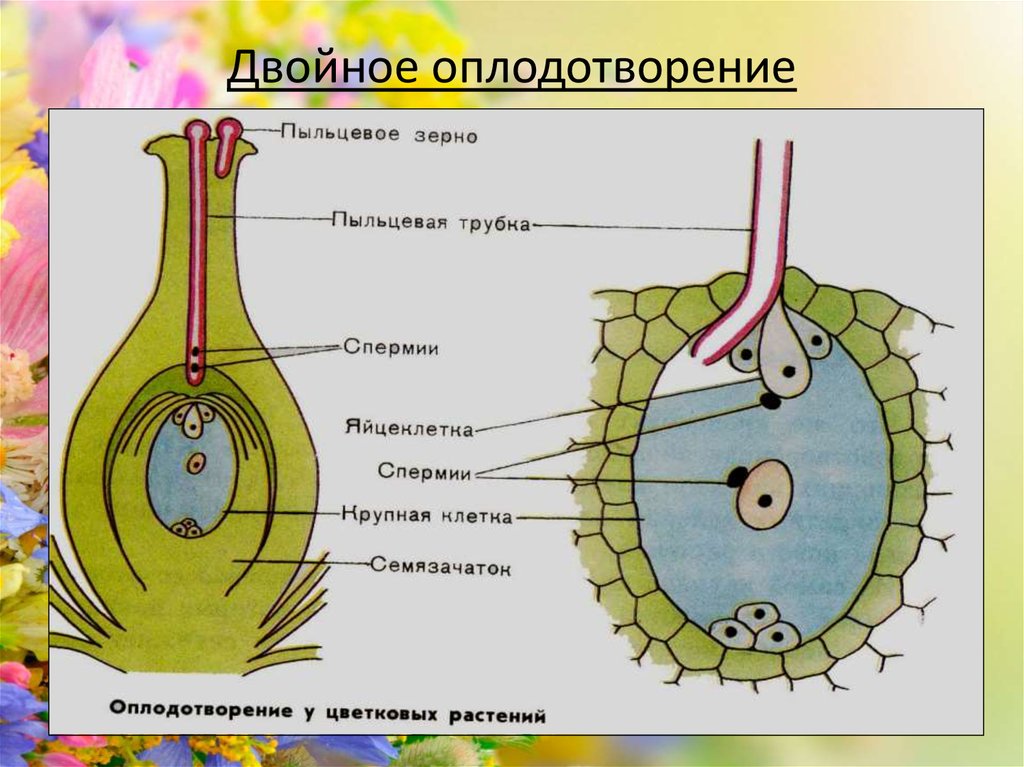
Ссылки
- Барретт СК
(2002)
Половое вмешательство цветочного типа
Наследственность 88 :154–159.
https://doi.org/10.1038/sj.hdy.6800020
- Google ученый
- Чарльзворт Д
- Уиллис JH
(2009)
Генетика депрессии инбридинга
Nature Reviews Genetics 10 :783–796.
https://doi.org/10.1038/nrg2664
- Google ученый
- Чарнов Э.
 Л.
Л. - Смит JM
- Бык JJ
(1976)
Зачем быть гермафродитом?
Природа 263 :125–126.
https://doi.org/10.1038/263125a0
- Google ученый
- Чарнов Э.
Книга
- Дарвин С
(1877)
Различные формы цветов на растениях одного и того же вида
Нью-Йорк: Эпплтон.
https://doi.org/10.5962/bhl.title.46988
- Google ученый
- Хуу CN
- Каппель С
- Келлер Б
- Сикард А
- Такебаяси Ю,
- Бройнингер Х,
- Новак MD,
- Берле I,
- Химмельбах А,
- Буркарт М,
- Эббинг-Лохаус Т,
- Сакакибара Х,
- Альтшмид Л,
- Конти Э,
- Ленхард М
(2016)
Наличие или отсутствие CYP734A50 лежит в основе диморфизма длины столбика у первоцветов
eLife 5 :17956.

https://doi.org/10.7554/eLife.17956
- Google ученый
Книга
- Ллойд ДГ
- Уэбб CJ
(1992а)
Эволюция гетеростилии
В: Barrett SCH, редакторы. Эволюция и функция гетеростилии . Берлин: Springer Verlag. стр. 151–178.
https://doi.org/10.1007/978-3-642-86656-2_6
- Google ученый
Книга
- Ллойд ДГ
- Уэбб CJ
(1992б)
Выбор гетеростилии
В: Barrett SCH, редакторы.
 Эволюция и функция гетеростилии . Берлин: Springer Verlag. стр. 179–207.
Эволюция и функция гетеростилии . Берлин: Springer Verlag. стр. 179–207.https://doi.org/10.1007/978-3-642-86656-2_7
- Google ученый
- Ониши Т
- Сатмари AM
- Ватанабэ Б
- Фуджита С
- Банкос S
- Конч С
- Лафос М
- Шибата К
- Ёкота Т
- Саката К
- Секереш М
- Мизутани М
(2006)
Гидроксилирование C-23 с помощью Arabidopsis CYP90C1 и CYP90D1 открывает новый путь биосинтеза брассиностероидов
The Plant Cell 18 :3275–3288.

https://doi.org/10.1105/tpc.106.045443
- Google ученый
- Реннер СС
(2014)
Относительная и абсолютная частота половых систем покрытосеменных растений: двудомность, однодомность, гинодиеция и обновленная онлайн-база данных
American Journal of Botany 101 :1588–1596.
https://doi.org/10.3732/ajb.1400196
- Google ученый
Статья и информация об авторе
Сведения об авторе
John R Pannell
Кафедра экологии и эволюции, Лозаннский университет, Лозанна, Швейцария
Для корреспонденции
Джон.
 Паннелл@unil.ch
Паннелл@unil.chКонкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Гийом Коссар
Кафедра экологии и эволюции, Лозаннский университет, Лозанна, Швейцария
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
«Этот ORCID iD идентифицирует автора этой статьи:»
0000-0003-4633-5159
История публикаций
- Версия записи опубликована: 6 сентября 2016 г. (версия 1)
- Версия записи обновлена: 7 сентября 2016 г. (версия 2)
Авторское право
© 2016, Pannell et al.
Эта статья распространяется в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование и распространение при условии указания оригинального автора и источника.
Метрики
Число цитирований статей, полученное путем опроса самых высоких значений из следующих источников: Crossref, PubMed Central, Scopus.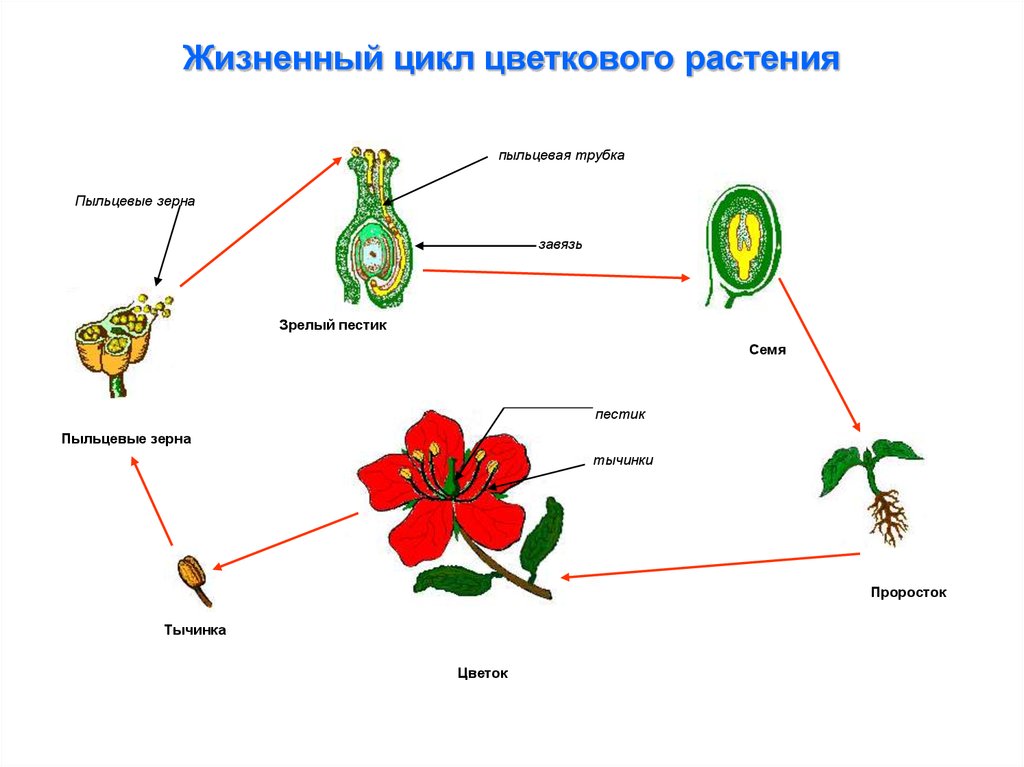
Ссылки для скачивания
Список ссылок, состоящий из двух частей, для загрузки статьи или частей статьи в различных форматах.
Загрузка (ссылка для загрузки статьи в формате PDF)
- Статья PDF
Открытые цитаты (ссылки для открытия цитат из этой статьи в различных онлайн-сервисах управления ссылками)
- Менделей
- ЧитатьКуб»>
Процитируйте эту статью (ссылки для загрузки цитат из этой статьи в форматах, совместимых с различными инструментами управления ссылками)
- Джон Р Паннелл
- Гийом Коссар
(2016)
Репродукция растений: короче говоря
eLife 5 :e20314.
https://doi.org/10.7554/eLife.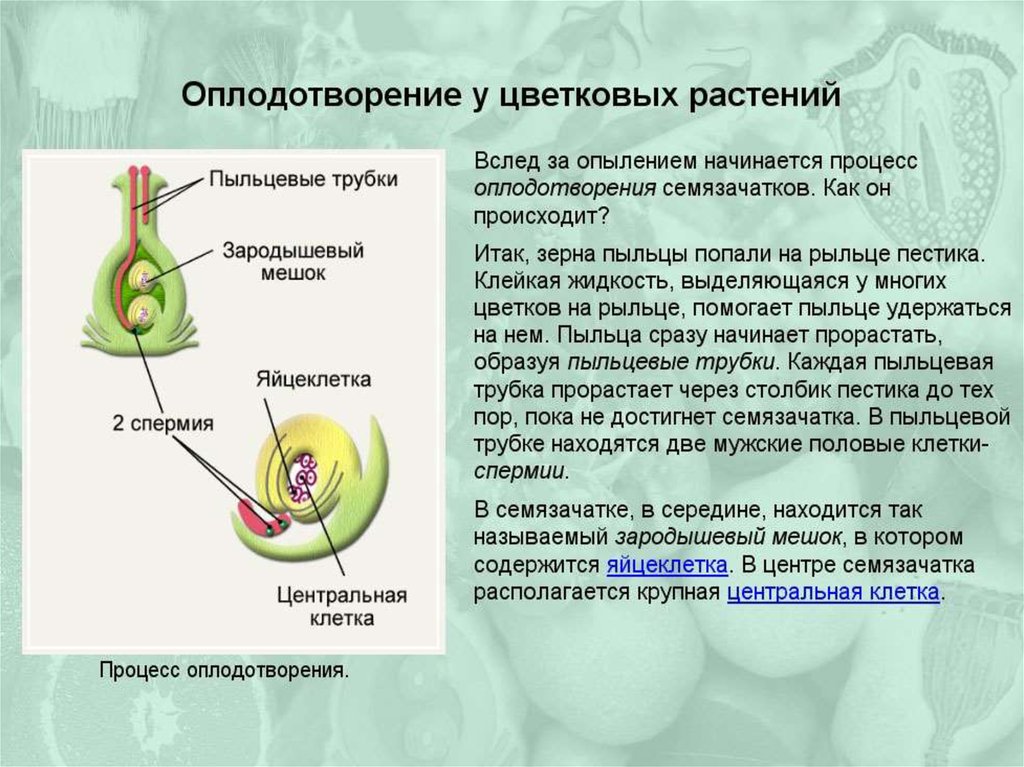


 В.Л. Комарова РАН.
В.Л. Комарова РАН.
 6-й конкурс экспертиза научных проектов молодых ученых РАН, проект «Репродуктивная биология некоторых редких и охраняемых растений России и разработка биотехнологических приемов их размножения».
6-й конкурс экспертиза научных проектов молодых ученых РАН, проект «Репродуктивная биология некоторых редких и охраняемых растений России и разработка биотехнологических приемов их размножения». calceolus. Доказано, что особи C. x ventricosum — это гибриды C. calceolus × C. macranthon. Показано отсутствие гибридизации между C. shanxiense и C. calceolus и C. shanxiense и C. macranthon в местах их совместного произрастания. Высказано предположение о гибридогенном происхождении C. shanxiense и «восточной» расы C. calceolus. Установлены ранее неизвестные таксон специфичные аллели для редких представителей рода Dactylorhiza (D. Salina и D. Ochroleuca). Впервые проведено исследование качества семян и жизнеспособности потомства у Orchis purpurea Huds. ssp. caucasica. На основании проведенного цитоэмбриологического исследования семян на разных стадиях их развития была выявлена причина снижения их качества к моменту диссеминации – генетические нарушения нормального хода эмбрионального развития.
calceolus. Доказано, что особи C. x ventricosum — это гибриды C. calceolus × C. macranthon. Показано отсутствие гибридизации между C. shanxiense и C. calceolus и C. shanxiense и C. macranthon в местах их совместного произрастания. Высказано предположение о гибридогенном происхождении C. shanxiense и «восточной» расы C. calceolus. Установлены ранее неизвестные таксон специфичные аллели для редких представителей рода Dactylorhiza (D. Salina и D. Ochroleuca). Впервые проведено исследование качества семян и жизнеспособности потомства у Orchis purpurea Huds. ssp. caucasica. На основании проведенного цитоэмбриологического исследования семян на разных стадиях их развития была выявлена причина снижения их качества к моменту диссеминации – генетические нарушения нормального хода эмбрионального развития. Член оргкомитета.
Член оргкомитета.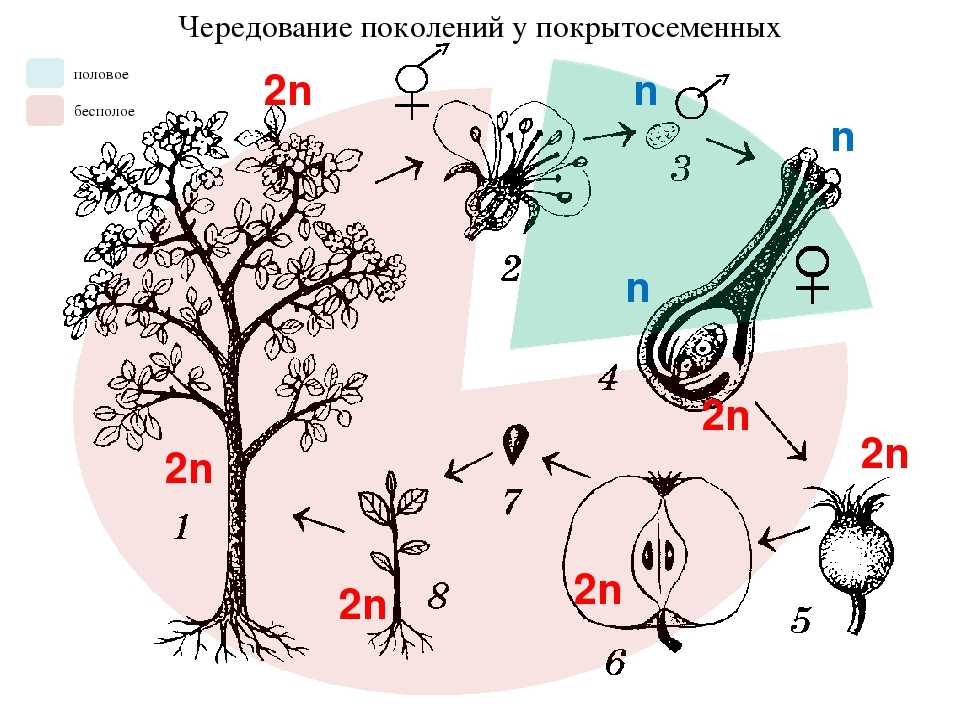
 calceolus, C. shanxiense, C. ventricosum, Orchis militaris, Dactylorhiza fuchsii, D. incarnata, D. cruenta, D. Salina.
calceolus, C. shanxiense, C. ventricosum, Orchis militaris, Dactylorhiza fuchsii, D. incarnata, D. cruenta, D. Salina. I., Syrova V.V., Salokhin A.V., Markelov I.N., Andronova E.V., Ganyushkina E.V. Conservation issues and infraspecific polymorphism of Cypripedium guttatum on selected locations in Russia. Nature Conservation Research. 2020. 5(1): 145–154.
I., Syrova V.V., Salokhin A.V., Markelov I.N., Andronova E.V., Ganyushkina E.V. Conservation issues and infraspecific polymorphism of Cypripedium guttatum on selected locations in Russia. Nature Conservation Research. 2020. 5(1): 145–154.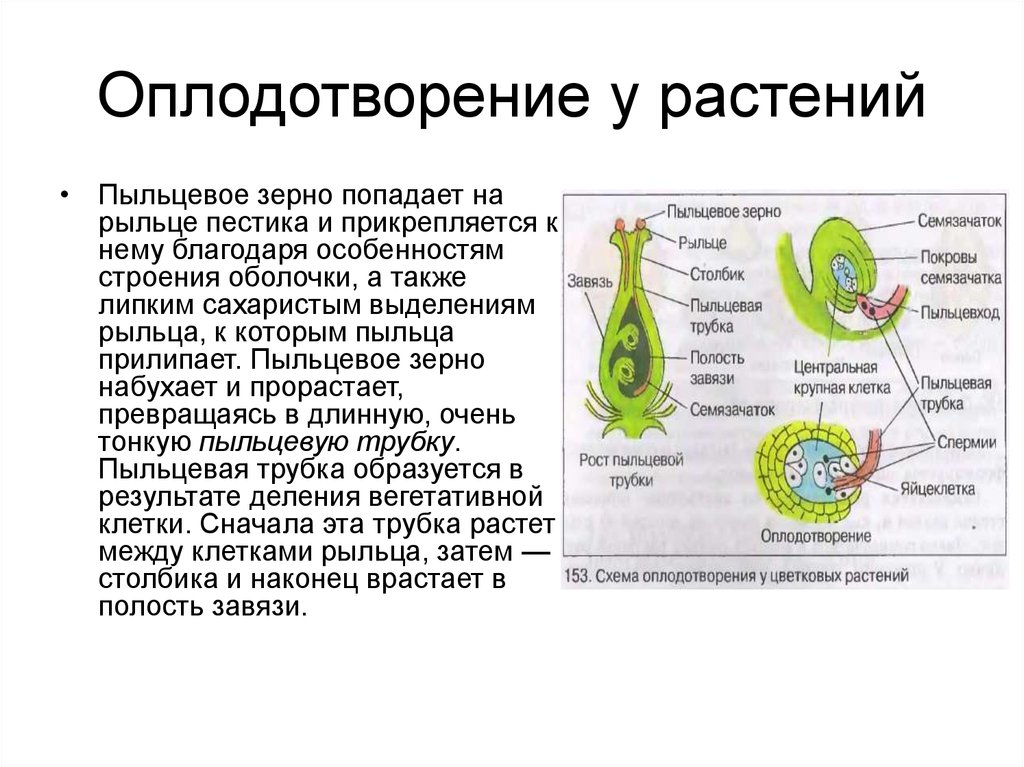 2019. 8(2): 19-24.
2019. 8(2): 19-24. Г., Райко М.П., Ли Янг-Ай, Аверьянов Л. В. Филогеография таксонов рода Cypripedium (Orchidaceae) на территории России. Ботанический журнал. 2017. 102(8): 1027–1059.
Г., Райко М.П., Ли Янг-Ай, Аверьянов Л. В. Филогеография таксонов рода Cypripedium (Orchidaceae) на территории России. Ботанический журнал. 2017. 102(8): 1027–1059. V. Morpho-histological analysis of direct shoot organogenesis induced in flower buds cultures of Allium altissimum. American Journal of Plant Sciences. 2014. 5(13): 2015-2022.
V. Morpho-histological analysis of direct shoot organogenesis induced in flower buds cultures of Allium altissimum. American Journal of Plant Sciences. 2014. 5(13): 2015-2022.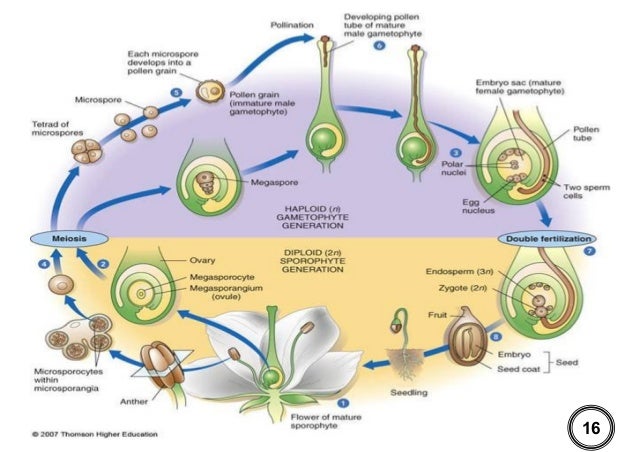 5: 97-107.
5: 97-107.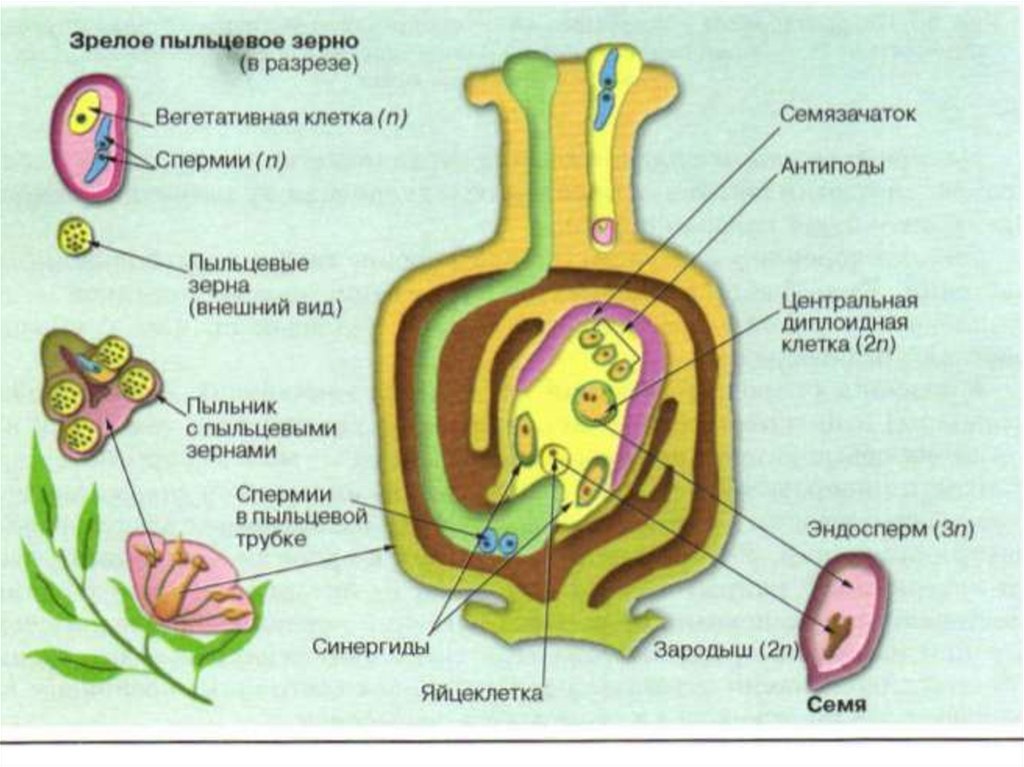 l. (Orchidaceae) после пересадки из культуры in vitro в природные условия. Вестник ТвГУ. серия Биология и Экология. 2007. 7(35): 11-16.
l. (Orchidaceae) после пересадки из культуры in vitro в природные условия. Вестник ТвГУ. серия Биология и Экология. 2007. 7(35): 11-16.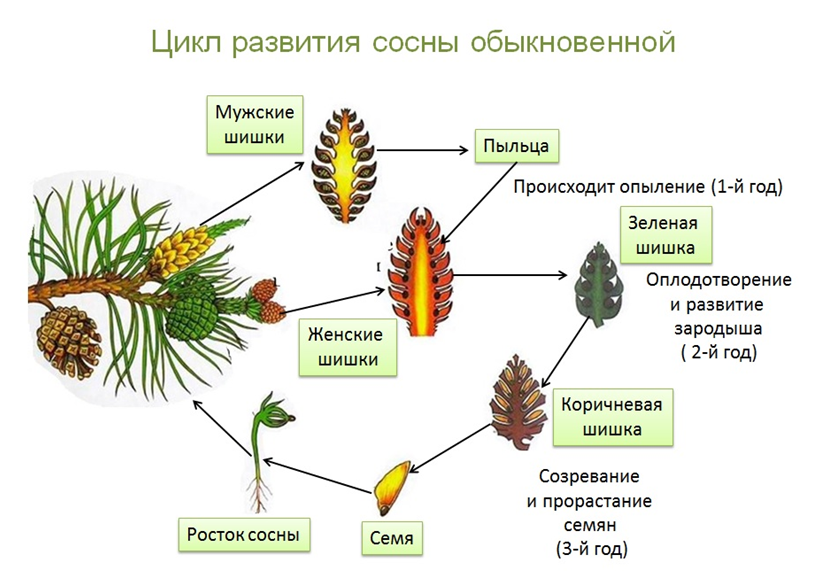 Вестник ТвГУ, Серия Биология и Экология. 2007. 7(35): 17-19.
Вестник ТвГУ, Серия Биология и Экология. 2007. 7(35): 17-19.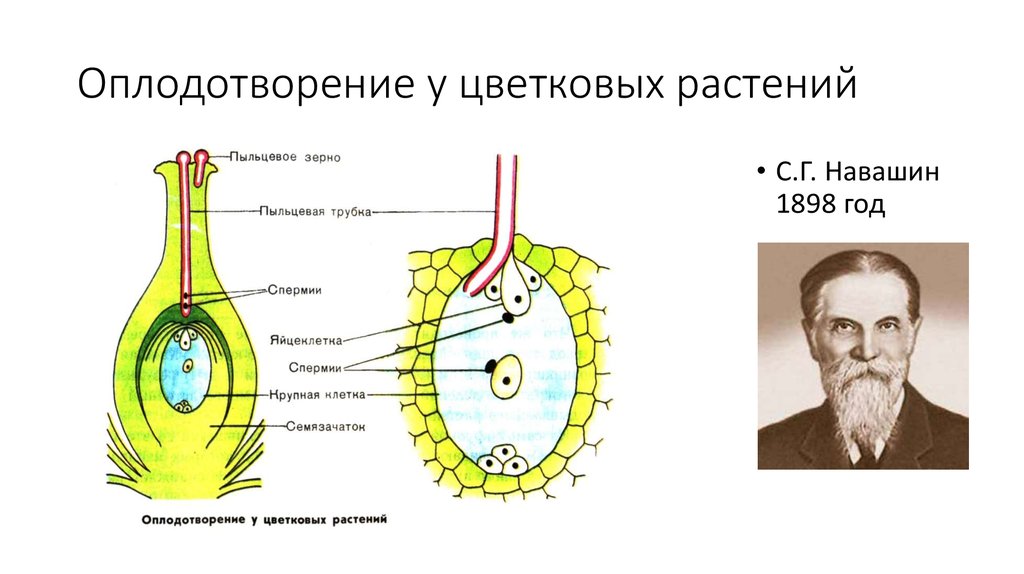 VIII. (Eds.: J.Arditti and T. Kull). Dordrecht, Boston, London: Kluwer Academic Publishers. 2002: 167-234.
VIII. (Eds.: J.Arditti and T. Kull). Dordrecht, Boston, London: Kluwer Academic Publishers. 2002: 167-234.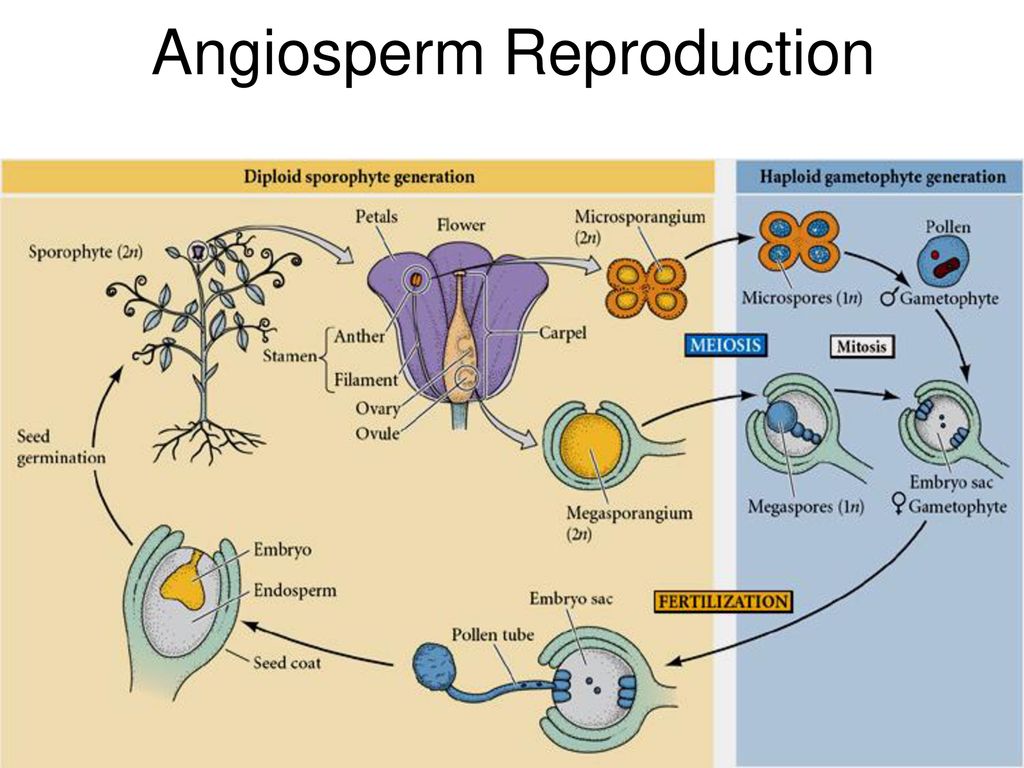 Терминология и концепции, Т.3. Системы репродукции. (ред. Т.Б. Батыгина). СПб, Мир и семья. 2000: 329-334.
Терминология и концепции, Т.3. Системы репродукции. (ред. Т.Б. Батыгина). СПб, Мир и семья. 2000: 329-334.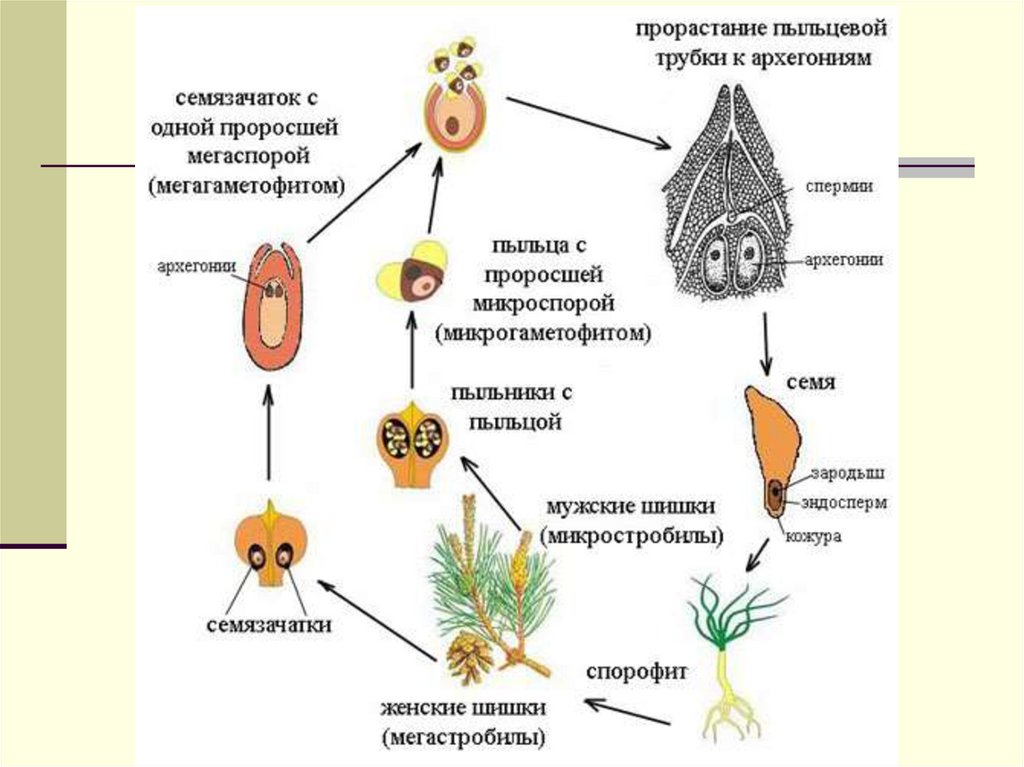 Corp. 1991: 369-374.
Corp. 1991: 369-374.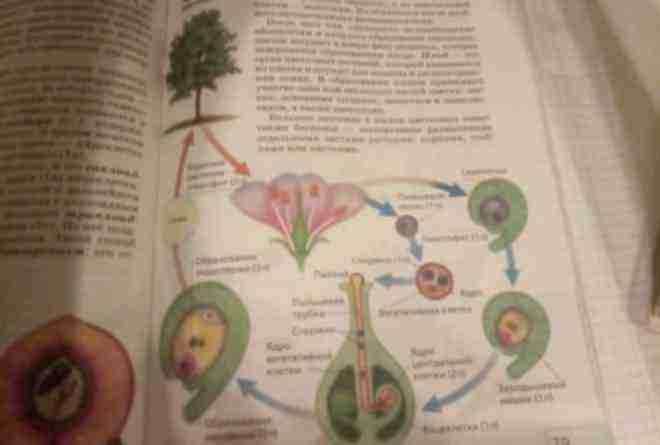
 Л.
Л.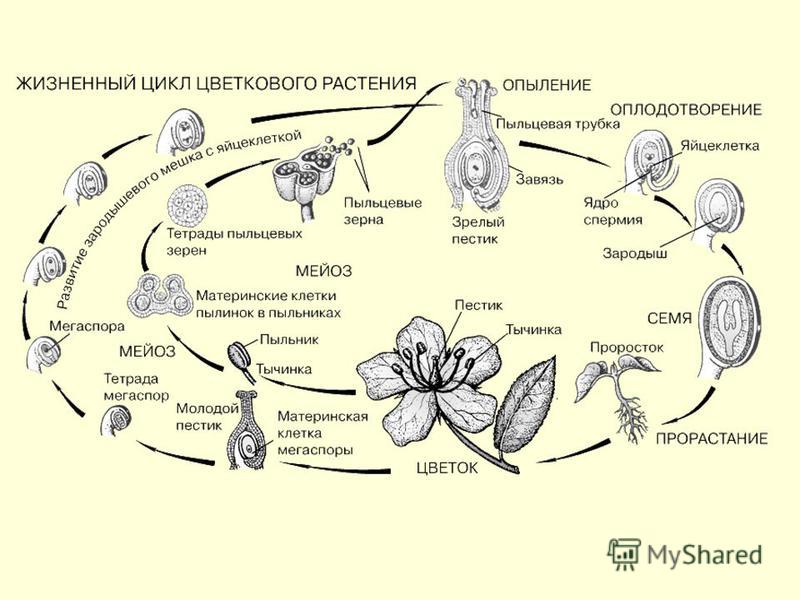
 Эволюция и функция гетеростилии . Берлин: Springer Verlag. стр. 179–207.
Эволюция и функция гетеростилии . Берлин: Springer Verlag. стр. 179–207.
 Паннелл@unil.ch
Паннелл@unil.ch