Содержание
Молекулярно-генетические механизмы формирования окраски плодов и семян растений | Аджиева
1. Алехина Н.Д., Балнокин Ю.В., Гавриленко В.Ф. Каротиноиды. Физиология растений. Под ред. И.П. Ермакова. М.: Академия, 2005.
2. Гордеева Е.И., Хлесткина Е.К. Взаимосвязь между накоплением антоцианов в перикарпе зерна пшеницы и реакцией на искусственное старение семян. Матер. науч.-практ. конф. «Свободные радикалы и антиоксиданты в химии, биологии и медицине». 1–4 октября 2013 г. Новосибирск.
3. Ершов Ю.В. Метилэритритолфосфатный (немевалонатный) путь биосинтеза каротиноидов. Усп. биол. химии. 2005;45:307-354.
4. Запрометов М.Н. Основы биохимии фенольных соединений. М.: Выс. шк., 1974.
5. Кильчевский А.В., Бабак О.Г., Аджиева В.Ф., Некрашевич Н.А., Малышев С.В., Грушецкая З.Ф., Мишин Л.А., Добродькин М.М., Зайцева И.Е., Пугачева И.Г. Молекулярные технологии в селекции томата (Solanum lycopersicum L.). Генетические основы селекции растений. Т. 4. Минск, 2014.
6. Стржалка К., Кострецка-Гугала А., Латовски Д. Каротиноиды растений и стрессовое воздействие окружающей среды: роль модуляции физических свойств мембран каротиноидами. Физиол. растений. 2003;50(2):188-193.
Стржалка К., Кострецка-Гугала А., Латовски Д. Каротиноиды растений и стрессовое воздействие окружающей среды: роль модуляции физических свойств мембран каротиноидами. Физиол. растений. 2003;50(2):188-193.
7. Хлесткина Е.К., Шоева О.Ю., Гордеева Е.И. Гены биосинтеза флавоноидов пшеницы. Вавиловский журнал генетики и селекции. 2014;18(4/1):784-796.
8. Akhtar M.S., Goldschmidt E.E., John I., Rodoni S., Matile P., Grierson. Altered patterns of senescence and ripening in gf, a staygreen mutant of tomato (Lycopersicon esculentum Mill.). J. Exp. Bot. 1999;50(336):1115-1122.
9. Al-Babili S., Beyer P. Golden rice – five years on the road – five years to go? Trends in Plant Sci. 2005;10:565-573.
10. Ashraf N., Jain D., Vishwakarma R.A. Identification, cloning and characterization of an ultrapetala transcription factor CsULT1 fromCrocus: a novel regulator of apocarotenoid biosynthesis. BMC Plant Biology. 2015;15(25):1-12.
11. Barry C., McQuinn R., Chung M., Besuden A. , Giovannoni J.J. Amino acid substitutions in homologs of the STAY-GREEN protein are responsible for the green-flesh and chlorophyll retainer mutations of tomato and pepper. Plant Physiol. 2008;147:179-187.
, Giovannoni J.J. Amino acid substitutions in homologs of the STAY-GREEN protein are responsible for the green-flesh and chlorophyll retainer mutations of tomato and pepper. Plant Physiol. 2008;147:179-187.
12. Barry C.S. The stay-green revolution: Recent progress in deciphering the mechanisms of chlorophyll degradation in higher plants. Plant Sci. 2009;176:325-333.
13. Bernhardt C., Lee M.M., Gonzalez A., Zhang F., Lloyd A., Schiefelbein J. The bHLH genes GLABRA3 (GL3) and ENHANCER OF GLABRA3 (EGL3) specify epidermal cell fate in the Arabidopsis root. Development. 2003;130:6431-6439.
14. Borevitz J.O., Xia Y., Blount J., Dixon R.A., Lamb C. Activation tagging identified a conserved MYB regulator of phenylpropanoid biosynthesis. Plant Cell. 2000;12:2383-2393.
15. Boss P.K., Davies C., Robinson S.P. Expression of anthocyanin biosynthesis genes in red and white grapes. Plant Mol. Biol. 1996;32: 565-569.
16. Bramley P.M. Regulation of carotenoid formation during tomato fruit ripening and development.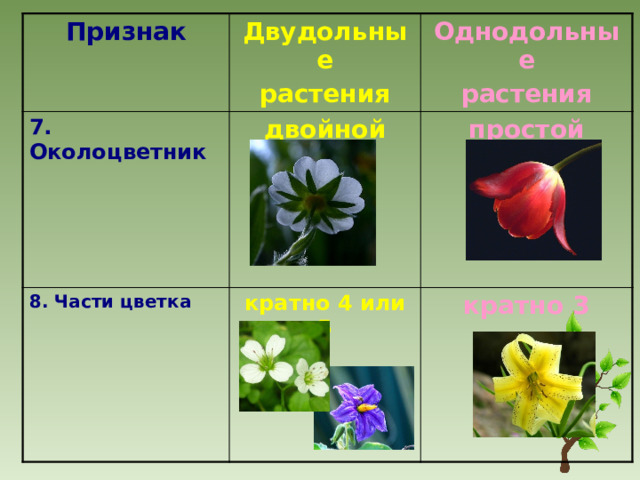 J. Exp. Bot. 2002;53(377):2107-2113.
J. Exp. Bot. 2002;53(377):2107-2113.
17. Britton G. The Biochemistry of Natural Pigments. Cambridge: Cambridge Univ. Press, 1983.
18. Burr F.A., Burr B., Scheffler B.E., Blewitt M., Wienand U., Matz E.C. The maize repressor-like gene intensifierl shares homology with the rVb7 multigene family of transcription factors and exhibits missplicing. Plant Cell. 1996;8:1249-1259.
19. Caspi N., Levin I., Chamovitz D.A., Reuveni M. A mutation in the tomato DDB1 gene affects cell and chloroplast compartment size and CDT1 transcript. Plant Signal Behavior. 2008;3(9):641-649.
20. Cazzonelli C.I., Pogson B.J. Source to sink: regulation of carotenoid biosynthesis in plants. Trends Plant Sci. 2010;15(5):266-274.
21. Cha K.W., Lee Y.J., Koh H.J., Lee B.M., Nam Y.M., Paek N.C. Isolation, characterization, and mapping of the stay green mutant in rice. Theor. Appl. Genet. 2002;104:526-532.
22. Chandler V.L., Radicella J.P., Robbins T.P., Chen J., Turks D. Two regulatory genes of the maize anthocyanin pathway are homologous: isolation of B utilizing R genomic sequences.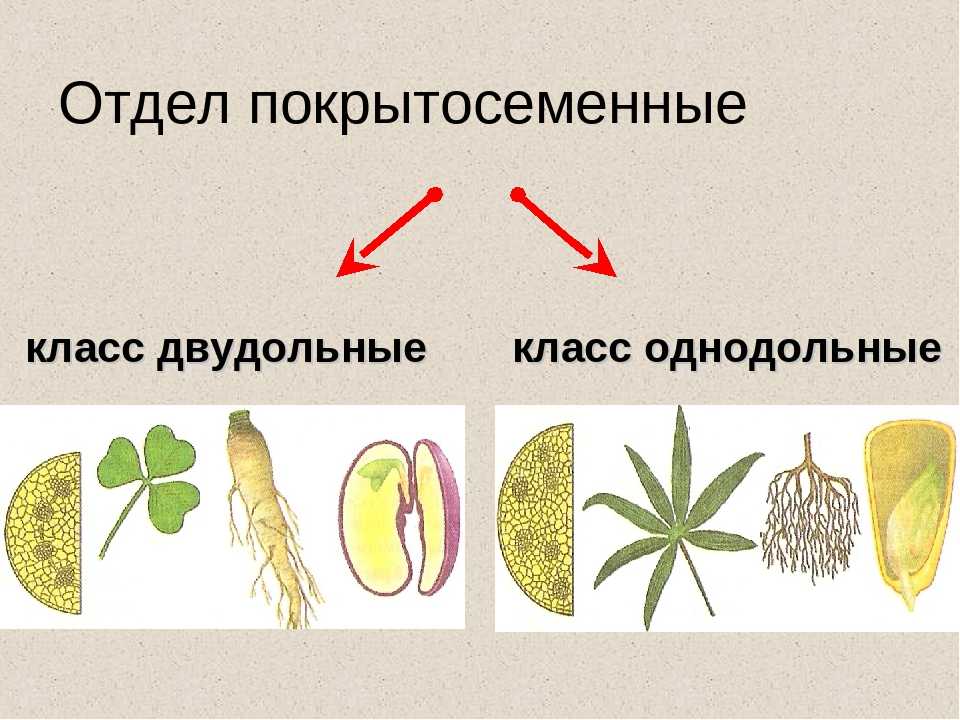 Plant Cell. 1989;1: 1175-1183.
Plant Cell. 1989;1: 1175-1183.
23. Chung M.Y., Vrebalov J., Alba R., Lee J., McQuinn R., Chung J.D., Klein P., Giovannoni J. A tomato (Solanum lycopersicum) APETALA2/ERF gene (SIAP2a), is a negative regulator of fruit ripening. Plant J. 2010;64:936-947.
24. Clegg M.T., Durbin M.L. Flower color variation: A model for the experimental study of evolution. Proc. Natl Acad. Sci. USA. 2000;97: 7016-7023.
25. Cockram J., White J., Zuluaga D.L., Smith D., Comadran J., Macaulay M., Luo Z., Kearsey M.J., Werner P., Harrap D., Tapsell C., Liu H., Hedley P.E., Stein N., Schulte D., Steuernagel B., Marshall D.F., Thomas W.T.B., Ramsay L., Mackay I., Balding D.J., The AGOUEB Consortium, Waugh R., O’Sullivan D.M. Genomewide association mapping to candidate polymorphism resolution in the unsequenced barley genome. Proc. Natl Acad. Sci. USA. 2010;107(50):21611-21616.
26. Cone K.C., Burr F.A., Burr B. Molecular analysis of the maize anthocyanin regulatory locus C1. Proc. Natl Acad. Sci. USA. 1986;83: 9631-9635.
Sci. USA. 1986;83: 9631-9635.
27. Consonni G., Geuna F., Gavazzi G., Tonelli C. Molecular homology among members of the R gene family in maize. Plant J. 1993;3: 335-346.
28. Cutanda-Perez M.C., Ageorges A., Gomez C., Vialet S., Terrier N., Romieu C., Torregrosa L. Ectopic expression of VlmybA1 in grapevine activates a narrow set of genes involved in anthocyanin synthesis and transport. Plant Mol. Biol. 2009;69:643-648.
29. de Vetten N., Quattrocchio F., Mol J., Koes R. The an11 locus controlling flower pigmentation in petunia encodes a novel WD-repeat protein conserved in yeast, plants and animals. Gene Dev. 1997;11:1422-1434.
30. Deluc L., Barrieu F., Marchive C., Lauvergeat V., Decendit A., Richard T., Carde J.P., Mérillon J.M., Hamdi S. Characterization of a grapevine R2R3-MYB transcription factor that regulates the phenylpropanoid pathway. Plant Physiol. 2006;140:499-511.
31. Deluc L., Bogs J., Walker A.R., Ferrier T., Decendit A., Mérillon J.M., Robinson S. P., Barrieu F. The transcription factor VvMYB5b contributes to the regulation of anthocyanin and proanthocyanidin biosynthesis in developing grape berries. Plant Physiol. 2008;147: 2041-2053.
P., Barrieu F. The transcription factor VvMYB5b contributes to the regulation of anthocyanin and proanthocyanidin biosynthesis in developing grape berries. Plant Physiol. 2008;147: 2041-2053.
32. Dobrovolskaya O.B., Arbuzova V.S., Lohwasser U., Röder M.S., Börner A. Microsatellite mapping of complementary genes for purple grain colour in bread wheat (Triticum aestivum L.). Euphytica. 2006;150:355-364.
33. Dooner H.K. Coordinate genetic regulation of flavonoid biosynthetic enzymes in maize. Mol. Gen. Genet. 1983;189:136-141.
34. Dubos C., Le Gourrierec J., Baudry A., Lanet E., Debeaujon I., Routaboul J.-M., Alboresi A., Weisshaar B., Lepiniec L. MYBL2 is a new regulator of flavonoid biosynthesis in Arabidopsis thaliana. Plant J. 2008;55:940-953.
35. Ferrandiz C., Liljegren S., Yanofsky M. FRUITFULL negatively regulates the SHATTERPROOF genes during Arabidopsis fruit development. Science. 2000;289:436-438.
36. Ferrandiz C., Pelaz S., Yanofsky M.F.Control of carpel and fruit development in Arabidopsis.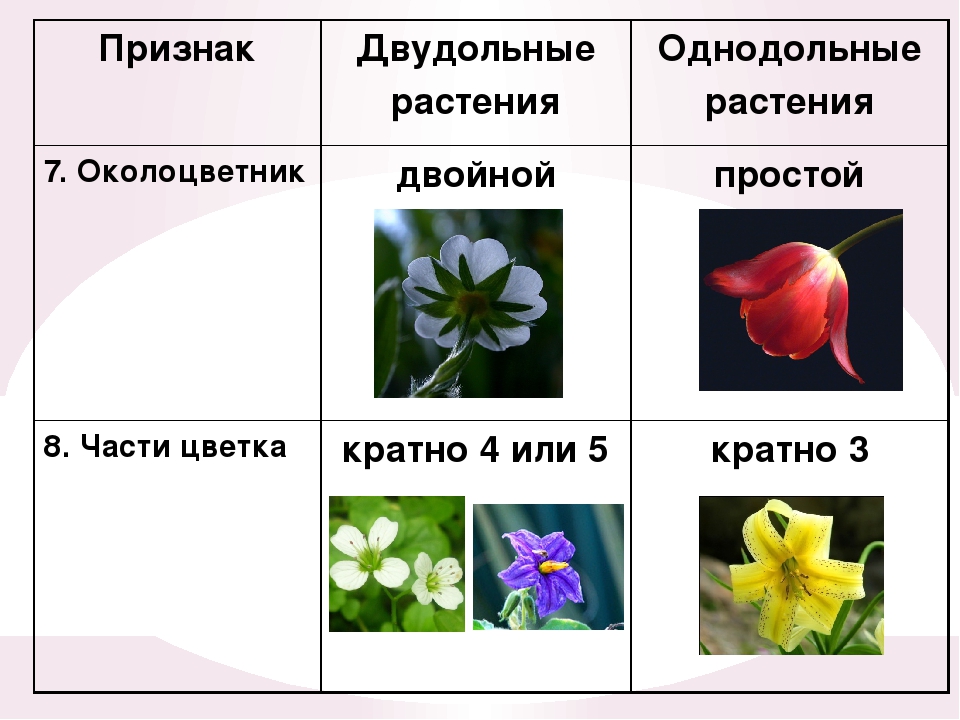 Annu. Rev. Biochem. 1999; 68:321-354.
Annu. Rev. Biochem. 1999; 68:321-354.
37. Fitter D.W., Martin D.J., Copley M.J., Scotland R.W., Langdale J.A. GLK gene pairs regulate chloroplast development in diverse plant species. Plant J. 2002;31:713-727.
38. Flesch G., Rohmer M. Prokaryotic hopanoids: the biosynthesis of the bacteriohopane skeleton. Formation of isoprenic units from two distinct acetate pools and a novel type of carbon/carbon linkage between a triterpene and D-ribose. Eur. J. Biochem. 1988;175:405-411.
39. Freed R.D., Everson E.H., Ringlund K., Gullord M. Seedcoat color in wheat and the elationship to seed dormancy and maturity. Cereal Res. Commun. 1976;4:147-149.
40. Fujisawa M., Nakano T., Ito Y. Identification of potential target genes for the tomato fruit-ripening regulator RIN by chromatin immunoprecipitation. BMC Plant Biol. 2011;11(26):1-16.
41. Giliberto L., Perrotta G., Pallara P., Weller J., Fraser P.D., Bramley P.M., Fiore A., Tavazza M., Giovanni G. Manipulation of the blue light photoreceptor cryptochrome 2 in tomato affects vegetative development, flowering time, and fruit antioxidant content.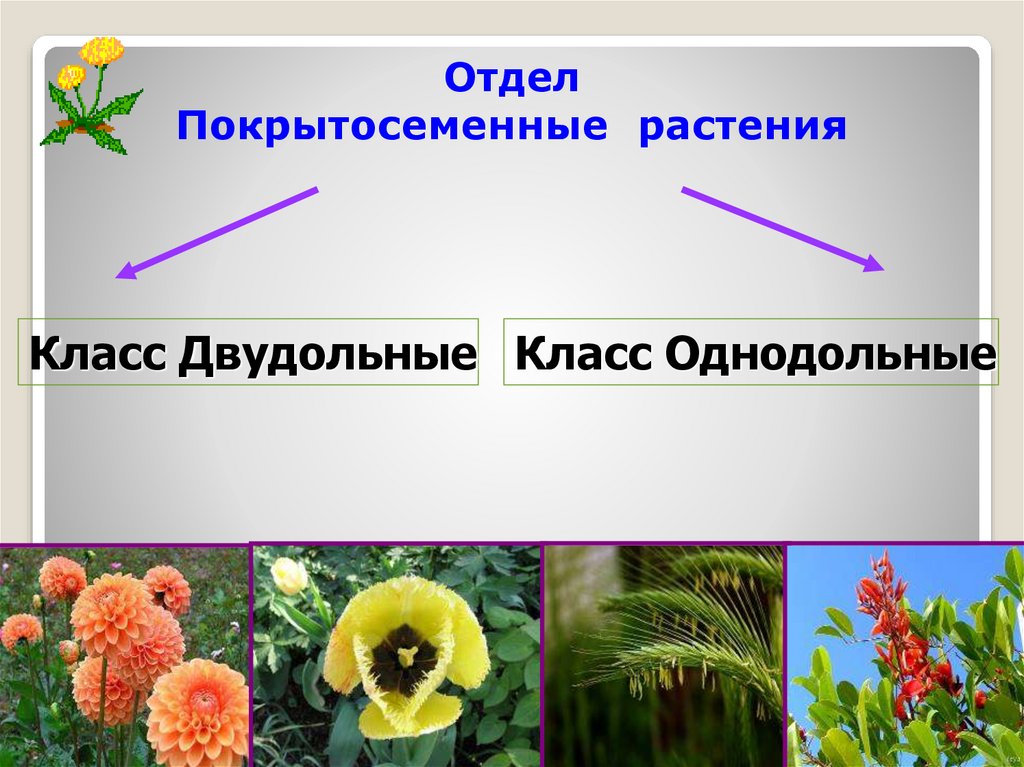 Plant Physiol. 2005;137:199-208.
Plant Physiol. 2005;137:199-208.
42. Giovannoni J.J. Genetic regulation of fruit development and ripening. Plant Cell. 2004;16:170-180.
43. Goff S.A., Klein T.M., Roth B.A., Fromm M.E., Cone K.C., Radicella J.P., Chandler V.L. transactivation of anthocyanin biosynthetic genes following transfer of B regulating genes into maize tissue. EMBO J. 1990;9:2517-2522.
44. Gonzalez A., Zhao M., Leavitt J.M., Llyod A.M. Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/Myb transcriptional complex in Arabidopsis seedlings. Plant J. 2008;53: 814-827.
45. Gordeeva E.I., Shoeva O.Y., Khlestkina E.K. Marker-assisted development of bread wheat near-isogenic lines carrying various combinations of Pp (purple pericarp) alleles Euphytica. 2015;203:469-476.
46. Heim M.A., Jakoby M., Werber M., Martin C., Weisshaar B., Bailey P.C. The basic helix–loop–helix transcription factor family in plants: a genome-wide study of protein structure and functional diversity.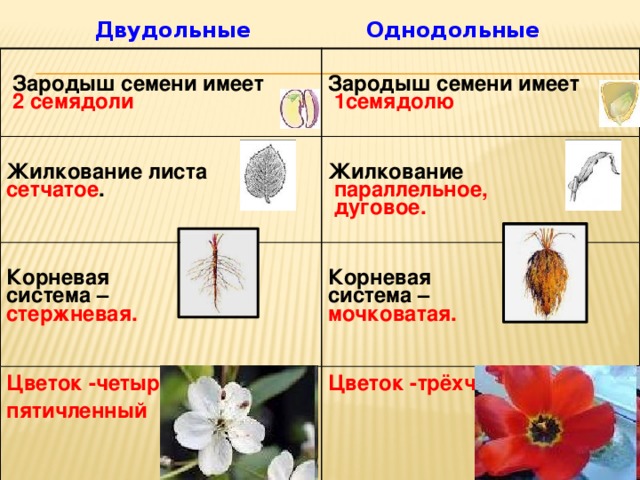 Mol. Biol. Evol. 2003;20:735-747.
Mol. Biol. Evol. 2003;20:735-747.
47. Hichri I., Heppel S.C., Pillet J., Leon C., Czemmel S., Delrot S., Lauvergeat V., Bogs J. The basic helix – loop – helix transcription factor MYC1 is involved in the regulation of the flavonoid biosynthesis pathway in grapevine. Mol. Plant. 2010;3:509-523.
48. Himi E., Nisar A., Noda K. Colour genes (R and Rc) for grain and coleoptile upregulate flavonoid biosynthesis genes in wheat. Genome. 2005;48:747-754.
49. Himi E., Noda K. Red grain colour gene (R) of wheat is a Myb-type transcription factor. Euphytica. 2005;143:239-242.
50. Himi E., Taketa S. Isolation of candidate genes for the barley Ant1 and wheat Rc genes controlling anthocyanin pigmentation in different vegetative tissues. Mol. Genet. Genomics. 2015;290:1287-1298.
51. Hirschberg J. Carotenoid biosynthesis in flowering plants. Current Opinion Plant Biol. 2001;4:210-218.
52. Hu J., Anderson B., Wessler R. Isolation and characterization of rice R genes: evidence for distinct evolutionary paths in rice and maize.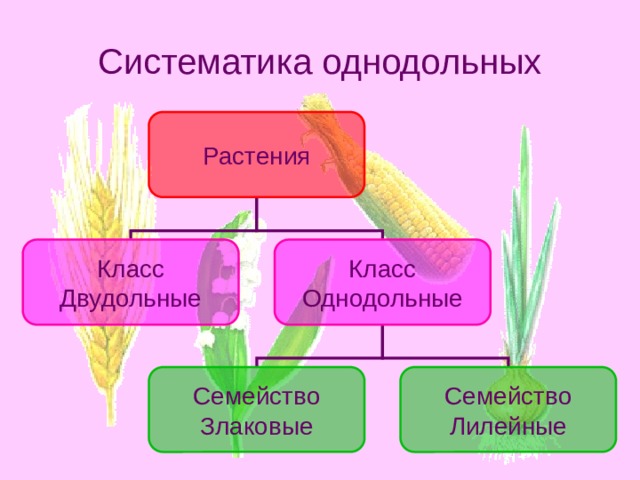 Genetics. 1996;142:1021-1031.
Genetics. 1996;142:1021-1031.
53. Hu J., Reddy V.S., Wessler S.R. The rice R gene family: two distinct subfamilies containing several miniature inverted repeat transposable elements. Plant Mol. Biol. 2000;42:667-678.
54. Itkin M., Seybold H., Breitel D., Rogachev I., Meir S., Aharoni A. TOMATO AGAMOUS-LIKE 1 is a component of the fruit ripening regulatory network. Plant J. 2009;60:1081-1095.
55. Jana B.K., Mukherjee S.K. Notes on the distribution of phytomelanin layer in higher plants – a short communication. J. Pharmaceutical Biol. 2014;4:131-132.
56. Johnson E.J. The role of carotenoids in human health. Nutr. Clin. Care. 2002;5:56-65.
57. Jung H.-J., Manoharan R.K., Park J.-I., Chung M.-Y., Lee J., Lim Y.-P., Hur Y., Nou I.-S. Identification of yellow pigmentation genes in Brassica rapa ssp. Pekinensis using Br300 microarray. Int. J. Genomics. 2014;2014:1-12.
58. Kachanovsky D., Filler S., Isaacson T., Hirschberg J. Epistasis in tomato color mutations involves regulation of phytoenesynthase 1 expression by cis-carotenoids.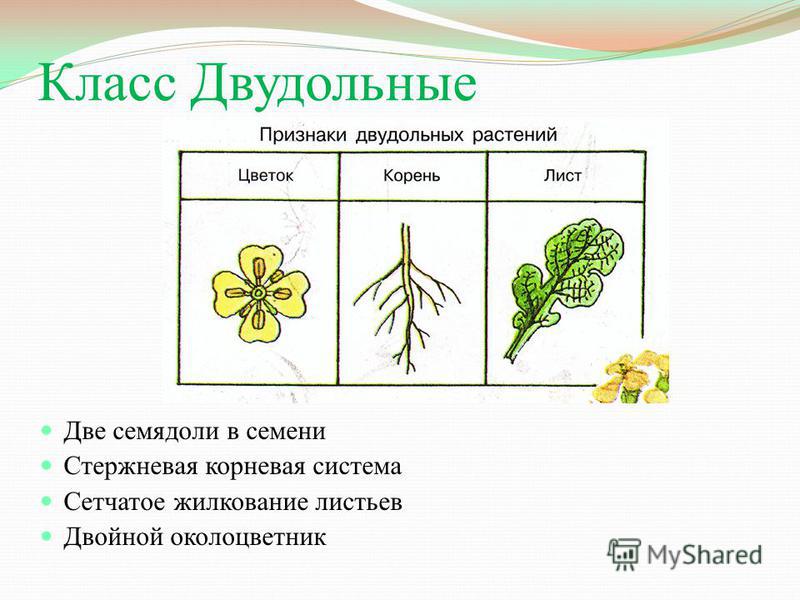 Proc. Natl Acad. Sci. USA. 2012;109(46): 19021-19026.
Proc. Natl Acad. Sci. USA. 2012;109(46): 19021-19026.
59. Karlova R., Rosin F.M., Busscher-Lange J., Parapunova V., Do P.T.,Fernie A.R., Fraser P.D., Baxter C., Angenent G.C., de Maagd R.A.Transcriptome and metabolite profiling show that APETALA2a is a major regulator of tomato fruit ripening. Plant Cell. 2011;23:923-941.
60. Kerr E.A. Green flesh, gf. Rpt. Tomato Genet. Coop. Rep. 1956;6(17).
61. Khlestkina E.K. Regulatory-target gene relationships in allopolyploid and hybrid genomes. Ed. K.V. Urbano. Adv. Genetics Res. V. 3. NOVA Science Publishers, Inc, USA, 2010.
62. Khlestkina E.K. The adaptive role of flavonoids: emphasis on cereals. Cereal Res. Commun. 2013;41:185-198.
63. Khlestkina E.K. Current applications of wheat and wheat-alien precise genetic stocks. Mol. Breeding. 2014;34:273-281. DOI: 10.1007/s11032-014-0049-8
64. Khlestkina E.K., Gordeeva E.I., Arbuzova V.S. Molecular and functionalcharacterization of wheat near-isogenic line ‘i:S29Ra’ having intensive anthocyanin pigmentation of the coleoptile, culm, leaves and auricles.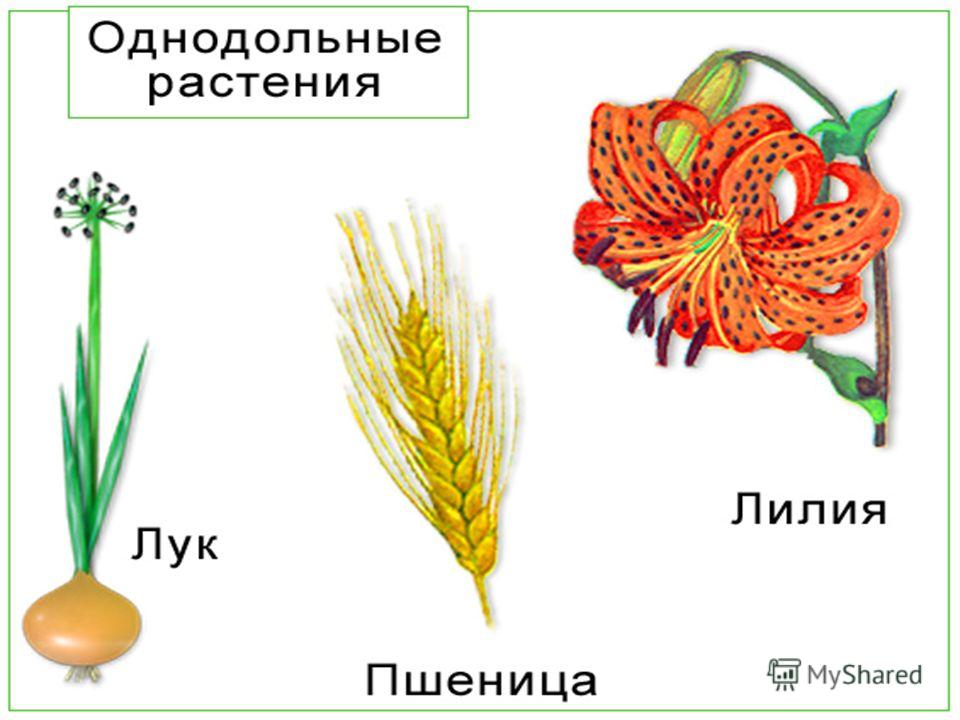 Plant Breeding. 2014;133:454-458.
Plant Breeding. 2014;133:454-458.
65. Khlestkina E.K., Pestsova E.G., Röder M.S., Börner A. Molecular mapping, phenotypic expression and geographical distribution of genes determining anthocyanin pigmentation of coleoptiles in wheat (Triticum aestivum L.). Theor. Appl. Genet. 2002;104:632-637.
66. Khlestkina E.K., Pshenichnikova T.A., Röder M.S., Börner A. Clustering anthocyanin pigmentation genes in wheat group 7 chromosomes. Cereal Res. Commun. 2009;37:391-398.
67. Khlestkina E.K., Röder M.S., Börner A. Mapping genes controlling anthocyanin pigmentation on the glume and pericarp in tetraploidwheat (Triticum durum L.). Euphytica. 2010;171:65-69.
68. Khlestkina E.K., Röder M.S., Salina E.A. Relationship between homoeologous regulatory and structural genes in allopolyploid genome – a case study in bread wheat. BMC Plant Biology. 2008; 8:88.
69. Kobayashi S., Ishimaru M., Hiraoka K., Honda C. Myb-related genes of the Kyoho grape (Vitis labruscana) regulate anthocyanin biosynthesis. Planta. 2002;215:924-933.
Planta. 2002;215:924-933.
70. Kolotilin I., Koltai H., Tadmor Y., Bar-Or C., Reuveni M., Meir A., Nahon S., Shlomo H., Chen L., Levin I. Transcriptional profiling of high pigment-2dg tomato mutant links early fruit plastid biogenesis with its overproduction of phytonutrients. Plant Physiol. 2007;145:389-401.
71. Kopsell D.A., Kopsell D.E. Accumulation and bioavailability of dietary carotenoids in vegetable crops. Trends Plant Sci. 2006;11(10): 499-507.
72. Lee J.M., Joung J.-G., McQuinn R., Chung M.-Y., Fei Z., Tieman D., Klee H., Giovannoni J. Combined transcriptome, genetic diversity and metabolite profiling in tomato fruit reveals that the ethylene response factor SlERF6 plays an important role in ripening and carotenoid accumulation. Plant J. 2012;70:191-204.
73. Li W.L., Faris J.D., Chittoor J.M., Leach J.E., Hulbert S.H., Liu D.J., Chen P.D., Gill B.S. Genomic mapping of defense response genes in wheat. Theor. Appl. Genet. 1999;98:226-233.
74. Lila A. M. Anthocyanins and human health: An in vitro investigative approach. J. Biomed. Biotechnol. 2004;2004(5):306-313.
M. Anthocyanins and human health: An in vitro investigative approach. J. Biomed. Biotechnol. 2004;2004(5):306-313.
75. Lin Z., Hong Y., Yin M., Li C., Zhang K., Grierson D. A tomato HD-Zip homeobox protein, LeHB-1, plays an important role in floral organogenesis and ripening. Plant J. 2008;55:301-310.
76. Liu Y.S., Gur A., Ronen G., Causse M., Damidaux R., Buret M., Hieschberg J., Zamir D. There is more to tomato fruit color than candidate carotenoid. Plant Biotechnol. J. 2003;1:195-207.
77. Liu Y., Roof S., Ye Z., Barry C., Van Tuinent A., Vrebalov J., Bowler C., Giovannoni J. Manipulation of light signal transduction as a means of modifying fruit nutritional quality in tomato. Proc. Natl Acad. Sci. USA. 2004;26:9897-9902.
78. Lloyd A.M., Walbot V., Davis R.W. Arabidopsis and Nicotiana anthocyanin production activated by maize regulators R and C1. Science. 1992;258:1773-1775.
79. Ludwig S.R., Habera L.F., Dellaporta S.L., Wessler S.R. Lc, a member of the maize R gene family responsible for tissue-specific anthocyanin production, encodes a protein similar to transcriptional activators and contains the myc-homology region. Proc. Natl Acad. Sci. USA. 1989;86:7092-7096.
Proc. Natl Acad. Sci. USA. 1989;86:7092-7096.
80. Manning K., Tor M., Poole M., Hong Y., Thompson A., King G., Giovannoni J., Seymour G. A naturally occurring epigenetic mutation in a gene encoding an SBP-box transcription factor inhibits tomato fruit ripening. Nat. Genet. 2006;38(8):948-952.
81. Martel C., Vrebalov J., Tafelmeyer P., Giovannoni J.J. The tomato MADS-box transcription factor RIPENING INHIBITOR interacts with promoters involved in numerous ripening processes in a COLORLESS NONRIPENING-dependent manner. Plant Physiol.2011;157:1568-1579.
82. Martin C., Prescott A., Mackay S., Bartlett J., Vrijlandt E. Control of anthocyanin biosynthesis in flowers of Antirrhinum majus. Plant J.1991;1:37-49.
83. Matsui K., Umemura Y., Ohme-Takagi M. AtMYBL2, a protein with a single MYB domain, acts as a negative regulator of anthocyanin biosynthesis in Arabidopsis. Plant J. 2008;55:954-967.
84. Matus J.T., Poupin M.J., Cañón P., Bordeu E., Alcalde J.A., ArceJohnson P.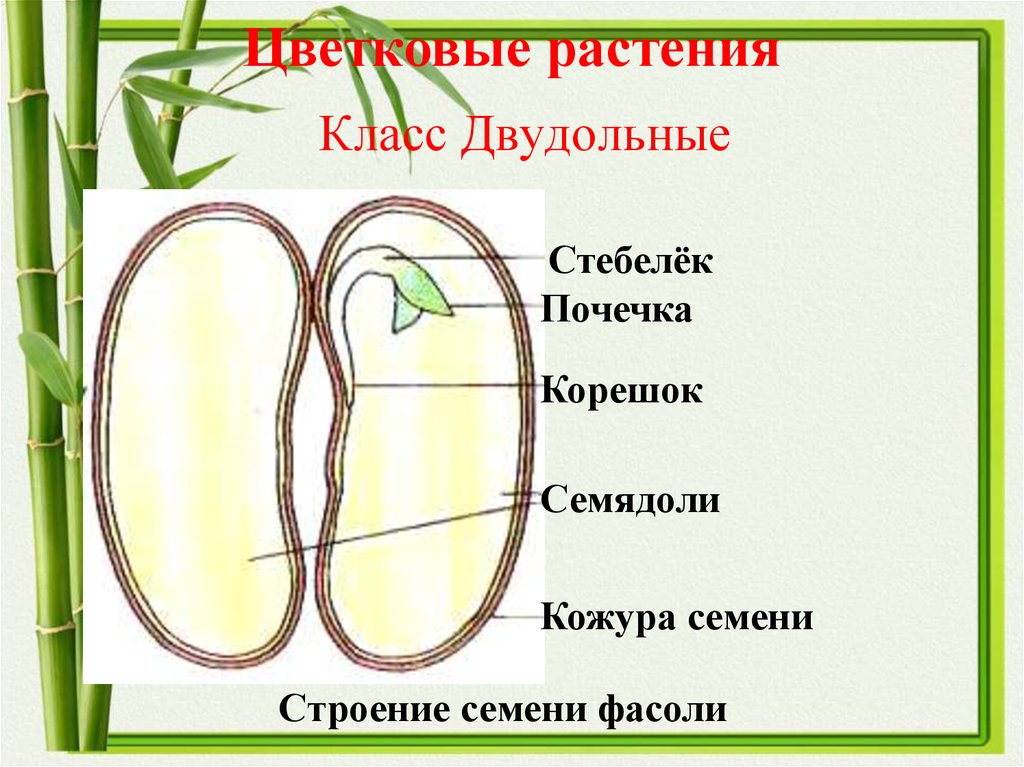 Isolation of WDR and bHLH genes related to flavonoid synthesis in grapevine (Vitis vinifera L.). Plant Mol. Biol. 2010;72: 607-620.
Isolation of WDR and bHLH genes related to flavonoid synthesis in grapevine (Vitis vinifera L.). Plant Mol. Biol. 2010;72: 607-620.
85. McClintock B. Controlling elements and the gene. Cold Spring Harbor Symp Quant. Biol. 1956;21:197-216.
86. Middleton E. Jr., Kandaswami C., Theoharides T.C. The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease, and cancer. Pharmacol. Rev. 2000;52:673-751.
87. Nakamura H., Muramatsu M., Hakata M., Ueno O., Nagamura Y., Hirochika H., Takano M., Ichikawa H. Ectopic overexpression of the transcription factor OsGLK1 induces chloroplast development in non-green rice cells. Plant Cell Physiol. 2009;50(11):1933-1949.
88. Nesi N., Debeaujon I., Jond C., Pelletier G., Caboche M., Lepiniec L. The TT8 gene encodes a basic helix-loop-helix domain protein required for expression of DFR and BAN genes in Arabidopsis siliques.Plant Cell. 2000;12:1863-1878.
89. Nguyen C.V., Vrebalov J.T., Gapper N. E., Zheng Y., Zhong S., Fei Z., Giovannoni J.J. Tomato GOLDEN2-LIKE transcription factors reveal molecular gradients that function during fruit development and ripening. Plant Cell. 2014;26:585-601.
E., Zheng Y., Zhong S., Fei Z., Giovannoni J.J. Tomato GOLDEN2-LIKE transcription factors reveal molecular gradients that function during fruit development and ripening. Plant Cell. 2014;26:585-601.
90. Orfila C., Huisman M.M.H., Willats W.G.T., van Alebeek G.J.W.M., Schols H.A., Seymour G.B., Knox J.P. Altered cell wall disassembly during ripening of Cnr tomato fruit: implications for cell adhesion and fruit softening. Puranta. 2002;215(3):440-447. DOI: 10.1007/s00425-002-0753-1
91. Osorio S. Systems biology of tomato fruit development: combined transcript, protein, and metabolite analysis of tomato transcription factor (nor, rin) and ethylene receptor (Nr) mutants reveals novel regulatory interactions plant physiology. Plant Physiol. 2011;157: 405-425.
92. Palmieri S., Martiniello P., Soressi G.P. Chlorophyll and carotene content in high pigment and green flesh fruits. Rep. Tomat. Genet. Coop. 1978;28:10.
93. Pan I.L., McQuinn R., Giovannoni J.J., Irish V.F. Functional diversification of AGAMOUS lineage genes in regulating tomato flower and fruit development. J. Exp. Bot. 2010;61:1795-1806.
J. Exp. Bot. 2010;61:1795-1806.
94. Park H., Kreunen S.S., Cuttriss A.J., Dellapenna D., Pogson B.J. Identification of the carotenoid isomerase provides insight into carotenoid biosynthesis, prolamellar body formation, and photomorphogenesis. Plant Cell. 2002;14:321-332.
95. Park K. A bHLH protein partially controls proanthocyanidin and phytomelanin pigmentation in the seed coats of morning glory Ipomoea tricolor. Hort. Environ. Biotechnol. 2012;53:304-309.
96. Park S.Y., Yu J.W., Park J.S., Li J., Yoo S.C., Lee N.Y., Lee S.K., Jeong S.W., Seo H.S., Koh H.J., Jeon J.S., Park Y.I., Paek N.C. The senescence-induced stay-green protein regulates chlorophyll degradation. Plant Cell. 2007;19:1649-1664.
97. Paz-Ares J., Ghosal D., Wienand U., Peterson P.A., Saedler H. The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators. EMBO J. 1987;6:3553-3558.
98. Pelletier M. K., Shirley B.W. Analysis of flavanone 3-hydroxylase in Arabidopsis seedlings. Coordinate regulation with chalcone synthase and chalcone isomerase. Plant Physiol. 1996;111:339-345.
K., Shirley B.W. Analysis of flavanone 3-hydroxylase in Arabidopsis seedlings. Coordinate regulation with chalcone synthase and chalcone isomerase. Plant Physiol. 1996;111:339-345.
99. Petroni K., Cominelli E., Consonni G., Gusmaroli G., Gavazzi G., Tonelli C. The developmental expression of the maize regulatory gene Hopi determines germination-dependent anthocyanin accumulation. Genetics. 2000;155:323-336.
100. Petroni K., Tonelli C. Recent advances on the regulation of anthocyanin synthesis in reproductive organs. Plant Sci. 2011;181:219-229.
101. Powell A.L., Nguyen C.V., Hill T., Cheng K.L., Figueroa-Balderas R., Aktas H. Uniform ripening encodes a Golden 2-like transcription factor regulating tomato fruit chloroplast development. Science. 2012;336:1711-1715.
102. Quattrocchio F., Wing J.F., Leppen H.T.C., Mol J.N.M., Koes R.E. Regulatory genes controlling anthocyanin pigmentation are functionally conserved among plant species and have distinct sets of target genes. Plant Cell. 1993;5:1497-1512.
Plant Cell. 1993;5:1497-1512.
103. Quattrocchio F., Wing J.F., van der Woude K., Mol J.N.M., Koes R. Analysis of bHLH and MYB domain proteins: species specific regulatory differences are caused by divergent evolution of target anthocyanin genes. Plant J. 1998;13:475-488.
104. Quattrocchio F., Wing J., van der Woude K., Souer E., de Vetten N., Mol J., Koes R. Molecular analysis of the anthocyanin2 gene of petunia and its role in the evolution of flower color. Plant Cell. 1999;11:1433-1444.
105. Quattrocchio F., Verweij W., Kroon A., Spelt C., Mol J., Koes R. Ph5 of petunia is an R2R3 MYB protein that activates vacuolar acidification through interactions with basic-helix–loop–helix transcription factors of the anthocyanin pathway. Plant Cell. 2006;18:1274-1291.
106. Rausher M.D. The evolution of flavonoids and their genes. Ed. P.E. Grotewold. The Science of Flavonoids. N.Y.: Springer, 2008.
107. Reddy V.S., Scheffler B.E., Wienand U., Wessler S.R., Reddy A.R.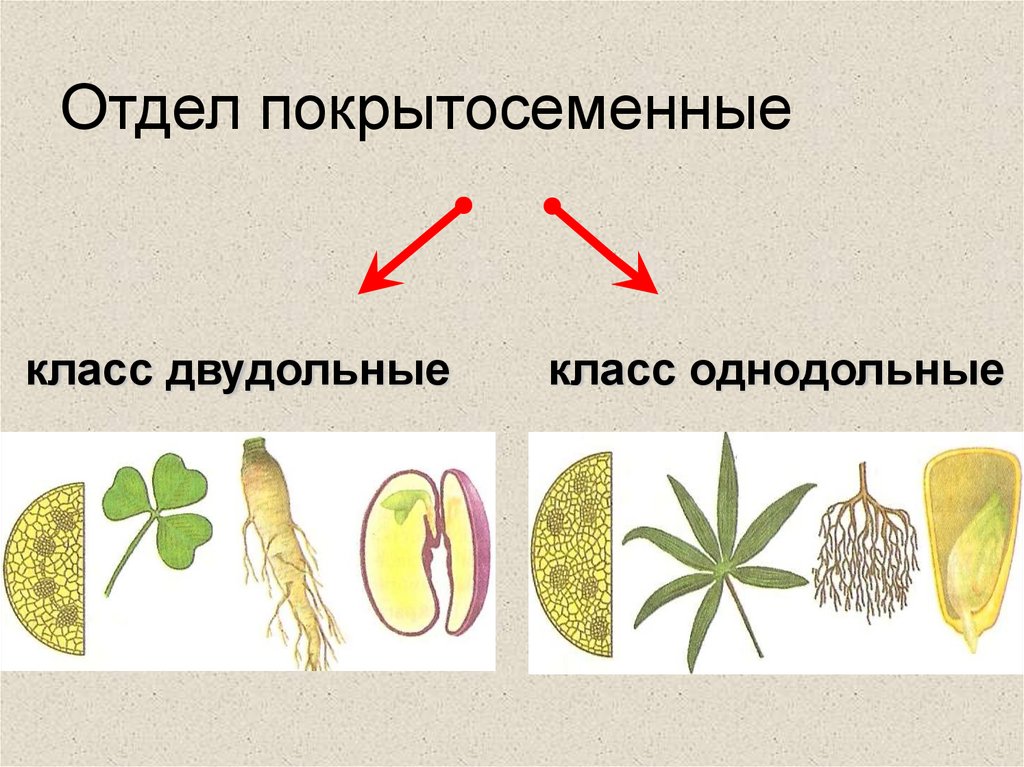 Cloning and characterization of the rice homologue of the maize C1 anthocyanin regulatory gene. Plant Mol. Biol. 1998;36:497-498.
Cloning and characterization of the rice homologue of the maize C1 anthocyanin regulatory gene. Plant Mol. Biol. 1998;36:497-498.
108. Ríos G., Naranjo M.A., Rodrigo M.-J., Alós E., Zacarías L., Cercós M., Talón M. Identification of a GCC transcription factor responding to fruit colour change events in citrus through the transcriptomic analyses of two mutants. BMC Plant Biol. 2010;10(276):1-14.
109. Rossini L., Cribb L., Martin D.J., Langdale J.A. The maize golden2 gene defines a novel class of transcriptional regulators in plants. Plant Cell. 2001;13:1231-1244.
110. Saitoh K., Onishi K., Mikami I., Thidar K., Sano Y. Allelic diversification at the C (OsC1) locus of wild and cultivated rice: nucleotide changes associated with phenotypes. Genetics. 2004;7:997-1007.
111. Sakamoto W., Ohmori T., Kageyama K., Miyazaki C., Saito A., Murata M., Noda K., Maekawa M. The Purple leaf (Pl) locus of rice: the Plw allele has a complex organization and includes two genes encoding basic helix-loop-helix proteins involved in anthocyanin biosynthesis.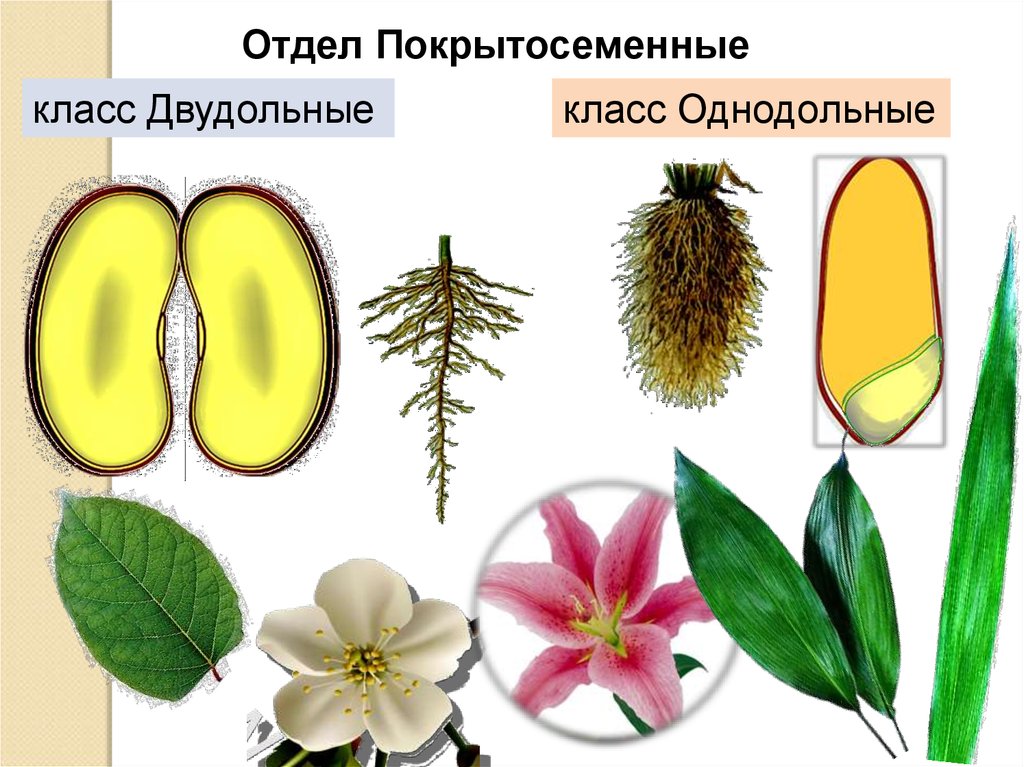 Plant Cell Physiol. 2001;42:982-991.
Plant Cell Physiol. 2001;42:982-991.
112. Sasaki K., Takahashi T. A flavonoid from Brassica rapa flower as the UV-absorbing nectar guide. Phytochemistry. 2002;61:339-343.
113. Selinger D.A., Chandler V.L. A mutation in the pale aleurone color1 gene identifies a novel regulator of the maize anthocyanin pathway. Plant Cell. 1999;11:5-14.
114. Shoeva O.Y., Gordeeva E.I., Khlestkina E.K. The regulation of anthocyanin synthesis in the wheat pericarp. Molecules. 2014;19:20266-20279. DOI: 10.3390/molecules191220266
115. Shoeva O.Yu., Kukoeva T.V., Börner A., Khlestkina E.K. Barley Ant1 is a homolog of maize C1 and its product is part of the regulatory machinery governing anthocyanin synthesis in the leaf sheath. Plant Breeding. 2015
116. Spelt C., Quattrocchio F., Mol J., Koes R. Anthocyanin1 of petunia encodes a basic helix–loop–helix protein that directly activates transcription of structural anthocyanin genes. Plant Cell. 2000;12: 1619-1631.
117. Strack D. , Vogt T., Schliemann W. Recent advances in betalain research. Phytochemistry. 2003;62:247-269.
, Vogt T., Schliemann W. Recent advances in betalain research. Phytochemistry. 2003;62:247-269.
118. Sun H., Fan H.-J., Ling H.-Q. Genome-wide identification and characterization of the bHLH gene family in tomato. BMC Genomics. 2015;16(9):1-12.
119. Tadiello A., Pavanello A., Zanin D., Caporali E., Colombo L., Rotino G.L., Trainotti L., Casadoro G. A PLENA-like gene of peach is involved in carpel formation and subsequent transformation into a fleshy Fruit. J. Exp. Bot. 2009;60:651-661.
120. Taylor L.P., Briggs W.R. Genetic regulation and photocontrol of anthocyanin accumulation in maize seedlings. Plant Cell. 1990;2: 115-127.
121. Tereshchenko O.Y., Arbuzova V.S., Khlestkina E.K. Allelic state of the genes conferring purple pigmentation in different wheat organs predetermines transcriptional activity of the anthocyanin biosynthesis structural genes. J. Cereal Sci. 2013;57:10-13.
122. Toledo-Ortiz G., Huq E., Rodríguez-Concepción M. Direct regulation of phytoene synthase gene expression and carotenoid biosynthesis by phytochrome-interacting factors.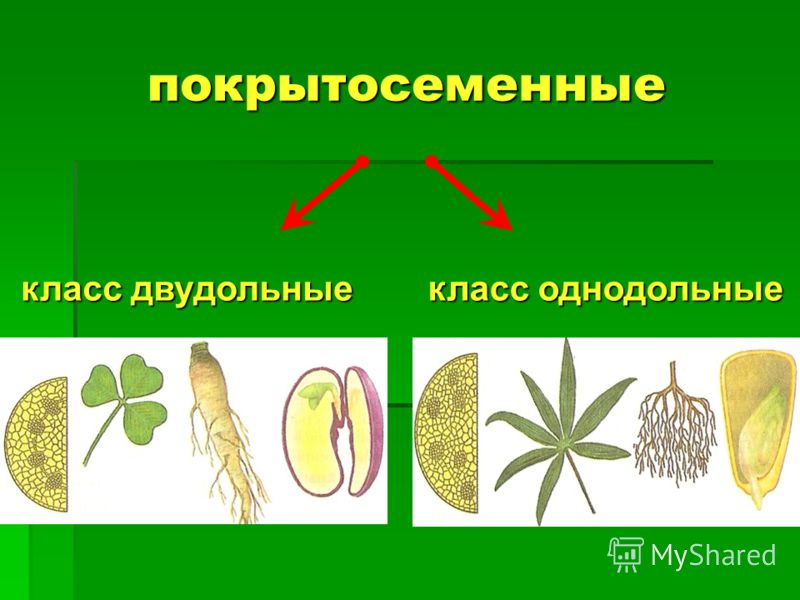 PNAS. 2010;107(25):11626-11631.
PNAS. 2010;107(25):11626-11631.
123. Vrebalov J., Pan I.L., Arroyo A.J.M., McQuinn R., Chung M., Poole M. Fleshy fruit expansion and ripening are regulated by the tomato SHATTERPROOF gene TAGL1. Plant Cell. 2009;21:3041-3062.
124. Vrebalov J., Ruezinsky D., Padmanabhan V., White R., Medrano D., Drake R., Giovannoni J. A MADS-box gene necessary for fruit ripening at the tomato ripening-inhibitor (Rin) locus. Science. 2002;296:343-345.
125. Walker A.R., Davison P.A., Bolognesi-Winfield A.C., James C.M., Srinivasan N., Blundell T.L., Esch J.J., Marks M.D., Gray J.C. The TRANSPARENT TESTA GLABRA1 locus, which regulates trichome differentiation and anthocyanin biosynthesis in Arabidopsis, encodes a WD40 repeat protein. Plant Cell. 1999;11:1337-1350.
126. Walker A.R., Lee E., Bogs J., McDavid D.A., Thomas M.R., Robinson S.P. White grapes arose through the mutation of two similar and adjacent regulatory gene. Plant J. 2007;49:772-785.
127. Welsch R., Maass D., Voegel T.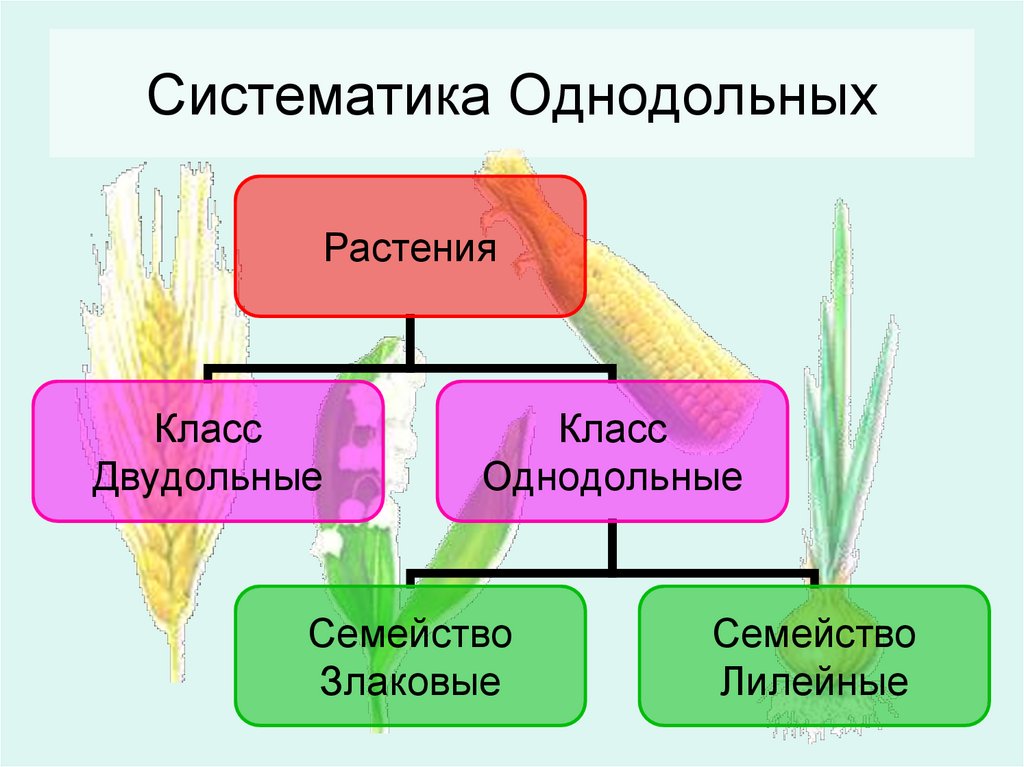 , Dellapenna D., Beyer P. Transcription factor RAP2.2 and its interacting partner SINAT2: stable elements in the carotenogenesis of Arabidopsis leaves. Plant Physiol.2007;145:1073-1085.
, Dellapenna D., Beyer P. Transcription factor RAP2.2 and its interacting partner SINAT2: stable elements in the carotenogenesis of Arabidopsis leaves. Plant Physiol.2007;145:1073-1085.
128. Winkel-Shirley B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology and biotechnology. Plant Physiol. 2001;126:485-493.
129. Zhang F., Gonzalez A., Zhao M., Payne T., Llyod A. A network of redundant bHLH proteins functions in all TTG1-dependent pathways of Arabidopsis. Development. 2003;130:4859-4869.
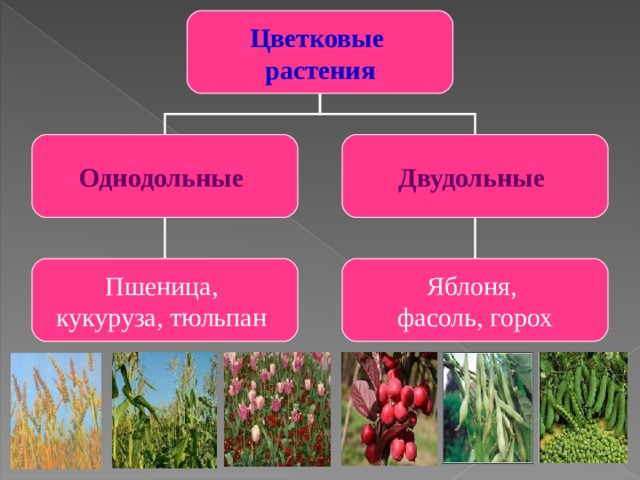
Характеристики однодольных и двудольных — Идеи для дома
Тюльпаны — примеры однодольных.
Термины «однодольные» и «двудольные» используются в науке и относятся к тому, сколько семенных листьев имеет эмбриональное цветущее растение, пока оно все еще находится в семени. У эмбриона один или два листа, что делает его однодольным или двудольным, соответственно. Однодольные и двудольные различаются по четырем анатомическим областям: цветы, листья, корни и стебли.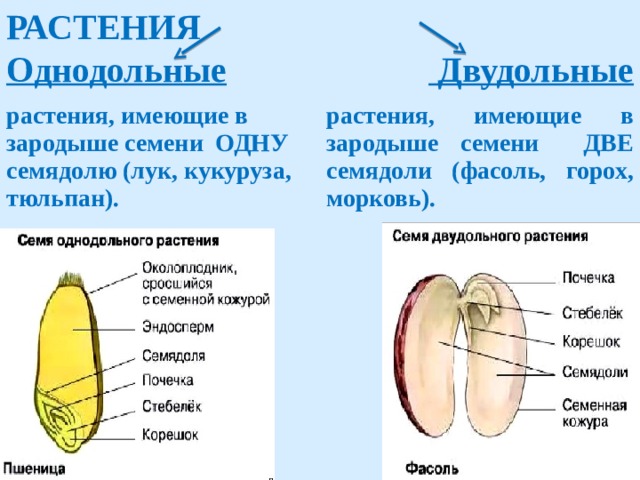
Однодольные и двудольные: получение технических знаний
Однодольные и двудольные — это сокращенные версии терминов однодольные и двудольные. Названия образованы от термина семядоли, что означает семенной лист, который является одной из отличительных черт этих двух классов. Термины моно и ди, означающие один и два, относятся к количеству этих листьев, которые производят растения. Существует около 65 000 видов однодольных и около 170 000 различных видов двудольных.
Характеристики, которые они разделяют
Однодольные и двудольные являются типами покрытосеменных или растений, которые производят цветы. Однодольные и двудольные растения удобряются пыльцой и растут из семян. Обе группы используют свои листья для фотосинтеза, и обе переносят питательные вещества из земли через корни и по сосудистой системе в своих стеблях. Однако структура и количество этих особенностей немного различаются между однодольными и двудольными, что позволяет различать два подразделения.
Характеристики однодольных
Бхупиндер Багга
Количество частей цветка на однодольном кратно трем.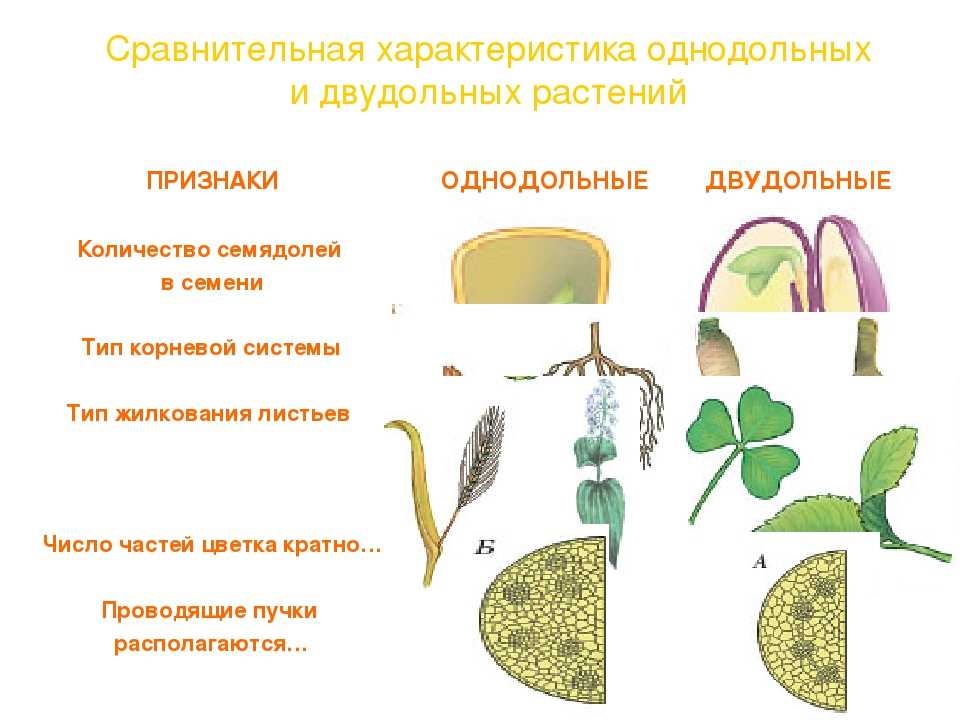 Лилия — пример однодольного. Семя однодольных дает один начальный семенной лист при прорастании. Этот семенной лист обеспечивает растение первыми питательными веществами. Когда однодольные растения достаточно развиты, чтобы дать дополнительные листья, на листьях появляются крупные жилки, идущие параллельно друг другу. Это можно увидеть на таких растениях, как травы. Эти листья позволяют растению получать энергию в процессе фотосинтеза. Сосудистая система, проходящая через стебель однодольного растения, не имеет строго организованного рисунка. Пыльцевые зерна однодольных цветов содержат одну пору или борозду.
Лилия — пример однодольного. Семя однодольных дает один начальный семенной лист при прорастании. Этот семенной лист обеспечивает растение первыми питательными веществами. Когда однодольные растения достаточно развиты, чтобы дать дополнительные листья, на листьях появляются крупные жилки, идущие параллельно друг другу. Это можно увидеть на таких растениях, как травы. Эти листья позволяют растению получать энергию в процессе фотосинтеза. Сосудистая система, проходящая через стебель однодольного растения, не имеет строго организованного рисунка. Пыльцевые зерна однодольных цветов содержат одну пору или борозду.
Характеристики двудольных
Общее количество частей цветка на двудольных может делиться на четыре или пять. Герань двудольная. Когда семена двудольных прорастают, они дают два семенных листа. Зрелые листья двудольных содержат множество мелких жилок, причем более мелкие жилки выходят наружу от основных жилок. Система жилок у двудольных листьев имеет неровный, похожий на паутину вид.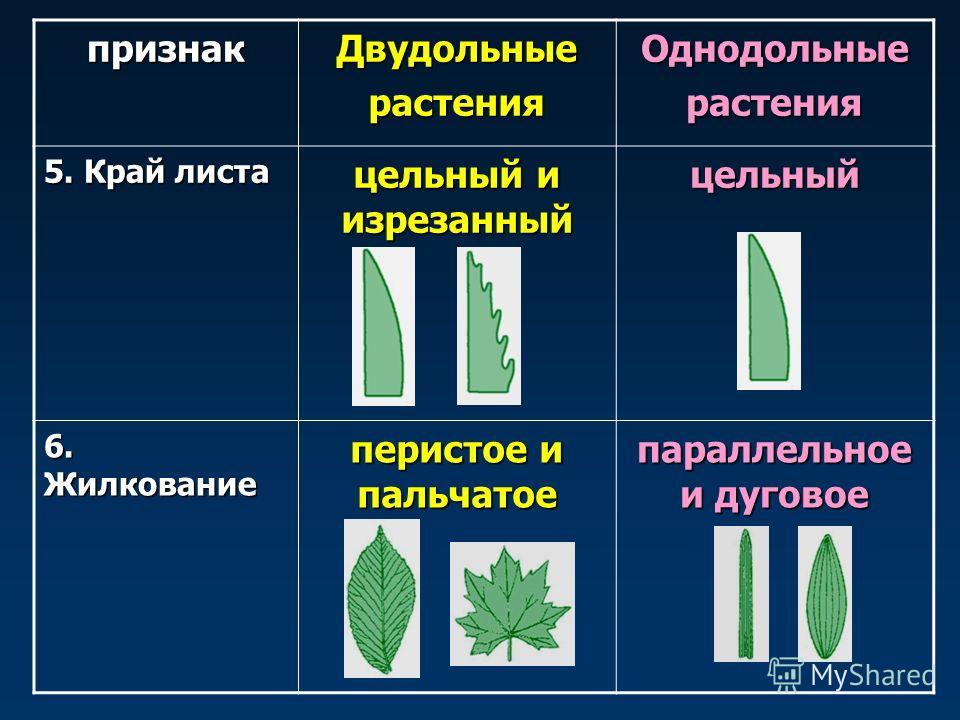 Яркие примеры листьев двудольных растений можно увидеть на большинстве деревьев. Сосудистая система внутри стебля двудольного дерева структурирована. Сосудистая ткань организована в серию кругов, которые образуют друг друга, придавая стержню цилиндрическую форму. В отличие от однодольных, двудольные часто могут образовывать вокруг себя слой коры. Из двудольных растений образуются пыльцевые зерна с тремя порами или бороздками.
Яркие примеры листьев двудольных растений можно увидеть на большинстве деревьев. Сосудистая система внутри стебля двудольного дерева структурирована. Сосудистая ткань организована в серию кругов, которые образуют друг друга, придавая стержню цилиндрическую форму. В отличие от однодольных, двудольные часто могут образовывать вокруг себя слой коры. Из двудольных растений образуются пыльцевые зерна с тремя порами или бороздками.
Проблемы с классификацией
Кевин Шафер / Банк изображений / GettyImages
Хотя однодольные и двудольные обычно можно классифицировать по общим признакам, таким как количество частей цветка или рисунок жилок на листе растения, есть некоторые исключения. Например, пальмы являются однодольными, но у них есть способность производить своего рода кору, что обычно ассоциируется с двудольными. Другие проблемы классификации могут возникнуть, когда функцию трудно идентифицировать. Например, некоторые виды растений могут давать цветы с небольшими или полупрозрачными лепестками, которые трудно заметить при подсчете количества частей цветка.
Подробные пояснения и изображения – Lambda Geeks
Однодольные или, короче говоря, однодольные – это группа покрытосеменных растений, в семенах которых имеется только одна семядоля или зародышевый лист. Здесь мы собираемся кратко обсудить некоторые примеры однодольных растений.
В эту группу входит более 60000 видов. Давайте посмотрим на некоторые очень распространенные примеры однодольных растений:
- Орхидеи
- Сахарный тростник
- Лилии
- Palm trees
- Bananas
- Bamboo
- Tulips
- Iris
- Aloe vera
- Daffodils
- Snowdrops
- Coconut trees
- Ананас
- Пшеница
- Йовар
- Ячмень
- Кукуруза
- Райс
- Molion
- Asparagus
Примеры монокота
Let a Lets более ближе
Примеры однодольных: Орхидеи с Pixabay.com
Сахарный тростник
Более 20000 видов семейства Poaceae или настоящих трав являются типичными примерами однодольных. Сахарный тростник — это сахарный тростник, или Saccharum officinarum — один из них. У него только одна семядоля в семени. В сельскохозяйственном аспекте это важный вид травы, поскольку из них производится 70% содержания сахара.
Лилии
Как и орхидеи, лилии также являются одной из наиболее распространенных групп однодольных растений. Четырехчленные лепестки цветка являются наиболее важным признаком, указывающим на то, что это однодольное растение. Большинство видов лилий родом из умеренного климата. Помимо настоящих лилий, есть несколько других видов, известных как лилии, такие как карликовая лилия, рыцарская лилия и т. д., которые также являются распространенными примерами однодольных растений.
Большинство видов лилий родом из умеренного климата. Помимо настоящих лилий, есть несколько других видов, известных как лилии, такие как карликовая лилия, рыцарская лилия и т. д., которые также являются распространенными примерами однодольных растений.
Лилии из Wikimedia Commons
Пальмы
Хотя большинство однодольных растений являются травянистыми, они обычно меньше, поскольку их вторичный рост ограничен. Но, будучи однодольными, пальмы используют свой сосудистый пучок и лигнин таким образом, что стали самыми крупными среди всех, как и двудольные. Единственная видимая вещь, которая указывает на характер однодольного растения на ладонях, — это структура его листьев. У него длинные лентовидные листья с жилками, идущими параллельно друг другу. Некоторыми распространенными однодольными пальмами являются финиковая пальма, пальма арека, трахикарпус фортуна и т. д.
Бананы
Банан также является одним из распространенных примеров однодольных растений.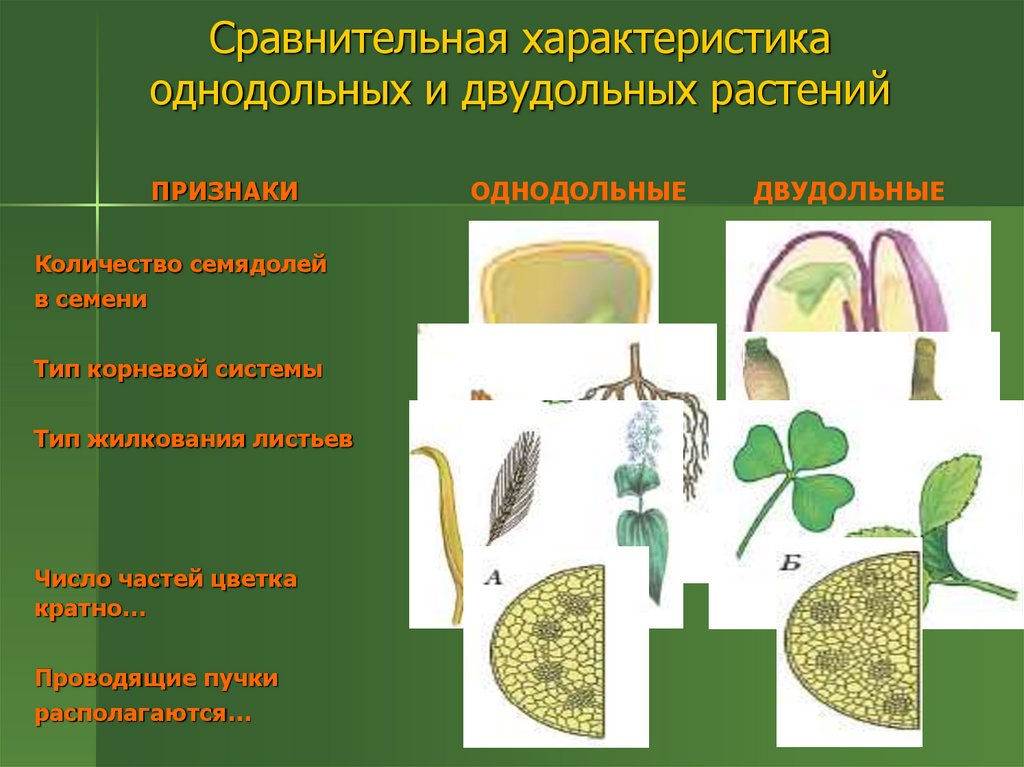 Он принадлежит к семейству Musaceae, тесно связанному с семейством злаков Poaceae. Как и у типичных однодольных, у него отсутствует вторичный рост, а листья располагаются по параллельному образцу жилок. После образования плодов растение закономерно погибает.
Он принадлежит к семейству Musaceae, тесно связанному с семейством злаков Poaceae. Как и у типичных однодольных, у него отсутствует вторичный рост, а листья располагаются по параллельному образцу жилок. После образования плодов растение закономерно погибает.
Бананы из Викисклада
Бамбук
Бамбук принадлежит к травянистому семейству Poaceae подсемейства Bambusoideae. Эти вечнозеленые столбчатые многолетние растения также являются одним из наиболее распространенных примеров однодольных. Как и у других однодольных растений, у бамбука отсутствует вторичный рост, но он выше по размеру. Цветение большинства видов бамбука происходит после 12-120 лет периода роста и дает семена один раз в жизни.
Тюльпаны
Тюльпаны также являются наиболее распространенными травянистыми многолетними однодольными растениями, принадлежащими к семейству лилейных. Растение имеет крупные красочные актиноморфные цветы.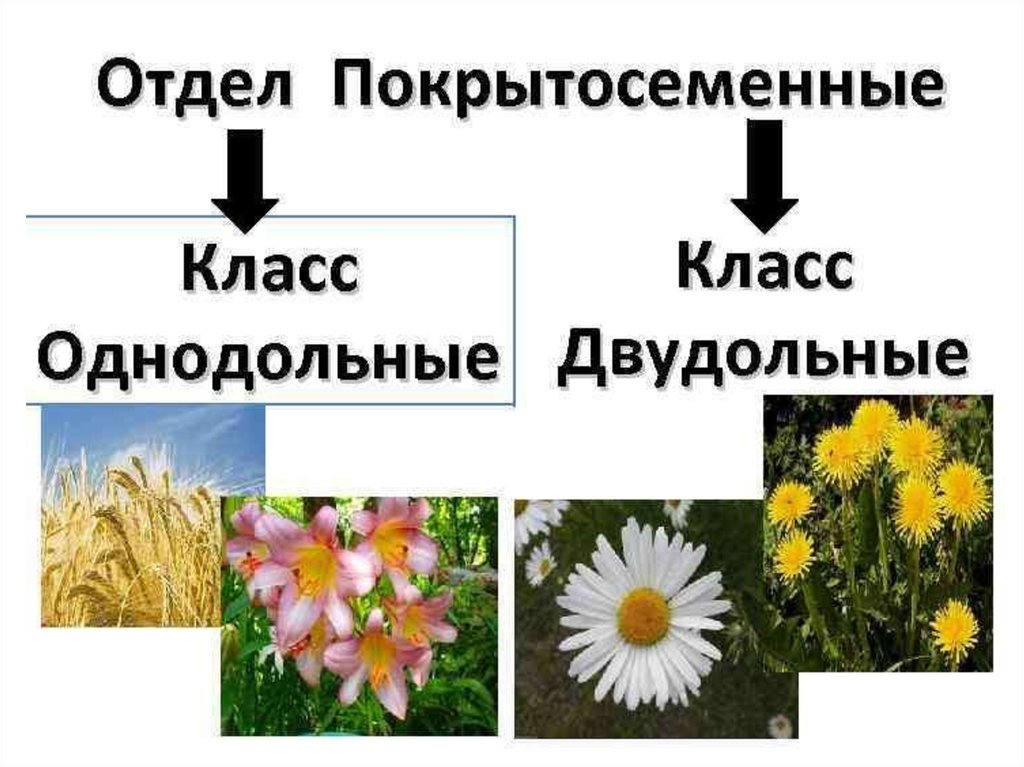 Тюльпаны, как правило, луковичные, то есть имеют подземную луковицу. Существует около 75 различных видов тюльпанов, и все они являются типичными однодольными растениями в природе.
Тюльпаны, как правило, луковичные, то есть имеют подземную луковицу. Существует около 75 различных видов тюльпанов, и все они являются типичными однодольными растениями в природе.
Тюльпаны с Pixabay.com
Ирис
Ирисы — многолетние однодольные растения, принадлежащие к семейству Iridaceae. Некоторые растения ириса являются луковичными, то есть имеют луковицы и цилиндрические прикорневые листья. Некоторые из ирисов являются корневищными, что означает, что они выращивают корневища и имеют мечевидные листья в количестве 3-10. В этом роду насчитывается 260-300 видов, и все они являются типичными однодольными в природе.
Алоэ вера
Алоэ вера – вечнозеленое многолетнее суккулентное однодольное растение, принадлежащее к семейству Asphodelaceae. В основном растет в тропических и субтропических регионах. Род насчитывает более 500 видов, обычно однодольных. Его толстые, мясистые, зеленые листья делают алоэ вера уникальным.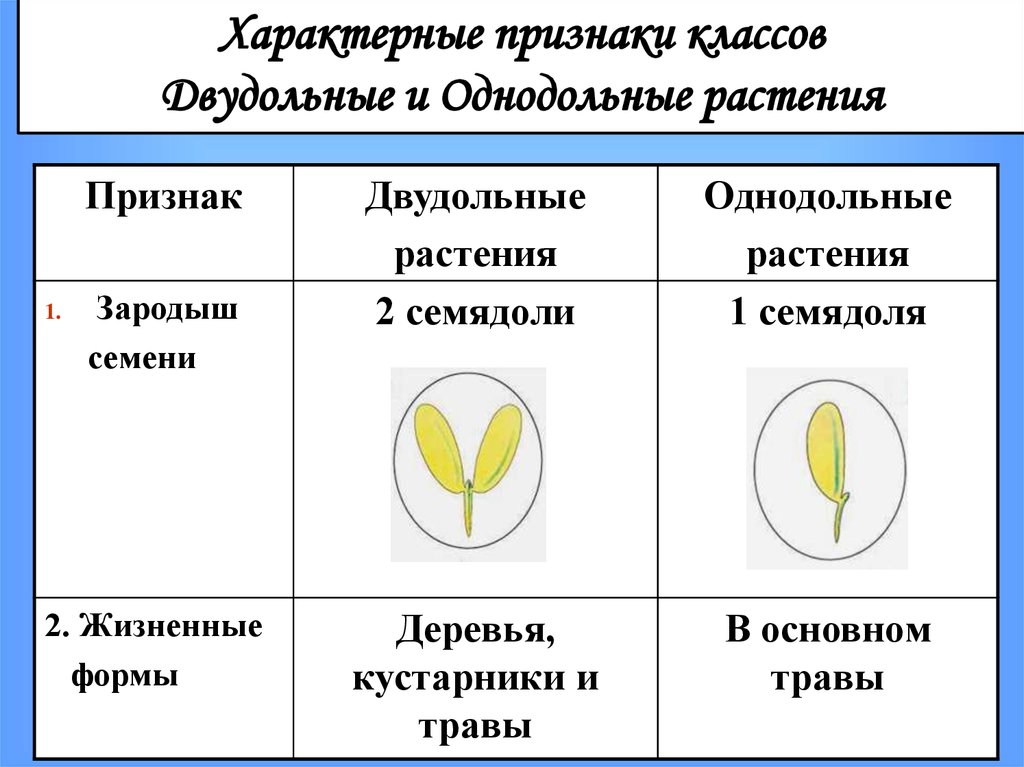 Он также образует арбускулярную микоризу, которая улучшает доступ к минеральным питательным веществам из почвы.
Он также образует арбускулярную микоризу, которая улучшает доступ к минеральным питательным веществам из почвы.
Нарциссы
Нарциссы или нарциссы — род весеннецветущих травянистых растений, принадлежащих к семейству амариллисовых, один из наиболее распространенных представителей однодольных растений. В этот род входит более 50 видов, все типичные однодольные.
Нарциссы с Викисклада
Подснежники
Подснежник — травянистое многолетнее однодольное цветущее растение, принадлежащее к семейству амариллисовых. Около 20 видов входят в род Galanthus. Galanthus nivalis — самый распространенный вид среди всех, встречающийся в основном в европейском регионе. Белый поникающий цветок со свободными долями околоцветника в двух мутовках между двумя линейными листьями вполне оправдывал название подснежника.
Подснежник из Wikimedia Commons
Кокосовые пальмы
Кокосовые пальмы принадлежат к семейству Arecaceae или семейству пальмовых.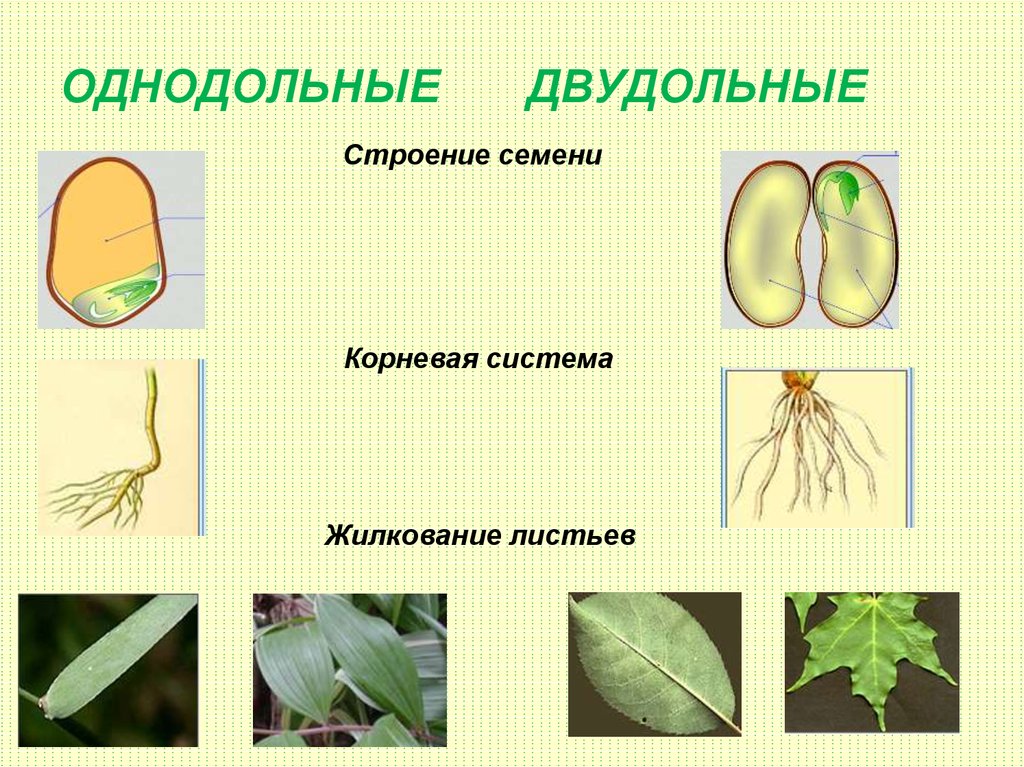 Как и другие пальмы, это однодольное растение без вторичного роста. Cocos nucifera — единственный живой вид рода Cocos. Он может плодоносить через шесть-десять лет и продолжаться до 15-20 лет. Он производит особый плод, называемый костянкой. Это однодомное растение, имеющее как мужские, так и женские цветки в соцветии.
Как и другие пальмы, это однодольное растение без вторичного роста. Cocos nucifera — единственный живой вид рода Cocos. Он может плодоносить через шесть-десять лет и продолжаться до 15-20 лет. Он производит особый плод, называемый костянкой. Это однодомное растение, имеющее как мужские, так и женские цветки в соцветии.
Ананас
Ананас – травянистое тропическое цветущее однодольное растение, принадлежащее к семейству Бромелиевых. Он производит до 200 цветков, чтобы плодоносить.
Пшеница
Пшеница является одним из наиболее распространенных представителей однодольных растений, принадлежащих к семейству Poaceae, что означает семейство злаковых. Обнаружено более 24 видов рода Titricum, из которых 95% Titricum aestivum производится во всем мире. В соцветии от 20 до 100 цветков. Цветы позже растут в виде колосков группами и образуют зерна.
Пшеница из Wikimedia Commons
Джовар
Джовар или сорго также является очень популярным зерновым видом, принадлежащим к семейству трав семейства Poaceae.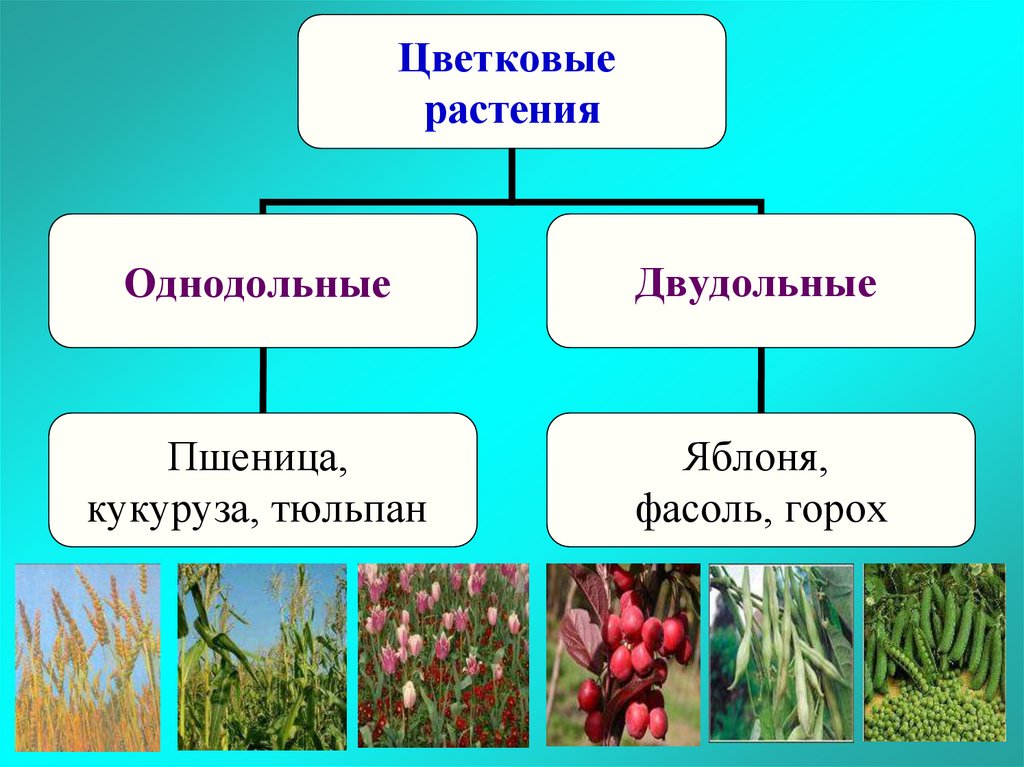 Обнаружено около 30 видов под родом сорго, и все они однодольные. Растение несет цветочные кисти с 800-3000 ядрами и дает семена.
Обнаружено около 30 видов под родом сорго, и все они однодольные. Растение несет цветочные кисти с 800-3000 ядрами и дает семена.
Ячмень
Ячмень или Hordeum vulgare — травянистое однодольное растение, принадлежащее к семейству злаковых Poaceae. Это самоопыляющийся вид с 14 хромосомами. Ячмень растет в основном в умеренном климате. Это одно из первых культурных злаков в мире. Ячмень в основном используется в качестве корма для животных. 30% зерна ячменя используется в процессе ферментации для производства пива и других напитков в нескольких странах.
Ячмень из Викисклада
Кукуруза
Кукуруза или кукуруза — травянистое растение, производящее зерновые, принадлежащее к семейству злаковых Poaceae. Есть три типа корней, которые возникают из семенных корней кукурузы, придаточных корней и опорных или опорных корней. Это однодомное растение, оба пола присутствуют, но разделены тычинкой (мужской цветок) и пестиком (женский цветок).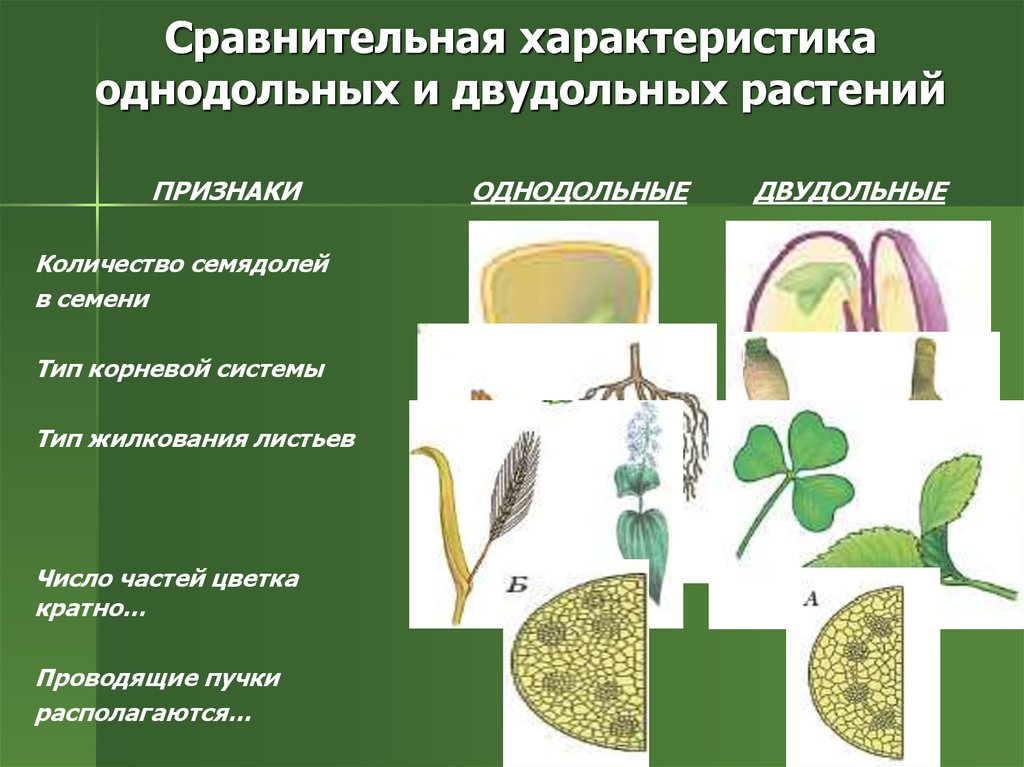 Мужской цветок созревает раньше, чем женский, и после созревания женского цветка через пестик образуется нитевидная структура, называемая шелком. Опыление происходит, когда новый влажный шелк захватывает пыльцевые зерна.
Мужской цветок созревает раньше, чем женский, и после созревания женского цветка через пестик образуется нитевидная структура, называемая шелком. Опыление происходит, когда новый влажный шелк захватывает пыльцевые зерна.
Рис
Рис или Oryza sativa является одним из наиболее культивируемых видов зерновых культур во всем мире. Он известен как обыкновенный рис или азиатский рис, принадлежащий к семейству злаковых Poaceae, обычно однодольных. Найдены два разных подвида. Это однолетняя трава, которая регулярно отмирает после образования зерен. Он содержит длинные, сплюснутые листья и мочковатую корневую систему. В соцветии есть колоски.
Рисовое растение с Викисклада
Лук репчатый
Луковое растение представляет собой травянистое луковичное двулетнее однодольное растение, принадлежащее к семейству амариллисовых. Обнаружено несколько видов лука, принадлежащих к роду Allium. Лук репчатый или Allium cepa является наиболее широко культивируемым видом лука. Луковые растения в основном выращивают в умеренном климате северного полушария. Это луковичное растение, имеющее настоящие луковицы на корневищах.
Луковые растения в основном выращивают в умеренном климате северного полушария. Это луковичное растение, имеющее настоящие луковицы на корневищах.
Спаржа
Спаржа или воробейник травянистое многолетнее однодольное растение относится к семейству Asparagaceae. Этот вид тесно связан с видами Allium. Обычно употребляют в пищу молодые побеги растения.
Примеры однодольных: Спаржа из Викисклада
Вот некоторые очень распространенные примеры однодольных. Все упомянутые примеры в основном встречаются в умеренном климате. Большинство растений регулярно умирают после того, как дают плоды, что обычно означает, что они имеют короткую продолжительность жизни.
У большинства однодольных растений корни не являются настоящими корнями, после прорастания растения стержневые корни обычно отмирают и оттуда вырастают мочковатые, широко распространенные придаточные корни.
У однодольных растений вторичный рост отсутствует, что означает невозможность увеличения своего диаметра за счет образования коры. Большинство видов травянистые, стебли растения отмирают каждый год и оттуда вырастают новые стебли.
Большинство видов травянистые, стебли растения отмирают каждый год и оттуда вырастают новые стебли.
У однодольных цветки обычно трехчленные, а зародыш имеет только одну семядолю в семени.
В целом можно сказать, что однодольные растения являются покрытосеменными растениями, имеющими в семени только одну семядолю. Существует несколько различных однодольных растений, в основном травянистые. Некоторые виды однодольных растений, в основном пальмы, являются самыми крупными среди всех. Здесь мы обсудим несколько примеров однодольных. Надеюсь, что эта статья об однодольных растениях будет вам полезна.
Нажмите, чтобы узнать больше о примерах двудольных.
Сорняки — проблема даже в саду с приподнятыми грядками — Maryland Grows
Мэриленд растет
В двух нижних средних квадратах моей грядки шпинат и листовой салат растут с прошлого месяца, но теперь кажется, что есть и нежелательные растения — сорняки! Всего за несколько коротких недель наш сад заполонили сорняки.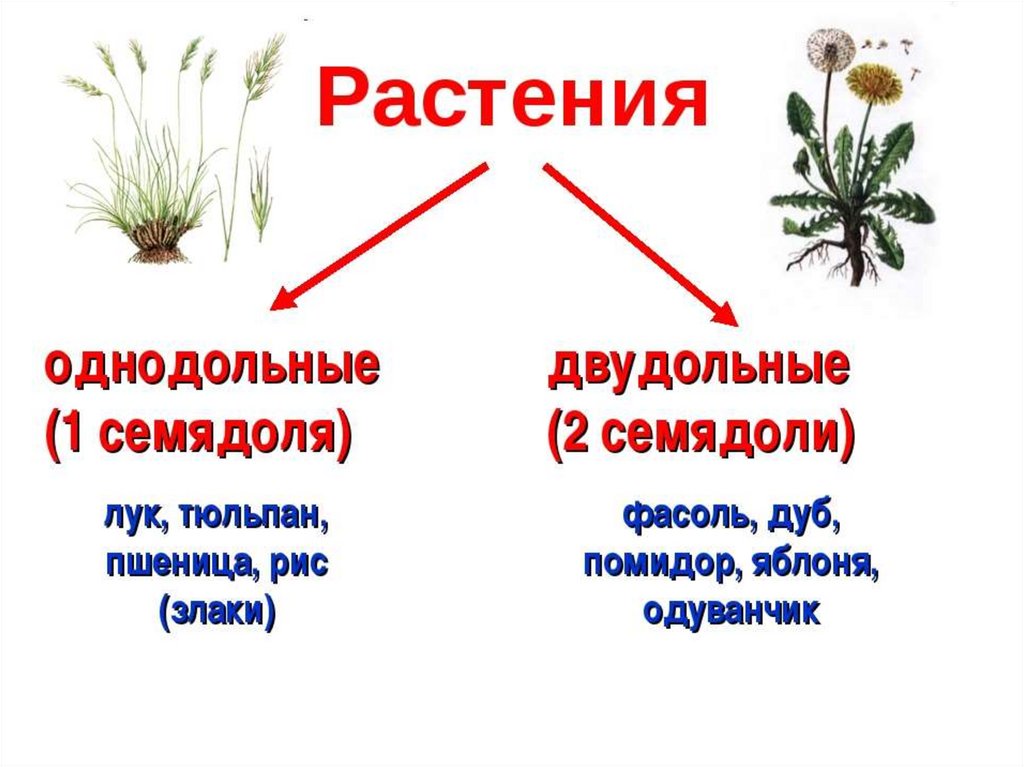 Семена сорняков были взяты из купленного мной верхнего слоя почвы. Сорняки — это проблема, если у вас есть сад любого размера, если только вы не используете новую, стерильную, беспочвенную среду для выращивания каждый сезон. Знание того, что вы посадили, действительно важно, чтобы вы могли следить за всходами и удалять только сорняки.
Семена сорняков были взяты из купленного мной верхнего слоя почвы. Сорняки — это проблема, если у вас есть сад любого размера, если только вы не используете новую, стерильную, беспочвенную среду для выращивания каждый сезон. Знание того, что вы посадили, действительно важно, чтобы вы могли следить за всходами и удалять только сорняки.
Листья сеянцев (семядоли) часто выглядят совершенно иначе, чем первые настоящие листья, которые появляются позже. Одна характеристика, которая может помочь вам выяснить, есть ли у вас сорняк или растение, которое вы хотите вырастить, — это посмотреть на количество листьев, которые прорастают из семени. Если растение имеет один сеянец, его называют однодольным (однодольным). Сюда входят такие растения, как лук, кукуруза и травы. Если растение имеет два листа сеянцев при прорастании, оно называется двудольным (двудольными) и включает такие растения, как помидоры, фасоль, картофель, шпинат и салат. Двудольные иногда называют широколиственными растениями.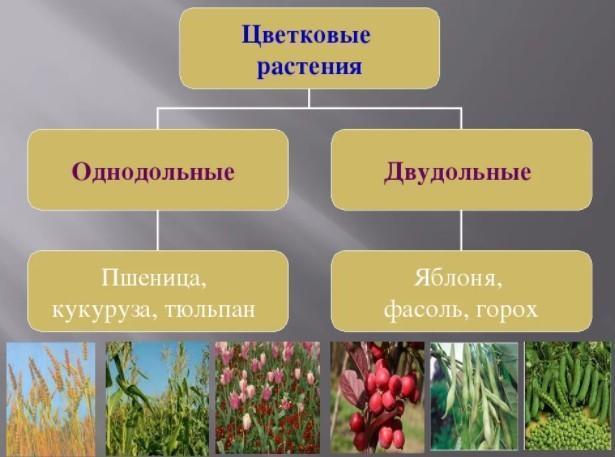 Во многих случаях селективные гербициды действуют либо на однодольные, либо на двудольные растения, но не на оба типа растений; именно это определяет, какое растение будет уничтожено гербицидом, а какое будет устойчивым. Неселективные гербициды убивают как однодольные, так и двудольные растения.
Во многих случаях селективные гербициды действуют либо на однодольные, либо на двудольные растения, но не на оба типа растений; именно это определяет, какое растение будет уничтожено гербицидом, а какое будет устойчивым. Неселективные гербициды убивают как однодольные, так и двудольные растения.
Иногда люди очень расстраиваются, когда я называю растение «сорняком». Пожалуйста, помните, что многие растения могут быть обозначены как сорняки. Простое определение — «растение, растущее там, где оно нежелательно». Таким образом, даже если сорняки могут иметь желаемые характеристики, когда это растение растет там, где оно нежелательно, это сорняк. Сорняки конкурируют за солнечный свет, воду, пространство и питательные вещества в саду, а некоторые из них могут стать переносчиками болезней и вредителей.
Как и в случае с большинством садовых работ, лучше всего решать проблему как можно раньше и чаще. Способность идентифицировать сорняки, когда они маленькие, — это один из навыков, который я продолжаю оттачивать каждый вегетационный период, и это требует практики и времени. Знание того, что вы посадили и где вы это посадили, является первым шагом к пониманию того, что может расти, а что нет. В Технологическом институте Вирджинии есть хорошее руководство по идентификации, которое позволяет вам отвечать на вопросы об образце и указывает на возможный ответ.
Знание того, что вы посадили и где вы это посадили, является первым шагом к пониманию того, что может расти, а что нет. В Технологическом институте Вирджинии есть хорошее руководство по идентификации, которое позволяет вам отвечать на вопросы об образце и указывает на возможный ответ.
Слева: рассада травы, пример однодольного растения. Справа: рассада амброзии, пример двудольного растения.
Примеры двудольных сорняков. Слева: Lambsquarter (большая и меньшая сцены). Справа: Smartweed (см. отпечаток большого пальца в центре листьев).
Я буду использовать механические методы борьбы (выдергивание вручную или небольшую ручную лопату для удаления сорняков), потому что это очень маленькая площадь.
В нашем коммерческом высотном туннеле мы используем физический барьер в качестве нашей первой линии защиты в борьбе с сорняками. Ветер может вызвать трудности с удержанием ландшафтной ткани на месте, но мы используем 6-8-дюймовые штифты для ландшафта, чтобы удерживать ее.
Здесь представлена информация об органической борьбе с сорняками.
На фото слева повреждения, какими они были утром после мороза. Справа: показано, как выглядят повреждения через неделю. Это не убило растения, но они будут спасены от мороза.
У нас были очень низкие температуры по ночам, что не редкость здесь, в горах. Наша ожидаемая безморозная дата — 5 июня, поэтому я с нетерпением жду возможности добавить овощи теплого сезона в ближайшие недели — помидоры, перец, стручковая фасоль и, возможно, тыква в нашем списке.
Прополка грядки
Эшли Бодкинс, старший помощник агента и главный координатор садовника, округ Гарретт, штат Мэриленд, под редакцией Кристы Кариньян, координатора Информационного центра по дому и саду, Расширенный университет Мэриленда. Другие сообщения от Эшли и Кристы.
Нравится:
Нравится Загрузка…
Мастер-садовникАвтор:Эшли, садоводство, овощи, сорняки
Категории
- Пищевое садоводство
- Мастер-садовник
- Двор и сад
Мы помогаем жителям Мэриленда развиваться! Изучите своевременные советы по уходу за газоном, декоративными растениями и огородами с советами экспертов Университета Мэриленда и сертифицированных садоводов.
Нажмите ниже, чтобы отправить нам свои вопросы:
Лучшее в сезоне
Еда Садоводство
Салат в разгар зимы
Домашний салат в разгар зимы или жара позднего лета? Можно с гидропоникой. И вам не нужна причудливая установка с электрическими насосами и системой циркуляции воды. Метод Kratky позволяет вам сделать это с помощью лампы для выращивания и пустой корзины для кофе. Разработано садоводом Бернардом А. Кратки из…
Продолжить чтение →
Нравится:
Нравится Загрузка…
Двор и сад
Варианты внутреннего освещения: термины, типы и размеры
Это третья статья из четырех статей о внутреннем освещении для растений. Вы также можете прочитать первую, вторую и четвертую статьи. Источники искусственного света бывают нескольких видов, и все их относительно легко приобрести. Затраты могут сильно различаться, и некоторые из них более энергоэффективны, чем другие. Разнообразие доступных опций позволяет…
Затраты могут сильно различаться, и некоторые из них более энергоэффективны, чем другие. Разнообразие доступных опций позволяет…
Продолжить чтение →
Нравится:
Нравится Загрузка…
Двор и сад
Январь Советы и задачи
Сильный снег и лед могут повредить кусты. Движением вверх осторожно сметайте снежные массы с кустов, чтобы предотвратить их поломку. Но часто согнутые или отягощенные ветки распрямляются после таяния снега/льда. Проблемные ветки деревьев (свисающие очень низко или поврежденные бурей) могут быть удалены по мере необходимости. Не нужно…
Читать далее →
Нравится:
Нравится Загрузка…
Следите за блогом по электронной почте
Введите свой адрес электронной почты, чтобы следить за этим блогом и получать уведомления о новых сообщениях по электронной почте.
Адрес электронной почты
Автор:Анаи
Автор:Аннет
Автор:Эшли
Автор:Криста
Автор: Дэн
Автор: Дэйв Клемент
Автор:Эрика
Автор:Джефф
Автор:Джон
Автор:Мири
пчелы
полезные насекомые
Изменение климата
Контейнерное садоводство
Осеннее садоводство
Продвигаемое Видео
Цветы
Еда Садоводство
Фрукты
Планирование сада
Вырасти, съешь
Комнатные растения
комнатные растения
Насекомые
инвазивные растения
ландшафтный дизайн
Лужайка
уход за газонами
Местные растения
перец
опыление
Опылители
семена
Начальное семя
Земля
Давить
Подкаст о садовом тимьяне
Советы
Советы и задачи
Помидоры
Деревья
деревья и кустарники
овощи
видео
Дикая природа
Архивы
Архивы
Выбрать месяц Январь 2023 Декабрь 2022 Ноябрь 2022 Октябрь 2022 Сентябрь 2022 Август 2022 Июль 2022 Июнь 2022 Май 2022 Апрель 2022 Март 2022 Февраль 2022 Январь 2022 Декабрь 2021 Ноябрь 2021 Октябрь 2021 Сентябрь 2021 Январь 2021 Декабрь 2020 Ноябрь 2020 Октябрь 2020 Сентябрь 2020 Август 2020 Июль 2020 Июнь 2020 Май 2020 Апрель 2020 Март 2020 Февраль 2020 Январь 2020 Декабрь 2019Ноябрь 2019 г.
