Содержание
Методы физиологии и биохимии растений и уровни исследовании
Физиология
растений — наука экспериментальная.
Основной метод познания в физиологии
— эксперимент,
опыт.
Она использует современные методы
химии,
физики, математики, кибернетики.
Для изучения физиологических и
биохимических процессов применяют
лабораторно-аналитический,
полевой
и вегетационный
методы исследований (в фитотронах
и лабораториях искусственного климата,
где растения выращивают в контролируемых,
заданные экспериментатором условиях:
температура, режим освещения, состав
воздуха и др.).
В
физиологических исследованиях чаще
используются физические и физико-химические
методы: меченых
атомов,
световой
и электронной,
ультрафиолетовой и люминесцентной
микроскопии,
электрофореза,
хроматографического
анализа, спектрометрии,
иммунологии,
кристаллографии.
Современная
физиология растений все больше сближается
с физико-химической биологией. Вместе
с тем она имеет специфические,
свойственные только этой науке методы
исследований: методы
водных
и песчаных
культур, биотестов,
исследования фотопериодизма,
системы
красный-дальний красный,
культуры
клеток и тканей
и др.
Изолированная
клетка — незаменимый объект исследований
фундаментальных основ физиологии
растений, а также клеточной биотехнологии
и биоинженерии растений.
Господствующим
принципом
физиологических исследований является
принцип причинности,
используются аналитический
и синтетический подходы
в познании явлений жизни растения.
Физиологи разрабатывают математические
модели
физиологических процессов, которые
экспериментально проверяются. Многие
физиологи в работах применяют
диалектический
метод,
исторический
подход
к изучению функции растительного
организма.
С
помощью всех этих методов физиологи
исследуют процессы жизнедеятельности
растений на
различных уровнях
организации. На молекулярном
уровне изучают функции НК, белков и
других веществ, на клеточном
и субклеточном
— функции клеток и её органел, на органном
— функции листа, стебля, корня и т.д., на
организменном
— функции целого интактного растения,
на популяционном
— функции вида и сорта растения, на
полевом
(ценотическом)- функции фито- и
агрофитоценозов, на биогеохимическом
— системы растение-почва и глобальные
процессы в биосфере Земли.
Биохимия
в своем развитии опирается на успехи
биологической науки, на новейшие
достижения химии и физики, использует
их новые методы. Методы биохимических
исследований являются важным звеном в
оценке химического состава и биохимических
особенностей растений.
|
У
биохимии выработались и свои специфические
методы исследования, которые существенно
отличаются от обычных химических или
физико-химических методов:
26.2.17
Методы физиологии растений
Физиология
растений относится к числу экспериментальных
наук. Экспериментом
в физиологии
называют изучение физиологического
явления в искусственно создаваемых
условиях. При этом может изучаться либо
отдельная функция (фотосинтез, дыхание
и т.д.), либо воздействие отдельного
фактора на комплекс функций, или влияние
комплекса воздействий на жизнедеятельность
растения в целом (например, антропогенные
воздействия).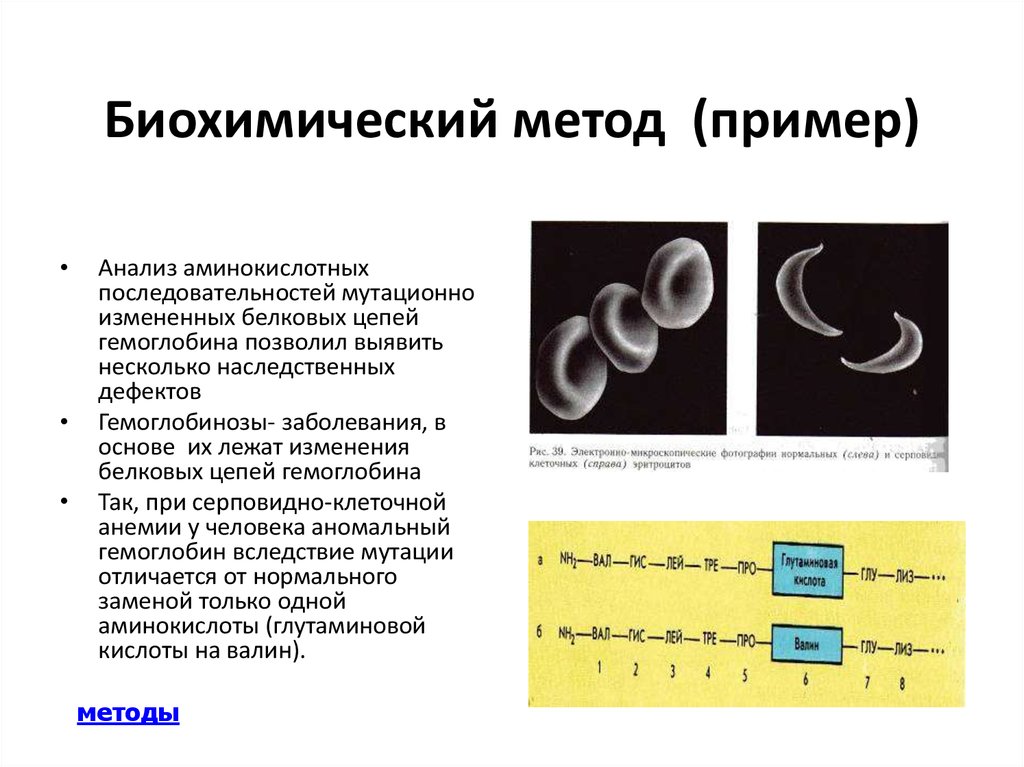 Опыты могут быть лабораторными
Опыты могут быть лабораторными
и полевыми.
Лабораторные
эксперименты позволяют глубоко
исследовать явления, происходящие на
клеточном субклеточном и молекулярном
уровнях.
К современным
приемам и методам исследования относятся:
Световая
микроскопия
– приготовление тонких окрашенных
срезов (разрешающая способность – 0,2
мкм х 2000 раз).
Электронная
микроскопия –
обычные приемы – фиксация быстрым
замораживанием, скол и травление
напылением ионов тяжелых металлов
(500-800 А˚, — обычно рассматриваемые объекты,
разрешающая способность 3-10 А˚, увеличение
1000000 раз).
Разрешающая
способность светового микроскопа
ограничена длиной световых волн.
Максимально возможное разрешение равно
½ λ используемого света. Средняя λ
видимого света составляет примерно 550
км, поэтому удавалось получить разрешение
примерно в 200 км. Однако многие клеточные
структуры имеют меньший размер. Эта
Эта
проблема была разрешена в 30-40 годы, когда
создание электронного микроскопа
произвело революцию в биологической
науке. Вместо света в электронном
микроскопе используют пучок электронов,
у которых λ значительно меньше,
следовательно разрешительная способность
больше, примерно в 500 раз больше.
Подготовка материала
к исследованию включает следующие
приемы:
Срезы готовятся
на ультратоме окрашиваются соединениями
тяжелых металлов. Окрашенные участки
становятся непроницаемыми и на
микрофотографиях они выглядят темными.Напыление. Образец
бомбардируется атомами тяжелых металлов,
например золотом или платиной, под
определенным углом. Закрытые площади
+ «тень» за образцом остаются прозрачными
для электронов.Замораживание –
скалывание и замораживание – травление.
Фрагмент ткани
быстро замораживается при очень низкой
температуре и затем разламывается с
помощью острого металлического лезвия.
Ткань растрескивается вдоль слабо
соединенных плоскостей. В вакууме лед
возгоняется, оставляя сколотую
поверхность. Реплика этой поверхности
создается слоем углерода. На эту реплику
из углерода напыляется тяжелый металл,
а также под репликой разрушаются
кислотой. Этот метод удобен при изучении
структуры мембран. Его преимущество
состоит в том, что ткани быстро
умерщвляются, не подвергаясь химической
обработке, которая может повлиять на
их структуру.
Дифференциальное
центрифугирование.
Широко используют для исследования
биохимических и физиологических
механизмов работы клетки. При этом
клеточные фракции сохраняют свою
морфологическую и функциональную
целостность.
Хроматография
– разделение
веществ /бумажная, колоночная/.
Метод хроматографии
впервые предложен русским ученым Цветом
в 1906 году и сейчас широко используется.
Хроматография –
это метод, применяемый для разделения
различных смесей на составляющие их
компоненты. Метод основан на том, что в
Метод основан на том, что в
неподвижной среде, через которую
протекает растворитель, каждый из
компонентов, увлекаемых растворителем,
движется со своей собственной скоростью
независимо от других.
В качестве
неподвижной среды /адсорбента/ могут
быть использованы различные вещества:
сахароза, окись магния, крахмал, стекло,
бумага и т.д. Подвижность вещества
зависит от его растворимости в
растворителе, пропускаемом через
адсорбент и адсорбируемости на данном
адсорбенте. Чем выше растворимость
вещества в растворителе, тем хуже он
адсорбируется на адсорбенте, тем больше
его подвижность. Применяя разные
комбинации растворителей и адсорбенты
различной природы, можно добиться
высокой степени разделения.
Метод
меченых атомов
– введение радиоактивной метки и
обнаружение ее при помощи массспектрометра.
Вегетационный
опыт –
опыт, проводимый в сосудах, где
экспериментатор дозирует и контролирует
количество питательной среды для
выращивания растений, ее качественный
или количественный состав и т. д. Если
д. Если
опыт ведется в теплице, то регулированию
поддается свет и температура.
Вегетационные
опыты позволяют установить закономерности
роста и развития растений от изучаемого
фактора.
Полевой
опыт –
ведется в полевых условиях (природных).
Ввиду пестроты природных условий:
неоднородность почвы, склоны, вредители,
осадки и т.д. – точность полевого опыта
значительно меньшая.
Методы исследования в физиологии растений I
Недели 1 и 2. Культура растений – упражнения по минеральному питанию растений
Лекция: Методы культивирования растений, питательные растворы, установка гидропонных культур. Камеры выращивания растений с климат-контролем, настройка параметров.
Практические: Проращивание опытных растений (определение % всхожести), посадка и рост (измерение рН, параметров роста — свежий и сухой вес). (Необязательные темы: Влияние незаменимых и токсичных элементов, дефицитных растворов и ингибирующих концентраций. Роль питания железом и влияние хелатирующих агентов. Влияние форм азота на растения.)
Роль питания железом и влияние хелатирующих агентов. Влияние форм азота на растения.)
Неделя 3. Занятия по газообмену растений
Порометрия: принцип измерения, устройство порометра Дельта-Т, измеряемые параметры (сопротивление, электропроводность, скорость газового потока), методы измерения. Связь между устьичной проводимостью и транспирацией. Измерение транспирации у подопытных растений. Инфракрасный газовый анализ: принцип измерения, устройство прибора и измерительных ячеек, методы измерения. Измерение фиксации СО2 подопытными растениями при разной интенсивности света.
Неделя 4. Флуоресцентная микроскопия
Лекция: Определение флуоресценции и хемилюминесценции. Явления люминесценции в природе. Использование люминесценции в биохимии. Характеристики наиболее важных флуорофоров. Применение флуорофоров для маркировки ядра, мембран и органелл, нуклеиновых кислот, окрашивания in vivo, обнаружения металлов (Са) и тяжелых металлов, измерения окислительно-восстановительного потенциала и рН. Принцип работы люминесцентного микроскопа.
Принцип работы люминесцентного микроскопа.
Практические: Изучение движения воды в растениях с помощью сульфата берберина. Обработанные контролем или ингибитором, вырезанные или интактные проростки пшеницы разного возраста, выращенные в гидропонике, помещают в раствор сульфата берберина на разное время. Изучая микроскопическую картину ксилемы, определяют и интерпретируют скорость движения воды в по-разному обработанных проростках.
Неделя 5. Измерения дыхания и фотосинтеза электродом О2
Лекция: Обзор физиологических процессов производства и потребления кислорода. Методы и оборудование для измерения образования и потребления кислорода в биологических системах. Теория электродных измерений О2. Установка и эксплуатация различных типов электродов O2. Электрод O2 типа Кларка. Базовые приготовления. Условия измерения. Возможные ошибки. Оценка результатов.
Практические: Демонстрация различных типов электродов O2. Основные части электрода O2 типа Кларка (Hansatech) и его дополнения. Компьютерная программа для оценки измерений. Процесс калибровки электрода O2. Подготовка образцов для измерения in vivo частоты дыхания и фотосинтетического выделения кислорода. In vitro измерение выделения кислорода в суспензии хлоропластов. Измерение скорости дыхания и фотосинтетического выделения кислорода в образцах, обработанных по-разному. Оценка результатов.
Компьютерная программа для оценки измерений. Процесс калибровки электрода O2. Подготовка образцов для измерения in vivo частоты дыхания и фотосинтетического выделения кислорода. In vitro измерение выделения кислорода в суспензии хлоропластов. Измерение скорости дыхания и фотосинтетического выделения кислорода в образцах, обработанных по-разному. Оценка результатов.
Неделя 6. Методы индукции флуоресценции и визуализации флуоресценции
Лекция: Связь флуоресценции и фотосинтеза. Феномен индукции флуоресценции. Связь быстрой и медленной фаз индукции флуоресценции с процессами фотосинтеза. Измерение индукции флуоресценции с помощью флуорометра PAM. Физиологическое значение важнейших параметров индукции флуоресценции. Механизмы тушения флуоресценции. Применение флуоресцентной визуализации для обнаружения стресса у растений.
Практическое занятие I. Изменение параметров тушения растений при различных абиотических/биотических стрессах.
Практическое занятие II: Измерение флуоресценции 440, 520, 690 и 740 нм, испускаемой листьями или другими органами растений, и диагностическая оценка данных флуоресцентной визуализации.
Недели с 7 по 10. Идентификация сортов пшеницы при изучении генов запасных белков с помощью ПЦР
Лекция: Теория и практика применения ПЦР для селекции на основе маркеров. Общие принципы планирования праймеров, праймеры, подходящие для отслеживания точечных мутаций (SNP), делеций и вставок.
Практические: экстракция ДНК из зерен и листьев различных сортов пшеницы. Измерение концентрации ДНК и проверка чистоты экстракта. Контроль качества ДНК осуществляется по внутреннему стандарту: приготовление реакционной смеси для ПЦР, проведение реакции и разделение продуктов электрофорезом в агарозном геле. Определение состава дрожжевых белков пшеницы по ПЦР-маркерам: приготовление ПЦР-реакционной смеси для внутреннего стандарта, проведение реакции и разделение продуктов электрофорезом в агарозном геле. Используемые маркеры известны из литературы. Они подходят для идентификации разновидностей, а также для поиска SNP, делеций и вставок. Оценка результатов.
Неделя 11. Разделение белковых комплексов центрифугированием в градиенте плотности
Разделение белковых комплексов центрифугированием в градиенте плотности
Лекция: Принципы центрифугирования. Методы центрифугирования: дифференциальное центрифугирование, центрифугирование в градиенте плотности (зонально-скоростное, изопикническое центрифугирование). Свойства и использование градиентных материалов. Типы и применение центрифуг, роторов. Методы приготовления градиентов. Образец заявления. Извлечение фракций из градиента.
Практические: Разделение тилакоидных комплексов центрифугированием в градиенте плотности сахарозы. Солюбилизация изолированных тилакоидов. Приготовление градиента, нанесение образцов, центрифугирование на ультрацентрифуге. Экстракция разделенных фракций. Характеристика комплексов по соотношению хлорофиллов а/б.
Неделя 12. Разделение регуляторов роста растений (PGR-s) с помощью ВЭЖХ
Лекция: Методика ВЭЖХ, применение для разделения растительных метаболитов.
Практические: Сравнение содержания цитокининов в разных органах растений разного возраста. Экстракция в буфере метанол:вода:муравьиная кислота, предварительное разделение на твердофазной колонке Baker, фильтрация на мембране Durapore (0,45) и разделение на колонке Hypersil Elite C18 с градиентным элюированием (метанол:вода). Содержание PGR измеряют по УФ-поглощению (275 нм) и рассчитывают по калибровочной кривой (стандарты: транс-зеатин, транс-зеатинрибозид, изопентениладенозин).
Экстракция в буфере метанол:вода:муравьиная кислота, предварительное разделение на твердофазной колонке Baker, фильтрация на мембране Durapore (0,45) и разделение на колонке Hypersil Elite C18 с градиентным элюированием (метанол:вода). Содержание PGR измеряют по УФ-поглощению (275 нм) и рассчитывают по калибровочной кривой (стандарты: транс-зеатин, транс-зеатинрибозид, изопентениладенозин).
Недели 13 и 14. Выделение РНК из растений и изучение трансляции in vitro
Лекция: Методы выделения РНК, особенности процедуры выделения растительной РНК. Условия, необходимые для работы бесклеточной системы синтеза белка.
Практические: Выделение тотальной РНК из растений, обработанных по-разному: этиолированных и освещенных в разные периоды времени. Очистка экстракта, удаление полисахаридных загрязнений. Выделение низкомолекулярной фракции РНК. Проверка чистоты экстрактов.
Настройка системы трансляции in vitro. Выделение полисомной фракции. Приготовление реакционной смеси различных фракций тРНК и радиоактивных аминокислот. Обнаружение меченых белков методом жидкостной сцинтилляции.
Обнаружение меченых белков методом жидкостной сцинтилляции.
Физиология и биохимия растений и сельскохозяйственных культур
Содействие устойчивому производству сельскохозяйственных культур, повышение продуктивности и качества растений, сокращение послеуборочных потерь, понимание того, как растения чувствуют и реагируют на абиотический стресс, изучение разнообразия специализированного метаболизма растений и понимание фундаментальных механизмов роста и развитие
Перейти к: Преподаватели Карьера Информационная работа
Интерес и опыт преподавателей
Корнелиус Бэрри
доцент
Биохимическая эволюция специализированного метаболизма в семействе Solanaceae; Генетические детерминанты качества плодов и созревания
barrycs@msu. edu
edu
(517) 884-6959Рэнди Бодри
Профессор
Послеуборочная биология и технология; хранение семечковых фруктов в контролируемой атмосфере, упаковка в модифицированной атмосфере; хранение сахарной свеклы, биология созревания и биохимия летучих ароматов.
[email protected]
(517) 353-0303Дэниел Брейнард
Профессор
Развитие малопахотных, интенсивных систем овощеводства с покровными культурами; экология сорняков и борьба с ними, с акцентом на биологию семян
brainar9@msu. edu
edu
517-353-0417Берт Крегг
Профессор
Физиология и управление деревьями в ландшафтах и питомниках
[email protected]
517-353-0335Тодд Эйнхорн
Доцент
Физиология плодов деревьев, отношения между растениями и водой, биология подвоя, регуляция роста растений
einhornt@msu. edu
edu
(517) 353-0430Том Фернандес, доктор философии.
Профессор
Устойчивое развитие оптовых питомников, управление водными ресурсами и качество
[email protected]
517-353-0336Ребекка Грумет
Профессор
Репродуктивное развитие Cucumis; регуляция сексуального выражения; устойчивость к болезням; биотехнология биобезопасность; геномика тыквы.
[email protected]
517-353-0431Кён-Хван Хан
Профессор
Молекулярная биология вторичного роста; биосинтез вторичной стенки; разработка сырья для биоэнергетики и биоматериалов; засухоустойчивость
[email protected]
517-803-9418Кортни Холлендер
Доцент
Молекулярная генетика, развитие растений, физиология плодовых деревьев
chollend@msu. edu
edu
(517) 353-0446Нин Цзян
Профессор
Функция мобильных элементов; механизмы диверсификации генома; вычислительная и молекулярная биология.
[email protected]
517-353-0381Муралидхаран Наир
Профессор
Биоактивные натуральные продукты: функциональные продукты и фитоцевтики. Открытие, выделение, очистка, идентификация и стандартизация биоактивных молекул; оценка эффективности, дозы и токсичности; разработка рецептуры и процесса.
Открытие, выделение, очистка, идентификация и стандартизация биоактивных молекул; оценка эффективности, дозы и токсичности; разработка рецептуры и процесса.
[email protected]
(517) 353-0406Эрик Ранкл
Профессор
Освещение в теплицах и закрытых вертикальных фермах; светодиоды; энергосбережение теплиц; растениеводство в контролируемых условиях
runkleer@msu. edu
edu
(517) 353-0350Паоло Саббатини
Профессор
физиология виноградной лозы; фотосинтетическая ассимиляция и разделение углерода; виноградарство; оценка сорта Мичигана.
[email protected]
(517) 353-0302Песня Го-Цин
Профессор
Улучшение садовых растений с использованием геномных, генетических и биотехнологических инструментов; генетическая трансформация, редактирование генов.
[email protected]
(517) 353-0384Стив ван Нокер
Профессор
Генетика развития растений, признаки, важные для производства, включая цветение, хроматиновая регуляция экспрессии генов
[email protected]
(517) 353-0394Райан Уорнер
доцент
генетика развития растений; разведение с помощью геномики; выбор с помощью маркера; цветочные культуры.
[email protected]
(517) 353-0344
Помещения
Учебные садоводческие теплицы
1066 Bogue St East Lansing, MI 48824Эти стеклянные теплицы используются в основном для обучения садоводству.
Теплицы для растений
1059 Фарм Лн
Ист-Лансинг, Мичиган 48824Расположенные недалеко от угла Farm Ln и Wilson Rd, теплицы для растениеводства используются факультетом садоводства, а также другими отделами для исследований в области растениеводства.

Центр поддержки исследовательских технологий
612 Wilson Road S-20 East Lansing, MI 48824Центр поддержки научно-исследовательских технологий Мичиганского государственного университета представляет собой набор из пяти аналитических объектов, которые предоставляют основные инструменты для современных исследований в области наук о жизни.
Центр ресурсов и информационно-просветительской работы по биотехнологии растений
1066 Bogue St East Lansing, MI 48824PBROC занимается безопасным внедрением достижений в области биотехнологии растений в Мичигане и во всем мире.



 edu
edu  edu
edu  edu
edu 
 edu
edu  Открытие, выделение, очистка, идентификация и стандартизация биоактивных молекул; оценка эффективности, дозы и токсичности; разработка рецептуры и процесса.
Открытие, выделение, очистка, идентификация и стандартизация биоактивных молекул; оценка эффективности, дозы и токсичности; разработка рецептуры и процесса.  edu
edu 


