Содержание
Суточные и сезонные изменения фотосинтеза. Фотосинтез, рост и продуктивность растений — Студопедия
Ранним утром фотосинтез идет слабо вследствие небольшой интенсивности света и низкой температуры. При повышении интенсивности света, нагревании воздуха устьица открываются, фотосинтез начинает быстро увеличиваться и может достичь максимума до полудня. Часто вслед за максимумом наступает полуденное понижение. Полуденная депрессия нередко сменяется новым повышением фотосинтеза в более поздние послеполуденные часы, а затем окончательно снижается.. Вследствие изменений условий внешней среды в разные дни и в пределах одного дня дневной ход фотосинтеза часто значительно отклоняется от описанного выше.
Причины дневных изменений фотосинтеза. Регуляция дневного хода фотосинтеза под влиянием разнообразных внешних и внутренних факторов очень сложна. Главными из внешних факторов являются, по-видимому, свет, температура, наличие воды, содержание СО2 в воздухе и различные взаимодействия между ними. Внутреннюю регуляцию поглощения СО2 относили за счет разных причин: водного стресса, закрывания устьиц, чрезмерного дыхания, накопления конечных продуктов фотосинтеза и фотоокисления ферментов.
Внутреннюю регуляцию поглощения СО2 относили за счет разных причин: водного стресса, закрывания устьиц, чрезмерного дыхания, накопления конечных продуктов фотосинтеза и фотоокисления ферментов.
Сезонные изменения
Сезонные изменения фотосинтетической способности у голосеменных происходят более постепенно, чем у листопадных покрытосеменных. Когда температура весной повышается и ночные заморозки становятся менее частыми, фотосинтетическая способность голосеменных постепенно увеличивается. Осенью интенсивность фотосинтеза также постепенно понижается. У листопадных покрытосеменных фотосинтез быстро ускоряется весной, когда деревья вновь покрываются листвой, остается высоким в течение лета, быстро уменьшается в конце лета, когда листья стареют, и окончательно падает до нуля, когда они опадают. Сезонные изменения фотосинтетической способности различаются у видов с разным характером развития листьев. Следовательно, сезонные изменения фотосинтетической способности происходят при изменении площади листьев.
Фотосинтез, рост и продуктивность растений
Взаимоотношения роста растений и интенсивности фотосинтеза отражают непрерывную перестройку фотосинтетического аппарата в ходе онтогенеза и динамику формирования и активности растущих (аттрагирующих) органов, потребляющих ассимиляты. Начальный этап развития листа осуществляется за счет деления и роста клеток, а затем — лишь путем растяжения. За это время делятся и развиваются хлоропласты, число которых увеличивается, пока растет объем клетки. Новообразование хлоропластов завершается довольно рано, но рост клеток опережает увеличение числа хлоропластов. Однако содержание хлорофилла в хлоропласте продолжает увеличиваться и после достижения хлоропластом наибольшей величины. Максимальная интенсивность фотосинтеза наблюдается во время роста клеток листа растяжением и начинает несколько снижаться. Затем процесс фотосинтеза может уменьшаться с возрастом листа.
На ранних этапах роста лист сам потребляет ассимиляты из более зрелых листьев или из запасающих тканей. По мере роста листа усиливается транспорт ассимилятов из него в другие листья и органы и постепенно лист становится донором ассимилятов. Взрослые листья отдают свои ассимиляты в аттрагирующие зоны растения, оставляя на собственные нужды 10—40% ассимйлятов и почти не обмениваясь между собой продуктами фотосинтеза. Последнее явление, названное «суровым законом», способствует лучшему распределению ассимилятов в целом растении. Стареющие листья со слабой фотосинтетической активностью отдают другим органам не только ассимиляты, но и продукты распада структур цитоплазмы.
По мере роста листа усиливается транспорт ассимилятов из него в другие листья и органы и постепенно лист становится донором ассимилятов. Взрослые листья отдают свои ассимиляты в аттрагирующие зоны растения, оставляя на собственные нужды 10—40% ассимйлятов и почти не обмениваясь между собой продуктами фотосинтеза. Последнее явление, названное «суровым законом», способствует лучшему распределению ассимилятов в целом растении. Стареющие листья со слабой фотосинтетической активностью отдают другим органам не только ассимиляты, но и продукты распада структур цитоплазмы.
| ||||||||||
| ||||||||||
| ||||||||||
| ||||||||||
| © 2006-2022 Издательство ГРАМОТА разработка и создание сайта, поисковая оптимизация: | ||||||||||
Решения для фотосинтеза для повышения продуктивности
Philos Trans R Soc Lond B Biol Sci. 2017 26 сентября; 372 (1730): 20160374.
Опубликовано онлайн 2017 август 14. DOI: 10.1098/rstb.2016.0374
, 1 , 2 и 3
Информация о сообщении. Примечания Copyright и лицензия.
Представление о том, что фотосинтез является крайне неэффективным процессом с точки зрения преобразования световой энергии в биомассу, широко распространено в литературе. Только в последнее десятилетие процессы, ограничивающие эффективность фотосинтеза, были поняты до такой степени, что это позволило резко изменить нашу способность манипулировать ассимиляцией световой энергии в прирост углерода. Таким образом, мы можем предположить, что будущее увеличение потенциальной урожайности зерна наших основных культур может в значительной степени зависеть от повышения эффективности фотосинтеза. Статьи в этом выпуске дают новое представление о природе текущих ограничений фотосинтеза и определяют новые цели, которые можно использовать для улучшения сельскохозяйственных культур, а также информацию о влиянии изменения окружающей среды на продуктивность фотосинтеза на суше и в наших океанах.
Статьи в этом выпуске дают новое представление о природе текущих ограничений фотосинтеза и определяют новые цели, которые можно использовать для улучшения сельскохозяйственных культур, а также информацию о влиянии изменения окружающей среды на продуктивность фотосинтеза на суше и в наших океанах.
Эта статья является частью тематического выпуска «Усиление фотосинтеза у сельскохозяйственных культур: цели для улучшения».
Ключевые слова: Цикл Кальвина-Бенсона, улучшение урожая, нефотохимическое тушение, фитопланктон, эффективность фотосинтеза, фотосистема II из воды. Значительный прогресс был достигнут в нашем понимании функционального действия фотосинтеза за последние 50 лет, особенно с точки зрения наших знаний о молекулярной физиологии путей компонентов и экологии фотосинтеза в мире, где атмосфера становится все более обогащенной. углекислый газ [1–5]. Несмотря на огромное количество данных исследований атмосферного CO 2 обогащения, подчеркивая тесную связь между увеличением фотосинтеза и урожайностью, применение наших знаний о механизмах фотосинтеза до недавнего времени было в значительной степени безуспешным. Раннее предположение о том, что отбор на основе фотосинтеза приведет к повышению продуктивности сельскохозяйственных культур, потерпело неудачу и разочарование. Хотя за последнее столетие благодаря применению знаний в области селекции растений и генетических манипуляций урожайность зерновых увеличилась почти вдвое, скорость фотосинтеза на единицу площади листа не изменилась.
Раннее предположение о том, что отбор на основе фотосинтеза приведет к повышению продуктивности сельскохозяйственных культур, потерпело неудачу и разочарование. Хотя за последнее столетие благодаря применению знаний в области селекции растений и генетических манипуляций урожайность зерновых увеличилась почти вдвое, скорость фотосинтеза на единицу площади листа не изменилась.
Эволюция увлекла и усовершенствовала фотосинтез для обеспечения высокой продуктивности в природных средах с ограниченными ресурсами. Учитывая сидячий характер наземных растений, который требует высокого уровня стабилизации метаболизма в сильно изменчивой среде, процессы фотосинтеза стали очень пластичными и гибкими за счет эффективности. Движущей силой фотосинтеза, солнечным светом, является почти безграничный запас по сравнению с сахарами и углеродными скелетами, которые управляют дыханием. Следовательно, процессы, лежащие в основе сохранения энергии в первом, гораздо менее строгие в первом, чем во втором. Более того, механизмы рассеивания энергии присущи процессу сбора света, связанному с переносом электронов при фотосинтезе, что позволяет эффективно защищать от избыточного излучения. Повышение эффективности фотосинтеза в настоящее время, по-видимому, открывает большие возможности для достижения устойчивого повышения урожайности, необходимого для удовлетворения будущих потребностей в продуктах питания. Статьи в этом томе не только представляют собой обзор механизмов фотосинтеза и их регуляции, но также предназначены для обсуждения того, как можно развить более эффективный фотосинтез у сельскохозяйственных культур для повышения как урожайности сельскохозяйственных культур, так и их питательной ценности.
Более того, механизмы рассеивания энергии присущи процессу сбора света, связанному с переносом электронов при фотосинтезе, что позволяет эффективно защищать от избыточного излучения. Повышение эффективности фотосинтеза в настоящее время, по-видимому, открывает большие возможности для достижения устойчивого повышения урожайности, необходимого для удовлетворения будущих потребностей в продуктах питания. Статьи в этом томе не только представляют собой обзор механизмов фотосинтеза и их регуляции, но также предназначены для обсуждения того, как можно развить более эффективный фотосинтез у сельскохозяйственных культур для повышения как урожайности сельскохозяйственных культур, так и их питательной ценности.
Когда хлоропласты произошли от цианобактерий посредством эндосимбиоза, они привнесли фотосинтез в эукариотические клетки. Помимо множества преимуществ, это включение принесло опасности, связанные с преобразованием энергии с помощью фотонов и транспортом электронов, а также регуляцией восстановления / окисления (окислительно-восстановительного потенциала) и передачей сигналов. Недавнее исследование протеома диатомей Phaeodactylum tricornutum позволяет предположить, что внедрение фотосинтетической электрон-транспортной цепи в фотосинтез сопровождалось увеличением остатков цистеина в белках, реагирующих на физиологическое состояние клетки [6]. Наличие фотосинтеза вызывает значительное увеличение производства активных форм кислорода (АФК), вызывая значительное расширение окислительно-восстановительного протеома, давая окислительно-восстановительным регуляторным сетям возможность справляться с колебаниями условий окружающей среды. Более того, высокое содержание цистеина в протеоме диатомовых водорослей может позволить клетке лучше контролировать фотосинтетический поток электронов в присутствии молекулярного кислорода и, таким образом, предотвратить чрезмерное окисление [7]. В этом томе Фальковский и др. . [8] обсуждают, как можно повысить эффективность фотосинтеза в океанах. Показано, что сообщество фитопланктона работает только с половинной максимальной эффективностью преобразования энергии фотосинтеза из-за плохой доступности питательных веществ, которая ограничивает синтез или функцию основных компонентов фотосинтетического аппарата.
Недавнее исследование протеома диатомей Phaeodactylum tricornutum позволяет предположить, что внедрение фотосинтетической электрон-транспортной цепи в фотосинтез сопровождалось увеличением остатков цистеина в белках, реагирующих на физиологическое состояние клетки [6]. Наличие фотосинтеза вызывает значительное увеличение производства активных форм кислорода (АФК), вызывая значительное расширение окислительно-восстановительного протеома, давая окислительно-восстановительным регуляторным сетям возможность справляться с колебаниями условий окружающей среды. Более того, высокое содержание цистеина в протеоме диатомовых водорослей может позволить клетке лучше контролировать фотосинтетический поток электронов в присутствии молекулярного кислорода и, таким образом, предотвратить чрезмерное окисление [7]. В этом томе Фальковский и др. . [8] обсуждают, как можно повысить эффективность фотосинтеза в океанах. Показано, что сообщество фитопланктона работает только с половинной максимальной эффективностью преобразования энергии фотосинтеза из-за плохой доступности питательных веществ, которая ограничивает синтез или функцию основных компонентов фотосинтетического аппарата.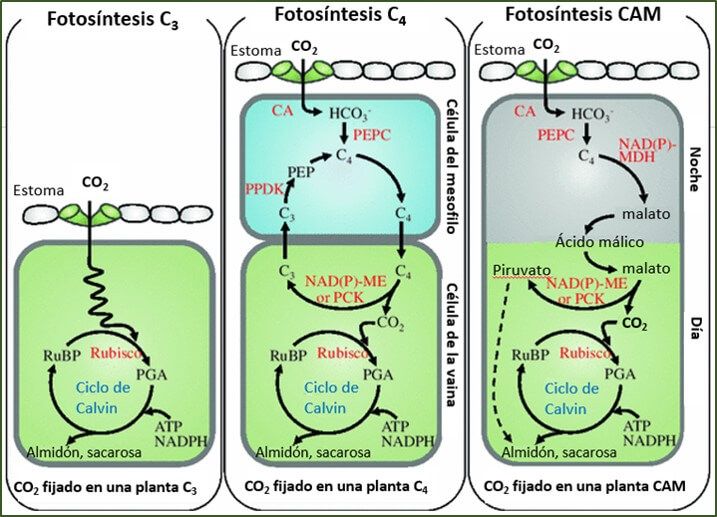 Внутренние фотозащитные механизмы, которые действуют в реакционных центрах фотосинтетической бактерии Rhodobacter sphaeroides , предотвращая образование долгоживущих триплетных или синглетных возбужденных электронных состояний при флуктуирующих условиях окружающей среды, были проанализированы Ма и др. . [9]. Эти авторы обнаружили, что спектроскопический признак разделения зарядов в препаратах частично окисленных реакционных центров заменяется признаком процесса диссипации энергии. Krieger-Liszkay и др. [10] описывают, как способность фотосистемы (PS) II к переносу электронов у цианобактерий Synechocystis sp. PCC 6803 был изменен по сравнению с PSI за счет конститутивной экспрессии терминальной оксидазы пластиды, которая окисляет пластохинол и восстанавливает кислород до воды. Наблюдаемое изменение стехиометрии PSI на PSII было связано с влиянием на окислительно-восстановительный статус клеток, особенно NAD(P)H/NAD(P) 9Пул 0007 + приводит к изменению экспрессии генов.
Внутренние фотозащитные механизмы, которые действуют в реакционных центрах фотосинтетической бактерии Rhodobacter sphaeroides , предотвращая образование долгоживущих триплетных или синглетных возбужденных электронных состояний при флуктуирующих условиях окружающей среды, были проанализированы Ма и др. . [9]. Эти авторы обнаружили, что спектроскопический признак разделения зарядов в препаратах частично окисленных реакционных центров заменяется признаком процесса диссипации энергии. Krieger-Liszkay и др. [10] описывают, как способность фотосистемы (PS) II к переносу электронов у цианобактерий Synechocystis sp. PCC 6803 был изменен по сравнению с PSI за счет конститутивной экспрессии терминальной оксидазы пластиды, которая окисляет пластохинол и восстанавливает кислород до воды. Наблюдаемое изменение стехиометрии PSI на PSII было связано с влиянием на окислительно-восстановительный статус клеток, особенно NAD(P)H/NAD(P) 9Пул 0007 + приводит к изменению экспрессии генов.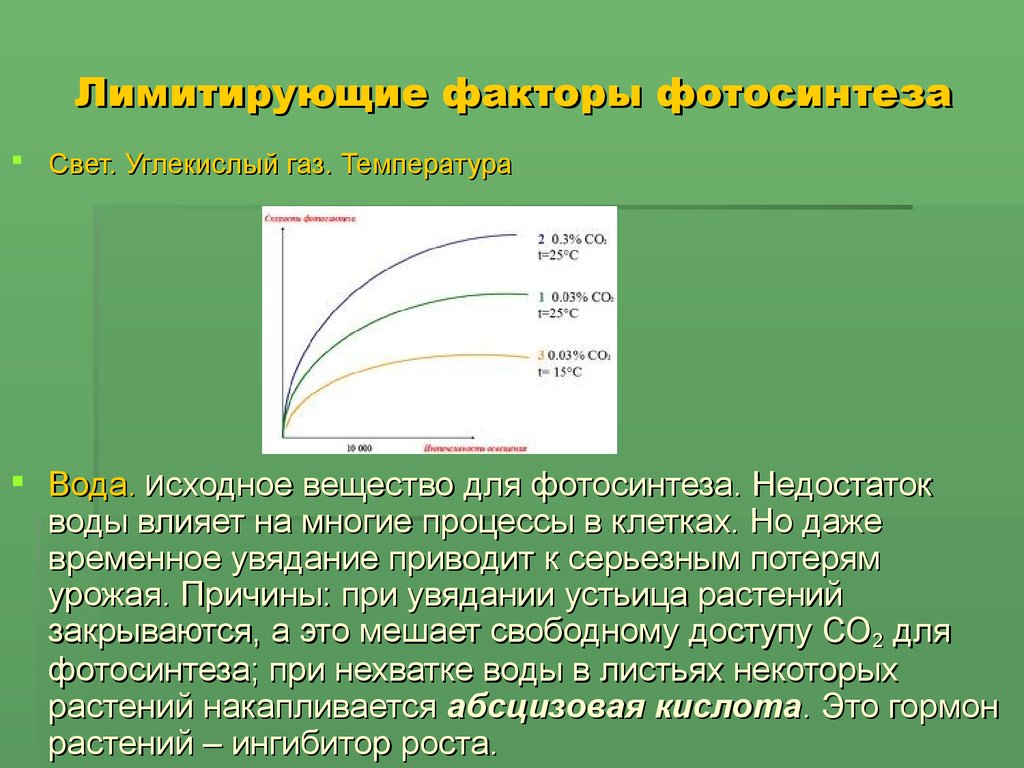 Роль встроенных в тилакоиды протеазных комплексов FtsH в селективной деградации субъединиц ФС II во время цикла репарации у Synechocystis sp. PCC 6803 был исследован Никсоном и сотрудниками [11]. Эти авторы показывают, что субъединица PSII Psb29 необходима для накопления гетероолигомерного комплекса Ftsh3/Ftsh4, который участвует в репарации PSII. Более того, было показано, что белок Psb29 из Thermosynechococcus elongatus имеет высококонсервативную область, которая, как предполагают авторы, связывается с FtsH. Предполагается, что снижение функции FtsH, ведущее к потере активности цикла репарации ФСII через THF1, способствует продукции АФК и потере функций хлоропластов. Биоархитектонический подход к инженерии метаболизма подробно описан Керфилдом [12], который разбивает сложность метаболических процессов на такие модули, как субклеточные компартменты, домены внутри белков, совместно регулируемые группы функционально ассоциированных генов и метаболические пути. В этом действительно интересном обзоре рассматриваются не только уроки, извлеченные из исследований, направленных на установку новых метаболических модулей в клетки, но и то, как биоархитектоника применяется для создания микробных клеточных фабрик, которые можно использовать для повышения первичной продуктивности.
Роль встроенных в тилакоиды протеазных комплексов FtsH в селективной деградации субъединиц ФС II во время цикла репарации у Synechocystis sp. PCC 6803 был исследован Никсоном и сотрудниками [11]. Эти авторы показывают, что субъединица PSII Psb29 необходима для накопления гетероолигомерного комплекса Ftsh3/Ftsh4, который участвует в репарации PSII. Более того, было показано, что белок Psb29 из Thermosynechococcus elongatus имеет высококонсервативную область, которая, как предполагают авторы, связывается с FtsH. Предполагается, что снижение функции FtsH, ведущее к потере активности цикла репарации ФСII через THF1, способствует продукции АФК и потере функций хлоропластов. Биоархитектонический подход к инженерии метаболизма подробно описан Керфилдом [12], который разбивает сложность метаболических процессов на такие модули, как субклеточные компартменты, домены внутри белков, совместно регулируемые группы функционально ассоциированных генов и метаболические пути. В этом действительно интересном обзоре рассматриваются не только уроки, извлеченные из исследований, направленных на установку новых метаболических модулей в клетки, но и то, как биоархитектоника применяется для создания микробных клеточных фабрик, которые можно использовать для повышения первичной продуктивности.
Ruban [13] представляет всесторонний обзор оценки защитной эффективности нефотохимического тушения флуоресценции (NPQ: [14,15]). Эта проницательная перспектива информации NPQ о степени фотоповреждения и фотозащиты () о продуктивности растений обсуждается в связи с переменными окружающей среды. Показано, что новая методология, описанная этим автором, обеспечивает прочную основу для получения инструмента для количественной оценки светоустойчивости фотосинтезирующих организмов и, следовательно, предлагает всестороннее понимание реакции растений на свет. Наводящий на размышления анализ того, как можно использовать манипуляции с движущей силой протонов тилакоидов (pmf) для улучшения фотосинтеза, предоставлен Крамером и его коллегами [16]. Однако вполне вероятно, что некоторые из предлагаемых модификаций фотосинтетического аппарата могут оказывать негативное влияние на общий метаболизм, а также на другие процессы, такие как стрессоустойчивость. В этом контексте Аро и его коллеги [17] обсуждают, как следует учитывать восприимчивость PSI к фотоингибированию, особенно при низких температурах или при ярком освещении, при рассмотрении манипулирования фотосинтезом.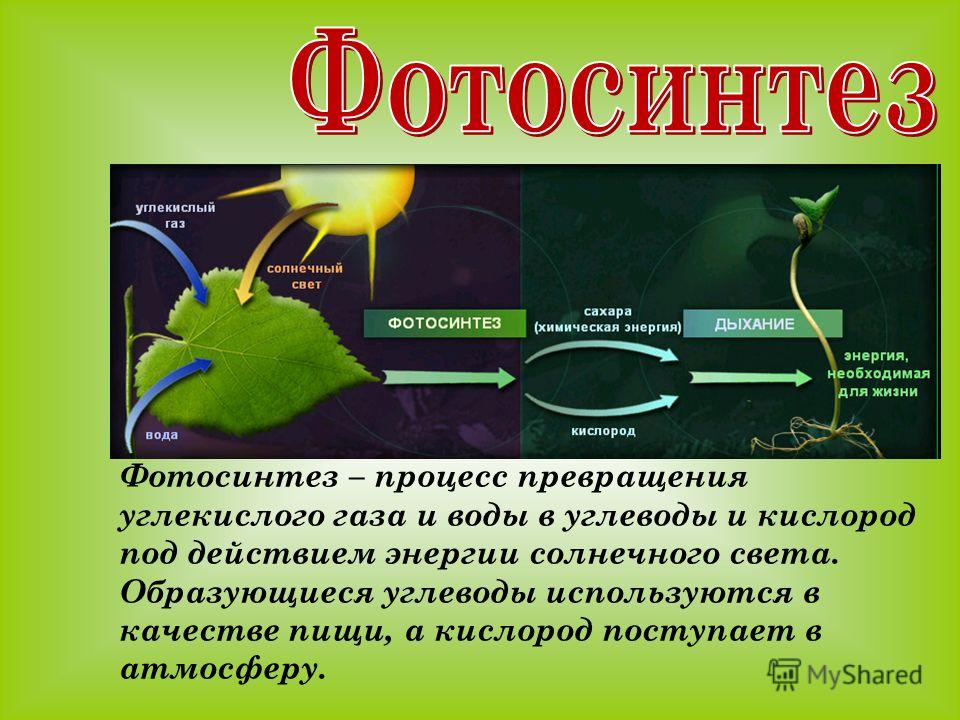 Использование pgr5 , у которого отсутствует ΔpH-зависимая регуляция фотосинтетического транспорта электронов, авторы обрисовывают последствия опосредованного сильным светом фотоингибирования PSI для нижестоящих процессов хлоропластов, таких как фиксация углерода и накопление крахмала, а также влияние на клеточную передачу сигналов.
Использование pgr5 , у которого отсутствует ΔpH-зависимая регуляция фотосинтетического транспорта электронов, авторы обрисовывают последствия опосредованного сильным светом фотоингибирования PSI для нижестоящих процессов хлоропластов, таких как фиксация углерода и накопление крахмала, а также влияние на клеточную передачу сигналов.
Открыть в отдельном окне
Изображения защитных NPQ ( a ) и параметра фотоповреждения qPd ( b ) у растений Arabidopsis (шкала ложных цветов), показывающие, что молодые листья в центре розетки менее защищены, чем наружные листья ( a , более высокий pNPQ), что приводит к более высокой скорости фотоповреждения ( b , более низкий qPd).
Приобретение способности к фотосинтезу требует обширного сотрудничества между органеллами, включая координированное восприятие света, экспрессию ядерных и пластидных генов, биосинтез липидов, белков и пигментов, а также транспорт и соответствующую локализацию и вставку компонентов. Это сотрудничество между органеллами, лежащее в основе функций хлоропластов, продолжается на протяжении всей жизни хлоропласта и подтверждает роль хлоропласта как клеточного сенсора изменений окружающей среды. Сигнальная функция хлоропластов включает фотосинтез, но распространяется на системные сигналы и продукцию фитогормонов, которые опосредуют реакции растений на стресс и изменения в развитии. Производство АФК и других окислительно-восстановительных медиаторов является ключом к сигнальной функции хлоропластов. Растительные клетки обладают сложными и сложными механизмами восприятия окислительно-восстановительного потенциала, передачи сигналов и регуляции. Один из наиболее хорошо изученных и широко распространенных механизмов, которые растительные клетки используют для восприятия и передачи информации о редокс-состоянии, включает небольшие белки, называемые тиоредоксины (Trx). Система Trx хлоропластов координирует активность ферментов, участвующих в CO 2 ассимиляция (цикл Кальвина–Бенсона).
Это сотрудничество между органеллами, лежащее в основе функций хлоропластов, продолжается на протяжении всей жизни хлоропласта и подтверждает роль хлоропласта как клеточного сенсора изменений окружающей среды. Сигнальная функция хлоропластов включает фотосинтез, но распространяется на системные сигналы и продукцию фитогормонов, которые опосредуют реакции растений на стресс и изменения в развитии. Производство АФК и других окислительно-восстановительных медиаторов является ключом к сигнальной функции хлоропластов. Растительные клетки обладают сложными и сложными механизмами восприятия окислительно-восстановительного потенциала, передачи сигналов и регуляции. Один из наиболее хорошо изученных и широко распространенных механизмов, которые растительные клетки используют для восприятия и передачи информации о редокс-состоянии, включает небольшие белки, называемые тиоредоксины (Trx). Система Trx хлоропластов координирует активность ферментов, участвующих в CO 2 ассимиляция (цикл Кальвина–Бенсона).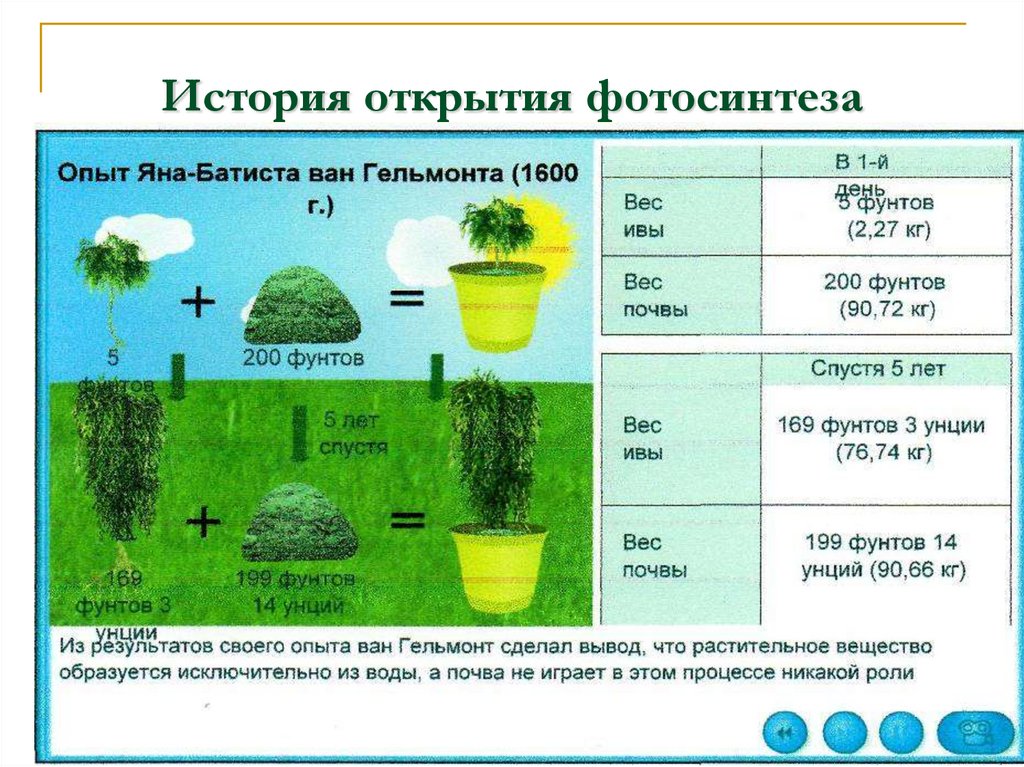 Восстановленный Trx, продуцируемый путем окисления НАДФН, продуцируемого фотосинтетической цепью переноса электронов, переносит восстанавливающие эквиваленты на редокс-чувствительные цистеиновые остатки ряда ферментов цикла Кальвина-Бенсона, только восстановленные формы которых активны. Таким образом, фотосинтетическая электрон-транспортная цепь способна включить ассимиляцию CO 2 на свету и избежать бесполезных циклов. Широкий обзор роли окислительно-восстановительной регуляции на основе тиолов представлен Ринтамаки и его коллегами [18], охватывающими такие функции, как контроль биогенеза хлоропластов, регуляция сбора света и распределения световой энергии между фотосистемами, а также растениями. реакции на стресс. Важно отметить, что в этой статье оцениваются перспективы улучшения фотосинтетической активности путем изменения состава Trx в растениях. Фойер и сотрудники [19] показывают, как применение широко используемых ингибиторов функций хлоропластов и митохондрий изменяет окислительно-восстановительный статус клеток корней и листьев ().
Восстановленный Trx, продуцируемый путем окисления НАДФН, продуцируемого фотосинтетической цепью переноса электронов, переносит восстанавливающие эквиваленты на редокс-чувствительные цистеиновые остатки ряда ферментов цикла Кальвина-Бенсона, только восстановленные формы которых активны. Таким образом, фотосинтетическая электрон-транспортная цепь способна включить ассимиляцию CO 2 на свету и избежать бесполезных циклов. Широкий обзор роли окислительно-восстановительной регуляции на основе тиолов представлен Ринтамаки и его коллегами [18], охватывающими такие функции, как контроль биогенеза хлоропластов, регуляция сбора света и распределения световой энергии между фотосистемами, а также растениями. реакции на стресс. Важно отметить, что в этой статье оцениваются перспективы улучшения фотосинтетической активности путем изменения состава Trx в растениях. Фойер и сотрудники [19] показывают, как применение широко используемых ингибиторов функций хлоропластов и митохондрий изменяет окислительно-восстановительный статус клеток корней и листьев ().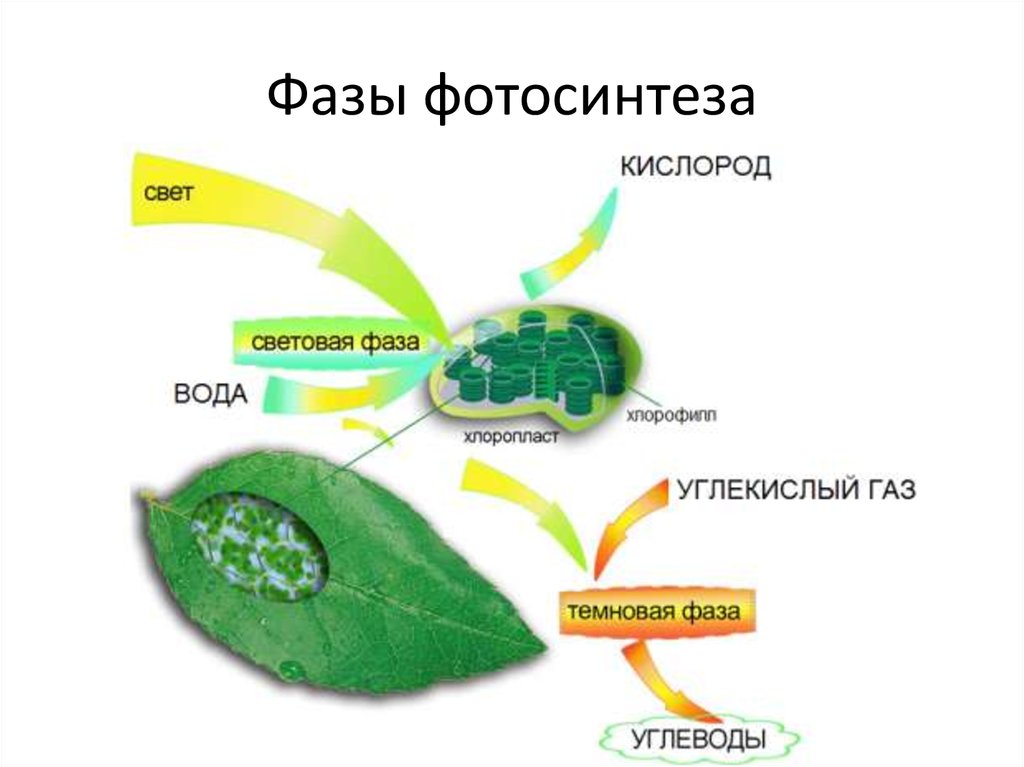 Используя редокс-репортер in vivo roGFP2, эти авторы показали, что присутствие ингибиторов, таких как норфлуразон, линкомицин, антимицин А и салицилгидроксамовая кислота, усиливает клеточное окисление. Все эти ингибиторы вызывали общее окисление цитозоля и ядер, а также изменения экспрессии ядерных генов.
Используя редокс-репортер in vivo roGFP2, эти авторы показали, что присутствие ингибиторов, таких как норфлуразон, линкомицин, антимицин А и салицилгидроксамовая кислота, усиливает клеточное окисление. Все эти ингибиторы вызывали общее окисление цитозоля и ядер, а также изменения экспрессии ядерных генов.
Открыть в отдельном окне
Эпидермис листа Arabidopsis , экспрессирующий редокс-чувствительный зеленый флуоресцентный белок в цитозоле. На изображении показаны одиночные устьица, окруженные эпидермальными клетками.
Повышенная эффективность фотосинтеза должна быть достигнута наряду с более эффективным использованием природных ресурсов с использованием комплексного подхода из нескольких естественнонаучных дисциплин. Перспективы усиления фотосинтеза путем введения нового генетического разнообразия в культурные растения всесторонне обсуждаются Лейстером и его сотрудниками [20]. Эти авторы обсуждают различные возможные источники естественной изменчивости и утверждают, что требуется новый подход. Эти авторы предполагают, что синтетическая бактериальная платформа может обеспечить решение проблемы усиления эукариотического фотосинтеза. Бейт и его коллеги [21] представляют обзор перспективы отрасли и рассматривают возможность оптимизации фотосинтеза для промышленного сельского хозяйства, обсуждая перевод фундаментальных и прикладных исследований в повышение производительности от разработки и применения новых методов открытия генов до трансляции и оценка признаков в современных производственных условиях. Две статьи в этом выпуске касаются возможности увеличения потенциальной урожайности пшеницы за счет увеличения фотосинтеза. Первый принадлежит Лонгу и его коллегам [22], которые сообщают, что более 20% продуктивности пшеницы теряется из-за медленной индукции фотосинтеза при переходе от тени к солнцу. Эти авторы показывают, что для адаптации фотосинтеза флагового листа, выращенного в тени, к полному солнечному свету требуется около 15 минут и что время, необходимое для достижения максимальной эффективности фотосинтеза, по большей части определяется активацией первичной карбоксилазы фотосинтеза С3, рибулозы-1.
Эти авторы предполагают, что синтетическая бактериальная платформа может обеспечить решение проблемы усиления эукариотического фотосинтеза. Бейт и его коллеги [21] представляют обзор перспективы отрасли и рассматривают возможность оптимизации фотосинтеза для промышленного сельского хозяйства, обсуждая перевод фундаментальных и прикладных исследований в повышение производительности от разработки и применения новых методов открытия генов до трансляции и оценка признаков в современных производственных условиях. Две статьи в этом выпуске касаются возможности увеличения потенциальной урожайности пшеницы за счет увеличения фотосинтеза. Первый принадлежит Лонгу и его коллегам [22], которые сообщают, что более 20% продуктивности пшеницы теряется из-за медленной индукции фотосинтеза при переходе от тени к солнцу. Эти авторы показывают, что для адаптации фотосинтеза флагового листа, выращенного в тени, к полному солнечному свету требуется около 15 минут и что время, необходимое для достижения максимальной эффективности фотосинтеза, по большей части определяется активацией первичной карбоксилазы фотосинтеза С3, рибулозы-1. : 5-бисфосфаткарбоксилаза/оксигеназа (Rubisco). Вторая статья написана Рейнсом и его коллегами [23], которые описывают, как повышение уровня другого фермента, участвующего в цикле Кальвина-Бенсона CO 2 ассимиляция, седогептулозо-1,7-бифосфатаза (SBPase) приводит к усилению фотосинтеза, увеличению общей биомассы и урожайности сухих семян. В обзоре Hibberd & Reyna-Llorens [24] рассматривается то, что можно узнать из эволюции фотосинтеза C4, процесса, который способствует концентрации CO 2 в среде Rubisco, что приводит не только к улучшенному захвату углерода, но и к увеличению количества воды и азота. использовать эффективность. В этом научном обзоре рассматривается, как полифилетическая эволюция фотосинтеза C4 строится на ранее существовавших метаболических и генетических сетях, и рассматривается, как относительные изменения в ранее существовавших второстепенных генетических и метаболических сетях лежат в основе повторяющейся эволюции этого процесса. Зная это, перенос признаков С4 в культуры С3 становится более решаемой проблемой.
: 5-бисфосфаткарбоксилаза/оксигеназа (Rubisco). Вторая статья написана Рейнсом и его коллегами [23], которые описывают, как повышение уровня другого фермента, участвующего в цикле Кальвина-Бенсона CO 2 ассимиляция, седогептулозо-1,7-бифосфатаза (SBPase) приводит к усилению фотосинтеза, увеличению общей биомассы и урожайности сухих семян. В обзоре Hibberd & Reyna-Llorens [24] рассматривается то, что можно узнать из эволюции фотосинтеза C4, процесса, который способствует концентрации CO 2 в среде Rubisco, что приводит не только к улучшенному захвату углерода, но и к увеличению количества воды и азота. использовать эффективность. В этом научном обзоре рассматривается, как полифилетическая эволюция фотосинтеза C4 строится на ранее существовавших метаболических и генетических сетях, и рассматривается, как относительные изменения в ранее существовавших второстепенных генетических и метаболических сетях лежат в основе повторяющейся эволюции этого процесса. Зная это, перенос признаков С4 в культуры С3 становится более решаемой проблемой.
За последние 50 лет прибавка урожайности, достигнутая с помощью традиционной селекции растений, оставалась стабильной на уровне около 1% в год. После значительного повышения урожайности зерновых культур, достигнутого во время Зеленой революции, увеличение генетического потенциала урожайности, по-видимому, остановилось. Однако к 2050 году урожайность сельскохозяйственных культур должна вырасти на 100%, чтобы удовлетворить прогнозируемые будущие потребности населения в продовольствии. Это требует годового увеличения урожайности на 1,7%. Одним из способов достижения такого большого увеличения является повышение эффективности фотосинтеза [25]. Повышение эффективности фотосинтеза в настоящее время, по-видимому, предоставляет прекрасную возможность решить проблему устойчивого увеличения урожайности, необходимого для удовлетворения будущего спроса на продовольствие. Достижение более высоких скоростей фотосинтеза при том же или уменьшенном использовании ресурсов воды и азота может изменить правила игры, необходимые для преобразования сельского хозяйства двадцать первого века.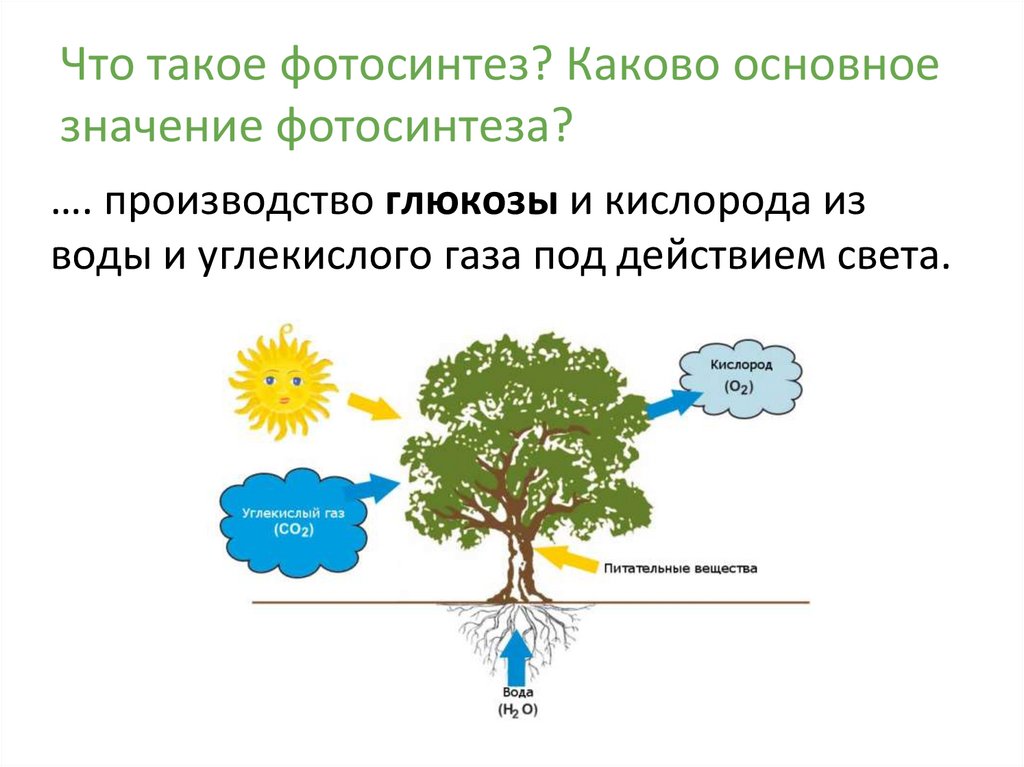 Развитие более эффективного фотосинтеза наряду с устойчивыми и устойчивыми к изменению климата системами растениеводства необходимо для повышения как урожайности, так и питательной ценности сельскохозяйственных культур. Кроме того, дополнительная ценность будет получена за счет лучшего понимания фотосинтеза и внедрения новых технологий.
Развитие более эффективного фотосинтеза наряду с устойчивыми и устойчивыми к изменению климата системами растениеводства необходимо для повышения как урожайности, так и питательной ценности сельскохозяйственных культур. Кроме того, дополнительная ценность будет получена за счет лучшего понимания фотосинтеза и внедрения новых технологий.
Этот тематический вопрос возник на дискуссионном собрании Королевского общества, состоявшемся в октябре 2016 года.
В этой статье нет дополнительных данных.
Мы заявляем, что у нас нет конкурирующих интересов.
Мы не получали финансирования для этого исследования.
1. Бланкеншип Р.Э. и др.
2011.
Сравнение фотосинтетической и фотоэлектрической эффективности и выявление потенциала для улучшения. Наука
332, 805–809. ( 10.1126/science.1200165) [PubMed] [CrossRef] [Google Scholar]
2. Belgio E, Kapitonova E, Chimeliov J, Duffy CDP, Ungerer P, Valkrunas L, Ruban AV.
2014.
Экономичная фотозащита в фотосистеме II, сохраняющая полную систему сбора света с ловушками медленной энергии. Нац. коммун.
Нац. коммун.
5, 4433 (10.1038/ncomms5433) [PubMed] [CrossRef] [Google Scholar]
3. Lin MT, Occhialiana A, Andralojc PJ, Parry MA, Hanson MR.
2014.
Более быстрый Rubisco с потенциалом увеличения фотосинтеза в сельскохозяйственных культурах. Природа
513, 547–550. ( 10.1038/nature13776) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Engineer CB, Ghassemain M, Anderson JC, Paek SC, Hu H, Schroeder JI.
2014.
Карбоангидразы, EPF2 и новая протеаза опосредуют CO 2 контроль развития устьиц. Природа
513, 246–250. ( 10.1038/nature13452) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Romero E, et al.
2014.
Квантовая когерентность в фотосинтезе для эффективного преобразования солнечной энергии. Нац. физ.
10, 676–682. ( 10.1038/nphys3017) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Woehle C, Dagan T, Landan G, Vardi A, Rosenwasser S.
2017.
Экспансия редокс-чувствительного протеома совпадает с пластидным эндосимбиозом.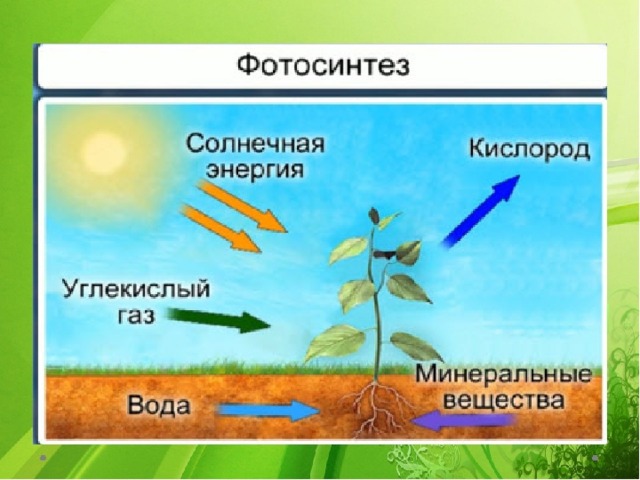 Нац. Растения
Нац. Растения
3, 17066 (10.1038/nplants.2017.66) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Martin WF, Sies H.
2017.
Геномные окислительно-восстановительные следы. Нац. Растения
3, 17071 ( 10.1038/nplants.2017.71) [PubMed] [CrossRef] [Google Scholar]
8. Фальковский П.Г., Лин Х., Горбунов М.Ю.
2017.
Что ограничивает эффективность фотосинтетического преобразования энергии в природе? Уроки океанов. Фил. Транс. Р. Соц. Б
372, 20160376 ( 10.1098/rstb.2016.0376) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Ma F, Swainsbury DJK, Jones MR, van Grondelle R.
2017.
Фотозащита за счет сверхбыстрой рекомбинации зарядов в фотохимических реакционных центрах в окислительных условиях. Фил. Транс. Р. Соц. Б
372, 20160378 ( 10.1098/rstb.2016.0378) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Feilke K, Ajlani G, Krieger-Liszkay A.
2017.
Сверхэкспрессия пластидной терминальной оксидазы у Synechocystis sp.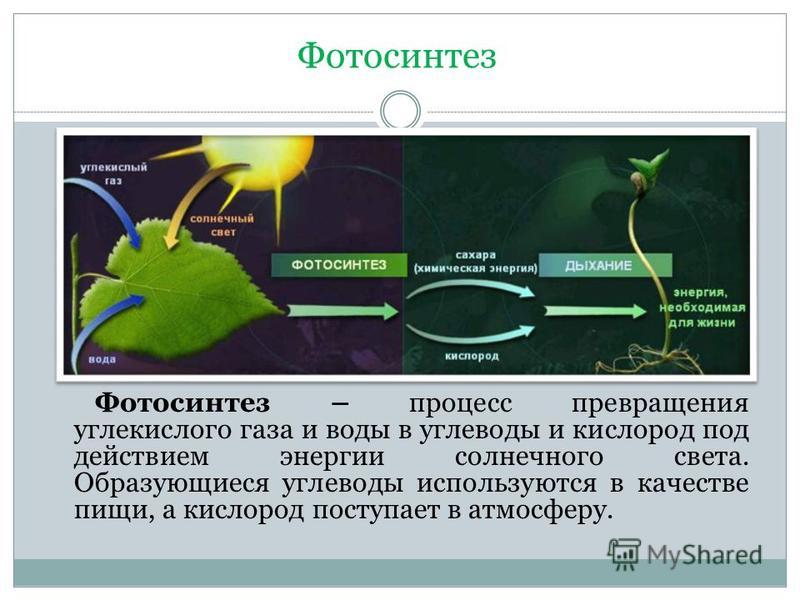 PCC 6803 изменяет окислительно-восстановительное состояние клеток. Фил. Транс. Р. Соц. Б
PCC 6803 изменяет окислительно-восстановительное состояние клеток. Фил. Транс. Р. Соц. Б
372, 20160379 ( 10.1098/rstb.2016.0379) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мюррей Дж.В., Никсон П.Дж.
2017.
Структура Psb29/Thf1 и его связь с протеазным комплексом FtsH, участвующим в репарации фотосистемы II у цианобактерий. Фил. Транс. Р. Соц. Б
372, 20160394 ( 10.1098/rstb.2016.0394) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Kerfeld CA.
2017.
Биоархитектонический подход к модульной инженерии метаболизма. Фил. Транс. Р. Соц. Б
372, 20160387 ( 10.1098/rstb.2016.0387) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Рубан А.В.
2017.
Количественная оценка эффективности фотозащиты. Фил. Транс. Р. Соц. Б
372, 20160393 ( 10.1098/rstb.2016.0393) [бесплатная статья ЧВК] [PubMed] [CrossRef] [Google Scholar]
14. Рубан А.В.
2016.
Нефотохимическое тушение флуоресценции хлорофилла: механизм и эффективность защиты растений от фотоповреждений.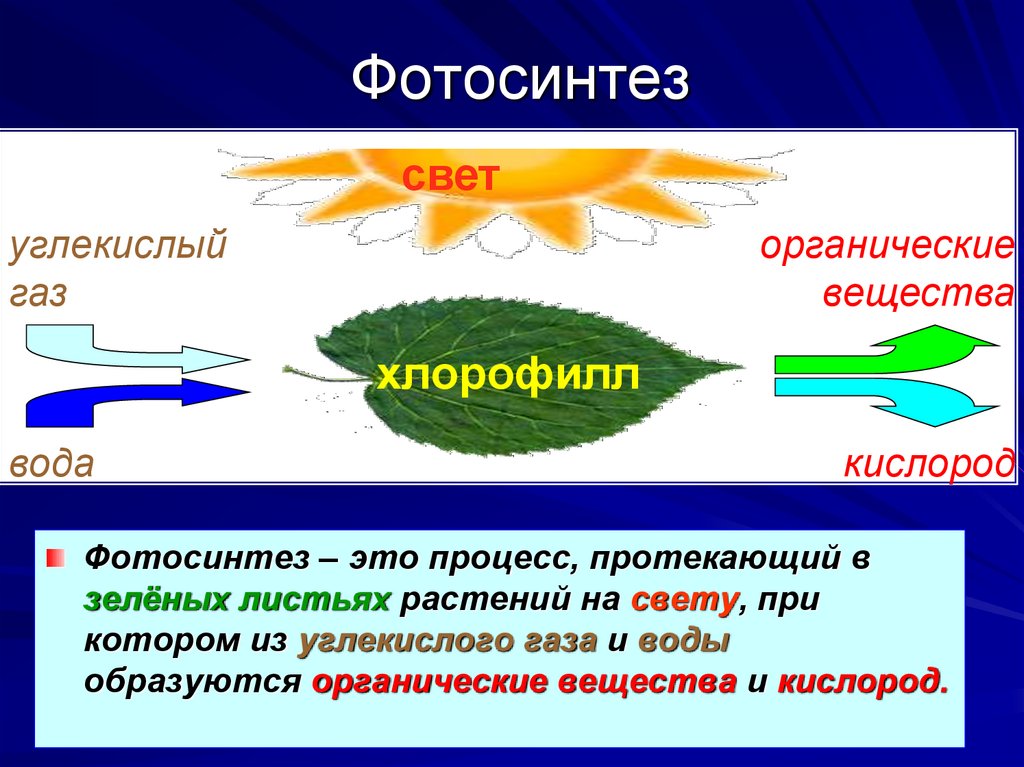 Завод Физиол.
Завод Физиол.
170, 1903–1916 гг. ( 10.1104/pp.15.01935) [бесплатная статья ЧВК] [PubMed] [CrossRef] [Google Scholar]
15. Рубан А.В.
2017.
Культуры на ускоренном пути к свету. Природа
541, 36–37. (10.1038/541036a) [PubMed] [CrossRef] [Google Scholar]
16. Дэвис Г.А., Резерфорд А.В., Крамер Д.М.
2017.
Взлом движущей силы протонов тилакоидов для улучшения фотосинтеза: модуляция скоростей потока ионов, которые контролируют разделение движущей силы протонов на Δ ψ
и ΔрН. Фил. Транс. Р. Соц. Б
372, 20160381 (10.1098/rstb.2016.0381) [CrossRef] [Google Scholar]
17. Голлан П.Дж., Лима-Мело Ю., Тивари А., Тикканен М., Аро Э.М.
2017.
Взаимодействие между фотосинтетическим транспортом электронов и стоками хлоропластов запускает защиту и передачу сигналов, важных для продуктивности растений. Фил. Транс. Р. Соц. Б
372, 20160390 ( 10.1098/rstb.2016.0390) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Nikkanen L, Toivola J, Diaz MG, Rintamäki E.
2017.
Хлоропластные тиоредоксиновые системы: перспективы улучшения фотосинтеза. Фил. Транс. Р. Соц. Б
372, 20160474 ( 10.1098/rstb.2016.0474) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Karpinska B, Alomrani SO, Foyer CH.
2017.
Ингибитор-индуцированное окисление ядра и цитозоля у Arabidopsis thaliana : последствия для ретроградной передачи сигналов от органелл к ядру. Фил. Транс. Р. Соц. Б
372, 20160392 ( 10.1098/rstb.2016.0392) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Dann M, Leister D.
2017.
Усиление фотосинтеза растений (урожая) за счет введения нового генетического разнообразия. Фил. Транс. Р. Соц. Б
372, 20160380 ( 10.1098/rstb.2016.0380) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Nuccio ML, et al.
2017.
Стратегии и инструменты для повышения продуктивности сельскохозяйственных культур за счет воздействия на фотосинтез. Фил. Транс. Р. Соц. Б
372, 20160377 ( 10.1098/rstb.2016.0377) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Taylor SH, Long SP.
Taylor SH, Long SP.
2017.
Медленная индукция фотосинтеза при переходе от тени к солнцу у пшеницы может стоить не менее 21% продуктивности. Фил. Транс. Р. Соц. Б
372, 20160543 ( 10.1098/rstb.2016.0543) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Driver SM, et al.
2017.
Повышенная активность SBPase улучшает фотосинтез и урожайность зерна у пшеницы, выращенной в тепличных условиях. Фил. Транс. Р. Соц. Б
372, 20160384 ( 10.1098/rstb.2016.0384) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Reyna-Llorens I, Hibberd JM.
2017.
Набор ранее существовавших сетей во время эволюции фотосинтеза C 4 . Фил. Транс. Р. Соц. Б
372, 20160386 ( 10.1098/rstb.2016.0386) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Kromdijk J, Głowacka K, Leonelli L, Gabilly ST, Iwai M, Niyogi KK, Long SP.
2017.
Улучшение фотосинтеза и урожайности сельскохозяйственных культур за счет ускорения восстановления после фотозащиты. Наука
354, 857–860.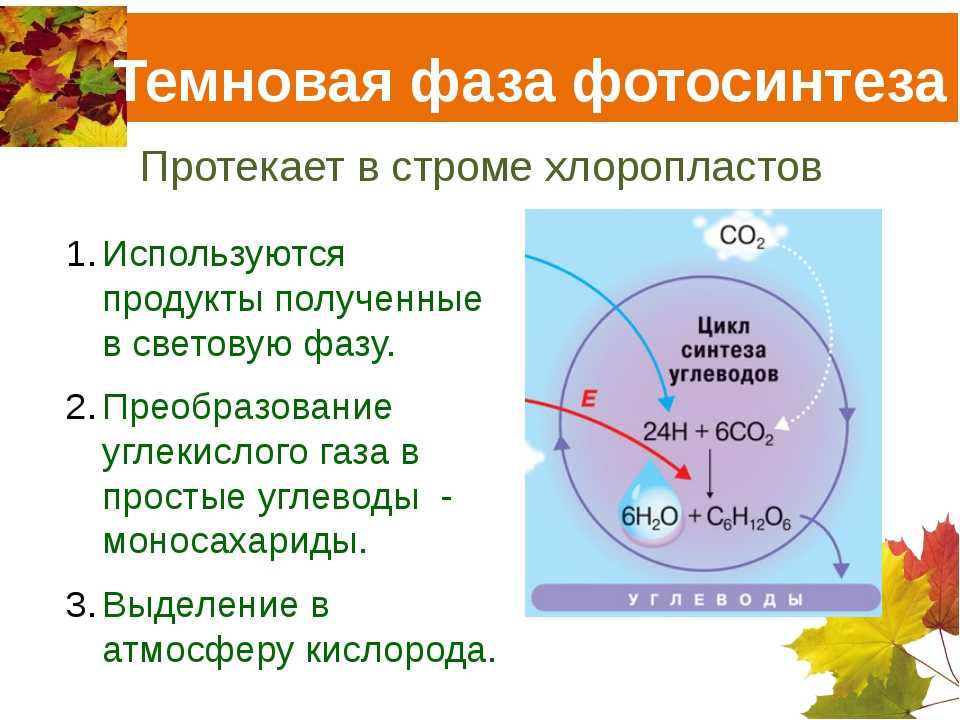 ( 10.1126/science.aai8878) [PubMed] [CrossRef] [Google Scholar]
( 10.1126/science.aai8878) [PubMed] [CrossRef] [Google Scholar]
ESA — Фотосинтез
Приложения
2043 просмотра
5 лайков
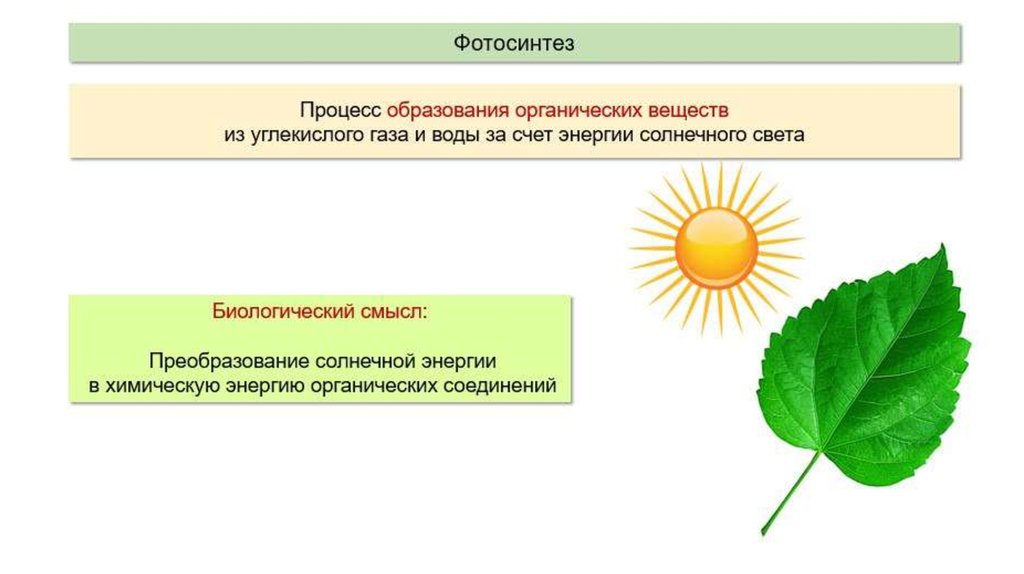
Превращение атмосферного углекислого газа и солнечного света в богатые энергией углеводы посредством фотосинтеза — один из важнейших процессов на Земле, от которого все мы зависим. Фотосинтез является фундаментальным механизмом, лежащим в основе роста и продуктивности растений и, следовательно, обмена энергией и массой.
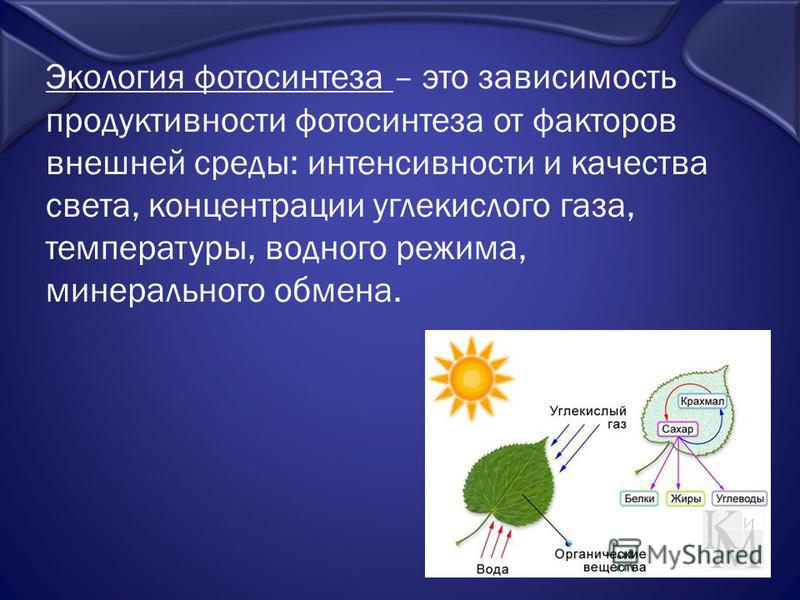
Поскольку рост и продуктивность растений требуют наличия питательных веществ и воды, в дополнение к достаточному солнечному свету и теплу, изменения в этих условиях влияют на скорость фотосинтеза и, следовательно, отражаются как изменения в продуктивности растений.
Хотя большинство людей слышали о фотосинтезе, многие могут не осознавать, что этот процесс включает чрезвычайно сложную цепь событий. Фотосинтез продолжает оставаться предметом огромного количества исследований, за которые с 19 века было присуждено десять Нобелевских премий. 15 для исследователей, разгадывающих его сложность в последние десятилетия.
15 для исследователей, разгадывающих его сложность в последние десятилетия.
Среда, в которой растут растения, во многих отношениях динамична. Свет может колебаться как по интенсивности, так и по спектральным характеристикам. Температура может резко падать, что замедляет ферментативные реакции; чрезмерное нагревание может вызвать денатурацию ферментов и других белков. Дефицит воды может спровоцировать закрытие пор листа (устьиц), тем самым ограничивая поступление углекислого газа к углеродфиксирующим субстратам и ферментам. Озон и другие токсичные вещества могут прямо и избирательно разрушать компоненты, участвующие в реакциях фотосинтеза.
Фотосинтез
Большинство зеленых растений осуществляют процесс фотосинтеза, при котором атмосферный углекислый газ преобразуется в богатые энергией углеводы, такие как сахара и растворимые углеводы, которые затем могут быть превращены во множество растительных продуктов, начиная от аромата цветка и заканчивая массивными деревянные стволы деревьев. Процесс происходит в основном в листьях и хвое.
Процесс происходит в основном в листьях и хвое.
В процессе используется энергия солнечного света, которая поглощается фотосинтетическими пигментами растений – хлорофиллом и каротиноидами. В мембранах хлоропластов сложный каскад биофизических и биохимических реакций соединен последовательно и управляется двумя фотосистемами (фотосистемами II и I), которые работают согласованно, чтобы создать достаточный энергетический потенциал для расщепления молекул воды и линейных процессов. электронный транспорт.
В конечном счете, эта «легкая реакция» обеспечивает достаточно энергии для производства двух биохимических продуктов: биохимического восстановителя никотинамидадениндинуклеотидфосфата (НАДФН) и биохимического энергоносителя аденозинтрифосфата (АТФ). В реакциях фиксации углерода АТФ и НАДФН используются для получения сахаров. Этот набор химических реакций называется циклом Бенсона-Кальвина.
Измерения фотосинтеза растений будут полезны не только для научного сообщества, изучающего углеродный цикл, но и для управляющих сельскохозяйственными и лесными ресурсами.

 Тамбов: Грамота, 2014. № 8. С. 143-149.
Тамбов: Грамота, 2014. № 8. С. 143-149. В работе приводится сравнительная физиологическая характеристика двух сортов озимой пшеницы. Показано, что растения более продуктивного короткостебельного сорта Немчиновская-52 характеризуются, по сравнению с Зарей, повышенными значениями рабочей адсорбирующей поверхности корней, интенсивности поглощения и накопления ионов К +, концентрации эндогенных цитокининов и хлорофиллов, фотохимической активности хлоропластов, интенсивности фотосинтеза и хлорофиллового индекса. Расширен круг изученных фаз развития растений, физиологических параметров и процессов, обуславливающих повышенную продуктивность короткостебельного сорта.
В работе приводится сравнительная физиологическая характеристика двух сортов озимой пшеницы. Показано, что растения более продуктивного короткостебельного сорта Немчиновская-52 характеризуются, по сравнению с Зарей, повышенными значениями рабочей адсорбирующей поверхности корней, интенсивности поглощения и накопления ионов К +, концентрации эндогенных цитокининов и хлорофиллов, фотохимической активности хлоропластов, интенсивности фотосинтеза и хлорофиллового индекса. Расширен круг изученных фаз развития растений, физиологических параметров и процессов, обуславливающих повышенную продуктивность короткостебельного сорта.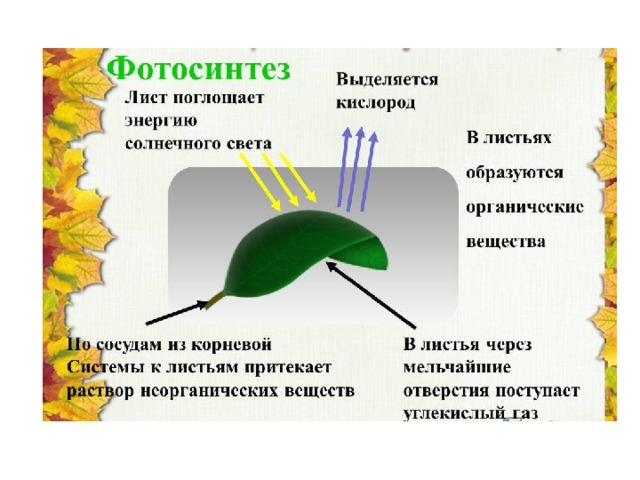 Бесплатный просмотрщик PDF-файлов можно скачать здесь.
Бесплатный просмотрщик PDF-файлов можно скачать здесь. Калининград, 1987. С. 72-80.
Калининград, 1987. С. 72-80. М., 1988. С. 247-251.
М., 1988. С. 247-251.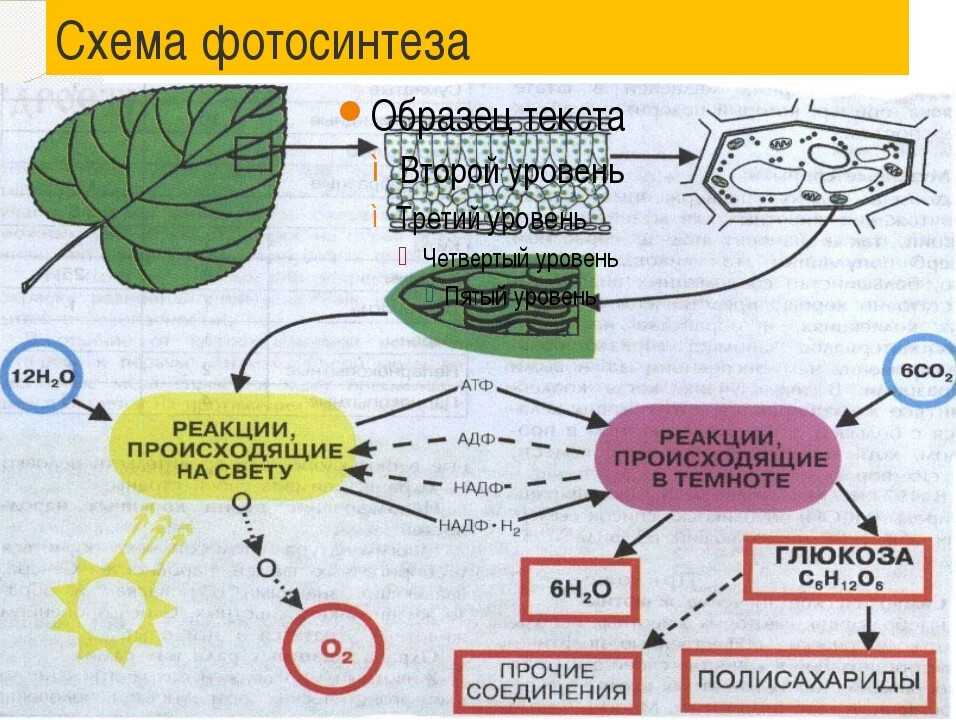 И. Вавилова. 1979. Вып. 87. С. 64-70.
И. Вавилова. 1979. Вып. 87. С. 64-70.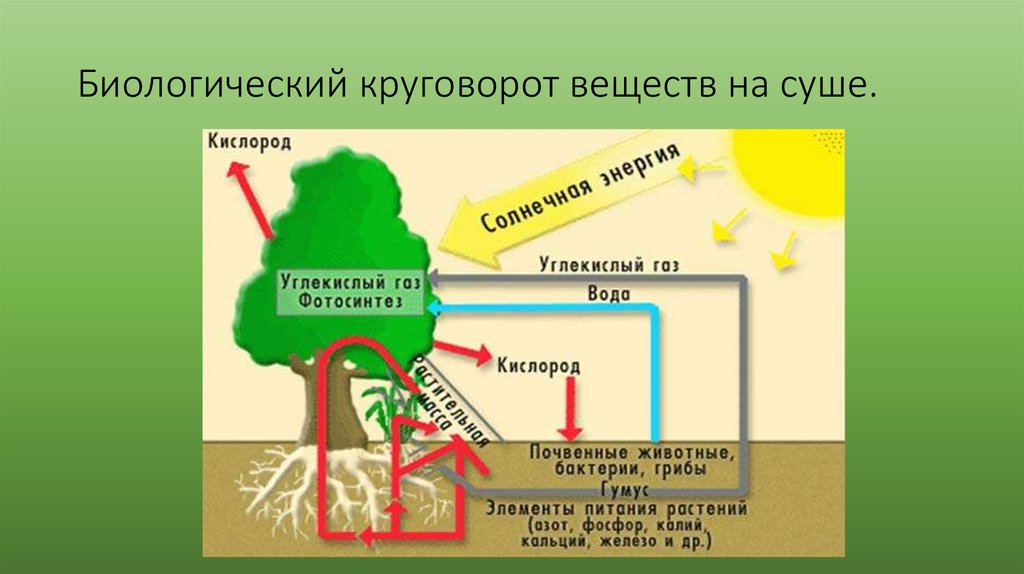 , Wareing P. F. Effect of Gibberellic Acid on Hypocotyl Growth of Lettuce of Seedlings // Nature. 1960. Vol. 185. № 4706. P. 255-256.
, Wareing P. F. Effect of Gibberellic Acid on Hypocotyl Growth of Lettuce of Seedlings // Nature. 1960. Vol. 185. № 4706. P. 255-256. ru
ru