Содержание
Клеточная стенка растений и механизмы устойчивости к патогенам | Смирнова
1. Михайлова Р.В. Мацерирующие ферменты мицелиальных грибов в биотехнологии. Минск: Белорус. наука, 2007.
2. Смирнова О.Г., Кочетов А.В. Промоторы генов, регулирующих ответ на патогены у растений. Вавиловский журнал генетики и селекции. 2014;18(4/1):765-775
3. Филипенко Е.А., Кочетов А.В., Канаяма Ю., Малиновский В.И., Шумный В.К. PR-белки с рибонуклеазной активностью и устойчивость растений к патогенным грибам. Вавиловский журнал генетики и селекции. 2013;17(2):326-334.
4. Ayliffe M., Devilla R., Mago R., White R., Talbot M., Pryor A., Leung H. Nonhost resistance of rice to rust pathogens. Mol. Plant-Microbe Interact. 2011a;24:1143-1155.
5. Ayliffe M., Jin Y., Kang Z.S., Persson M., Steffenson B., Wang S.P., Leung H. Determining the basis of nonhost resistance in rice to cereal rusts. Euphytica. 2011b;179:33-40. DOI 10.1007/s10681-010-0280-2
6. Azinheira H.G., Silva M.D., Talhinhas P. , Medeira C., Maia I., Petitot A.S., Fernandez D. Non-host resistance responses of Arabidopsis thaliana to the coffee leaf rust fungus (Hemileia vastatrix). Botany. 2010;88:621-629.
, Medeira C., Maia I., Petitot A.S., Fernandez D. Non-host resistance responses of Arabidopsis thaliana to the coffee leaf rust fungus (Hemileia vastatrix). Botany. 2010;88:621-629.
7. Bayles C.J., Ghemawat M.S., Aist J.R. Inhibition by 2-deoxy-D-glucose of callose formation, papilla deposition, and resistance to powdery mildew in an mlo barley mutant. Physiol. Mol. Plant Pathol. 1990;36:63-72. DOI 10.1016/0885-5765(90)90092-C
8. Bednarek P., Piślewska-Bednarek M., Svatoš A., Schneider B., Doubský J., Mansurova M., Humphry M., Consonni C., Panstruga R., Sanchez-Vallet A., Molina A., Schulze-Lefert P. A glucosinolate metabolism pathway in living plant cells mediates broadspectrum antifungal defense. Science. 2009;232:101-106. DOI 10.1126/science.1163732
9. Belien T., Van Campenhout S., Robben J., Volckaert G. Microbial endoxylanases: effective weapons to breach the plant cell-wall barrier or, rather, triggers of plant defense systems? Mol. Plant-Microbe Interact. 2006;19:1072-1081.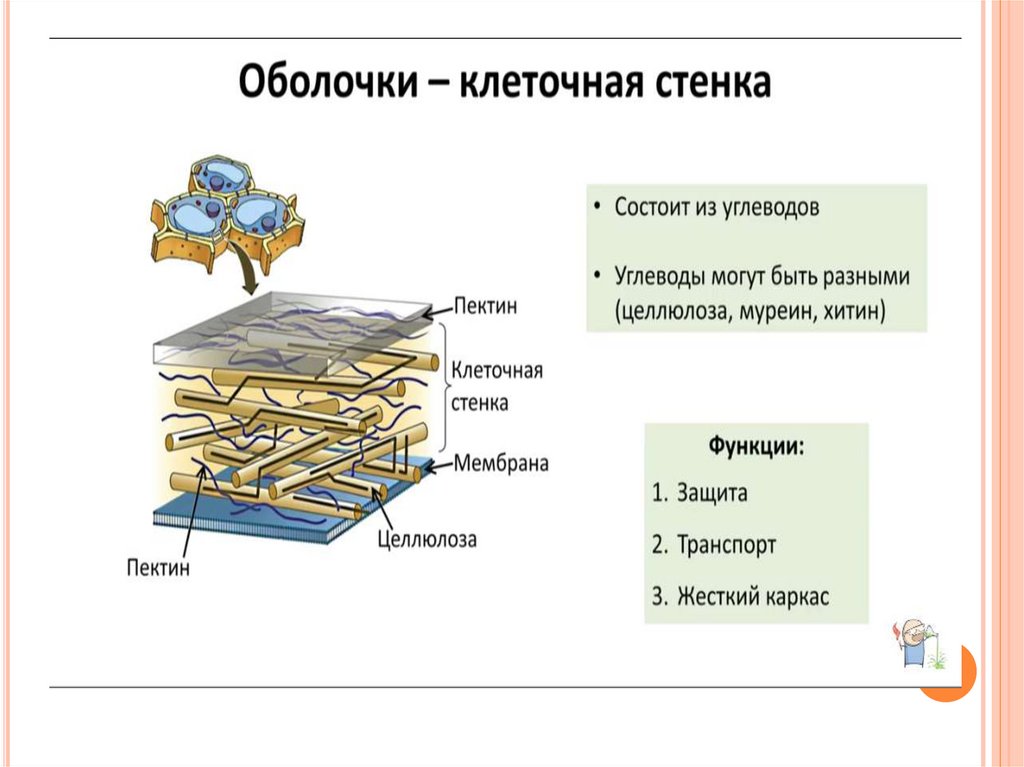
10. Bellincampi D., Camardella L., Delcour J.A., Desseaux V., D’Ovidio R., Durand A., Elliot G., Gebruers K., Giovane A., Juge N., Sørensen J. F., Svensson B., Vairo D. Potential physiological role of plant glycosidase inhibitors. Biochim. Biophys. Acta. 2004;1696(2):265-274. DOI 10.1016/j.bbapap.2003.10.011
11. Bhuiyan N., Liu W., Liu G., Selvaraj G., Wei Y., King J. Transcriptional regulation of genes involved in the pathways of biosynthesis and supply of methyl units in response to powdery mildew attack and abiotic stresses in wheat. Plant Mol. Biol. 2007;64:305-318.
12. Bhuiyan N.H., Selvaraj G., Wei Y., King J. Gene expression profiling and silencing reveal that monolignol biosynthesis plays a critical role in penetration defence in wheat against powdery mildew invasion. J. Exp. Bot. 2009;60:509-521. DOI 10.1093/jxb/ern290
13. Bishop D.L., Chyatterton N.J., Harrison P.A., Hatfield R.D. Changes in carbohydrate partitioning and cell wall remodeling with stressinduced pathogenesis in wheat sheaths. Physiol. Mol. Plant Pathol. 2002;61:53-63. DOI 10.1006/pmpp.2002.0416
Physiol. Mol. Plant Pathol. 2002;61:53-63. DOI 10.1006/pmpp.2002.0416
14. Boller T., Felix G. A renaissance of elicitors: perception of microbeassociated molecular patterns and danger signals by pattern-recognition receptors. Annu. Rev. Plant Biol. 2009;60:379-406. DOI 10.1146/annurev.arplant.57.032905.105346
15. Bolton M.D., Van Esse H.P., Vossen J.H., De Jonge R., Stergiopoulos I., Stulemeijer I.J., van den Berg G.C., Borrás-Hidalgo O., Dekker H. L., de Koster C.G., de Wit P.J., Joosten M.H., Thomma B.P. The novel Cladosporium fulvum lysin motif effector Ecp6 is avirulence factor with orthologues in other fungal species. Mol. Microbiol. 2008; 69(1):119-136. DOI 10.1111/j.1365-2958.2008.06270.x
16. Bout S., Vermerris W. A candidate-gene approach to clone the sorghum Brown midrib gene encoding caffeic acid O-methyltransferase. Mol. Genet. Genomics. 2003;269:205-214. DOI 10.1007/s00438-003-0824-4
17. Bueter C.L., Specht C.A., Levitz S.M. Innate sensing of chitin and chitosan. PLoS Pathog. 2013;9:e1003080. DOI 10.1371/journal. ppat.1003080
PLoS Pathog. 2013;9:e1003080. DOI 10.1371/journal. ppat.1003080
18. Cano-Delgado A., Penfield S., Smith C., Catley M., Bevan M. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. Plant J. 2003;34:351-362. DOI 10.1046/j.1365-313X.2003.01729.x
19. Casassola A., Brammer S.P., Chaves M.S., Martinelli J.A., Stefanato F., Boyd L.A. Changes in gene expression profiles as they relate to the adult plant leaf rust resistance in the wheat cv. Toropi. Physiol Mol. Plant Pathol. 2015;89:49-54. DOI 10.1016/j.pmpp.2014.12.004
20. Cheng Y., Zhang H., Yao J., Wang X., Xu J., Han Q., Wei G., Huang L., Kang Z. Characterization of non-host resistance in broad bean to the wheat stripe rust pathogen. BMC Plant Biol. 2012;12:96. DOI 10.1186/1471-2229-12-96
21. Clay N.K., Adio A.M., Denoux C., Jander G., Ausubel F.M. Glucosinolate metabolites required for an Arabidopsis innate immune response. Science. 2009;323:95-100. DOI 10.1126/science.1164627
22. Collins N.C., Thordal-Christensen H., Lipka V., Bau S., Kombrink E., Qiu J.L., Huckelhoven R., Stein M., Freialdenhoven A., Somerville S.C., Schulze-Lefert P. SNARE-protein-mediated disease resistance at the plant cell wall. Nature. 2003;425:973-977. DOI 10.1038/nature02076
Collins N.C., Thordal-Christensen H., Lipka V., Bau S., Kombrink E., Qiu J.L., Huckelhoven R., Stein M., Freialdenhoven A., Somerville S.C., Schulze-Lefert P. SNARE-protein-mediated disease resistance at the plant cell wall. Nature. 2003;425:973-977. DOI 10.1038/nature02076
23. Cunnac S., Lindeberg M., Collmer A. Pseudomonas syringae type III secretion system effectors: repertoires in search of functions. Curr. Opin. Microbiol. 2009;12(1):53-60. DOI 10.1016/j.mib.2008.12.003
24. Dangl J.L., Horvath D.M., Staskawicz B.J. Pivoting the plant immune system from dissection to deployment. Science. 2013;341(6147):746- 751. DOI 10.1126/science.1236011
25. de Jonge R., Van Esse H.P., Kombrink A., Shinya T., Desaki Y., Bours R., van der Krol S., Shibuya N., Joosten M.H., Thomma B.P. Conserved fungal LysM effector Ecp6 prevents chitin-triggered immunity in plants. Science. 2010;329:953-955. DOI 10.1126/science.1190859
26. Del Río J.C., Rencoret J., Prinsen P., Martínez Á.T.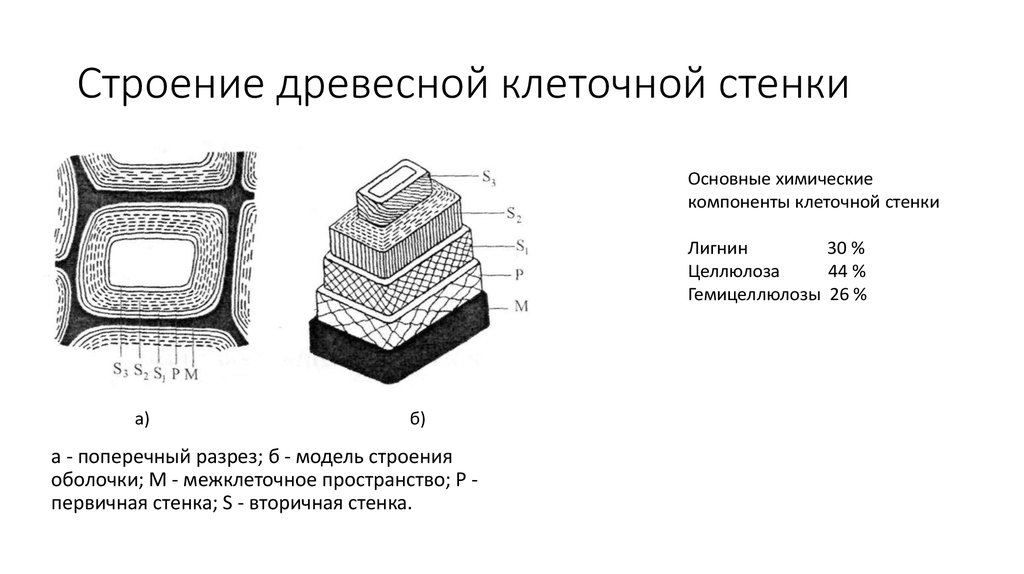 , Ralph J., Gutiérrez A. Structural characterization of wheat straw lignin as revealed by analytical pyrolysis, 2D-NMR, and reductive cleavage methods. J. Agric. Food Chem. 2012;60(23):5922-5935. DOI 10.1021/jf301002n
, Ralph J., Gutiérrez A. Structural characterization of wheat straw lignin as revealed by analytical pyrolysis, 2D-NMR, and reductive cleavage methods. J. Agric. Food Chem. 2012;60(23):5922-5935. DOI 10.1021/jf301002n
27. Denness L., Mckenna J.F., Segonzac C., Wormit A., Madhou P., Bennett M., Mansfield J., Zipfel C., Hamann T. Cell wall damage-induced lignin biosynthesis is regulated by a reactive oxygen speciesand jasmonic acid-dependent process in Arabidopsis. Plant Physiol. 2011;156(3):1364-1374. DOI 10.1104/pp.111.175737.
28. Ellis C., Turner J.G. The Arabidopsis mutant cev1 has constitutively active jasmonate and ethylene signal pathways and enhanced resistance to pathogens. Plant Cell. 2001;13(5):1025-1033.
29. Endler A., Persson S. Cellulose synthases and synthesis in Arabidopsis. Mol. Plant. 2011;4(2):199-211. DOI 10.1093/mp/ssq079
30. Fatima U., Senthil-Kumar M. Plant and pathogen nutrient acquisition strategies. Front Plant Sci. 2015;17;6:750. DOI 10.3389/fpls. 2015. 00750
2015. 00750
31. Ferrari S., Savatin D.V., Sicilia F., Gramegna G., Cervone F., Lorenzo G.D. Oligogalacturonides: plant damage-associated molecular patterns and regulators of growth and development. Front. Plant Sci. 2013;4:49. DOI 10.3389/fpls.2013.00049
32. Funnell-Harris D.L., Pedersen J.F., Sattler S.E. Alteration in lignin biosynthesis restricts growth of Fusarium spp. in brown midrib sorghum. Phytopathology. 2010;100(7):671-681. DOI 10.1094/PHYTO-100-7-0671
33. Furman-Matarasso N., Cohen E., Du Q., Chejanovsky N., Hanania U., Avni A. A point mutation in the ethylene-inducing xylanase elicitor inhibits the beta-1-4-endoxylanase activity but not the elicitation activity. Plant Physiol. 1999;121(2):345-351.
34. Furukawa T., Inagaki H., Takai R., Hirai H., Che F.S. Two distinct EFTu epitopes induce immune responses in rice and Arabidopsis. Mol. Plant Microbe Interact. 2013;27(2):113-124. DOI 10.1094/MPMI-10-13-0304-R
35. Galletti R., De Lorenzo G., Ferrari S.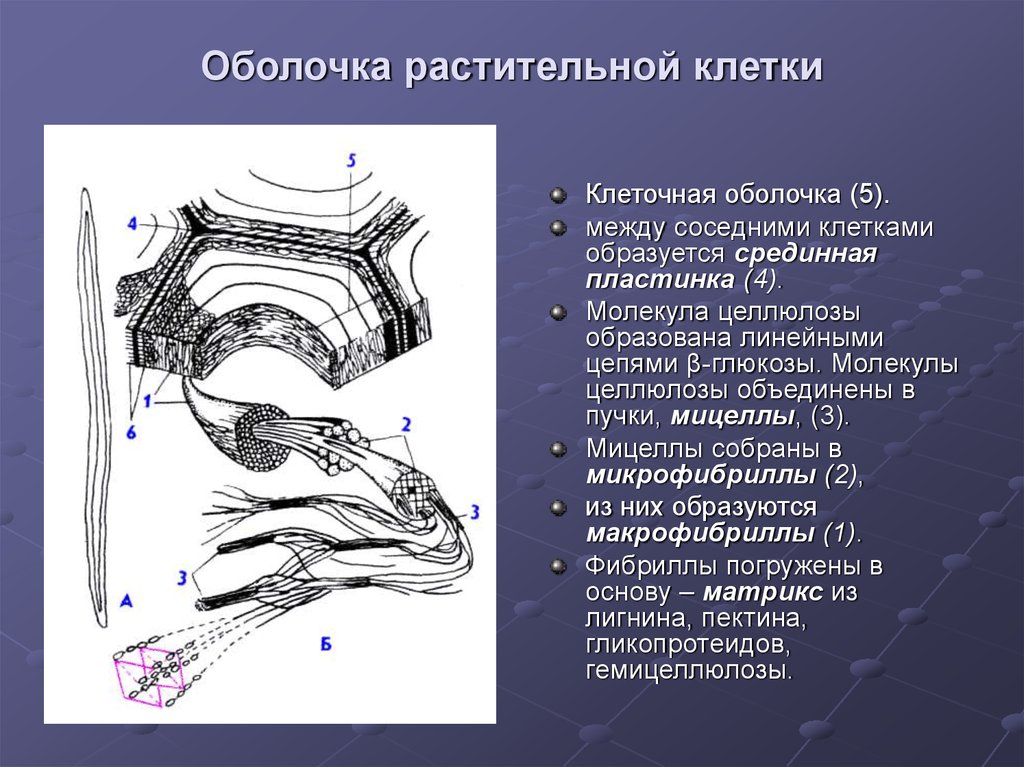 Host-derived signals activate plant innate immunity. Plant Signal. Behav. 2009;4:33-34.
Host-derived signals activate plant innate immunity. Plant Signal. Behav. 2009;4:33-34.
36. Hadwiger L.A. Multiple effects of chitosan on plant systems: solid science or hype. Plant Sci. 2013;208:42-49. DOI 10.1016/j.plantsci. 2013.03.007
37. Hamann T. Plant cell wall integrity maintenance as an essential component of biotic stress response mechanisms. Front. Plant Sci. 2012;3:77. DOI 10.3389/fpls.2012.00077
38. Hernandez-Blanco C., Feng D.X., Hu J., Sanchez-Vallet A., Deslandes L., Llorente F., Berrocal-Lobo M., Keller H., Barlet X., Sán chez-Rodríguez C., Anderson L.K., Somerville S., Marco Y., Molina A. Impairment of cellulose synthases required for Arabidopsis secondary cell wall formation enhances disease resistance. Plant Cell. 2007;19(3):890-903. DOI 10.1105/tpc.106.048058
39. Hoogkamp T., Chen W.Q., Niks R. Specificity of prehaustorial resistance to Puccinia hordei and to two inappropriate rust fungi in barley. Phytopathology. 1998;88(8):856-861. DOI 10. 1094/PHYTO.1998.88.8.856
1094/PHYTO.1998.88.8.856
40. Ikegawa T., Mayama S., Nakayashiki H., Kato H. Accumulation of diferulic acid during the hypersensitive response of oat leaves to Puccinia coronate f. sp. avenae and its role in the resistance of oat tissues to cell wall degrading enzymes. Physiol. Mol. Plant Pathol. 1996;48(4):245-256. DOI 10.1006/pmpp.1996.0021
41. Jafary H., Albertazzi G., Marcel T.C., Niks R.E. High diversity of genes for nonhost resistance of barley to heterologous rust fungi. Genetics. 2008;178(4):2327-2339. DOI 10.1534/genetics.107.077552
42. Jones J.D.G., Dangl J.L. The plant immune system. Nature. 2006; 444(7117):323-329. DOI 10.1038/nature05286
43. Juge N. Plant protein inhibitors of cell wall degrading enzymes. Trends Plant Sci. 2006;11(7):359-367. DOI 10.1016/j.tplants.2006.05.006
44. Kofalvi S.A., Nassuth A. Influence of wheat streak mosaic virus infection on phenylpropanoid metabolism and the accumulation of phenolics and lignin in wheat. Physiol. Mol.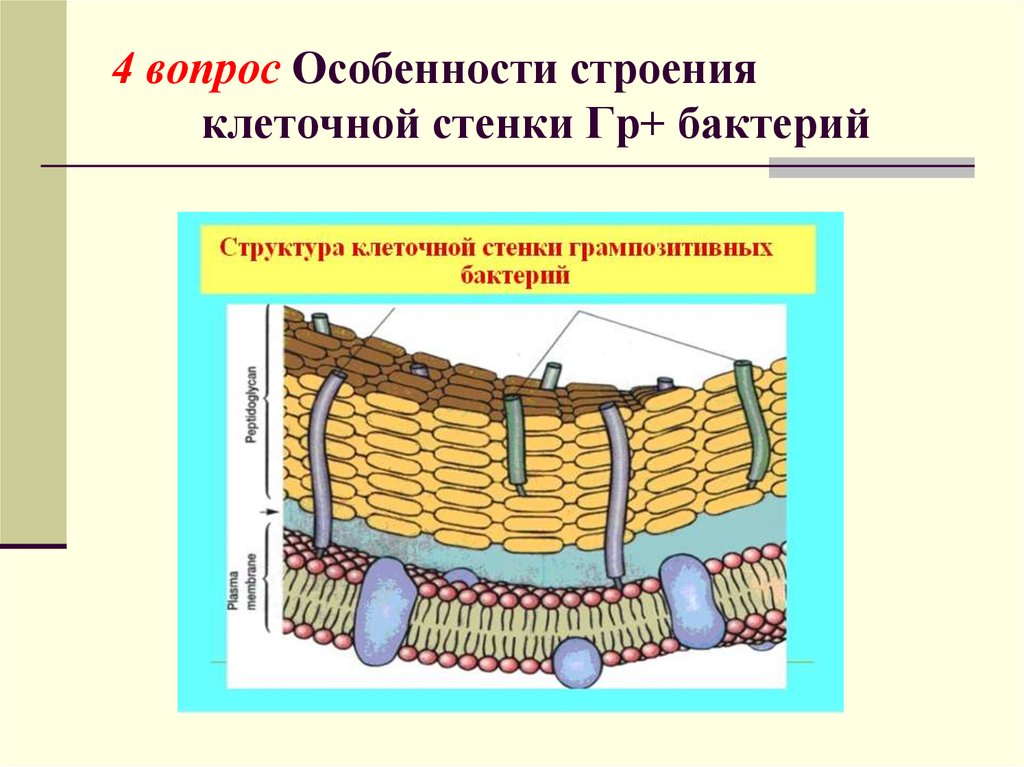 Plant Pathol. 1995;47(6):365-377. DOI 10.1006/pmpp.1995.1065
Plant Pathol. 1995;47(6):365-377. DOI 10.1006/pmpp.1995.1065
45. König S., Feussner K., Kaever A., Landesfeind M., Thurow C., Karlovsky P., Gatz C., Polle A., Feussner I. Soluble phenylpropanoids are involved in the defense response of Arabidopsis against Verticillium longisporum. New Phytol. 2014;202(3):823-837. DOI 10.1111/ nph.12709
46. Kumar M., Turner S. Plant cellulose synthesis: CESA proteins crossing kingdoms. Phytochemistry. 2015;112:91-99. DOI 10.1016/j.phytochem.2014.07.009
47. Lacombe S., Rougon-Cardoso A., Sherwood E., Peeters N., Dahlbeck D., Van Esse H.P., Smoker M., Rallapalli G., Thomma B.P., Staskawicz B., Jones J.D., Zipfel C. Interfamily transfer of a plant pattern-recognition receptor confers broad-spectrum bacterial resistance. Nat. Biotechnol. 2010;28(4):365-369. DOI 10.1038/nbt.1613
48. Lee W.S., Rudd J.J., Hammond-Kosack K.E., Kanyuka K. Mycosphaerella graminicola LysM effector-mediated stealth pathogenesis subverts recognition through both CERK1 and CEBiP homologues in wheat.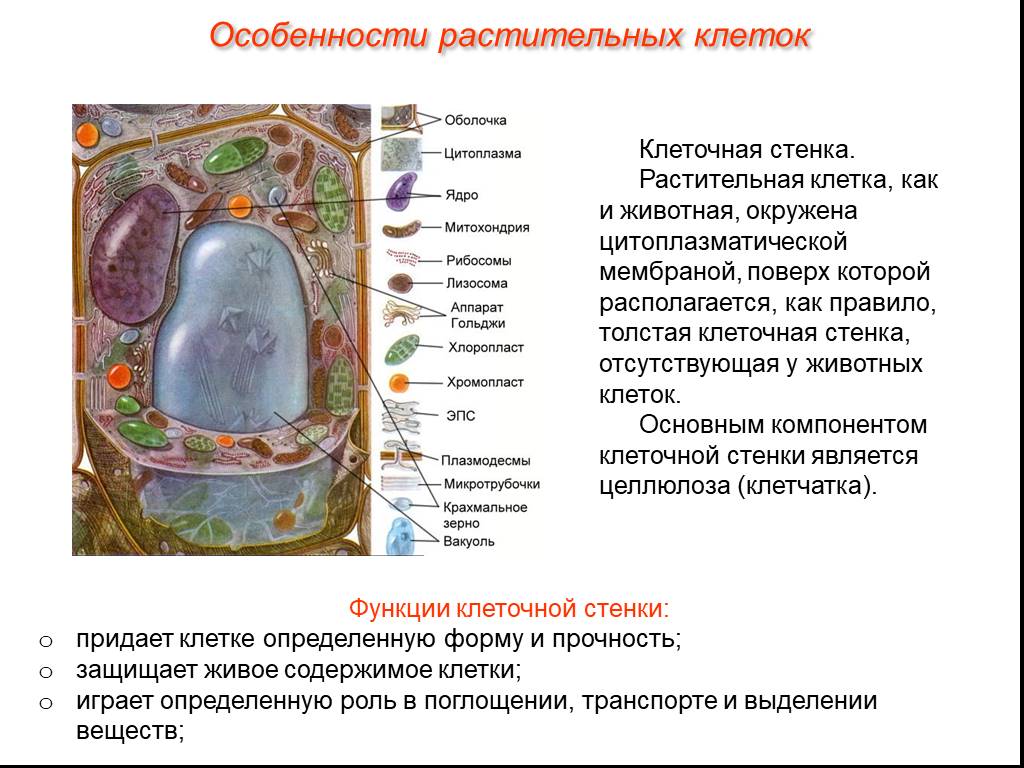 Mol. Plant Microbe Interact. 2014;27(3):236-243. DOI 10.1094/MPMI-07-13-0201-R
Mol. Plant Microbe Interact. 2014;27(3):236-243. DOI 10.1094/MPMI-07-13-0201-R
49. Li H., Goodwin P.H., Han Q., Huang L., Kang Z. Microscopy and proteomic analysis of the non-host resistance of Oryza sativa to the wheat leaf rust fungus, Puccinia triticina f. sp. tritici. Plant Cell Rep. 2012;31(4):637-650. DOI 10.1007/s00299-011-1181-0
50. Lionetti V. PECTOPLATE: the simultaneous phenotyping of pectin methylesterases, pectinases, and oligogalacturonides in plants during biotic stresses. Front Plant Sci. 2015;6:331. DOI 10.3389/fpls.2015.00331
51. Liu T., Liu Z., Song C., Hu Y., Han Z., She J., Fan F., Wang J., Jin C., Chang J., Zhou J.M., Chai J. Chitin-induced dimerization activates a plant immune receptor. Science. 2012;336(6085):1160-1164. DOI 10.1126/science
52. Maher E.A., Bate N.J., Ni W., Elkind Y., Dixon R.A., Lamb C.J. Increased disease susceptibility of transgenic tobacco plants with suppressed levels of preformed phenylpropanoid products. Proc. Natl Acad.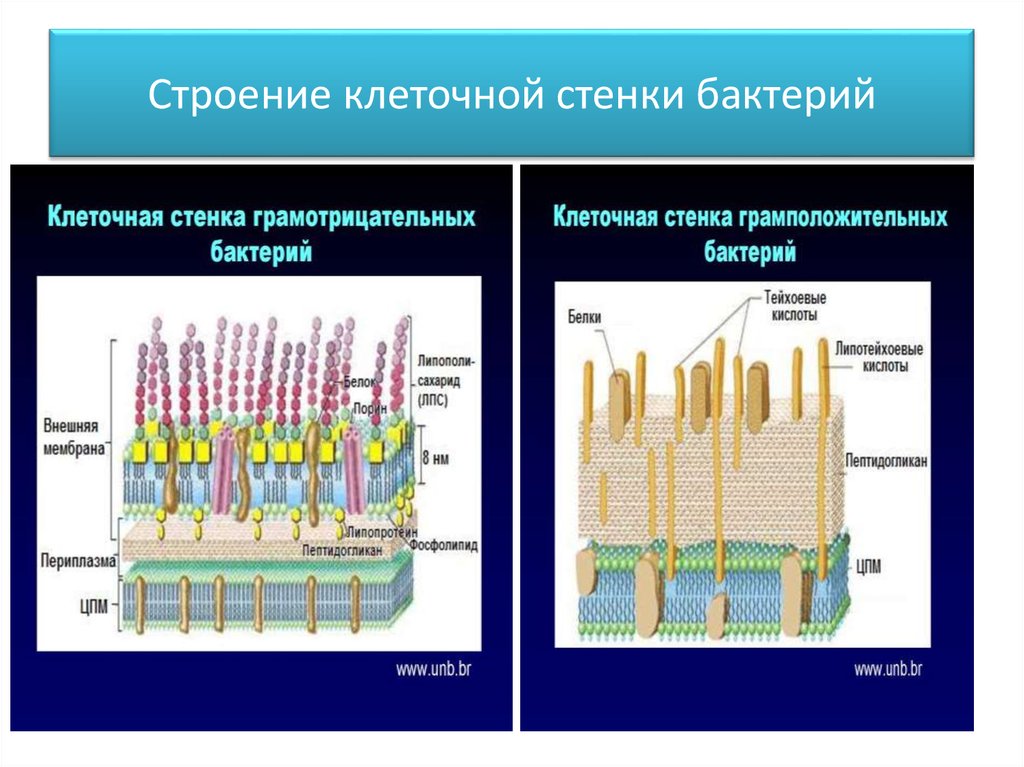 Sci. USA. 1994;91(16):7802-7806.
Sci. USA. 1994;91(16):7802-7806.
53. Malinovsky F.G., Fangel J.U., Willats W.G. The role of the cell wall in plant immunity. Front Plant Sci. 2014;5:178. DOI 10.3389/fpls.2014.00178
54. Manabe Y., Nafisi M., Verhertbruggen Y., Orfila C., Gille S., Rautengarten C., Cherk C., Marcus S.E., Somerville S., Pauly M., Knox J. P., Sakuragi Y., Scheller H.V. Loss-of-function mutation of reduced wall acetylation 2 in Arabidopsis leads to reduced cell wall acetylation and increased resistance to Botrytis cinerea. Plant Physiol. 2011;155(3):1068-1078. DOI 10.1104/pp.110.168989
55. Maury S., Delaunay A., Mesnard F., Cronier D., Chabbert B., Geoffroy P., Legrand M. O-methyltransferase(s)-suppressed plants produce lower amounts of phenolic vir inducers and are less susceptible to Agrobacterium tumefaciens infection. Planta. 2010;232(4):975- 986. DOI 10.1007/s00425-010-1230-x
56. Mellersh D.G., Heath M.C. An investigation into the involvement of defense signaling pathways in components of the nonhost resistance of Arabidopsis thaliana to rust fungi also reveals a model system for studying rust fungal compatibility.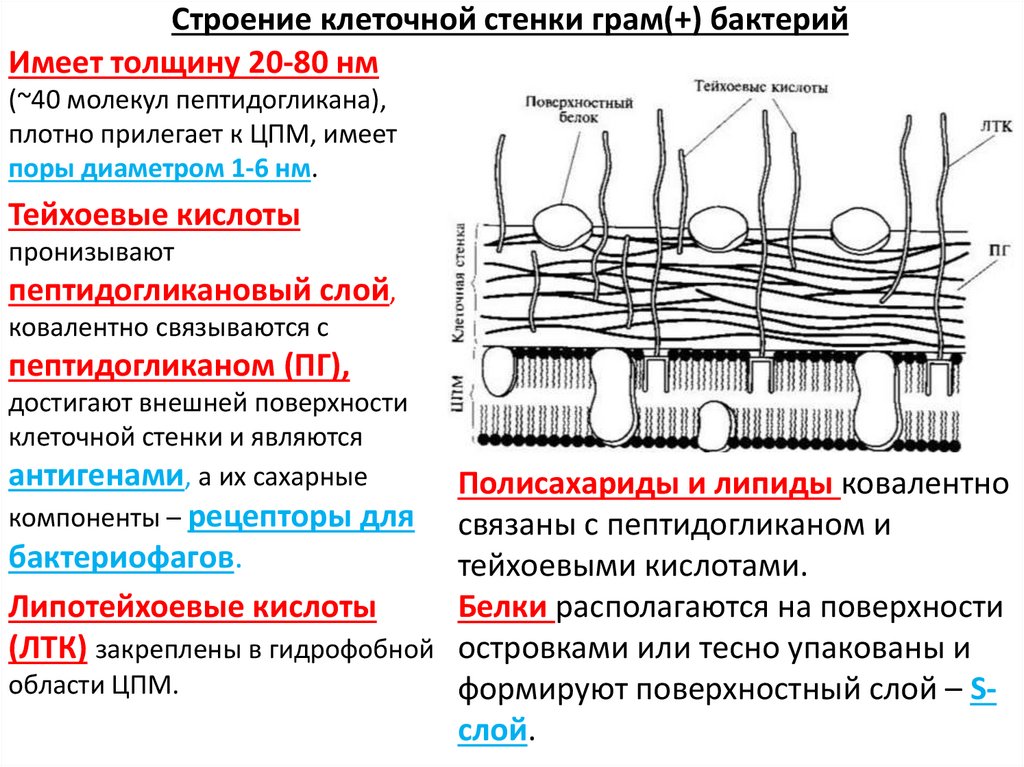 Mol. Plant Microbe Interact. 2003;16(5):398-404.
Mol. Plant Microbe Interact. 2003;16(5):398-404.
57. Menden B., Kohlhoff M., Moerschbacher B.M. Wheat cells accumulate a syringyl-rich lignin during the hypersensitive resistance response. Phytochemistry. 2007;68(4):513-520. DOI 10.1016/j.phytochem. 2006.11.011
58. Miedes E., Vanholme R Boerjan W Molina A. The role of the secondary cell wall in plant resistance to pathogens. Front Plant Sci. 2014;5:358. DOI 10.3389/fpls.2014.00358
59. Moscetti I., Tundo S., Janni M., Sella L., Gazzetti K., Tauzin A., Giardina T., Masci S., Favaron F., D’Ovidio R. Constitutive expression of the xylanase inhibitor TAXI-III delays fusarium head blight symptoms in durum wheat transgenic plants. Mol. Plant Microbe Interact. 2013;26(12):1464-1472. DOI 10.1094/MPMI-04-13-0121-R
60. Mysore K.S., Ryu C.M. Nonhost resistance: how much do we know? Trends Plant Sci. 2004;9(2):97-104. DOI 10.1016/j.tplants.2003.12.005
61. Nicaise V., Roux M., Zipfel C. Recent advances in PAMP-triggered immunity against bacteria: pattern recognition receptors watch over and raise the alarm. Plant Physiol. 2009;150(4):1638-1647. DOI 10.1104/pp.109.139709
Plant Physiol. 2009;150(4):1638-1647. DOI 10.1104/pp.109.139709
62. Niks R. Comparative histology of partial resistance and the nonhost reaction to leaf rust pathogens in barley and wheat seedlings. Phytopathology. 1983;73:60-64.
63. Noda J., Brito N., González C. The Botrytis cinerea xylanase Xyn11A contributes to virulence with its necrotizing activity, not with its catalytic activity. BMC Plant Biol. 2010;10:38. DOI 10.1186/1471-2229-10-38
64. Nurnberger T., Lipka V. Non-host resistance in plants: new insights into an old phenomenon. Mol. Plant. Pathol. 2005;6(3):335-345. DOI 10.1111/j.1364-3703.2005.00279.x
65. Parrott D.L., Anderson A.J., Carman J.G. Agrobacterium induces plant cell death in wheat (Triticum aestivum L.). Physiol. Mol. Plant Pathol. 2002;60(2):59-69. DOI 10.1006/pmpp.2002.0378
66. Pauly M., Gille S., Liu L.F., Mansoori N., De Souza A., Schultink A., Xiong G. Hemicellulose biosynthesis. Planta. 2013;238(4):627-642. DOI 10.1007/s00425-013-1921-1
67. Pogorelko G., Lionetti V., Bellincampi D., Zabotina O. Cell wall integrity: targeted post-synthetic modifications to reveal its role in plant growth and defense against pathogens. Plant Signal Behav. 2013;8: e25435. DOI 10.4161/psb.25435
Pogorelko G., Lionetti V., Bellincampi D., Zabotina O. Cell wall integrity: targeted post-synthetic modifications to reveal its role in plant growth and defense against pathogens. Plant Signal Behav. 2013;8: e25435. DOI 10.4161/psb.25435
68. Prabhu S.A., Wagenknecht M., Melvin P., Gnanesh Kumar B.S., Veena M., Shailasree S., Moerschbacher B.M., Kini K.R. Immuno-affinity purification of PglPGIP1, a polygalacturonase-inhibitor protein from pearl millet: studies on its inhibition of fungal polygalacturonases and role in resistance against the downy mildew pathogen. Mol. Biol. Rep. 2015;42(6):1123-1138. DOI 10.1007/s11033-015-3850-5
69. Prats E., Martinez F., Rojas-Molina M., Rubiales D. Differential effects of phenylalanine ammonia lyase, cinnamyl alcohol dehydrogenase, and energetic metabolism inhibition on resistance of appropriate host and nonhost cereal-rust interactions. Phytopathology. 2007;97(12):1578-1583. DOI 10.1094/PHYTO-97-12-1578
70. Romero D., Rivera M.E., Cazorla F. M., Codina J.C., Fernández-Ortuño D., Torés J.A., Pérez-García A., de Vicente A. Comparative histochemical analyses of oxidative burst and cell wall reinforcement in compatible and incompatible melon-powdery mildew (Podosphaera fusca) interactions. J. Plant Physiol. 2008;165(18):1895-1905. DOI 10.1016/j.jplph.2008.04.020
M., Codina J.C., Fernández-Ortuño D., Torés J.A., Pérez-García A., de Vicente A. Comparative histochemical analyses of oxidative burst and cell wall reinforcement in compatible and incompatible melon-powdery mildew (Podosphaera fusca) interactions. J. Plant Physiol. 2008;165(18):1895-1905. DOI 10.1016/j.jplph.2008.04.020
71. Ron M., Avni A. The receptor for the fungal elicitor ethylene-inducing xylanase is a member of a resistance-like gene family in tomato. Plant Cell. 2004;16(6):1604-1615. DOI 10.1105/tpc.022475
72. Rudd J.J., Kanyuka K., Hassani-Pak K., Derbyshire M., Andongabo A., Devonshire J., Lysenko A., Saqi M., Desai N.M., Powers S.J., Hooper J., Ambroso L., Bharti A., Farmer A., Hammond-Kosack K.E., Dietrich R.A., Courbot M. Transcriptome and metabolite profiling of the infection cycle of Zymoseptoria tritici on wheat reveals a biphasic interaction with plant immunity involving differential pathogen chromosomal contributions and a variation on the hemibiotrophic lifestyle definition. Plant Physiol. 2015;167(3):1158-1185. DOI 10.1104/pp.114.255927
Plant Physiol. 2015;167(3):1158-1185. DOI 10.1104/pp.114.255927
73. San Clemente H., Jamet E. WallProtDB, a database resource for plant cell wall proteomics. Plant Methods. 2015;11(1):2. DOI 10.1186/s13007-015-0045-y
74. Sanchez-Vallet A., Saleem-Batcha R., Kombrink A., Hansen G., Valkenburg D.J., Thomma B.P., Mesters J.R. Fungal effector Ecp6 outcompetes host immune receptor for chitin binding through intrachain LysM dimerization. Elife. 2013;2:e00790. DOI 10.7554/eLife.00790
75. Sattler S.E., Funnell-Harris D.L. Modifying lignin to improve bioenergy feedstocks: strengthening the barrier against pathogens? Front. Plant Sci. 2013;4:70. DOI 10.3389/fpls.2013.00070
76. Sattler S.E., Saathoff A.J., Haas E.J., Palmer N.A., Funnell-Harris D.L., Sarath G., Pedersen J.F. A nonsense mutation in a cinnamyl alcohol dehydrogenase gene is responsible for the sorghum brown midrib 6 phenotype. Plant Physiol. 2009;150(2):584-595. DOI 10.1104/ pp.109.136408
77. Scheller H.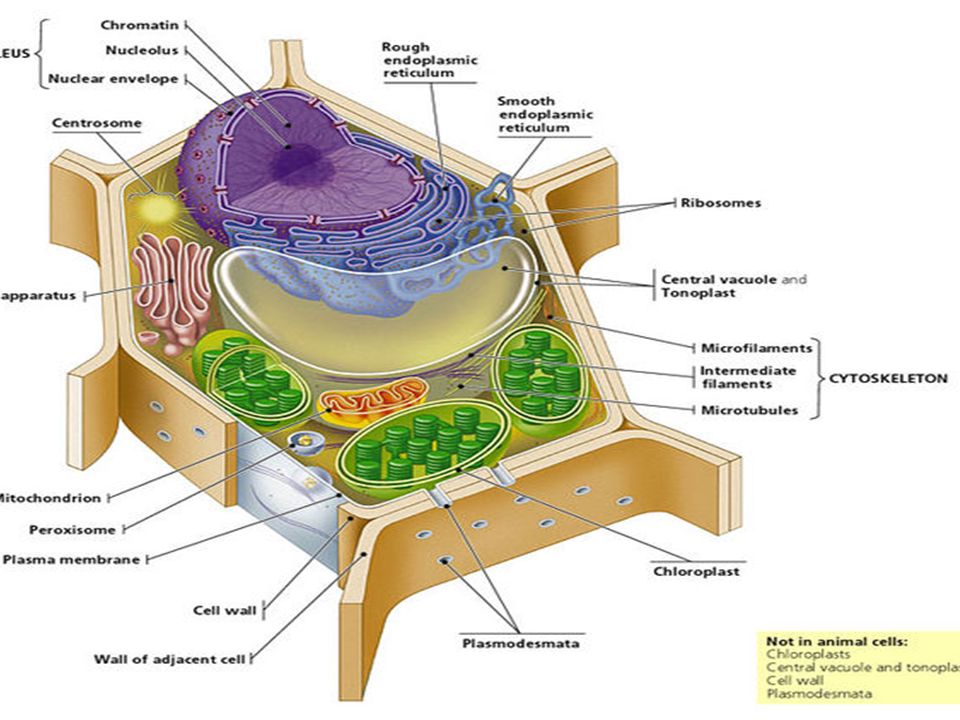 V., Ulvskov P. Hemicelluloses. Annu. Rev. Plant Biol. 2010;61:263-289. DOI 10.1146/annurev-arplant-042809-112315
V., Ulvskov P. Hemicelluloses. Annu. Rev. Plant Biol. 2010;61:263-289. DOI 10.1146/annurev-arplant-042809-112315
78. Schoonbeek H.J., Wang H.H., Stefanato F.L., Craze M., Bowden S., Wallington E., Zipfel C., Ridout C.J. Arabidopsis EF-Tu receptor enhances bacterial disease resistance in transgenic wheat. New Phytol. 2015;206(2):606-613. DOI 10.1111/nph.13356
79. Sella L., Gazzetti K., Faoro F., Odorizzi S., D’Ovidio R., Schafer W., Favaron F. A Fusarium graminearum xylanase expressed during wheat infection is a necrotizing factor but is not essential for virulence. Plant Physiol. Biochem. 2013;64:1-10. DOI 10.1016/j.plaphy. 2012.12.008
80. Senthil-Kumar M., Mysore K.S. Non host resistance against bacterial pathogens: retrospectives and prospects. Annu. Rev. Phytopathol. 2013;51:407-427. DOI 10.1146/annurev-phyto-082712-102319
81. Shadle G.L., Wesley S.W., Korth K.L., Chen F., Lamb C., Dixon R.A. Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of l-phenylalanine ammonia-lyase.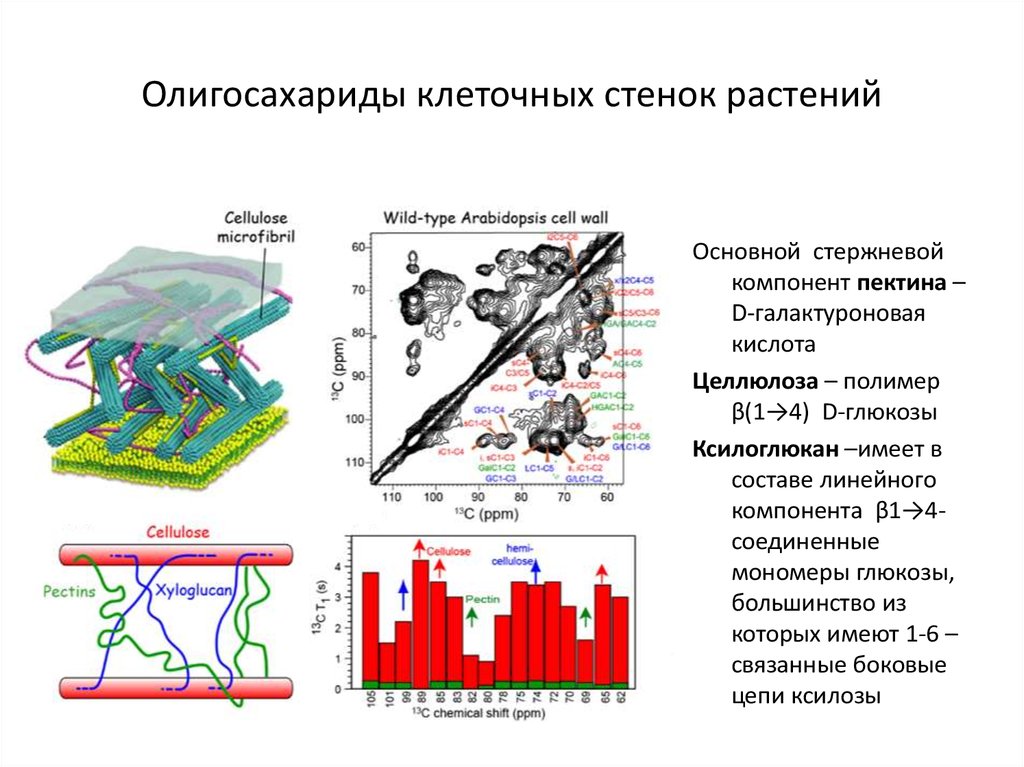 Phytochemistry 2003;64(1):153-161. DOI 10.1016/S0031-9422(03)00151-1
Phytochemistry 2003;64(1):153-161. DOI 10.1016/S0031-9422(03)00151-1
82. Shafiei R., Hang C., Kang J.G., Loake G.J. Identification of loci controlling non-host disease resistance in Arabidopsis against the leaf rust pathogen Puccinia triticina. Mol. Plant Pathol. 2007;8(6):773- 784. DOI 10.1111/j.1364-3703.2007.00431.x
83. Shi H., Liu Z., Zhu L., Zhang C., Chen Y., Zhou Y., Li F., Li X. Overexpression of cotton (Gossypium hirsutum) dirigent 1 gene enhances lignification that blocks the spread of Verticillium dahlia. Acta Biochim.Biophys. Sin. 2012;44(7):555-564. DOI 10.1093/abbs/gms035
84. Shimizu T., Nakano T., Takamizawa D., Desaki Y., Ishii-Minami N., Nishizawa Y., Minami E., Okada K., Yamane H., Kaku H., Shibuya N. Two LysM receptor molecules, CEBiP and OsCERK1, cooperatively regulate chitin elicitor signaling in rice. Plant J. 2010;64(2):204-214. DOI 10.1111/j.1365-313X.2010.04324.x
85. Shinya T., Motoyama N., Ikeda A., Wada M., Kamiya K., Hayafune M., Kaku H.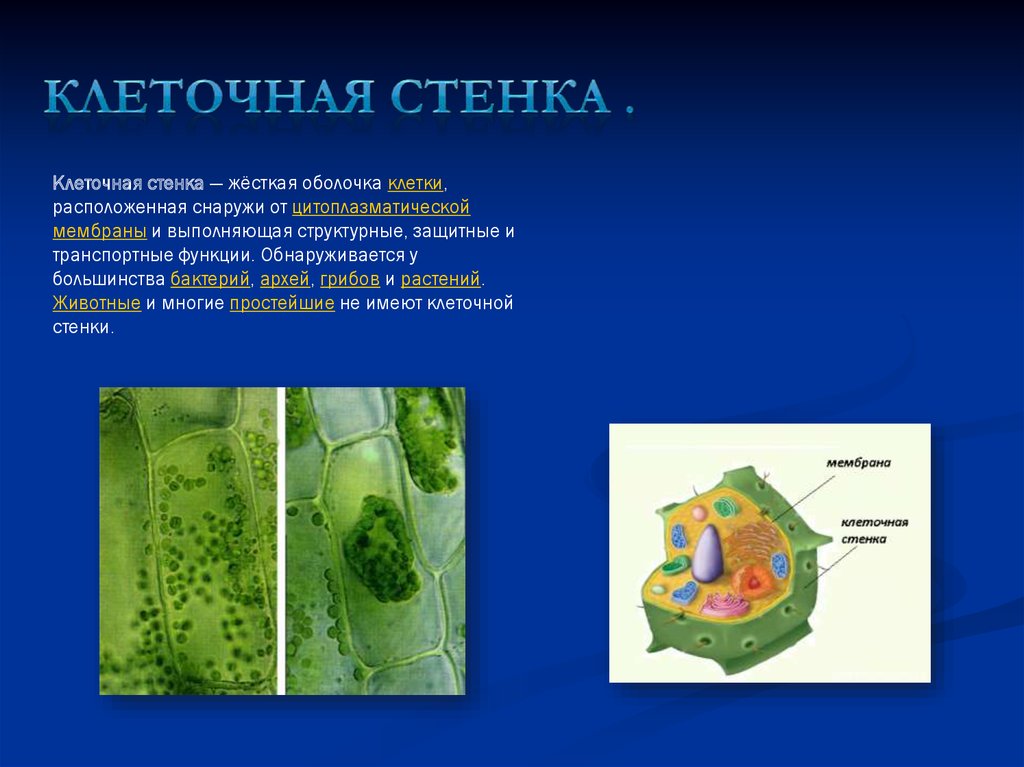 , Shibuya N. Functional characterization of CEBiP and CERK1 homologs in Arabidopsis and rice reveals the presence of different chitin receptor systems in plants. Plant Cell Physiol. 2012;53(10):1696-1706. DOI 10.1093/pcp/pcs113
, Shibuya N. Functional characterization of CEBiP and CERK1 homologs in Arabidopsis and rice reveals the presence of different chitin receptor systems in plants. Plant Cell Physiol. 2012;53(10):1696-1706. DOI 10.1093/pcp/pcs113
86. Smirnova O.G., Ibragimova S.S., Kochetov A.V. Simple database to select promoters for plant transgenesis. Transgenic Res. 2012;21(2): 429-437. DOI 10.1007/s11248-011-9538-2
87. Smirnova O.G., Kochetov A.V. Promoters of plant genes responsive to pathogen invasion. Russ. J. Genet.: Applied Res. 2015;5(3):254-261. DOI: 10.1134/S2079059715030181
88. Smith A.H., Gill W.M., Pinkard E.A., Mohammed C.L. Anatomical and histochemical defence responses induced in juvenile leaves of Eucalyptus globulus and Eucalyptus nitens by Mycosphaerella infection. For. Pathol. 2007;37:361-373. DOI 10.1111/j.1439- 0329.2007.00502.x
89. Szabo L.J., Bushnell W.R. Hidden robbers: the role of fungal haustoria in parasitism of plants. Proc. Natl Acad. Sci. USA. 2001;98(14):7654- 7765. DOI 10.1073/pnas.151262398
DOI 10.1073/pnas.151262398
90. Takken F.L., Thomas C.M., Joosten M.H., Golstein C., Westerink N., Hille J., Nijkamp H.J., De Wit P.J., Jones J.D. A second gene at the tomato Cf-4 locus confers resistance to Cladosporium fulvum through recognition of a novel avirulence determinant. Plant J. 1999;20(3):279-288. DOI 10.1046/j.1365-313X.1999.00601.x
91. Trdá L., Boutrot F., Claverie J., Brulé D., Dorey S., Poinssot B. Perception of pathogenic or beneficial bacteria and their evasion of host immunity: pattern recognition receptors in the frontline. Front Plant Sci. 2015;6:219. DOI 10.3389/fpls.2015.00219
92. Underwood W. The plant cell wall: a dynamic barrier against pathogen invasion. Front Plant Sci. 2012;3:85. DOI 10.3389/fpls.2012.00085
93. van den Burg H.A., Harrison S.J., Joosten M.H., Vervoort J., De Wit P.J. Cladosporium fulvum Avr4 protects fungal cell walls against hydrolysis by plant chitinases accumulating during infection. Mol. Plant Microbe Interact. 2006;19(12):1420-1430.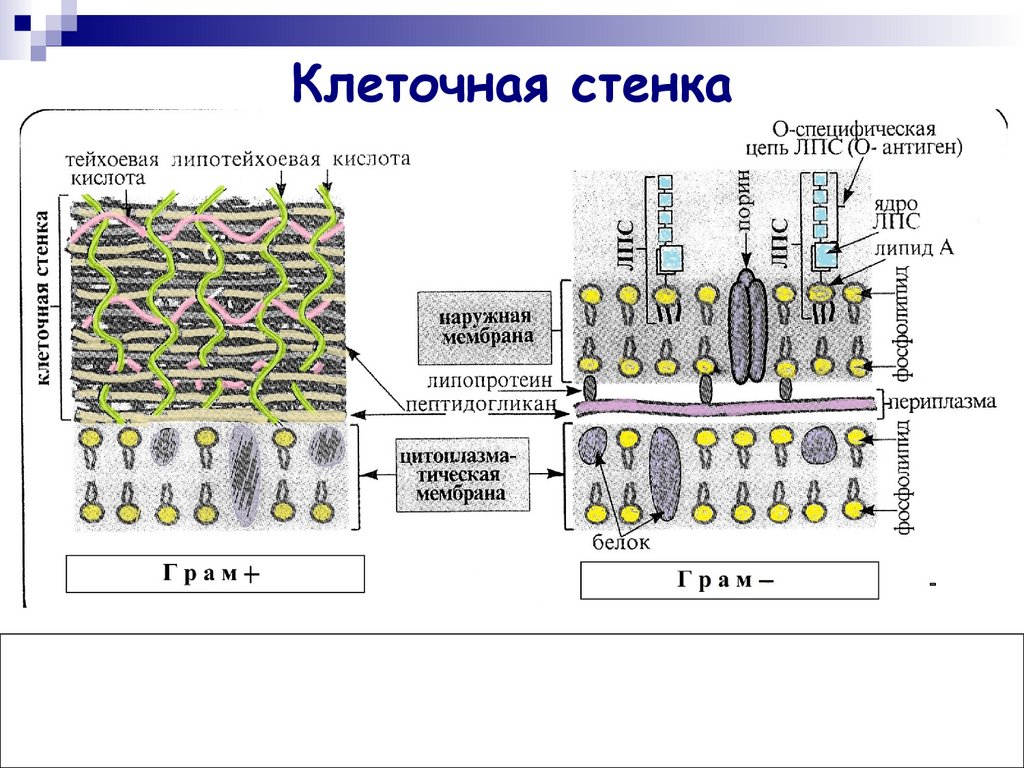
94. van Esse H.P., Bolton M.D., Stergiopoulos I., de Wit P.J., Thomma B.P. The chitin-binding Cladosporium fulvum effector protein Avr4 is a virulence factor. Mol. Plant Microbe Interact. 2007;20(8):1092-1101.
95. Voigt C.A. Callose-mediated resistance to pathogenic intruders in plant defense-related papillae. Front Plant Sci. 2014;5:168. DOI 10.3389/fpls.2014.00168
96. Wang K., Senthil-Kumar M., Ryu C.M., Kang L., Mysore K.S. Phytosterols play a key role in plant innate immunity against bacterial pathogens by regulating nutrient efflux into the apoplast. Plant Physiol. 2012;158(4):1789-1802. DOI 10.1104/pp.111.189217
97. Way H.M., Kazan K., Mitter N., Goulter K.C., Birch R.G., Manners J. M. Constitutive expression of a phenylalanine ammonia-lyase gene from Stylosanthes humilis in transgenic tobacco leads to enhanced disease resistance but impaired plant growth. Physiol. Mol. Plant Pathol. 2002;60(6):275-282. DOI 10.1006/pmpp.2002.0407
98. Wiesel L., Newton A.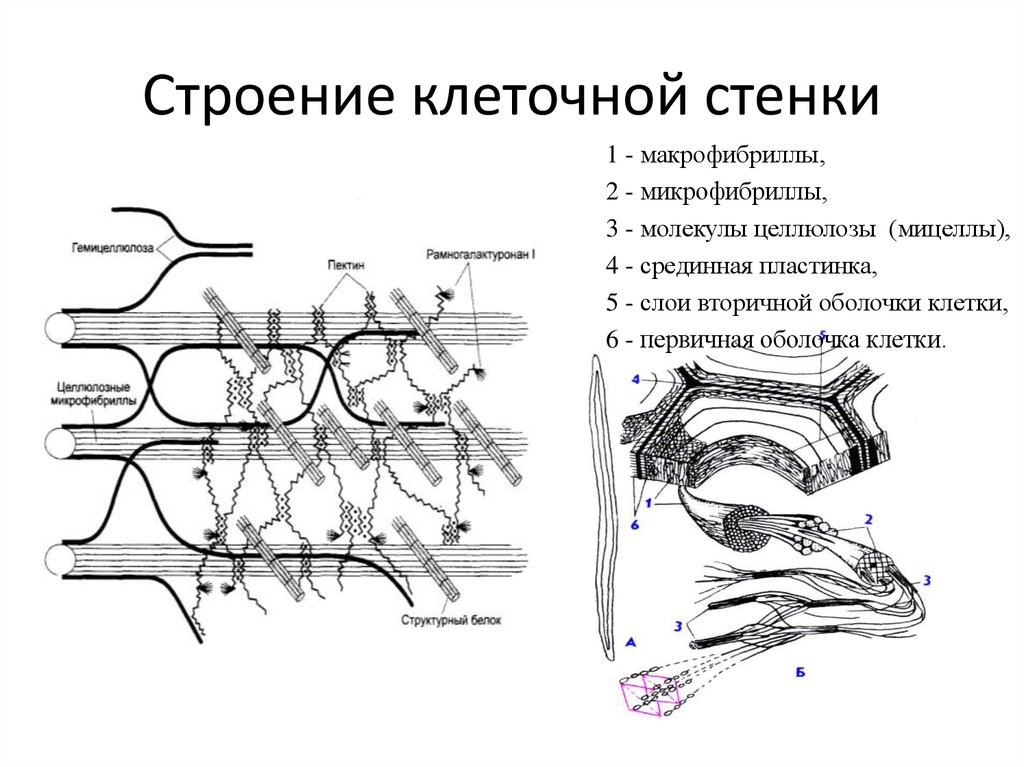 C., Elliott I., Booty D., Gilroy E.M., Birch P.R., Hein I. Molecular effects of resistance elicitors from biological origin and their potential for crop protection. Front Plant Sci. 2014;5:655. DOI 10.3389/fpls.2014.00655
C., Elliott I., Booty D., Gilroy E.M., Birch P.R., Hein I. Molecular effects of resistance elicitors from biological origin and their potential for crop protection. Front Plant Sci. 2014;5:655. DOI 10.3389/fpls.2014.00655
99. Wróbel-Kwiatkowska M., Starzycki M., Zebrowski J., Oszmiañski J., Szopa J. Lignin deficiency in transgenic flax resulted in plants with improved mechanical properties. J. Biotechnol. 2007;128(4):919-934. DOI 10.1016/j.jbiotec.2006.12.030
100. Xu L., Zhu L., Tu L., Liu L., Yuan D., Jin L., Long L., Zhang X. Lignin metabolism has a central role in the resistance of cotton to the wilt fungus Verticillium dahliae as revealed by RNA-Seq-dependent transcriptional analysis and histochemistry. J. Exp. Bot. 2011;62: 5607-5621.
101. Zipfel C. Plant pattern-recognition receptors. Trends Immunol. 2014; 35(7):345-351. DOI 10.1016/j.it.2014.05.004
102. Zhang H., Wang C., Cheng Y., Wang X., Li F., Han Q., Xu J., Chen X., Huang L., Wei G., Kang Z. Histological and molecular studies of the non-host interaction between wheat and Uromyces fabae. Planta. 2011;234(5):979-991. DOI 10.1007/s00425-011-1453-5
Planta. 2011;234(5):979-991. DOI 10.1007/s00425-011-1453-5
103. Zhao J., Buchwaldt L., Rimmer S.R., Sharpe A., Mcgregor L., Bekkoui D., Heqedus D. Patterns of differential gene expression in Brassica napus cultivars infected with Sclerotinia sclerotiorum. ol. Plant Pathol. 2009;10(5):635-649. DOI 10.1111/j.1364-3703. 2009.00558.x
Клеточная стенка (оболочка) растений
Если выделить
любую клетку из организма животного и
поместить ее в воду, то через короткое
время клетка после набухания лопнет,
лизируется. Это происходит из-за того,
что через плазматическую мембрану вода
будет поступать в цитоплазму, в зону с
более высокой концентрацией солей и
органических молекул. При этом будет
увеличиваться внутренний объем клетки
до тех пор, пока не разорвется плазматическая
мембрана. В составе организма животных
этого не происходит, потому что клетки
низших и высших животных существуют в
окружении жидкостей внутренней среды,
концентрация солей и веществ в которой
близка к таковой в цитоплазме.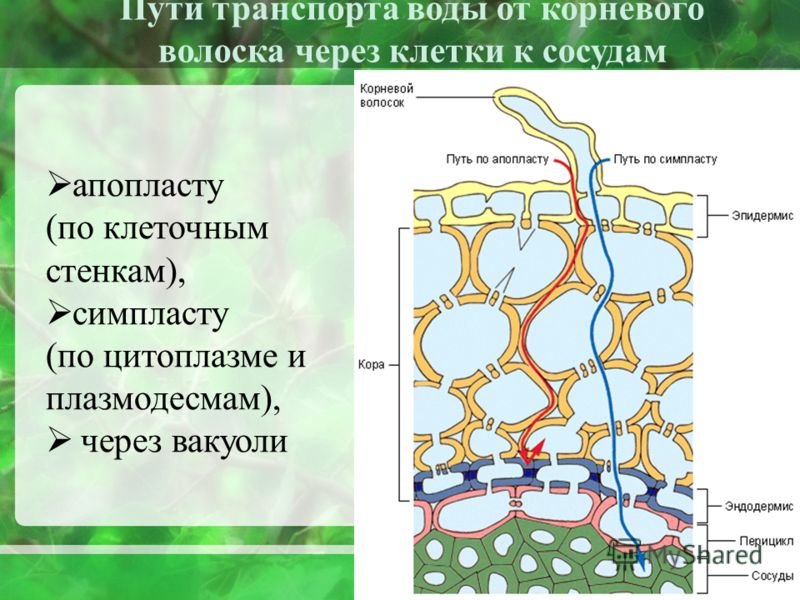
Свободноживущие в пресной воде
одноклеточные простейшие организмы не
лизируются (при отсутствии клеточной
стенки) из-за того, что у них постоянно
работает клеточный насос, откачивающий
воду из цитоплазмы, — сократительная
вакуоль.
Если же мы в воду
поместим клетки бактерий или растений,
то они не будут лизироваться до тех пор,
пока цела их клеточная стенка. Воздействием
набора различных ферментов эти стенки
можно растворить. В этом случае моментально
происходит набухание и разрыв, лизис,
клеток. Следовательно, в естественных
условиях клеточная стенка предотвращает
этот гибельный для клетки процесс. Более
того, наличие клеточных стенок является
одним из главных факторов, регулирующих
поступление воды в клетку. Клетки
бактерий и растений обитают чаще всего
в гипотонической водной среде, они не
имеют сократительных (выделительных)
вакуолей, чтобы откачать воду, но зато
прочная клеточная стенка предохраняет
их от чрезвычайного набухания. По мере
поступления воды в клетке возникает
внутреннее давление, тургор, которое
препятствует дальнейшему поступлению
воды.
Интересно, что у
многих низших растений, например у
зеленых водорослей, клетки имеют хорошо
сформированную клеточную оболочку, но
при половом размножении, когда образуются
подвижные зооспоры, последние теряют
клеточную оболочку и у них появляются
пульсирующие вакуоли.
Клеточная
стенка растений формируется при участии
плазматической мембраны и является
экстраклеточным (внеклеточным)
многослойным образованием, защищающим
поверхность клетки, служащим как бы
наружным скелетом растительной клетки
(рис.
158). Клеточная стенка растений состоит
из двух компонентов: аморфного пластичного
гелеобразного матрикса (основы) с высоким
содержанием воды и опорной фибриллярной
системы. Часто для придания свойств
жесткости, несмачиваемости и др. в состав
оболочек входят дополнительные полимерные
вещества и соли.
В химическом
отношении главные компоненты оболочек
растений относятся к структурным
полисахаридам.
В состав матрикса
оболочек растений входят гетерогенные
группы полисахаридов, растворяющиеся
в концентрированных щелочах, гемицеллюлозы
и пектиновые вещества.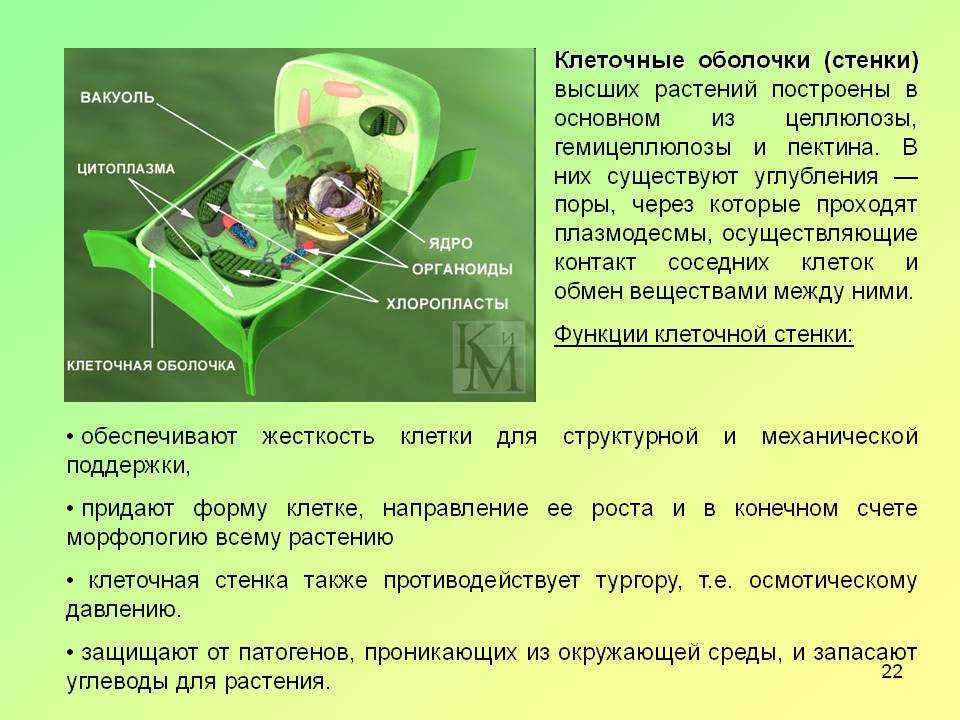 Гемицеллюлозы
Гемицеллюлозы
представляют собой ветвящиеся полимерные
цепи, состоящие из различных гексоз
(глюкоза, манноза, галактоза и др.), пентоз
(ксилоза, арабиноза) и уроновых кислот
(глюкуроновая и галактуроновая кислоты).
Эти компоненты гемицеллюлоз сочетаются
между собой в разных количественных
отношениях и образуют разнообразные
комбинации. Цепи гемицеллюлозных молекул
не кристаллизуются и не образуют
элементарных фибрилл. Из-за наличия
полярных групп уроновых кислот они
сильно гидратированы.
Пектиновые вещества
— гетерогенная группа, в которую входят
разветвленные сильно гидратированные
полимеры, несущие отрицательные заряды
из-за множества остатков галактуроновой
кислоты. Благодаря свойствам своих
компонентов матрикс представляет собой
мягкую пластическую массу, укрепленную
фибриллами.
Волокнистые
компоненты клеточных оболочек растений
состоят обычно из целлюлозы, линейного,
неветвящегося полимера глюкозы.
Молекулярный вес целлюлозы варьирует
от 5 х 104
до 5 х 105,
что соответствует 300-3000 остаткам глюкозы.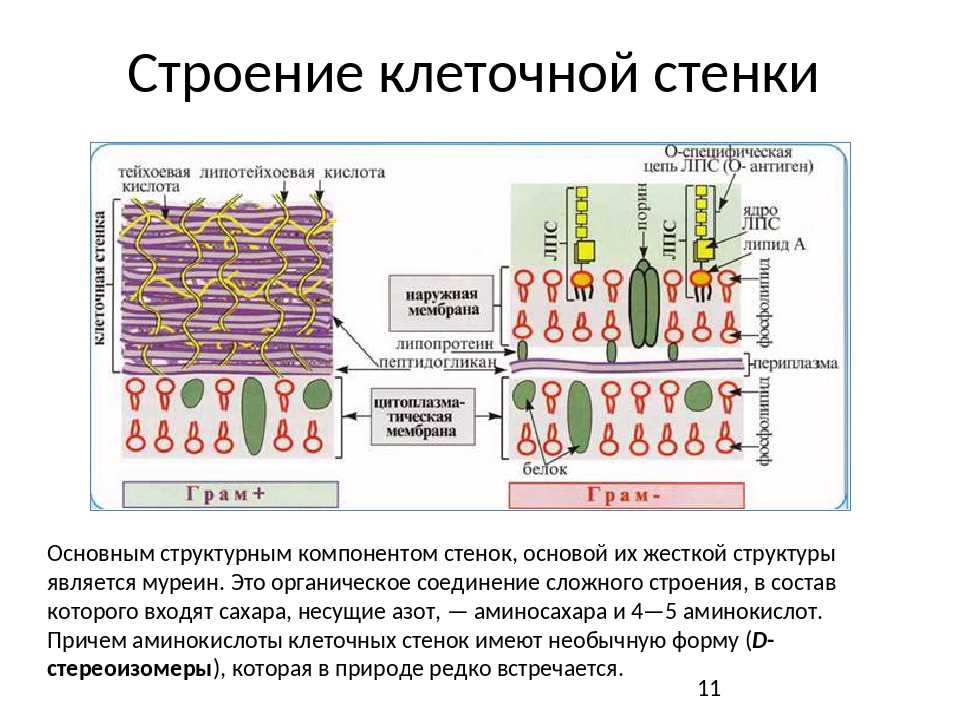
Такие линейные молекулы целлюлозы могут
соединяться в пучки или волокна. В
клеточной оболочке целлюлоза образует
фибриллы, которые состоят из
субмикроскопических микрофибрилл
толщиной до 25 нм, которые в свою очередь
состоят из множества параллельно лежащих
цепей молекул целлюлозы.
Количественные
соотношения целлюлозы к веществам
матрикса (гемицеллюлозы) могут быть
весьма различными у разных объектов.
Свыше 60% сухого веса первичных оболочек
составляет их матрикс и около 30% приходится
на скелетное вещество — целлюлозу. В
сырых клеточных оболочках почти вся
вода связана с гемицеллюлозами, поэтому
вес основного вещества в набухшем
состоянии достигает 80% сырого веса всей
оболочки, тогда как содержание волокнистых
веществ сводится всего к 12%. В случае же
другого примера, волоски хлопчатника,
целлюлозный компонент составляет 90%; в
древесине целлюлоза составляет 50% от
компонентов клеточной стенки.
Кроме
целлюлозы, гемицеллюлозы и пектинов в
состав клеточных оболочек входят
дополнительные компоненты, придающие
им особые свойства.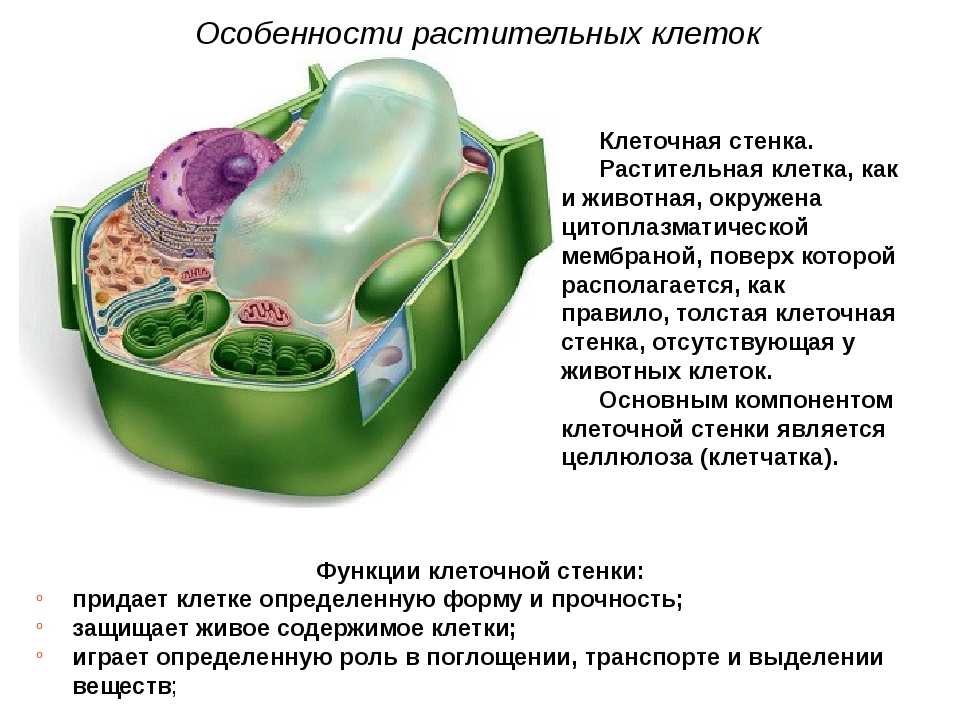 Так, инкрустация
Так, инкрустация
(включение внутрь) оболочек лигнином
(полимер кониферилового спирта) приводит
к одревеснению клеточных стенок,
повышению их прочности (рис.
159). Лигнин замещает в таких оболочках
пластические вещества матрикса и играет
роль основного вещества, обладающего
высокой прочностью. Часто матрикс бывает
укреплен минеральными веществами (SiO2,
CaCO3
и др.).
На поверхностях
клеточной оболочки могут скапливаться
различные адкрустирующие вещества,
например кутин и суберин, приводящие к
опробковению клеток. В клетках эпидермиса
на поверхности клеточных оболочек
откладывается воск, который образует
водонепроницаемый слой, препятствующий
потере клеткой воды.
Из-за своего
пористого, рыхлого строения клеточная
стенка растений проницаема в значительной
степени для низкомолекулярных соединений,
таких как вода, сахара и ионы. Но
макромолекулы проникают через целлюлозные
оболочки плохо: величина пор в оболочках,
позволяющая свободную диффузию веществ
составляет всего лишь 3-5 нм.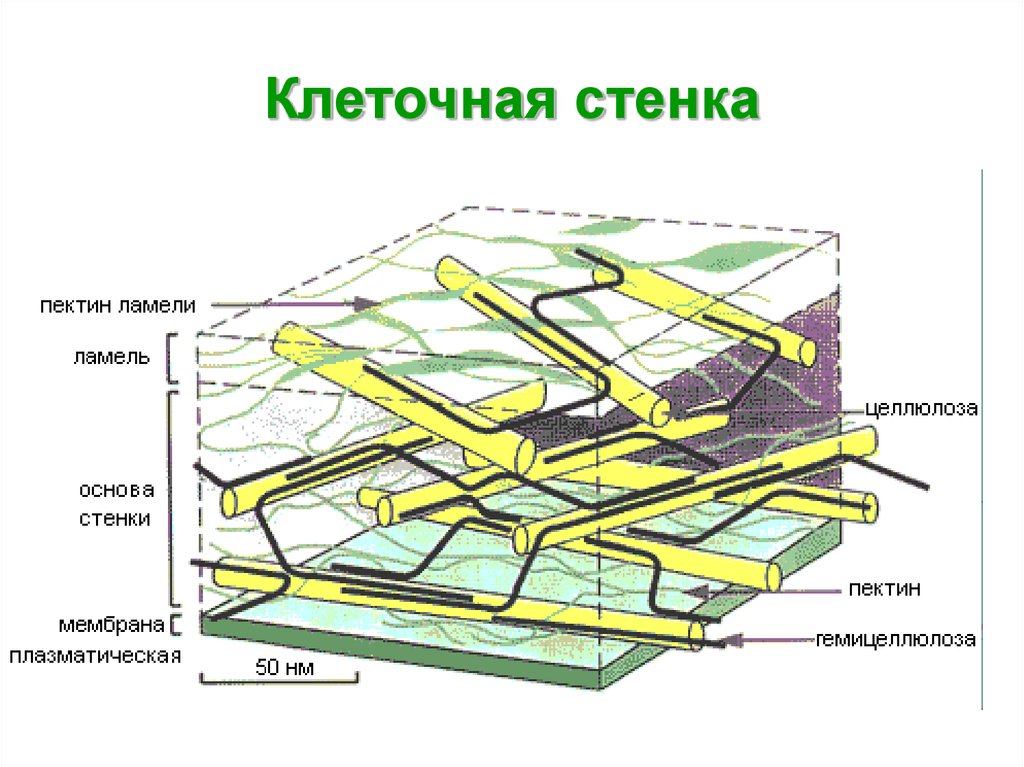
Опыты с мечеными
соединениями показали, что при росте
клеточной оболочки выделение веществ,
из которых она строится, происходит по
всей поверхности клетки. Аморфные
вещества матрикса, гемицеллюлозы и
пектины синтезируются в вакуолях
аппарата Гольджи и выделяются через
плазмолемму путем экзоцитоза. Фибриллы
целлюлозы синтезируются специальными
ферментами, встроенными в плазмолемму.
Оболочки
дифференцированных, зрелых, клеток
обычно многослойные, в слоях фибриллы
целлюлозы ориентированы по-разному, и
количество их также может значительно
колебаться. Обычно описывают первичные,
вторичные и третичные клеточные оболочки
(рис.
158). Для того чтобы разобраться в строении
и появлении этих оболочек, необходимо
познакомиться с тем, как же возникают,
образуются клеточные оболочки после
деления клеток.
При
делении клеток растений после расхождения
хромосом в экваториальной плоскости
клеток появляется скопление мелких
мембранных пузырьков, которые в
центральной части клеток начинают
сливаться друг с другом (рис.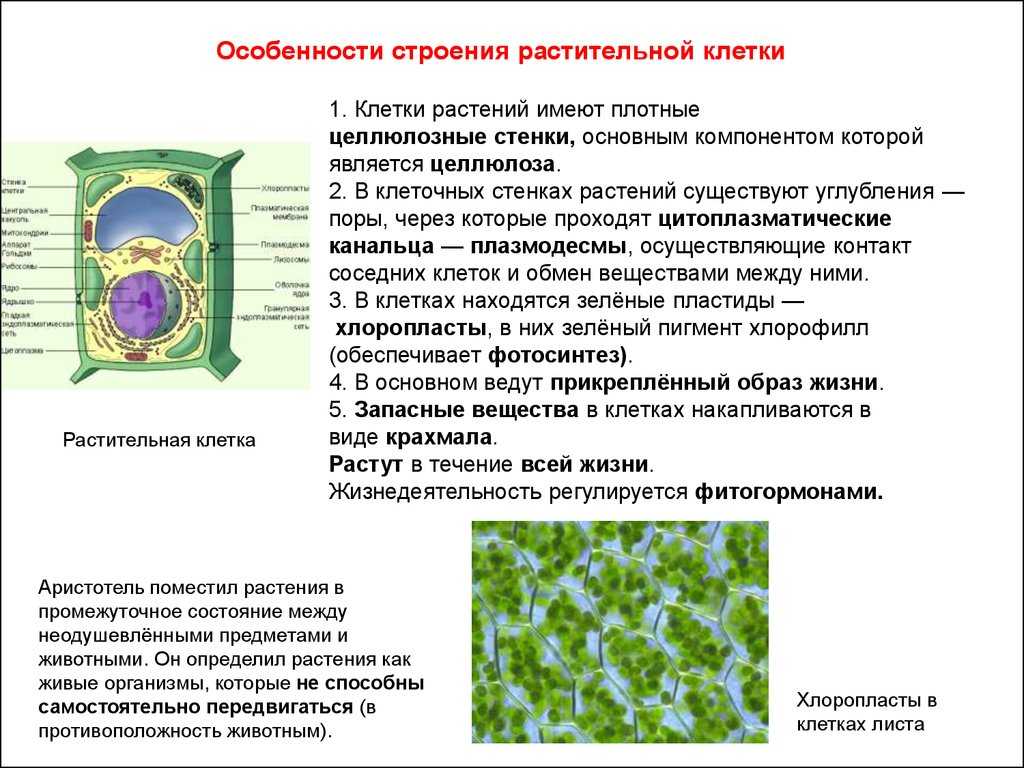
160). Этот процесс слияния мелких вакуолей
происходит от центра клетки к периферии
и продолжается до тех пор, пока мембранные
пузырьки не сольются между собой и с
плазматической мембраной боковой
поверхности клетки. Так образуется
клеточная
пластинка
или фрагмопласт.
В центральной части ее располагается
аморфное вещество матрикса, которое
наполняло сливающиеся пузырьки. Доказано,
что эти первичные вакуоли происходят
от мембран аппарата Гольджи. В состав
первичной клеточной стенки входит также
небольшое количество белка (около 10%),
богатого гидроксипролином. имеющего
множество коротких олигосахаридных
цепей, что определяет этот белок как
гликопротеид. По периферии клеточной
пластинки при наблюдении ее в поляризованном
свете обнаруживается заметное двойное
лучепреломление, вызванное тем, что в
этом месте располагаются ориентированные
фибриллы целлюлозы. Таким образом,
растущая первичная клеточная стенка
состоит уже из трех слоев: центральный
— срединная пластинка, состоящая только
из аморфного матрикса, и два периферических
— первичная оболочка, содержащая
гемицеллюлозу и целлюлозные фибриллы.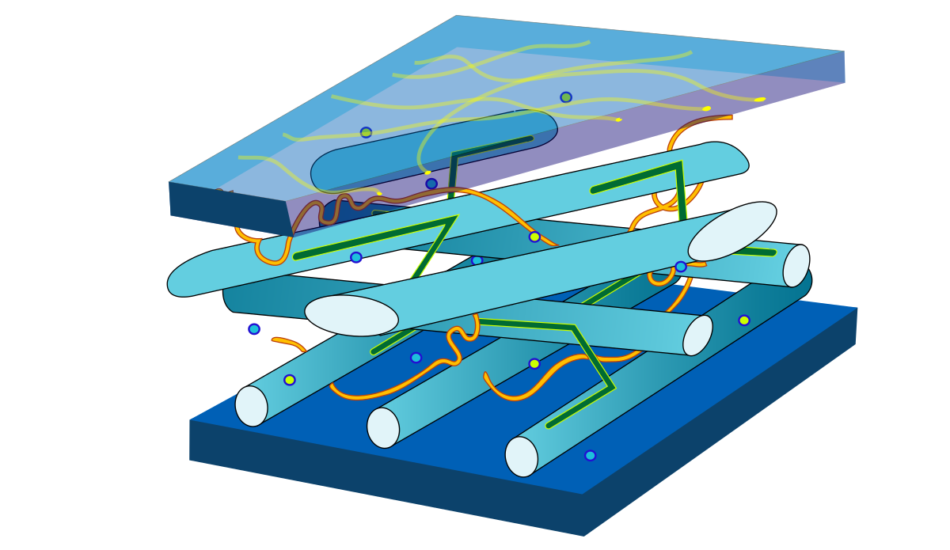
Если срединная пластинка — это продукт
активности еще исходной клетки, то
первичная оболочка образуется за счет
выделения гемицеллюлозы и фибрилл
целлюлозы уже двумя новыми клеточными
телами. И все дальнейшее увеличение
толщины клеточной (вернее, межклеточной)
стенки будет происходить за счет
активности двух дочерних клеток, которые
с противоположных сторон будут выделять
вещества клеточной оболочки, утолщающейся
путем подслаивания все новых и новых
пластов. Так же как и с самого начала,
выделение веществ матрикса происходит
за счет подхода к плазматической мембране
пузырьков аппарата Гольджи, слияния их
с мембраной и высвобождения их содержимого
за пределы цитоплазмы. Здесь же вне
клетки на ее плазматической мембране
идет синтез и полимеризация целлюлозных
фибрилл. Так постепенно образуется
вторичная клеточная оболочка. С
достаточной точностью определить и
суметь отличить первичную оболочку от
вторичной трудно, так как они соединены
между собой несколькими промежуточными
слоями.
Основную массу
закончившей свое формирование клеточной
стенки составляет вторичная оболочка.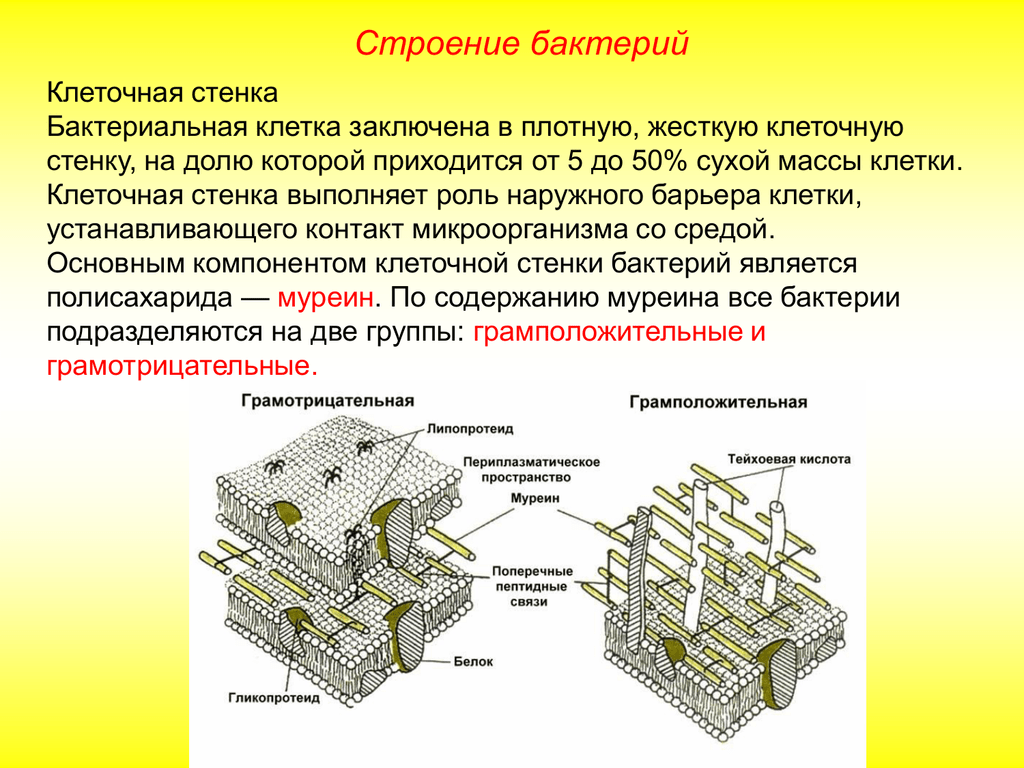
Она придает клетке ее окончательную
форму. После разделения клетки на две
дочерних происходит рост новых клеток,
увеличение их объема и изменение формы;
клетки часто вытягиваются в длину.
Одновременно с этим идет наращивание
толщины клеточной оболочки и перестройка
ее внутренней структуры.
При образовании
первичной клеточной оболочки в ее
составе еще мало целлюлозных фибрилл,
и они располагаются более или менее
перпендикулярно будущей продольной
оси клетки, позже в период растяжения
(удлинения клетки за счет роста вакуолей
в цитоплазме) ориентация этих
поперечно-направленных фибрилл
подвергается пассивным изменениям:
фибриллы начинают размещаться под
прямым углом друг к другу и в конечном
счете оказываются вытянутыми более или
менее параллельно продольной оси клетки.
Постоянно идет процесс: в старых слоях
(ближе к центру оболочки) фибриллы
подвергаются пассивным сдвигам, а
отложение новых фибрилл во внутренних
слоях (ближайших к мембране клетки)
продолжается в соответствии с исходным
планом конструкции оболочки.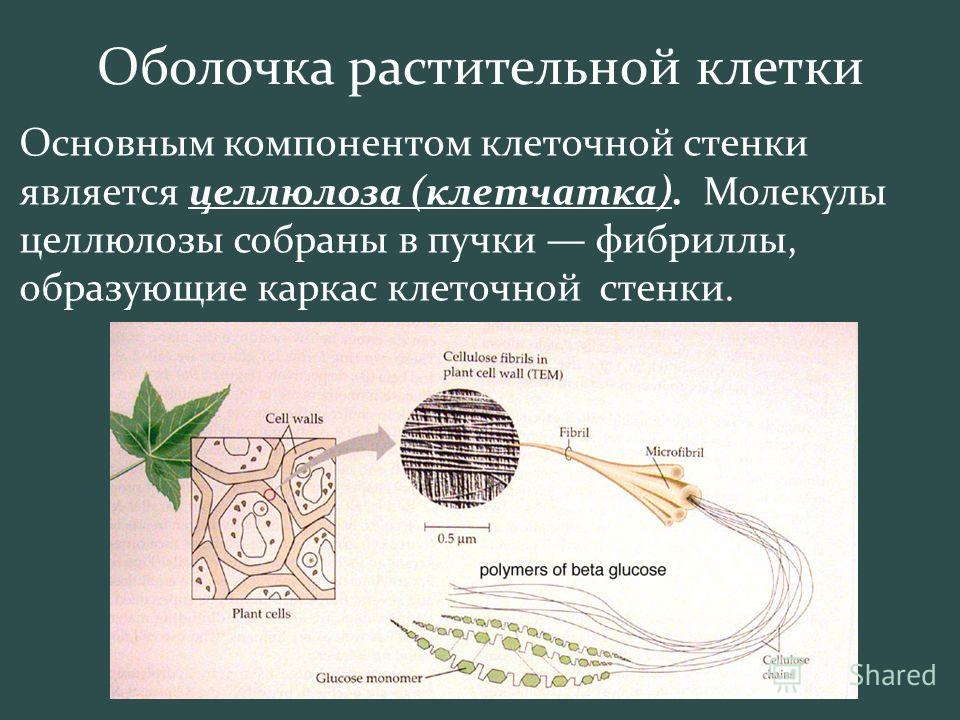 Этот
Этот
процесс создает возможность скольжения
фибрилл относительно друг друга, а
перестройка арматуры клеточной оболочки
возможна из-за студенистого состояния
компонентов ее матрикса. В дальнейшем
при замещении в матриксе гемицеллюлозы
на лигнин подвижность фибрилл резко
снижается, оболочка становится плотной,
происходит одревеснение.
Часто под вторичной
оболочкой обнаруживают третичную
оболочку, которую можно рассматривать
как засохший остаток дегенерировавшего
слоя собственно цитоплазмы.
Следует отметить,
что при делении клеток растений
формированию первичной оболочки не во
всех случаях предшествует образование
клеточной пластинки. Так, у зеленой
водоросли спирогиры новые поперечные
перегородки возникают путем образования
на боковых стенках исходной клетки
выступов, которые, постепенно разрастаясь
к центру клетки, смыкаются и делят клетку
надвое.
Как
уже говорилось, если в водной гипотонической
среде лишить клетку ее оболочки, то
произойдет лизис, разрыв клетки.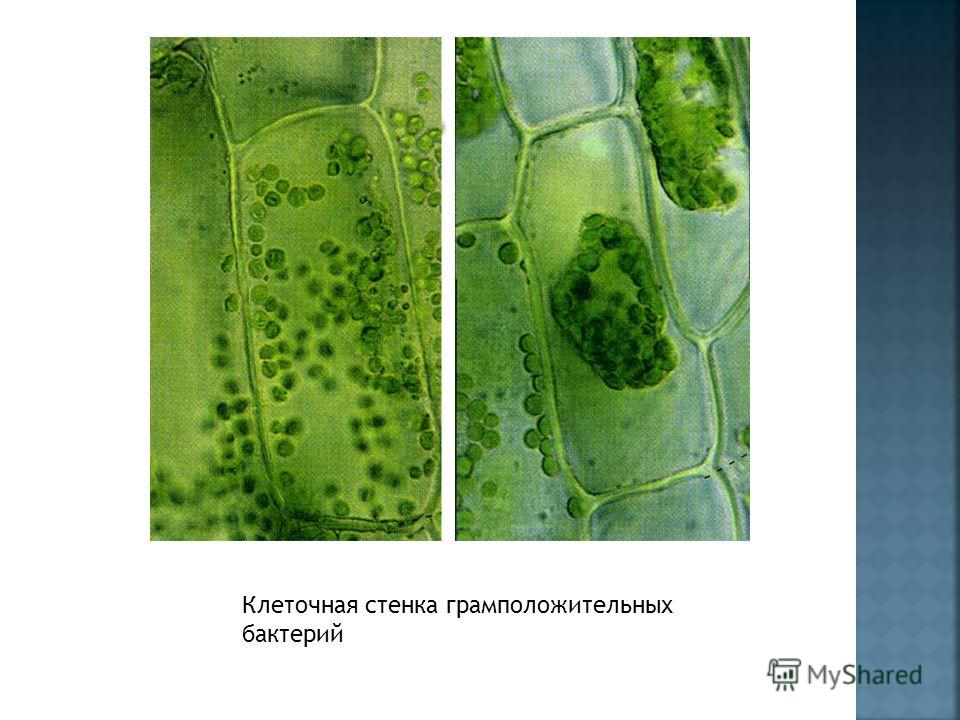
Оказалось, что, подбирая соответствующие
концентрации солей и сахаров, можно
уравнять осмотические давления снаружи
и внутри клеток, лишенных своих оболочек.
При этом такие протопласты
приобретают шаровидную форму (сферопласты).
Если в среде, где находятся протопласты,
будет достаточное количество питательных
веществ и солей (среди них необходим
Ca2+),
то клетки снова восстанавливают ,
регенерируют свою клеточную оболочку.
Более того, они способны в присутствии
гормонов — ауксинов — делиться и создавать
клеточные колонии, которые могут дать
начало для роста целого растения, от
которого была взята клетка.
Главный волокнистый
компонент клеточной стенки больших
групп грибов (базибиомицеты, аскомицеты,
зигомицеты) — хитин, полисахарид, где
основным сахаридом является
N-ацетилглюкозамин. В состав клеточной
стенки грибов кроме хитина могут входить
вещества матрикса, гликопротеиды и
различные белки, синтезированные в
цитоплазме и выделенные клеткой наружу.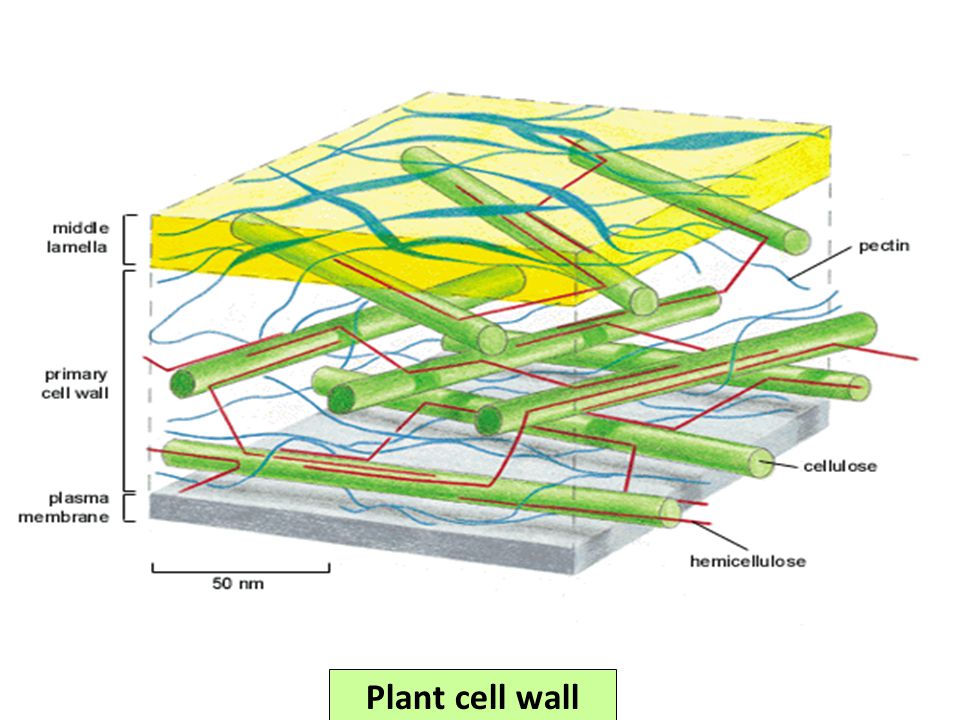
Клеточные
оболочки бактерий
Опорным
каркасом клеточной стенки бактерий и
синезеленых водорослей также служит в
значительной степени однородный полимер
— пептидогликан или муреин. Жесткий
каркас, окружающий бактериальную клетку,
представляет собой одну гигантскую
мешковидную молекулу сложного
полисахарида-пептида. Каркас этот
называют муреиновым мешком. Основа
структуры муреинового мешка — сеть
параллельных полисахаридных цепей,
построенных из чередующихся дисахаридов
(ацетилглюкозамин, соединенный с
ацетилмурамовой кислотой), связанных
многочисленными пептидными поперечными
связями (рис.
161). Длина цепочек гликана может быть
огромной — до нескольких сот дисахаридных
блоков. Основу пептидной части муреина
составляют тетрапептиды, образованные
различными аминокислотами.
Бактериальная
стенка может составлять до 20-30% от сухого
веса бактерии. Это связано с тем, что в
ее состав кроме многослойного муреинового
каркаса входит большое количество
дополнительных компонентов, как и в
матриксе стенки растений. У грамположительных
У грамположительных
бактерий (при окраске по Граму (окраска
кристаллическим фиолетовым, обработка
иодом, отмывка спиртом) бактерии
по-разному воспринимают краситель:
грамположительные остаются окрашенными
после обработки спиртом; грамотрицательные
обесцвечиваются). сопутствующими
компонентами служат полимерные вещества,
сложным образом вплетенные в муреиновую
сеть. К ним относятся тейхоевые кислоты,
полисахариды, полипептиды и белки.
Клеточная стенка грамположительных
бактерий обладает большой жесткостью,
ее муреиновая сеть многослойна.
Стенки
грамотрицательных бактерий содержат
однослойную муреиновую сеть, составляющую
12% сухой массы стенки. Сопутствующие
компоненты составляют до 80% сухой массы.
Это липопротеиды, сложные липополисахариды.
Они образуют сложную наружную
липопротеиновую мембрану. Следовательно,
периферия грамотрицательных бактерий
содержит наружную мембрану, затем
однослойную муреиновую сеть, ниже нее
расположена плазматическая мембрана
(рис.
162). Наружная мембрана обеспечивает
Наружная мембрана обеспечивает
структурную целостность клетки, служит
барьером, ограничивающим свободный
доступ разных веществ к плазматической
мембране. На ней также могут располагаться
рецепторы для бактериофагов. Она содержит
белки-порины,
которые участвуют в переносе многих
низкомолекулярных веществ. Молекулы
порина образуют тримеры, проходящие
сквозь толщу мембраны. Одна из функций
этих белков — формирование в мембране
гидрофильных пор, через которые происходит
диффузия молекул, не более 900 дальтон.
Через поры проходят свободно сахара,
аминокислоты, небольшие олигосахариды
и пептиды. Поры образованы разными
поринами, обладают разной проницаемостью.
Между
внешней липопротеидной мембраной
бактериальной стенки и плазматической
мембраной лежит периплазматическое
пространство
или периплазма.
Ее толщина обычно составляет около 10
нм, она содержит тонкий (1-3 нм) муреиновый
слой и раствор, содержащий специфические
белки двух типов — гидролитические
ферменты и транспортные белки.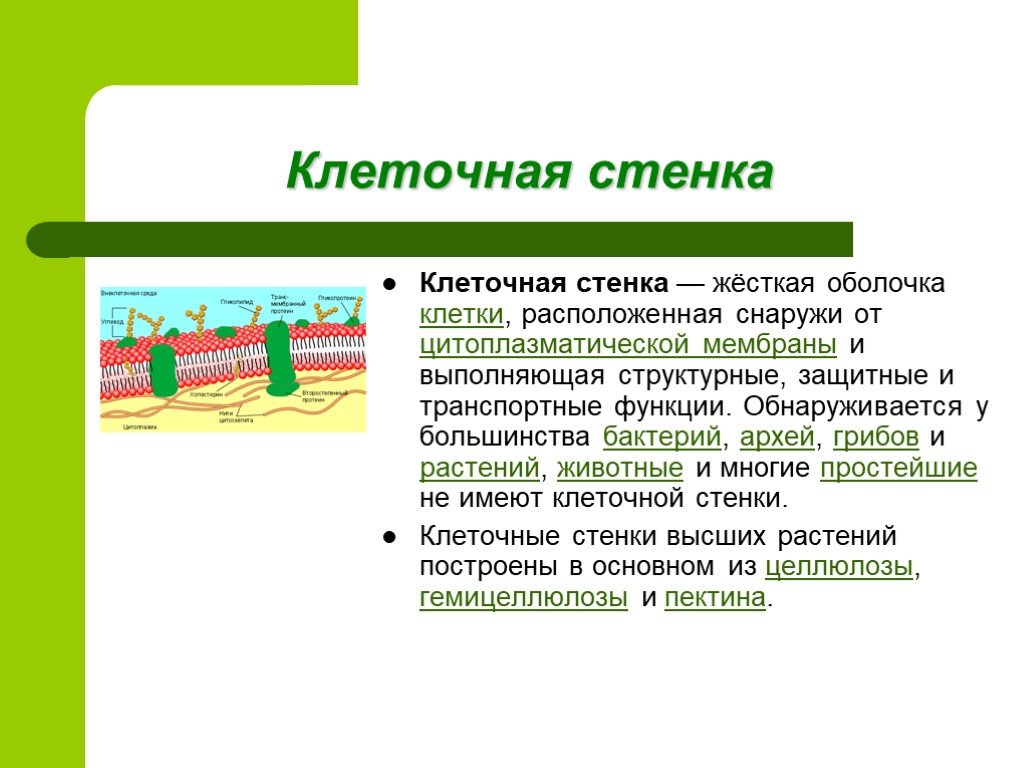 Из-за
Из-за
наличия гидролаз иногда периплазму
рассматривают как аналог лизосомного
компартмента эукариот. Периплазматические
транспортные белки связывают и переносят
сахара, аминокислоты и др. от внешней
мембраны к плазмолемме.
Предшественники
стенок бактерий синтезируются внутри
клетки, сборка стенок происходит снаружи
от плазматической мембраны.
Под действием
фермента лизоцима можно разорвать
муреиновый каркас и растворить
бактериальную стенку. В гипотонических
условиях клетки при этом разрушаются,
как разрушаются голые клетки животных
и растений; в изотонических условиях
образуются шаровидные протопласты,
которые способны снова вырабатывать
свою клеточную стенку.
Интересно, что
протопласты бактерий нечувствительны
к действию бактериофагов- вирусов,
паразитирующих на бактериях. Следовательно,
компоненты бактериальной стенки обладают
антигенной специфичностью по отношению
к этим вирусам.
| gif»> | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
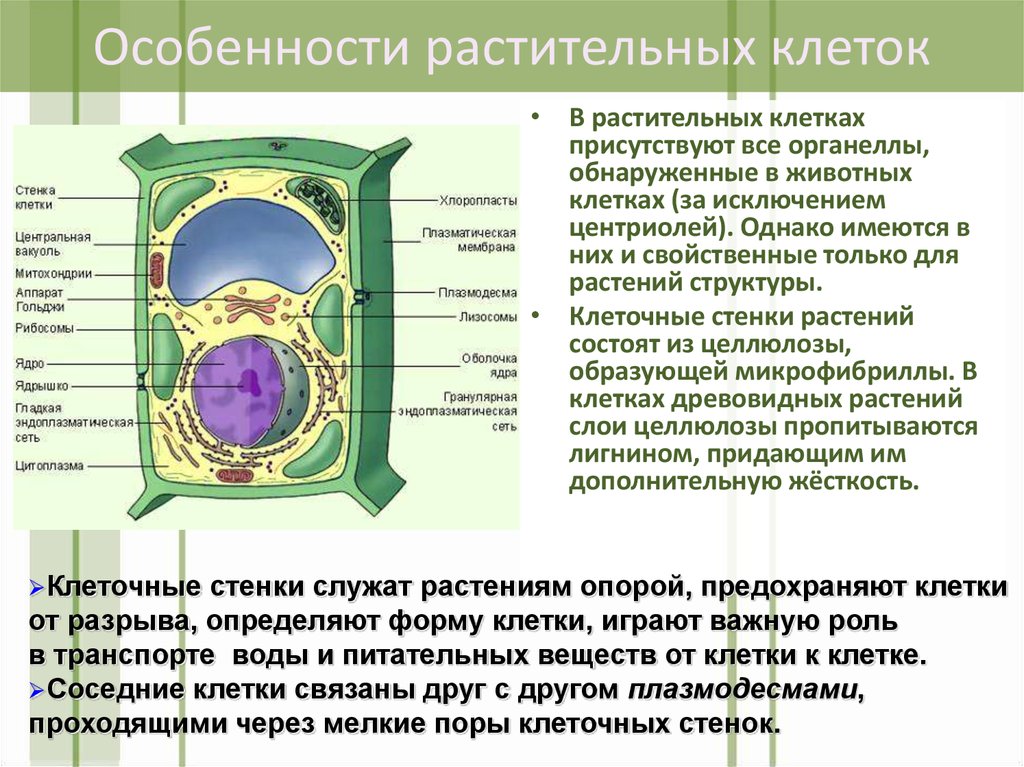
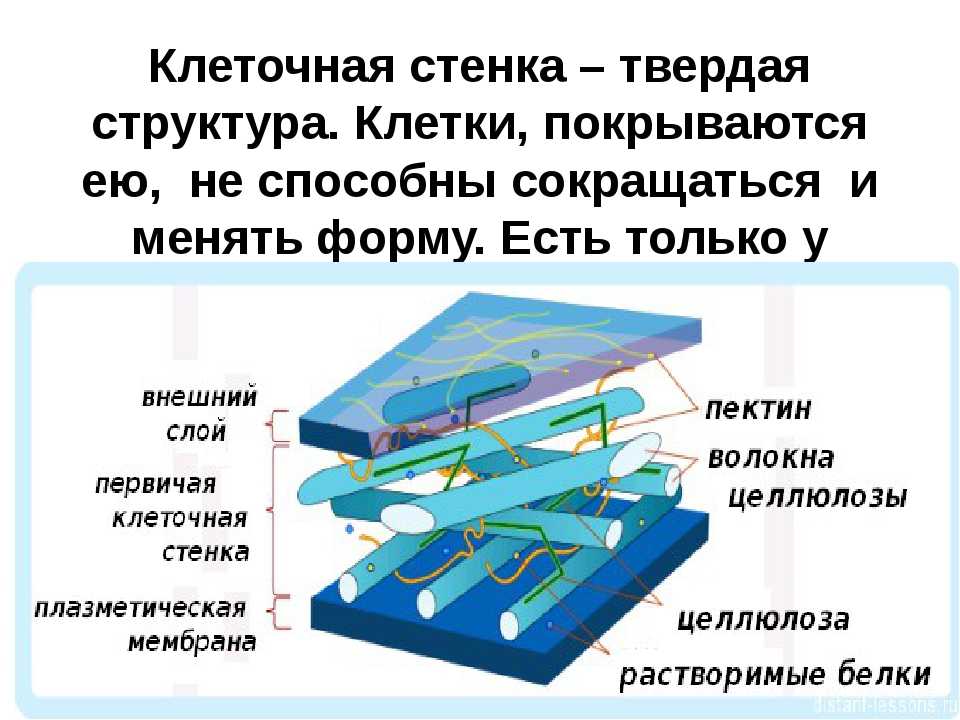
Растительная клеточная стенка
Одной из важнейших отличительных черт растительных клеток является наличие клеточной стенки. Относительная жесткость клеточной стенки делает растения малоподвижными, в отличие от животных, у которых отсутствие этого типа строения обеспечивает их клеткам большую гибкость, необходимую для передвижения. Клеточная стенка растений выполняет множество функций. Наряду с защитой внутриклеточного содержимого структура придает растению жесткость, обеспечивает пористую среду для циркуляции и распределения воды, минералов и других питательных веществ, а также содержит специальные молекулы, которые регулируют рост и защищают растение от болезней. 903:50
Относительная жесткость клеточной стенки делает растения малоподвижными, в отличие от животных, у которых отсутствие этого типа строения обеспечивает их клеткам большую гибкость, необходимую для передвижения. Клеточная стенка растений выполняет множество функций. Наряду с защитой внутриклеточного содержимого структура придает растению жесткость, обеспечивает пористую среду для циркуляции и распределения воды, минералов и других питательных веществ, а также содержит специальные молекулы, которые регулируют рост и защищают растение от болезней. 903:50
Клеточные стенки
значительно толще плазматических мембран и были видны даже ранним микроскопистам, в том числе Роберту Гуку, который первоначально идентифицировал структуры в образце пробки, а затем ввел термин клетки в 1660-х годах. Толщина, а также состав и организация клеточных стенок могут значительно различаться. Многие растительные клетки имеют как первичную клеточную стенку, которая вмещает клетку по мере ее роста, так и вторичную клеточную стенку, которая развивается внутри первичной стенки после прекращения роста клетки.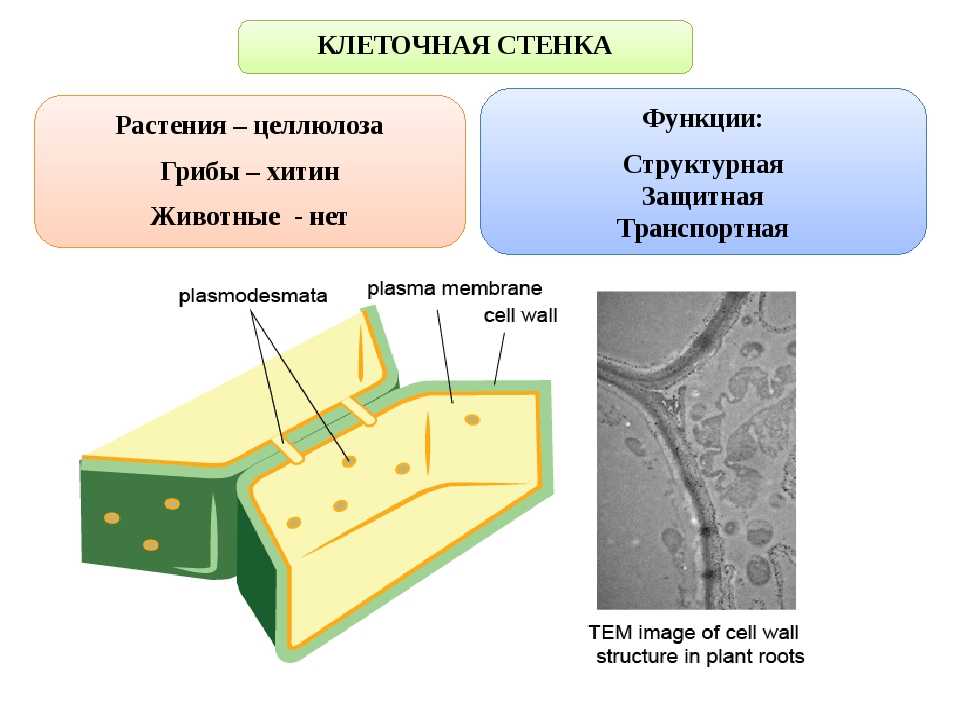 Первичная клеточная стенка тоньше и более податлива, чем вторичная клеточная стенка, и иногда сохраняется в неизменном или слегка измененном состоянии без добавления вторичной стенки даже после окончания процесса роста. 903:50
Первичная клеточная стенка тоньше и более податлива, чем вторичная клеточная стенка, и иногда сохраняется в неизменном или слегка измененном состоянии без добавления вторичной стенки даже после окончания процесса роста. 903:50
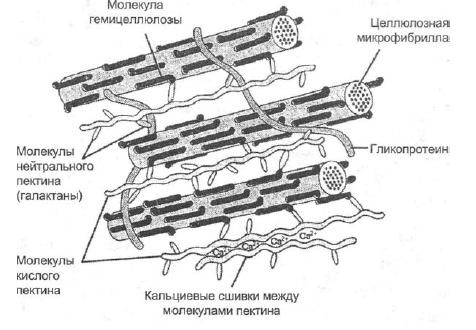
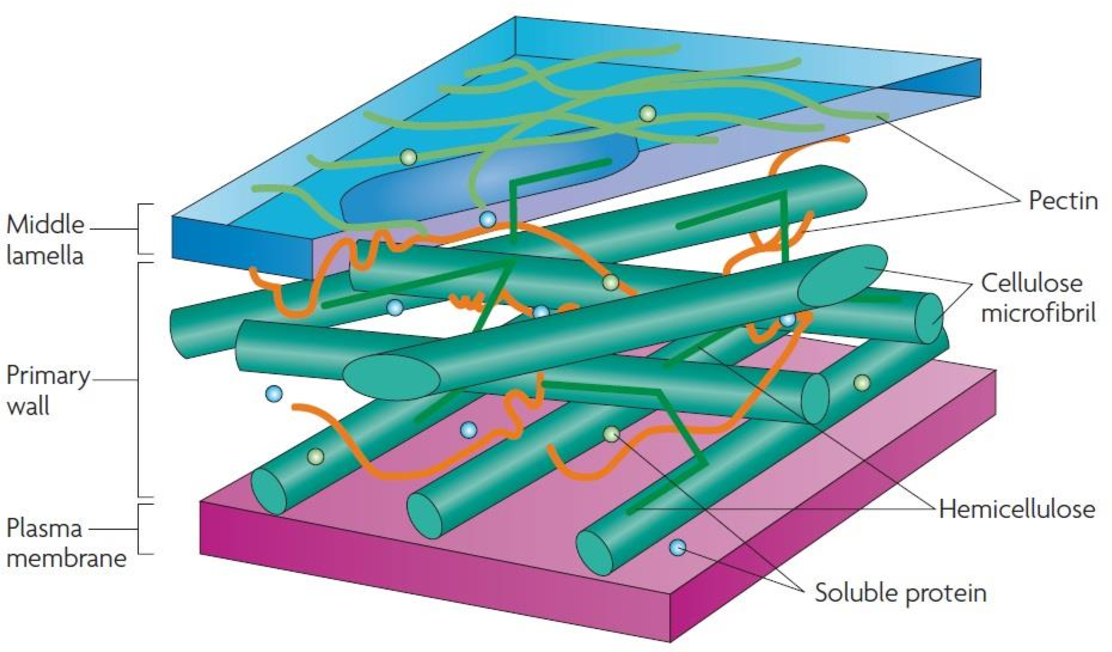
Основные химические компоненты первичной клеточной стенки растений включают целлюлозу (в форме организованных микрофибрилл ; см. рис. 1), сложный углевод, состоящий из нескольких тысяч молекул глюкозы, соединенных друг с другом. Кроме того, клеточная стенка содержит две группы разветвленных полисахаридов, пектинов и сшивающих гликанов . Организованные в сеть с микрофибриллами целлюлозы, сшивающие гликаны увеличивают прочность целлюлозы на растяжение, тогда как совместная сеть пектинов придает клеточной стенке способность сопротивляться сжатию. В дополнение к этим сетям небольшое количество белка можно найти во всех первичных клеточных стенках растений. Считается, что часть этого белка повышает механическую прочность, а часть состоит из ферментов, которые инициируют реакции, формирующие, реконструирующие или разрушающие структурные сети стенки.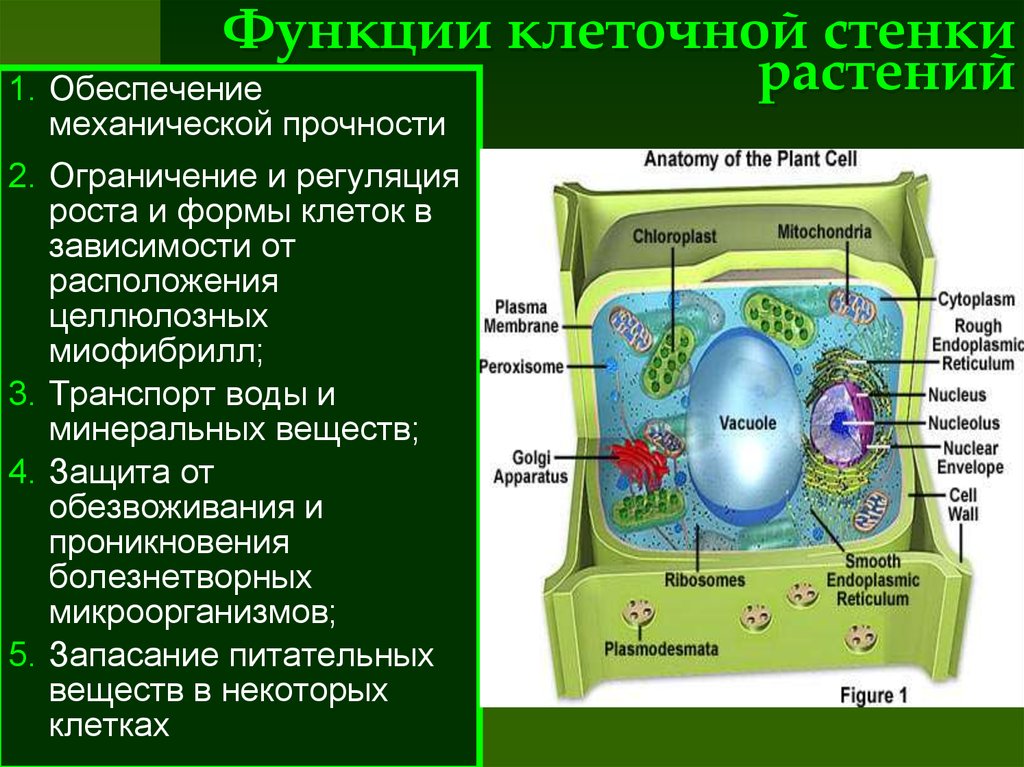 Такие изменения в клеточной стенке, направляемые ферментами, особенно важны для созревания плодов и опадания листьев осенью. 903:50
Такие изменения в клеточной стенке, направляемые ферментами, особенно важны для созревания плодов и опадания листьев осенью. 903:50
Вторичная клеточная стенка растений, которая часто откладывается внутри первичной клеточной стенки по мере созревания клетки, иногда имеет состав, почти идентичный составу ранее развитой стенки. Однако чаще во вторичной стенке обнаруживаются дополнительные вещества, особенно лигнин . Лигнин — общее название группы полимеров ароматических спиртов, обладающих твердостью и придающих значительную прочность структуре вторичной стенки. Лигнин — это то, что обеспечивает благоприятные характеристики древесины для волокнистых клеток древесных тканей, а также распространен во вторичных стенках сосудов ксилемы, которые играют центральную роль в обеспечении структурной поддержки растений. Лигнин также делает клеточные стенки растений менее уязвимыми для поражения грибами или бактериями, как это делает кутин , суберин и другие восковые вещества, которые иногда обнаруживаются в клеточных стенках растений.
Специализированная область, связанная с клеточными стенками растений и иногда считающаяся дополнительным их компонентом, — это средняя пластинка (см. рис. 1). Срединная пластинка, богатая пектинами, разделяется соседними клетками и прочно скрепляет их между собой. Расположенные таким образом клетки могут общаться друг с другом и делиться своим содержимым через специальные каналы. Срок plasmodesmata , эти небольшие проходы проникают в среднюю пластинку, а также в первичную и вторичную клеточные стенки, обеспечивая пути для транспорта цитоплазматических молекул из одной клетки в другую.
НАЗАД К СТРУКТУРЕ КЛЕТКИ РАСТЕНИЯ
Вопросы или комментарии? Отправить нам письмо.
© 1995-2022 автор
Майкл В. Дэвидсон
и Университет штата Флорида.
Все права защищены. Никакие изображения, графика, программное обеспечение, сценарии или апплеты не могут быть воспроизведены или использованы каким-либо образом без разрешения владельцев авторских прав.
 Использование этого веб-сайта означает, что вы соглашаетесь со всеми правовыми положениями и условиями, изложенными владельцами.
Использование этого веб-сайта означает, что вы соглашаетесь со всеми правовыми положениями и условиями, изложенными владельцами.
Этот веб-сайт поддерживается нашим
Группа графического и веб-программирования
в сотрудничестве с Optical Microscopy в
Национальной лаборатории сильного магнитного поля.
Последнее изменение: пятница, 13 ноября 2015 г., 13:18
Количество обращений с 1 октября 2000 г.: 768670
Микроскопы предоставлены:
Что делает стенки растительных клеток прочными и растяжимыми?
Исследования
Новое исследование, моделирующее клеточную стенку растений, показало, что цепочки целлюлозы связываются вместе в клеточной стенке и скользят друг относительно друга, когда клетка растягивается, обеспечивая уникальное сочетание прочности и растяжимости. На изображении показана растянутая модель клеточной стенки, включая ее основные компоненты целлюлозу (фиолетовый), ксилоглюкан (зеленый) и пектин (желтый).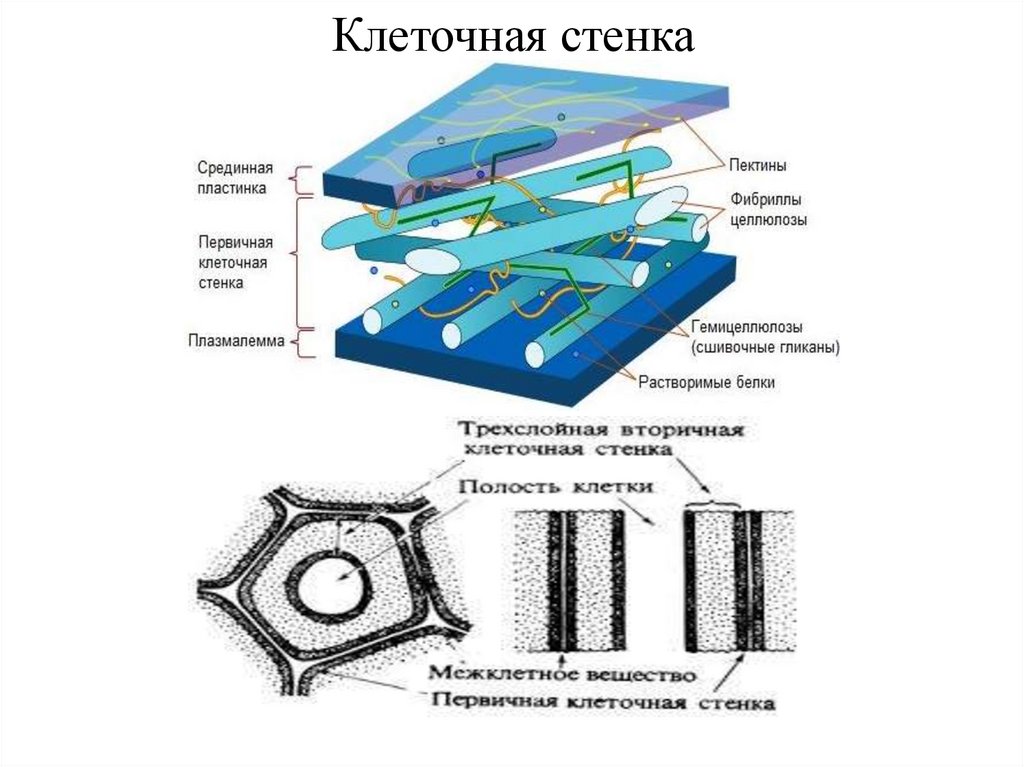 Предоставлено: Cosgrove Lab, Penn State. Все права защищены.
Предоставлено: Cosgrove Lab, Penn State. Все права защищены.
UNIVERSITY PARK, Pa. — Уникальная способность клеточной стенки растений расширяться без ослабления или разрушения — качество, необходимое для роста растений — связана с движением ее целлюлозного скелета, согласно новому исследованию, моделирующему клеточную стенку. Новая модель, созданная исследователями штата Пенсильвания, показывает, что цепочки целлюлозы связываются вместе внутри клеточной стенки, обеспечивая прочность, и скользят друг относительно друга, когда клетка растягивается, обеспечивая растяжимость.
Новое исследование, опубликованное 14 мая в журнале Science, представляет новую концепцию клеточной стенки растений, дает представление о росте растительных клеток и может вдохновить на разработку полимерных материалов с новыми свойствами.
«Долгое время преобладающей концепцией клеточной стенки растений было представление о геле, армированном целлюлозными волокнами, с жесткими целлюлозными стержнями, действующими как стальная арматура в цементе», — сказал Дэниел Косгроув, профессор биологии в Penn State и старший автор статьи.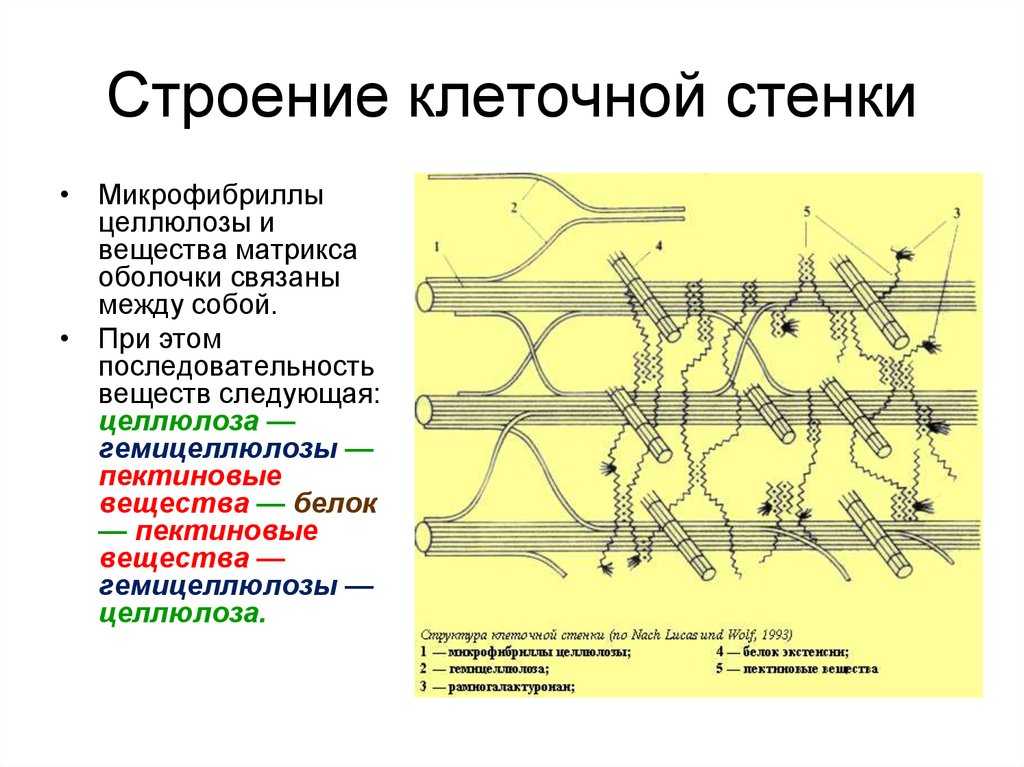 «Однако мы определили, что цепочки целлюлозы вместо этого слипаются друг с другом, образуя сеть пучков целлюлозы, которая обеспечивает гораздо большую механическую прочность, чем несвязанные стержни, плавающие в геле. И именно цепи целлюлозы, а не другие компоненты, ограничивают расширение клеточной стенки, скользя друг рядом с другом, как лестница, когда клетка растягивается».
«Однако мы определили, что цепочки целлюлозы вместо этого слипаются друг с другом, образуя сеть пучков целлюлозы, которая обеспечивает гораздо большую механическую прочность, чем несвязанные стержни, плавающие в геле. И именно цепи целлюлозы, а не другие компоненты, ограничивают расширение клеточной стенки, скользя друг рядом с другом, как лестница, когда клетка растягивается».
Предыдущие подходы к моделированию клеточных стенок растений были сосредоточены либо на слишком большом масштабе, чтобы учесть поведение отдельных клеточных компонентов, либо на слишком маленьком масштабе — атомном уровне — для учета фактической механики стенки. В этом исследовании ученые использовали крупнозернистую компьютерную модель на уровне полимеров, из которых состоит клеточная стенка, — цепочек целлюлозы и других молекул сахара, связанных друг с другом в длинные цепочки. Вместо моделирования отдельных атомов исследователи представили микроволокна целлюлозы и другие компоненты цепочками шариков, которые ведут себя как липкие пружины, чтобы воспроизвести физические свойства этих компонентов.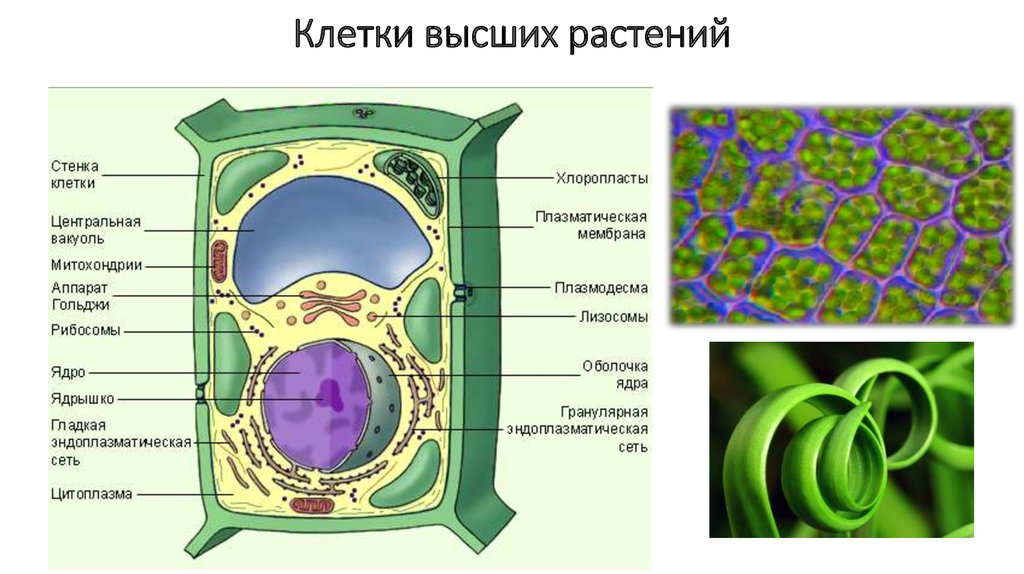
«В отличие от многих других моделей, мы также учитывали тенденцию молекул слипаться, моделируя нековалентную связь между ними», — сказал Косгроув. «Это позволило нам исследовать последствия взаимодействия между цепями».
Команда специально смоделировала слои клеточной стенки лука, чтобы сравнить смоделированные значения механических характеристик с экспериментами, проведенными с реальной луковой шелухой. Растягивая клеточные стенки луковицы несколькими способами и используя молекулярные данные модели, они исследовали структуры, ответственные за уникальные механические характеристики клеточной стенки.
«Стены растительных клеток уникальны, потому что они должны быть очень прочными, чтобы защищать и поддерживать растение, и очень растяжимыми, потому что они должны расширяться, когда растение растет», — сказал Яо Чжан, научный сотрудник в области биологии в Пенсильванском университете и первый автор исследования. бумага. «Мы обнаружили, что микроволокна целлюлозы несут большую часть нагрузки и играют ключевую роль в поддержании прочности и растяжимости клеточной стенки».
Новое исследование биологов штата Пенсильвания моделирует клеточную стенку растений и раскрывает молекулярную основу ее уникальной способности расширяться, не ослабляясь и не ломаясь. Кредит: штат Пенсильвания.
Исследователи определили, что отдельные волокна целлюлозы выравниваются и прилипают друг к другу, образуя сеть пучков. Микроволокна в пучке выпрямляются и могут скользить друг относительно друга, по типу телескопического действия, когда клетка растягивается, передавая силы между собой и приводя к растяжению клетки.
«Долгое время исследователи измеряли механические свойства, такие как стресс и деформация, стенок клеток растений и то, как эти свойства меняются в условиях засухи и других условий», — сказал Косгроув. «Но до сих пор нам не хватало молекулярного описания того, что происходит на молекулярном уровне, чтобы понять эти измерения. В этом исследовании мы прояснили роль различных компонентов клеточной стенки растений и предоставили количественную основу для интерпретации экспериментов, используемых в исследованиях растений».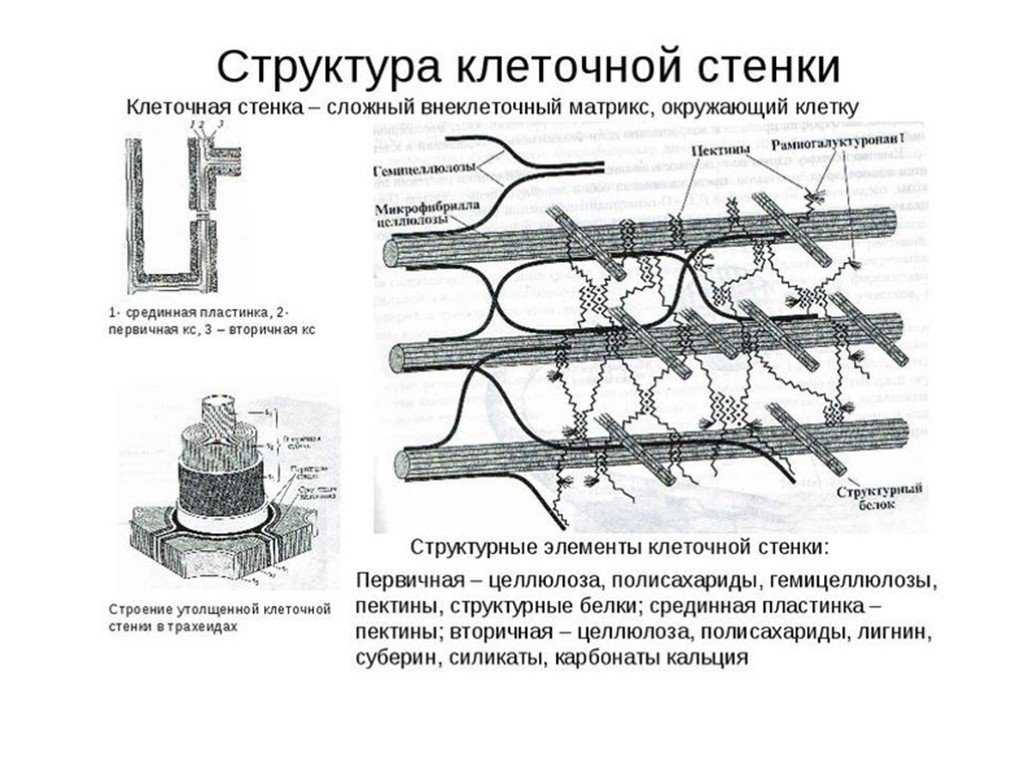
Результаты этого исследования могут быть особенно полезны в будущей работе по изучению того, как растения регулируют свойства своих клеточных стенок, что влияет на скорость и направление их роста. Например, молодые стебли весной быстро удлиняются, в то время как многие плоды растут шарообразными.
Исследователи надеются расширить свою модель, чтобы смоделировать клеточные стенки других видов растений и расширить ее, чтобы охватить всю клетку.
«В настоящее время наша технология не может сравниться со способностью растений создавать такой прочный и эластичный материал», — сказал Яо. «Дизайн клеточных стенок растений может послужить источником вдохновения для разработки зеленых материалов с различными применениями».
Помимо Косгроува и Чжана, в исследовательскую группу Пенсильванского университета входят Цзинъи Ю, аспирант биологии растений; Сюань Ван, аспирант биологии растений на момент проведения исследования; Даниил Дурачко, научный сотрудник на момент проведения исследования; и Сулин Чжан, профессор технических наук, механики и биоинженерии.