Содержание
как повысить урожай? — ASM-AGRO
Элемент No7 в таблице Менделеева – азот – незаменим в сельском хозяйстве. Благодаря ему культуры быстрее растут и дают более богатый урожай. Все потому, что азот входит в состав молекул и белков, из которых строится растение. Другими словами, он помогает им развиваться – примерно так же, как протеин помогает спортсменам наращивать мышечную массу.
При недостатке азота синтез белков замедляется: растения хуже растут и быстрее чахнут. Поэтому важно, чтобы почва содержала достаточное количество элемента No7. Разберемся, каким бывает азотное питание растений, как бактерии улучшают почву и чем азотное питание бобовых отличается от питания других культур.
Азотное питание различных групп растений: удобрения
Виды удобрений:
- аммиачная селитра,
- мочевина,
- сульфат аммония,
- натриевая селитра,
- кальциевая селитра,
- навоз.

Поговорим о каждом из них подробнее.
Аммиачная селитра содержит до 35% азота. Она растворима в воде и быстро усваивается растениями. Подойдет для ранних подкормок, потому что работает даже в промерзшей земле. Аммиачная селитра может быть только корневой подкормкой, так как она обжигает растения.
В мочевине 46% азота. Она также хорошо растворяется и быстро усваивается, но требует более глубокой закладки, так как плохо держится в почве и не устойчива к солнцу. Зато она подходит для внекорневых подкормок – даже если переборщить, культуры не пострадают.
Сульфат аммония содержит 20% азота, а также серу, которой бедны около 80% почв. Сера положительно влияет на урожай и увеличивает срок его хранения. Сульфат аммония легко растворяется в воде.
Натриевая селитра хорошо растворяется, содержит 16% азота и полезный для корнеплодов натрий. Но с ней надо быть осторожным: на коже человека вещество вызывает раздражение, а для домашних животных может стать ядом. Вымывается из почвы.
Но с ней надо быть осторожным: на коже человека вещество вызывает раздражение, а для домашних животных может стать ядом. Вымывается из почвы.
Кальциевая селитра не только растворяется в воде, но и активно ее впитывает. Требует хранения в сухости. Содержит 15,5% азота.
Навоз – одно из самых известных органических удобрений. Славится содержанием фосфора, калия, кальция и магния, благотворно влияет на почву. Но в нем всего от 0,5 до 2,5% азота. Чтобы навоз дал положительный эффект, его нужно много. Кроме того, необходимо дождаться, чтобы он перегнил.
Аммиачную селитру вносят осенью или весной под перекопку. В течение лета ее можно использовать в виде почвенных подкормок. Мочевину, кальциевую и натриевую селитру – только весной и летом в виде подкормок. Сульфат аммония и полуперепревший навоз – под перекопку осенью.
Первый признак того, что растению не хватает азота – светло-зеленые или слегка пожелтевшие по краям листья. Вообще, по листьям можно определить много заболеваний, например, распространенный пиренофороз.
Вообще, по листьям можно определить много заболеваний, например, распространенный пиренофороз.
Так, азотное питание различных групп растений:
- стимулирует рост,
- увеличивает размер листьев и плодов,
- обогащает урожай.
Роль бактерий в азотном питании растений
Азотные удобрения востребованы и применяются для выращивания большинства культур по всему миру, поэтому промышленность активно занимается их производством. В 2018 году в России на рынок вывели около 10,5 миллионов тонн азотных удобрений. Но такое производство требует больших затрат полезных ископаемых вроде природного газа или каменного угля.
При этом прекратить пользоваться азотными удобрениями нельзя: без него в почве урожайность значительно снизится. Поэтому ученые работают над тем, чтобы помочь растениям самим вырабатывать азот – с помощью некоторых бактерий.
Как работает симбиоз бактерий и бобовых культур?
Растения не могут впитывать азот из воздуха, но за них это могут делать микробы.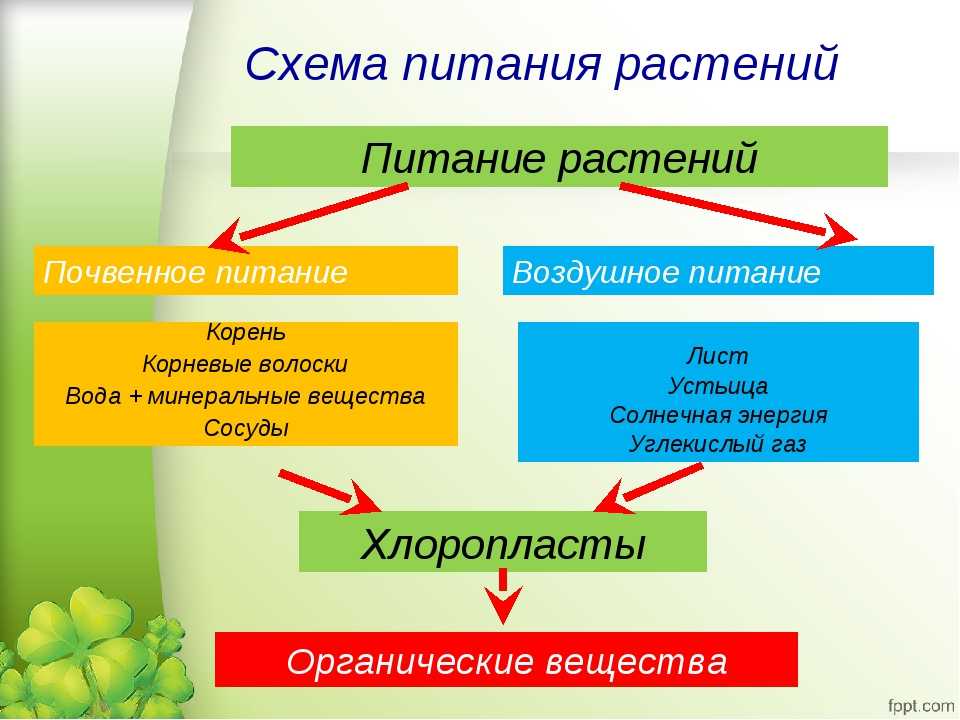 Но какие бактерии улучшают азотное питание растений? Например, клубеньковые. Они преобразуют азот в ту форму, которую могут усвоить растения: это называется азотфиксацией. В этом процессе большую роль играют семейства бобовых.
Но какие бактерии улучшают азотное питание растений? Например, клубеньковые. Они преобразуют азот в ту форму, которую могут усвоить растения: это называется азотфиксацией. В этом процессе большую роль играют семейства бобовых.
Азотное питание бобовых растений отличается от питания остальных культур. В симбиозе с клубеньковыми бактериями зернобобовые культуры могут получить от 60 до 90% своей нормы азота. При этом, удовлетворив свою потребность в веществе, растения обогащают им почву за счет оставшихся в ней корневых остатков.
Они выступают своего рода минеральным удобрением и питают азотом другие культуры. Так, люпин и горох за один сезон оставляют земле от 25 до 50 кг/га азота, а клевер и люцерна – от 70 до 100 кг/га. Поэтому аграрии активно засевают участки бобовыми, тем самым улучшая качество грунта.
Как увеличить количество бактерий?
Удобрение бобовых культур должно создавать подходящие условия для азотфиксации. В первую очередь, необходимо заражать корни активными клубеньковыми бактериями.
В первую очередь, необходимо заражать корни активными клубеньковыми бактериями.
Один из самых популярных способов увеличить количество этих микроорганизмов в почве – препарат «Нитрагин». Он содержит эффективные расы клубеньковых бактерий. Нитрагин используют для заселения микробами почв, на которых бобовые растения выращиваются впервые. Препарат повышает их общую урожайность.
В благоприятных для азотфиксации условиях бобовые удовлетворяют свои потребности в азоте за счет усвоения его из воздуха и дают хороший урожай. Остается только бережно его собрать и просушить. В этом поможет бережная конвейерная зерносушилка. Например, сушилка от «ASM-AGRO» позволяет сохранить от повреждений до 99,9% зерна.
Какие бактерии улучшают азотное питание растений при насыщении почвы азотом
Азот является наиболее распространенным элементом на нашей планете. Он играет очень важную роль в поддержании жизненных циклов биологических организмов. Все органические белковые молекулы, которые формируют органическую жизнь, включают в свой состав азот. Большая его часть фиксируется одноклеточными простейшими микроорганизмами, называемыми бактериями. На Земле больше не существует ни одного организма, способного усвоить азот из слоев атмосферы.
Большая его часть фиксируется одноклеточными простейшими микроорганизмами, называемыми бактериями. На Земле больше не существует ни одного организма, способного усвоить азот из слоев атмосферы.
Содержание
- Значение бактерий в процессе круговорота азота
- Попадание азота в грунт
- Виды клубеньковых бактерий
Значение бактерий в процессе круговорота азота
Такой химический элемент, как азот является составной частью не только атмосферы. Он также содержится в мантии, земной коре и гидросфере. На поверхности планеты постоянно циркулирует геохимический круговорот веществ, главным элементом которого является азот.
Процесс круговорота заключается в перемещении веществ из атмосферы в разные слои земной коры и гидросферу. И наоборот. Единственным слоем, который не участвует в этом цикле, считается мантия. Ее компоненты выходят в атмосферу вместе с лавой вулканов, а обратно вглубь земли они уже не попадают. Однако мантия содержит небольшое количество азота, поэтому тот процент, который регулярно извергается, не может воздействовать на геохимический цикл.
Следует отметить, что наличие бактерий в системе круговорота азота очень важный показатель, так как они являются практически единственной биогенной составляющей. И азотный цикл может происходить бесконечно.
- Клубеньковые и прочие прокариоты абсорбируют молекулы азота из атмосферы и грунта. Затем преобразовывают их в так называемые органические соединения. Их впоследствии поглощают растения.
- Эти растения усваиваются животными и людьми, для которых со временем жизненный цикл заканчивается, и они после смерти разлагаются. В разложении биологических тканей участвуют бактерии другого вида (денитрификаторы). С их помощью проходит явление денитрификации, в результате которого в воздух выделяются молекулы азота.
Рекомендуем Рыбная мука
Если рассматривать циркуляцию азота в геохимическом составе планеты, то не вспомнить о других бактериях было бы неправильно. Существует большое количество микроорганизмов, благодаря которым азот может усваиваться из других видов источников, но при этом тоже попадает в общий химический круговорот.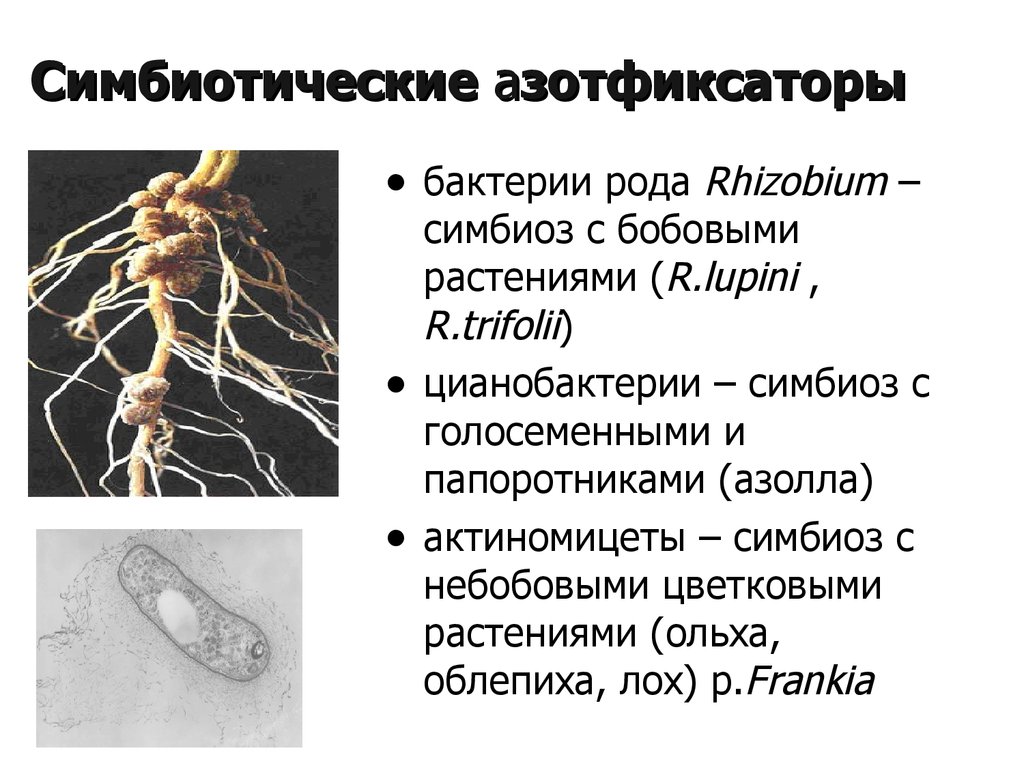 Использование знаний о бактериях приводит к тому, что человек может искусственно увеличить плодородие почвы, а также восстановить ее химический состав при длительном и неправильном использовании в агропромышленном секторе.
Использование знаний о бактериях приводит к тому, что человек может искусственно увеличить плодородие почвы, а также восстановить ее химический состав при длительном и неправильном использовании в агропромышленном секторе.
Попадание азота в грунт
Благодаря именно микроорганизмам почвы обогащаются азотом естественным образом. Раньше существовало мнение, что клубеньковые микроорганизмы являются единственными бактериями, проявляющими способность фильтровать азот из слоев атмосферы. При этом главное значение для этого процесса имеют растения, семейства бобовых. Это, пожалуй, единственные растения, которые способны создать уникальный симбиоз с клубеньковыми микробами.
На настоящее время ученые провели множество исследований и доказали, что такая позиция противоречит действительности.
На самом деле в природе насчитывается большое количество разнообразных бактерий, способных преобразовать молекулы азота в соединения аммония.
Как известно, растения способны усвоить непосредственно сам аммоний. Для примера следует отметить, что для актиномицетов характерен симбиоз практически со ста разновидностями деревьев. Чтобы понять, как происходит наполнение грунта азотом, необходимо проследить за последовательностью всех процессов.
Для примера следует отметить, что для актиномицетов характерен симбиоз практически со ста разновидностями деревьев. Чтобы понять, как происходит наполнение грунта азотом, необходимо проследить за последовательностью всех процессов.
- Корни растений, для которых клубеньковые микроорганизмы являются симбионтами, выделяют в грунте возле себя специфические органические соединения. Им дали название флавины. Каждое из растений характеризуется своими индивидуальными флавинами, которые способны реагировать только с одним типом бактерий. Им присвоили названия в зависимости от вида растения, с которым они образуют симбиоз.
- Бактерии, которые поглощают молекулы азота из атмосферы, направляются в сторону флавинов, и перемещаются поближе к корневой системе самого растения. Они всасываются в него через корневые волоски и проходят в ствол корня.
- В тканях корней бактерии активно размножаются. В свою очередь, в корне для создания необходимого пространство для бактерий начинается процесс деления клеток.
 В результате образуется клубенек.
В результате образуется клубенек. - Все жизненные процессы бактерий проходят в этом клубеньке, через него растение дополнительно получает аммоний. Взамен растение отдает выработанные углеводы, являющиеся источником энергии для микробов.
- После определенного жизненного цикла растение может сбросить листья или погибает. В результате этого живые ткани, наполненные аммонием, перегнивают в верхних слоях грунта, и происходит насыщение грунта соединениями азота органического происхождения.
- Смысл процессов заключается в следующем. Получившееся удобрение становится источником образования органических азотных соединений для растений, которые в дальнейшем будут произрастать на таком грунте. При этом образованные таким способом удобрения не могут существовать в симбиозе с бактериями, которые могут фиксировать молекулы азота из воздуха. Они не способны выделить требуемый аммоний непосредственно из слоев атмосферы.
Рекомендуем Удобрение из морских водорослей
Такой естественный процесс давно применяется в агропромышленном комплексе. Аграрии улучшают качественный состав грунта благодаря засеванию земельных участков бобовыми культурами. После вырастания зеленой массы поля вспахиваются вместе с ней. И спустя некоторое время поле готово к дальнейшему использованию. Этот метод позволяет повысить урожай в несколько раз.
Аграрии улучшают качественный состав грунта благодаря засеванию земельных участков бобовыми культурами. После вырастания зеленой массы поля вспахиваются вместе с ней. И спустя некоторое время поле готово к дальнейшему использованию. Этот метод позволяет повысить урожай в несколько раз.
Виды клубеньковых бактерий
Как отмечалось ранее, огромное значение для фиксации азота имеют клубеньковые бактерии. Рассмотрим, какие бактерии улучшают азотное питание растений, характерные для клубеньковой группы:
- ризобиумы. К ним относятся грамотрицательные бактерии, облигатные и факультативные анаэробы. По внешнему виду они напоминают палочки. Микроорганизмы существуют либо в паре, либо по одному. Они не способны группироваться в колонии. Некоторые виды опасны для людей и могут переносить вирус СПИДа;
- несколько разновидностей актиномицетов. Они произрастают в корневой системе деревьев, которые могут создать клубеньки. Это такие деревья, как ольха, облепиха и другие. Внутри клубеньков актиномицеты образуют мицелий.
 Они являются хемоорганотрофами и грамположительными.
Они являются хемоорганотрофами и грамположительными.
Помимо клубеньковых микроорганизмов, существуют цианобактерии. Они также производят аммоний, но строят симбиоз с папоротниками. По структуре цианобактерии очень похожи на актиномицеты, которые имеют множество мелких ниточек, и дают положительную реакцию на окраску по методу Грамма.
Не менее полезным являют спорообразующие палочки, которые называются Clostndium pasteurianum. В грунте они размещаются свободно, не привязываясь к растениям. Они очень подвижны и поглощают из почв углеводы, которые служат для них источником энергии.
Самым популярным способом повысить концентрацию клубеньковых бактерий является использование средства Нитрагин.
Он в своем составе имеет расы клубеньковых микроорганизмов и добавляется в почвы для повышения урожайности только бобовых растений, корневая система которых поможет обогатить грунт азотом. Еще одним распространенным препаратом бактериального действия является Азотобактерин. Он способен накапливать в земле азот из воздуха, повышает качество грунта. Его используют для разных типов растений, но не для бобовых.
Еще одним распространенным препаратом бактериального действия является Азотобактерин. Он способен накапливать в земле азот из воздуха, повышает качество грунта. Его используют для разных типов растений, но не для бобовых.
Роль бактерий, стимулирующих рост растений, в повышении эффективности использования азота для устойчивого растениеводства: акцент на пшенице
1. Godfray HCJ, Beddington JR, Crute IR, et al. Продовольственная безопасность: задача накормить 9 миллиардов человек. Наука. 2010; 327:812–818. [PubMed] [Google Scholar]
2. де Соуза Р., Амброзини А., Пассалья Л.М.П. Бактерии, стимулирующие рост растений, как инокулянты в сельскохозяйственных почвах. Генет Мол Биол. 2015; 38: 401–419. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Адесемое А.О., Торберт Х.А., Клоппер Дж.В. Стимулирующие рост растений Rhizobacteria позволяют снизить нормы внесения химических удобрений. Микроб Экол. 2009; 58: 921–929. [PubMed] [Google Scholar]
4. ФАО. Как накормить мир в 2050 году. Рим, Италия: Продовольственная и сельскохозяйственная организация; 2009. [Google Scholar]
ФАО. Как накормить мир в 2050 году. Рим, Италия: Продовольственная и сельскохозяйственная организация; 2009. [Google Scholar]
5. ФАО. 19 декабря Рим. 2014 г. Доступно по адресу: http://www.fao.org/news/story/en/item/2733/icode.
6. Troccoli A, Borrelli GM, De Vita P, et al. Качество твердой пшеницы: междисциплинарная концепция. J Зерновые науки. 2000;32:99–113. [Google Scholar]
7. Хэтфилд Дж. Л., Зауэр Т. Дж., Прюгер Дж. Х. Управление почвами для повышения эффективности использования воды: обзор. Агрон Дж. 2001; 93: 271–280. [Google Scholar]
8. Cormier F, Foulkes J, Randhirel B, et al. Селекция для повышения эффективности использования азота: обзор пшеницы ( T. Aestivum L.) Селекция растений. 2016; 135: 255–278. [Google Scholar]
9. Hirel B, Tétu T, Lea PJ, et al. Повышение эффективности использования азота в сельскохозяйственных культурах для устойчивого сельского хозяйства. Устойчивость. 2011;3:1452–1485. [Академия Google]
10. Сингх Б., Райан Дж. Международная ассоциация производителей удобрений. Париж, Франция: 2015 г. Использование удобрений для улучшения здоровья почвы; стр. 1–24. [Google Scholar]
Сингх Б., Райан Дж. Международная ассоциация производителей удобрений. Париж, Франция: 2015 г. Использование удобрений для улучшения здоровья почвы; стр. 1–24. [Google Scholar]
11. Ахемад М., Кибрет М. Механизмы и применение стимулирования роста растений Rhizobacteria : современная перспектива. J King Saud Univ Sci. 2014; 26:1–20. [Google Scholar]
12. Powell N, Ji X, Ravash R, et al. Стабильность урожая зерновых в условиях меняющегося климата. Функция биологии растений. 2012; 39: 539–552. [Академия Google]
13. Семенов М.А., Шеври ПР. Моделирование предсказывает, что тепловой стресс, а не засуха, повысит уязвимость пшеницы в Европе. Научный представитель 2011; 1:66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Коллекции базы данных FAOSTAT (Рим: Продовольственная и сельскохозяйственная организация Объединенных Наций) Доступно по адресу: http://faostat.fao.org/.
15. Кэнфилд Д.Э., Глейзер А.Н., Фальковски П.Г. Эволюция и будущее азотного цикла Земли. Наука. 2010; 330:192–196. [PubMed] [Академия Google]
Наука. 2010; 330:192–196. [PubMed] [Академия Google]
16. Snyder CS, Bruulsema TW, Jensen TL, et al. Обзор выбросов парниковых газов от систем растениеводства и эффектов использования удобрений. Агроэкосистема Окружающая среда. 2009; 133: 247–266. [Google Scholar]
17. Чен Дж. Х. Совместное использование химических и органических удобрений и/или биоудобрений для роста сельскохозяйственных культур и повышения плодородия почвы. Международный семинар по устойчивому управлению системой почва-ризосфера для эффективного растениеводства и использования удобрений. 2006;16:20. [Академия Google]
18. Гилл Х.К., Гарг Х. Пестициды: воздействие на окружающую среду и стратегии управления. В: Марсело Л., редактор. Пестициды – токсичные аспекты. СС BY; 2014. С. 187–230. [Google Scholar]
19. Актар В., Сенгупта Д., Чоудхури А. Влияние использования пестицидов в сельском хозяйстве: их польза и вред. Междисковый токсикол. 2009; 2:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Saharan BS, Nehra V. Содействие росту растений Rhizobacteria : критический обзор. Life Sci Med Res. 2011; 21:1–30. [Академия Google]
Saharan BS, Nehra V. Содействие росту растений Rhizobacteria : критический обзор. Life Sci Med Res. 2011; 21:1–30. [Академия Google]
21. Walker TS, Bais HP, Grotewold E, et al. Корневая экссудация и биология ризосферы. Завод Физиол. 2003; 132:44–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Ortiz-Castro R, Contreras-Cornejo HA, Macías-Rodríguez L, et al. Роль микробных сигналов в росте и развитии растений. Поведение сигналов растений. 2009; 4: 701–712. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Dimkpa C, Wein T, Folkard A. Взаимодействия Plant- Rhizobacteria облегчают условия абиотического стресса. Окружающая среда растительной клетки. 2009 г.;32:1682–1694. [PubMed] [Google Scholar]
24. Glick BR. Бактерии, стимулирующие рост растений: механизмы и применение. Научная. 2012: 1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Leigh GJ. Азотфиксация в тысячелетии. Лондон: Elsevier Science; 2002. [Google Scholar]
[Google Scholar]
26. Lucas-Garcia JA, Probanza A, Ramos B, et al. Влияние стимулятора роста растений Rhizobateria (PGPR) на биологическую фиксацию нитрозы, образование клубеньков и рост Lupinus albus I. cv . Мультолупа. англ Life Sci. 2004; 4:71–77. [Google Scholar]
27. Бхаттачарья П.Н., Джа Д.К. Стимулирующие рост растений Rhizobacteria (PGPR): появление в сельском хозяйстве. World J Microbiol Biotechnol. 2012;28:1327–1350. [PubMed] [Google Scholar]
28. Tabatabaei S, Ehsanzadeh P, Etesami H, et al. Индол-3-уксусная кислота (ИУК), продуцирующая изолятов Pseudomonas , ингибирует прорастание семян и активность α-амилазы твердой пшеницы (9).0007 Triticum turgidum L.) Испания J Agric Res. 2016;14:e0802. [Google Scholar]
29. Beneduzi A, Ambrosini A, Passaglia LMP. Rhizobacteria , стимулирующие рост растений (PGPR): их потенциал в качестве антагонистов и агентов биоконтроля. Генет Мол Биол. 2012;35:1044–1051. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2012;35:1044–1051. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Kundan R, Pant G, Jadon N, et al. Стимуляция роста растений Rhizobacteria : механизм и текущие перспективы. Джей Фертил Пестик. 2015;6:2. [Академия Google]
31. Отейно Н., Лалли Р.Д., Киванука С. и соавт. Стимуляция роста растений, индуцированная растворяющими фосфат эндофитными изолятами Pseudomonas . Фронт микробиол. 2015;6:745. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Haas D, Keel C. Регуляция выработки антибиотиков при колонизации корней Pseudomonas spp. и актуальность для биологической борьбы с болезнями растений. Анну Рев Фитопат. 2003;41:117–153. [PubMed] [Google Scholar]
33. Пеньяльвер Р., Лопес М.М. Коколонизация ризосферы патогенными Штаммы Agrobacterium и непатогенные штаммы K84 и K1026, используемые для биоконтроля корончатого галла. Приложение Environ Microb. 1999; 65: 1936–1940. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Okon Y, Labandera-Gonzales CA. Агротехническое применение Azospirillum : оценка 20-летней полевой инокуляции во всем мире. Почва Биол Биохим. 1994; 26:1591–1601. [Google Scholar]
Okon Y, Labandera-Gonzales CA. Агротехническое применение Azospirillum : оценка 20-летней полевой инокуляции во всем мире. Почва Биол Биохим. 1994; 26:1591–1601. [Google Scholar]
35. Найман А.Д., Латронико А., Гарсия де Саламоне IE. Инокуляция пшеницы Azospirillum brasilense и Pseudomonas fluorescens : воздействие на продукционную и культивируемую ризосферную микрофлору. Eur J Soil Biol. 2009; 45:44–51. [Google Scholar]
36. Piccinin GG, Dan LGM, Braccini ALE, et al. Агрономическая эффективность Azospirillum brasilense по физиологическим показателям и компонентам урожайности в посевах пшеницы. Джей Агрон. 2011;10:132–135. [Google Scholar]
37. Намвар А., Хандан Т. Реакция пшеницы на минеральное азотное удобрение и биоудобрение ( Azotobacter сп. и Azospirillum sp.) инокуляции при различных уровнях воздействия сорняков. Экология. 2013;59:85–94. [Google Scholar]
38. Амири А., Рафи М. Влияние инокуляции почвы бактериями Azospirillum и Azotobacter на эффективность использования азота и агрономические характеристики кукурузы.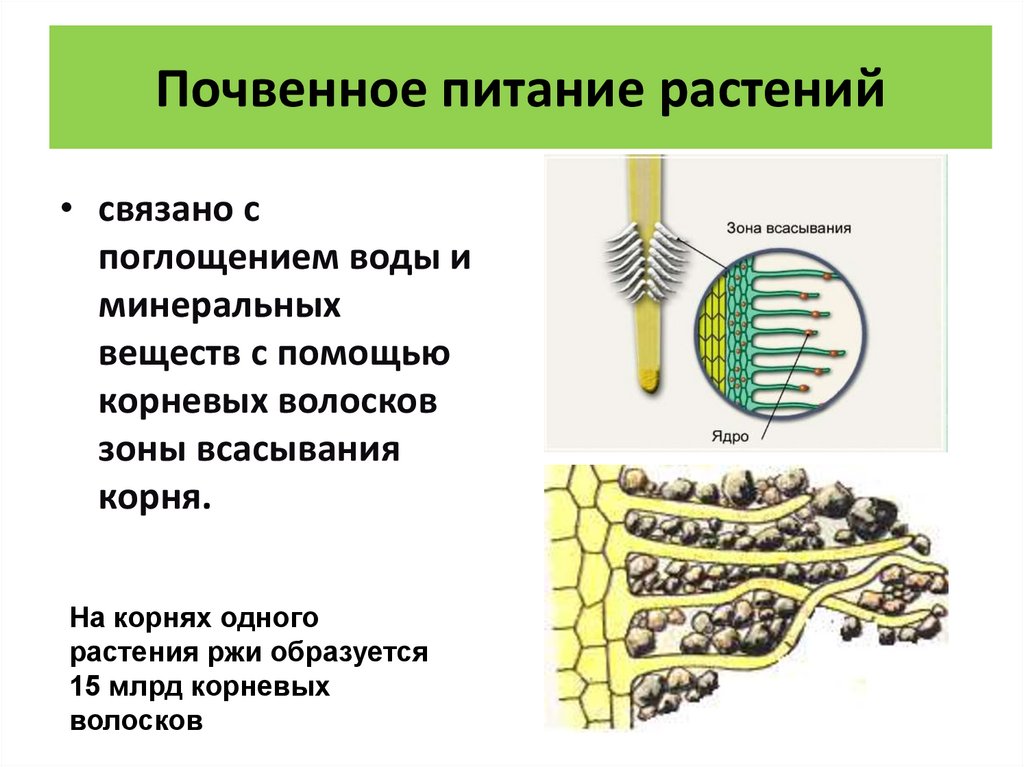 Энн Биол Рез. 2013; 4:77–79. [Google Scholar]
Энн Биол Рез. 2013; 4:77–79. [Google Scholar]
39. Аманулла А., Курд А., Хан С. и др. Биоудобрение — возможный заменитель удобрений при производстве пшеницы сорта зардана в Белуджистане. Пакистан J Agric Res. 2012; 25:44–49. [Google Scholar]
40. Saia S, Rappa V, Ruisi P, et al. Инокуляция почвы симбиотическими микроорганизмами способствует росту растений и экспрессии генов переносчиков питательных веществ в твердой пшенице. Фронт завод науч. 2015;6:815. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Vessey JK. Стимулирующие рост растений Rhizobacteria в качестве биоудобрений. Растительная почва. 2003; 255: 571–586. [Google Scholar]
42. Dobbelaere S, Croonenborghs A, Thys A, et al. Фитостимулирующий эффект Azospirillum brasilense штаммов дикого типа и мутантных штаммов с измененной продукцией ИУК на пшенице. Растительная почва. 1999; 212: 155–164. [Google Scholar]
43. Pereyra MA, Ballesteros FM, Creus CM, et al. Стимулирование роста проростков с помощью Azospirillum brasilense в нормальных и засушливых условиях остается неизменным в семенах пшеницы, обработанных тебуконазолом. Eur J Soil Biol. 2009;45:20–27. [Google Scholar]
Eur J Soil Biol. 2009;45:20–27. [Google Scholar]
44. Мина К.К., Кумар М., Калюжная М.Г. и др. Эпифитные розово-пигментированные метилотрофные бактерии усиливают всхожесть и рост проростков пшеницы (9).0007 Triticum aestivum ), производя фитогормон. Антони ван Левенгук. 2012; 101:777–786. [PubMed] [Google Scholar]
45. García de Salamone IE, Funes JM, Di Salvo LP, et al. Инокуляция риса-сырца Azospirillum brasilense и Pseudomonas fluorescens : влияние генотипов растений на микробные сообщества ризосферы и урожайность полевых культур. Прил. Экология почвы. 2012;61:196–204. [Google Scholar]
46. Ferreira AS, Pires RR, Rabelo PG, et al. Прикладные последствия экологии почвы Azospirillum brasilense Инокуляция и добавление питательных веществ на кукурузу в почвах бразильского Серрадо в тепличных и полевых условиях. Прил. Экология почвы. 2013;72:103–108. [Google Scholar]
47. Majeed A, Abbasi MK, Hameed S, et al. Выделение и характеристика стимулирующих рост растений Rhizobacteria из ризосферы пшеницы и их влияние на стимулирование роста растений. Фронт микробиол. 2015;6:198. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Фронт микробиол. 2015;6:198. [Статья бесплатно PMC] [PubMed] [Google Scholar]
48. Hassan TU, Bano A. Биоудобрение: новый состав для улучшения роста, физиологии и урожайности пшеницы. Пак Джей Бот. 2016;48:2233–2241. [Академия Google]
49. Чарусова И., Медо Дж., Халенарова Е. и др. Влияние удобрения на биологическую активность почвенного сообщества Стрептомицеты . J Cent Eur Agr. 2016;17:1134–1149. [Google Scholar]
50. Хао Т., Чен С. Колонизация пшеницы, кукурузы и огурца Paenibacillus Polymyxa Wly78. PloS Один. 2017;12:e0169980. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Veresoglou SD, Menexes G. Влияние прививки Azospirillum spp. о ростовых свойствах и урожайности семян пшеницы: метаанализ исследований в ISI Web of Science от 1981 к 2008 г. Растительная почва. 2010; 337: 469–480. [Google Scholar]
52. Перес-Монтано Ф., Алиас-Вильегас С., Беллогин Р.А. и соавт. Стимулирование роста зерновых и зернобобовых культур, важных для сельского хозяйства: от потенциала микроорганизмов до растениеводства. Микробиолог Рез. 2014; 169: 325–336. [PubMed] [Google Scholar]
Микробиолог Рез. 2014; 169: 325–336. [PubMed] [Google Scholar]
53. Piccinin GG, Braccini ALE, Dan LGM, et al. Влияние инокуляции семян препаратом Azospirillum brasilense на агротехнические показатели и урожайность пшеницы. Ind Crops Prod. 2013;43:393–397. [Google Scholar]
54. Hungria M, Campo RJ, Souza EM, et al. Инокуляция отобранными штаммами Azospirillum brasilense и A. lipoferum повышает урожайность кукурузы и пшеницы в Бразилии. Растительная почва. 2010; 331:413–425. [Google Scholar]
55. Диас-Зорита М., Фернандес-Каниджа М.В. Полевые характеристики жидкой композиции Azospirillum brasilense на продуктивность пшеницы в засушливых районах. Eur J Soil Biol. 2009; 45:3–11. [Академия Google]
56. Spaepen S, Dobbelaere S, Croonenborghs A, et al. Влияние продукции индол-3-уксусной кислоты Azospirillum brasilense на инокулированные растения пшеницы. Растительная почва. 2008; 312:15–23. [Google Scholar]
57. Доступно по адресу: https://www.ag.ndsu.edu/plantsciences/research/durum.
Доступно по адресу: https://www.ag.ndsu.edu/plantsciences/research/durum.
58. Colla G, Rouphael Y, Bonini P, et al. Покрытие семян эндофитными грибами улучшает рост, усвоение питательных веществ, урожайность и качество зерна озимой пшеницы. Int J Plant Prod. 2015;9:171–190. [Академия Google]
59. Di Benedetto NA, Campaniello D, Bevilacqua A, et al. Материалы Европейского конгресса по биологии растений. Прага, Чехия: EPSO/FESPB; 2016. Характеристика автохтонных бактерий, стимулирующих рост растений, в зависимости от эффективности использования азота твердой пшеницы; стр. 26–30. [Google Scholar]
60. Baffoni L, Gaggia F, Dalanaj N, et al. Микробные инокулянты для биоконтроля Fusarium spp. в твердой пшенице. БМС микробиол. 2015;15:242. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Mnasri N, Chennaoui C, Gargouri S, et al. Эффективность некоторых ризосферных и эндофитных бактерий in vitro и в качестве покрытия семян для борьбы с Fusarium culmorum , заражающим твердую пшеницу в Тунисе.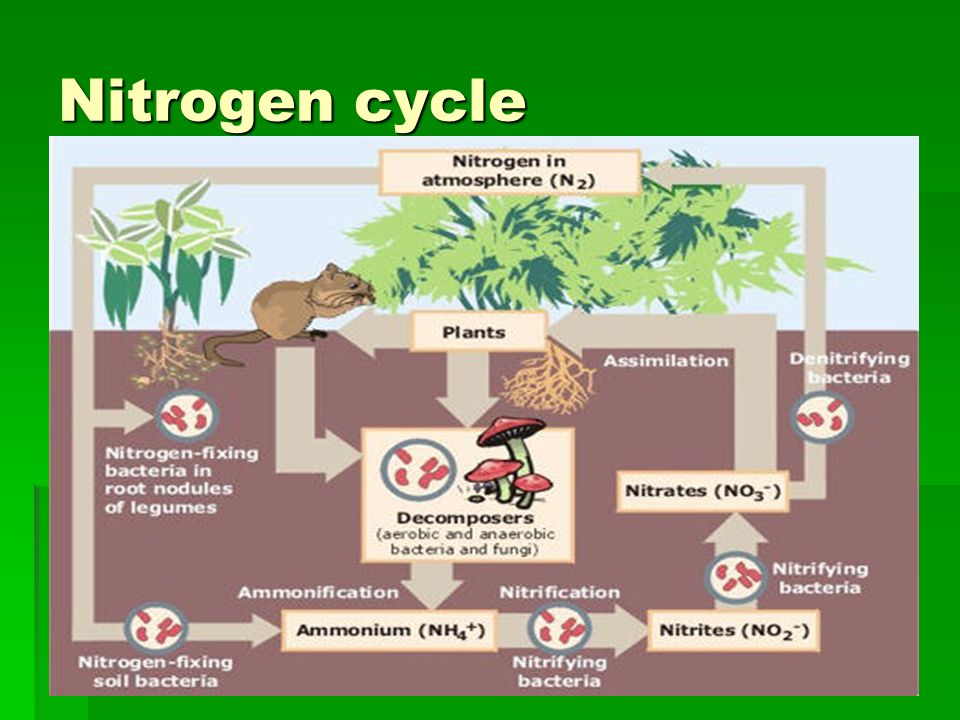 Eur J Plant Pathol. 2017; 147: 501–515. [Google Scholar]
Eur J Plant Pathol. 2017; 147: 501–515. [Google Scholar]
62. Indiragandhi P, Anandham R, Madhaiyan M, et al. Характеристика стимулирующих рост растений признаков бактерий, выделенных из кишечника личинок ромбовидной огневки Plutella xylostella (Lepidoptera: Plutellidae) Curr Microbiol. 2008; 56: 327–333. [PubMed] [Академия Google]
63. Xu G, Fan X, Miller T. Усвоение азота растениями и эффективность использования. Annu Rev Plant Biol. 2012; 63: 153–182. [PubMed] [Google Scholar]
64. Han J, Shi J, Zeng L, et al. Влияние непрерывного чрезмерного внесения удобрений на нитрифицирующую активность почвы и динамику сообщества нитрифицирующих микробов в тепличной системе. J Почвенные отложения. 2017; 17: 471–480. [Google Scholar]
65. Shaw LJ, Nicol GW, Smith Z, et al. Nitrosospira spp. может производить закись азота по пути денитрификации нитрификатора. Окружающая среда микробиол. 2006; 8: 214–222. [PubMed] [Академия Google]
66. Xia W, Zhang C, Zeng X, et al. Автотрофный рост нитрифицирующего сообщества в сельскохозяйственной почве. ISME J. 2011; 5:1226–1236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Xia W, Zhang C, Zeng X, et al. Автотрофный рост нитрифицирующего сообщества в сельскохозяйственной почве. ISME J. 2011; 5:1226–1236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Wang YF, Gu JD. Влияние аллилтиомочевины, солености и рН на аммиак/окисляющие аммоний прокариоты в отложениях мангровых зарослей, инкубированных в лабораторных микрокосмах. Приложение Microbiol Biotechnol. 2014;98:3257–3274. [PubMed] [Google Scholar]
68. Shen JP, Zhang LM, Zhu YG, et al. Численность и состав сообществ аммиакокисляющих бактерий и аммиакокисляющих архей щелочной супеси. Окружающая среда микробиол. 2008; 10:1601–1611. [PubMed] [Академия Google]
69. Xiao R, Chen B, Liu Y, et al. Более высокая численность аммиакокисляющих архей, чем аммиакокисляющих бактерий и их сообществ в почвах тибетских альпийских лугов при длительном азотном удобрении. Geomicrobiol J. 2014;31:597–604. [Google Scholar]
70. Nicol GW, Leininger S, Schleper C, et al. Влияние рН почвы на разнообразие, численность и транскрипционную активность аммиакокисляющих архей и бактерий. Окружающая среда микробиол. 2008; 10: 2966–2978. [PubMed] [Академия Google]
Окружающая среда микробиол. 2008; 10: 2966–2978. [PubMed] [Академия Google]
71. Ai C, Liang GQ, Sun JW, et al. Различная роль ризосферного воздействия и длительного оплодотворения в деятельности и структуре сообщества окислителей аммиака в карбонатной речно-водно-водной почве. Почва Биол Биохим. 2013;57:30–42. [Google Scholar]
72. Erguder TH, Boon N, Wittebolle L, et al. Факторы среды, формирующие экологические ниши аммиакокисляющих архей. FEMS Microbiol Rev. 2009; 33:855–869. [PubMed] [Google Scholar]
73. O’Sullivan CA, Wakelin SA, Fillery IR, et al. Факторы, влияющие на микроорганизмы, окисляющие аммиак, и потенциальные показатели нитрификации в сельскохозяйственных почвах южной Австралии. Почва Res. 2013;51:240–252. [Академия Google]
74. Мохеле Б., Чжан С., Ян Г. и др. Обзор: Усвоение азота культурными растениями и факторы, влияющие на него. Может J Plant Sci. 2012;92:399–405. [Google Scholar]
75. Кант С., Би Ю.М., Ротштейн С.Дж. Понимание реакции растений на ограничение азота для повышения эффективности использования азота сельскохозяйственными культурами. J Опытный бот. 2011;62:1499–1509. [PubMed] [Google Scholar]
J Опытный бот. 2011;62:1499–1509. [PubMed] [Google Scholar]
76. Wickert S, Marcondes J, Lemos MV, et al. Ассимиляция азота цитрусовыми на основе интеллектуального анализа данных CitEST. Генет Мол Биол. 2007; 30:810–818. [Академия Google]
77. Kaiser WM, Planchet E, Rümer S. Нитратредуктаза и оксид азота. В: Foyer CH, Zhang H, редакторы. Ежегодные обзоры растений, Метаболизм азота у растений в постгеномную эру. Чичестер: Уайли-Блэквелл; 2011. С. 127–146. [Google Scholar]
78. Boisson M, Mondon K, Torney V, et al. Частичные последовательности генов азотистого обмена у гексаплоидной пшеницы. Теория Appl Genet. 2005; 110:932–940. [PubMed] [Google Scholar]
79. Сакакибара Ю., Кимура Х., Ивамура А. и др. Новое структурное понимание дифференциального взаимодействия ферредоксинов цианобактерий и растений с нитритредуктазой, выявленное с помощью ЯМР и рентгеноструктурных исследований. Дж Биохим. 2012; 151: 483–49.2. [PubMed] [Google Scholar]
80. Lea PJ, Miflin BJ. Усвоение азота и его значение для улучшения урожая. В: Чжан Х, редактор. Ежегодные обзоры растений, Метаболизм азота у растений в постгеномную эру. Чичестер: Уайли-Блэквелл; 2011. С. 1–40. [Google Scholar]
Усвоение азота и его значение для улучшения урожая. В: Чжан Х, редактор. Ежегодные обзоры растений, Метаболизм азота у растений в постгеномную эру. Чичестер: Уайли-Блэквелл; 2011. С. 1–40. [Google Scholar]
81. Hawkins HJ, George H. Снижает транспорт N-азота 15 через арбускулярные гифы до Triticum aestivum L, снабженного аммонийным , по сравнению с нитратным питанием. Энн Бот. 2001; 87: 303–311. [Академия Google]
82. Mantelin S, Touraine B. Бактерии, способствующие росту растений, и доступность нитратов: влияние на развитие корневой системы и поглощение нитратов. J Опытный бот. 2004; 394: 27–34. [PubMed] [Google Scholar]
83. Cacco G, Attina E, Gelsomino A, et al. Влияние нитратов и гуминовых веществ разного молекулярного размера на кинетические параметры поглощения нитратов проростками пшеницы. J Plant Nutr Soil Sci. 2000;163:313–320. [Google Scholar]
84. Abenavoli MR, De Santis CD, Sidari M, et al. Влияние кумарина на чистое поглощение нитратов твердой пшеницей.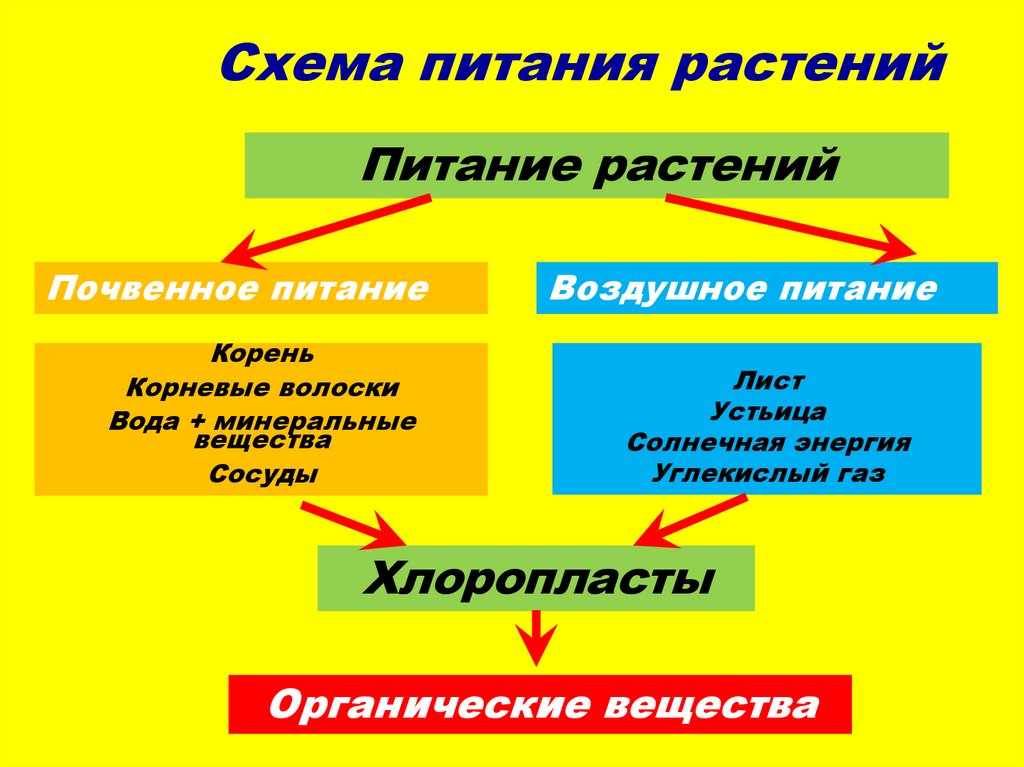 Новый Фитол. 2001;150:619–627. [Google Scholar]
Новый Фитол. 2001;150:619–627. [Google Scholar]
85. Bloom AJ, Burger M, Kimball BA, et al. Усвоение нитратов ингибируется повышенным содержанием CO 2 в полевой пшенице. Нат Клим Чанг. 2014; 4: 477–480. [Google Scholar]
86. Гуд А.Г., Шрават А.К., Мюнх Д.Г. Может ли меньшее дать больше? Совместимо ли сокращение поступления питательных веществ в окружающую среду с сохранением урожая? Тенденции Растениевод. 2004; 9: 597–605. [PubMed] [Google Scholar]
87. Fageria NK, Baligar VC, Li YC. Роль эффективных растений в повышении урожайности сельскохозяйственных культур в XXI веке. J Растительное питание. 2008; 31:1121–1157. [Академия Google]
88. Giuliani MM, Giuzio L, De Caro A, et al. Взаимосвязь между использованием азота и технологическим качеством зерна твердой пшеницы. I. Транслокация азота и эффективность использования азота для белка. Агрон Дж. 2011а; 103:1487–1494. [Google Scholar]
89. Giuliani MM, Giuzio L, De Caro A, et al. Взаимосвязь между использованием азота и технологическим качеством зерна твердой пшеницы.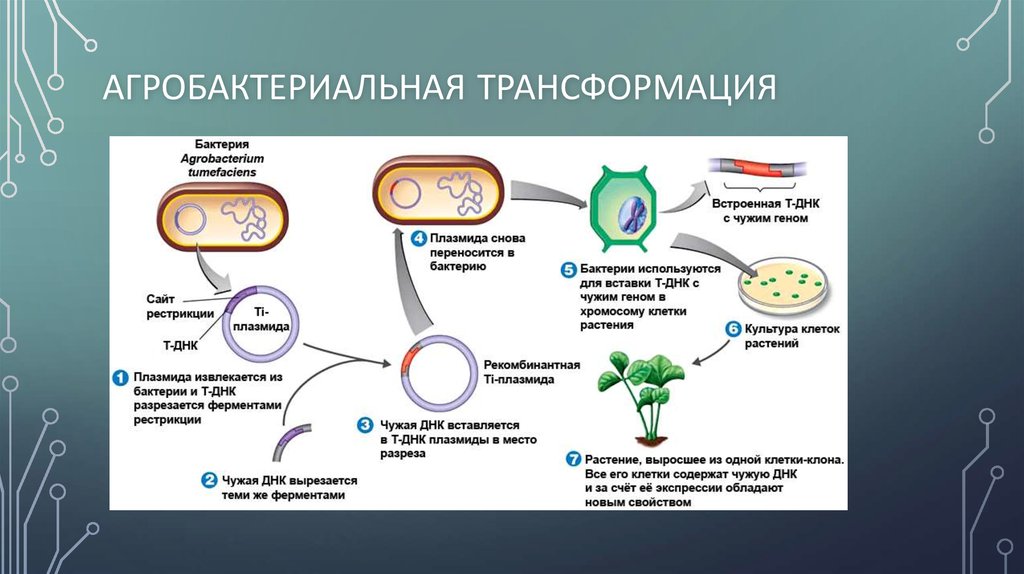 II. Урожайность и качество зерна. Агрон Дж. 2011b; 103:1668–1675. [Академия Google]
II. Урожайность и качество зерна. Агрон Дж. 2011b; 103:1668–1675. [Академия Google]
90. Ву Х, Хейг Т., Пратли Дж. и др. Аллелохимические свойства пшеницы ( Triticum aestivum L.): различие сортов в экссудации фенольных кислот. J Agric Food Chem. 2001;49:3742–3745. [PubMed] [Google Scholar]
91. Germida J, Siciliano S. Таксономическое разнообразие бактерий, связанных с корнями современных, современных и древних сортов пшеницы. Биол Плодородные почвы. 2001; 33: 410–415. [Google Scholar]
92. Cheng W, Johnson DW, Fu S. Влияние ризосферы на разложение. Почвоведение Soc Am J. 2003;67:1418–1427. [Академия Google]
93. Хсу С.Ф., Бакли Д.Х. Доказательства функционального значения структуры сообщества диазотрофов в почве. ISME J. 2009; 3: 124–136. [PubMed] [Google Scholar]
94. Нельсон Д.Р., Меле П.М. Влияние пожнивных остатков и извести на структуру микробного сообщества и азотфиксирующих бактерий в ризосфере пшеницы. Почва Res. 2006; 44: 319–329.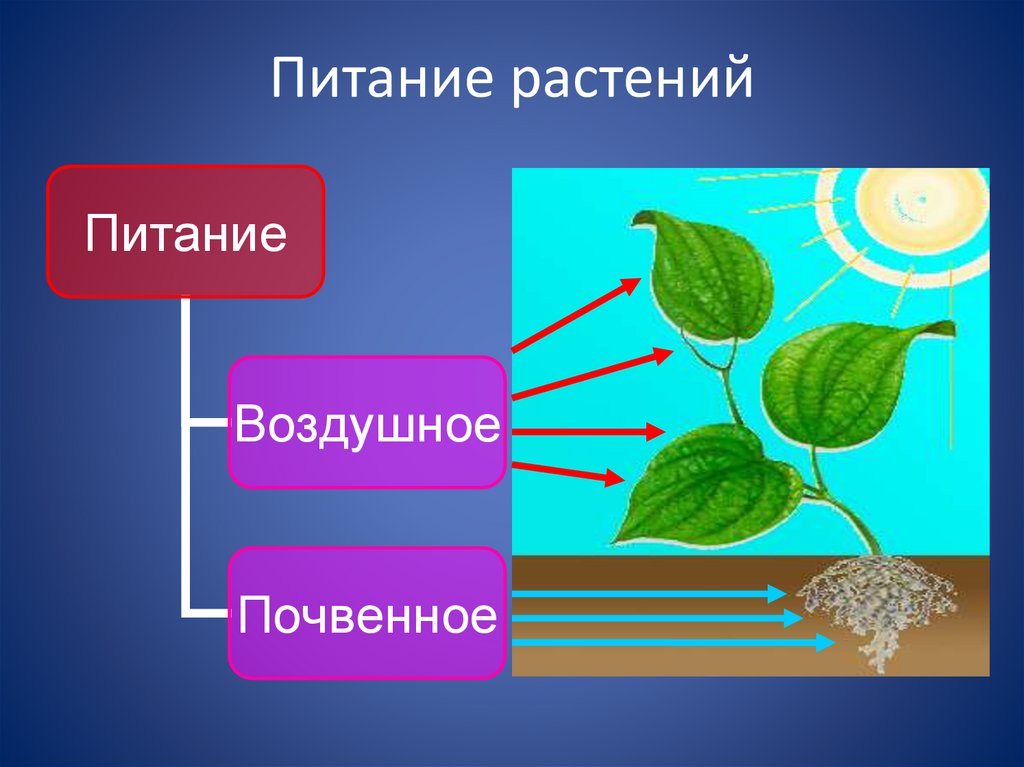 [Google Scholar]
[Google Scholar]
95. Venieraki A, Dimou M, Pergalis P, et al. Генетическое разнообразие культивируемых азотфиксирующих бактерий ризосферы пшеницы. Микроб Экол. 2011;61:277–285. [PubMed] [Академия Google]
96. Behl RK, Ruppel S, Kothe E, et al. Взаимодействие пшеницы × Azotobacter × VA Mycorhiza в отношении питания и роста растений — обзор. J Appl Bot Food Qual. 2012; 81: 95–109. [Google Scholar]
97. Neiverth A, Delai S, Garcia DM, et al. Показатели различных генотипов пшеницы, инокулированных стимулирующей рост растений бактерией Herbaspirillum seropedicae . Eur J Soil Biol. 2014;64:1–5. [Google Scholar]
98. Перин Л., Мартинес-Агилар Л., Кастро-Гонсалес Р. и др. Диазотрофный Burkholderia видов, связанных с полевой кукурузой и сахарным тростником. Appl Environ Microbiol. 2006;72:3103–3110. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Рирдон CL, Gollany HT, Wuest SB. Структура и численность сообщества диазотрофов в пшенично-паровом и пшенично-гороховом севооборотах. Почва Биол Биохим. 2014;69:406–412. [Google Scholar]
Почва Биол Биохим. 2014;69:406–412. [Google Scholar]
100. Coelho MRR, Marriel IE, Jenkins SN, et al. Молекулярное обнаружение и количественная оценка последовательностей генов nifH в ризосфере сорго ( Sorghum bicolor ) засевают двумя уровнями азотных удобрений. Прил. Экология почвы. 2009; 42:48–53. [Google Scholar]
101. Кристиансен-Венигер К., Гронеман А.Ф., ван Вин Дж.А. Ассоциативная N 2 фиксация и корневая экссудация органических кислот сортов пшеницы различной устойчивости к алюминию. Растительная почва. 1992; 139: 167–174. [Google Scholar]
102. Manske GGB, Behl RK, Luttger AB, et al. Усиление микоризной инфекции, эффективности питательных веществ и роста растений на Azotobacter в пшенице: свидетельство сортовых эффектов. В: Нарула Н, редактор. Азотобактерии в устойчивом сельском хозяйстве. Нью-Дели: Издательство CBS; 2000. С. 136–147. [Google Scholar]
103. Combes-Meynet E, Pothier JF, Moënne-Loccoz Y, et al. Вторичный метаболит Pseudomonas 2,4-диацетилфлороглюцин является сигналом, индуцирующим экспрессию ризопланов генов Azospirillum , участвующих в стимуляции роста растений.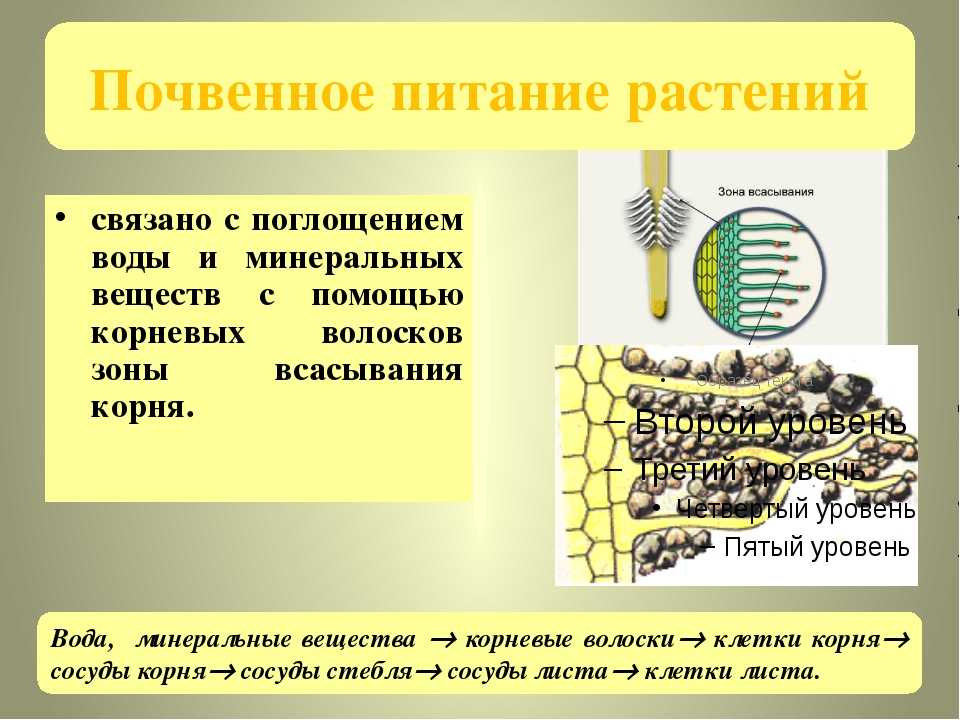 Мол Растительный Микроб В. 2011; 24: 271–284. [PubMed] [Академия Google]
Мол Растительный Микроб В. 2011; 24: 271–284. [PubMed] [Академия Google]
104. Baldani JI, Baldani VLD. История исследований биологической фиксации азота в злаковых растениях: особый акцент на бразильском опыте. Acad Bras Ciênc. 2005; 77: 549–579. [PubMed] [Google Scholar]
105. Cassán F, Perrig D, Sgroy V, et al. Azospirillum brasilense Az39 и Bradyrhizobium japonicum E109, инокулированные по отдельности или в комбинации, способствуют прорастанию семян и раннему росту проростков кукурузы ( Zea mays L.) и сои ( Glycine max L.) Eur J Soil Biol. 2009;45:28–35. [Google Scholar]
106. Мубайдин Л., Ди Мамбро Р., Сабатини С. Перекрестные помехи цитокинин-ауксин. Тенденции Растениевод. 2009; 14: 557–562. [PubMed] [Google Scholar]
107. Cohen AC, Bottini R, Piccoli PN. Azospirillum brasilense Sp 245 продуцирует АБК в культуральной среде с определенным химическим составом и увеличивает содержание АБК в растениях арабидопсиса.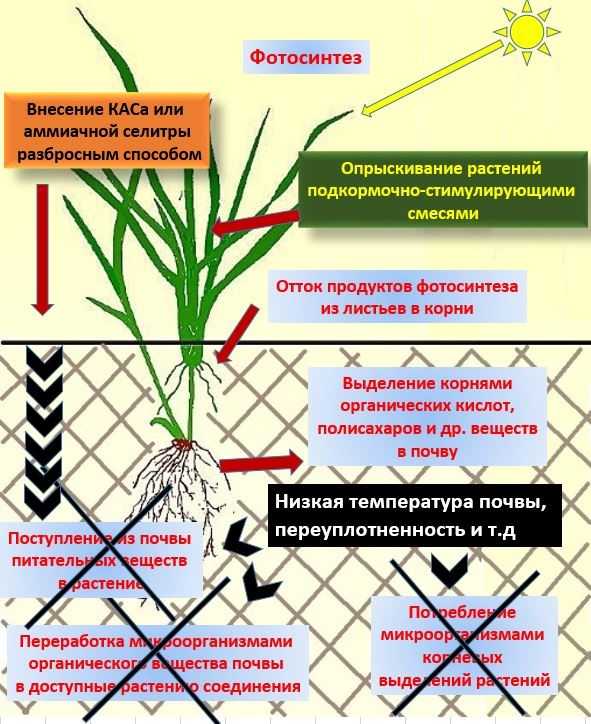 Регулятор роста растений. 2008; 54: 97–103. [Google Scholar]
Регулятор роста растений. 2008; 54: 97–103. [Google Scholar]
108. Упадхьяй С.К., Сингх Д.П., Сайкия Р. Генетическое разнообразие стимулирующих рост растений ризобактерий, выделенных из ризосферной почвы пшеницы в засоленных условиях. Карр микробиол. 2009 г.;59:489–496. [PubMed] [Google Scholar]
109. Graham JH, Linderman RG. Производство этилена эктомикоризными грибами, Fusarium oxysporum f. сп. pini и асептически синтезированной эктомикоризой и Fusarium , инфицированными корнями пихты Дугласа. Может J Microbiol. 1980; 26:1340–1347. [PubMed] [Google Scholar]
110. Prigent-Combaret C, Blaha D, Pothier JF, et al. Физическая организация и филогенетический анализ acdR как лейцин-чувствительного регулятора гена 1-аминоциклопропан-1-карбоксилатдезаминазы acdS в фитобенефициарии Azospirillum lipoferum 4B и другие Proteobacteria . FEMS Microbiol Ecol. 2008; 65: 202–219. [PubMed] [Google Scholar]
111. Bertrand H, Plassard C, Pinochet X, et al. Стимуляция системы ионного транспорта в Brassica napus с помощью ризобактерии, стимулирующей рост растений ( Achromobacter sp.) Can J Microbiol. 2000; 46: 229–236. [PubMed] [Google Scholar]
Стимуляция системы ионного транспорта в Brassica napus с помощью ризобактерии, стимулирующей рост растений ( Achromobacter sp.) Can J Microbiol. 2000; 46: 229–236. [PubMed] [Google Scholar]
112. Mantelin S, Desbrosses G, Larcher M, et al. Зависимый от нитратов контроль архитектуры корней и азотного питания изменяются стимуляторами роста растений Phyllobacterium sp. Планта. 2006; 223: 591–603. [PubMed] [Google Scholar]
Биологическая фиксация азота | Изучайте науку в Scitable
Appleby, CA Leghemoglobin и Rhizobium дыхания. Ежегодный обзор физиологии растений 33 , 443-478 (1984).
Beijerinck, M.W. Über oligonitrophile Mikroben. Збл. Назад 7 , 561-582 (1901).
Бенсон, Д. Р. и Сильвестр, В. Б. Биология Штаммы Frankia , актиномицеты-симбионты актиноризных растений. Microbiological Reviews 57 , 293-319 (1993).
Ченг, Х-П. & Walker, G.C. Сукциногликан необходим для инициации и удлинения инфекционных нитей во время образования клубеньков на люцерне Rhizobium meliloti. Journal of Bacteriology 180 , 5183-5191 (1998).
& Walker, G.C. Сукциногликан необходим для инициации и удлинения инфекционных нитей во время образования клубеньков на люцерне Rhizobium meliloti. Journal of Bacteriology 180 , 5183-5191 (1998).
Диас, Р. Дж. и Розенберг, Р. Распространение мертвых зон и последствия для морских экосистем. Наука 321 , 926-929 (2008).
Fattah, Q.A. «Растительные ресурсы для человеческого развития». Третья международная ботаническая конференция, 2005 г. Бангладешское ботаническое общество, Дакка, Бангладеш, 2005 г.
Камст, Э. Х., Спаник, П., и Кафетзопулос, Д. «Биосинтез и секреция ризобиальных сигнальных молекул липохитин-олигосахаридов», в Субклеточная биохимия , Том 29. Взаимодействия растений и микробов , ред. BB Biswas и HK Das. (Пленум Паблишинг, Нью-Йорк, 1998) 29-33.
Херридж, Д. Ф., Пиплс, М. Б., и Бодди, Р. М. Глобальный вклад биологической фиксации азота в сельскохозяйственных системах. Почва для растений 311 , 1-18 (2008).
Хаббелл, Д. Х. и Киддер, Г. Биологическая фиксация азота. Расширенная публикация IFAS Университета Флориды SL16. 1-4 (2009).
Наполи, К.А. и Хаббелл, Д.Х. Ультраструктура инфекционных нитей, вызванных Rhizobium, в корневых волосках клевера. Прикладная и экологическая микробиология 30 , 1003-1009 (1975).
Национальный исследовательский совет. Биологическая фиксация азота: исследовательские проблемы. Вашингтон, округ Колумбия: National Academy Press, 1994.
Postgate, JR Основы фиксации азота . Нью-Йорк, штат Нью-Йорк: Издательство Кембриджского университета, 1982.
Стефан, член парламента и др. . «Физиологические исследования с Azospirillum spp. в Associative N 2 -Fixation. Volume I, eds. PB Vose & AP Ruschel (Boca Raton, FL: CRC Press, 19)79) 7-14.
Вэнс, К. Симбиотическая фиксация азота и усвоение фосфора. Питание растений в условиях сокращения возобновляемых ресурсов. Физиология растений 127 , 391-397 (2001).


 В результате образуется клубенек.
В результате образуется клубенек. Они являются хемоорганотрофами и грамположительными.
Они являются хемоорганотрофами и грамположительными.