Содержание
АЛКАЛОИДЫ • Большая российская энциклопедия
Авторы: О. Н. Толкачёв
АЛКАЛО́ИДЫ, азотсодержащие органич. основания, обладающие биологич. активностью. Встречаются преим. в растениях, произрастающих в тропиках и субтропиках; содержание А. колеблется от долей процента до 1–2% и более в зависимости от видовой принадлежности, условий среды, а также времени вегетации и сбора. В некоторых растениях содержание А. может достигать 10–18% (напр., хинин в коре хинного дерева, никотин в листьях табака). Как правило, в растениях присутствует неск. А. (напр., в маке снотворном 15–20, в катарантусе розовом до 100).
Известно неск. тысяч природных А., выделенных из представителей более 100 семейств растений. А. являются вторичными метаболитами аминокислот. Их значение для растений пока не ясно, хотя им приписывают и защитную (предохраняют от поедания животными и насекомыми) и гормональную (что маловероятно) функции. Но очевидно, что они играют важную роль в обмене веществ у растений (напр., установлено, что некоторые А. могут служить переносчиками кислорода в окислительно-восстановит. реакциях). Большинство А. – гетероциклич. соединения; в природных источниках обычно присутствуют в виде солей органич. и неорганич. кислот; для многих из них полностью установлена химич. структура.
Но очевидно, что они играют важную роль в обмене веществ у растений (напр., установлено, что некоторые А. могут служить переносчиками кислорода в окислительно-восстановит. реакциях). Большинство А. – гетероциклич. соединения; в природных источниках обычно присутствуют в виде солей органич. и неорганич. кислот; для многих из них полностью установлена химич. структура.
Единой классификации А. не существует. В зависимости от структуры углерод-азотного скелета молекулы различают А. алифатические, апорфиновые, бензофенантридиновые, изохинолиновые, индольные, пептидные, пиридиновые, стероидные, хинолиновые и др. Т. к. к индольным относится самое большое число А., среди них выделяют неск. подгрупп: бета-карболиновые, карбазольные, иохимбиновые, коринантеиновые и др. Часто А. систематизируют по таксономич. признаку, включая в одну группу все соединения, содержащиеся в растениях одного рода или семейства, напр. А. амариллисов, винки, кактусов, ликоподия, мака, эфедры, паслёна, безвременника и др. Такая классификация во многом условна, т. к. эти А. могут существенно различаться по химич. структуре и биологич. действию. Часто названия индивидуальных А. производят от лат. родового или видового названия растения, содержащего А., с прибавлением суффикса «ин», напр. стрихнин и атропин, выделяемые соответственно из растений родов Strychnos и Atropa.
А. амариллисов, винки, кактусов, ликоподия, мака, эфедры, паслёна, безвременника и др. Такая классификация во многом условна, т. к. эти А. могут существенно различаться по химич. структуре и биологич. действию. Часто названия индивидуальных А. производят от лат. родового или видового названия растения, содержащего А., с прибавлением суффикса «ин», напр. стрихнин и атропин, выделяемые соответственно из растений родов Strychnos и Atropa.
К числу А. относят также азотсодержащие основания, выделенные из водорослей, грибов и животных, в т. ч. А. морских губок, моллюсков, млекопитающих, саламандр, яды жаб и др. Некоторые азотсодержащие соединения включают в группу А. по биогенетическому принципу лишь на основании того, что имеют общих с А. предшественников при биосинтезе, хотя на самом деле они А. не являются (напр., т. н. А. жгучего перца или циклопептиды бледной поганки). В группу А. включены также сопутствующие природные N-оксиды А., обладающие слабоосно́вными свойствами. Структурные особенности отдельных А. (в т. ч. стереохимические) используются в хемосистематике высших растений.
В группу А. включены также сопутствующие природные N-оксиды А., обладающие слабоосно́вными свойствами. Структурные особенности отдельных А. (в т. ч. стереохимические) используются в хемосистематике высших растений.
Многие А. ядовиты. Напр., стрихнин поражает нервную систему, вызывая судороги всех мышц и смерть от удушья. Один из самых известных А., никотин, в малых дозах действует на нервную систему возбуждающе, а в больших вызывает её паралич. Несколько капель никотина (100–200 мг, т. е. количество, содержащееся в 200 г табака) могут вызвать смерть человека. Длительное поглощение никотина небольшими дозами при курении вызывает хронич. отравление (никотинизм). Среди А. существуют соединения, вызывающие наркотич. эффект. При регулярном употреблении таких А., напр. морфина, кокаина, развивается привыкание и болезненное пристрастие (наркомания).
Растительные А. применяют в качестве лекарственных средств: кофеин стимулирует деятельность нервной системы, повышает работоспособность, двигат. активность; атропин и скополамин снижают тонус гладкой мускулатуры внутр. органов; кокаин – местное обезболивающее средство; папаверин снимает спазмы сосудов, обладает способностью расширять их; берберин проявляет желчегонное действие; винбластин и винкристин – активные цитостатики; галантамин – антихолинэстеразный агент, который также используется при лечении болезни Альцгеймера; глауцин, кодеин – средства от кашля; морфин обладает сильным болеутоляющим и снотворным эффектом и т. д. А. применяют также в качестве модельных соединений при изучении связей между структурой и функцией биологически активных веществ.
Многие А. и их производные получают химич. синтезом, а также биомиметич. путём в физиологич. условиях, моделируя их биосинтез в природе. В ряде случаев природные А. путём химич. модификации превращают в более активные и сильнодействующие препараты. Налажено пром. получение синтетич. А. (эфедрина, эметина), а также аналогов природных А., которые дают более высокий лечебный эффект или не оказывают побочного действия, напр. новокаин (вместо кокаина) и акрихин (вместо хинина).
путём в физиологич. условиях, моделируя их биосинтез в природе. В ряде случаев природные А. путём химич. модификации превращают в более активные и сильнодействующие препараты. Налажено пром. получение синтетич. А. (эфедрина, эметина), а также аналогов природных А., которые дают более высокий лечебный эффект или не оказывают побочного действия, напр. новокаин (вместо кокаина) и акрихин (вместо хинина).
Этюды о растениях
: 17 Ноя 2007 , В поисках энергии большого взрыва , том 17,
№5
Вниманию читателей мы предлагаем первую публикацию, посвященную фитохимии и фитофармакологии, выполненную на основе материалов, которые были предоставлены редакции династией известных российских ученых: академиком РАН Г.А. Толстиковым (Новосибирский институт органической химии им.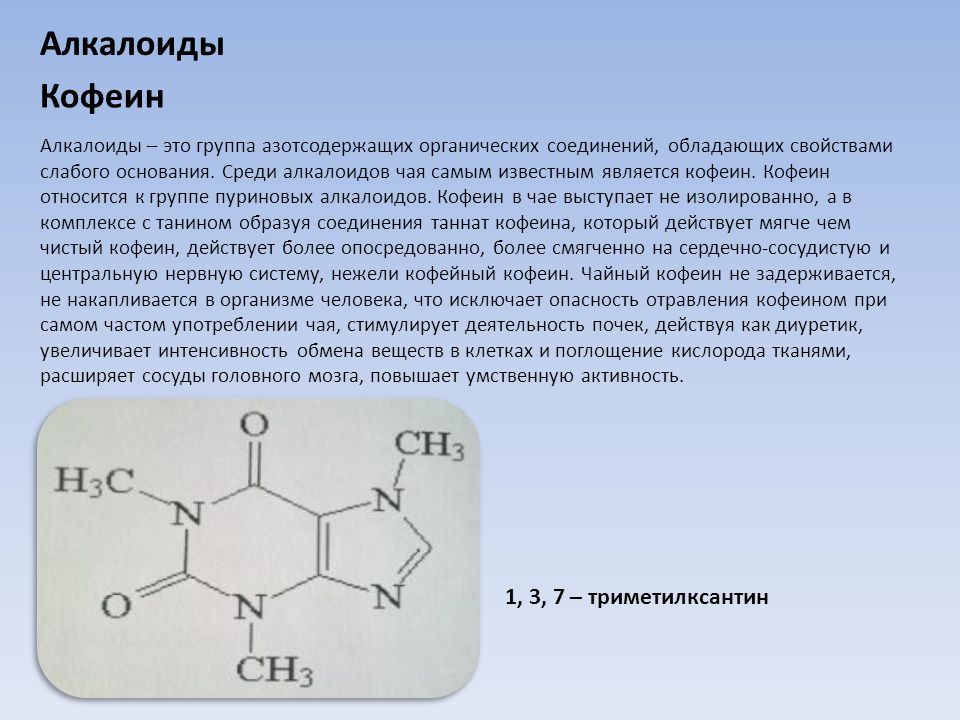 Н.Н. Ворожцова СО РАН), член-корреспондентом РАН А.Г. Толстиковым (Президиум РАН, Москва) и доктором биологических наук Т.Г. Толстиковой (Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН). Речь пойдет об истории врачевания травами, о традиционных и современных технологиях получения из растений лекарственных препаратов, а также об алкалоидах — сильнодействующих растительных средствах, издавна пользовавшихся дурной славой, но в умелых руках превращающихся в лекарство. В последующих выпусках журнала мы планируем опубликовать оригинальные статьи авторов, которые знакомят с необъятным миром растений: наших друзей, помощников и лекарей, — а также с традиционными и современными технологиями создания лекарственных средств на основе низкомолекулярных растительных веществ
Н.Н. Ворожцова СО РАН), член-корреспондентом РАН А.Г. Толстиковым (Президиум РАН, Москва) и доктором биологических наук Т.Г. Толстиковой (Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН). Речь пойдет об истории врачевания травами, о традиционных и современных технологиях получения из растений лекарственных препаратов, а также об алкалоидах — сильнодействующих растительных средствах, издавна пользовавшихся дурной славой, но в умелых руках превращающихся в лекарство. В последующих выпусках журнала мы планируем опубликовать оригинальные статьи авторов, которые знакомят с необъятным миром растений: наших друзей, помощников и лекарей, — а также с традиционными и современными технологиями создания лекарственных средств на основе низкомолекулярных растительных веществ
За многие века, в течение которых человек изучает растения, выработалось понятие о фитохимии как о разделе химической науки, который исследует строение и превращения химических соединений, продуцируемых растениями. Примыкающая к фитохимии фитофармакология занимается проблемами биологической активности растительных веществ (или растительных метаболитов), являясь, таким образом, частью медицинской науки.
Примыкающая к фитохимии фитофармакология занимается проблемами биологической активности растительных веществ (или растительных метаболитов), являясь, таким образом, частью медицинской науки.
Органические вещества, входящие в состав растений, о которых далее пойдет речь, можно условно разделить на два класса соединений: высокомолекулярные и низкомолекулярные. Первый класс включает в себя преимущественно полимеры моносахаридов (глюкозы, ксилозы, галактозы и т. п.). Характерными представителями полисахаридов являются такие полимеры глюкозы, как целлюлоза, служащая опорным строительным материалом растений, и крахмалы, которые можно назвать аккумуляторами энергии.
Но главным предметом нашего внимания будут низкомолекулярные растительные вещества, составляющие так называемый класс вторичных метаболитов. Их роль в жизни растений огромна, хотя до конца и не выяснена. На сегодня известно, что они ведают процессами роста и развития растений, охраняют хозяев от патогенных микроорганизмов, грибов и насекомых-вредителей. Исследование функций этих удивительно разнообразных метаболитов, безусловно, принесет еще немало сенсаций.
Исследование функций этих удивительно разнообразных метаболитов, безусловно, принесет еще немало сенсаций.
Интерес же человека к низкомолекулярным растительным веществам связан с его потребностями в продуктах питания, средствах врачевания болезней, а также в сырье для промышленности и в других подобных «сущностях», которые определяют качество жизни.
Если говорить об объемах производства и потребления низкомолекулярных растительных метаболитов, то безусловными чемпионами являются сахароза (130 млн т в год) и растительные жиры со схожим уровнем потребления. Следующую позицию можно закрепить за D-глюкозой, производимой из растительного крахмала (5 млн т в год). На ее основе получают D-сорбит (650 тыс. т), без которого немыслимо производство аскорбиновой кислоты. В последние десятилетия появилась потребность в таких моносахаридах, как D-фруктоза (60 тыс. т), D-ксилоза (25 тыс. т), ксилит (30 тыс. т), которые используются в медицинской и пищевой промышленности.
К низкомолекулярным метаболитам относятся и скипидары, живицы и канифоли, добываемые из хвойных деревьев. Скипидары (годовое производство более 200 тыс. т) заняли в последние десятилетия важное место в химической промышленности. Так, более четверти объема их годовой добычи идет на производство душистых, ароматических и лекарственных веществ, имеющих широчайший рынок сбыта. Трудно найти равноценную замену и канифолям, которые используются в производстве синтетических каучуков, резинотехнических изделий (в особенности автомобильных шин), а также лаков и красок высокого качества.
Скипидары (годовое производство более 200 тыс. т) заняли в последние десятилетия важное место в химической промышленности. Так, более четверти объема их годовой добычи идет на производство душистых, ароматических и лекарственных веществ, имеющих широчайший рынок сбыта. Трудно найти равноценную замену и канифолям, которые используются в производстве синтетических каучуков, резинотехнических изделий (в особенности автомобильных шин), а также лаков и красок высокого качества.
ИСТОРИЯ ВРАЧЕВАНИЯ ТРАВАМИ Фармакогнозия — изучение растительных метаболитов, основой которого стали народная мудрость и наблюдательность, — берет свое начало в глубокой древности. Среди 22 тысяч глиняных клинописных табличек, найденных при раскопках дворца ассирийского царя Ашурбанипала, 33 содержат сведения о лекарственных растениях. В сочинениях знаменитого врача Гиппократа описываются 236 целебных растений. «Отцом фармакогнозии» считают грека Диоскорида, известного античного врача и ботаника, чей труд «Materia medica» вплоть до XVI в. считался в Европе самым авторитетным медицинским руководством. Труды греческого врача Галена (его именем до сих пор называют препараты, получаемые из растений в виде настоек, отваров и т. д.) высоко ценились еще в XIX в.
считался в Европе самым авторитетным медицинским руководством. Труды греческого врача Галена (его именем до сих пор называют препараты, получаемые из растений в виде настоек, отваров и т. д.) высоко ценились еще в XIX в.
Древнейшая медицинская книга Индии «Яджур-веда» («Наука о жизни») содержит сведения о 700 лекарственных растениях. На ее основе составлена и популярная тибетская медицинская книга «Джуд-Ши» («Сущность целебного»). До сих пор непревзойденным источником сведений о лекарственных растениях является травник китайского ученого XVI в. Ли Ши-Чжена, в котором содержится описание 1892 объектов. Лекарственным растениям уделено много места и в получившем широчайшую известность многотомном «Каноне врачебной науки» великого ученого Абу-Али Ибн Сины (Авиценны).
Лечение травами издавна практиковалось и у славян. В Древней Руси оно было профессией волхвов и знахарей, передававших свое умение устно из поколения в поколение. Эту эстафету приняли у них монастыри, при которых была организована заготовка лекарственных трав. К сожалению, письменные сведения о положении лечебного дела в России до середины XVII в. отсутствуют.
К сожалению, письменные сведения о положении лечебного дела в России до середины XVII в. отсутствуют.
На государственную основу лечебное дело в России было поставлено при царе Алексее Михайловиче, организовавшем специальную «госструктуру» — Аптекарский приказ, и в особенности при Петре I, который издал указы о создании аптек и аптекарских огородов.
Дальнейшее развитие исследований, посвященных врачеванию с помощью лекарственных растений, стимулировалось составлением в 1778 г. первой в России гражданской фармакопеи. Так, известный общественный деятель А. Т. Болотов поместил в издаваемом им журнале около 500 статей о лекарственных растениях. Событием своего времени явилось издание многотомного труда Н. М. Максимовича-Амбодика «Врачебное веществословие», также включавшего описание многочисленных целебных растений.
Однако в первой половине XIX в. «петровский импульс», по-видимому, стал иссякать. Было отменено введенное царем государственное снабжение войск медикаментами, ушли в историю аптекарские огороды и галеновые лаборатории, распалась система заготовки трав. Многочисленные частные аптеки взяли курс на торговлю импортным сырьем и лекарствами. Российская фармакопея перестала переиздаваться: аптеки стали пользоваться немецкой фармакопеей.
Многочисленные частные аптеки взяли курс на торговлю импортным сырьем и лекарствами. Российская фармакопея перестала переиздаваться: аптеки стали пользоваться немецкой фармакопеей.
Ничуть не отрицая необходимости восприятия мирового научного опыта, не преминем заметить, что властные структуры нашего государства периодически, что называется, «наступают на одни и те же грабли». Синдром отмены централизованной заботы о здоровье нации, к сожалению, оказался живуч и в наше время — спустя более полутора столетий
Сегодня определились и новые направления в использовании смоляных кислот компонентов живиц и канифолей. Так, исследования последних трех десятилетий наметили пути превращения их в вещества, перспективные в качестве лекарственных препаратов. Объем производства низкомолекулярных метаболитов, предназначенных для такого производства, более скромен и составляет от нескольких килограммов до нескольких десятков тонн.
Выделение растительных веществ. От перегонки — до хроматографии
Основные приемы, которые используются для извлечения из растений нужных веществ, немногочисленны. В первую очередь, это экстракция подходящими растворителями, в качестве которых могут выступать вода, спирты, ацетон, эфиры и т. д. Экстракции могут подвергаться большие объемы материала: в мире ежегодно перерабатываются десятки и сотни тысяч тонн растительного сырья для извлечения веществ, необходимых для химической промышленности.
В первую очередь, это экстракция подходящими растворителями, в качестве которых могут выступать вода, спирты, ацетон, эфиры и т. д. Экстракции могут подвергаться большие объемы материала: в мире ежегодно перерабатываются десятки и сотни тысяч тонн растительного сырья для извлечения веществ, необходимых для химической промышленности.
Поскольку первым продуктом обработки растительного материала обычно являются сложные смеси веществ, то одним из необходимых элементов высоких технологий стала разработка методов выделения индивидуальных соединений. В настоящее время в промышленном масштабе для этих целей используются адсорбционная и ионообменная хроматография, высокоэффективная жидкостная хроматография, мембранное разделение, тонкая ректификация и многие другие методы.
Старинным, но хорошо работающим методом является перегонка с водяным паром, используемая для выделения летучих соединений, таких как эфирные масла. Например, мятное масло, ценимое за содержащийся в нем ментол, получают паровой перегонкой надземной части перечной мяты, собранной в период цветения. В этот период максимальная концентрация эфирных масел наблюдается также в шалфее, герани и лаванде.
В этот период максимальная концентрация эфирных масел наблюдается также в шалфее, герани и лаванде.
Для получения же жасминного, иланг-илангового и особо ценного розового масла используются только цветы. Незабываемое ощущение чего-то сказочного испытываешь, стоя перед целой горой розовых цветочных лепестков, приготовленных для паровой перегонки. На почетном месте у парфюмеров стоит ирисовое масло, добываемое из корней ириса. А вот источником анисового и кориандрового эфирных масел служат семена. К началу 1980-х гг. в производстве лекарственных добавок, средств парфюмерии и косметики использовалось более 35 видов эфирных масел, среди которых безусловными чемпионами по объему выпускаемой продукции являются масла цитрусовых.
Паровой перегонкой живиц хвойных деревьев и так называемого пневого осмола — продукта экстракции пней — можно получить десятки тысяч тонн скипидаров. Не меньшее количество скипидара производится и в процессе превращения древесины в целлюлозу. Саму жививцу (древесную смолу) получают собирательством — древнейшим способом, известным человеку с добиблейских времен. Смолы собирали не только на местах случайных повреждений ствола или веток — их выделение стимулировали, нанося на ствол дерева специальные надрезы. Так была изобретена подсочка — прием, принципиально не изменившийся за несколько тысячелетий.
Смолы собирали не только на местах случайных повреждений ствола или веток — их выделение стимулировали, нанося на ствол дерева специальные надрезы. Так была изобретена подсочка — прием, принципиально не изменившийся за несколько тысячелетий.
Смолы различных деревьев широко использовались в древней медицине. Известно, например, что они служили дезинфицирующим покрытием при лечении ран. Установлено и дезинфицирующее действие жертвенных храмовых воскурений: это свойство смол заметили еще древние египтяне во время эпидемии чумы.
Огромное внимание в древности уделялось искусству составления благовоний, мазей и притираний — косметическим средствам, которые мы с полным правом можем причислить к средствам медицинского назначения. Так, в числе подарков Царицы Савской царю Соломону были и смолы и бальзамы из Южной Аравии. А персидского царя Дария во время похода против Греции пользовали четыре десятка мастеров-косметологов!
Воспетая поэтом мирра — тоже ароматическая смола, выделяющаяся после надрезания коры аравийского дерева Commiphora.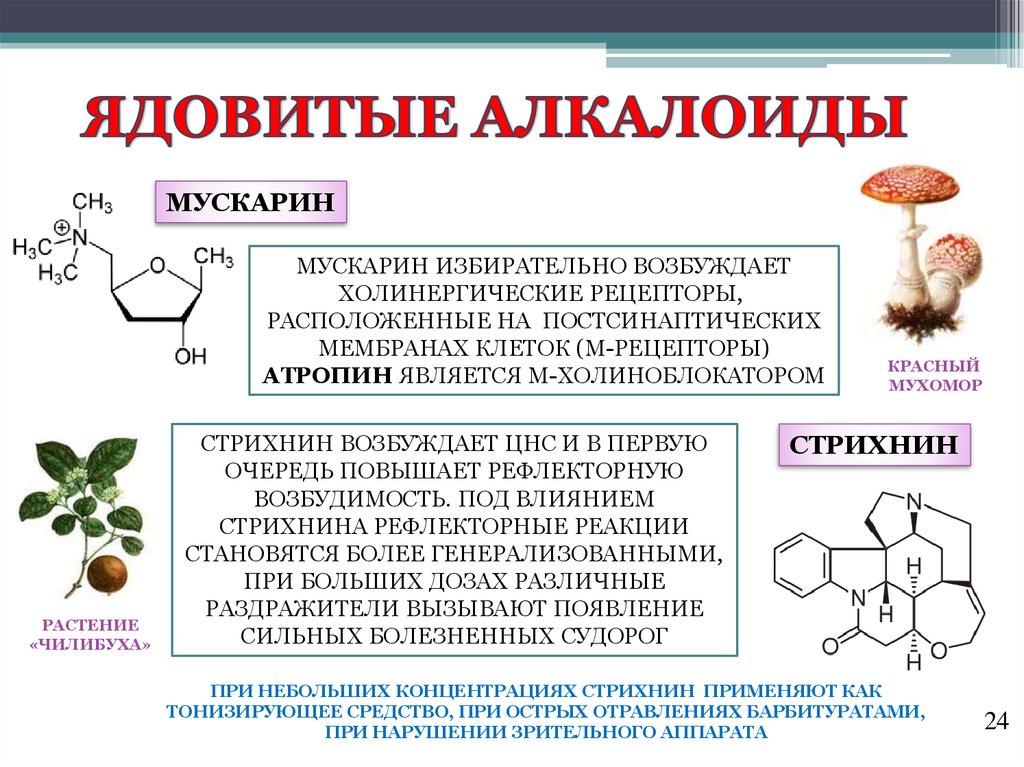 Помните, у Куприна: «… сам весь благоухающий, старый, жирный, сморщенный скопец-египтянин» «осторожно отсчитал из финикийской склянки в маленький глиняный флакончик ровно столько капель мирры, сколько было динариев во всех деньгах Суламифи, и когда окончил это дело, то сказал, подбирая пробкой остаток масла вокруг горлышка и лукаво смеясь: “Смуглая девушка, прекрасная девушка! Когда сегодня твой милый поцелует тебя между грудей и скажет: “Как хорошо пахнет твое тело, о моя возлюбленная!”, — ты вспомни обо мне в этот миг. Я перелил тебе три лишние капли”».
Помните, у Куприна: «… сам весь благоухающий, старый, жирный, сморщенный скопец-египтянин» «осторожно отсчитал из финикийской склянки в маленький глиняный флакончик ровно столько капель мирры, сколько было динариев во всех деньгах Суламифи, и когда окончил это дело, то сказал, подбирая пробкой остаток масла вокруг горлышка и лукаво смеясь: “Смуглая девушка, прекрасная девушка! Когда сегодня твой милый поцелует тебя между грудей и скажет: “Как хорошо пахнет твое тело, о моя возлюбленная!”, — ты вспомни обо мне в этот миг. Я перелил тебе три лишние капли”».
Наконец, египетские жрецы использовали смолу кедра и канифоль при бальзамировании. Кстати, само название «канифоль» происходит от названия малоазиатского города «Колофон», где процветала технология термической переработки живицы хвойных деревьев, дающая канифоль и терпентинное масло (скипидар). Есть все основания считать, что эта технология была заимствована от умельцев Древней Месопотамии. К сожалению, это искусство долгое время считалось утраченным и возродилось благодаря трудам арабских алхимиков VII—VIII вв. нашей эры, после чего перекочевало в средневековую Европу.
нашей эры, после чего перекочевало в средневековую Европу.
Итак, теми или иными методами целевые растительные вещества получены. Как складывается их дальнейшая судьба? При всем огромном разнообразии технологий переработки растительных метаболитов, среди них можно выделить два подхода.
Первый из них предусматривает использование соединений в нативном (природном) виде. Будучи самым старым, этот подход не утратил своего значения и по настоящее время. Например, еще в XIX в. стали употребляться такие препараты, как противомалярийный хинин, добываемый из коры хинного дерева, анальгетик морфин, получаемый из опийного мака, регулятор сердечной деятельности строфантин, вырабатываемый африканским растением строфантус. Во второй половине прошлого века в лечении онкологических заболеваний начали применять винбластин и винкристин из вьюнка розового, камптоцетин — метатаболит дерева камптотека остроконечная, растущего в горных лесах Юго-Западного Китая.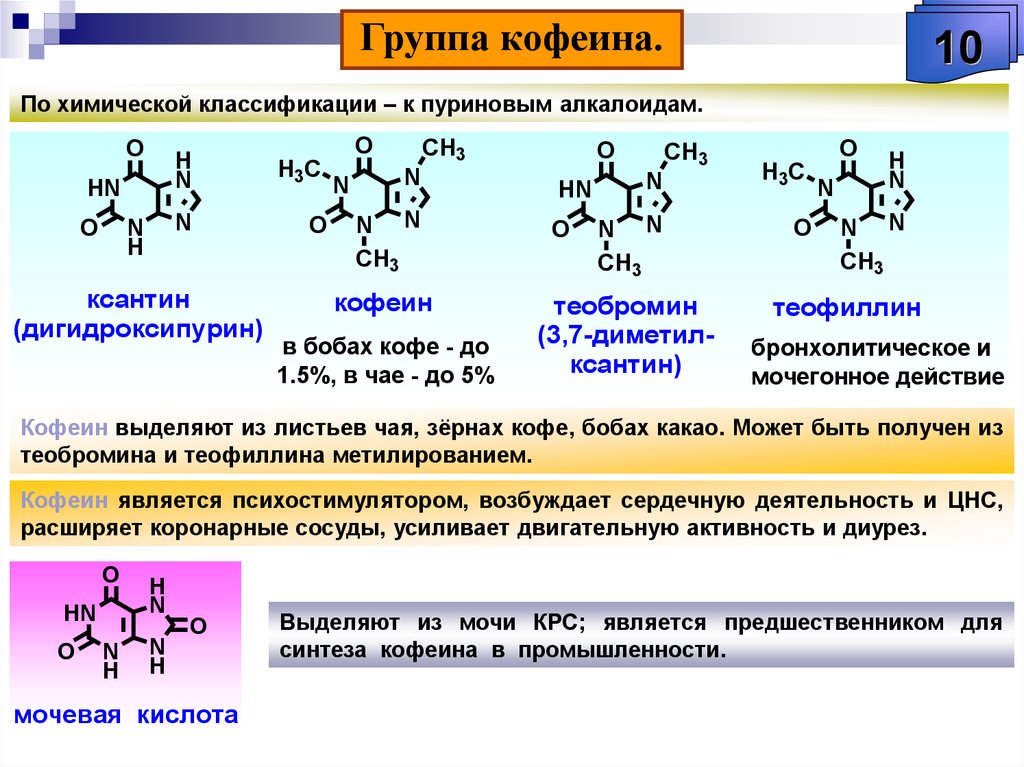
Согласно второму подходу, растительные метаболиты рассматриваются как исходный материал для направленных химических или микробиологических трансформаций, имеющих целью либо усиление базовой активности исходных веществ, либо получение препаратов с совершенно новыми свойствами.
Глубина структурной трансформации веществ может быть различной. Очень часто без значительного изменения структуры вещества удается улучшить транспорт лекарственного препарата в организме и повысить его базовую активность. Глубокие превращения растительных метаболитов нередко требуют приложения самых современных методов тонкой химической технологии, что лимитирует объемы их производства.
В качестве наглядного примера создания новых лекарственных форм из растительного материала давайте обратимся к исследованиям отечественных ученых, связанных с одним из наиболее перспективных классов растительных метаболитов — алкалоидов.
Алкалоидная одиссея
«Это снадобье для полета ведьм приготавливалось из ядовитого латука, болотного сельдерея, болиголова, паслена, корней мандрагоры, снотворного мака, змеиной крови и жира некрещеных, колдуньями замученных детей» (Д. Мережковский, «Воскресшие боги»).
Мережковский, «Воскресшие боги»).
Ядовитые растения, которые могут одурманить, вызвать состояние анальгезии, а то и убить человека, были издавна отмечены вниманием людей, занимавшихся врачеванием, колдовством и ведовством. Мандрагора, о которой говорится в рецепте из процитированного романа, обладала, по поверьям, магической силой, чему в немалой степени способствовала сама форма растения, напоминающая человеческую фигуру. Настой корня действительно был способен вызвать бредовое состояние, а людям средневековья казалось, что под действием дьявольских сил устами человека говорит сам нечистый.
К началу XIX в. изучение сильнодействующих растительных средств стало одним из важных научных направлений. В первой четверти века особый интерес вызывали такие средства, как опий, применявшийся для утоления боли, хинная корка, завезенная в Европу отцами-иезуитами, а также белладонна, использовавшаяся для лечения ряда болезней.
В 1806 г. французский аптекарь Сертюрнер, выделив из опия морфин, сообщил, что он открыл новый класс веществ — класс так называемых растительных щелочей. Двенадцатью годами позже Мейснер предложил для таких веществ название «алкалоиды» (от латинского alcali — «щелочь»). В 1820 г. было показано, что действующим началом хинной корки является алкалоид хинин, а еще через 11 лет была установлена «ответственность» атропина, алкалоида из белладонны, за способность расширять глазной зрачок. В настоящее время алкалоидами называют органические вещества, выделенные из природных объектов и содержащие в своей структуре хотя бы один атом азота.
Двенадцатью годами позже Мейснер предложил для таких веществ название «алкалоиды» (от латинского alcali — «щелочь»). В 1820 г. было показано, что действующим началом хинной корки является алкалоид хинин, а еще через 11 лет была установлена «ответственность» атропина, алкалоида из белладонны, за способность расширять глазной зрачок. В настоящее время алкалоидами называют органические вещества, выделенные из природных объектов и содержащие в своей структуре хотя бы один атом азота.
Список известных алкалоидов огромен, также как и разнообразие их структур, и все они обладают высокой биологической активностью. (Нужно отметить, что к перечню растительных алкалоидов (а их продуцируют многие тысячи видов растений) ныне добавляются многочисленные субстанции, которые синтезируются животными и морскими организмами.)
Российская «алкалоидная одиссея» началась в 1928 г., когда в СССР возвратился А. П. Орехов, до этого более пятнадцати лет проработавший в лабораториях Швейцарии и Франции. Огромная эрудиция, научные заслуги этого выдающегося химика позволили ему быстро создать мощную научную школу, главным направлением которой стало изучение алкалоидоносных растений страны.
Огромная эрудиция, научные заслуги этого выдающегося химика позволили ему быстро создать мощную научную школу, главным направлением которой стало изучение алкалоидоносных растений страны.
Нужно заметить, что к этому времени флора нашей страны, в особенности ее азиатской части, была для исследователей настоящей «terra incognita». Самые интересные находки ожидали Орехова и его сотрудников в Средней Азии, флора которой оказалась исключительно богатой на растения, продуцирующие алкалоиды. Научная школа Орехова была четко ориентирована на практику: разработки, относившиеся к разряду фундаментальных исследований, в течение считанных лет становились промышленными технологиями. Главной базой отечественного производства алкалоидов стал Химико-фармацевтический завод в г. Чимкенте (Казахстан).
Талантливейшим учеником Орехова был С. Ю. Юнусов. Мальчик-узбек, выходец из бедной семьи, одетый в халат и в знаменитые азиатские калоши, поехал учиться в Москву. Юный Сабир оказался крепким орешком: преодолев все препоны, которые ставили ему чиновники от образования, он пробился на прием к самому всесоюзному старосте М.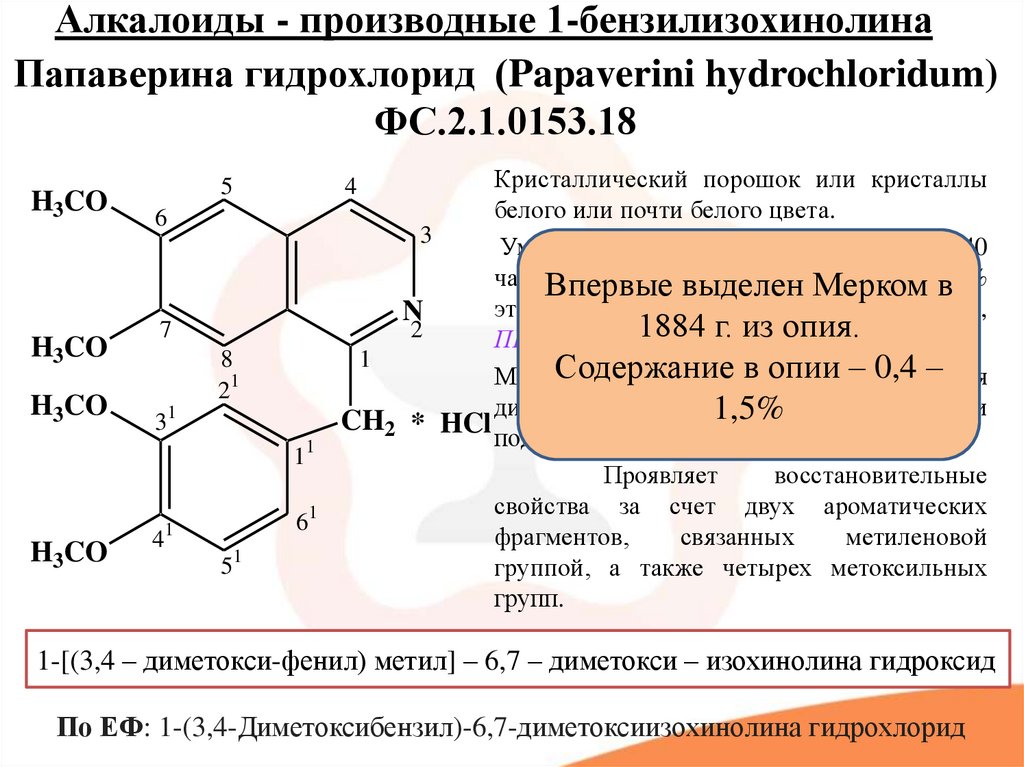 И. Калинину.
И. Калинину.
Юнусов добился своего. Позже, следуя заветам учителя, он создал в Узбекистане одну из самых крупных и авторитетных научных школ мирового уровня. За годы, что он возглавлял организованный им Институт химии растительных веществ Академии наук Узбекистана, там было исследовано более тысячи алкалоидов. Экспедиции института работали во всех районах Средней Азии и Казахстана, а по мере роста авторитета школы в институт стали поступать образцы растений-алкалоидоносов из Сибири, Монголии и с Дальнего Востока. В опытном цехе института не только проводились наработки крупных партий алкалоидов, необходимых для фармакологических исследований и клинических испытаний, но и разрабатывались производственные регламенты, предназначенные для передачи в промышленность. Можно смело утверждать, что с таким размахом в 1960—80-е гг. не работал ни один исследовательский центр в мире.
Среди ярких учеников Юнусова нужно отметить его сына, М. С. Юнусова, ныне академика РАН, занимающегося исследованиями так называемых дитерпеновых алкалоидов — веществ, которые продуцируются дельфиниумами и аконитами, относящимися к семейству лютиковых. Эти красивые растения распространены практически по всей территории бывшего СССР, особенно в горных районах Средней Азии, Казахстана, Алтая, Западной Сибири, в Забайкалье и на Дальнем Востоке. Звездообразные фосфоресцирующие цветы дельфиниумов имеют такой глубокий голубой цвет, что, встречая их в горах, невольно думаешь о них как об одном из источников вдохновения знаменитого художника Рериха-старшего.
Эти красивые растения распространены практически по всей территории бывшего СССР, особенно в горных районах Средней Азии, Казахстана, Алтая, Западной Сибири, в Забайкалье и на Дальнем Востоке. Звездообразные фосфоресцирующие цветы дельфиниумов имеют такой глубокий голубой цвет, что, встречая их в горах, невольно думаешь о них как об одном из источников вдохновения знаменитого художника Рериха-старшего.
О лечебных свойствах дельфиниумов и аконитов издавна знали в Китае и Тибете. Но среди аконитов встречаются и далеко не безобидные виды: так, неосторожное обращение с корнями или надземной частью растений, синтезирующих алкалоид аконитин, может привести к отравлению и к смерти.
Однако дурная слава этих растений не только не оттолкнула, но, напротив, вызвала повышенный интерес исследователей, в том числе Юнусова-младшего, занявшегося разработкой на основе дитерпеновых алкалоидов кардиоактивных препаратов. В частности, было установлено, что самый доступный алкалоид лаппаконитин, содержащийся в ряде аконитов, обладает свойствами мощного антиаритмика. В результате в контакте с клиницистами школы академика Е. И. Чазова в медицинскую практику был внедрен препарат аллапинин, применяемый для лечения различных форм аритмии сердца.
В результате в контакте с клиницистами школы академика Е. И. Чазова в медицинскую практику был внедрен препарат аллапинин, применяемый для лечения различных форм аритмии сердца.
Никаких проблем с растительным сырьем для производства этого препарата при надлежащей постановке заготовок в России нет. Так, исследованиями ботаников Уфимского научного центра РАН было показано, что только на территории Башкирии возможна экологически обоснованная заготовка корня аконита северного для получения ежегодно не менее 5 т алкалоида. Этого количества достаточно не только для обеспечения потребности здравоохранения России, но и для поставки на экспорт.
В химическом цехе Новосибирского института органической химии СО РАН было организовано первое в России опытное производство лаппаконитина из алтайских аконитов. В настоящее время исследователи НИОХ и Института органической химии Уфимского НЦ РАН разрабатывают на основе этого алкалоида антиаритмический препарат нового поколения.
Яд оказался лучшим наркозом
С исследованием алкалоидов связаны и многие другие памятные страницы истории химии минувшего века, причем немало из них заполнено благодаря деятельности советских ученых.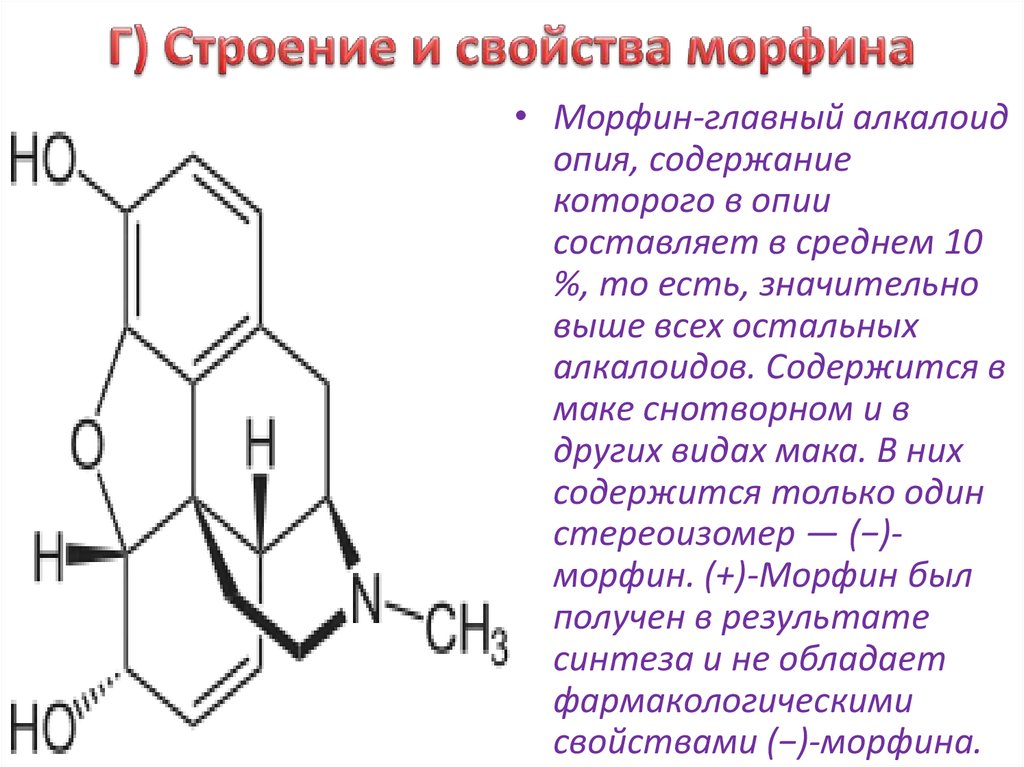 В качестве примера стоит привести работы с кураре — ядом, который испанские завоеватели Южной Америки узнали в XVI в. Стрелы с ядовитыми наконечниками были оружием местного населения, причем поражение ими вызывало обездвижение или даже смерть. Способ получения яда индейцы тщательно скрывали, но сейчас известно, что кураре является сложной смесью веществ, получаемых экстракцией нескольких ядовитых растений. При этом физиологическая активность разных видов кураре значительно колеблется в зависимости от района производства.
В качестве примера стоит привести работы с кураре — ядом, который испанские завоеватели Южной Америки узнали в XVI в. Стрелы с ядовитыми наконечниками были оружием местного населения, причем поражение ими вызывало обездвижение или даже смерть. Способ получения яда индейцы тщательно скрывали, но сейчас известно, что кураре является сложной смесью веществ, получаемых экстракцией нескольких ядовитых растений. При этом физиологическая активность разных видов кураре значительно колеблется в зависимости от района производства.
При распознании природы уникальной токсичности кураре ученые натолкнулись на большие трудности. Выделить в чистом виде главное действующее вещество кураре — тубокурарин — удалось только в 1935 г. английскому химику Г. Кингу. Длительное время оно использовалось дополнительно к наркозу для более совершенного мышечного расслабления при полостных операциях.
Тщательное исследование физиологической активности тубокурарина привело к появлению в медицине такого понятия, как курареподобные препараты. Комбинация наркотизирующих средств с такими препаратами была признана одним из лучших способов хирургического наркоза. Но это означало зависимость от ненадежного рынка природного кураре. В результате сформировалось два подхода к решению проблемы: первый заключался в синтезе нужных алкалоидов, второй — в поиске структурных аналогов, обладающих необходимой активностью.
Комбинация наркотизирующих средств с такими препаратами была признана одним из лучших способов хирургического наркоза. Но это означало зависимость от ненадежного рынка природного кураре. В результате сформировалось два подхода к решению проблемы: первый заключался в синтезе нужных алкалоидов, второй — в поиске структурных аналогов, обладающих необходимой активностью.
Синтез алкалоидов кураре увенчался успехом в результате блестящих работ школы профессора Н. А. Преображенского и его ученицы, члена-корреспондента РАН, Р. П. Евстигнеевой. Активное участие в мировой гонке по синтезу соединений с курареподобным действием принял коллектив химиков, который возглавляли академик РАН Н. К. Кочетков и профессор А. П. Сколдинов. Результатом работ наших ученых стало промышленное производство оригинальных отечественных препаратов, для чего не потребовались многие годы и миллионы долларов — лишь государственный, по-настоящему «петровский», подход к делу.
Фитофармакология и государство
Проблемами, прямо или косвенно связанными с разработкой лекарственных препаратов на основе растительных метаболитов, занимались и продолжают заниматься многие ведущие химики-органики, фармакологи и клиницисты мира. В их числе целый ряд нобелевских лауреатов в области химии: Э. Фишер, Р. Кун, Л. Ружичка, Р. Робинсон. Впечатляюще выглядит и российский «пантеон», который украшают такие имена, как А. М. Бутлеров, Е. Е. Вагнер, отец и сын Арбузовы, Н. А. Преображенский и многие другие. В течение второй половины минувшего века неуклонно возрастало влияние на мировой научный процесс и исследователей из стран Азии и Южной Америки — регионов, богатых дикорастущей флорой и обширными плантациями культивируемых растений.
В их числе целый ряд нобелевских лауреатов в области химии: Э. Фишер, Р. Кун, Л. Ружичка, Р. Робинсон. Впечатляюще выглядит и российский «пантеон», который украшают такие имена, как А. М. Бутлеров, Е. Е. Вагнер, отец и сын Арбузовы, Н. А. Преображенский и многие другие. В течение второй половины минувшего века неуклонно возрастало влияние на мировой научный процесс и исследователей из стран Азии и Южной Америки — регионов, богатых дикорастущей флорой и обширными плантациями культивируемых растений.
Излишне говорить о том, что путь к созданию клинически значимых препаратов с многомиллиардными продажами весьма долог, сложен и недешев. Вот почему препараты, отмеченные особым клиническим и коммерческим успехом, заслуженно становятся предметом гордости разработчиков.
В целом фитохимические исследования находятся «под крылом» крупнейших фармацевтических фирм мира. А в Китае к ним «прикладывает руку» государство, которое выдвигает весьма действенные программы общенационального значения, не пренебрегая при этом взаимовыгодными контактами с отечественным капиталом и с крупнейшими мировыми концернами. Мощное государственное финансирование имеют и национальные программы, созданные в США. Так, уже несколько десятилетий там действует Национальный институт рака (NCI). Исследователи из любой страны могут прислать в NCI для изучения как индивидуальные соединения, так и смеси веществ и экстракты растений, которые в первую очередь проверяются на цитостатическое и противовирусное действие.
Мощное государственное финансирование имеют и национальные программы, созданные в США. Так, уже несколько десятилетий там действует Национальный институт рака (NCI). Исследователи из любой страны могут прислать в NCI для изучения как индивидуальные соединения, так и смеси веществ и экстракты растений, которые в первую очередь проверяются на цитостатическое и противовирусное действие.
В основу фитофармации в бывшем Советском Союзе был положен введенный еще Петром I государственный подход к созданию лекарств. Наиболее последовательные исследования в области фитохимии и фитофармакологии проводились в институтах Дальневосточного и Сибирского отделений Академии наук, Академий наук Узбекистана, Казахстана, Грузии и Молдавии; огромная роль в развитии фитохимической науки и промышленности принадлежала отраслевым институтам. Важнейшим достижением фитохимической науки советского времени стало обращение к флоре не изученных огромных регионов Сибири, Дальнего Востока, Казахстана и Средней Азии.
Исследователи руководствовались той идеей, что растительный мир страны, включающий дикорастущие, а также культурно возделываемые растения, является национальным достоянием, которым нужно пользоваться, не вредя ему, но умножая его. За короткое время в стране удалось создать четко работающую систему разведки, оценки запасов и заготовки дикорастущих растений, организовать специализированные хозяйства по выращиванию ценных растений, построить фитофармацевтические предприятия.
К великому сожалению, известные события последнего времени привели налаженное дело в состояние коллапса. Запасы многих перспективных для фитохимической промышленности растений-дикоросов остались на территории стран СНГ; Россия лишилась практически всех предприятий фитохимической промышленности.
Конечно, можно подумать, что на фоне таких дел геополитического значения, как распределение энергоресурсов, рудного сырья и лесоматериалов, освоение растительных ресурсов для целей медицины является третьестепенным. К тому же, развитие химической науки и технологий привело к созданию огромного числа синтетических лекарственных препаратов на основе продуктов нефтехимии. В настоящее время в мире клиническую апробацию проходят около 200 препаратов на основе природных соединений и их полусинтетических производных, разработанных в лабораториях 50 фармацевтических фирм. Из этих препаратов растительное происхождение имеют 48.
К тому же, развитие химической науки и технологий привело к созданию огромного числа синтетических лекарственных препаратов на основе продуктов нефтехимии. В настоящее время в мире клиническую апробацию проходят около 200 препаратов на основе природных соединений и их полусинтетических производных, разработанных в лабораториях 50 фармацевтических фирм. Из этих препаратов растительное происхождение имеют 48.
Так может быть, интерес к растительным веществам должен уйти в прошлое и России вообще не стоит печалиться об утраченном? Однако самый беглый обзор состояния дел в этой области в мире не оставляет сомнений в том, что фитохимическое направление в медицинской химии и индустрии лекарственных средств не только не ослабевает, но постоянно крепнет.
Фотографии экспонатов гербария В. Короткоручко
Редакция благодарит за предоставленные иллюстративные материалы Гербарий Сибирского института физиологии и биохимии растений СО РАН (Иркутск)
: 17 Ноя 2007 , В поисках энергии большого взрыва , том 17,
№5
UPLC-MS/MS Профиль алкалоидов с цитотоксическими свойствами некоторых лекарственных растений семейств Berberidaceae и Papaveraceae
На этой странице
РезюмеВведениеЭкспериментальные результаты и обсуждениеВыводыСокращенияКонфликты интересовСсылкиАвторское правоСтатьи по теме
Рак является одной из наиболее развитых и распространенных болезней в развивающихся странах . Соединения на растительной основе все еще исследуются на предмет их противораковой активности и количества в растениях. Поэтому для их количественного определения в растениях применяются современные хроматографические методы, например, УЭЖХ-МС/МС (сверхэффективная жидкостная хроматография в сочетании с масс-спектрометрией). Поэтому целью настоящего исследования было оценить содержание сангвинарина, берберина, протопина и хелидонина в Dicentra Spectabilis (L.) Lem., Fumaria officinalis L., Glaucium flavum Crantz, Corydalis Cava L., Berberis Thunbergii Dc., Meconopsis Cambrica (L.) VILIII DC., Meconopsis Cambrica (L.) VIL. Mahonia aquifolium (Pursh) Nutt., Macleaya cordata Willd. и Chelidonium majus L. Впервые N,N-диметил-герновин идентифицирован у M. cambrica , B. thunbergii , М. остролистный , C. cava , G. flavum и C. majus ; метил-герновин был идентифицирован в G.
Соединения на растительной основе все еще исследуются на предмет их противораковой активности и количества в растениях. Поэтому для их количественного определения в растениях применяются современные хроматографические методы, например, УЭЖХ-МС/МС (сверхэффективная жидкостная хроматография в сочетании с масс-спектрометрией). Поэтому целью настоящего исследования было оценить содержание сангвинарина, берберина, протопина и хелидонина в Dicentra Spectabilis (L.) Lem., Fumaria officinalis L., Glaucium flavum Crantz, Corydalis Cava L., Berberis Thunbergii Dc., Meconopsis Cambrica (L.) VILIII DC., Meconopsis Cambrica (L.) VIL. Mahonia aquifolium (Pursh) Nutt., Macleaya cordata Willd. и Chelidonium majus L. Впервые N,N-диметил-герновин идентифицирован у M. cambrica , B. thunbergii , М. остролистный , C. cava , G. flavum и C. majus ; метил-герновин был идентифицирован в G.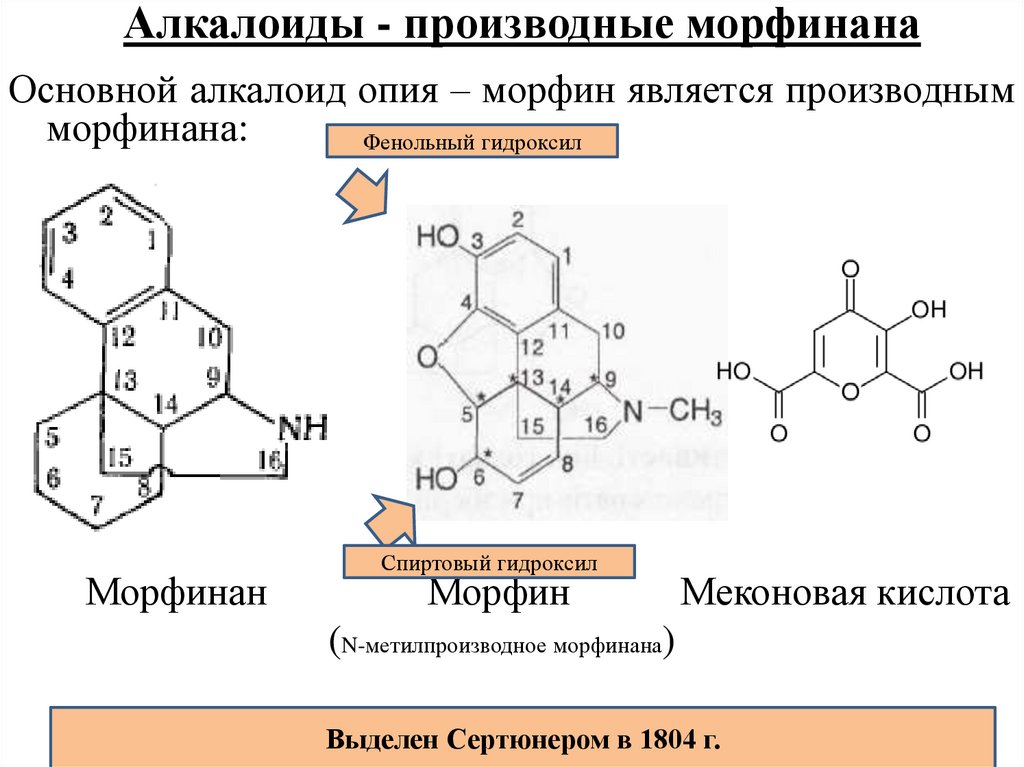 flavum ; колумбамин был идентифицирован в B. thunbergii ; а метилкорипальмин, хелидонин и сангвинарин – у F. officinalis L. Самым богатым источником протопина среди всех исследованных видов был M. cordata (5463,64 ± 26,3 мк г/г). Наибольшее количество хелидонина и сангвинарина обнаружено в C. Majus (51,040,0 ± 1,8 μ г/г и 7925,8 ± 3,3 μ г/г, соответственно), в то время как B. Тунберги содержал самое высокое количество берберина (6358,4 ± 4,2 μ g. /г).
flavum ; колумбамин был идентифицирован в B. thunbergii ; а метилкорипальмин, хелидонин и сангвинарин – у F. officinalis L. Самым богатым источником протопина среди всех исследованных видов был M. cordata (5463,64 ± 26,3 мк г/г). Наибольшее количество хелидонина и сангвинарина обнаружено в C. Majus (51,040,0 ± 1,8 μ г/г и 7925,8 ± 3,3 μ г/г, соответственно), в то время как B. Тунберги содержал самое высокое количество берберина (6358,4 ± 4,2 μ g. /г).
1. Введение
Различные этнические сообщества мира веками использовали лекарственные препараты растительного происхождения для лечения различных заболеваний. Природные источники лекарств, такие как паклитаксел ( Taxus brevifolia ) и алкалоиды Vinca , являются примерами ценности традиционно используемых растений для разработки современных лекарств. Молекулы растительного происхождения очень часто используются в качестве предшественников лекарств, превращаясь в лекарства путем химической модификации, например, 10-деацетибаккатин. Установлено, что в западной медицине используется около 120 соединений растительного происхождения, а около 80% населения земного шара используют лекарственные растения в первичной медико-санитарной помощи. Несмотря на то, что был достигнут значительный прогресс в открытии эффективных противоопухолевых препаратов, многие западные сообщества по-прежнему используют лекарства на растительной основе, включая растения традиционной китайской медицины. Препараты растительного происхождения применяются в развитых и развивающихся странах отдельно или совместно с синтетическими препаратами [1].
Установлено, что в западной медицине используется около 120 соединений растительного происхождения, а около 80% населения земного шара используют лекарственные растения в первичной медико-санитарной помощи. Несмотря на то, что был достигнут значительный прогресс в открытии эффективных противоопухолевых препаратов, многие западные сообщества по-прежнему используют лекарства на растительной основе, включая растения традиционной китайской медицины. Препараты растительного происхождения применяются в развитых и развивающихся странах отдельно или совместно с синтетическими препаратами [1].
Алкалоиды представляют собой встречающиеся в природе химические соединения с самой сильной фармакологической активностью среди веществ, синтезируемых растениями. Они ответственны за токсические свойства многих видов растений. Высокая биологическая активность этих соединений сделала их предметом изучения для использования в фармации, в частности, в качестве противоопухолевых препаратов. Сангвинарин, берберин и протопин являются четвертичными изохинолиновыми алкалоидами, тогда как хелидонин является третичным алкалоидом. Эти соединения широко исследуются на предмет их противоопухолевой активности. По данным литературы, сангвинарин индуцирует апоптоз многих линий опухолевых клеток [2, 3]. Берберин также обладает противоопухолевой активностью в отношении ряда клеточных линий [4, 5]. Хелидонин — основной алкалоид чистотела ( Chelidonium majus L.). Повышенный интерес к хелидонину наблюдался в начале 21 века, когда ученые стали обращать внимание на его многообещающую противораковую активность, например, в отношении клеток увеальной меланомы [6], рака печени [7], клеток лейкемии [8] или меланомы. клетки [6]. Протопин – алкалоид с высокой фармакологической активностью. Он ингибирует агрегацию тромбоцитов и действует антигистаминно и антибактериально [9]. Что касается его противоопухолевой активности, то большое значение имеет тот факт, что соединение значительно увеличивает уровни мРНК CYP1A1 в клетках печени человека и клетках гепатомы HepG2 [10]. В клетках рака предстательной железы соединение ингибирует митоз и индуцирует апоптоз [11].
Эти соединения широко исследуются на предмет их противоопухолевой активности. По данным литературы, сангвинарин индуцирует апоптоз многих линий опухолевых клеток [2, 3]. Берберин также обладает противоопухолевой активностью в отношении ряда клеточных линий [4, 5]. Хелидонин — основной алкалоид чистотела ( Chelidonium majus L.). Повышенный интерес к хелидонину наблюдался в начале 21 века, когда ученые стали обращать внимание на его многообещающую противораковую активность, например, в отношении клеток увеальной меланомы [6], рака печени [7], клеток лейкемии [8] или меланомы. клетки [6]. Протопин – алкалоид с высокой фармакологической активностью. Он ингибирует агрегацию тромбоцитов и действует антигистаминно и антибактериально [9]. Что касается его противоопухолевой активности, то большое значение имеет тот факт, что соединение значительно увеличивает уровни мРНК CYP1A1 в клетках печени человека и клетках гепатомы HepG2 [10]. В клетках рака предстательной железы соединение ингибирует митоз и индуцирует апоптоз [11]. Эти алкалоиды присутствуют в основном в растениях 9 видов.0007 Papaveraceae , Rannunculaceae и Berberidaceae семейств.
Эти алкалоиды присутствуют в основном в растениях 9 видов.0007 Papaveraceae , Rannunculaceae и Berberidaceae семейств.
Существуют различные способы противоопухолевого действия алкалоидов, включая индукцию и активацию апоптотических сигнальных белков и стимулирование апоптоза посредством индукции повреждения ДНК, активаторов каспаз и ингибиторов клеточного роста. Помимо этих способов действия существуют и другие, основанные на образовании G-квадруплексов. Этот способ действия можно рассматривать как новый подход к лечению рака [12, 13].
C. Majus , M. Cordata , D. Spectabilis , F. officinalis , G. flavum , C. Cava , B. Thunbergii , M. Cambrica , и M. aquifolium являются источниками алкалоидов. Наиболее известны среди изученных видов C. majus и M. cordata , отличающиеся наибольшим содержанием хелидонина. До сих пор только эти два вида были проанализированы методом УЭЖХ [14]. B. thunbergii — это вид, который в настоящее время вызывает большой интерес в исследованиях, особенно в Китае. Это растение традиционной китайской и тибетской медицины, где оно очень эффективно при лечении многих воспалительных заболеваний в этом регионе. Другие виды также используются в народной медицине в Северной Америке и Европе и в аюрведической медицине из-за их очень богатого химического состава [15–17]. До настоящего времени обсуждаемые виды растений анализировали такими методами, как неводный капиллярный электрофорез-масс-спектрометрия с ионной ловушкой с электрораспылением [18], хроматография на колонке с силикагелем, ТСХ [19].] и ВЭЖХ [18]. Для видов F. officinalis и G. flavum в основном разработаны методы выделения индивидуального вещества [14, 20]. M. aquifolium изучали в основном с точки зрения его антимикробной активности за счет присутствия (4- O- метил- α -D-глюкуроно)-D-ксилана, обладающего мощной иммуномодулирующей активностью [21].
B. thunbergii — это вид, который в настоящее время вызывает большой интерес в исследованиях, особенно в Китае. Это растение традиционной китайской и тибетской медицины, где оно очень эффективно при лечении многих воспалительных заболеваний в этом регионе. Другие виды также используются в народной медицине в Северной Америке и Европе и в аюрведической медицине из-за их очень богатого химического состава [15–17]. До настоящего времени обсуждаемые виды растений анализировали такими методами, как неводный капиллярный электрофорез-масс-спектрометрия с ионной ловушкой с электрораспылением [18], хроматография на колонке с силикагелем, ТСХ [19].] и ВЭЖХ [18]. Для видов F. officinalis и G. flavum в основном разработаны методы выделения индивидуального вещества [14, 20]. M. aquifolium изучали в основном с точки зрения его антимикробной активности за счет присутствия (4- O- метил- α -D-глюкуроно)-D-ксилана, обладающего мощной иммуномодулирующей активностью [21].
В этой статье мы сообщаем о разделении и определении четырех изохинолиновых алкалоидов в девяти видах растений, чтобы подтвердить опубликованные данные, полученные с использованием других аналитических методов. Семь из исследованных видов никогда не анализировались с помощью УЭЖХ. Исследование проводилось также с целью выявления новых алкалоидов в исследованных видах растений. Метод UPLC был выбран, поскольку он является точным, точным, воспроизводимым и позволяет идентифицировать соединения на основе их спектров ESI-MS/MS.
2. Экспериментальный
2.1. Materials and Chemicals
Berberis thunbergii , Chelidonium majus , Corydalis cava , Dicentra spectabilis , Fumaria officinalis , Glaucium flavum , Macleaya cordata , Mahonia aquifolium , and Meconopsis cambrica были собраны в июне 2012 г. в Ботаническом саду Университета Марии-Кюри Склодовской в Люблине, Польша. Эти образцы были заверены профессором Анной Богуцкой-Коцкой (образцы ваучеров: DS-0612, FO-0612, GF-0612, CC-0612, BT-.0612, MeCa-0612, MA-0612, CM-0612 и MaCo- 0612). Соединения сравнения протопин (P), берберин (B), хелидонин (CH) и сангвинарин (S) были аналитической чистоты от Sigma-Aldrich Company (Сент-Луис, США). Чистота каждого соединения была более 98%, по данным производителя. Ацетонитрил, ацетат аммония, метанол с градиентом качества для ВЭЖХ и уксусную кислоту (>98%) для разделения ЖХ-УФ-МС были приобретены у J.T. Бейкер (Филлипсбург, Нью-Джерси). Вода очищалась собственными силами на установке Simplicity-185 с системой очистки воды Milli-Q (Millipore Co.).
Эти образцы были заверены профессором Анной Богуцкой-Коцкой (образцы ваучеров: DS-0612, FO-0612, GF-0612, CC-0612, BT-.0612, MeCa-0612, MA-0612, CM-0612 и MaCo- 0612). Соединения сравнения протопин (P), берберин (B), хелидонин (CH) и сангвинарин (S) были аналитической чистоты от Sigma-Aldrich Company (Сент-Луис, США). Чистота каждого соединения была более 98%, по данным производителя. Ацетонитрил, ацетат аммония, метанол с градиентом качества для ВЭЖХ и уксусную кислоту (>98%) для разделения ЖХ-УФ-МС были приобретены у J.T. Бейкер (Филлипсбург, Нью-Джерси). Вода очищалась собственными силами на установке Simplicity-185 с системой очистки воды Milli-Q (Millipore Co.).
2.2. Подготовка проб
Смешанные стандартные исходные растворы, содержащие протопин (P) (0,960 мг/мл), берберин (B) (1,105 мг/мл), хелидонин (CH) (1,225 мг/мл) и сангвинарин (S) (1,065 мг /мл) в метаноле готовили и разбавляли метанолом до шести различных концентраций в пределах (P) 4,4–131,5 мк г/мл; (Б) 6,1–183,8 мк г/мл; (СН) 5,5–165,8 мк г/мл; и (S) 5,3–159,8 мк г/мл для построения калибровочных кривых.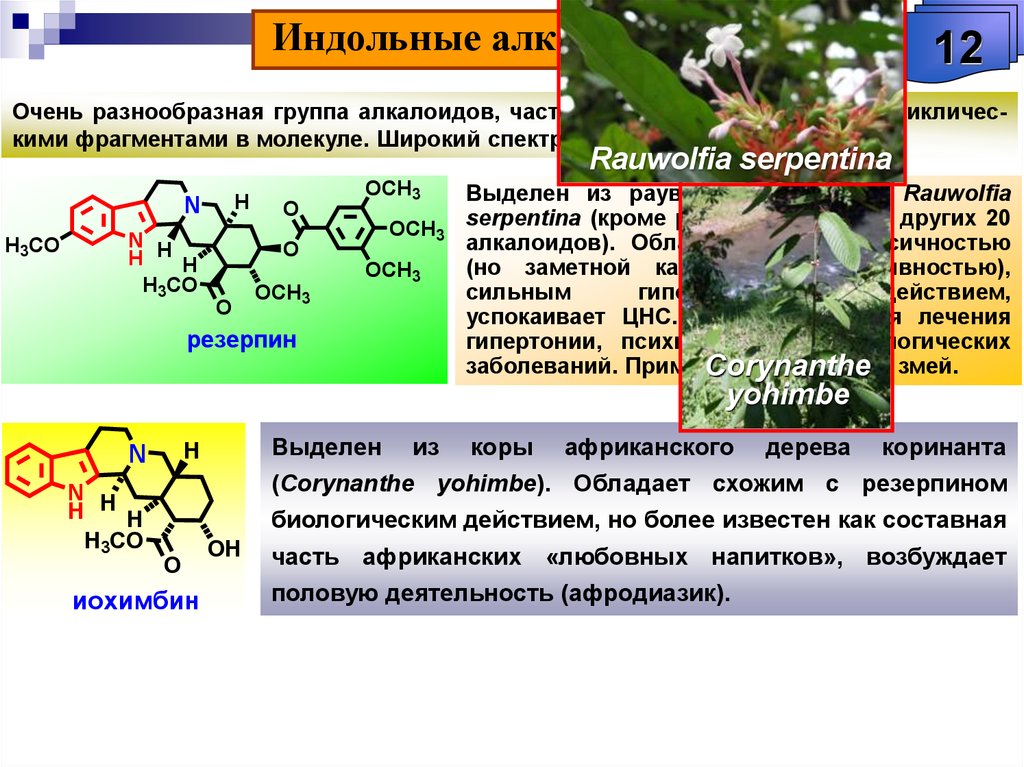 Стандартные растворы перед инъекцией фильтровали через мембрану 0,22 мм. Все растворы перед анализом хранили в холодильнике при 4°С.
Стандартные растворы перед инъекцией фильтровали через мембрану 0,22 мм. Все растворы перед анализом хранили в холодильнике при 4°С.
Экстракты готовили по методике, описанной ранее [22]. Пять граммов высушенного и измельченного растительного сырья мацерировали 80 мл метанола в течение 3-4 дней. Затем метанол сливали и добавляли новую порцию. Этот процесс повторялся девять раз. После последней экстракции не осталось остатка после выпаривания растворителя. Полученные порции экстрактов объединяли. Растворитель частично упаривали на вакуум-выпарном аппарате UnipanPro Typ 365 до общего объема 100 мл.
2.3. Сверхэффективная жидкостная хроматография-тандемная масс-спектрометрия (UPLC-MS/MS)
Хроматографические условия основаны на Lu et al. [12] с некоторыми изменениями. Анализ UPLC проводили с использованием системы Waters ACQUITY UPLC (Waters Corp., Милфорд, Массачусетс, США), оснащенной бинарной насосной системой, системой управления образцами, системой управления колонками и детектором PDA (Waters Corp.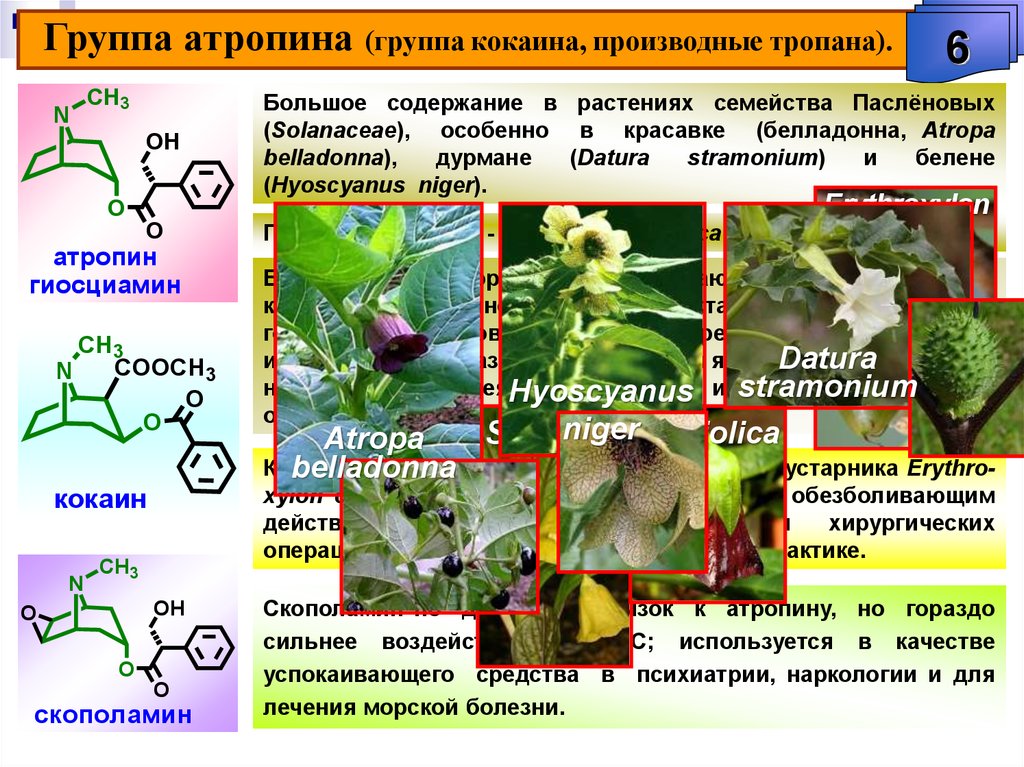 ). Программное обеспечение Waters MassLynx v.4.1 использовалось для сбора и обработки данных. Разделение алкалоидов в анализируемых экстрактах проводили на колонке BEH C18 (100 мм × 2,1 мм × 1,7 μ м), Waters Corp., Милфорд, Массачусетс, США. Температуру колонки поддерживали на уровне 35°С. Скорость потока доводили до 0,40 мл/мин. Элюцию проводили с использованием подвижной фазы А (ацетат аммония, 20 мМ, доведенный до pH 3,0 уксусной кислотой в воде Milli-Q) и подвижной фазы B (ацетонитрил) с использованием следующей программы градиента: 0–0,8 мин, 3% B; 0,8–1,0 мин, 3–12% В; 1,0–9,5 мин, 12% В; 9,5–15,0 мин, 12–20% В; 15,0–20,0 мин, 20–30% В; 20,0–21,0 мин, 30% В; 21,0–21,1 мин, 30–80% В; 21,1–22,1 мин, 80% В; 22,1–22,2, 80–3% В; и 22,2–25,0 мин, 3% B. Образцы хранились при 15°C в менеджере образцов. Объем закачки образца составлял 1,0 мк л (частичный цикл с режимом переполнения иглы). Использовали сильный раствор для промывки игл (95 : 5, метанол-вода, против / против ) и слабый раствор для промывания игл (5 : 95, ацетонитрил-вода, против / против ).
). Программное обеспечение Waters MassLynx v.4.1 использовалось для сбора и обработки данных. Разделение алкалоидов в анализируемых экстрактах проводили на колонке BEH C18 (100 мм × 2,1 мм × 1,7 μ м), Waters Corp., Милфорд, Массачусетс, США. Температуру колонки поддерживали на уровне 35°С. Скорость потока доводили до 0,40 мл/мин. Элюцию проводили с использованием подвижной фазы А (ацетат аммония, 20 мМ, доведенный до pH 3,0 уксусной кислотой в воде Milli-Q) и подвижной фазы B (ацетонитрил) с использованием следующей программы градиента: 0–0,8 мин, 3% B; 0,8–1,0 мин, 3–12% В; 1,0–9,5 мин, 12% В; 9,5–15,0 мин, 12–20% В; 15,0–20,0 мин, 20–30% В; 20,0–21,0 мин, 30% В; 21,0–21,1 мин, 30–80% В; 21,1–22,1 мин, 80% В; 22,1–22,2, 80–3% В; и 22,2–25,0 мин, 3% B. Образцы хранились при 15°C в менеджере образцов. Объем закачки образца составлял 1,0 мк л (частичный цикл с режимом переполнения иглы). Использовали сильный раствор для промывки игл (95 : 5, метанол-вода, против / против ) и слабый раствор для промывания игл (5 : 95, ацетонитрил-вода, против / против ). Хроматограммы были получены при 240 нм и 270 нм по 5 точкам с разрешением 4,8 нм. Пики были назначены на основе их времени удерживания, отношения массы к заряду ( m/z ) и картины фрагментации ESI-MS/MS по сравнению с эталонными соединениями и литературными данными [23]. Анализы МС проводили на масс-спектрометре TQD (Waters Corp.), оборудованном интерфейсом электрораспыления Z-spray. Параметры источника ЭРИ: капиллярное напряжение 3,0 кВ, конусное напряжение 30 В, газ десольватации N 2 800 л/ч, конусный газ N 2 80 л/ч, темп. 120°С, температура десольватации. 350°С, время выдержки 0,6 с. Анализ проводили в режиме полного сканирования (сканировался диапазон масс 250–450 а.е.м.). Соединения анализировали в режиме положительных ионов. Содержание идентифицированных соединений оценивали по площади пика при 270 нм [+/− очень низкое содержание (менее 5% от общей площади пика при 270 нм), + низкое содержание (менее 15% от общей площади пика при 270 нм). нм), ++ умеренное содержание (15–30% от общей площади пика при 270 нм) и +++ высокое содержание (более 30% от общей площади пика при 270 нм)].
Хроматограммы были получены при 240 нм и 270 нм по 5 точкам с разрешением 4,8 нм. Пики были назначены на основе их времени удерживания, отношения массы к заряду ( m/z ) и картины фрагментации ESI-MS/MS по сравнению с эталонными соединениями и литературными данными [23]. Анализы МС проводили на масс-спектрометре TQD (Waters Corp.), оборудованном интерфейсом электрораспыления Z-spray. Параметры источника ЭРИ: капиллярное напряжение 3,0 кВ, конусное напряжение 30 В, газ десольватации N 2 800 л/ч, конусный газ N 2 80 л/ч, темп. 120°С, температура десольватации. 350°С, время выдержки 0,6 с. Анализ проводили в режиме полного сканирования (сканировался диапазон масс 250–450 а.е.м.). Соединения анализировали в режиме положительных ионов. Содержание идентифицированных соединений оценивали по площади пика при 270 нм [+/− очень низкое содержание (менее 5% от общей площади пика при 270 нм), + низкое содержание (менее 15% от общей площади пика при 270 нм). нм), ++ умеренное содержание (15–30% от общей площади пика при 270 нм) и +++ высокое содержание (более 30% от общей площади пика при 270 нм)].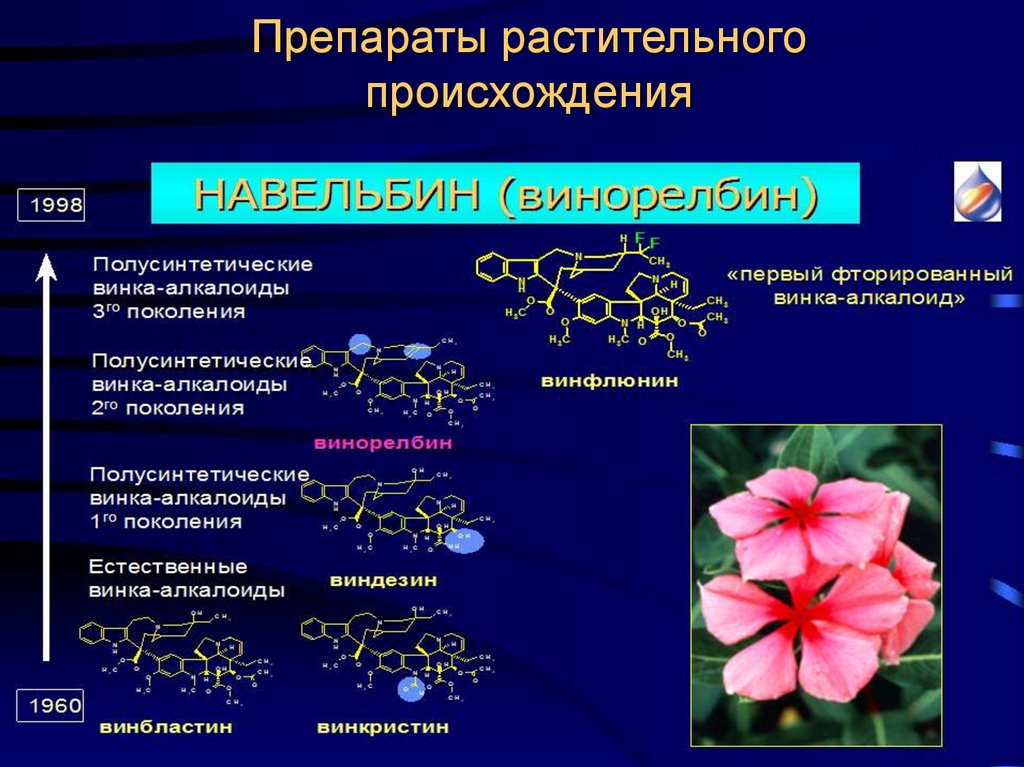 Протопин, берберин, хелидонин и сангвинарин определяли количественно на основе их площадей пиков и сравнения с калибровочной кривой, полученной с соответствующими стандартами.
Протопин, берберин, хелидонин и сангвинарин определяли количественно на основе их площадей пиков и сравнения с калибровочной кривой, полученной с соответствующими стандартами.
Методы были проверены с точки зрения точности, прецизионности LOD и LOQ. Кроме того, были определены линейные диапазоны калибровочных кривых. Исходный раствор четырех стандартов был приготовлен и разбавлен до шести соответствующих концентраций для построения калибровочных кривых. Уравнения регрессии были получены после линейной регрессии площадей пиков в зависимости от соответствующих концентраций. Предел обнаружения (LOD) и предел количественного определения (LOQ) для каждого аналита определяли в хроматографических условиях при отношении сигнал/шум (S/N), равном 3 и 10 соответственно. Внутридневные и междневные вариации были выбраны для определения точности разработанного анализа. Были приготовлены растворы трех различных концентраций (низкая, средняя и высокая) стандартов. Внутридневную изменчивость определяли, анализируя семь повторов в день. Междневная вариация исследовалась в течение семи дней. Повторяемость была подтверждена шестью растворами, приготовленными из образца 1, и один из них был введен в аппарат через 0, 3, 6, 12, 16, 18 и 24 часа для оценки стабильности раствора. Вариации выражали в RSD.
Междневная вариация исследовалась в течение семи дней. Повторяемость была подтверждена шестью растворами, приготовленными из образца 1, и один из них был введен в аппарат через 0, 3, 6, 12, 16, 18 и 24 часа для оценки стабильности раствора. Вариации выражали в RSD.
3. Результаты и обсуждение
В нашем эксперименте установленный аналитический метод был применен для определения алкалоидов в девяти видах, принадлежащих к семействам Berberidaceae и Papaveraceae . Анализ образцов выявил наличие девятнадцати алкалоидов. Для окончательной идентификации B, CH, P и S были проведены сравнения времени удерживания с доступными химическими стандартами. Идентификация алкалоидов, отличных от B, CH, P и S, была основана на обнаруженных максимумах и форме спектров. Результаты представлены в таблице 1. Примеры хроматограмм УЭЖХ 9Экстракт 0007 B. thunbergii показан на рисунке 1.
Наименее дифференцированными таксонами являются M. cambrica и D. spectabilis , содержащие два идентифицированных алкалоида. Самыми богатыми являются C. majus — восемь идентифицированных алкалоидов и C. cava — семь идентифицированных алкалоидов.
Самыми богатыми являются C. majus — восемь идентифицированных алкалоидов и C. cava — семь идентифицированных алкалоидов.
Наименьший уровень протопина выявлен у M. cambrica (74,4 ± 0,4 мк г/г), а самый высокий — у M. cordata (54 636,4 ± 2,6 мк г/г). У M. aquifolium и B. thunbergii протопин не обнаружен. Берберин был обнаружен в четырех исследованных видах растений — C. majus , M. cordata , B. thunbergii и M. aquifolium . Самый низкий уровень берберина был обнаружен в M. cordata (1401,4 ± 2,4 μ г/г), а самый высокий — в B. thunbergii (6358,4 ±4,2 μ г/г).
Наименьшее содержание сангвинарина обнаружено в C. cava (69,0 ± 0,1 мк г/г), а максимальное содержание сангвинарина – в C. majus (7925,8 ± 3,3 г/г
мкг/г). ). У
B. thunbergii , M. cambrica и M. aquifolium сангвинарин не обнаружен.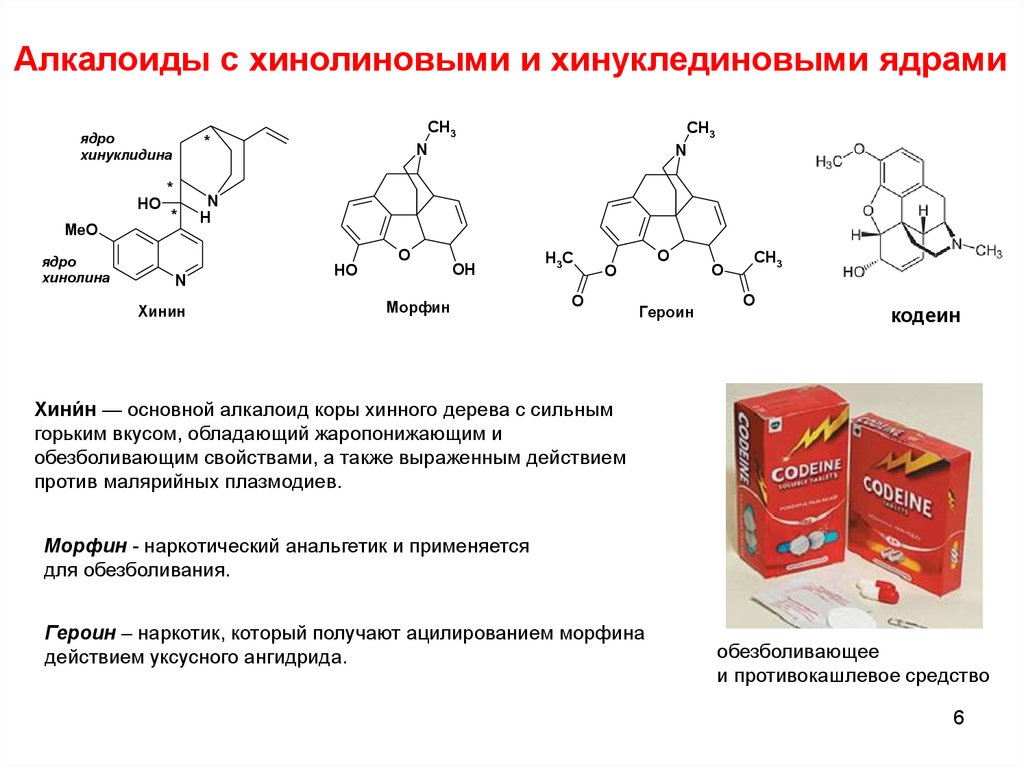 Хелидонин обнаружен только у F. officinalis (650,0 ± 0,5 мк г/г) и C. majus (51040,0 ± 1,8 мк г/г). N,N -Диметил-герновин ранее не был обнаружен ни в одном из исследованных растений. Соединение было обнаружено в M. cambrica , B. thunbergii , M. aquifolium , C. cava , G. flavum и C. majus . Метилгерновин был впервые обнаружен в G. flavum , а колумбамин в B. thunbergii . По литературным данным колумбамин встречается у C. cava [24] и M. aquifolium 9.0008 [25], что не подтвердилось в данном исследовании. Метил-корипальмин обнаружен в F. officinalis впервые. В данном исследовании было подтверждено наличие фумарофицина [26] и коридамина [27] в этом растительном материале. Наличие ятроризина у M. aquifolium [25] и коридалина у C. cava [28, 29] также было подтверждено, но не у F. officinalis [27]. Коридин и тетрагидропальматин были обнаружены в этом исследовании только в C.
Хелидонин обнаружен только у F. officinalis (650,0 ± 0,5 мк г/г) и C. majus (51040,0 ± 1,8 мк г/г). N,N -Диметил-герновин ранее не был обнаружен ни в одном из исследованных растений. Соединение было обнаружено в M. cambrica , B. thunbergii , M. aquifolium , C. cava , G. flavum и C. majus . Метилгерновин был впервые обнаружен в G. flavum , а колумбамин в B. thunbergii . По литературным данным колумбамин встречается у C. cava [24] и M. aquifolium 9.0008 [25], что не подтвердилось в данном исследовании. Метил-корипальмин обнаружен в F. officinalis впервые. В данном исследовании было подтверждено наличие фумарофицина [26] и коридамина [27] в этом растительном материале. Наличие ятроризина у M. aquifolium [25] и коридалина у C. cava [28, 29] также было подтверждено, но не у F. officinalis [27]. Коридин и тетрагидропальматин были обнаружены в этом исследовании только в C. cava 9.0008, но не были обнаружены у других исследованных видов растений. Аллокриптопин был обнаружен только у C. majus и M. cordata . Анализ подтвердил наличие криптопина в Chelidonium majus , но не в F. officinalis [27] и не в M. cordata [30]. Исследование не подтвердило наличие колумбамина в C. cava [23] и M. aquifolium [25] и криптопина в F. officinalis [27], D. spectabilis 9.0008 [31] и M. cordata [30].
cava 9.0008, но не были обнаружены у других исследованных видов растений. Аллокриптопин был обнаружен только у C. majus и M. cordata . Анализ подтвердил наличие криптопина в Chelidonium majus , но не в F. officinalis [27] и не в M. cordata [30]. Исследование не подтвердило наличие колумбамина в C. cava [23] и M. aquifolium [25] и криптопина в F. officinalis [27], D. spectabilis 9.0008 [31] и M. cordata [30].
Валидация метода УВЭЖХ была выполнена с точки зрения точности и прецизионности LOD и LOQ. Результаты регрессии показали, что все четыре эталонных соединения показали хорошую линейность в относительно широком диапазоне концентраций. Коэффициенты корреляции всех калибровочных кривых составили R 2 > 0,9992. LOD и LOQ четырех аналитов составляли 10,0–47,8 и 33,2–159,6 мк г/г соответственно. Параметры калибровочных кривых вместе со значениями LOD и LOQ представлены в таблице 2.
Относительное стандартное отклонение (RSD%), как мера повторяемости, составляло от 0,58% (берберин) до 1,25% (хелидонин). Эти значения хорошо согласуются с требованиями, предъявляемыми к разрабатываемому методу. Значения RSD внутри- и междневной прецизионности были менее 3,0% для всех соединений, что свидетельствует о хорошей воспроизводимости метода. Результаты обобщены в таблице 3.
4. Выводы
Несмотря на обширные исследования фитохимического состава исследованных видов, некоторые алкалоиды были обнаружены в этом исследовании впервые. Это были криптопины в Chelidonium majus ; N,N-диметил-герновин в Meconopsis cambrica , Berberis thunbergii , Mahonia aquifolium , Corydalis cava , Glaucium flavum и Chelidonium majus; метил-герновин в Glaucium flavum ; колумбамин в Berberis thunbergii ; метилкорипальмин, хелидонин и сангвинарин в Fumaria officinalis ; и сангвинарин в Corydalis cava . Условия окружающей среды являются одной из возможных причин вариации алкалоидного состава тестируемого растительного сырья, так как данные получены при исследовании сырья турецкого и китайского происхождения. Эти различия также могут быть связаны с используемыми аналитическими методами, поскольку экстракты из C. cava и F. officinalis ранее не анализировались методом УЭЖХ-МС/МС.
Условия окружающей среды являются одной из возможных причин вариации алкалоидного состава тестируемого растительного сырья, так как данные получены при исследовании сырья турецкого и китайского происхождения. Эти различия также могут быть связаны с используемыми аналитическими методами, поскольку экстракты из C. cava и F. officinalis ранее не анализировались методом УЭЖХ-МС/МС.
Abbreviations
| P: | Protopine |
| B: | Berberine |
| CH: | Chelidonine |
| S: | Sanguinarine |
| UPLC-MS/MS: | Ультраэффективная жидкостная хроматография-тандемная масс-спектрометрия. |
Конфликт интересов
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Ссылки
R. Verpoorte, «Фармакогнозия в новом тысячелетии: поиск руководства и биотехнология», Journal of Pharmacy and Pharmacology , vol.
 52, стр. 253–262, 2000.
52, стр. 253–262, 2000.Посмотреть по адресу:
Сайт издателя | Google Scholar
H. Ahsan, S. Reagan-Shaw, J. Breur и N. Ahmad, «Сангвинарин индуцирует апоптоз клеток карциномы поджелудочной железы человека AsPC-1 nad BxPC-3 посредством модуляции белков семейства Bcl-2, Рак Письма , том. 249, стр. 198–208, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M. C. Chang, C. P. Chan, Y. J. Wang et al., «Индукция некроза и апоптоза раковых клеток KB сангвинарином связана с продукцией активных форм кислорода и деполяризацией митохондриальной мембраны», Toxicology and Applied Pharmacology , об. 218, стр. 143–151, 2007.
Посмотреть по адресу:
Сайт издателя | Академия Google
H. P.
 Kuo, T. C. Chuang, S. C. Tsai et al., «Берберин, изохинолиновый алкалоид, ингибирует метастатический потенциал клеток рака молочной железы посредством модуляции пути Akt», Journal of Agriculture and Food Chemistry , vol. 60, стр. 9649–9658, 2012.
Kuo, T. C. Chuang, S. C. Tsai et al., «Берберин, изохинолиновый алкалоид, ингибирует метастатический потенциал клеток рака молочной железы посредством модуляции пути Akt», Journal of Agriculture and Food Chemistry , vol. 60, стр. 9649–9658, 2012.Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Дж. Парк, С. М. Сео, Э. Дж. Ким и др., «Берберин ингибирует миграцию раковых клеток толстой кишки человека посредством подавления интегрина 9, опосредованного АМФ-активируемой протеинкиназой.0007 β 1 сигнализация», Biochemistry Biophysics Research Communations , vol. 426, стр. 461–467, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Kemény-Beke, J. Aradi, J. Damjanovich et al., «Апоптотический ответ клеток увеальной меланомы на лечение хелидонином, сангвинарином и хелеритрином», Cancer Letters , vol.
 237, стр. 67–75, 2006.
237, стр. 67–75, 2006.Посмотреть по адресу:
Сайт издателя | Академия Google
S. K. Noureini и M. Wink, «Транскрипционное подавление hTERT и индукция старения в клетках HepG2 с помощью хелидонина», World Journal Gastroenterology , vol. 15, стр. 3603–3610, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
В. Каминский, К. В. Лин, Ю. Филяк и Р. Стойка, «Дифференциальный эффект сангвинарина, хелеритрина и хелидонина на повреждение ДНК и жизнеспособность клеток в первичных клетках селезенки мыши и лейкозных клетках мыши», Cell Biology International , vol. 32, стр. 271–277, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. А. Саид, А. Х. Гилани, Р. У. Маджу и Б.
 Х. Шах, «Антитромботическая и противовоспалительная активность протопина», Pharmacology Research , vol. 36, стр. 1–7, 1997.
Х. Шах, «Антитромботическая и противовоспалительная активность протопина», Pharmacology Research , vol. 36, стр. 1–7, 1997.Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Врба, Е. Врублова, М. Модрянски и Дж. Ульрихова, «Протопин и аллокриптопин повышают уровни мРНК цитохромов P450 1A в гепатоцитах человека и клетках HepG2 независимо от AhR», Письма по токсикологии , том. 203, стр. 135–141, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
CH Chen, CH Liao, YL Chang, JH Guh, S. L. Pan, and CM Teng, «Протопин, новый агент, стабилизирующий микротрубочки, вызывает остановку митоза и апоптозную гибель клеток в клетках гормонорезистентного рака предстательной железы человека. линии», Cancer Letters , vol. 315, стр. 1–11, 2010 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
Дж.
 Дж. Лу, Дж. Л. Бао, Х. П. Чен, М. Хуанг и Ю. Т. Ван, «Алкалоиды, выделенные из натуральных трав в качестве противораковых средств», Доказательная дополнительная и альтернативная медицина , том. 2012 г., идентификатор статьи 485042, 12 страниц, 2012 г.
Дж. Лу, Дж. Л. Бао, Х. П. Чен, М. Хуанг и Ю. Т. Ван, «Алкалоиды, выделенные из натуральных трав в качестве противораковых средств», Доказательная дополнительная и альтернативная медицина , том. 2012 г., идентификатор статьи 485042, 12 страниц, 2012 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Z. Habli, G. Toumieh, M. Fatfat, O.N. Rahal и H.G. Muhtasib, «Новые цитотоксические алкалоиды в борьбе с раком: обзор молекулярных механизмов», Молекулы , об. 22, стр. 1–22, 2017 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Y. Gu, D. Qian, J. Duan et al., «Одновременное определение семи основных алкалоидов Chelidonium majus L. с помощью ультраэффективной ЖХ с фотодиодным детектором», Journal Separation Наука , том. 33, стр. 1004–1009, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Богданов М.
 Г., Свиняров И. Ионно-жидкостная твердо-жидкостная экстракция биоактивных алкалоидов. II. Кинетика, моделирование и механизм выделения глауцина из Glaucium flavum Cr. (Papaveraceae)», Separation Purify Technology , vol. 103, стр. 279–232, 2013.
Г., Свиняров И. Ионно-жидкостная твердо-жидкостная экстракция биоактивных алкалоидов. II. Кинетика, моделирование и механизм выделения глауцина из Glaucium flavum Cr. (Papaveraceae)», Separation Purify Technology , vol. 103, стр. 279–232, 2013.Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Кардошова, А. Маловикова, В. Пятопрсти, Г. Носалова и Т. Матакова, «Структурная характеристика и противокашлевая активность глюкуроноксилана из Mahonia aquifolium (Pursh) Nutt», Carbomers. , том. 47, стр. 27–33, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
G. Y. Zuo, F. Y. Meng, J. Han et al., «Активность растительных экстрактов и алкалоидов in vitro против клинических изолятов штаммов, продуцирующих β -лактамазу (ESBL) расширенного спектра», Molecules , том.
 16, стр. 5453–5459, 2011.
16, стр. 5453–5459, 2011.Посмотреть по адресу:
Сайт издателя | Google Scholar
S. Sturm, C. Seger и H. Stuppner, «Анализ центрально-европейского вида Corydalis с помощью неводного капиллярного электрофореза-масс-спектрометрии с ионной ловушкой», Журнал Хроматография , том. 1159, стр. 42–50, 2007 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Славик Дж., Бочоракова Дж., Косталова Д., Хрохова В. Алкалоиды Mahonia aquifolium (Pursh) Nutt. II», Chemical Papers , vol. 39, pp. 537–542, 1985.
Посмотреть по адресу:
Google Scholar
C.W. Kim, N. Takao, M. Ichimaru, and A. Kato, «On the alkaloid cell and содержали алкалоиды Dicentra spectabilis (Papaveraceae)», Японский журнал фармакогнозии , vol.
 46, pp. 109–114, 1992.
46, pp. 109–114, 1992.Просмотр по адресу:
Google Scholar
Ракотондрамаси-Рабесиака Л., Хавет Дж. процесс экстракции протопина из Fumaria officinalis L., Separation and Purification Technology , vol. 76, стр. 126–131, 2010.
Просмотр:
Сайт издателя | Google Scholar
Дж. Сухомелова, Х. Бочоракова, Х. Паулова, П. Мусил и Э. Таборска, «Количественная оценка с помощью ВЭЖХ семи четвертичных бензо[c]фенантридиновых алкалоидов в шести видах семейства Papaveraceae», Journal Фармацевтического и биомедицинского анализа , том. 44, стр. 283–287, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Славик Дж., Славикова Л. Алкалоиды маковых. LXVII. Алкалоиды из Corydalis cava (L.
 ). Чехословацкий сборник», Химические сообщения , т. 1, с. 44, pp. 2261–2274, 1979.
). Чехословацкий сборник», Химические сообщения , т. 1, с. 44, pp. 2261–2274, 1979.Посмотреть по адресу:
Google Scholar
особенности и биологическая активность кислого полисахаридного комплекса из Mahonia aquifolium (Pursh) Nutt», Carbohydrate Polymers , vol. 57, стр. 165–176, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
В. Брезова, Д. Дворанова и Д. Косталова, «Активация кислорода фотовозбужденными алкалоидами протобербериния из Mahonia aquifolium », Phytotherapy Research , vol. 18, стр. 640–646, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. Seger, S. Sturm, E. Strasser, E. Ellmerer и H. Stuppner, «Отнесение сигналов ЯМР 1H и 13C бензилизохинолиновых алкалоидов из Fumaria officinalis L.
 (Papaveraceae)», Magnetic Resonance Chemistry , vol. 42, стр. 882–886, 2004.
(Papaveraceae)», Magnetic Resonance Chemistry , vol. 42, стр. 882–886, 2004.Посмотреть по адресу:
Сайт издателя | Google Scholar
Б. Сенер, «Турецкие виды Fumaria L. и их алкалоиды. VII. Алкалоиды из Fumaria officinalis L. и Fumaria cilicica Hausskn», Gazi Universitesi Eczacilik Fakultesi Dergisi , vol. 2, стр. 45–49, 1985.
Посмотреть по адресу:
Google Scholar
Z. Novak, J. Chlebek, L. Opletal et al., «Корилуцинин, новый алкалоид из Corydalis cava (Fumariaceae), и его холинэстеразная активность», Natural Products Communications , об. 7, pp. 859-860, 2012.
Посмотреть по адресу:
Google Scholar
Г. Верзар-Петри и Х. Мин, «Хроматографическое разделение алкалоидов из Corydalis cava L.
 » (Fumariaceae) Наука Фармасьютика , том. 46, pp. 169–180, 1978.
» (Fumariaceae) Наука Фармасьютика , том. 46, pp. 169–180, 1978.Посмотреть по адресу:
Google Scholar
Y. Guo, J. Zeng, M. Tan, J. Huang, and X. Z. Y. Liu, «Content of 4 алкалоиды в листьях Macleaya microcarpa (maxim) Fedde и Macleaya cordata (Willd.) R. Br», Central South Pharmacy , vol. 9, pp. 829–832, 2011.
Посмотреть по адресу:
Google Scholar
Исраилов И.А., Меликов Ф.М., Муравьева Д.А. Алкалоиды дицентра. Химия природных соединений , вып. 20, стр. 74–76, 1984.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright
Copyright © 2017 Анна Оч и др. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ АЛКАЛОИДНЫХ ЭКСТРАКТОВ РАЗЛИЧНЫХ РАСТЕНИЙ В ОТНОШЕНИИ КЛЕТОЧНОЙ ЛИНИИ 9 РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ0001
- title={ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ АЛКАЛОИДНЫХ ЭКСТРАКТОВ РАЗЛИЧНЫХ РАСТЕНИЙ В ОТНОШЕНИИ КЛЕТОЧНОЙ ЛИНИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ},
автор = {Фара А. Аль-марзук и Рабаб Омран},
journal={Азиатский журнал фармацевтических и клинических исследований},
год = {2017},
громкость = {10},
страницы = {168-171}
}- Фарах А. Аль-марзук, Рабаб Омран
- Опубликовано 1 июля 2017 г.
- Biology
- Asian Journal of Pharmaceutical and Clinical Research
Цели: Изучение in vitro цитотоксической активности суммарных алкалоидных экстрактов Pinus sabiniana L., Phoenix dactylifera L. и Ferocactus sp. L. против клеточной линии рака молочной железы Michigan Cancer Foundation-7 (MCF-7) и неканцерогенной фетальной печеночной клеточной линии (WRL-68).
 Методы: растительный порошок из каждого листа P. sabiniana L., пыльцевых зерен P. dactylifera L. и Ferocactus sp. л. Листья отдельно экстрагировали 80% метанолом, хлороформом при pH 2 и pH 10, часть хлороформа сушили…
Методы: растительный порошок из каждого листа P. sabiniana L., пыльцевых зерен P. dactylifera L. и Ferocactus sp. л. Листья отдельно экстрагировали 80% метанолом, хлороформом при pH 2 и pH 10, часть хлороформа сушили… View via Publisher
Innovareacademics.in
Фитохимический скрининг и цитотоксическая оценка экстрактов листьев Bauhinia
- L. Lianah, Rita Arianan.19.
7 L. Lianah, Rita Ariyanan.
- 2021
Аннотация. Лиана Л., Хасана Ран, Пранатами Д.А., Крисантини К. 2021. Фитохимический скрининг и цитотоксическая оценка экстрактов листьев Bauhinia scandens с использованием клеточных линий HeLa и T47D. Биоразнообразие…
НОВЫЙ АЛКАЛОИД ИЗ МАСЛА СЕМЯН DERRIS INDICA (LAM) BENNETT: ВЫДЕЛЕНИЕ И ХАРАКТЕРИСТИКА
Цель: Целью исследования было выделение алкалоидного соединения из масла семян Derris indica (Lam) Bennett, обладающего противомикробными свойствами в традиционной медицине.
Методы: растение было…Фитохимический скрининг и биоактивность членов семейства кактусовых, эндемичных для Мексики
- C.
 Rodríguez-Mendosa, Rubí Esmeralda González Campos, H. Bach
Rodríguez-Mendosa, Rubí Esmeralda González Campos, H. Bach Биология
Растения
- 2022
Фитохимия и биоактивность этанольных экстрактов Ferocactus echidne, F. latispinus и Mammillaria geminispina показали различную биоактивность, включая цитотоксическую, антимикробную и антимикробную активность.
Фитохимический анализ и антибактериальная активность экстрактов Kyllinga nemoralis в отношении роста некоторых патогенных бактерий
- Нур Зарина Абд Вахаб, Амирул Хафизул Айман Абд Рахман
Journal of Pure and Applied Microbiology
- 2022
Это исследование было направлено на скрининг фитохимического состава и изучение антибактериальной активности водных и метанольных экстрактов Kyllinga nemoralis. Экстракция проводилась с использованием целого растения…
1 Индукция апоптоза и остановка клеточного цикла в двух 2 линиях клеток рака человека A 549 и HT 29 по Barhi 3 экстракты ядер финиковой пальмы и три выделенных 4 цитотоксических соединения 5
- I.
 Mahmud, M. Mirghani, Phirdaous Abbas
Mahmud, M. Mirghani, Phirdaous Abbas Биология
- 2019
Оценка влияния экстрагируемых полифенолов из клеток рака легких EPP, NEPP, NOB, TEC и PERSI на индукцию апоптоза человека что экстракты BDPK и три изолированных флавоноида могут быть хорошими кандидатами для разработки противораковых средств.
АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ ЭКСТРАКТОВ ТРЕХ РАСТЕНИЙ В ОТНОШЕНИИ МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ PSEUDOMONAS AERUGINOSA
- Yassir Haider Almawlah, H. Alaa, Sanaa O Aljelawi
Biology, Medicine
- 2017
Рекомендация о том, что натуральные продукты можно использовать в качестве терапевтических средств, вероятно, не вызовет резистентности у бактерий.
НАНОИНКАПСУЛЯЦИЯ ПОВЫШАЕТ ЭФФЕКТИВНОСТЬ ВЫсвобождения и толерантность к глюкозе наночастиц поликапролактона, нагруженных 14-дезокси, 11, 12-дидегидроандрографолидом, при диабете 2 типа, индуцированном стрептозотоцин-никотинамидом
- K.
 Nagalakshmi, S. Sujatha
Nagalakshmi, S. Sujatha Биология, медицина
- 2017
Медленное и устойчивое высвобождение DDA из полимерной матрицы подтвердило, что наноинкапсулирование увеличивает пероральную биодоступность, что приводит к снижению пероральной биодоступности DDA глюкозы, что может быть связано с выраженной антигипергликемической активностью нано-ДДА по сравнению со свободным ДДА.
ПОКАЗЫВАЕТ 1-10 ИЗ 33 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантностьНаиболее влиятельные документыНедавность
in vitro Цитотоксическая активность Clerodendrum infortunatum L. против T47D, PC-3, A549 и HCT-116 раковых клеточных линий человека и его фитохимического скрининга
- М. Харис, Р. Махмуд, Хасибур Рэхман, Nazneen rahman
96696696696696969696966966966966969696969696966387787878879696969н. Химия
- 2015
Цель: Настоящее исследование объясняет научную оценку растения Clerodendrum infortunatum L. в отношении его лекарственной эффективности, которая включает фитохимический скрининг и противораковое действие…
в отношении его лекарственной эффективности, которая включает фитохимический скрининг и противораковое действие…
Антиоксидантная и противоопухолевая активность метанольного экстракта из Стефании Элеганс
- Равин Шарма, Г. Чандан, А. Чахал, Р. Саини
Химия
- 2017
- 2017
- B. Debnath, M.J. Uddin, Prasenjit Patari, Manik Das, D. Maiti, K. Manna
Biology, Chemistry
- 2015
- Yiyi Sun, Keli Xun, Yitao Wang, Xiuping Chen
Биология, химия
Противораковые препараты
- 2009
- Neelapu N eelima, G.
 Naikwadi, Muvvala Sudhakar, Jadhav Kiran
Naikwadi, Muvvala Sudhakar, Jadhav Kiran Химия 6 0396
- А. Капассо, Р. Акино, Н. Томмази, С. Пиасенте, Л. Растрелли, К. Пицца
Химия, биология
- 2002
- Nishant Verma, K.
 K. Jha, S. Chaudhary, Omvir Singh, Arvind Kumar
K. Jha, S. Chaudhary, Omvir Singh, Arvind Kumar Medicine
- 2014
.
.
. Антиоксидантная и противораковая активность in vitro метанольного экстракта Stephania elegans, неизученного вида семейства Menispermaceae.…
ОЦЕНКА АЛКАЛОИДОВ И ФЕНОЛИКОВ ПЯТИ СЪЕДОБНЫХ БАХВАЧНЫХ РАСТЕНИЙ И ИХ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТИ
Momordica charantia экстракт был выбран наиболее активным среди пяти (Linnica.charantia). растения против тестируемых патогенов, и степень активности или зона ингибирования были обнаружены разными для разных экстрактов, что может быть связано с различием в компонентах, присутствующих в растительных экстрактах.
Систематический обзор противораковых свойств берберина, натурального продукта из китайских трав
Медикаментозное подавление роста и метастазов улучшение множественной лекарственной устойчивости как in vivo, так и in vitro ясно показывает потенциал берберина в качестве альтернативного лекарства для химиотерапии опухолей.
Алкалоиды, выделенные из натуральных трав, в качестве противораковых средств
На основании информации из литературы, которая обобщена в этой статье, использование алкалоидов в качестве противораковых средств является очень многообещающим, но необходимы дополнительные исследования и клинические испытания, прежде чем можно будет сделать окончательные рекомендации по конкретным свойствам алкалоидов.
ПРЕДВАРИТЕЛЬНОЕ ФИТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ ЛИСТЬЕВ SOLANUM XANTHOCARPUM
Идентификация первичных и вторичных компонентов стала чрезвычайно важным инструментом для определения наличия активного компонента. Настоящее исследование было направлено на изучение фитохимических веществ, присутствующих в…
Нейрофармакологическая активность алкалоидов из южноамериканских лекарственных растений
Основная цель состоит в том, чтобы выделить как можно больше вторичных метаболитов для получения фитохимических знаний об изучаемых растениях, идентифицировать активные вещества в растениях с заявленной биологической активностью и оценить фармакологические эффекты растительные экстракты, фракции и чистые соединения по отношению к исходному растительному материалу.
Phytochemistry, pharmacology and traditional uses of Leptadenia pyrotechnica — An important medicinal plant
A wide number of isolated Включены химические компоненты и различные этномедицинские и традиционные способы использования Leptadenia pyrotechnica, включая информацию об историческом происхождении, концептуальной основе, различных дисциплинах, изучаемых в системах, аспектах исследований и разработок, аспектах производства лекарств и влиянии глобализации.
Открытие водорастворимых противоопухолевых агентов (эдотидов) из овощей, найденных в Бенин-Сити, Нигерия
Предполагается, что овощ VA, если его включить в рацион, может предотвратить или отсрочить начало рака молочной железы.
BM6, новый полусинтетический алкалоид барвинка, проявляет свою мощную противоопухолевую активность in vivo за счет высокого сродства к тубулину и улучшенных фармакокинетических профилей. другие алкалоиды барвинка, а также индуцировали значительный клеточный цикл, остановленный при митозе и разрушении цитоскелета посредством взаимодействия с сайтом связывания VincA на тубулине.


 52, стр. 253–262, 2000.
52, стр. 253–262, 2000. Kuo, T. C. Chuang, S. C. Tsai et al., «Берберин, изохинолиновый алкалоид, ингибирует метастатический потенциал клеток рака молочной железы посредством модуляции пути Akt», Journal of Agriculture and Food Chemistry , vol. 60, стр. 9649–9658, 2012.
Kuo, T. C. Chuang, S. C. Tsai et al., «Берберин, изохинолиновый алкалоид, ингибирует метастатический потенциал клеток рака молочной железы посредством модуляции пути Akt», Journal of Agriculture and Food Chemistry , vol. 60, стр. 9649–9658, 2012.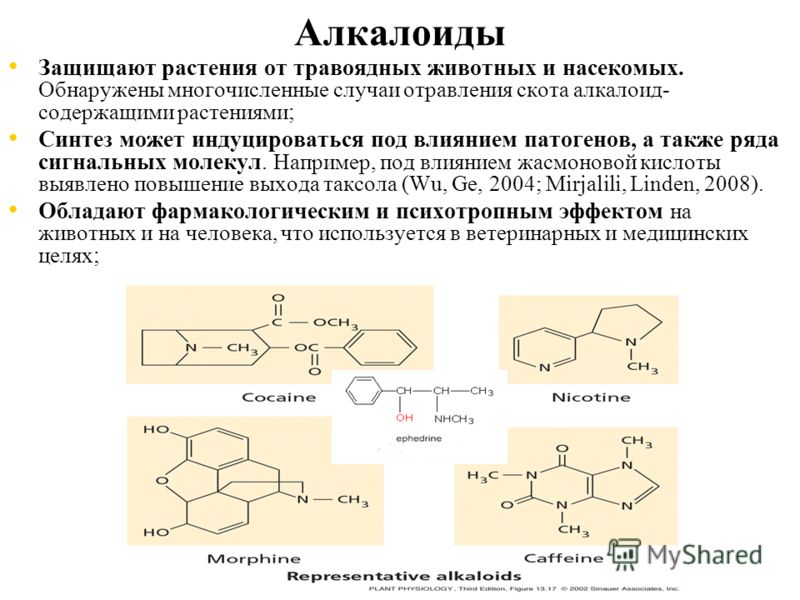 237, стр. 67–75, 2006.
237, стр. 67–75, 2006. Х. Шах, «Антитромботическая и противовоспалительная активность протопина», Pharmacology Research , vol. 36, стр. 1–7, 1997.
Х. Шах, «Антитромботическая и противовоспалительная активность протопина», Pharmacology Research , vol. 36, стр. 1–7, 1997. Дж. Лу, Дж. Л. Бао, Х. П. Чен, М. Хуанг и Ю. Т. Ван, «Алкалоиды, выделенные из натуральных трав в качестве противораковых средств», Доказательная дополнительная и альтернативная медицина , том. 2012 г., идентификатор статьи 485042, 12 страниц, 2012 г.
Дж. Лу, Дж. Л. Бао, Х. П. Чен, М. Хуанг и Ю. Т. Ван, «Алкалоиды, выделенные из натуральных трав в качестве противораковых средств», Доказательная дополнительная и альтернативная медицина , том. 2012 г., идентификатор статьи 485042, 12 страниц, 2012 г.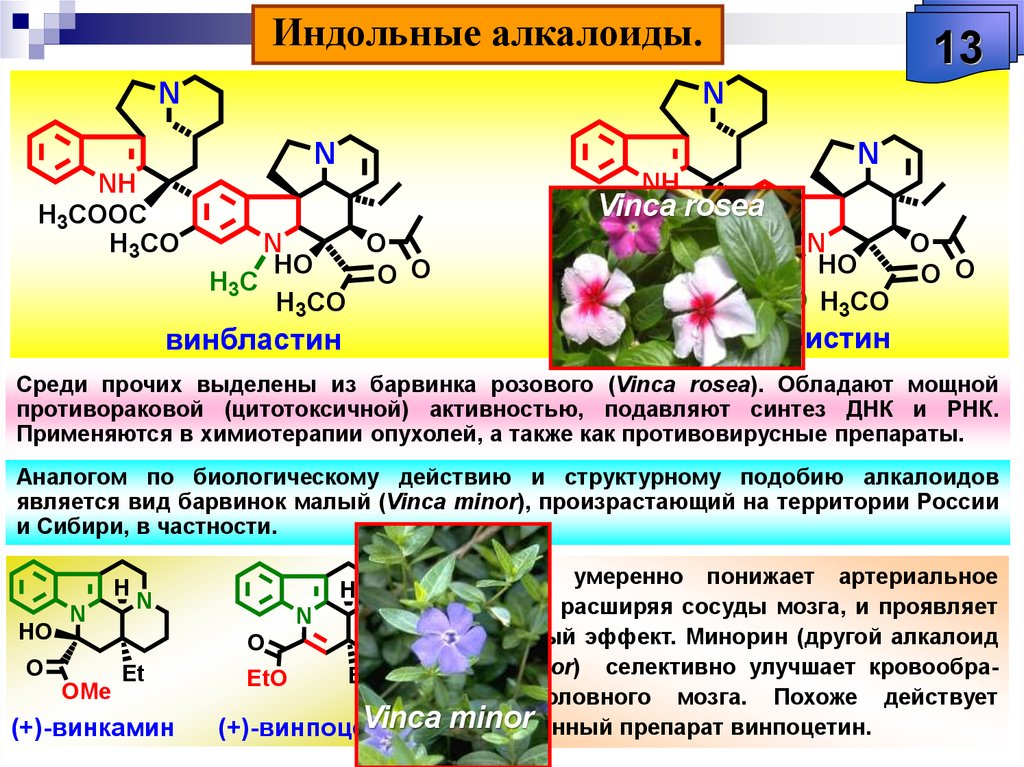 Г., Свиняров И. Ионно-жидкостная твердо-жидкостная экстракция биоактивных алкалоидов. II. Кинетика, моделирование и механизм выделения глауцина из Glaucium flavum Cr. (Papaveraceae)», Separation Purify Technology , vol. 103, стр. 279–232, 2013.
Г., Свиняров И. Ионно-жидкостная твердо-жидкостная экстракция биоактивных алкалоидов. II. Кинетика, моделирование и механизм выделения глауцина из Glaucium flavum Cr. (Papaveraceae)», Separation Purify Technology , vol. 103, стр. 279–232, 2013. 16, стр. 5453–5459, 2011.
16, стр. 5453–5459, 2011. 46, pp. 109–114, 1992.
46, pp. 109–114, 1992.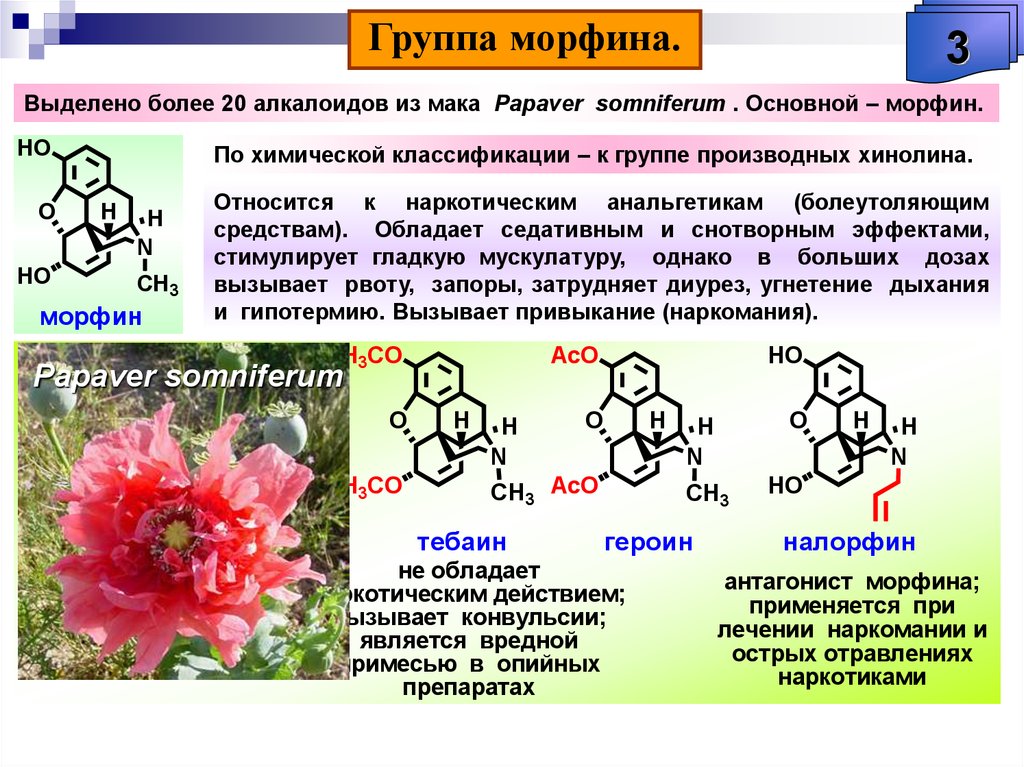 ). Чехословацкий сборник», Химические сообщения , т. 1, с. 44, pp. 2261–2274, 1979.
). Чехословацкий сборник», Химические сообщения , т. 1, с. 44, pp. 2261–2274, 1979. (Papaveraceae)», Magnetic Resonance Chemistry , vol. 42, стр. 882–886, 2004.
(Papaveraceae)», Magnetic Resonance Chemistry , vol. 42, стр. 882–886, 2004. » (Fumariaceae) Наука Фармасьютика , том. 46, pp. 169–180, 1978.
» (Fumariaceae) Наука Фармасьютика , том. 46, pp. 169–180, 1978. Методы: растительный порошок из каждого листа P. sabiniana L., пыльцевых зерен P. dactylifera L. и Ferocactus sp. л. Листья отдельно экстрагировали 80% метанолом, хлороформом при pH 2 и pH 10, часть хлороформа сушили…
Методы: растительный порошок из каждого листа P. sabiniana L., пыльцевых зерен P. dactylifera L. и Ferocactus sp. л. Листья отдельно экстрагировали 80% метанолом, хлороформом при pH 2 и pH 10, часть хлороформа сушили…  Rodríguez-Mendosa, Rubí Esmeralda González Campos, H. Bach
Rodríguez-Mendosa, Rubí Esmeralda González Campos, H. Bach