Аденозинтрифосфат. Структура и функции. Физиологическая роль атф у растений
АТФ и ее роль в клетке
В цитоплазме каждой клетки, а также в митохондриях, хлоропластах и ядрах содержится аденозинтрифосфорная кислота (АТФ). Она поставляет энергию для большинства реакций, происходящих в клетке. С помощью АТФ клетка синтезирует новые молекулы белков, углеводов, жиров, избавляется от отходов, осуществляет активный транспорт веществ, биение жгутиков и ресничек и т. д.
Молекула АТФ представляет собой нуклеотид, образованный азотистым основанием аденином, пятиуглеродным сахаром рибозой и тремя остатками фосфорной кислоты. Фосфатные группы в молекуле АТФ соединены между собой высокоэнергетическими (макроэргическими) связями :
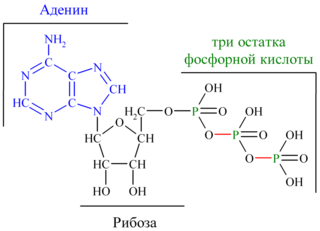
Связи между фосфатными группами не очень прочные, и при их разрыве выделяется большое количество энергии. В результате гидролитического отщепления от АТФ фосфатной группы образуется аденозиндифосфорная кислота (АДФ) н высвобождается порция энергии:
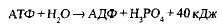
АДФ также может подвергаться дальнейшему гидролизу с отщеплением еще одной фосфатной группы и выделением второй порции энергии; при этом АДФ преобразуется в аденозин-монофосфат (АМФ), который далее не гидролизуется:
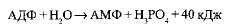
АТФ образуется из АДФ и неорганического фосфата за счет энергии, освобождающейся при окислении органических веществ и в процессе фотосинтеза. Этот процесс называется фосфорилированием. При этом должно быть затрачено не менее 40 кДж/моль энергии, которая аккумулируется в макроэргических связях:
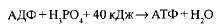
Следовательно, основное значение процессов дыхания и фотосинтеза определяется тем, что они поставляют энергию для синтеза АТФ, с участием которой в клетке выполняется большая часть работы.
Таким образом, АТФ — это главный универсальный поставщик энергии в клетках всех живых организмов.
АТФ чрезвычайно быстро обновляется. У человека, например, каждая молекула АТФ расщепляется и вновь восстанавливается 2 400 раз в сутки, так что ее средняя продолжительность жизни менее 1 мин. Синтез АТФ осуществляется главным образом в митохондриях и хлоропластах (частично в цитоплазме). Образовавшаяся здесь АТФ направляется в те участки клетки, где возникает потребность в энергии.
Источник : Н.А. Лемеза Л.В.Камлюк Н.Д. Лисов "Пособие по биологии для поступающих в ВУЗы"
sbio.info
Биология для студентов - 35. Энергетические процессы микроорганизмов. Роль АТФ и способы ее образования
Все живые организмы могут использовать только химически связанную энергию. Каждое вещество обладает определенным запасом потенциальной энергии. Главные материальные носители ее химические связи, разрыв или преобразование которых приводит к освобождению энергии.
Энергетический уровень химических связей неодинаков. Для одних он имеет величину порядка 8—10 кДж. Такие связи называют нормальными. В других связях заключена значительно большая энергия - 25—40 кДж. Это так называемые макроэргические связи. Почти все известные соединения, обладающие такими связями, включают атомы фосфора и серы, участвующие в образовании этих связей. Важнейшую роль в жизнедеятельности клетки играет аденозинтрифосфорная кислота (АТФ). В состав ее молекулы входят аденин, рибоза и три остатка фосфорной кислоты.
Обмен веществ (метаболизм) – это совокупность всех химических реакций, которые происходят в организме. Все эти реакции делятся на 2 группы:
- Пластический обмен (ассимиляция, анаболизм, биосинтез) – это когда из простых веществ с затратой энергии образуются (синтезируются) более сложные. Пример: При фотосинтезе из углекислого газа и воды синтезируется глюкоза.
- Энергетический обмен (диссимиляция, катаболизм, дыхание) – это когда сложные вещества распадаются (окисляются) до более простых, и при этом выделяется энергия, необходимая для жизнедеятельности. Пример: В митохондриях глюкоза, аминокислоты и жирные кислоты окисляются кислородом до углекислого газа и воды, при этом образуется энергия (клеточное дыхание).
Пластический обмен обеспечивает клетку сложными органическими веществами (белками, жирами, углеводами, нуклеиновыми кислотами), в том числе белками-ферментами для энергетического обмена.
Энергетический обмен обеспечивает клетку энергией. При выполнении работы (умственной, мышечной и т.п.) энергетический обмен усиливается.
АТФ – универсальное энергетическое вещество клетки (универсальный аккумулятор энергии). Образуется в процессе энергетического обмена (окисления органических веществ).
При энергетическом обмене все вещества распадаются, а АТФ – синтезируется. При этом энергия химических связей распавшихся сложных веществ переходит в энергию АТФ, энергия запасается в АТФ.
При пластическом обмене все вещества синтезируются, а АТФ – распадается. При этом расходуется энергия АТФ (энергия АТФ переходит в энергию химических связей сложных веществ, запасается в этих веществах).
АТФ занимает центральное место в энергетическом обмене клетки. Макроэргические связи в молекуле АТФ очень непрочны. Гидролиз этих связей приводит к освобождению значительного количества свободной энергии:
АТФ + Н20→АДФ + Н3Р04- 30,56 кДж
Гидролиз протекает с участием специфических ферментов, обеспечивая энергией биохимические процессы, идущие с поглощением энергии. В этом случае АТФ играет роль поставщика энергии. Имея малый размер, молекула АТФ и диффундирует в различные участки клетки. Запас АТФ в клетках непрерывно возобновляется за счет реакций присоединения остатка фосфорной кислоты к молекуле аденозиндифосфорной кислоты (АДФ):
АДФ + Н3Р04 → АТФ + Н20
Синтез АТФ, как и гидролиз, идет при участии ферментов, но сопровождается поглощением энергии, способы получения которой у микроорганизмов хотя и разнообразны, но могут быть сведены к двум типам:
- использование энергии света;
- использование энергии химических реакций.
При этом тот и другой виды энергии трансформируются в энергию химических связей АТФ. Таким образом, АТФ выполняет в клетке роль трансформатора. Анаболизм и катаболизм неразрывно связаны, составляя единое целое, поскольку продукты энергетического обмена (АТФ и некоторые низкомолекулярные соединения) непосредственно используются в конструктивном обмене клетки.
В клетках микроорганизмов соотношение между энергетическими и конструктивными процессами зависит от ряда конкретных условий, в частности от характера питательных веществ. Тем не менее по объему катаболические реакции обычно превосходят биосинтетические процессы. Взаимосвязь и сопряженность этих двух видов метаболизма проявляется прежде всего в том, что суммарный объем конструктивных процессов полностью зависит от количества доступной энергии, получаемой в ходе энергетического обмена.
vseobiology.ru
| Процессы обмена вещества включают в себя реакции, идущие с потреблением энергии, и реакции с выделением энергии. В некоторых случаях эти реакции сопряжены. Однако часто реакции, в которых энергия выделяется, отделены в пространстве и во времени от реакций, в которых она потребляется. В процессе эволюции у растительных и животных организмов выработалась возможность хранения энергии в форме соединений, обладающих богатыми энергией связями. Среди них центральное место занимает аденозинтрифосфат (АТФ). АТФ представляет собой нуклеотидфосфат, состоящий из азотистого основания (аденина), пентозы (рибозы) и трех молекул фосфорной кислоты. Две концевые молекулы фосфорной кислоты образуют макроэргические, богатые энергией связи. В клетке АТФ содержится, главным образом, в виде комплекса с ионами магния. Аденозинтрифосфйт в процессе дыхания образуется из аденозиндифосфата и остатка неорганической фосфорной кислоты (Фн) с использованием энергии, освобождающейся при окислении различных органических веществ: АДФ + Фн -> АТФ + Н20. При этом энергия окисления органических соединений превращается в энергию фосфорной связи. В 1939—1940 гг. Ф. Липман установил, что АТФ служит главным переносчиком энергии в клетке. Особые свойства этого вещества определяются тем, что конечная фосфатная группа легко переносится с АТФ на другие соединения или отщепляется с выделением энергии, которая может быть использована на физиологические функции. Эта энергия представляет собой разность между свободной энергией АТФ и свободной энергией образующихся продуктов (AG). AG — это изменение свободной энергии системы или количество избыточной энергии, которая освобождается при реорганизации химических связей. Распад АТФ происходит по уравнению: АТФ + Н20 -> АДФ + Фн, при этом
|
fizrast.ru
Реферат АТФ-синтаза
Реферат на тему:
План:
- Введение
- 1 Структура и номенклатура
- 2 Механизм изменения участка связывания
- 3 Физиологическое значение
- 4 АТФ-синтаза у разных организмов
- 4.1 АТФ-синтаза растений
- 4.2 АТФ-синтаза E. coli
- 4.3 АТФ-синтаза дрожжей
- 5 Эволюция АТФ-синтазы ПримечанияЛитература
Введение
Молекулярная модель АТФ-синтазы
Аденозинтрифосфатсинта́за (АТФ-синта́за) — класс ферментов, синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганических фосфатов. Энергию для синтеза АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например из просвета хлоропласта в его строму, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова:
АТФ-синтазы очень важны для жизнедеятельности почти всех организмов, так как АТФ — основная внутриклеточная «энергетическая валюта».
Антибиотик олигомицин подавляет активность FO-компонента АТФ-синтазы.
1. Структура и номенклатура
Структура АТФ-синтазы. Протонный канал FO и вращающаяся часть показаны синим, компонент F1 — красным, мембрана — серым.
Имеющаяся в митохондриях АТФ-синтаза F1FO очень хорошо исследована.
- компонент FO — трасмембранный домен,
- компонент F1 находится вне мембраны, в матриксе.
АТФ-синтазный комплекс FOF1 по форме напоминает плодовое тело гриба, у которого компонент F1 — это шляпка, ножка — это γ-субъединица компонента F1, а «корни» гриба — компонент FO, заякоренный в мембране.
Номенклатура фермента имеет традиционное происхождение, поэтому довольно непоследовательна.
Обозначение компонента F1 является сокращением от «Fraction 1» (часть 1), а символом FO (в индексе записана буква O, а не ноль) обозначался участок связывания олигомицина.
Некоторые субъединицы фермента имеют также буквенные обозначения:
- Греческие: α, β, γ, δ, ε
- Латинские: a, b, c, d, e, f, g, h
Другие — более сложные обозначения:
- F6 (от «Fraction 6»)
- OSCP — белок, чувствительный к олигомицину (от англ. the oligomycin sensitivity conferral protein), ATP5O
- A6L (названный так по названию гена, кодирующего его в митохондриальном геноме)
- IF1 (фактор ингибирования 1), ATPIF1
Компонент F1 достаточно велик (диаметр его составляет 9 нм), чтобы быть видимым в трансмиссионный электронный микроскоп при негативном окрашивании[1].
Частичками F1 усеяна внутренняя митохондриальная мембрана. Изначально считалось, что они содержат весь дыхательный аппарат митохондрии. Однако после долгих экспериментов группа Эфраима Рекера (впервые выделившая компонент F1 в 1961) показала, что эти частички связаны с АТФазной активностью в том числе и в разделенных митохондриях, и в субмитохондриальных частицах, формирующихся при ультразвуковом воздействии на митохондрии. Множество дальнейших исследований в разных лабораториях подтвердили эту АТФазную активность.
2. Механизм изменения участка связывания
В 60-70 годах XX века Пол Бойер предположил, что синтез АТФ связан с изменениями конфигурации АТФ-синтазы, вызываемыми вращением γ-субъединицы, так называемый механизм изменения участка связывания («перевертыш», англ. flip-flop). Исследовательской группе под руководством Джона Э. Уокера, относившейся тогда к Лаборатории молекулярной биологии в Кембридже, удалось выделить АТФ-синтазный каталитический комплекс F1 в кристаллической форме. На тот момент это была самая крупная из известных науке асимметричная белковая структура. Ее исследования показали, что модель вращающегося катализа, предложенная Бойером, соответствует действительности. За это открытие Бойер и Уокер получили половину Нобелевской премии по химии в 1997 году. Вторую половину получил Йенс Кристиан Скоу «за первое открытие фермента, осуществляющего транспорт ионов — Na+,K±аденозинтрифосфатазы».
Механизм действия АТФ-синтазы. АТФ показан красным, АДФ и фосфат — розовым, вращающаяся субъединица γ — черным.
Кристалл F1 состоит из перемежающихся α- и β-субъединиц (по 3 каждого вида), расположенных как дольки апельсина вокруг асимметричной γ-субъединицы. В соответствии с принятой моделью синтеза АТФ (также называемой моделью непостоянного катализа), градиент электрического поля, направленный поперек внутренней митохондриальной мембраны и обусловленный электронной транспортной цепочкой, заставляет протоны проходить сквозь мембрану через АТФ-синтазный компонент FO. Часть компонента FO (кольцо из c-субъединиц) вращается, когда протоны проходят через мембрану. Это c-кольцо жестко связано с асимметричной центральной ножкой (состоящей в основном из γ-субъединицы), которая в свою очередь вращается внутри α3β3-участка компонента F1. Это приводит к тому, что три участка катализа, связывающиеся с нуклеотидами, претерпевают изменения в конфигурации, приводящие к синтезу АТФ.
Основные субъединицы (α3β3) компонента F1 соединены дополнительной боковой ножкой с неподвижным участком FO, что предотвращает их вращение вместе с γ-субъединицей. Структура неповрежденной АТФ-синтазы с низкой точностью выявлена при помощи электронной криомикроскопии (ЭКМ). Показано, что боковая ножка — это гибкая перемычка, похожая на канат, наматывающаяся на комплекс во время его работы.
В определенных условиях каталитическая реакция может протекать в обратном направлении, при этом гидролиз АТФ вызывает прокачку протонов через мембрану.
В механизме изменения участка связывания задействован активный участок β-субъединицы, последовательно проходящий через три состояния[2].
В «открытом» состоянии АДФ и фосфат подходят к активному участку. Затем белок охватывает эти молекулы и свободно связывается с ними («свободное» состояние). Следующее изменение формы белка прижимает молекулы друг к другу («тесное» состояние), что приводит к формированию АТФ. Наконец, активный участок снова переходит в «открытое» состояние, освобождает АТФ и связывает следующую молекулу АДФ и фосфата, после чего цикл производства АТФ повторяется. Из рисунка видно что за один поворот γ-субъединици синтезируется 3 молекулы АТФ, а для одного полного поворота нужно примерно 1000 протонов (их количество может колебатся в зависимости от тапиа)
3. Физиологическое значение
Как и у многих других ферментов, действие АТФ-синтазы F1FO обратимо. Большие концентрации АТФ заставляют ее расщеплять АТФ и создавать трансмембранный протонный градиент. Такое использование АТФ-синтазы отмечено у анаэробных бактерий, не имеющих электронной транспортной цепочки. Эти бактерии применяют гидролиз АТФ для создания протонного градиента, который задействован в движении жгутиков и клеточном питании.
У аэробных бактерий в нормальных условиях АТФ-синтаза, как правило, работает в обратном направлении, производя АТФ за счет энергии электрохимического потенциала, создаваемого электронной транспортной цепочкой. В целом данный процесс называется окислительным фосфорилированием. Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1 находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
КПД АТФ-синтазы близок к 100% [3]
4. АТФ-синтаза у разных организмов
4.1. АТФ-синтаза растений
У растений АТФ-синтаза CF1FO присутствует в хлоропластах. Она встроена в мембрану тилакоида, причем компонент CF1 выступает в строму, где протекают реакции тёмного фотосинтеза (также называемые светонезависимыми реакциями Кальвиновского цикла). Структура и механизм катализа АТФ-синтазы хлоропластов почти такая же, как и в митохондриях. Однако электрохимический потенциал у хлоропластов формируется не дыхательной электротранспортной цепочкой, а фотосинтетическими белками.
4.2. АТФ-синтаза E. coli
АТФ-синтаза кишечной палочки — самая простая из всех известных АТФ-синтаз. Она состоит всего из 8 видов субъединиц.
4.3. АТФ-синтаза дрожжей
Напротив, АТФ-синтаза дрожжей — самая сложная из известных. Она состоит из 20 различных видов субъединиц.
5. Эволюция АТФ-синтазы
Эволюция АТФ-синтазы считается примером модульной эволюции, при которой две субъединицы, каждая обладающая своими функциями, соединились и получили новые функции.
Гексамер α3β3, входящий в состав компонента F1 проявляет существенное сходство с гексамерной ДНК-геликазой. Оба типа ферментов образуют кольцо с вращательной симметрией 3 порядка, обладающее центральной пóрой. Действие каждого из них также зависит от относительного вращения макромолекулы внутри поры: геликазы используют спиральную форму ДНК для движения вдоль нее и для обнаружения суперскручивания, тогда как α3β3-гексамер использует изменения своей конфигурации из-за вращения γ-субъединицы для осуществления каталитической реакции.
Протонный мотор компонента FO проявляет большое функциональное сходство с протонными моторами жгутиков. И там, и там присутствует кольцо из множества небольших богатых α-спиралями белков, вращающихся относительно соседних неподвижных белков за счет энергии протонного градиента. Это, конечно, очень зыбкое сходство, так как структура жгутиковых моторов гораздо сложнее, чем FO, а вращающееся белковое кольцо гораздо крупнее и состоит из 30 субъединиц против 10, 11 или 14, входящих в состав компонента FO.
Теория молекулярной эволюции предполагает, что две субъединицы с независимыми функциями — ДНК-геликаза с дополнительным АТФ-азным действием и протонный мотор — смогли соединяться, причем вращение мотора вызывало проявление АТФ-азной активности геликазы. Или же, наоборот, в первичной связке ДНК-геликазы и протонного мотора гидролиз АТФ на геликазе заставлял работать протонный мотор. Это соединение затем постепенно оптимизировалось, получило возможность катализировать обратную реакцию и через какое-то время превратилось в сложную АТФ-синтазу, существующую в настоящее время. Однако, до сих пор неясен механизм происхождения протонного мотора, который без геликазы или других комплексов не представляет никакой пользы.
Примечания
- Fernandez-Moran et al., Journal of Molecular Biology, Vol 22, p 63, 1962
- Gresser MJ, Myers JA, Boyer PD (1982). «Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model - www.jbc.org/cgi/reprint/257/20/12030». J. Biol. Chem. 257 (20): 12030–8. PMID 6214554 - www.ncbi.nlm.nih.gov/pubmed/6214554?dopt=Abstract.
- K. Kinosita, Jr. R. Yasuda, H. Noji, K. Adachi. А rotary molecular motor that can work at near 100% efficiency. Philos Trans R Soc Lond B Biol Sci. 2000 April 29; 355(1396): 473–489.
Литература
- Ю. М. Романовский, А. Н. Тихонов Молекулярные преобразователи энергии живой клетки. Протонная АТФ-синтаза — вращающийся молекулярный мотор - ufn.ru/ru/articles/2010/9/b/ // УФН. — 2010. — Т. 180. — С. 931—956.
wreferat.baza-referat.ru
Физиология растений
Министерство сельского хозяйства РФ
ФГБОУ ВПО «Ярославская государственная сельскохозяйственная академия»
Кафедра экологии
КОНТРОЛЬНАЯ РАБОТА
По дисциплине «Физиология растений»
Выполнила:
студентка 4 курса
технологического факультета
Степанова А. Ю.
Проверил:
преподаватель Таран Т. В.
Ярославль 2014
Содержание
1. Поглощение веществ растительной клеткой. Пассивный и активный транспорты……………………………………………………………………
2. Транскрипция и ее биологическое значение, виды. Факторы, определяющие величину транскрипции……………………………………
3. Дегидрогеназы, их химическая природа и характер действия………………
4. Физиология покоя и прорастания семян. Влияние внутренних и внешних условий на процесс прорастания семян……………………………………..
1. Поглощение веществ растительной клеткой. Пассивный и активный транспорты
Поступление веществ в клеточную стенку (1-й этап).
Поглощение веществ клеткой начинается с их взаимодействия с клеточной оболочкой. Еще работами Д. А. Сабинина и И. И. Колосова было показано, что клеточная оболочка способна к быстрой адсорбции ионов. Причем эта адсорбция в ряде случаев носит обменный характер. В дальнейшем в опытах с выделенными клеточными оболочками было показано, что их можно рассматривать как ионообменник. На поверхности клеточной оболочки оказываются адсорбированными ионы Н+ и НС03-, которые в эквивалентных количествах меняются на ионы, находящиеся во внешней среде. Ионы могут частично локализоваться в межмицеллярных и межмолекулярных промежутках клеточной стенки, частично связываться и фиксироваться в клеточной стенке электрическими зарядами.
Первый этап поступления характеризуется большой скоростью и обратимостью. Поступившие ионы легко вымываются. Это пассивный диффузионный процесс, идущий по градиенту электрохимического потенциала. Объем клетки, доступный для свободной диффузии ионов, включает клеточные стенки и межклеточные промежутки, т. е. апопласт или свободное пространство. По расчетам свободное пространство (СП) может занимать в растительных тканях 5—10% объема. Поскольку в клеточную оболочку входят амфотерные соединения (белки), заряд которых меняется при разных значениях рН, то в зависимости от значения рН скорость адсорбции катионов и анионов также может меняться. Поступление веществ через мембрану (2-й этап). Для того чтобы проникнуть в цитоплазму и включиться в метаболизм клетки, вещества должны пройти через мембрану — плазмалемму. Перенос веществ через мембрану может идти пассивным и активным путем. При пассивном поступлении веществ через мембрану основой переноса и в этом случае является диффузия. Скорость диффузии зависит от толщины мембраны и от растворимости вещества в липидной фазе мембраны. Поэтому неполярные вещества, которые растворяются в липидах (органические и жирные кислоты, эфиры), легче проходят через мембрану. Однако большинство веществ, которые важны для питания клетки и ее метаболизма не могут диффундировать через липидный слой и транспортируются с помощью белков, которые облегчают проникновение воды, ионов, Сахаров, аминокислот и других полярных молекул в клетку. В настоящее время показано существование трех типов таких транспортных белков: каналы, переносчики, помпы.
Три класса транспортных белков:
1 — белковый канал;
2 — переносчик;
3 — помпа.
Каналы — это трансмембранные белки, которые действуют как поры. Иногда их называют селективными фильтрами. Транспорт через каналы, как правило, пассивный. Специфичность транспортируемого вещества определяется свойствами поверхности поры. Как правило, через каналы передвигаются ионы. Скорость транспорта зависит от их величины и заряда. Если пора открыта, то вещества проходят быстро. Однако каналы открыты не всегда. Имеется механизм «ворот», который под влиянием внешнего сигнала открывает или закрывает канал. Долгое время представлялась труднообъяснимой высокая проницаемость мембраны (10 мкм/с) для воды — вещества полярного и нерастворимого в липидах. В настоящее время открыты интегральные мембранные белки, представляющие канал через мембрану для проникновения воды — аквапорины. Способность аквапоринов к транспорту воды регулируется процессом фосфорилирования. Было показано, что присоединение и отдача фосфатных групп к определенным аминокислотам аквапоринов ускоряет или тормозит проникновение воды, но не влияет на направление транспорта.
Переносчики — это специфические белки, способные связываться с переносимым веществом. В структуре этих белков имеются группировки, определенным образом ориентированные на наружную или внутреннюю поверхность. В результате изменения конформации белков вещество передается наружу или внутрь. Поскольку для транспорта каждой отдельной молекулы или иона переносчик должен изменить конфигурацию, скорость транспорта вещества в несколько раз меньше, чем происходит перенос через каналы. Показано наличие транспортных белков не только в плазмалемме, но и в тонопласте. Транспорт с помощью переносчиков может быть активным и пассивным. В последнем случае такой транспорт идет по направлению электрохимического потенциала и не требует затрат энергии. Этот тип переноса называется облегченной диффузией. Благодаря переносчикам он идет с большей скоростью, чем обычная диффузия.
Согласно представлениям о работе переносчиков, ион (М) реагирует со своим переносчиком (X) на поверхности мембраны или вблизи нее. Эта первая реакция может включать или обменную адсорбцию, или какое-то химическое взаимодействие. Ни сам переносчик, ни его комплекс с ионом не могут перейти во внешнюю среду. Однако комплекс переносчика с ионом (MX) подвижен в самой мембране и передвигается к ее противоположной стороне. Здесь этот комплекс распадается и высвобождает ион во внутреннюю среду с образованием предшественника переносчика (X1). Этот предшественник переносчика снова передвигается к внешней стороне мембраны, где вновь превращается из предшественника в переносчик, который на поверхности мембраны может соединиться с другим ионом. При введении в среду вещества, способного образовать прочный комплекс с переносчиком, перенос вещества блокируется. Опыты, проведенные на искусственных липидных мембранах, показали, что перенос ионов может проходить под влиянием некоторых антибиотиков, вырабатываемых бактериями и грибами,— ионофоров. Транспорт с участием переносчиков обладает свойством насыщения, т. е. при увеличении концентрации веществ в окружающем растворе скорость поступлении сначала возрастает, а затем остается постоянной. Это объясняется ограниченным количеством переносчиков.
Переносчики специфичны, т. е. участвуют в переносе только определенных веществ и, тем самым, обеспечивают избирательность поступления.
Комплекс ионофор К+
Это не исключает того, что один и тот же переносчик может обеспечивать перенос нескольких ионов. Например, переносчик К+, обладающий специфичностью для этого иона, также переносит Rb+ и Na+, но не транспортирует Сl- или незаряженные молекулы сахарозы. Транспортный белок, специфичный для нейтральных кислот, хорошо переносит аминокислоты глицин, валин, но не аспарагин или лизин. Благодаря разнообразию и специфичности белков осуществляется избирательная их реакция с веществами, находящимися в среде, и, как следствие, их избирательный перенос.
Насосы (помпы) — интегральные транспортные белки, осуществляющие активное поступление ионов. Термин «насос» показывает, что поступление идет с потреблением свободной энергии и против электрохимического градиента. Энергия, используемая для активного поступления ионов, поставляется процессами дыхания и фотосинтеза и в основном аккумулирована в АТФ. Как известно, для использования энергии, заключенной в АТФ, это соединение должно быть гидролизовано по уравнению АТФ + НОН —> АДФ + Фн. Ферменты, осуществляющие гидролиз АТФ, называются аденозинтрифосфатазы (АТФазы). В мембранах клеток обнаружены различные АТФазы: К+ — Na+ — АТФаза; Са2+ — АТФаза; Н+ — АТФаза. Н+— АТФаза (Н+—насос или водородная помпа) является основным механизмом активного транспорта в клетках растений, грибов и бактерий. Н+ — АТФаза функционирует в плазмалемме и обеспечивает выброс протонов из клетки, что приводит к образованию электрохимической разности потенциалов на мембране. Н+— АТФаза переносит протоны в полость вакуоли и в цистерны аппарата Гольджи.
Расчет показывает, что для того, чтобы 1 моль соли диффундировал против градиента концентрации, необходимо затратить около 4600 Дж. Вместе с тем при гидролизе АТФ выделяется 30660 Дж/моль. Следовательно, этой энергии АТФ должно хватить для транспорта нескольких моль соли. Имеются данные, показывающие прямо пропорциональную зависимость, существующую между активностью АТФазы и поступлением ионов. Необходимость молекул АТФ для осуществления переноса подтверждается еще и тем, что ингибиторы, нарушающие аккумуляцию энергии дыхания в АТФ (нарушение сопряжения окисления и фосфорилирования), в частности динитрофенол, тормозят поступление ионов.
Насосы делят на две группы:
1. Электрогенные, которые осуществляют активный транспорт иона какого-либо одного заряда только в одном направлении. Этот процесс ведет к накоплению заряда одного типа на одной стороне мембраны.
2. Электронейтральные, при которых перенос иона в одном направлении сопровождается перемещением иона такого же знака в противоположном либо перенос двух ионов с одинаковыми по величине, но разными по знаку зарядами в одинаковом направлении.
Механизм действия транспортной АТФазы (P - неорганический фосфат).
Таким образом, перенос ионов через мембрану может осуществляться активным и пассивным путем. В обеспечении транспортной функции мембран и избирательности поглощения большую роль играют транспортные белки: каналы, переносчики и помпы. В настоящее время для многих транспортных белков гены клонированы. Идентифицированы гены, кодирующие калиевые каналы. На арабидопсисе получены мутации генов, которые влияют на транспорт и восстановление нитратов. Показано, что в геноме растений за транспорт веществ через мембраны отвечает не один ген, а несколько. Такая множественность обеспечивает выполнение функции в различных частях растений, что позволяет транспортировать вещества из одной ткани в другую.
Наконец, клетка может «заглатывать» питательные вещества вместе с водой (пиноцитоз). Пиноцитоз — это впячивание поверхностной мембраны, благодаря которому происходит заглатывание капелек жидкости с растворенными веществами. Явление пиноцитоза известно для клеток животных. Сейчас доказано, что оно характерно и для клеток растений. Процесс этот можно подразделить на несколько фаз: 1) адсорбция ионов на определенном участке плазмалеммы; 2) впячивание, которое происходит под влиянием заряженных ионов; 3) образование пузырьков с жидкостью, которые могут мигрировать по цитоплазме; 4) слияние мембраны, окружающей пиноцитозный пузырек, с мембранами лизосом, эндоплазматической сети или вакуоли и включение веществ в метаболизм. С помощью пиноцитоза в клетки могут попадать не только ионы, но и различные растворимые органические вещества.
Действие АТФ-азного насоса цитоплазматической мембраны.
Транспорт веществ в цитоплазме (3-й этап) и поступление в вакуоль (4-й этап). Пройдя через мембрану, ионы поступают в цитоплазму, где включаются в метаболизм клетки. Существенная роль в процессе связывания ионов цитоплазмой принадлежит клеточным органеллам. Митохондрии, хлоропласта, по-видимому, конкурируют между собой, поглощая катионы и анионы, поступившие через плазмалемму в цитоплазму. В процессе аккумуляции ионов в разных органеллах цитоплазмы и включения в метаболизм большое значение имеет их внутриклеточный транспорт. Этот процесс осуществляется, по-видимому, по каналам ЭПР.
В вакуоль попадают ионы в случае, если цитоплазма уже насыщена ими. Это как бы излишки питательных веществ, не включенные в реакции метаболизма. Для того, чтобы попасть в вакуоль, ионы должны преодолеть еще один барьер — тонопласт. Если в плазмалемме механизм переноса ионов действует в пределах относительно низких концентраций, то в тонопласте — при более высоких концентрациях, когда цитоплазма уже насыщена данным ионом. В мембранах вакуоли были обнаружены вакуолярные каналы, которые отличаются по времени открывания (быстрые и медленные). Перенос ионов через тонопласт совершается также с помощью переносчиков и требует затраты энергии, что обеспечивается работой Н+ — АТФазы тонопласта. Потенциал вакуоли по сравнению с цитоплазмой положителен, поэтому анионы поступают по градиенту электрического потенциала, а катионы и сахара — в антипорте с протонами. Низкая проницаемость тонопласта для протонов позволяет снизить затраты энергии для поступления веществ. Вакуолярная мембрана имеет и вторую протонную помпу, связанную с Н+-пирофосфатазой. Этот фермент состоит из единственной полипептидной цепи. Источником энергии для потока протонов является гидролиз неорганического пирофосфата. В тонопласте обнаружены транспортные белки, которые позволяют проникать в вакуоль большим органическим молекулам непосредственно за счет энергии гидролиза АТФ. Это играет роль в аккумуляции пигментов в вакуоли, в образовании антимикробных веществ, а также при обезвреживании гербицидов. Поступившие в вакуоль вещества обеспечивают осмотические свойства клетки. Таким образом, проникающие через плазмалемму ионы накапливаются и связываются цитоплазмой, и только их избыток десорбируется в вакуоль. Именно поэтому между содержанием ионов во внешнем растворе и клеточном соке нет и не может быть равновесия. Необходимо еще раз подчеркнуть, что большое значение для жизнедеятельности клетки имеет активное поступление. Именно оно ответственно за избирательное накопление ионов в цитоплазме. Поглощение питательных веществ клеткой тесно связано с обменом веществ. Эти связи многосторонни. Для активного переноса необходимы синтез белков — переносчиков, энергия, поставляемая в процессе дыхания, эффективная работа транспортных АТФаз. Надо учитывать также, что, чем быстрее поступающие ионы включаются в метаболизм, тем интенсивнее идет их поглощение. Для многоклеточного высшего растения не меньшее значение имеет и передвижение питательных веществ из клетки в клетку. Чем быстрее проходит этот процесс, тем быстрее соли будут при прочих равных условиях поступать в клетку.
ПАССИВНОЕ И АКТИВНОЕ ПОСТУПЛЕНИЯ
Поглощение питательных веществ клеткой может быть пассивным и активным. Пассивное поглощение — это поглощение, не требующее затраты энергии. Оно связано с процессом диффузии и идет по градиенту концентрации данного вещества. С термодинамической точки зрения направление диффузии определяется химическим потенциалом вещества. Чем выше концентрация вещества, тем выше его химический потенциал. Передвижение идет в сторону меньшего химического потенциала. Необходимо отметить, что направление движения ионов определяется не только химическим, но также электрическим потенциалом. Следовательно, пассивное передвижение ионов может идти по градиенту химического и электрического потенциала. Таким образом, движущей силой пассивного транспорта ионов через мембраны является электрохимический потенциал.
Электрический потенциал на мембране — трансмембранный потенциал может возникать в силу разных причин:
1.Если поступление ионов идет по градиенту концентрации (градиенту-химического потенциала), однако благодаря разной проницаемости мембраны с большей скоростью поступает либо катион, либо анион. В силу этого на мембране возникает разность электрических потенциалов, что, в свою очередь, приводит к диффузии противоположно заряженного иона.
2. При наличии на внутренней стороне мембраны белков, фиксирующих определенные ионы, т. е. иммобилизирующих их. За счет фиксированных зарядов создается дополнительная возможность поступления ионов противоположного заряда (доннановское равновесие) .
3. В результате активного (связанного с затратой энергии) транспорта либо катиона, либо аниона. В этом случае противоположно заряженный ион может передвигаться пассивно по градиенту электрического потенциала. Явление, когда потенциал генерируется активным поступлением через мембрану ионов одного заряда, носит название электрогенного насоса. Термин «насос» показывает, что поступление идет с потреблением свободной энергии.
Активный транспорт — это транспорт, идущий против электрохимического потенциала с затратой энергии, выделяющейся в процессе метаболизма.
Пассивный и активный транспорт
Имеется ряд доказательств существования активного транспорта ионов. В частности, это опыты по влиянию внешних условий. Так, оказалось, что поступление ионов зависит от температуры. В определенных пределах с повышением температуры скорость поглощения веществ клеткой возрастает. В отсутствие кислорода, в атмосфере азота, поступление ионов резко тормозится и может даже наблюдаться выход солей из клеток корня наружу. Под влиянием дыхательных ядов, таких, как KCN, СО, поступление ионов также затормаживается. С другой стороны, увеличение содержания АТФ усиливает процесс поглощения. Все это указывает на то, что между поглощением солей и дыханием существует тесная связь.
Многие исследователи приходят к выводу о тесной взаимосвязи между поглощением солей и синтезом белка. Так, хлорамфеникол — специфический ингибитор синтеза белка — подавляет и поглощение солей. Активное поступление ионов осуществляется с помощью особых транспортных механизмов — насосов. Насосы подразделяются на две группы:
1.Электрогенные (упомянутые ранее), которые осуществляют активный транспорт иона какого-либо одного заряда только в одном направлении. Этот процесс ведет к накоплению заряда одного типа на одной стороне мембраны.
2. Электронейтральные, при которых перенос иона в одном направлении сопровождается перемещением иона такого же знака в противоположном либо перенос двух ионов с одинаковыми по величине, но разными по знаку зарядами в одинаковом направлении.
Способность клетки к избирательному накоплению питательных солей, зависимость поступления от интенсивности обмена служат доказательством того, что наряду с пассивным имеет место и активное поступление ионов. Оба процесса часто идут одновременно и бывают настолько тесно связаны, что разграничить их трудно.
studfiles.net












